Method Article
الجامعة-جبل [كنفوكل] الفحص المجهري للجلد الإذن الكبار: نظام نموذجي لدراسة Morphogenesis المتفرعة العصبية والأوعية الدموية وتوزيع الخلايا المناعية
In This Article
Summary
هنا، نحن وصف أسلوب تصوير الجامع-جبل عالية دقة في الجلد الإذن الكامل الماوس الكبار، والتي تمكننا من تصور morphogenesis المتفرعة والزخرفة للأعصاب المحيطية، والأوعية الدموية، فضلا عن توزيع الخلايا المناعية.
Abstract
نقدم هنا، على بروتوكول للجلد كلياً-جبل الإذن الكبار التصوير تقنية لدراسة شاملة morphogenesis المتفرعة الأوعية الدموية العصبية ثلاثي الأبعاد والزخرفة، فضلا عن توزيع الخلايا المناعية على مستوى خلوي. ويوفر تحليل الهياكل التشريحية الأعصاب والأوعية الدموية الطرفية في أنسجة البالغين بعض الأفكار في فهم الأسلاك الوظيفية العصبية والأوعية الدموية وضمور الأعصاب والأوعية الدموية في الحالات المرضية مثل التئام الجروح. كنظام نموذجي الزاخر، وقد ركزنا على دراساتنا على جلد الإذن الكبار، ومتاحة للتشريح. ويوفر لنا البروتوكول بسيطة واستنساخه تصوير دقيق للمكونات الخلوية في الجلد كله، مثل الأعصاب المحيطية (محاور عصبية حسية ومتعاطفة مع محاور عصبية وخلايا شوان)، والأوعية الدموية (خلايا بطانية وخلايا العضلات الملساء والأوعية الدموية )، والخلايا الملتهبة. ونحن نعتقد أن هذا البروتوكول سوف تمهد الطريق للتحقيق المورفولوجية تشوهات في الأعصاب المحيطية والأوعية الدموية وكذلك الالتهاب في الجلد الإذن الكبار تحت مختلف الحالات المرضية.
Introduction
يتكون الجلد من ثلاث طبقات: البشرة، الأدمة و hypodermis. قد استخدمت كنظام نموذجي لدراسة الحفاظ على الخلايا الجذعية، والتمايز، و morphogenesis في التنمية، فضلا عن تجديد وتوموريجينيسيس، والتهاب في تعليم الكبار. الجلد الغني vascularized ومعصب أن تطوير نظام الأوعية الدموية والجهاز العصبي المحيطي منسقة تنسيقاً جيدا.
وقد أثبتنا سابقا تقنية تصوير الجامع-جبل جنينية جلد مع وضع العلامات متعددة لدراسة سليمة الأعصاب المحيطية والأوعية الدموية، بما في ذلك تلك المكونات الخلوية1،2،3، 4: محاور عصبية حسية ومحاور عصبية متعاطفة، شوان خلايا الأعصاب، خلايا بطانية، بيريسيتيس، وخلايا العضلات الملساء والأوعية الدموية (فسمكس) في الأوعية الدموية. خلال الأوعية، شبكة شعرية الأولية يخضع لإعادة عرض الأوعية الدموية المكثفة ويتطور إلى شبكة المتفرعة الأوعية الدموية هرمية. في الأدمة النامية/hypodermis، فرع جنبا إلى جنب مع الأعصاب الحسية الطرفية وعروق الشرايين ثم تشكل المتاخمة للشرايين. بعد شبكة الأوعية الدموية الهرمية دقة مغطاة فسمكس، تمتد على طول الأعصاب متعاطفة ويعصب الأوعية الدموية كبيرة قطرها1،،من56. وعلى الرغم من الأهمية في الارتباط الوثيق بين نظم الأوعية الدموية والجهاز العصبي النامي، كان سؤالاً رئيسيا للتصدي لما يحدث للشبكات العصبية والأوعية الدموية في مختلف الحالات المرضية لدى البالغين. تصوير ثلاثي الأبعاد عالية الدقة ضروري نقدر المرضية، جنبا إلى جنب مع التعرف تشريحيا morphogenesis المتفرعة والزخرفة.
عادة يتم تحليل morphogenesis الخلايا العصبية والأوعية الدموية في الجلد الماوس الكبار تلطيخ قسم الأنسجة. واستخدمت دراسات أخرى تصوير الجامع-جبل من الجلد إلى تصور الأعصاب المحيطية والأوعية الدموية، بالإضافة إلى بصيلات الشعر والغدد الدهنية، ومقفه الشعرة العضلات7،،من89. ومع ذلك، سمك الجلد الكبار جعلت من الصعب تحليل الجلد على مدى عمق أكملها.
في هذه الدراسة، قمنا بتطوير تصوير الجامع-جبل عالية الدقة رواية الجلد الإذن الكبار للتغلب على هذه التحديات. الجلد الإذن متاحة لتشريح وتصوير الجامع-جبل اللاحقة من الجلد على مدى عمق أكملها. وهكذا، هو أسلوب مباشر واستنساخه بشدة التي يمكن تطبيقها لمقارنة هيكل ثلاثي الأبعاد نظم الجهاز العصبي والأوعية الدموية الطرفية في الجلد، مع القياسات القياس الكمي الشامل. أظهرنا أن المحاذاة للأعصاب المحيطية الحسية ومتعاطفة مع الأوعية الدموية كبيرة قطرها محفوظاً في الجلد الكبار. والهدف من هذا البروتوكول تصور morphogenesis المتفرعة، والزخرفة للأعصاب المحيطية، والأوعية الدموية، فضلا عن توزيع الخلايا المناعية على مستوى خلوي في نماذج الماوس الكبار في ظروف مختلفة مثل التهاب و التجديد.
Protocol
أجريت جميع التجارب في هذا الباب تحت الموافقة من الوطني للقلب والرئة، والدم معهد (NHLBI) العناية بالحيوان واللجنة استخدام.
1-الكبار الماوس الإذن الجلد جمع
- Euthanize الفئران الكبار بالتعرض لغاز ثاني أكسيد الكربون (CO2) في دائرة مغلقة، ثم قم بتأكيد القتل الرحيم بخلع عنق الرحم.
ملاحظة: التجربة يتبع المبدأ التوجيهي المعاهد الوطنية للصحة (NIH) لأسلوب القتل الرحيم. - تشريح الإذن من القاعدة ووضعه في 35 × 10 مم2 طبق بتري يحتوي على 2 مل من موازنة الملح الحل (حبس هانك). بإيجاز قص الشعر بالمقص.
- قشر الجلد الخلفي والجلد الأمامي بعيداً بعناية من الغضاريف الفاصلة.
ملاحظة: غضروف تعلق على الجلد الأمامي. - نقل مؤخرة والجلد الأمامي بشكل منفصل إلى 24 جيدا لوحة تحتوي على 1 مل من المثلج الطازج 4% بارافورمالدهيد (PFA) في الفوسفات مخزنة المالحة (PBS) كل بئر. تسطيح الجلد الأمامي والخلفي في 4% منهاج عمل بيجين.
- إصلاح الجلد الأمامي والخلفي مع غضروف في 4 درجات مئوية عن ح 1.
- أغسل الجلد الأمامي والخلفي 3 مرات لمدة 5 دقائق في 1 مل من برنامج تلفزيوني مع خلط لطيف في خلاط في درجة حرارة الغرفة.
- نقل الجلد الأمامي والخلفي مع الغضروف إلى الجزء السفلي من 35 × 10 مم2 طبق بيتري. قطع منطقة الأساسي، الذي هو مطوية والدهنية والأنسجة الضامة. تقشر الغضروف من الجلد الأمامي باستخدام الملقط المنحنية الجميلة.
- بعناية إزالة الشعر والأنسجة الدهنية، والأنسجة الضامة من داخل الجلد الخلفي باستخدام الملقط المنحنية الجميلة. الحفاظ على الجلد الرطب مع برنامج تلفزيوني.
2-المناعي الجامعة-جبل تلطيخ الجلد الإذن الماوس
ملاحظة: أجريت جميع التجارب في المقاطع التالية وفقا لإرشادات السلامة المختبرية المعاهد الوطنية للصحة.
- إعداد المخزن المؤقت حظر. تصفية الحرارة 10% معطل الماعز المصل (هيجس) المخفف في برنامج تلفزيوني مع تريتون 0.2% X-100 (تكساس-100) حظر المخزن المؤقت، أو المخفف 10% حمار المصل (DS) في برنامج تلفزيوني مع 0.2% المخزن المؤقت حظر TX-100، باستخدام وحدة تصفية 0.45 ميكرومتر.
- نقل مؤخرة والجلد الأمامي 24 أيضا لوحة تحتوي على 1 مل 10% هيجس حظر المخزن المؤقت أو المخزن المؤقت حظر س 10% كل بئر. احتضان الجلد لمدة 30 دقيقة مع خلط لطيف في خلاط في درجة حرارة الغرفة.
- إعداد الحل جسم الأولية بتمييع الأجسام المضادة الأولية (جدول المواد) في المخزن المؤقت لحظر (أي 10% هيجس أو 10% DS).
ملاحظة: كل-موت المناعي تحليل الجلد الإذن الكبار مع الأجسام المضادة لعموم العصبية العلامة الخاصة بالخلايا العصبية فئة الثالث β-tubulin (Tuj1، أرنب [بولكلونل] مفتش أو الماوس مونوكلونكال IgG2a، وتمييع 1: 500 في تركيز نهائي 2 ميكروغرام/مل)، خلية عموم غشائي ماركر الصفائح الدموية غشائي خلية التصاق جزيء 1 (بيكم-1، الهامستر [مونوكلونل] مفتش، تمييع رافعة في تركيز نهائي 3.3 ميكروغرام/مل)، المايلين غمد المايلين ماركر البروتين الأساسية (MBP، أرنب [بولكلونل] مفتش، تمييع 1: 200 في النهائي تركيز 5 ميكروغرام/مل) وعلامة خلية النقوي التهاب CD11b (الفئران [مونوكلونل] IgG2b، 01:50 إضعاف تركيز النهائي 20 ميكروغرام/مل) كان هو مبين في الشكل 1 و الشكل 2. وكان المحتضنة الجلد مع مترافق Cy3 الأجسام المضادة للعضلات الملساء والأوعية الدموية الخلية علامة α العضلات الملساء أكتين (αSMA) جنبا إلى جنب مع الأجسام المضادة الثانوية (2.6). الأجسام المضادة الابتدائي اختبرت بأنفسنا مدرجة في الجدول للمواد. يمكن أن تكون مختلطة متعددة الأجسام الأولية المستمدة من مختلف الأنواع في وقت واحد. - نقل الجلد الأمامي والخلفي لبئر جديدة تحتوي على 150 ميليلتر من الحل الأجسام الأولية. احتضان الجلد مع خلط لطيف في خلاط في 4 درجات مئوية بين عشية وضحاها.
- اليوم التالي، نقل الجلد الأمامي والخلفي لآبار جديدة في لوحة جيدا 24 أو نضح حظر المخزن المؤقت الذي يحتوي على الأجسام المضادة الأولية. أضف 1 مل أما 2% المخفف هيجس في برنامج تلفزيوني مع المخزن المؤقت للغسيل TX-100 0.2% أو 2% المخفف DS في برنامج تلفزيوني مع 0.2% TX 100 الغسيل المخزن المؤقت. أغسل الجلد مع التغييرات 3 الغسيل المخزن المؤقت كل 15 دقيقة مع خلط لطيف في خلاط في درجة حرارة الغرفة.
- إعداد الحل جسم الثانوي (جدول المواد). تمييع الأجسام المضادة الثانوية في المخزن المؤقت لحظر (أي 10% هيجس أو 10% DS) وتصفية حظر المخزن المؤقت الذي يحتوي على الأجسام المضادة الثانوية من خلال 0.22 ميكرومتر ثنائي الفلوريد (PVDF) غشاء الفينيليدن مرشح حقنه متصلة بحقنه 1 مل.
ملاحظة: أليكسا 488 أو الماعز مترافق 633 أرنب المضادة IgG (H + L) أو الماوس IgG2a ل Tuj1، الهامستر المضادة مفتش (H + L) مترافق 647 أليكسا الماعز للماعز بيكم-1، 488 أليكسا مترافق الأرنب المضادة IgG (H + L) ل MBP، واستخدمت الفئران مترافق 594 أليكسا مفتش (H + L) ل CD11b مع تمييع 1: 250 في تركيز النهائي 8 ميكروغرام/مل. وكان المحتضنة الجلد بجسم αSMA Cy3 مترافق (تخفيف 1: 500 في تركيز نهائي 2-3 ميكروغرام/مل) في تركيبة مع هذه الأجسام المضادة الثانوية. - الطرد المركزي الحل في 13,000 س ز لمدة 10 دقيقة لإزالة الجسيمات المجمعة من الأجسام المضادة الثانوية من المخزن المؤقت حظر.
ملاحظة: يمكن أن تكون مختلطة مختلفة الفلورسنت مترافق الثانوي الأجسام المضادة المستمدة من مختلف الأنواع في وقت واحد. - نقل الجلد الأمامي والخلفي جيدا يحتوي على 150 ميليلتر من الأجسام المضادة الثانوية الحل. التفاف لوحة جيدا 24 في رقائق الألومنيوم تجنب الضوء واحتضان الجلد ح 1 مع خلط لطيف في خلاط في درجة حرارة الغرفة.
- نقل الجلد الأمامي والخلفي لآبار جديدة في لوحة جيدا 24 أو نضح الحل جسم الثانوية قبل بيبيت تماما. أضف 1 مل من المخزن المؤقت للغسيل هيجس 2% أو 2% DS الغسيل المخزن المؤقت.
- التفاف لوحة جيدا 24 في رقائق الألومنيوم وتغسل مع التغييرات 3 من المخزن المؤقت الغسيل كل 15 دقيقة مع خلط لطيف في خلاط في درجة حرارة الغرفة.
3-تصاعد الجلد الإذن على الشريحة
- مكان الجلد في الجزء السفلي من 35 × 10 مم2 طبق بيتري. بعناية إزالة الشعر والأنسجة الدهنية والأنسجة الضامة، وغبار وألياف من داخل الجلد باستخدام الملقط المنحنية الجميلة تحت ستيريوميكروسكوبي مع إضاءة منخفضة إلى أدنى حد من تبييض الصورة الواسعة. الحفاظ على الجلد الرطب مع برنامج تلفزيوني.
- نقل الجلد إلى شريحة مجهر لاصقة باستخدام الملقط. ضع الجلد الأمامي والخلفي مع الداخل مواجهة على الشريحة. تسطيح الجلد باستخدام الملقط.
- جبل الجلد في متوسط سائل تتلاشى لمكافحة تصاعد تجنب فوتوبليتشينج والحفاظ على إشارات الفلورسنت. تأكد من أن لا فقاعات الهواء على أو حول الجلد.
- تغطية مع ساترة على عينات الجلد بعناية وتخزين الشرائح عينة الجلد المحملة في ليل الظلام في درجة حرارة الغرفة للسماح بالحصول على وسائل الإعلام تصاعد راسخ. ختم ساترة للشريحة مع طلاء الأظافر وتخزينها في 4 درجات مئوية للتخزين على المدى الطويل.
4-[كنفوكل] مجهرية
- إعداد الليزر المناسبة فلوروفوريس. ويستخدم مجهر [كنفوكل] مع ثلاثة مصادر الليزر (الأرجون 488 نانومتر، nm 561 والعسف وزناد 633 نانومتر) في هذه التجربة.
- استخدم أداة التفحص متسلسلة، مما يثير في نفس الوقت عينات ثلاثية الملون، لتجنب والحد من حدوث أي تداخل.
ملاحظة: سوف تؤخذ الصور بطريقة متسلسلة باستخدام طريقة المسح الضوئي متسلسلة. - الصورة تحت هدف X 10. استخدام أداة مسح البلاط لالتقاط الجلد الإذن كلها. تعيين مكدس Z وتأكد من أن z-الموقف الذي يغطي كامل سمك الجلد الإذن.
النتائج
كانت الماوس الكبار الإذن الخلفي الجلد (الشكل 1A) والجلد الإذن الأمامية (الشكل 1B) إيمونوستينيد مع الأجسام المضادة إلى αSMA (أحمر)، Tuj1 (الأخضر)، وبيكم-1 (أزرق). وكان الجلد الخلفي إيمونوستينيد لدراسة التوزيع العصبية المناعية باستخدام الأجسام المضادة CD11b (أحمر) و MBP (الأخضر)، جنبا إلى جنب مع Tuj1 (الأزرق) (الشكل 2 أ). توزيع CD11b+ تم الكشف عن الخلايا التحريضية، بما في ذلك الضامة في قرار واحد خلوية (الشكل 2).

رقم 1: محاذاة أوفبيريفيرال الأعصاب والأوعية الدموية في جلد الإذن الكبار- الجامعة-جبل مجهرية [كنفوكل] الفلورة ثلاثية من الجلد الأمامي والخلفي، والإذن بالأجسام المضادة إلى αSMA (أحمر)، Tuj1 (الأخضر)، ويرد بيكم-1 (أزرق). الأوعية الدموية (A) المغطاة فسمك كبيرة قطرها محاذاة مع الأعصاب الطرفية في الجلد الإذن اللاحق. (ب) أصغر-قطرها الأوعية الدموية مغطاة فسمكس محاذاة مع حزم قطرها أصغر الأعصاب الطرفية في الجلد الإذن الأمامي. مقياس بار = 1 مم الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
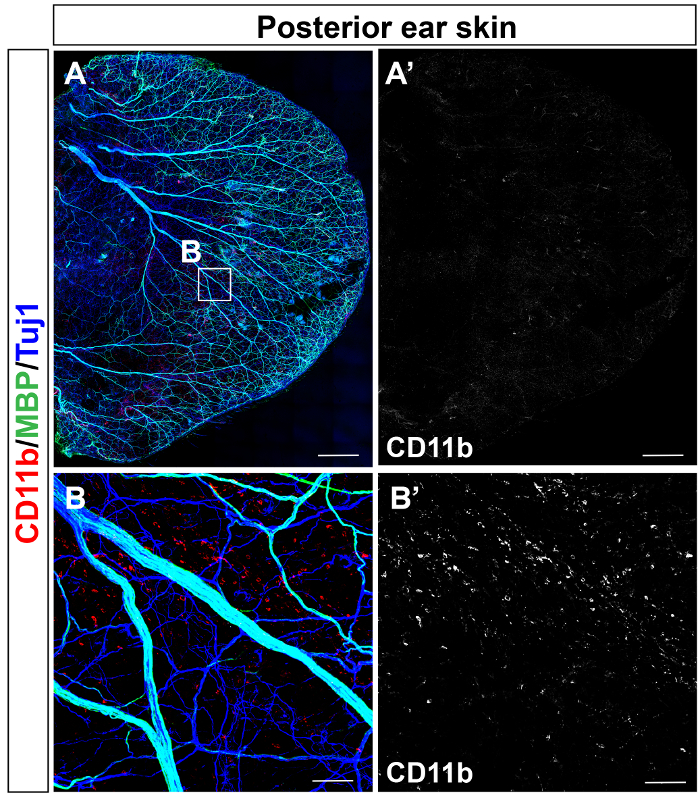
الشكل 2: مييلينيشن الأعصاب المحيطية و CD11b+ توزيع الخلية النقوي في جلد الإذن الكبار. ويرد مجهرية الفلورة ثلاثية أسرة-جبل [كنفوكل] من الجلد الإذن الخلفي مع الأجسام المضادة CD11b (أحمر) و MBP (الأخضر)، جنبا إلى جنب مع Tuj1 (الأزرق)،. (أ) متوسطة إلى كبيرة قطرها الأعصاب المحيطية ميليناتيد. الصورة عن قرب (ب) في (أ). CD11b+ الخلايا التحريضية توزع بالتساوي في الجلد الإذن اللاحق. مقياس بار = 1 مم (A)، 100 ميكرومتر (ب). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Discussion
ويصف هذا البروتوكول تصوير الجامع-جبل إيمونونوهيستوتشيميكال من الجلد الإذن الكبار لتحليل الهياكل العصبية والأوعية الدموية وتوزيع الخلايا المناعية. ونحن نعتقد أن هذا الأسلوب له العديد من المزايا التجريبية للباحثين لدراسة morphogenesis المتفرعة والزخرفة للأعصاب المحيطية، والأوعية الدموية، وكذلك توزيع ثلاثي الأبعاد لمكونات الجلد بما فيها الخلايا المناعية والشعر المسام. يمكن قياس نتائج التصوير باستخدام برامج التصوير لمزيد من التحليل الكمي.
الإعداد السليم للجلد الإذن أمر بالغ الأهمية لنجاح هذا البروتوكول. أولاً، ينبغي أن تشريح الجلد الإذن بعناية بعد يوثانيزينج الماوس. ينبغي أن تكون مقشرة في الجزء الخلفي من الإذن الجلد بعيداً عن الغضروف. ثم الغضروف ينبغي أن تكون انشقت من الجلد الأمامي قبل التلوين. وثانيا، الأنسجة الضامة والأنسجة الدهنية والشعر يجب إزالة بلطف ودقة قبل التركيب. بسبب وجود الأعصاب المحيطية على سطح الجلد، مطلوب إزالة حذراً لتجنب إتلاف الأعصاب. ثالثا، ينبغي أن يكون الجلد الإذن تكشفت مع إزالة بعض أنسجة سميكة من الجلد الإذن. وأخيراً، ينبغي أن يكون الجلد الإذن المسطحة التي شنت دون فقاعات الهواء.
واحد الحد من هذا البروتوكول أن الجلد معلم الإذن الإذن ليست مناسبة للتحليل العلامة الإذن يسبب حفرة أو ندبة. ولذلك، تحديد هوية فئران بأساليب مختلفة عدا علامة الإذن مثل وضع العلامات على الذيل ضروري في حالة هناك الفئران متعددة لتحليل.
يمكن تفحص الجلد الإذن الكامل بالفحص المجهري [كنفوكل] مع بلاط أداة المسح الضوئي، وعلى الرغم من أن تقارير سابقة أظهرت أن منطقة الاهتمام يمكن تصويرها ب دقة عالية10. من المثير للاهتمام، يكشف تصوير الجامع-جبل الجلد الإذن الكامل morphogenesis المتفرعة متميزة والزخرفة للأعصاب المحيطية والأوعية الدموية بين الجلد الأمامي والخلفي (الشكل 1): الجلد الخلفي قد كبيرة قطرها العصب حزم (20 – 50 ميكرومتر) تتماشى مع تشكيلها الأوعية الدموية كبيرة قطرها مغطاة αSMA+ فسمكس (20 – 60 ميكرومتر)، في حين الأمامي الجلد قد حزم العصب أصغر القطر (< 20 ميكرومتر) تتماشى مع القطر الأصغر ولكن تشكيلها من الأوعية الدموية مغطاة αSMA+ فسمكس (< 20 ميكرومتر).
وهناك عدد ملحوظ من الماوس نماذج11 إلى توضيح إليه البشرية من الأمراض الجلدية مثل الاستشرائية1213من الصدفية، الجرح الشفاء14، و15من اعتلال الأعصاب السكري. تطبيق هذا البروتوكول على جلد الإذن الفئران السمنة الناجمة عن النظام الغذائي، واكتب 2 الفئران السكري اعتلال الأعصاب السكري16دراسة. يمكن تطبيق هذا البروتوكول من الأحداث للجلد الماوس الكبار في مختلف الحالات المرضية.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
ونشكر ك. جيل لإدارة المختبرات والدعم التقني، J. هوكينز والموظفين من الوطنية معاهد للصحة (المعاهد الوطنية للصحة) بناء 50 منشأة الحيوان للمساعدة مع الرعاية الماوس، ور. ريد وبالدريي واو للمساعدة الإدارية. شكرا أيضا موتيجى س. و. م. أوديي لتقاسم على بروتوكول تشريح الجلد الإذن، وحروق أ لتعليمات تحريرية، وأعضاء من "مختبر الخلايا الجذعية" وبيولوجيا الأعصاب والأوعية الدموية للمساعدة التقنية ومناقشة مدروسة. ت يامازاكي أيده "الجمعية اليابانية" لتعزيز العلوم (JSPS) المعاهد الوطنية للصحة-كايتوكو. هذا العمل كان يدعمها "برنامج البحوث الداخلية الوطني للقلب" والرئة، والدم معهد (HL005702-11 إلى Y.M.)
Materials
| Name | Company | Catalog Number | Comments |
| 10 x Phosphate Buffered Saline | KD Medical | RGE-3210 | PBS, without Ca2+/Mg2+ |
| Hank’s Balanced Salt Solution | Gibco | 14025-092 | HBSS, with Ca2+/Mg2+ |
| 16% Paraformaldehyde | Electron Microscopy Sciences | 15710 | PFA, fixative, diluted in PBS |
| Triton X-100 | Sigma | X100 | Detergent |
| Normal goat serum | Gibco | 16210064 | Component of blocking/washing buffer |
| Normal donkey serum | Jackson Immuno research | 017-000-121 | Component of blocking/washing buffer |
| Curved fine tweezers | Dumont | RS-5047 | |
| Curved tweezers | Integra Miltex Vantage | V918-782, V918-784 | |
| Filter Unit 0.45 mm | Thermo Scientific | 157-0045 | For filtration |
| 1 mL syringe | Coviden | 8881501400 | For filtration |
| Syringe filter Unit 0.22 mm | Millex-GV | SLGVR04NL | For filtration |
| ProLong Gold | Thermo Scientific | P36934 | Anti-fade mounting medium |
| Nail Polish | Electron Microscopy Sciences | 72180 | For sealing |
| Dissecting microscope | Leica | MZ95 | |
| Confocal microscope | Leica | TCS SP5 | |
| Photoshop CC 2017 | Adobe | Graphics editor software | |
| Illustrator CC 2017 | Adobe | Graphics editor software | |
| Image J | NIH | Image processing software | |
| Anti-PECAM-1 (CD31) antibody | Millipore | MAB1398Z | Hamster IgG, vascular endothelial cell marker, 1:300 |
| Anti-PECAM-1 (CD31) antibody | BD Pharmingen | 553369 | Rat IgG2a kappa, vascular endothelial cell marker, 1:300 |
| Anti-aSMA antibody conjugated with cy-3 | Sigma | C6198 | Mouse IgG2a, vascular smooth muscle cell marker, 1:500 |
| Anti-EphB1 antibody | Santa Cruz | sc-9319 | Goat polyclonal, venous endothelial cell marker, 1:100 |
| Anti-neuron-specific Class III b-tubulin (Tuj1) | Abcam | AB18207 | Tuj1, Rabbit polyclonal IgG, pan-axonal marker, 1:500 |
| Anti-Tuj1 antibody | Covance | MMS-435P | Mouse IgG2a, pan-axonal marker, 1:500 |
| Anti-MBP antibody | Abcam | AB40390 | Rabbit polyclonal IgG, myelination marker, 1:200 |
| Anti-Tyrosine Hydroxylase antibody | Chemicon | AB152 | Rabbit polyclonal, sympathetic neuron marker, 1:500 |
| Anti-Peripherin antibody | Chemicon | AB1530 | Rabbit polyclonal, peripheral neuron marker, 1:1000 |
| Anti-CD11b antibody | Bio-Rad | MCA74G | Rat IgG2b, inflammatory cell marker (macrophages), 1:50 |
| Anti-CD45 antibody | Thermo Fisher Scientific | 14-0451-85 | Rat IgG2b kappa, pan-hematopoietic cell marker, 1:500 |
| Anti-CD3 antibody | Bio-Rad | MCA1477T | Rat IgG1, immune cell marker, 1:100 |
| Anti-CD45R (B220) antibody | Thermo Fisher Scientific | 14-0452 | Rat IgG2a kappa, inflammatory cell marker, 1:200 |
| Anti-GFP antibody | Thermo Fisher Scientific | A11122 | Rabbit polyclonal, 1:300 |
| Anti-GFP antibody | Abcam | Ab13970 | Chicken polyclonal, 1:500 |
| Anti-b-gal antibody | Cappel | 55976 | Rabbit polyclonal, 1:5000 |
| Anti-RFP antibody | Abcam | Ab62341 | Rabbit polyclonal, 1:300 |
| Goat anti-rabbit IgG (H+L) Alexa 488 | Thermo Fisher Scientific | A11034 | Rabbit polyclonal secondary antibody, 1:250 |
| Goat anti-hamster IgG (H+L) Alexa 647 | Jackson Immuno research | 127-605-160 | Hamster polyclonal secondary antibody, 1:250 |
| Goat anti-rat IgG (H+L) Alexa 594 | Jackson Immuno research | 112-585-167 | Rat polyclonal secondary antibody, 1:250 |
| Goat anti-mouse IgG2a Alexa 633 | Thermo Fisher Scientific | A21136 | Mouse IgG2a secondary antibody, 1:250 |
References
- Mukouyama, Y. S., Shin, D., Britsch, S., Taniguchi, M., Anderson, D. J. Sensory nerves determine the pattern of arterial differentiation and blood vessel branching in the skin. Cell. 109, 693-705 (2002).
- Mukouyama, Y. S., James, J., Nam, J., Uchida, Y. Whole-mount confocal microscopy for vascular branching morphogenesis. Methods Mol Biol. 843, 69-78 (2012).
- Li, W., Mukouyama, Y. S. Whole-mount immunohistochemical analysis for embryonic limb skin vasculature: a model system to study vascular branching morphogenesis in embryo. J Vis Exp. , (2011).
- Yamazaki, T., et al. Tissue Myeloid Progenitors Differentiate into Pericytes through TGF-beta Signaling in Developing Skin Vasculature. Cell Rep. 18, 2991-3004 (2017).
- Mukouyama, Y. S. Vessel-dependent recruitment of sympathetic axons: looking for innervation in all the right places. J Clin Invest. 124, 2855-2857 (2014).
- Li, W., et al. Peripheral nerve-derived CXCL12 and VEGF-A regulate the patterning of arterial vessel branching in developing limb skin. Dev Cell. 24, 359-371 (2013).
- Chang, H., Wang, Y., Wu, H., Nathans, J. Flat mount imaging of mouse skin and its application to the analysis of hair follicle patterning and sensory axon morphology. J Vis Exp. , e51749 (2014).
- Salz, L., Driskell, R. R. Horizontal Whole Mount: A Novel Processing and Imaging Protocol for Thick, Three-dimensional Tissue Cross-sections of Skin. J Vis Exp. , (2017).
- Liakath-Ali, K., et al. Novel skin phenotypes revealed by a genome-wide mouse reverse genetic screen. Nat Commun. 5, 3540 (2014).
- Gunawan, M., et al. The methyltransferase Ezh2 controls cell adhesion and migration through direct methylation of the extranuclear regulatory protein talin. Nat Immunol. 16, 505-516 (2015).
- Avci, P., et al. Animal models of skin disease for drug discovery. Expert Opin Drug Dis. 8, 331-355 (2013).
- Jin, H., He, R., Oyoshi, M., Geha, R. S. Animal models of atopic dermatitis. J Invest Dermatol. 129, 31-40 (2009).
- Wagner, E. F., Schonthaler, H. B., Guinea-Viniegra, J., Tschachler, E. Psoriasis: what we have learned from mouse models. Nat Rev Rheumatol. 6, 704-714 (2010).
- Nunan, R., Harding, K. G., Martin, P. Clinical challenges of chronic wounds: searching for an optimal animal model to recapitulate their complexity. Dis Model Mech. 7, 1205-1213 (2014).
- O'Brien, P. D., Sakowski, S. A., Feldman, E. L. Mouse models of diabetic neuropathy. ILAR J. 54, 259-272 (2014).
- Yamazaki, T., et al. Whole-Mount Adult Ear Skin Imaging Reveals Defective Neuro-Vascular Branching Morphogenesis in Obese and Type 2 Diabetic Mouse Models. Sci Rep. 8, (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved