Method Article
Kas iskelet uydu hücreleri tarafından Pax7 ve Laminin antikorlar ile ayirt tanımlaması
Bu Makalede
Özet
Uydu hücreleri hassas tanımlaması işlevlerini çeşitli fizyolojik ve patolojik koşullarda çalışmak için esastır. Bu makale ayirt tabanlı boyama tarafından uydu hücreleri yetişkin iskelet kas bölümlerinde tanımlamak için bir protokol sunar.
Özet
Ayirt doku bölümlerinde farklı hücre tipleri tanımlamak için yardımcı olan etkili bir yöntemdir. İstenen hücre nüfus çalışma için antikorlar belirli hücre işaretçileri için doku bölümlerde uygulanır. Yetişkin iskelet kas, uydu (SCs) kas onarım ve rejenerasyon katkıda kök hücre hücrelerdir. Bu nedenle, görselleştirmek ve uydu hücre nüfus farklı fizyolojik koşullar altında izlemek önemlidir. İskelet kas istirahat, SCs Bazal lamina ve myofiber plazma zarı arasında yer alır. Myofibers veya hücre kültürü SCs tanımlamak için yaygın olarak kullanılan bir işaretleyici Pax7 Eşli kutu proteindir. Bu makalede, en iyi duruma getirilmiş bir Pax7 ayirt protokol kas iskelet bölümleri üzerinde non-spesifik boyama ve arka plan en aza indiren sunulur. Bir protein (laminin) Bazal lamina tanır başka bir antikor SCs. benzer protokoller tanımlamanıza yardımcı olması için de Pax7 ve ilgi ek proteinler için antikorlar ile ikili veya üçlü etiketleme gerçekleştirmek için kullanılabilir da eklendi.
Giriş
Kas iskelet multinucleated kas hücreleri oluşur, myotubes denilen, kuvvet ve daralma ile hareketleri oluşturmak myofibers düzenlenmektedir. En iskelet kasları kraniyofasiyal bazı kasları dışında bir somite1adında bir geçici embriyonik yapısından türetilir. Myogenic öncül hücreleri epitel somite myoblasts olmak için delaminate. Myoblasts daha da çok çekirdekli myofibers oluşturmak için myotubes olmak için sigorta miyositler ayırt etmek. Yukarıdaki işlem myogenesis denir ve gen ekspresyonu tarafından geçici düzenlenir kontrolünü ile karakterizedir. Myogenic Kara filmin tarih öncesi Pax3 ve Pax7, oysa myoblasts Tanrım hızlı ve/veya2,3myogenin ve myosins Myf5 ve miyositler hızlı hızlı. Kas büyüme hangi myofibers daha fazla myonuclei varolan lifleri (Hiperplazi) birleşmeyle ve kas lif boyutu (hipertrofisi)4bir artış daha büyük olmak bir süreçtir. Kas büyüme sırasında onlar ayırt etmek ve kendi kendini yenilemek kök hücre özelliklerine sahip myogenic hücre sürdürülebilir bir kaynağıdır. Bu hücreler uydu fiziksel konumlarını sarcolemma (myofiber, hücre zarı) ve Bazal lamina5arasındaki temel hücre denir. SCs şiddetle Juvenil aşamasında (doğum sonrası fareler ilk 2-3 hafta) kas büyümesine katkıda bulunmak, ama yetişkin kas6dinlenme sakin ol. Dikkat çekici, onlar-ebilmek var olmak yanıt kas olarak yeniden Aktif kişi yaralandı ve hasarlı kas7onarmak için yeni kas hücreleri ayırt etmek.
Kök hücre özellikleri SCs çalışmanın ilgili temel kas Biyoloji ve terapileri kas hastalıkları8için yapmak. Sonuç olarak, son yıllarda yoğun araştırma çalışmaları bir alan olmuştur. Bir muazzam genetik ve epigenetik SCs9,10dissekan ilerlemeler kaydedilmiştir. SCs in situ tespit ve yalıtma de tekniklerin geliştirilmiş olup yol11en iyi duruma getirilmiş. İmmünfloresan boyama SCs tanımlaması için Pax7 da dahil olmak üzere belirli antikor kullanımı sağlar. Ancak, kıtlık ve bir güçlü auto-floresan ile yetişkin iskelet kas dokusunun kombine SCs küçük boyutlu görselleştirme zorlu render. Burada, biz fare kas dokusu için Pax7 için optimize edilmiş ve Zebra balığı kas12için varolan bir yöntemine dayalı bir immünfloresan boyama iletişim kuralı tanımlamak. Buna ek olarak, farklı bir fluorophore ile etiketli bir Laminin antikor Bazal lamina altında SCs yer almaktadır belirlemek için istihdam edilmektedir. Bu iletişim kuralı sürekli Pax7 pozitif SCs ve tüm test fizyolojik şartlarda ve gelişim aşamalarında altında myogenic öncüleri görselleştirme sağlar.
Protokol
Bu protokol için yetişkin fareler (2-6 ay), tibialis anterior (TA) ve ekstansiyon digitorum longus (EDL), ön arka bacak kasları üzerinde onların SCs boyama ayirt gerçekleştirmek için bir örnek olarak istihdam edildi. Tüm belgili tanımlık merdiven fareler ve kas doku gruptakiler hayvan bakım ve kullanım Komitesi (ACUC), NIAMS/NIH tarafından onaylanmış.
1. fare Hind Lime TA/Edi kas incelemek
- Fareyi NIH ACUC kurallar altında bir CO2 dolu ötenazi odasında ötenazi. Servikal yerinden çıkması gerekiyorsa gerçekleştirin.
- Fare yukarı bir diseksiyon üzerinde (sırtüstü) koymak. % 70 etanol karın derisi üzerine sprey. Bir 1-2 cm yatay olarak fare göbek Cilt Merkezi üzerinde açma kesebilir ve sonra fareyi fare ayakları doğru açılış çekerek deskin. Fare hind bacak bir tarafı ortaya çıkarmak.
- İki keskin forseps kullanın: ayak bileği için TA/Edi eklemek tendonlar tutmak için kullanın ve break ve TA/Edi kapsayan fasya yamultmak için diğerini kullanın. Fasya soyulmuş sonra forseps keskin ucu ucunu TA/Edi kas altında çalıştırarak TA/Edi tibia kemikten ayırmak için kullanabilirsiniz.
- Ayak bileği tendon hala onları Forseps ile tutarak makasla kesme. Forseps ile TA/Edi ayak bileği taraftan kaldırma sırasında diz için TA/Edi ayak bileği dan uzunlamasına çizgi boyunca makasla kas kırpın. Bütün TA/Edi tibia dan ayırmak için diz tarafı tendonlar kesilmiş.
2. Cryo-gömme TA/Edi kas
- Bir kap içinde örneğinbir sıvı azot Banyosu hazırlamak., sıvı nitrojen Dewar flask. Methylbutane yarısı dolu için küçük plastik kabı (yaklaşık 20 mL) içine dökün. Sonra kabı dondur için sıvı azot banyoda koymak. Birkaç dakika sonra methylbutane donuk olduğunu denetleyin.
Not: Sıvı azot kuru buz bir kova tarafından değiştirilebilir, ancak daha yavaş dondurma zamanı. - Küçük plastik enjektör pompası düz yüzeyine disseke TA/Edi yatıyordu. Tam olarak TA/Edi ile birkaç damla, en uygun kesme sıcaklık (O.C.T.) bileşik (dondurucu orta) kapsar.
- Sıvı azot banyosu dışında methylbutane kabı alın ve sıcak bir nesne ile yüzey çözülme (örn., makas tanıtıcısı). Hızlı bir şekilde DIP O.C.T. TA/Edi pistonu üzerinde ek-doku dondurmak için erimiş methylbutane kapalı.
- Forseps ile pistonu katıştırılmış dokusundan ayırmak ve 1.5 mL microcentrifuge tüp içine koy. Daha fazla örnekleri işlerken depolamak için sıvı azot tüpü yerleştirin.
Not: Katıştırılmış doku-80 ° C-20 ° C veya uzun vadeli (2 yıl) için kısa vadeli (6 ay) saklanır.
3. cryostat kesit
- O.C.T. bir cryostat numune sahibinin Merkezi bileşik bir damla ekleyin. O.C.T. bileşik neredeyse katılaşmış kadar bekleyin. Hızlı bir şekilde katıştırılmış TA/Edi O.C.T. karışımla, ayak bileği tarafı dik için sopa aşağı ve diz tarafı yukarı.
- Numune tutucu bir cryostat üzerine monte, doku 10 µm Aralık kesme ve cryo-bölümleri ile kaplı frost slaytlarda ilgili toplamak bir slayt bölümlerde 4-8.
- Bölümler için en az 3 saat gece oda sıcaklığında kuru.
Not: dondurucu gece veya daha uzun bölümlerde kurutma kabul edilebilir olsa da, bu kaçınılmaz autofluorescence artıracaktır. En iyi sonuçlar için Kuru bölümleri için 0,5 h, sonra devam edin fiksasyon ve boyama adımları ile hemen. - Slaytları bir slayt kutusunda toplamak ve bunları hemen kullanmak veya slaytları-80 ° C veya daha sonra kullanmak için-20 ° C, depolama.
4. ayirt boyama için hazırlanması reaktifler
-
Arabellekleri hazırlayın:
- 2 L 1 fosfat tamponlu tuz (PBS) x 10 x PBS hazırlayın.
- 1 x PBS % 16 dan % 4 paraformaldehyde (PFA) 40 mL hazırlayın PFA.
- PBST 2 L hazırlamak: 1 x PBS ile % 0,1 Triton-100.
- PBST-B: PBST 50 mL % 2 sığır serum albumin (BSA) ile hazırlayın.
- 10 mL PBST-B-G: PBST % 2 BSA ve % 5 Normal keçi Serum ile hazırlayın.
- 1 mL engelleme çözeltisi hazırlamak. Seyreltik AffiniPure Fab parçası keçi Anti-fare IgG (H + L) (1:10) PBST-d.
- 200 mL 1 x sitrat arabelleği hazırlayın.
Not: Yukarıdaki çözümleri hacimleri en az 5 slayt için yeterlidir. Birimleri istediğiniz slayt sayısını ve slayt konteyner boyutunu göre ayarlanmalıdır.
-
Antikor lekeleri hazırlayın:
- Birincil antikorlar (çalışma konsantrasyonu): birincil antikor Mix 1.2 mL Pax7 fare Monoklonal antikor (Igg1) sulandrarak hazırlamak (1-5 µg/mL) + Laminin tavşan poliklonal antikor (0,5-2 µg/mL) + MF20 fare Monoklonal antikor (Igg2b) (0,5-2,5 µg / mL) içinde PBST-B-G.
Not: MF20 fare Monoklonal antikor (Igg2b) isteğe bağlıdır. - İkincil antikorlar (çalışma konsantrasyonu): ikincil antikor Mix 1.2 mL keçi Anti-fare Igg1 çapraz adsorbe ikincil antikor, Alexa Fluor 488 sulandrarak hazırlamak (0,5-2 µg/mL) + keçi Anti-tavşan IgG (H + L) son derece çapraz adsorbe ikincil antikor, Alexa Fluor artı 555 (0,5-2 µg/mL) + keçi Anti-fare Igg2b çapraz adsorbe ikincil antikor, Alexa Fluor 647 (0,5-2 µg/mL) içinde PBST-B-G.
Not: Alexa Fluor 647 seçime bağlıdır.
- Birincil antikorlar (çalışma konsantrasyonu): birincil antikor Mix 1.2 mL Pax7 fare Monoklonal antikor (Igg1) sulandrarak hazırlamak (1-5 µg/mL) + Laminin tavşan poliklonal antikor (0,5-2 µg/mL) + MF20 fare Monoklonal antikor (Igg2b) (0,5-2,5 µg / mL) içinde PBST-B-G.
5. ayirt boyama adımları
-
Suyla temasa ve cryo-bölümler PFA ile düzeltin.
- Birkaç TA/Edi cryo-bölümü slaytları slayt kutusundan kaldırın. Slaytları bir slayt tutma tepsi oda sıcaklığında ısıtın.
- Bir sıvı engelleyici kalem (PAP kalem) tüm cryo-bölümleri slayt içeren bir çizmek için kullanın. Bu daire çözümleri slaytın dışına akan önlemek.
- Tepsiyi laboratuvar duman kukuIeta götür. 300-500 µL % 4'lük eklemek PFA daire içinde alanı içinde slayda 10 dk. dışarı PFA 1 x PBS ile yıkama için oda sıcaklığında bölümleri düzeltmek için en az 3 x 5 dk bir slayt kap içinde.
Dikkat: PFA zehirli ve tehlikeli atık olduğunu; özenle işletilen ve tehlikeli atık konteyner içine atılması gerekir.
-
Antijen alma
- Başka bir slayt konteyner sitrat arabellek 200 mL ile doldurulması.
- Slaytları konteyner içine aktarın. Slaytları yüksek basınç modunda 10 dk pişirmek bir düdüklü tencere kapsayıcı slaytlar ile aktarın.
- PBST (200 mL) ile yeni bir kapsayıcı tüm slaytlara 10 dk. Transfer için su boşaltma ile konteyner sakin, PBST ile slaytlar için en az 3 x 5 dakika yıkayın.
-
Engelleme
- Kimwipes suya batırılmış slaytları slayt kurutma önlemek için nemli bir ortam oluşturmak için tutan tepsisi.
- Slaytlar geri tepsiye hareket ve çözüm her slayda engelleme 200 µL ekleyin. Tepsiyi bir kap ile kapak ve geliştirmek için 30 dk engelleme izin.
Not: yüksek arka plan oluşturan fare IgG fare Kas dokularında belirsiz bağlama yani fare Monoklonal antikor Pax7 antikor var. AffiniPure Fab parçası keçi Anti-fare IgG (H + L) kullanarak fare fare belirsiz bağlama engeller.
-
Birincil antikorlar uygulanır.
- Slaytlar slayt kapsayıcısında bir kez PBST ile yıkayın. Ardından slaytları yeniden boyama tepsi taşıyın.
- Birincil antikor Mix 200 µL her slayta uygulamak, tepsiyi bir kap ile kapak ve 1 h için oda sıcaklığında veya gece kalmak için 4 ° C'de geliştirmek tepki izin.
Not: oda sıcaklığında reaksiyon gelişen tatmin edici sonuçlar verir, ancak en iyi sonucu 4 ° C'de gecede tepki verir. Myosin MF20 antikor karışımı bir üçlü (Pax7, Laminin, MF20) etiketleme gerçekleştirmek için eklenebilir. MF20 lekeleri kas lifleri farklı. Bu adımı da ikincil antikorlar (keçi antikorlar) aşağıdaki adımda potansiyel belirsiz bağlama azaltmak için PBST-B-G ile başka bir engelleme adım olarak hizmet vermektedir.
-
İkincil antikorlar uygulanır.
- Oda sıcaklığında PBST ile antikor birincil dışarı yıkama en az 3 x 5 dak.
- İkincil antikor Mix 200 µL her slayta eklemek ve oda sıcaklığında en az 1 h için geliştirmek tepki sağlar.
Not: Pax7 + Laminin, keçi Anti-fare Igg1 Alexa 488 ve keçi Anti-tavşan Alexa 555 kullanın.
Pax7 + Laminin + MF20 için keçi Anti-fare Igg2b Alexa 647 karışımı ekleyin. - PBST ile ikincil antikorlar dışarı yıkama en az 3 x 5 dak.
-
DAPI (4', 6-diamidino-2-phenylindole) Counter leke ve montaj
- DAPI (1:20, 000) PBST slayt kapsayıcısında, örneğin, DAPI 10 µL PBST 200 ml seyreltik.
- 3 dk. DAPI kapsayıcısı içindeki slaytları leke.
- PBST ile DAPI dışarı en az 5 x 5 dakika yıkayın.
- Montaj orta slaytlarla bağlayın. Coverslips ile slaytlar kapağı.
Dikkat: Zehirli ve tehlikeli DAPI; dikkatli ve tehlikeli atık şişe bertaraf gerekir.
6. floresan mikroskobu
Not: yukarıda bildirilen immünfloresan boyama protokolü ile bir geniş alanlı floresan veya confocal mikroskop SCs görselleştirme izin verir. SCs tanımlamak için başlangıçta zor olabilir. Burada yardımcı olabilir birkaç önerilen adımlar vardır.
- DAPI kanal ve düşük büyütme hedefleri slaytlardaki bölümler görselleştirmek için kullanın.
- Düşük-yüksek boyuta geçiş. SCs gözlemlemek için en az bir 20 X amaç gereklidir).
- İkili filtre küp 488 (FITC) için kullanmak / 555 (rodamine) Pax7 ve Laminin gözlemlemek için SCs tanımlamak için aynı anda sinyalleri. Bu ayarı altında arka plan gürültü daha iyi bir kontrast Pax7 boyama sinyal var.
- Hızlı bir şekilde FITC kanala doğru SCs tanımlamak için DAPI alternatif. Tüm SCs Pax7/DAPI-pozitif olmalıdır.
Sonuçlar
Belgili tanımlık yukarıda merdiven SCs floresan mikroskop (şekil 1) altında yetişkin dinlenme kas bölümlerde başarıyla görüntülenmeyecektir. Yetişkin kas dokusu lifleri belirli tür güçlü auto-floresan olsa da, parlak Alexa serisi boyalar arka plan gürültü üstesinden gelebilir ve sinyal öne çıkmaktadır (şekil 1A, B; ok uçları). İki fotonlu confocal mikroskobu nispeten temiz görüntü (şekil 1B) geniş alanlı floresan mikroskop (şekil 1A) yakalar. Aynı iletişim kuralını da iyi kas dokuları Juvenil fareler (şekil 2A), fare embriyo (şekil 2B), üzerinde çalıştı ve yetişkin kas dokuları (şekil 3) yaralandı. Çocukça ve embriyonik kas dokularda, orada daha fazla aktif SCs (şekil 2A, oklar) veya Pax7 pozitif nispeten daha büyük çekirdekleri; var myogenic öncüleri (şekil 2B, oklar) Bu nedenle, Yetişkin fareler (Resim 2 Resim 1karşı) daha genç farelerin SCs görselleştirmek nispeten daha kolaydır. Yaralı kas dokusunda da orada daha aktif Pax7 pozitif SCs (şekil 3).

Şekil 1: Pax7 ve Laminin ayirt fare kas dokuları dinlenme yetişkin görüntülerini. TA/Edi kas bölümleri yetişkin farelerin Pax7 (yeşil) ve Laminin (kırmızı) antikorları ile immunostained vardı ve karşı DAPI (mavi) ile lekeli. (A)görüntü geniş alanlı floresan mikroskop altında ele geçirdi. (B) görüntü confocal mikroskop altında ele geçirdi. Ölçek çubukları: 50 µm. ok: SCs liflerinden düşük autofluorescence ile. Ok uçları: SCs liflerinden ile yüksek autofluorescence. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Resim 2: Pax7 ve Laminin veya MF20 ayirt kas dokuları genç farelerin üzerinde görüntülerini. TA/Edi kas bölümleri genç farelerin Pax7 (yeşil) ve Laminin (kırmızı) veya MF20 (macenta) antikorlar ile immunostained vardı ve karşı DAPI (mavi) ile lekeli. (A)doğum sonrası gün 8 (P8) kas bölüm confocal mikroskop altında ele geçirdi. (B) embriyonik gün 17,5 (E17.5) kas bölüm geniş alanlı floresan mikroskop altında ele geçirdi. Ölçek çubukları = 50 µm. ok: SCs P8 kas bölümünde (A); temsilcisi Pax7 + E17.5 kas bölümünde, görüntü (B) daha fazla iken myogenic öncüleri. Bu iki resim de görüntüleri yayımlanan kağıt13 (sşekil 3D) ve (sşekil 1B), anılan sıraya göre oluşturulan ham verilerden modifiye edilmiştir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
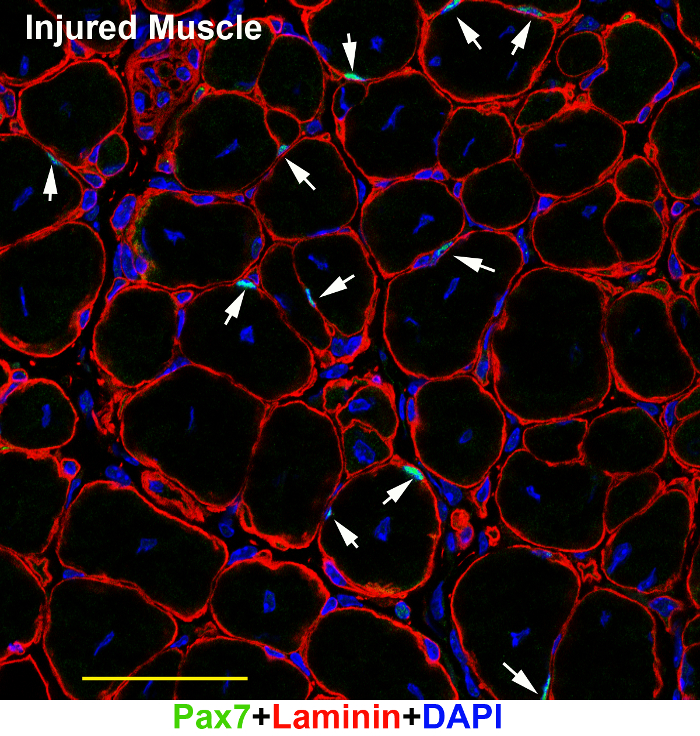
Şekil 3: Pax7 ve Laminin ayirt yaralı yetişkin kas dokuları üzerinde temsilcisi bir görüntüsünü. TA/Edi kas bölümleri bir yaralı yetişkin kas dokuları (7 gün sonra yaralanma) immunostained Pax7 (yeşil) ve Laminin (kırmızı) antikorları ile vardı ve karşı DAPI (mavi) ile lekeli. Görüntü confocal mikroskop altında ele geçirildi. Ölçek çubuğu = 50 µm. ok: SCs bölümünde. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Tartışmalar
Yukarıdaki Protokolü Pax7/MF20 Zebra balığı iskelet kas12tarihinde boyama yöntemi dayanıyordu. Kullanılan ve adımları engelleme çözümleri aynı veya benzer. Kullanılan antikor aynıdır. Ayarlanan adımları fare kas dokusu ve SCs özelliklerini temel. İlk olarak, Laminin antikor görselleştirmek ve SCs konumunu doğrulamak için mix eklendi. SCs mikroskop altında 488/555 çift filtre küp kullanırken saymak için özellikle yararlı; Bu büyük ölçüde gürültülü autofluorescent kökenli öne Pax7 SC elde edilen sinyal geliştirilmiştir. İkinci olarak, kullanılan Pax7 antikor fare antikor olduğu için fareyi IgG belirsiz bağlama dan kaynaklanan arka plan azaltmak için bir fare fare engelleme adım (Adım 5.3) eklendi. Üçüncü olarak, antijen alma adım (Adım 5.2) ile Pax7 antikor doku sabit PFA üzerinde boyama için son derece önemliydi.
Aynı iletişim kuralını (pups ve embriyo) genç farelerin kas dokuları üzerinde kullanılmıştır (Şekil 2). Aslında, aynı protokolü tarafından pups içinde yetişkin fareler SCs görselleştirmek nispeten daha kolaydı. Yavru yetişkin kas dokusu ile devam etmeden önce deneyim kazanmak için üzerinde SCs boyama ile başlatmak yardımcı olabilir. Bir negatif kontrol birincil antikorlar (Adım 5,4) olmadan da her deneyde gereklidir. Benzer bir iletişim kuralı başarıyla adımları işleme ilave parafin ile parafin bölümlerinde kullanılmıştır. Ancak, parafin kesitler nispeten zayıf Pax7 ifade var SCs gelen sinyalleri maskeli bir daha yüksek autofluorescence altyapıya sahip eğilimindedir. Mümkünse, parafin kesitler kullanmaktan kaçının. Aynı iletişim kuralını da çok sayıda SCs, ve bu pups kas dokusu (şekil 3) ile elde edilen benzer sonuçlar verdi yaralı kas dokuları üzerinde istihdam edildi.
Kas doku autofluorescence temiz ayirt sonuçları14almak üzere büyük engel temsil eder. Cryo-bölümleri kurutma süresini azaltma autofluorescence düşürebilir ve taze hazırlanmış cryo-bölümleri kullanarak önerilir. Benzer şekilde diğer protokolleri15, fare fare engelleme adım daha fazla arka plan azaltmak için gereklidir.
Geniş alanlı floresan mikroskop ve confocal mikroskop SCs görselleştirme yoluyla göz parçalar için etkili iken, yüksek kaliteli fotoğraflar çekmek için confocal mikroskobu kullanılması önerilir.
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
NIAMS ışık Imaging mikroskoplar ve teknik yardım sağlamak için bölüm teşekkür ediyoruz. MF20 ve Pax7 antikor bankadan gelişim çalışmaları Hibridoma NICHD himayesinde geliştirilip Biyolojik Bilimler Bölümü Iowa Üniversitesi Iowa City tarafından elde edilmiştir. Bu eser Intramural araştırma programı, NIAMS tarafından Ulusal Sağlık Enstitüleri ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| methylbutane | Sigma-Aldrich | M32631 | |
| Optimal Cutting Temperature (O.C.T.) compound | Electron Microscopy Sciences | 62550-01 | |
| 10x PBS | Gibco, Themo Fisher | 70011-044 | |
| 16% PFA | TED PELLA | 50-00-0 | |
| Triton-100 | Sigma-Aldrich | T8787 | |
| Normal Goat Serum | Thermo Fisher | 0 1-6201 | |
| AffiniPure Fab Fragment Goat Anti-Mouse IgG (H+L) | Jackson ImmunoResearch Laboratories Inc. | 115-007-003 | |
| 20x Citrate Buffer | Thermo Fisher | 00 500 | |
| Pax7 mono-clonal mouse antibody (IgG1) (supernatant) | Developmental Study Hybridoma Bank | N/A | |
| Laminin polyclonal rabbit antibody | Sigma-Aldrich | L9393 | |
| MF20 mono-clonal mouse antibody (IgG2b) (supernatant) | Developmental Study Hybridoma Bank | N/A | |
| Goat anti-Mouse IgG1 cross-absorbed secondary antibody, Alexa Fluor 488 | Thermo Fisher | A-21121 | |
| Goat anti-Mouse IgG2b cross-absorbed secondary antibody, Alexa Fluor 647 | Thermo Fisher | A-21242 | |
| Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 555 | Thermo Fisher | A32732 | |
| Leica CM1860 cryostat | |||
| Leica DM6000 wide-field fluorescent microscope | |||
| Leica DMR wide-field fluorescent microscope | |||
| Zeiss LSM510 confocal microscope | |||
| Zeiss LSM780 confocal microscope | |||
| Cuisinart electronic pressure cooker |
Referanslar
- Buckingham, M. Gene regulatory networks and cell lineages that underlie the formation of skeletal muscle. Proc Natl Acad Sci U S A. 114 (23), 5830-5837 (2017).
- Buckingham, M., Relaix, F. PAX3 and PAX7 as upstream regulators of myogenesis. Semin Cell Dev Biol. 44, 115-125 (2015).
- Relaix, F., Buckingham, M. From insect eye to vertebrate muscle: redeployment of a regulatory network. Genes Dev. 13 (24), 3171-3178 (1999).
- Chang, N. C., Chevalier, F. P., Rudnicki, M. A. Satellite Cells in Muscular Dystrophy - Lost in Polarity. Trends Mol Med. 22 (6), 479-496 (2016).
- Mauro, A. Satellite cell of skeletal muscle fibers. J Biophys Biochem Cytol. 9, 493-495 (1961).
- Kuang, S., Rudnicki, M. A. The emerging biology of satellite cells and their therapeutic potential. Trends Mol Med. 14 (2), 82-91 (2008).
- Wang, Y. X., Rudnicki, M. A. Satellite cells, the engines of muscle repair. Nat Rev Mol Cell Biol. 13 (2), 127-133 (2011).
- Rinaldi, F., Perlingeiro, R. C. Stem cells for skeletal muscle regeneration: therapeutic potential and roadblocks. Transl Res. 163 (4), 409-417 (2014).
- Le Grand, F., Rudnicki, M. A. Skeletal muscle satellite cells and adult myogenesis. Curr Opin Cell Biol. 19 (6), 628-633 (2007).
- Giordani, L., Puri, P. L. Epigenetic control of skeletal muscle regeneration: Integrating genetic determinants and environmental changes. FEBS J. 280 (17), 4014-4025 (2013).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nat Protoc. 10 (10), 1612-1624 (2015).
- Feng, X., Adiarte, E. G., Devoto, S. H. Hedgehog acts directly on the zebrafish dermomyotome to promote myogenic differentiation. Dev Biol. 300 (2), 736-746 (2006).
- Juan, A. H., et al. Polycomb EZH2 controls self-renewal and safeguards the transcriptional identity of skeletal muscle stem cells. Genes Dev. 25 (8), 789-794 (2011).
- Jackson, K. A., Snyder, D. S., Goodell, M. A. Skeletal muscle fiber-specific green autofluorescence: potential for stem cell engraftment artifacts. Stem Cells. 22 (2), 180-187 (2004).
- Lepper, C., Conway, S. J., Fan, C. M. Adult satellite cells and embryonic muscle progenitors have distinct genetic requirements. Nature. 460 (7255), 627-631 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır