Method Article
Identification des cellules satellites musculaires squelettiques par Immunofluorescence avec des anticorps de laminine et Pax7
Dans cet article
Résumé
L’identification précise des cellules satellites est essentielle pour l’étude de leurs fonctions dans des conditions physiologiques et pathologiques différents. Cet article présente un protocole pour identifier les cellules satellites sur des coupes de muscle squelettique adulte par axée sur l’immunofluorescence souillant.
Résumé
Immunofluorescence est une méthode efficace qui aide à identifier les différents types de cellules sur des sections de tissu. Afin d’étudier la population de la cellule souhaitée, anticorps pour les marqueurs de cellules spécifiques sont appliqués sur des sections de tissu. Dans le muscle squelettique adulte, les cellules satellites (SCs) sont des cellules souches qui contribuent à la régénération et la réparation musculaire. Par conséquent, il est important de visualiser et de tracer la population de cellules satellites dans différentes conditions physiologiques. Dans le muscle squelettique au repos, SCs se trouvent entre la lame basale et la membrane plasmique de fibre musculaire. Un marqueur couramment utilisé pour identifier les SCs sur les myofibres ou en culture cellulaire est la protéine jumelé boîte Pax7. Dans cet article, un protocole d’immunofluorescence Pax7 optimisé sur des coupes de muscle squelettique est présenté qui minimise la coloration non spécifiques et fond. Un autre anticorps qui reconnaît une protéine (laminine) de la lame basale a également été ajouté pour aider à identifier les protocoles SCs. Similar permet également d’effectuer le double ou triple marquage avec des anticorps pour des protéines d’intérêt et de Pax7.
Introduction
Le muscle squelettique est composé de cellules musculaires multinucléées, appelé myotubes, organisé dans les fibres musculaires, qui génèrent des forces et mouvements par contraction. Plus les muscles squelettiques, à l’exception de certains muscles cranio-faciales, proviennent d’une structure embryonnaire temporaire appelée un somite1. Cellules précurseurs myogénique se délamineront depuis le somite épithélial pour devenir des myoblastes. Outre les myoblastes se différencient en myocytes qui se fusionnent pour devenir des myotubes pour former les myofibres multi nucléées. Le processus décrit ci-dessus est appelé myogenèse et se caractérise par réglementés dans le temps de contrôle de l’expression génique. Les précurseurs myogènes expriment Pax3 et Pax7, tandis que les myoblastes expriment MyoD et/ou myocytes et Myf5 express myogénine et myosines2,3. La croissance musculaire est un processus dans lequel les myofibres deviennent plus grandes incorpore plusieurs noyaux de fibres existantes (hyperplasie) et par une augmentation des fibres musculaires taille (hypertrophie)4. Au cours de la croissance musculaire, il y a une source durable de cellules myogènes ayant des propriétés de cellules souches qu’ils peuvent faire la différence et se renouveler. Ces cellules sont appelées cellules satellites basés sur leur emplacement physique entre le sarcolemme (membrane cellulaire de la fibre musculaire) et la lame basale5. SCs vigoureusement contribuent à la croissance musculaire dans le stade juvénile (les premières 2-3 semaines de souris après la naissance), mais devient quiescents au repos le muscle adulte6. Fait remarquable, elles peuvent être ré-activés en réponse à muscle blesse et se différencient en cellules de muscle nouveau de réparer le muscle lésé7.
Les propriétés de cellules souches font l’étude de SCs pertinentes pour la biologie de base musculaire et thérapies des maladies de muscle8. En conséquence, il a été un domaine de recherche intense dans les dernières décennies. Un énorme progrès ont été réalisés en disséquant la génétique et épigénétique de SCs9,10. Techniques intervenant dans l’isolement et l’identification SCs in situ ont été développés et optimisés le long de la voie11. Immunofluorescence permet l’identification de SCs grâce à l’utilisation des anticorps spécifiques, y compris celle pour Pax7. Toutefois, la rareté et la petite taille des SCs, combinée à une forte fluorescence-auto du tissu musculaire squelettique adulte rendent la visualisation difficile. Nous décrivons ici un protocole de coloration par immunofluorescence optimisé pour les tissus musculaires de souris pour Pax7 et basé sur une méthode existante pour le poisson-zèbre muscle12. En outre, un anticorps de laminine marqué avec un fluorophore distinct est utilisé pour identifier la couche basale, dans lesquelles se trouvent les SCs. Ce protocole permet toujours la visualisation de SCs Pax7 séropositifs et myogènes précurseurs dans des conditions physiologiques tous testées et stades de développement.
Protocole
Dans le présent protocole, les muscles de la patte antérieure de souris adultes (2 à 6 mois), tibialis anterior (TA) et extensor digitorum longus (EDL), travaillaient à titre d’exemple, pour effectuer l’immunofluorescence souillant sur leurs SCs. Toutes les étapes de manipulation souris et muscle les dissections de tissu ont été approuvées par l’utilisation Comité (ACUC) du NIAMS/NIH et animalier.
1. disséquer le Muscle TA/PCP de la patte de souris
- Euthanasier la souris dans une chambre d’euthanasie rempli2 CO conformément aux lignes directrices de l’ACUC des NIH. Effectuer la dislocation cervicale si nécessaire.
- Mettre la souris face vers le haut sur un socle de dissection (décubitus dorsal). Vaporiser de l’éthanol à 70 % sur sa peau de ventre. Couper un 1 ou 2 cm ouverture horizontalement sur le centre de la peau de ventre de la souris, puis deskin la souris en tirant sur l’ouverture vers les pieds de la souris. Exposer un côté de la patte de la souris.
- Utiliser des pinces à deux tranchants : utiliser une pour maintenir les tendons qui s’attachent le TA/EDL à la cheville et utiliser l’autre se casser et le cisaillement du fascia couvrant la TA/EDL. Une fois que le fascia est décollée, utilisez le bout pointu de la pince pour détacher la TA/PCP de l’os du tibia en exécutant la pointe sous le muscle TA/EDL.
- Couper les tendons de la cheville avec des ciseaux tout en les tenant toujours avec la pince. Coupez le muscle avec des ciseaux le long de la ligne longitudinale d’un TA/PCA de la cheville au genou tout en soulevant la TA/EDL du côté de la cheville avec la pince. Couper les tendons du genou côté pour détacher l’ensemble TA/EDL du tibia.
2. Cryo-incorporation du Muscle TA/EDL
- Préparez un bain d’azote liquide dans un récipient, par exemple., de l’azote liquide flacon Dewar. Versez méthylbutane dans un bécher en plastique petit (environ 20 mL) à moitié plein. Mettre ensuite le bécher dans un bain d’azote liquide pour congeler. Après quelques minutes, vérifier que le méthylbutane est gelé.
Remarque : L’azote liquide peut être remplacé par un seau de glace sèche, mais le temps de congélation est plus lent. - Posez la TA/EDL disséqué sur la surface plane d’un piston de petite seringue en plastique. Couvrir entièrement la TA/EDL avec quelques gouttes de Optimal coupe température (PTOM) composé (le milieu de congélation).
- Prenez le gobelet méthylbutane sortant du bain d’azote liquide et décongeler la surface avec un objet chaud (par exemple., la poignée de ciseaux). Rapidement dip les PTOM couvert TA/EDL sur le piston dans le fondu méthylbutane snap-gel le tissu.
- Détacher le tissu incorporé depuis le piston avec une pince et mettez-la dans un tube de microtubes de 1,5 mL. Placer le tube dans l’azote liquide à stocker lors de la manipulation des échantillons plus.
NOTE : Le tissu embarqué peut être stocké à-80 ° C à long terme (2 ans) ou à-20 ° C à court terme (6 mois).
3. cryostat sectionnement
- Ajouter une goutte de PTOM composé vers le centre d’un porte-spécimen d’un cryostat. Attendez que le composé PTOM est presque solidifié. Coller rapidement la TA/EDL incorporé au composé des PTOM, perpendiculairement à la cheville du côté vers le bas et le côté du genou vers le haut.
- Monter le porte-échantillon dans un cryostat, couper le tissu à 10 µm intervalle et recueillir les cryo-sections sur des lames de gel enduit avec sur 4-8 sections sur une diapositive.
- Sécher les sections à température ambiante pendant au moins 3 h pour la nuit.
Remarque : Bien que les sections dans le congélateur pendant au moins une nuit de séchage est acceptable, il augmentera inévitablement l’autofluorescence. Pour de meilleurs résultats, sèche les sections pour 0,5 h, puis procéder à la fixation et coloration des étapes immédiatement. - Recueillir les lames dans une boîte de diapositive et utilisez-les immédiatement ou stocker les lames à-80 ° C ou -20 ° C pour une utilisation ultérieure.
4. préparation des réactifs pour Immunofluorescence souillant
-
Préparez les tampons :
- Préparer 2 L de 1 x en solution saline tamponnée au phosphate (PBS) de PBS 10 x.
- Préparer 40 mL de paraformaldéhyde à 4 % (PFA) dans du PBS 1 x 16 % PFA.
- Préparer 2 L de PBST : PBS 1 x 0,1 % Triton-100.
- Préparation de 50 mL de PBST PBST-b : avec 2 % d’albumine sérique bovine (BSA).
- Préparer 10 mL de PBST PBST-B-g : avec 2 % BSA et 5 % de sérum de chèvre Normal.
- Préparer 1 mL de solution de saturation. Diluer AffiniPure Fab Fragment Goat anti-mouse IgG (H + L) (01:10) PBST-b.
- Préparez 200 mL de tampon citrate 1 x.
Remarque : Les volumes des solutions mentionnées ci-dessus sont suffisants pour au moins 5 toboggans. Des volumes doivent être ajustées selon le nombre de diapositives et la taille des conteneurs diapositive.
-
Préparer des anticorps taches :
- Anticorps primaires (concentration de travail) : préparer 1,2 mL de mélange de l’anticorps primaire en diluant anticorps monoclonal de souris de Pax7 (IgG1) (1 à 5 µg/mL) + anticorps polyclonaux de lapin laminine (0,5 à 2 µg/mL) + anticorps monoclonal de souris de MF20 (IgG2b) (0,5 à 2,5 µg / mL) PBST-B-g.
NOTE : Anticorps monoclonal de souris de MF20 (IgG2b) est facultative. - Anticorps secondaires (concentration de travail) : préparer 1,2 mL de mélange d’anticorps secondaire en diluant chèvre anti-souris Croix-adsorbé secondaires anticorps IgG1, Alexa Fluor 488 (0,5 à 2 µg/mL) + chèvre anti-IgG (H + L) fortement adsorbés à la Croix secondaires anticorps de lapin, Alexa Fluor Plus 555 (0,5 à 2 µg/mL) + chèvre anti-souris IgG2b Croix-adsorbé anticorps secondaire, Alexa Fluor 647 (0,5 à 2 µg/mL) dans le PBST-B-G.
NOTE : Alexa Fluor 647 est facultative.
- Anticorps primaires (concentration de travail) : préparer 1,2 mL de mélange de l’anticorps primaire en diluant anticorps monoclonal de souris de Pax7 (IgG1) (1 à 5 µg/mL) + anticorps polyclonaux de lapin laminine (0,5 à 2 µg/mL) + anticorps monoclonal de souris de MF20 (IgG2b) (0,5 à 2,5 µg / mL) PBST-B-g.
5. immunofluorescence souillant étapes
-
Réhydrater et fixer les cryo-sections avec IFP.
- Supprimer quelques-uns des diapositives TA/EDL cryo-section de la zone de diapositive. Réchauffer les diapositives dans un plateau porte-diapositive à température ambiante.
- Utiliser un stylo liquide bloqueur (stylo PAP) pour dessiner une zone qui comprend toutes les sections de cryo de la diapositive. Ce cercle empêchera les solutions de s’écouler hors de la diapositive.
- Prendre le bac pour une hotte de laboratoire. Ajouter 300-500 µL de 4 % PFA sur la diapositive dans la zone encerclée de fixer les sections à température ambiante pendant 10 min. lavent par la PFA avec du PBS 1 x au moins 3 x 5 min dans un conteneur de la diapositive.
ATTENTION : PFA est toxique et un déchet dangereux ; il doit être géré avec soin et éliminé dans un conteneur de déchets dangereux.
-
Recherche d’antigène
- Remplir un autre conteneur de la diapositive avec 200 mL de tampon citrate.
- Transférer les lames dans le conteneur. Transférer le conteneur avec les diapositives dans un autocuiseur, faire cuire les diapositives en mode haute pression pendant 10 min.
- Refroidir le récipient avec drainage de l’eau pendant 10 min. transfert toutes les diapositives vers un nouveau conteneur avec PBST (200 mL), rincer les lames avec PBST pendant au moins 3 x 5 min.
-
Blocage
- Ajouter kimwipes imbibées d’eau dans le plateau de tenir les diapositives pour créer un milieu humide pour éviter le séchage des lames.
- Déplacer les diapositives vers le plateau et ajouter 200 µL de solution sur chaque diapositive de blocage. Recouvrir le plateau avec un bouchon et laisser le blocage se développer pendant 30 min.
NOTE : Pax7 anticorps est un anticorps monoclonal de souris, donc il y a liaison non-spécifique de souris IgG dans les tissus musculaires de souris qui crée de fond élevé. À l’aide de la AffiniPure Fab Fragment Goat anti-mouse IgG (H + L) bloque la liaison non-spécifique sur-souris.
-
Appliquer les anticorps primaires.
- Rincer les lames avec PBST une fois dans le conteneur de la diapositive. Puis replacez les diapositives dans le plateau de coloration.
- 200 µL du mélange de l’anticorps primaire sur chaque diapositive, recouvrir le plateau avec un couvercle et laissez la réaction développer à température ambiante pendant 1 h ou à 4 ° C pour la nuit.
Remarque : La réaction pendant la nuit à 4 ° C donne le meilleur résultat, bien que le développement de la réaction à la température ambiante donne des résultats satisfaisants. L’anticorps MF20 de myosine peuvent être ajoutés dans le mélange pour effectuer un marquage de triple (Pax7, laminine, MF20). MF20 taches différencient des fibres musculaires. Cette étape sert également une autre étape de blocage avec PBST-B-G pour réduire le potentiel liaison non-spécifique d’Anticorps secondaires (anticorps de chèvre) dans l’étape suivante.
-
Appliquer des anticorps secondaires.
- Laver à l’anticorps primaires avec PBST à température ambiante au moins 3 x 5 min.
- Ajouter 200 µL du mélange de l’anticorps secondaire à chaque diapositive et laisser la réaction de développer à température ambiante pendant au moins 1 h.
Remarque : Pour Pax7 + laminine, utilisez Goat anti-Mouse IgG1 Alexa 488 et chèvre anti-lapin Alexa 555.
Pour Pax7 + laminine + MF20, ajouter le chèvre anti-souris IgG2b 647 Alexa dans le mélange. - Laver à l’anticorps secondaires avec PBST au moins 3 x 5min.
-
Montage et tache contre le DAPI (4', 6-diamidino-2-phénylindole)
- Diluer PBST dans le conteneur de diapositive, par exemple, 10 µL de DAPI dans 200 mL de PBST DAPI (01:20, 000).
- Tacher les diapositives dans le conteneur DAPI pendant 3 min.
- Lavez le DAPI avec PBST pendant au moins 5 x 5 min.
- Monter les lames avec milieu de montage. Couvrir les lames avec des lamelles couvre-objet.
ATTENTION : Le DAPI est toxique et dangereux ; il doit être manipulé avec soin et éliminé dans la bouteille de déchets dangereux.
6. fluorescence Microscopy
Remarque : Le protocole de coloration par immunofluorescence présenté ci-dessus permettra à SCs visualisation avec un microscope à champ large fluorescent ou confocal. Il peut être initialement difficile d’identifier les SCs. Voici quelques étapes recommandées qui peuvent être utiles.
- Utiliser le canal DAPI et objectifs grossissement faible pour visualiser les sections sur les diapositives.
- Changer le grossissement de faible à élevé. Pour observer la SCs, au moins un objectif 20 X est nécessaire).
- Utilisez le cube double filtre pour 488 (FITC) / 555 (Rhodamine) d’observer les Pax7 et laminine signale en même temps d’identifier les SCs. En vertu de cet arrangement, le signal de coloration Pax7 a un meilleur contraste avec le bruit de fond.
- Rapidement, remplaçant le canal de FITC à DAPI d’identifier correctement les SCs. Tous SCs devraient être Pax7/DAPI-positif.
Résultats
Suivant les étapes ci-dessus, SCs peuvent être visualisées avec succès dans les sections de muscle au repos adultes sous un microscope à fluorescence (Figure 1). Bien que les tissus musculaires adultes a auto-fluorescence forte dans certain type de fibres, les colorants de série Alexa lumineux peuvent surmonter le bruit de fond et le signal se distingue (Figure 1 a, B; têtes de flèche). La microscopie confocale biphotonique restitue une image relativement plus propre (Figure 1 b) que le microscope à fluorescence à champ large (Figure 1 a). Aussi, le même protocole a bien fonctionné sur les tissus musculaires des souris juvéniles (Figure 2 a), des embryons de souris (Figure 2 b) et blessé des tissus de muscle adulte (Figure 3). Dans les tissus musculaires de juvéniles et embryonnaire, il n’y a plus de SCs activés (Figure 2 a, flèches) ou Pax7 séropositifs myogènes précurseurs (Figure 2 b, flèches) qui ont des noyaux relativement plus importantes ; par conséquent, il est relativement facile à visualiser SCs de jeunes souris que de souris adultes (Figure 2 et Figure 1). Dans le tissu de muscle lésé, il y a aussi plus activé Pax7 séropositifs SCs (Figure 3).

Figure 1 : Images de Pax7 et laminine immunofluorescence sur des souris adulte au repos des tissus musculaires. TA/EDL muscle sections de souris adultes ont été immunomarquées avec des anticorps de la laminine (rouge) et Pax7 (vert) et Counter-colorées au DAPI (bleu). (A) Image capturée sous un microscope à fluorescence grand champ. (B) Image capturée sous un microscope confocal. Barreaux de l’échelle : 50 µm. flèches : SCs de fibres avec faible autofluorescence. Pointes de flèche : SCs de fibres à haute autofluorescence. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : Images d’immunofluorescence Pax7 et laminine ou MF20 sur les tissus musculaires des souris jeunes. TA/EDL muscle sections de jeunes souris ont été immunomarquées avec le Pax7 (vert) et laminine (rouge) ou MF20 (magenta) et Counter-colorées au DAPI (bleu). (A) jour après la naissance 8 section de muscle (P8) rattaché à un microscope confocal. (B) jour embryonnaire 17,5 (E17.5) section de muscle rattaché à un microscope à fluorescence grand champ. Barreaux de l’échelle = 50 µm. flèches : SCs dans la section du muscle P8 (A) ; représentant Pax7 + précurseurs myogéniques dans E17.5 section musculaire, alors qu’il n’y a plus dans l’image (B). Ces deux images ont été modifiés à partir des données brutes qui a aussi généré des images dans un document publié13 (sFigure 3D) et (sFigure 1 b), respectivement. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
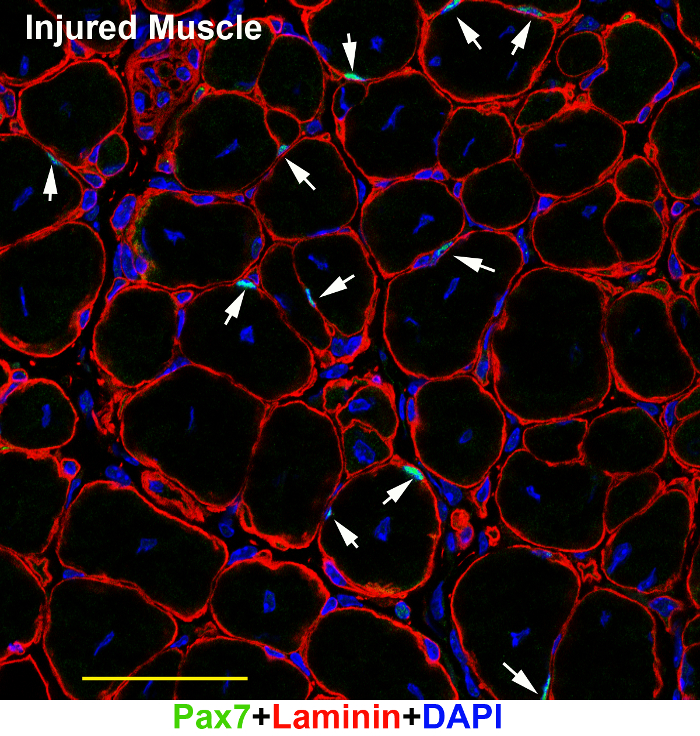
Figure 3 : une image représentative de Pax7 et laminine immunofluorescence sur les tissus musculaires adultes blessés. TA/EDL muscle sections d’un tissus de muscle adulte blessé (7 jours après la lésion) ont été immunomarquées avec des anticorps de la laminine (rouge) et Pax7 (vert) et Counter-colorées au DAPI (bleu). L’image a été prise sous un microscope confocal. Echelle = 50 µm. flèches : SCs dans la section. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Le protocole ci-dessus était fondé sur une méthode de coloration de Pax7/MF20 le poisson-zèbre muscle squelettique12. Les solutions utilisées et en bloquant les étapes sont identiques ou similaires. Les anticorps utilisés sont identiques. Les mesures rajustés reposaient sur les caractéristiques des tissus musculaires de souris et de SCs. Tout d’abord, laminine anticorps a été ajouté dans le mélange afin de visualiser et de confirmer la position de la SCs. Il a été particulièrement utile compter le nombre de SCs au microscope lorsque vous utilisez le cube double filtre de 488/555 ; Cela a grandement amélioré le signal Pax7 SC-dérivé de se démarquer de l’arrière-plan auto-fluorescente bruyant. Deuxièmement, étant donné que l’anticorps Pax7 utilisé est un anticorps de souris, nous avons ajouté une étape de blocage sur-souris (étape 5.3) afin de réduire le fond résultant de la liaison non-spécifique de la souris IgG. Troisièmement, l’étape de récupération de l’antigène (étape 5.2) a critiqué pour la coloration avec anticorps Pax7 sur PFA tissu fixé.
Le même protocole a été utilisé sur les tissus musculaires des souris plus jeunes (les chiots et les embryons) (Figure 2). En fait, il était relativement facile à visualiser SCs chez les petits que chez les souris adultes par le même protocole. Il pourrait être utile de commencer par une coloration SCs sur petits à acquérir de l’expérience avant de procéder à des tissus musculaires adultes. Un contrôle négatif sans anticorps primaires (étape 5.4) est également nécessaire dans chaque expérience. Un protocole similaire a été utilisé avec succès sur des sections de paraffine avec paraffine supplémentaire étapes de traitement. Toutefois, les sections de paraffine ont tendance à avoir un fond d’autofluorescence supérieur, masquer les signaux des SCs qui ont relativement plus faible expression Pax7. Si possible, évitez d’utiliser des sections de paraffine. Le même protocole travaillait aussi sur des tissus de muscle lésé qui ont de nombreux SCs et a donné des résultats similaires à ceux obtenus avec le tissu musculaire du pup (Figure 3).
Autofluorescence tissu musculaire représente l’obstacle majeur dans l’obtention d’immunofluorescence propres résultats14. Réduire le temps de séchage de cryo-sections peut diminuer autofluorescence et à l’aide de cryo-sections fraîchement préparés est fortement recommandée. Comme pour les autres protocoles15, l’étape de blocage sur-souris est nécessaire afin de réduire davantage le fond.
Microscope à fluorescence grand champ tant de microscope confocal étaient efficaces pour la visualisation de la SCs par morceaux d’oeil, l’utilisation du microscope confocal est recommandée pour capturer des images de haute qualité.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions la Section NIAMS lumière Imaging pour fournir les microscopes et les aides techniques. Les anticorps MF20 et Pax7 ont obtenu de la Banque de hybridome études développement développé sous les auspices de la NICHD et maintenu par le Department of Biological Sciences, The University of Iowa, Iowa City. Ce travail a été soutenu par le programme de recherche intra-muros de NIAMS de la National Institutes of Health.
matériels
| Name | Company | Catalog Number | Comments |
| methylbutane | Sigma-Aldrich | M32631 | |
| Optimal Cutting Temperature (O.C.T.) compound | Electron Microscopy Sciences | 62550-01 | |
| 10x PBS | Gibco, Themo Fisher | 70011-044 | |
| 16% PFA | TED PELLA | 50-00-0 | |
| Triton-100 | Sigma-Aldrich | T8787 | |
| Normal Goat Serum | Thermo Fisher | 0 1-6201 | |
| AffiniPure Fab Fragment Goat Anti-Mouse IgG (H+L) | Jackson ImmunoResearch Laboratories Inc. | 115-007-003 | |
| 20x Citrate Buffer | Thermo Fisher | 00 500 | |
| Pax7 mono-clonal mouse antibody (IgG1) (supernatant) | Developmental Study Hybridoma Bank | N/A | |
| Laminin polyclonal rabbit antibody | Sigma-Aldrich | L9393 | |
| MF20 mono-clonal mouse antibody (IgG2b) (supernatant) | Developmental Study Hybridoma Bank | N/A | |
| Goat anti-Mouse IgG1 cross-absorbed secondary antibody, Alexa Fluor 488 | Thermo Fisher | A-21121 | |
| Goat anti-Mouse IgG2b cross-absorbed secondary antibody, Alexa Fluor 647 | Thermo Fisher | A-21242 | |
| Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 555 | Thermo Fisher | A32732 | |
| Leica CM1860 cryostat | |||
| Leica DM6000 wide-field fluorescent microscope | |||
| Leica DMR wide-field fluorescent microscope | |||
| Zeiss LSM510 confocal microscope | |||
| Zeiss LSM780 confocal microscope | |||
| Cuisinart electronic pressure cooker |
Références
- Buckingham, M. Gene regulatory networks and cell lineages that underlie the formation of skeletal muscle. Proc Natl Acad Sci U S A. 114 (23), 5830-5837 (2017).
- Buckingham, M., Relaix, F. PAX3 and PAX7 as upstream regulators of myogenesis. Semin Cell Dev Biol. 44, 115-125 (2015).
- Relaix, F., Buckingham, M. From insect eye to vertebrate muscle: redeployment of a regulatory network. Genes Dev. 13 (24), 3171-3178 (1999).
- Chang, N. C., Chevalier, F. P., Rudnicki, M. A. Satellite Cells in Muscular Dystrophy - Lost in Polarity. Trends Mol Med. 22 (6), 479-496 (2016).
- Mauro, A. Satellite cell of skeletal muscle fibers. J Biophys Biochem Cytol. 9, 493-495 (1961).
- Kuang, S., Rudnicki, M. A. The emerging biology of satellite cells and their therapeutic potential. Trends Mol Med. 14 (2), 82-91 (2008).
- Wang, Y. X., Rudnicki, M. A. Satellite cells, the engines of muscle repair. Nat Rev Mol Cell Biol. 13 (2), 127-133 (2011).
- Rinaldi, F., Perlingeiro, R. C. Stem cells for skeletal muscle regeneration: therapeutic potential and roadblocks. Transl Res. 163 (4), 409-417 (2014).
- Le Grand, F., Rudnicki, M. A. Skeletal muscle satellite cells and adult myogenesis. Curr Opin Cell Biol. 19 (6), 628-633 (2007).
- Giordani, L., Puri, P. L. Epigenetic control of skeletal muscle regeneration: Integrating genetic determinants and environmental changes. FEBS J. 280 (17), 4014-4025 (2013).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nat Protoc. 10 (10), 1612-1624 (2015).
- Feng, X., Adiarte, E. G., Devoto, S. H. Hedgehog acts directly on the zebrafish dermomyotome to promote myogenic differentiation. Dev Biol. 300 (2), 736-746 (2006).
- Juan, A. H., et al. Polycomb EZH2 controls self-renewal and safeguards the transcriptional identity of skeletal muscle stem cells. Genes Dev. 25 (8), 789-794 (2011).
- Jackson, K. A., Snyder, D. S., Goodell, M. A. Skeletal muscle fiber-specific green autofluorescence: potential for stem cell engraftment artifacts. Stem Cells. 22 (2), 180-187 (2004).
- Lepper, C., Conway, S. J., Fan, C. M. Adult satellite cells and embryonic muscle progenitors have distinct genetic requirements. Nature. 460 (7255), 627-631 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon