Method Article
Identificazione delle cellule satelliti del muscolo scheletrico dall'immunofluorescenza con Pax7 e Laminin anticorpi
In questo articolo
Riepilogo
La precisa identificazione delle cellule satelliti è essenziale per lo studio delle loro funzioni in varie condizioni fisiologiche e patologiche. Questo articolo presenta un protocollo per identificare cellule satelliti su sezioni del muscolo scheletrico adulto tramite basati su immunofluorescenza colorazione.
Abstract
L'immunofluorescenza è un metodo efficace che aiuta a identificare i diversi tipi di cellule su sezioni di tessuto. Al fine di studiare la popolazione di cella desiderata, anticorpi per gli indicatori delle cellule specifiche vengono applicati su sezioni di tessuto. Nel muscolo scheletrico adulto, le cellule satellite (SC) sono cellule staminali che contribuiscono alla rigenerazione e riparazione del muscolo. Pertanto, è importante visualizzare e tracciare la popolazione delle cellule satelliti in diverse condizioni fisiologiche. Nel muscolo scheletrico di riposo, SCs risiedono tra la lamina basale e la membrana plasmatica miofibre. Un indicatore comunemente usato per l'identificazione SCs i myofibers o nella coltura delle cellule è la proteina accoppiati casella Pax7. In questo articolo, è presentato un protocollo ottimizzato di Pax7 immunofluorescenza su sezioni del muscolo scheletrico che minimizza la colorazione aspecifica e sfondo. Un altro anticorpo che riconosce una proteina (laminina) della lamina basale è stato anche aggiunto per identificare i protocolli SCs. simile può essere utilizzato anche per eseguire doppio o triplo etichettatura con Pax7 e anticorpi per ulteriori proteine di interesse.
Introduzione
Muscolo scheletrico è composto di cellule multinucleate muscolo, chiamato miotubi, organizzato nelle miofibre, che generano la forza e i movimenti attraverso la contrazione. Più i muscoli scheletrici, ad eccezione di alcuni muscoli cranio-facciali, sono derivati da una struttura embrionale temporanea denominata un somite1. Le cellule del precursore miogenico delaminare dal somite epiteliali diventare mioblasti. Mioblasti ulteriormente differenziano in miociti che si fondono per diventare miotubi per formare multi-nucleate miofibre. Il processo di cui sopra è chiamato miogenesi ed è caratterizzato da temporaneamente-ha regolato il controllo dell'espressione genica. Precursori myogenic esprimono Pax3 e Pax7, mentre mioblasti esprimono MyoD e/o Myf5 e miociti express miogenina e miosine2,3. Crescita muscolare è un processo in cui myofibers diventano più grandi, incorporando più mionuclei in fibre esistenti (iperplasia) e da un aumento della fibra di muscolo dimensioni (ipertrofia)4. Durante la crescita muscolare, c'è una fonte sostenibile di cellule miogeniche che hanno proprietà di cellule staminali che possono differenziare e auto-rinnovarsi. Queste cellule sono chiamate cellule satelliti in base alla loro posizione fisica tra il sarcolemma (membrana cellulare delle miofibre) e la lamina basale5. SCs, vigorosamente, contribuire alla crescita muscolare nella fase giovanile (i prime 2-3 settimane di topi postnatali), ma diventano quiescenti nel muscolo adulto6di riposo. Notevolmente, possono essere ri-attivati in risposta al muscolo ferisce e differenziarsi in nuove cellule muscolari per la riparazione del muscolo danneggiato7.
Le proprietà delle cellule staminali rendono lo studio della SCs pertinenti per terapie di muscolo malattie8e biologia di base muscolare. Di conseguenza, è stato un'area di intensa ricerca negli ultimi decenni. Un tremendo progressi nella dissezione genetica e l'epigenetica di SCs9,10. Tecniche di isolamento e identificazione di SCs in situ sono stati sviluppati e ottimizzati lungo la strada11. Macchiatura immunofluorescente permette l'identificazione di SCs attraverso l'uso di anticorpi specifici, compreso quello per Pax7. Tuttavia, la scarsità e la piccola dimensione di SCs combinato con una forte auto-fluorescenza del tessuto muscolo scheletrico adulto rendering la visualizzazione impegnativo. Qui, descriviamo un protocollo di macchiatura immunofluorescente ottimizzato per il tessuto muscolare del mouse per Pax7 e basato su un metodo esistente per zebrafish muscolo12. Inoltre, un Laminin anticorpo marcato con un fluoroforo distinto è impiegato per identificare la lamina basale in cui si trovano la SCs. Questo protocollo permette costantemente la visualizzazione di SCs Pax7-positivo e precursori myogenic sotto condizioni fisiologiche tutti testate e stadi di sviluppo.
Protocollo
In questo protocollo, i muscoli dell'arto anteriore di topi adulti (2-6 mesi), tibiale anteriore (TA) e longus di digitorum dell'estensore (EDL), sono stati impiegati ad esempio per eseguire l'immunofluorescenza che macchia il loro SCs. Tutte le fasi di movimentazione topi e muscolo dissezioni di tessuto sono state approvate dalla cura degli animali e uso Comitato (ACUC) di NIAMS/NIH.
1. sezionare il muscolo TA/EDL dal Mouse dell'arto
- Eutanasia il mouse in una camera di eutanasia riempito CO2 nell'ambito degli orientamenti di ACUC del NIH. Eseguire, dislocazione cervicale se necessario.
- Mettere il mouse a faccia in su un pad di dissezione (supina). Spruzzare etanolo al 70% sulla sua pelle del ventre. Tagliare un 1-2 cm apertura orizzontalmente al centro della pelle del ventre del mouse, quindi deskin il mouse tirando l'apertura verso i piedi del mouse. Esporre un lato dell'arto posteriore del mouse.
- Utilizzare due pinze taglienti: utilizzare uno per tenere i tendini che si attaccano il TA/EDL alla caviglia e l'altra per rompere e la fascia che copre il TA/EDL di taglio. Una volta che la fascia è pelata, è possibile utilizzare la punta tagliente delle pinze per staccare il TA/EDL dall'osso tibia eseguendo la punta sotto il muscolo TA/EDL.
- Tagliare i tendini della caviglia con le forbici, tenendo comunque con le pinze. Tagliare il muscolo con le forbici lungo la linea longitudinale di TA/EDL dalla caviglia al ginocchio mentre si solleva il TA/EDL dal lato della caviglia con il forcipe. Tagliare i tendini del ginocchio-lato per staccare l'intero TA/EDL dalla tibia.
2. Cryo-incorporamento del muscolo TA/EDL
- Preparare un bagno di azoto liquido in un contenitore, ad es., un pallone Dewar di azoto liquido. Versare metilbutano in un piccolo bicchiere in plastica (circa 20 mL) a mezzo pieno. Poi mettere il bicchiere nel bagno di azoto liquido per congelare. Dopo pochi minuti, controllare che il metilbutano è congelata.
Nota: L'azoto liquido può essere sostituito da un secchio di ghiaccio secco, ma la data di congelamento è più lenta. - Posare il TA/EDL dissecata sulla superficie piana di un piccolo stantuffo in plastica. Coprire completamente il TA/EDL con poche gocce di ottimale taglio temperatura (t.o.c.) composto (il mezzo di congelamento).
- Prendere il becher metilbutano fuori dal bagno di azoto liquido e scongelare la superficie con un oggetto caldo (ad es., il manico delle forbici). Tuffo il t.o.c. coperta velocemente TA/EDL sullo stantuffo nel fuso metilbutano a snap-congelare il tessuto.
- Staccare il tessuto incorporato dallo stantuffo con il forcipe e metterlo in una provetta da microcentrifuga da 1,5 mL. Posto il tubo nell'azoto liquido per conservarla durante la gestione di più campioni.
Nota: Il tessuto incorporato possa essere memorizzato a-80 ° C per il lungo termine (2 anni) o a-20 ° C per breve termine (6 mesi).
3. criostato di sezionamento
- Aggiungere una goccia di composto al centro di un titolare di esemplare di un criostato o.c.t.. Attendere fino a quando il composto di t.o.c. è quasi solidificato. Attaccare rapidamente la TA/EDL incorporate al composto o.c.t., perpendicolarmente al lato della caviglia verso il basso e il lato ginocchio fino.
- Montare il supporto dell'esemplare su un criostato, tagliare il tessuto a intervalli di 10 µm e raccogliere il cryo-sezioni sulle diapositive di gelo rivestito con circa 4-8 sezioni su una diapositiva.
- Asciugare le sezioni a temperatura ambiente per almeno 3 ore a tutta la notte.
Nota: Anche se le sezioni nel congelatore per una notte o più a lungo di asciugatura è accettabile, inevitabilmente aumenterà l'autofluorescenza. Per risultati ottimali, secca le sezioni per 0,5 h, quindi procedere con la fissazione e la colorazione passi immediatamente. - Raccogliere le diapositive in una casella di scorrimento e utilizzare immediatamente o archiviare le diapositive a-80 ° C o -20 ° C per un uso successivo.
4. preparazione dei reagenti per colorazione di immunofluorescenza
-
Preparare il buffer:
- Preparare 2 L di tampone fosfato salino (PBS): 1x da 10X PBS.
- Preparare 40 mL di paraformaldeide al 4% (PFA) in PBS 1X dal 16% PFA.
- Preparare 2 L di PBST: 1x PBS con 0,1% Triton-100.
- Preparare 50 mL di PBST PBST-b: con 2% albumina di siero bovino (BSA).
- Preparare 10 mL di PBST PBST-B-g: con 2% di BSA e 5% di siero di capra normale.
- Preparare 1 mL di soluzione di blocco. Diluire AffiniPure Fab frammento Goat Anti-Mouse IgG (H + L) (01:10) in PBST-B.
- Preparare 200 mL di tampone citrato 1x.
Nota: I volumi delle soluzioni di cui sopra sono sufficienti per almeno 5 scivoli. Volumi dovrebbero essere regolate secondo il numero di diapositive e la dimensione dei contenitori diapositiva.
-
Preparare colorazioni di anticorpo:
- Gli anticorpi primari (concentrazione di lavoro): preparare 1,2 mL di anticorpo primario mix diluendo Pax7 anticorpo monoclonale murino (IgG1) (1-5 µ g/mL) + anticorpo policlonale del coniglio laminina (0,5-2 µ g/mL) + MF20 anticorpo monoclonale murino (IgG2b) (0,5-2,5 µ g / mL) in PBST-B-G.
Nota: MF20 anticorpo monoclonale murino (IgG2b) è facoltativo. - Anticorpi secondari (concentrazione di lavoro): preparare 1,2 mL di anticorpo secondario mix diluendo anticorpo di capra anti-topo IgG1 Croce-adsorbito secondaria, Alexa Fluor 488 (0,5-2 µ g/mL) + anticorpo di capra anti-coniglio IgG (H + L) altamente cross-adsorbito secondario, Alexa Fluor Plus 555 (0,5-2 µ g/mL) + anticorpo di capra anti-topo IgG2b Croce-adsorbito secondaria, Alexa Fluor 647 (0,5-2 µ g/mL) in PBST-B-G.
Nota: Alexa Fluor 647 è facoltativo.
- Gli anticorpi primari (concentrazione di lavoro): preparare 1,2 mL di anticorpo primario mix diluendo Pax7 anticorpo monoclonale murino (IgG1) (1-5 µ g/mL) + anticorpo policlonale del coniglio laminina (0,5-2 µ g/mL) + MF20 anticorpo monoclonale murino (IgG2b) (0,5-2,5 µ g / mL) in PBST-B-G.
5. immunofluorescenza colorazione passaggi
-
Reidratare e fissare le cryo-sezioni con PFA.
- Rimuovere alcuni delle diapositive di cryo-sezione TA/EDL dalla casella di scorrimento. Caldo le diapositive in un cassetto scorrevole-tenuta a temperatura ambiente.
- Utilizzare una liquido bloccante penna (PAP) per disegnare un'area che comprende tutte le sezioni di cryo sulla diapositiva. Questo cerchio impedirà le soluzioni che scorre fuori della diapositiva.
- Prendere il vassoio per una cappa di laboratorio. 300-500 µ l di 4% PFA sulla diapositiva all'interno dell'area cerchiata a fissare le sezioni a temperatura ambiente per 10 min. di Wash out il PFA con PBS 1X almeno 3 x 5 min in un contenitore scorrevole.
Attenzione: PFA è tossica e rifiuti pericolosi; dovrebbe essere gestito con cura e disposto in un contenitore di rifiuti pericolosi.
-
Ricupero dell'antigene
- Riempire un altro contenitore di diapositiva con 200 mL di tampone citrato.
- Trasferire i vetrini in contenitore. Trasferire il contenitore con le diapositive in una pentola a pressione per cucinare le diapositive in modalità ad alta pressione per 10 min.
- Raffreddare il contenitore con lo scarico dell'acqua per 10 min trasferimento tutte le diapositive in un nuovo contenitore con PBST (200 mL), sciacquare i vetrini con PBST per almeno 3 x 5 min.
-
Blocco
- Aggiungere kimwipes impregnati d'acqua nel vassoio che tiene le diapositive per creare un ambiente umido per evitare l'essiccazione delle diapositive.
- Spostare le diapositive indietro al vassoio e aggiungere 200 µ l di soluzione in ogni diapositiva di blocco. Coprire il vassoio con un tappo e lasciare il blocco sviluppare per 30 min.
Nota: Pax7 anticorpo è un anticorpo monoclonale di topo, quindi non c'è legame aspecifici di IgG di topo in tessuti muscolari del mouse che crea un'elevato background. Utilizzando la capra di frammento Fab AffiniPure anti-Mouse IgG (H + L) blocca il legame aspecifiche del mouse il mouse.
-
Applicare gli anticorpi primari.
- Sciacquare i vetrini con PBST una volta nel contenitore scorrevole. Quindi spostare le diapositive nuovamente il vassoio di colorazione.
- Applicare 200 µ l di anticorpo primario mix su ogni diapositiva, coprire il vassoio con un tappo e lasciare che la reazione di sviluppare a temperatura ambiente per 1 h o a 4 ° C per una notte.
Nota: La reazione durante la notte a 4 ° C dà i risultati migliori, anche se in via di sviluppo la reazione a temperatura ambiente dà risultati soddisfacenti. L'anticorpo di MF20 miosina può essere aggiunto nel mix di eseguire un triplo (Pax7, laminina, MF20) etichettatura. MF20 macchie differenziano fibre muscolari. Questo passaggio serve anche come un ulteriore passo di blocco con PBST-B-G per ridurre il potenziale associazione aspecifici da anticorpi secondari (anticorpi di capra) nel passaggio seguente.
-
Applicare gli anticorpi secondari.
- Lavare gli anticorpi primari con PBST a temperatura ambiente almeno 3 x 5 min.
- Aggiungere 200 µ l di anticorpo secondario mix per ogni diapositiva e lasciare che la reazione sviluppare a temperatura ambiente per almeno 1 h.
Nota: Per Pax7 + Laminin, utilizzare capra anti-topo IgG1 Alexa 488 e Goat Anti-Rabbit Alexa 555.
Per Pax7 + Laminin + MF20, aggiungere Goat Anti-Mouse IgG2b Alexa 647 nel mix. - Lavare gli anticorpi secondari con PBST almeno 3 x 5min.
-
Montaggio e Counter-macchia DAPI (4', 6-diamidino-2-phenylindole)
- Diluire DAPI (01:20, 000) in PBST nel contenitore della diapositiva, ad esempio, 10 µ l di DAPI in 200 mL di PBST.
- Colorare i vetrini nel contenitore DAPI per 3 min.
- Lavare il DAPI con PBST per almeno 5 x 5 min.
- Montare i vetrini con mezzo di montaggio. Coprire i vetrini con vetrini coprioggetti.
Attenzione: DAPI è tossica e pericolosa; deve essere maneggiato con cura e smaltito in bottiglia rifiuti pericolosi.
6. fluorescente microscopia
Nota: Il protocollo di macchiatura immunofluorescente riportato sopra consentirà SCs visualizzazione con un microscopio grandangolari fluorescente o confocale. Può essere inizialmente difficile identificare SCs. Qui ci sono alcuni passaggi consigliati che possono essere di aiuto.
- Utilizzare il canale di DAPI e gli obiettivi a basso ingrandimento per visualizzare le sezioni sulle diapositive.
- Passare l'ingrandimento da bassa a alta. Per osservare SCs, almeno un obiettivo X 20 è richiesto).
- Utilizzare il cubo doppio filtro per 488 (FITC) / 555 (rodamina) per osservare sia Pax7 e Laminin segnali allo stesso tempo per identificare SCs. Con questa impostazione, il segnale di macchiatura Pax7 ha un migliore contrasto con il rumore di fondo.
- Rapidamente si alternano il canale da FITC DAPI per identificare correttamente SCs. SCs tutti dovrebbe essere Pax7/DAPI-positivo.
Risultati
Seguendo i passi sopra, SCs possono essere visualizzati correttamente in adulto sezioni muscolari che riposa sotto un microscopio a fluorescenza (Figura 1). Anche se il tessuto di muscolo adulto ha una forte auto-fluorescenza in certo tipo di fibre, i coloranti di serie di Alexa luminosi in grado di superare il rumore di fondo e il segnale si distingue (Figura 1A, B; teste di freccia). La microscopia confocale del due-fotone cattura un'immagine relativamente più pulita (Figura 1B) rispetto al microscopio a fluorescenza grandangolari (Figura 1A). Lo stesso protocollo anche lavorato bene su tessuti muscolari di topi giovani (Figura 2A), embrioni del mouse (Figura 2B) e feriti tessuti muscolo adulto (Figura 3). In tessuti muscolari giovanile ed embrionale, ci sono più attivato SCs (Figura 2A, frecce) o Pax7-positivi precursori myogenic (Figura 2B, frecce) che hanno nuclei relativamente più grandi; Pertanto, è relativamente più facile da visualizzare SCs di topi più giovani che di topi adulti (Figura 2 contro 1 nella figura). Nel tessuto del muscolo leso, ci sono anche più attivato SCs Pax7-positivi (Figura 3).

Figura 1: immagini dell'immunofluorescenza Pax7 e Laminin mouse adulto tessuti muscolari a riposo. Sezioni del muscolo TA/EDL di topi adulti immunostained con Pax7 (verde) e gli anticorpi laminina (rosso) e Counter-macchiato con DAPI (blu). (A) immagine catturata sotto un microscopio a fluorescenza grandangolari. (B) immagine catturata al microscopio confocale. Scala bar: 50 µm. frecce: SCs da fibre con autofluorescenza basso. Punte di freccia: SCs da fibre con alta autofluorescenza. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: immagini di Pax7 e laminina o MF20 immunofluorescenza su tessuti muscolari di giovani topi. TA/EDL muscolo sezioni dei più giovani topi immunostained con Pax7 (verde) e laminina (rosso) o anticorpi MF20 (magenta) e Counter-macchiato con DAPI (blu). (A) giorno postnatale 8 sezione di muscolo (P8) catturato sotto un microscopio confocale. (B) giorno embrionale 17,5 (E17.5) sezione di muscolo catturato sotto un microscopio a fluorescenza grandangolari. Scala bar = 50 µm. frecce: SCs nella sezione di muscolo P8 (A); rappresentante Pax7 + myogenic precursori in E17.5 sezione del muscolo, mentre ci sono più nell'immagine (B). Queste due immagini sono state modificate dai dati grezzi che hanno immagini generate in una carta pubblicata13 (sFigura 3D) e (sFigura 1B), rispettivamente. Clicca qui per visualizzare una versione più grande di questa figura.
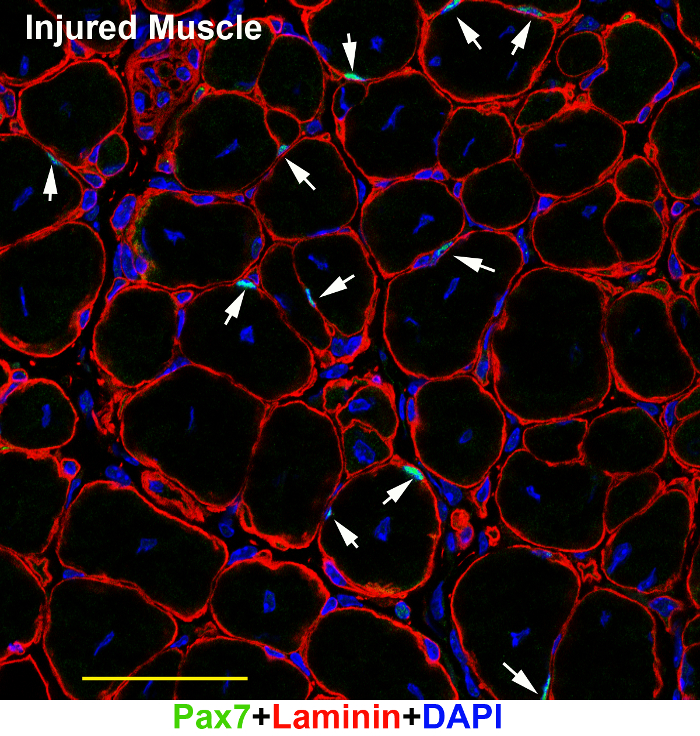
Figura 3: un'immagine rappresentativa dell'immunofluorescenza Pax7 e Laminin sui tessuti del muscolo adulto leso. TA/EDL muscolo sezioni dei tessuti muscolo adulto leso (7 giorni dopo la lesione) immunostained con Pax7 (verde) e gli anticorpi laminina (rosso) e Counter-macchiato con DAPI (blu). L'immagine è stata scattata sotto un microscopio confocale. Barra della scala = 50 µm. frecce: SCs nella sezione. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Il protocollo di cui sopra è stato basato su un metodo di macchiatura Pax7/MF20 su zebrafish muscolo scheletrico12. Le soluzioni utilizzate e bloccando i passaggi sono identici o simili. Gli anticorpi utilizzati sono identici. I passaggi regolati erano basati sulle caratteristiche del tessuto muscolare del mouse e SCs. In primo luogo, laminina anticorpo è stato aggiunto nel mix per aiutare a visualizzare e confermare la posizione di SCs. E ' stato particolarmente utile contare il numero di SCs al microscopio quando si utilizza il cubo doppio filtro di 488/555; Questo notevolmente migliorato il segnale Pax7 SC-derivato di distinguersi dallo sfondo autofluorescent rumoroso. In secondo luogo, poiché l'anticorpo Pax7 utilizzato è un anticorpo murino, abbiamo aggiunto un passaggio di blocco del mouse il mouse (punto 5.3) per ridurre lo sfondo derivando da un'associazione non specifica del mouse IgG. In terzo luogo, il passo di ricupero dell'antigene (punto 5.2) è stato fondamentale per la macchiatura con l'anticorpo Pax7 su PFA tessuti fissata.
Lo stesso protocollo è stato utilizzato su tessuti muscolari di topi più giovani (pups ed embrioni) (Figura 2). In realtà, era relativamente più semplice la visualizzazione SCs nei cuccioli rispetto a topi adulti dal protocollo stesso. Potrebbe essere utile iniziare con la macchiatura SCs su cuccioli per fare esperienza prima di procedere con il tessuto di muscolo adulto. Controllo negativo senza anticorpi primari (punto 5.4) è anche necessario in ogni esperimento. Un protocollo simile è stato usato con successo sulle sezioni della paraffina con paraffina supplementare passaggi di elaborazione. Tuttavia, le sezioni di paraffina tendono ad avere uno sfondo di autofluorescenza superiore, che mascherato segnali da SCs che sono espressione di Pax7 relativamente più debole. Se possibile, evitare l'uso di sezioni della paraffina. Lo stesso protocollo è stato impiegato anche sui tessuti muscolo leso che hanno numerosi SCs e ha dato risultati simili a quelli ottenuti con tessuto muscolare del cucciolo (Figura 3).
Autofluorescenza del tessuto muscolare rappresenta il principale ostacolo nell'ottenere pulito immunofluorescenza risultati14. Riducendo il tempo di asciugatura di cryo-sezioni può diminuire autofluorescenza e utilizzando preparati cryo-sezioni è altamente raccomandato. Simile ad altri protocolli15, il passo di blocco del mouse il mouse è necessaria per ridurre ulteriormente lo sfondo.
Mentre sia largo campo microscopio fluorescente e microscopio confocale erano efficaci per la visualizzazione di SCs attraverso parti dell'occhio, è consigliato l'uso del microscopio confocale per catturare immagini di alta qualità.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Ringraziamo la sezione Imaging luce NIAMS per fornire i microscopi e aiuto tecnico. Gli anticorpi MF20 e Pax7 sono stati ottenuti da Developmental Studies Hybridoma Bank sviluppato sotto l'egida del NICHD e mantenuto dal dipartimento di scienze biologiche, The University of Iowa, Iowa City. Questo lavoro è stato supportato dal programma di ricerca intramurale di NIAMS del National Institutes of Health.
Materiali
| Name | Company | Catalog Number | Comments |
| methylbutane | Sigma-Aldrich | M32631 | |
| Optimal Cutting Temperature (O.C.T.) compound | Electron Microscopy Sciences | 62550-01 | |
| 10x PBS | Gibco, Themo Fisher | 70011-044 | |
| 16% PFA | TED PELLA | 50-00-0 | |
| Triton-100 | Sigma-Aldrich | T8787 | |
| Normal Goat Serum | Thermo Fisher | 0 1-6201 | |
| AffiniPure Fab Fragment Goat Anti-Mouse IgG (H+L) | Jackson ImmunoResearch Laboratories Inc. | 115-007-003 | |
| 20x Citrate Buffer | Thermo Fisher | 00 500 | |
| Pax7 mono-clonal mouse antibody (IgG1) (supernatant) | Developmental Study Hybridoma Bank | N/A | |
| Laminin polyclonal rabbit antibody | Sigma-Aldrich | L9393 | |
| MF20 mono-clonal mouse antibody (IgG2b) (supernatant) | Developmental Study Hybridoma Bank | N/A | |
| Goat anti-Mouse IgG1 cross-absorbed secondary antibody, Alexa Fluor 488 | Thermo Fisher | A-21121 | |
| Goat anti-Mouse IgG2b cross-absorbed secondary antibody, Alexa Fluor 647 | Thermo Fisher | A-21242 | |
| Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 555 | Thermo Fisher | A32732 | |
| Leica CM1860 cryostat | |||
| Leica DM6000 wide-field fluorescent microscope | |||
| Leica DMR wide-field fluorescent microscope | |||
| Zeiss LSM510 confocal microscope | |||
| Zeiss LSM780 confocal microscope | |||
| Cuisinart electronic pressure cooker |
Riferimenti
- Buckingham, M. Gene regulatory networks and cell lineages that underlie the formation of skeletal muscle. Proc Natl Acad Sci U S A. 114 (23), 5830-5837 (2017).
- Buckingham, M., Relaix, F. PAX3 and PAX7 as upstream regulators of myogenesis. Semin Cell Dev Biol. 44, 115-125 (2015).
- Relaix, F., Buckingham, M. From insect eye to vertebrate muscle: redeployment of a regulatory network. Genes Dev. 13 (24), 3171-3178 (1999).
- Chang, N. C., Chevalier, F. P., Rudnicki, M. A. Satellite Cells in Muscular Dystrophy - Lost in Polarity. Trends Mol Med. 22 (6), 479-496 (2016).
- Mauro, A. Satellite cell of skeletal muscle fibers. J Biophys Biochem Cytol. 9, 493-495 (1961).
- Kuang, S., Rudnicki, M. A. The emerging biology of satellite cells and their therapeutic potential. Trends Mol Med. 14 (2), 82-91 (2008).
- Wang, Y. X., Rudnicki, M. A. Satellite cells, the engines of muscle repair. Nat Rev Mol Cell Biol. 13 (2), 127-133 (2011).
- Rinaldi, F., Perlingeiro, R. C. Stem cells for skeletal muscle regeneration: therapeutic potential and roadblocks. Transl Res. 163 (4), 409-417 (2014).
- Le Grand, F., Rudnicki, M. A. Skeletal muscle satellite cells and adult myogenesis. Curr Opin Cell Biol. 19 (6), 628-633 (2007).
- Giordani, L., Puri, P. L. Epigenetic control of skeletal muscle regeneration: Integrating genetic determinants and environmental changes. FEBS J. 280 (17), 4014-4025 (2013).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nat Protoc. 10 (10), 1612-1624 (2015).
- Feng, X., Adiarte, E. G., Devoto, S. H. Hedgehog acts directly on the zebrafish dermomyotome to promote myogenic differentiation. Dev Biol. 300 (2), 736-746 (2006).
- Juan, A. H., et al. Polycomb EZH2 controls self-renewal and safeguards the transcriptional identity of skeletal muscle stem cells. Genes Dev. 25 (8), 789-794 (2011).
- Jackson, K. A., Snyder, D. S., Goodell, M. A. Skeletal muscle fiber-specific green autofluorescence: potential for stem cell engraftment artifacts. Stem Cells. 22 (2), 180-187 (2004).
- Lepper, C., Conway, S. J., Fan, C. M. Adult satellite cells and embryonic muscle progenitors have distinct genetic requirements. Nature. 460 (7255), 627-631 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon