Method Article
Identificação de células satélite de músculo esquelético por imunofluorescência com anticorpos de laminina e Pax7
Neste Artigo
Resumo
A identificação precisa de células satélites é essencial para estudar as suas funções sob diferentes condições fisiológicas e patológicas. Este artigo apresenta um protocolo para identificar células satélites em seções de músculo esquelético adulto baseado em imunofluorescência manchando.
Resumo
Imunofluorescência é um método eficaz que ajuda a identificar diferentes tipos de células em secções de tecido. A fim de estudar a população celular desejado, anticorpos para marcadores de célula específica são aplicados em cortes de tecido. No músculo esquelético adulto, células satélites (SCs) são as células-tronco que contribuem para a regeneração e reparação muscular. Portanto, é importante Visualizar e traçar a população de células satélite sob diferentes condições fisiológicas. No músculo esquelético a descansar, SCs residam entre a lâmina basal e a membrana plasmática de miofibras. Um marcador comumente usado para a identificação de SCs no myofibers ou em cultura de células é a proteína emparelhados caixa Pax7. Neste artigo, um protocolo de imunofluorescência Pax7 otimizado em seções de músculo esquelético é apresentado que minimiza a mancha não específica e plano de fundo. Outro anticorpo que reconhece uma proteína (laminina) da lâmina basal também foi adicionado para ajudar a identificar os protocolos de SCs. Similar também pode ser usado para executar a rotulagem duplos ou triplos, com Pax7 e anticorpos para proteínas adicionais de interesse.
Introdução
Músculo esquelético é composto de células musculares multinucleadas, chamado myotubes, organizado em myofibers, que geram força e movimentos através de contração. Mais os músculos esqueléticos, com exceção de alguns músculos craniofaciais, são derivados de uma estrutura temporária embrionária chamada um somite1. Células precursoras miogênico delaminate partir do somite epitelial tornar mioblastos. Mioblastos mais diferenciarem em miócitos que fundem-se para tornar-se myotubes para formar myofibers multi nucleada. O processo acima é chamado myogenesis e é caracterizado pelo controle temporalmente-regulado da expressão do gene. Miogênico precursores expressam Pax3 e Pax7, Considerando que mioblastos expressam MyoD e/ou Myf5 e miócitos expressam Miogenina e myosins2,3. Crescimento muscular é um processo em que myofibers se tornam maiores, incorporando mais myonuclei em fibras existentes (hiperplasia) e pelo aumento da fibra muscular (hipertrofia) de tamanho4. Durante o crescimento muscular, há uma fonte sustentável de miogênico células que possuem propriedades de célula-tronco, em que eles podem diferenciar e auto renovar. Estas células são denominadas células satélites com base em sua localização física entre a sarcolema (membrana celular das miofibras) e a lâmina basal5. SCs vigorosamente contribuem para o crescimento muscular na fase juvenil (as primeiras 2-3 semanas de ratos pós-natal), mas tornar-se quiescente no músculo adulto6a descansar. Surpreendentemente, eles podem ser re-ativados em resposta ao músculo fere e se diferenciar em células de músculo novo para reparar o músculo danificado7.
As propriedades de célula-tronco fazem o estudo da SCs relevantes para biologia básica muscular e terapias de músculo doenças8. Como resultado, ele tem sido uma área de intensa investigação nas últimas décadas. Fez um tremendo progresso em dissecando a genética e epigenética de SCs9,10. Técnicas envolvidas no isolamento e identificação de SCs em situ foram desenvolvidas e optimizadas ao longo do caminho11. A coloração imunofluorescente permite a identificação de SCs através do uso de anticorpos específicos, inclusive para Pax7. No entanto, a escassez e o tamanho pequeno das SCs combinada com uma forte autofluorescência do tecido muscular esquelético adulto processam a visualização desafiador. Aqui, descrevemos um protocolo de coloração imunofluorescente otimizado para o tecido do músculo de rato para Pax7 e com base em um método existente para zebrafish muscular12. Além disso, um anticorpo de laminina rotulado com um fluoróforo distinto é empregado para identificar a lâmina basal sob as quais se situam os SCs. Este protocolo consistentemente permite a visualização de SCs Pax7-positivo e precursores miogênico sob condições fisiológicas tudo testadas e estádios de desenvolvimento.
Protocolo
Neste protocolo, os músculos anterior membro posterior de ratos adultos (2-6 meses), tibial anterior (TA) e extensor longo dos dedos (EDI), foram utilizados como exemplo para realizar a imunofluorescência coloração sobre seus SCs. Todas as etapas de manipulação de camundongos e músculo dissecções de tecidos foram aprovadas pelo Comitê de uso (ACUC) de NIAMS/NIH e cuidado Animal.
1. dissecar o músculo TA/EDI desde o membro posterior Mouse
- Eutanásia o mouse numa câmara cheia de eutanásia CO2 sob as diretrizes do ACUC de NIH. Se necessário, realize deslocamento cervical.
- Coloque o rato voltado para cima sobre uma almofada de dissecação (supino). Pulverize o etanol a 70% na pele sua barriga. Corte um 1-2 cm abertura horizontal no centro da pele barriga do mouse e, em seguida, mesa o mouse puxando a abertura em direção aos pés do mouse. Expor um lado do membro hind do mouse.
- Use duas pinças afiadas: usar um para segurar os tendões que unem o TA/EDI ao tornozelo e usar o outro para romper e distorcer a fáscia cobrindo o TA/EDL. Uma vez que a fáscia é descascada, use a ponta afiada da pinça para desanexar do TA/EDI do osso tíbia executando a ponta por baixo do músculo TA/EDL.
- Corte os tendões do tornozelo com uma tesoura enquanto ainda segurando-os com a pinça. Apare o músculo com a tesoura ao longo da linha longitudinal do TA/EDI do tornozelo para o joelho ao levantar o EDI/TA do lado do tornozelo com a pinça. Cortou os tendões do joelho-lado para desanexar o inteiro TA/EDI da tíbia.
2. Cryo-incorporação do músculo TA/EDI
- Preparar um banho de nitrogênio líquido em um recipiente, por exemplo., um frasco de Dewar de nitrogênio líquido. Despeje num copo de plástico pequeno (cerca de 20 mL) para meio cheio methylbutane. Então coloque o béquer no banho de nitrogênio líquido para congelá-lo. Depois de alguns minutos, verificar que a methylbutane está congelada.
Nota: O nitrogênio líquido pode ser substituído por um balde de gelo seco, mas o tempo de congelamento é mais lento. - Leigos do TA/EDI dissecado para a superfície plana de um êmbolo de seringa de plástico pequena. Cobrir totalmente o TA/EDI com algumas gotas de ideal corte temperatura (O.C.T.) composto (o meio de congelação).
- Pegue o copo de methylbutane fora da banheira de nitrogênio líquido e descongelar a superfície com um objeto quente (ex., o cabo da tesoura). Rapidamente mergulho o O.C.T. cobriu TA/EDI sobre o êmbolo para a methylbutane derretida para snap-congelar o tecido.
- Desanexe o tecido incorporado do êmbolo com fórceps e colocá-lo em um tubo de microcentrifugadora de 1,5 mL. Coloca o tubo em nitrogênio líquido para armazená-lo durante a manipulação de mais amostras.
Nota: O tecido incorporado pode ser armazenado a-80 ° C para longo prazo (2 anos) ou a-20 ° C para curto prazo (6 meses).
3. criostato seccionamento
- Adicione uma gota de O.C.T. composto para o centro de um suporte de amostra de um criostato. Espere até que o composto O.C.T. é quase solidificado. Rapidamente vara do TA/EDI incorporado ao complexo O.C.T., perpendicular com o lado do tornozelo para baixo e o lado do joelho acima.
- Montar o suporte de amostra em um criostato, corte o tecido no intervalo de 10 µm e coletar as cryo-seções em slides de geada revestida com sobre seções de 4-8 em um slide.
- Seque as seções em temperatura ambiente pelo menos 3 h durante a noite.
Nota: Embora as seções no congelador por uma noite ou mais de secagem é aceitável, inevitavelmente aumentará a autofluorescência. Para melhores resultados, seca as seções para 0,5 h, então prosseguir com a fixação e coloração passos imediatamente. - Recolher os slides em uma caixa de slides e usá-los imediatamente ou armazenar os slides a-80 ° C ou a-20 ° C para uso posterior.
4. preparação dos reagentes para coloração de imunofluorescência
-
Prepare os amortecedores:
- Prepare-se 2 L de 1 x salina tamponada fosfato (PBS) de PBS 10x.
- Prepare-se 40 mL de paraformaldeído 4% (PFA) em PBS 1x de 16% PFA.
- Prepare-se 2 L de PBST: 1X PBS com 0,1% Triton-100.
- Prepare 50 mL de PBST PBST-b: com 2% albumina de soro bovino (BSA).
- Prepare-se 10 mL de PBST PBST-B-g: com 2% BSA e 5% de soro de cabra Normal.
- Prepare-se 1 mL de solução de bloqueio. Diluído AffiniPure Fab fragmento cabra anti-Mouse IgG (H + L) (01:10) em PBST-B.
- Prepare 200 mL de tampão de citrato de 1x.
Nota: Os volumes das soluções acima são suficientes para pelo menos 5 slides. Volumes devem ser ajustadas de acordo com o número de slides e o tamanho dos recipientes de slide.
-
Prepare esfregaços para coloração anticorpo:
- Anticorpos primários (concentração de trabalho): preparar 1,2 mL de anticorpo primário mistura diluindo o anticorpo monoclonal de rato de Pax7 (IgG1) (1-5 µ g/mL) + anticorpo policlonal laminina (0,5-2 µ g/mL) + anticorpo monoclonal de rato de MF20 (IgG2b) (0.5-2.5 µ g / mL) em PBST-B-G.
Nota: O anticorpo monoclonal de rato de MF20 (IgG2b) é opcional. - Anticorpos secundários (concentração de trabalho): preparar 1,2 mL de anticorpo secundário mistura diluindo cabra anti-rato IgG1 Cruz-adsorvido anticorpo secundário, Alexa Fluor 488 (0,5-2 µ g/mL) + cabra anti-coelho IgG (H + L) altamente Cruz-adsorvido anticorpo secundário, Alexa Fluor Plus 555 (0,5-2 µ g/mL) + cabra anti-rato IgG2b Cruz-adsorvido anticorpo secundário, Alexa Fluor 647 (0,5-2 µ g/mL) em PBST-B-G.
Nota: Alexa Fluor 647 é opcional.
- Anticorpos primários (concentração de trabalho): preparar 1,2 mL de anticorpo primário mistura diluindo o anticorpo monoclonal de rato de Pax7 (IgG1) (1-5 µ g/mL) + anticorpo policlonal laminina (0,5-2 µ g/mL) + anticorpo monoclonal de rato de MF20 (IgG2b) (0.5-2.5 µ g / mL) em PBST-B-G.
5. imunofluorescência coloração passos
-
Re-hidratar e corrigir as cryo-seções com PFA.
- Remova alguns dos slides TA/EDI cryo-seção da caixa de slides. Aquecer os slides em uma bandeja de slide-terra arrendada à temperatura ambiente.
- Use uma caneta de bloqueador líquido (caneta PAP) para desenhar uma área que inclui todas as seções de criogenia do slide. Este círculo irá impedir as soluções fluem fora do slide.
- Leve a bandeja para uma coifa de laboratório. Adicionar 300-500 µ l de 4% PFA a lâmina dentro da área de um círculo para corrigir as seções à temperatura ambiente durante 10 min. lavar fora o PFA com 1X PBS pelo menos 3 x 5 min em um recipiente de slide.
Cuidado: PFA é tóxico e resíduos perigosos; deve ser operado com cuidado e descartado em um recipiente de resíduos perigosos.
-
Recuperação do antígeno
- Encha outro slide recipiente com 200 mL de tampão citrato.
- Transferi os slides no recipiente. Transferi o recipiente com os slides para uma panela de pressão para cozinhar os slides no modo de alta pressão durante 10 minutos.
- Arrefecer o recipiente com a drenagem de água de 10 min. transferência todos os slides para um novo recipiente com PBST (200 mL), enxágue-os slides com PBST pelo menos 3 x 5 min.
-
Bloqueio
- Adicione kimwipes ensopados de água para a bandeja segurando os slides para criar um ambiente úmido para evitar a secagem dos slides.
- Voltar os slides para a bandeja e adicionar 200 µ l de solução para cada slide de bloqueio. Cubra a bandeja com uma tampa e deixe-o bloqueando desenvolver durante 30 min.
Nota: Pax7 anticorpo é um anticorpo monoclonal de rato, para que haja ligação inespecífica do mouse IgG nos tecidos do músculo de rato que cria o fundo elevado. Usar o AffiniPure Fab fragmento de cabra anti-Mouse IgG (H + L) bloqueia a ligação inespecíficas na-do rato.
-
Aplicam-se os anticorpos primários.
- Enxágue as lâminas com PBST uma vez no recipiente do slide. Mova os slides volta à bandeja de coloração.
- Aplicam-se 200 µ l de mistura de anticorpo primário em cada slide, cubra a bandeja com uma tampa e deixe a reação desenvolver à temperatura ambiente durante 1 h, ou a 4 ° C, durante a noite.
Nota: A reação durante a noite a 4 ° C dá o melhor resultado, apesar de desenvolver a reação na temperatura de quarto dá resultados satisfatórios. O anticorpo de MF20 miosina pode ser adicionado na mistura para realizar um triplo (Pax7, laminina, MF20) rotulagem. MF20 manchas diferenciadas de fibras musculares. Este passo também serve como mais um passo de bloqueio com PBST-B-G para reduzir potencial inespecíficas ligação de anticorpos secundários (anticorpos de cabra), na etapa seguinte.
-
Aplicam-se anticorpos secundários.
- Lavar os anticorpos primários com PBST à temperatura ambiente pelo menos 3 x 5 min.
- Adicionar 200 µ l de mistura de anticorpo secundário para cada slide e permitir que a reação a desenvolver em temperatura ambiente pelo menos 1 h.
Nota: Para Pax7 + laminina, use cabra anti-rato IgG1 Alexa 488 e cabra anticoelho Alexa 555.
Para MF20 + Pax7 + laminina, adicione cabra anti-rato IgG2b Alexa 647 no mix. - Lavar os anticorpos secundários com PBST pelo menos 3 x 5min.
-
Montagem e Counter-mancha DAPI (4, 6-diamidino-2-phenylindole)
- Dilua o DAPI (01:20, 000) em PBST no recipiente de slide, por exemplo, 10 µ l de DAPI em 200 mL de PBST.
- Mancha os slides no contêiner DAPI por 3 min.
- Lave o DAPI com PBST pelo menos 5 x 5 min.
- Monte as lâminas com meio de montagem. Cobrir os slides com as lamelas.
Cuidado: DAPI é tóxicos e perigosos; deve ser manuseado com cuidado e eliminado na garrafa resíduos perigosos.
6. fluorescente microscopia
Nota: O protocolo de coloração imunofluorescente relatado acima permitirá visualização SCs com qualquer um campo amplo fluorescente ou confocal microscópio. Pode ser inicialmente desafiador para identificar SCs. Aqui estão alguns passos recomendados que podem ser de ajuda.
- Use o canal de DAPI e objectivos de baixa ampliação para visualizar as seções sobre os slides.
- Alterne o aumento de baixa a alta. Para observar o SCs, pelo menos um objetivo X 20 é necessário).
- Usar o cubo de filtro duplo para 488 (FITC) / 555 (rodamina) observar tanto Pax7 e laminina sinaliza ao mesmo tempo para identificar SCs. Sob esta definição, o sinal de Pax7 coloração tem um melhor contraste com o ruído de fundo.
- Alterne rapidamente o canal FITC-DAPI para identificar corretamente a SCs. Todos SCs devem ser Pax7/DAPI-positivo.
Resultados
Seguindo os passos acima, SCs podem ser visualizadas com êxito em seções de músculo adulto descanso sob um microscópio fluorescente (Figura 1). Embora o tecido muscular adulto tem forte autofluorescência de determinado tipo de fibras, as tinturas de série brilhantes Alexa podem superar o ruído de fundo e destaca-se o sinal (figura 1A, B; cabeças de seta). A microscopia confocal dois fotões capta uma imagem relativamente limpa (figura 1B) do que o microscópio fluorescente de campo amplo (figura 1A). O mesmo protocolo também trabalhou bem em tecidos musculares de ratos juvenis (Figura 2A), embriões do rato (Figura 2B) e ferido tecidos musculares adulto (Figura 3). Nos tecidos musculares embrionárias e juvenil, existem mais registrados SCs (Figura 2A, setas) ou Pax7-positivo miogênico precursores (Figura 2B, setas), que têm núcleos relativamente maiores; Portanto, é relativamente mais fácil de Visualizar SCs de ratos mais jovens do que de ratos adultos (Figura 2 e Figura 1). No tecido do músculo lesionado, também existem mais ativado SCs Pax7-positivo (Figura 3).

Figura 1: imagens de Pax7 e laminina imunofluorescência no rato adulto descansando tecidos musculares. TA/EDI seções de músculo de ratos adultos foram immunostained com os anticorpos de laminina (vermelho) e Pax7 (verde) e Counter-manchado com DAPI (azul). (A) imagem capturada sob um microscópio fluorescente de campo amplo. (B) imagem capturada sob um microscópio confocal. Barras de escala: 50 µm. setas: SCs de fibras com baixa autofluorescência. Setas: SCs de fibras com alta autofluorescência. Clique aqui para ver uma versão maior desta figura.

Figura 2: imagens de Pax7 e laminina ou MF20 imunofluorescência em tecidos musculares de ratos jovens. Seções de músculo TA/EDI dos ratos mais jovens eram immunostained com Pax7 (verde) e laminina (vermelha) ou anticorpos MF20 (magenta) e Counter-manchado com DAPI (azul). (A) pós-Natal dia 8 seção de músculo (P8) capturou um microscópio confocal. (B) embrionárias dia 17.5 seção de músculo (E17.5) capturado sob um microscópio fluorescente de campo amplo. Barras de escala = 50 µm. setas: SCs na secção de músculo P8 (A); representante Pax7 + miogênico precursores E17.5 seção de músculo, embora existam mais na imagem (B). Estas duas imagens foram modificadas de dados brutos que também gerou imagens em um artigo publicado13 (sFigura 3D) e (sfigura 1B), respectivamente. Clique aqui para ver uma versão maior desta figura.
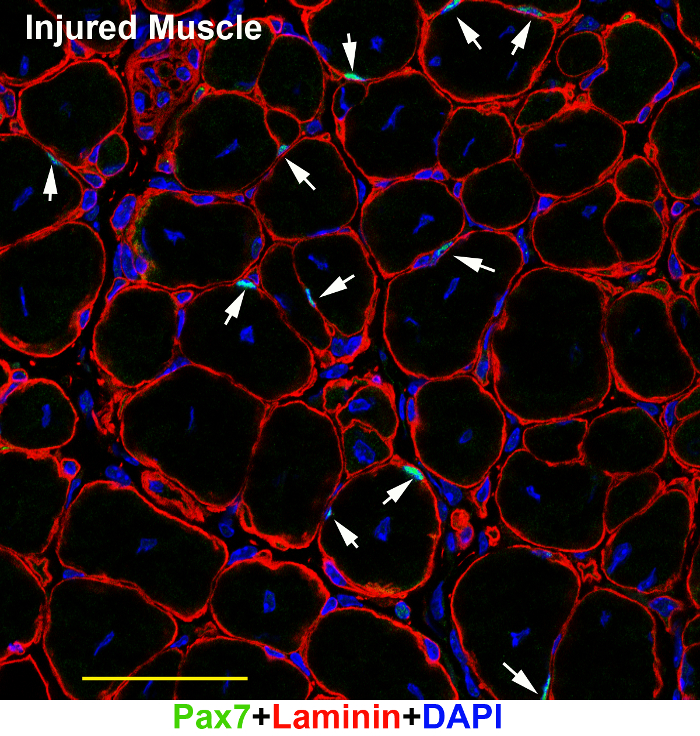
Figura 3: uma imagem representativa de Pax7 e laminina imunofluorescência em tecidos do músculo lesionado adulto. Seções de músculo TA/EDI de tecidos um músculo lesionado adulto (7 dias após a lesão) foram immunostained com os anticorpos de laminina (vermelho) e Pax7 (verde) e Counter-manchado com DAPI (azul). A imagem foi capturada em um microscópio confocal. Barra de escala = 50 µm. setas: SCs na seção. Clique aqui para ver uma versão maior desta figura.
Discussão
O protocolo acima foi baseado em um método de coloração de Pax7/MF20 no zebrafish músculo esquelético12. As soluções utilizadas e bloqueando os passos são idênticos ou semelhantes. Os anticorpos utilizados são idênticos. As etapas ajustadas basearam-se nas características do tecido muscular de rato e SCs. Primeiro, laminina anticorpo foi adicionado na mistura para ajudar a visualizar e confirmar a posição do SCs. Foi particularmente útil para contar o número de SCs sob o microscópio, quando usando o cubo do filtro duplo de 488/555; isto bastante reforçada o sinal de Pax7 SC-derivado para se destacar do fundo autofluorescent barulhento. Em segundo lugar, uma vez que o anticorpo Pax7 usado é um anticorpo de rato, nós adicionamos um rato na bloqueio passo (5.3) para reduzir o fundo resultante da consolidação inespecífica do mouse IgG. Em terceiro lugar, a etapa de recuperação de antígeno (passo 5.2) foi fundamental para coloração com anticorpos Pax7 em PFA tecidos reparados.
O mesmo protocolo foi utilizado em tecidos musculares de ratos mais jovens (filhotes e embriões) (Figura 2). Na verdade, era relativamente fácil Visualizar SCs em filhotes de cachorro do que em ratos adultos pelo mesmo protocolo. Talvez seja útil começar com coloração SCs sobre filhotes para ganhar experiência antes de prosseguir com o tecido muscular de adultos. Um controle negativo sem anticorpos primários (passo 5.4) é também necessário em cada experimento. Um protocolo similar foi utilizado com sucesso em cortes de parafina com parafina extra etapas de processamento. No entanto, as seções de parafina tendem a ter um maior fundo de autofluorescência, que mascarados sinais de SCs que têm relativamente mais fraca expressão de Pax7. Se possível, evite o uso de cortes de parafina. O mesmo protocolo também foi utilizado em tecidos do músculo lesionado que têm numerosos SCs e deram resultados semelhantes aos obtidos com o tecido do músculo do pup (Figura 3).
Autofluorescência de tecido muscular representa o principal obstáculo na obtenção de resultados de imunofluorescência limpo14. Reduzir o tempo de secagem de cryo-seções pode diminuir a autofluorescência e usar cryo-seções preparadas é altamente recomendado. Similar a outros protocolos de15, a etapa de bloqueio na-do rato é necessário para reduzir ainda mais o fundo.
Enquanto ambos microscópio fluorescente de campo amplo e confocal microscópio foram eficazes para visualização de SCs através de olho peças, recomenda-se o uso do microscópio confocal para capturar imagens de alta qualidade.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Agradecemos a seção de Imaging luz NIAMS para fornecer os microscópios e a ajuda técnica. Os anticorpos MF20 e Pax7 foram obtidos de estudos do desenvolvimento do Hybridoma banco desenvolvido sob os auspícios dos FORMULADORES e mantido pela departamento de ciências biológicas, da Universidade de Iowa, Iowa City. Este trabalho foi financiado pelo programa Intramural de pesquisa, NIAMS, do institutos nacionais da saúde.
Materiais
| Name | Company | Catalog Number | Comments |
| methylbutane | Sigma-Aldrich | M32631 | |
| Optimal Cutting Temperature (O.C.T.) compound | Electron Microscopy Sciences | 62550-01 | |
| 10x PBS | Gibco, Themo Fisher | 70011-044 | |
| 16% PFA | TED PELLA | 50-00-0 | |
| Triton-100 | Sigma-Aldrich | T8787 | |
| Normal Goat Serum | Thermo Fisher | 0 1-6201 | |
| AffiniPure Fab Fragment Goat Anti-Mouse IgG (H+L) | Jackson ImmunoResearch Laboratories Inc. | 115-007-003 | |
| 20x Citrate Buffer | Thermo Fisher | 00 500 | |
| Pax7 mono-clonal mouse antibody (IgG1) (supernatant) | Developmental Study Hybridoma Bank | N/A | |
| Laminin polyclonal rabbit antibody | Sigma-Aldrich | L9393 | |
| MF20 mono-clonal mouse antibody (IgG2b) (supernatant) | Developmental Study Hybridoma Bank | N/A | |
| Goat anti-Mouse IgG1 cross-absorbed secondary antibody, Alexa Fluor 488 | Thermo Fisher | A-21121 | |
| Goat anti-Mouse IgG2b cross-absorbed secondary antibody, Alexa Fluor 647 | Thermo Fisher | A-21242 | |
| Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 555 | Thermo Fisher | A32732 | |
| Leica CM1860 cryostat | |||
| Leica DM6000 wide-field fluorescent microscope | |||
| Leica DMR wide-field fluorescent microscope | |||
| Zeiss LSM510 confocal microscope | |||
| Zeiss LSM780 confocal microscope | |||
| Cuisinart electronic pressure cooker |
Referências
- Buckingham, M. Gene regulatory networks and cell lineages that underlie the formation of skeletal muscle. Proc Natl Acad Sci U S A. 114 (23), 5830-5837 (2017).
- Buckingham, M., Relaix, F. PAX3 and PAX7 as upstream regulators of myogenesis. Semin Cell Dev Biol. 44, 115-125 (2015).
- Relaix, F., Buckingham, M. From insect eye to vertebrate muscle: redeployment of a regulatory network. Genes Dev. 13 (24), 3171-3178 (1999).
- Chang, N. C., Chevalier, F. P., Rudnicki, M. A. Satellite Cells in Muscular Dystrophy - Lost in Polarity. Trends Mol Med. 22 (6), 479-496 (2016).
- Mauro, A. Satellite cell of skeletal muscle fibers. J Biophys Biochem Cytol. 9, 493-495 (1961).
- Kuang, S., Rudnicki, M. A. The emerging biology of satellite cells and their therapeutic potential. Trends Mol Med. 14 (2), 82-91 (2008).
- Wang, Y. X., Rudnicki, M. A. Satellite cells, the engines of muscle repair. Nat Rev Mol Cell Biol. 13 (2), 127-133 (2011).
- Rinaldi, F., Perlingeiro, R. C. Stem cells for skeletal muscle regeneration: therapeutic potential and roadblocks. Transl Res. 163 (4), 409-417 (2014).
- Le Grand, F., Rudnicki, M. A. Skeletal muscle satellite cells and adult myogenesis. Curr Opin Cell Biol. 19 (6), 628-633 (2007).
- Giordani, L., Puri, P. L. Epigenetic control of skeletal muscle regeneration: Integrating genetic determinants and environmental changes. FEBS J. 280 (17), 4014-4025 (2013).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nat Protoc. 10 (10), 1612-1624 (2015).
- Feng, X., Adiarte, E. G., Devoto, S. H. Hedgehog acts directly on the zebrafish dermomyotome to promote myogenic differentiation. Dev Biol. 300 (2), 736-746 (2006).
- Juan, A. H., et al. Polycomb EZH2 controls self-renewal and safeguards the transcriptional identity of skeletal muscle stem cells. Genes Dev. 25 (8), 789-794 (2011).
- Jackson, K. A., Snyder, D. S., Goodell, M. A. Skeletal muscle fiber-specific green autofluorescence: potential for stem cell engraftment artifacts. Stem Cells. 22 (2), 180-187 (2004).
- Lepper, C., Conway, S. J., Fan, C. M. Adult satellite cells and embryonic muscle progenitors have distinct genetic requirements. Nature. 460 (7255), 627-631 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados