Method Article
Akış Sitometresi ile Primer Sıçan Retinalı Ganglion Hücrelerinin (RGC) İzolasyonu
Bu Makalede
Özet
Milyonlarca insan irreversibl körlüğe neden olan retinal dejeneratif hastalıklardan muzdarip. Bu hastalıkların birçoğunun ortak bir unsuru retinal gangliyon hücrelerinin kaybıdır (RGC'ler). Bu ayrıntılı protokol, primer murin RGC'lerin akış sitometrisi ile pozitif ve negatif seçilim yoluyla izole edilmesini açıklar.
Özet
Nörodejeneratif hastalıklar genellikle etkilenenler üzerinde yıkıcı bir etkiye sahiptir. Retinal gangliyon hücresi (RGC) kaybı, normal yaşlanmaya ek olarak diyabetik retinopati ve glokom da dahil olmak üzere bir dizi hastalıkta rol oynar. RGC'lerin önemine rağmen, bugüne kadar, retina içindeki çok çeşitli hücrelerin yalnızca küçük bir yüzdesini oluşturmaları nedeniyle kısmen çalışmak son derece zor olmuştur. Buna ek olarak, mevcut izolasyon yöntemleri canlı olmayan hücreler üreten RGC'leri belirlemek için hücre içi işaretleyicileri kullanır. Bu teknikler aynı zamanda uzun izolasyon protokollerini de içerdiğinden, RGC'leri elde etmek ve izole etmek için pratik, standartlaştırılmış ve güvenilir yöntemlerin eksikliği vardır. Bu çalışma, hem pozitif hem de negatif seçim kriterlerine dayanan bir protokol kullanarak, farelerin retinasından birincil RGC'lerin izole edilmesi için etkili, kapsamlı ve güvenilir bir yöntem açıklamaktadır. Sunulan yöntemler, RGC'lerin ilerideki çalışmalarına olanak tanır;Nörodejeneratif hastalıklarda fonksiyonel RGC kaybından kaynaklanan görme keskinliğinde azalma.
Giriş
RGC'ler terminal olarak diferansiye edilmiş nöronlardır ve bu nedenle deney için birincil hücreler gerekir. Birincil sıçangil retinal gangliyon hücrelerinin (RGC'lerin) izolasyonu ve zenginleştirilmesi için bir protokol geliştirilmesi, RGC'nin sağlık ve dejenerasyon mekanizmalarını in vitro ortaya koymak için temel teşkil etmektedir. Bu, RGC işlevini desteklemek ve ölümlerini en aza indirmek için potansiyel terapiler üretmek isteyen araştırmalar için özellikle önemlidir. RGC'lerin dejenerasyonu, glokom, diyabetik retinopati ve normal yaşlanma gibi retinal dejeneratif hastalıklarla ilişkilidir. RGC kaybına neden olan spesifik hücresel mekanizmalar belirsiz olmasına rağmen, bir dizi risk faktörü tanımlanmıştır. Optik sinir başındaki oksijenasyon yetersizliği 1 , 2 , 3 RGC ölümüne 4 neden olur ve uyarıcı ve ben aktivasyonu arasındaki homeostazın bozulması gibi davranırBireysel RGC'lerde nhibitor reseptörler 5 , 6 . Bir dizi zorluk, derinlemesine çalışmalar için bu hücrelerin kullanımına yönelik ilerlemeyi engeller. İlk olarak, bir sıçangil retinasında bulunan RGC sayısı azdır. RGC'ler toplam retinal hücrelerin% 1'inden azını oluşturmaktadır 7 , 8 , 9 . İkincisi, RGC'ye özgü belirteçlerin çoğunda hücre içi proteinler 10 , 11 , 12'dir . Bu işaretleyicilere dayanan seçim, hücreleri canlı olmamakla birlikte, işlevsel analizlerin yapılmasını engellemektedir. Sonunda, mevcut protokoller uzun sürmektedir ve standardizasyon eksikliği 13,14'tür. Erken RGC izolasyon protokolleri bağışıklama yöntemlerine dayanıyordu. Barres ve ark. 15 Klasik bağışıklığı uyarladıAnasyon tekniğiyle birleştirildi ve bir hücre yüzeyi markörü olan anti-timosit antijenine (aka Thy1) immünopozitifliğe dayalı pozitif seçilimden önce retin hücrelerinin hacminden monositleri ve endotel hücrelerini hariç tutan ikinci bir adım ekledi. Yıllar sonra, Hong ve ark. RGC'leri yüksek saflıkta izole etmek için hücre ayırma stratejileri ile manyetik boncuk izolasyon teknikleri kombine edilmiştir 16 . Manyetik boncukların kullanımı halen birçok bilimsel uygulamada kullanılmaktadır. Birlikte, manyetik boncuklar ve akış sitometri protokolleri izole edilmiş hücrelerin saflığını geliştirdi. Bununla birlikte, bu saflaştırma sistemleri henüz ayrılmış retinadan sıçangiller RGC'lerin izolasyonu için standardize edilmemiştir.
Akış sitometresi, hücre süspansiyonlarının optik ve floresans özelliklerini ölçen güçlü bir analitik yöntemdir. Hücreler hem niceliksel hem de niteliksel olarak yüksek duyarlılıkla analiz edilir ve hücre halkının çok boyutlu bir analizini sağlartirme. Hücresel ayrımcılık, iki ana fiziksel özellik üzerine kuruludur: hücre boyutu veya yüzey alanı ve taneciklilik veya iç karmaşıklık 17 . Benzer uyarılma dalga boylarına ve farklı emisyonlara sahip olan florokromlarla etiketlenmiş antikorları birleştirerek çok boyutlu bir analiz yapılabilir. Akış sitometrisi hızlı, tekrarlanabilir ve hassas. Multitpe lazerler, akış sitometrisiyle tek hücrelerin çok boyutlu analizlerine izin verir. Bu nedenle, sitolojik örneklerin incelenmesi için çekici bir metodoloji. Floresan aktive hücre ayırma (FACS), bireysel hücreleri farklı alt popülasyonlara ayırmak için akış sitometrisi ile tanımlanan çok boyutlu fenotipik farklılıkları kullanır.
Son on yılda, nöronlar da dahil olmak üzere hücre seçimi için potansiyel biyolojik belirteç olarak çoklu yüzey ve hücre içi proteinler tespit edilmiştir. RGC'leri sıçanlardan ayırmaya çalışan ilk çalışmalar, Thy1'i ganglion celi olarak kullandıL işaretleyici. Ne yazık ki Thy1, diğer CD90, diğer kemirgen türleri 18 , 19 , 20'de birden fazla izoforma sahiptir ve çoklu retinal hücre tipleri 19 , 20 tarafından ifade edilir, bu da RGC'ler için spesifik olmayan bir belirteç yapar. CD48 adlı bir diğer yüzey markörü makrofajlar ve mikroglialar da dahil olmak üzere retinanın monositik popülasyonlarında bulunur. Bu iki yüzey markörünü kullanarak, modifiye edilmiş bir RGC imza-Thy1 + ve CD48 negatif hücreleri- 15 , 16 , 21 , 22 geliştirildi . Maalesef, bu iki seçim ölçütü, oldukça zenginleştirilmiş bir RGC popülasyonu seçmek için yeterli değildir. Bu karşılanmamış ihtiyacı gidermek için, çok tabakalı pozitif ve negatif seçim kriterlerine dayanan bir flow sitometri protokolü geliştirildi.Primer murin RGC'leri zenginleştirmek ve saflaştırmak için bilinen hücre yüzeyi belirteçleri.
Protokol
Aşağıdaki protokolde detaylandırılan bütün prosedürler, Tennessee Sağlık Bilimleri Merkezi (UTHSC) Üniversitesinde Kurumsal Hayvan Bakımı ve Kullanım Komitesi (IACUC) gözden geçirme kurulu tarafından onaylanmış ve Kullanım İçin Vizyon ve Oftalmoloji Araştırma Derneği (ARVO) Beyannamesini takip etmiştir (Laboratuar Hayvanları Enstitüsü Enstitüsü, Hayvan Bakımı ve Laboratuar Hayvanları Kullanımına Yönelik Kamu Sağlığı Hizmet Politikası) ek olarak, oftalmik ve Vizyon Araştırmalarında Hayvanlar Üzerine Etkileri.
1. Araçların, Çözümlerin ve Medyanın Hazırlanması
Not: Protokolde rapor edilen malzemeler, reaktifler, aletler ve aletlerle ilgili tüm bilgiler Tablo Materyallerinde belirtilmiştir.
- Tüm diseksiyon aletlerini otoklavda tutun ve steril bir alanda saklayın. Aşağıdaki enstrümanları kullanın: 4 standart forseps (2 uzun ve 2 kısa) ve 2 makas,Aynı zamanda 2 forseps (1 uzun ve 1 kısa) ve diseksiyon için 1 makas; Yedek olarak yedek olarak tutun.
- Yıkamalar sırasında kullanılacak 100 mL steril PBS /% 1 FBS solüsyonu hazırlayın, immünolojik işaretleme prosedürleri ve hücre sıralama adımları. Solüsyonu 4 ° C'de soğumaya devam edin.
Not: Çözeltiye sodyum azid (NaN 3 ) ilave etmeyin, çünkü canlı hücreler için toksik olabilir.- 99 mL PBS ve 1 mL FBS ile 100 mL PBS /% 1 FBS hazırlayın.
- Toplama ve kültür ortamı olarak kullanılmak üzere% 3 FBS ile takviye edilmiş 100 mL steril sinir hücresi ortamı hazırlayın (Malzeme Listesine bakın). Hücre kültürü ortamını 4 ° C'de steril tutun. Kullanmadan önce oda sıcaklığına (RT) ısıtın.
- 97 mL nöral hücre ortamı ve 3 mL FBS kullanarak% 3 FBS ile takviye edilmiş 100 mL sinir hücresi ortamı hazırlayın.
- 5 mL toplama ortamı ile önceden kaplanmış ön soğutmalı toplama tüpleri (15 mL tüpler), tBuz kovasında etek Hücrelerin boru yüzeyine yapışmasını önlemek için yalnızca polipropilen tüpler kullanın.
- Biyolojik güvenlik kabininde 40 mm'lik tabaklar, 70 μm'lik naylon süzgeçler, şırınga, hücre süzgeci için paçallar ve steril polipropilen tüpler yerleştirin. Prosedürlerden önce tüm maddeleri sterilize edin ve prosedür boyunca steril bir şekilde muhafaza edin.
Not: Retinanın toplanmasından sonraki tüm basamaklar biyogüvenlik kabininde yapılacaktır.
2. Enükleasyon
Not: Bu deneyde 1.0 x 106 RGC'yi fenotip CD90.2 + CD48 negatif CD15 negatif CD57 negatif ile izole etmek için toplam 10 genç (5-7 haftalık) C57BL / 6J faresi kullanılmıştır.
- Fareleri, CO 2 inhalasyonunu takiben servikal dislokasyonu kullanarak euthanize edin. Ötenazede kalan hayvanın öldüğünden emin olmak için her zaman ikinci bir ötanazi yöntemi kullanın.
Not: İsoflüoran, CO2'ye alternatif olarak kullanılabilir. Anestezinin indükleyicisi olarak kullanıldığında göz içi basıncında (GİB) bir artış ile ilişkili olduğu için Ketamin önerilmez 24 , 25 . - Gözün altına forseps yerleştirin, optik siniri tutun ve çekin; Optik sinir bozulmadan, dünyanın enükleasyonu yapılacaktır. Toplanan gözleri PBS içeren bir şişeye yerleştirin ve bir sonraki adıma kadar şişeyi buzda tutun.
Not: Herhangi bir personel, Laboratuar Hayvan Bakım Ünitesi'nden (LACU) uygun eğitimi aldıktan sonra bu adımı gerçekleştirebilir.
3. Retinal Hücre Süspansiyonunun Hazırlanması
- Korneal diseksiyonu başlatmak için toplanan gözü diseksiyon mikroskopunun taban plakasına yerleştirin. Her gözü tek tek ayırın.
- Forseps kullanarak dikkatle dünya optik sinir tabanı tutun. Bu adım için bir lon kullanınG ve bir kısa standart forseps.
- Sulu mizahın gözlerden çıkmasını sağlamak için kornea delmek için 30-gauge (30G) keskin bir iğne kullanın, bu sayede forseps ile göz tutulmasını kolaylaştıracaktır.
- Korneayı forsepsle tutun ve korneada küçük bir kesi yapmak için makas kullanın. Forseps kullanarak korneayı ve sklerayı hafifçe soyun. Dünya yarıya kadar soyulduğunda, forseps kullanarak retinayı ve lensi yuvarlayın. Korneayı, sklerayı ve objektifi atın.
Not: Bu yöntem, retinanın gözün geri kalan kısmından tamamen ayrılmasını sağlar. - Retinayı, PBS /% 1 FBS içeren küçük bir 40 mm'lik Petri kabına yerleştirin.
Not: Petri kabına alternatif olarak bir hücre kültürü çanağı kullanılabilir. Retinayı fizyolojik koşullarda olduğu gibi nemli tutmaya dikkat edin.- Her retinayı biyogüvenlik kabini içinde üç kez taze steril PBS /% 1 FBS ile yıkayın.
- Üzerine 12 retina yerleştirinPBS /% 1 FBS ile nemlendirilmiş steril bir 70-μm naylon süzgeç. 10 mL'lik şırınganın arka ucunu kullanarak, hücreleri ayırmak için retinaayı yavaşça dairesel bir hareketle macerante edin.
- Alternatif olarak, hücre süzgeç macerası için bir havan tozu kullanın veya 15 IU / mL papain, 5 mM L-sistein ve 200 U / mL DNaz I kombinasyonu ile enzimatik sindirimi 37 ° C'de 15 dakika boyunca kullanın ve ardından PBS ile inaktive edin /% 10 FBS.
Not: enzimatik sindirim, makarna ile karşılaştırıldığında ya şırınganın ya da havanının arka ucunda iyileşen hücrelerin yüzdesinde herhangi bir değişiklik gözlenmemiştir.
- Alternatif olarak, hücre süzgeç macerası için bir havan tozu kullanın veya 15 IU / mL papain, 5 mM L-sistein ve 200 U / mL DNaz I kombinasyonu ile enzimatik sindirimi 37 ° C'de 15 dakika boyunca kullanın ve ardından PBS ile inaktive edin /% 10 FBS.
- İzole hücreleri aktarmak için steril 70-μm naylon süzgeci polipropilen toplama tüpünün üzerine yerleştirin. Toplanan hücreleri P1000 pipet kullanarak süzgeçten geçirin. Geriye kalan hücreleri serbest bırakmak için toplama tüpüne aktarmak için süzgeci ( adım 3.6 ) PBS /% 1 FBS ile durulayın.
- Ach için PBS /% 1 FBS ekleyinRetina başına 1 mL'lik nihai bir hacim var. Hücre süspansiyonunu 200 xg ve RT'de 7 dakika boyunca santrifüjleyin.
Not: Macerasyonlu retinaların sayısına (<6 retina) bağlı olarak, hücre peleti görünür olamayacak kadar küçük olabilir.- Hücre süpernatantı atın ve 5 retina başına 1 mL'lik bir oran kullanarak PBS /% 1 FBS'de hücre topağını tekrar süspansiyon haline getirin.
- Hemocytometer kullanarak hücreleri sayın.
- Bir cam hemocytometer ve lamel% 70 alkol ile temizleyin. Retina hücre süspansiyonunun eşit olarak dağıldığından emin olmak için hücreleri içeren tüpü yavaşça döndürün. Mikro santrifüj tüpüne 20 μL% 0.4 tripan mavisi yerleştirin ve hücre süspansiyonunun 20 μL'si ile karıştırın.
- Nazikçe karıştırın ve her iki hazneyi de doldurarak hemositometrede% 0.4 tripan mavisi / hücre süspansiyonu karışımı 10 mcL uygulayın; Kılcal etki, lamelin altında% 0.4 tripan mavisi / hücre süspansiyonu karışımı çekecektir. Mikroskop kullanarak tripan mavisi negatif hücreleri sayın; thiS sayısı canlı hücreleri temsil eder.
- Aşağıdaki formülü kullanarak hücre yaşayabilirliğini belirleyin: canlı hücre sayısı / toplam hücre sayısı = canlılık.
Not: Hücrelerin yaşayabilirliği% 95'ten düşükse, FACS sırasında hücre canlılığı ayrımı için floresan boyanın kullanılması gereklidir.
- Canlı hücreler için geçirgen olmayan flüoresan yaşamsal boya kullanın. Herhangi bir serum izini kaldırmak için hücreleri PBS ile yıkayın. 100 uL'lik son hacimde 5.0 x 10 6 hücre başına hücre canlılığı ayrımcılığı için 1 μL floresan boya ekleyin. Isıdan korunan, oda sıcaklığında 15 dakika inkübe edin. 10x hacimde PBS /% 1 FBS ekleyin. 200 xg ve RT'de 5 dakika boyunca santrifüjleyin.
- Gerekirse, hücre süspansiyonu gece boyunca 4 ° C'de inkübe edin. Bu yapılırsa, hücre süspansiyon tüp yerine PBS /% 1 FBS sinir hücresi orta doldurun. Tüpü yatay konuma getirin ve 4 ° C'de tutun.
4. Yeniden bağışıklık kazandırmaTinal hücreler
- Hücre sayısı başına antikor hacmini belirlemek için aşağıdaki dönüşüm kullanın: 100 uL hacimdeki 5.0 x 10 6 hücre başına 2 uL antikor.
- Hücreleri yıkayın ve PBS /% 1 FBS'de muhafaza edin. Sıralama kurulumunda negatif bir kontrol (etiketsiz) olarak kullanmak için küçük bir hücre parçasını (5.0 x 10 6 hücre) alın.
Not: Bu negatif kontrol, hücre sıralayıcının doğru şekilde kalibre edilmesi için kritik öneme sahiptir. - Fcγ reseptörlerini II ve III ifade eden hücrelere karşı antikorların spesifik olmayan bağlanmasını en aza indirgemek için, PBS /% 1 PBS kullanılarak 50 uL'lik bir nihai hacim içinde 1.0 x 10 6 hücre başına bir anti-fare CD16 / 32 antikoru 1 uL ekleyin. FBS. Oda sıcaklığında 10 dakika inkübe edin.
- Antikor kokteyli numuneye ekleyin ve pipetle hafifçe karıştırın. 30 dakika buz kovasında inkübe edin. Etiketlenmiş fluoro'nun foto-ağartılması nedeniyle ışığın deneyden ödünç alabileceğinden, buz kovasının kapalı olduğundan emin olunphores.
- Aşağıdaki floresan etiketli anti-fare antikorlarını kullanarak antikor kokteyli hazırlayın: CD90.2 AF-700, CD48 PE-Siyanin7, CD15 PE ve etiketlenmemiş CD57.
Not: Her bir antikor için 5.0 x 106 hücre başına aşağıdaki konsantrasyonları kullanın: CD90.2 AF700, 1 μg; CD48 PE-Siyanin 7, 0.4 μg; CD15 PE, 0.02 ug; Ve etiketsiz CD57, 0.4 μg.- Ciltleri aşağıdaki hesaplamalara göre kullanın (Malzeme Tablosunda listelenen piyasada bulunan antikorlara göre): etiketlenecek toplam 5.0 x 107 hücre; 5.0 x 10 6 hücre başına 2 mcL = her bir antikorun 20 uL'si; 4 farklı antikor = 80 uL antikor kokteyli; Nihai hacim = [(5.0 x 10 7 toplam hücre) /5.0 x 106 hücre] x 100 = 1,000 uL; 80 μL Abs + 50 μL anti-fare CD16 / 32 + 870 μL PBS /% 1 FBS = 1000 μL.
Not: Bu kombinasyon,Enstrüman konfigürasyonu için florokromların optimum kombinasyonu. Aşağıdaki parametreler emisyon ve uyarılmayı özetler: AF-700, 638 nm'lik kırmızı diyot lazerle uyarıldığında 719 nm'lik emisyon; PE-Cyanine7, 488 nm mavi diyot lazer ile uyarıldığında 767 nm emisyon; Ve PE, 488 nm mavi diyot lazer ile uyarıldığında 575 nm emisyon.
- Ciltleri aşağıdaki hesaplamalara göre kullanın (Malzeme Tablosunda listelenen piyasada bulunan antikorlara göre): etiketlenecek toplam 5.0 x 107 hücre; 5.0 x 10 6 hücre başına 2 mcL = her bir antikorun 20 uL'si; 4 farklı antikor = 80 uL antikor kokteyli; Nihai hacim = [(5.0 x 10 7 toplam hücre) /5.0 x 106 hücre] x 100 = 1,000 uL; 80 μL Abs + 50 μL anti-fare CD16 / 32 + 870 μL PBS /% 1 FBS = 1000 μL.
- Aşağıdaki floresan etiketli anti-fare antikorlarını kullanarak antikor kokteyli hazırlayın: CD90.2 AF-700, CD48 PE-Siyanin7, CD15 PE ve etiketlenmemiş CD57.
- 30 dakika inkübasyondan sonra, PBS /% 1 FBS kullanarak hacmi 5 mL'ye getirin. Numuneleri 200 xg ve RT'de 7 dakika santrifüjleyerek yıkayın. Bağlanmamış tüm antikorları kaldırmak için işlemi bir kez tekrarlayın.
- 5.0 x 10 6 hücrelerinin CD57'sini bağlayacak 2 uL ikincil antikor (0.1 μg) ekleyin. Adım 4.4'te olduğu gibi bir buz kovasında 30 dakika inkübe edin. Adım 4.5'te olduğu gibi hücreleri iki kez yıkayın.
- Adım 4.4'te etiketlenmemiş birincil antikor kullanılmışsa, ikincil antikorla hücreleri işaretleyin.
Not: İkinciBu konfigürasyon için seçilen bir artı antikor , Malzeme Tablosu'nda listelenmiştir; 421 nm'lik bir emisyon dalga boyuna sahiptir. 405 nm'de menekşötik diyot lazeriyle uyarıldığında 450/50 nm'lik bir bant geçiren filtreyle kullanın. - Aşağıdaki hesaplamalara göre hacim kullanın (Malzeme Tablosunda listelenen ticari olarak temin edilebilir antikora dayanılarak): 5.0 x 10 6 hücre başına 2 μL = ikincil antikorun 20 uL'si; Nihai hacim = [(5.0 x 10 7 toplam hücre) /5.0 x 106 hücre] x 50 = 500 uL; 20 μL Abs + 480 μL PBS /% 1 FBS = 500 μL.
- Adım 4.4'te etiketlenmemiş birincil antikor kullanılmışsa, ikincil antikorla hücreleri işaretleyin.
- Etiketli hücreleri PBS /% 1 FBS'de tutun. Bir hemocytometer kullanarak hücreleri sayın; 3.0 - 4.0 x 107 hücre / mL son retinal hücre konsantrasyonunu kullanın.
Not: Hücre kültürü ortamını hücreleri inceltmek için kullanmayın, çünkü fenol kırmızısı otofloresansı artırabilir, böylece negat arasındaki çözünürlüğü düşürebilirIve ve pozitif hücreler. Her bir hacim için nihai hücre yoğunluğu, cihaz konfigürasyonunun hacim akış oranına büyük ölçüde bağlıdır. - Floresan yayılımı en aza indirgemek için kurulum sırasında tek renkli kontrolleri kullanın.
Not: Dengeleme olarak da bilinen bu adım, florofor kombinasyonunun yarattığı gürültüyü düzeltmek için uygulanır. PBS /% 0.1 BSA / 2 mM NaN 3 içerisindeki , birden fazla türe ait floresan etiketli immünoglobülin (Ig) izotiplerini bağlama kapasitesine sahip polistiren mikro küreleri, dengelemeyi ayarlamak için pozitif kontroller sağlar.- Florofor başına bir tane ayırarak steril FACS tüplerine 3 damla polistiren mikrosfer yerleştirin. Her bir tüpe ilgili flüorofordan 1 μg ekleyin. Oda sıcaklığında 15 dakika boyunca oda sıcaklığında inkübe edin. Örnek tüplerine 3 mL PBS /% 1 FBS ekleyin. 200 xg ve RT'de 5 dakika boyunca santrifüjleyin. Yüzen maddeyi dikkatlice çıkarın ve 250 μL PBS /% 1 FBS içinde tekrar süspanse edin.
- Negatif kontrölü oluşturmak içinOls, Ig'ye bağlanmayan polistiren mikro küreler kullanın. Gerekirse, bir önceki güne kadar bu adımı uygulayın.
5. Hücre Sıralama Stratejisi
Not: 355 nm, UV ile FACS için enstrüman kurulumu için özel talimatlar; 405 nm, menekşe; 488 nm, mavi; Ve sırasıyla 2, 2, 5 ve 3 floresan kanalı dağılımı ile 640 nm, kırmızı lazerler. İşletim yazılımı DIVA 8.0.1 sürümü idi. Hücre ayıracı, 70 psi kılıf basıncı, 70 psi kılıf basıncı, 87.5 frekans, 333'te ilk damla kırılma ile 48.6 genlik, 6'lık aralık atlaması, sıralama hassaslığı varsayılan (32) saflık maskesiyle dört yönlü saflığa ayarlanmış ve damla damlası ile gerçekleştirildi Boncuk kullanarak gecikme 42.98'e ayarlandı.
- Toplama gemileri olarak 15 mL'lik polipropilen konik tüpleri kullanın. Her tüpe toplama ortamı (hücre kültürü ortamı) 5 mL ekleyin ve duvarları kaplamak için tüp döndürün.
Not: Bu adım, hücrelerin t yanlarına yapışmasını önler.Koleksiyon tüpü. Alternatif olarak, boru seyreltilmemiş FBS ile kaplanabilir. - Hücrenin son verimini hesaplamak için hücre ayırıcı etkinliğini göz önünde bulundurun.
Not: Bu tür etkinlik, kullanılan akış sitometresine göre değişir. CD90.2 + CD48 negatif CD15 negatif CD57 neg fenotipi olan RGC'ler, tüm retinal hücrelerin yaklaşık% 1'ini oluşturur. - Hücre ayırımını, eğitilmiş bir operatör tarafından gerçekleştirin (genellikle çekirdek bir tesiste). Numunenin alınmasından önce cihazın% 70 etanol ile temizlendiğinden ve steril edildiğinden emin olun. Toplama tüplerinin dışını dikkatli bir şekilde% 70 etanol ile silin.
- Hücreler çöktükten veya bir araya getirildiyse, hücreleri yukarı ve aşağı pipetle alın ve süspansiyonu edinmeden önce steril bir 40-μm naylon süzgeçle filtreleyin. Hücre ayıracı yapılırken sıcaklığı kontrol ettiğinizden ve 4 ° C'de tuttuğunuzdan emin olun; Bunu yapmakta başarısızlık cel oranını düşürürVerim.
- Deneyleri gerçekleştirmeden önce sıralama ayrıntılarını hücre sıralayıcı operatörüyle tartışın.
Not: Deney sırasında hücre ayırıcı operatörü, sitometre için edinme yazılımının Çalışma Alanı araç çubuğundan bir dizi düğme tıklatmış olacaktır. Bunlar Tarayıcı , Sitometre , Müfettiş , Çalışma Sayfası ve Edinme Gösterge Tablosu'dur . Burada kullanılan hücre ayırma stratejisi 2 yönlü bir sıralama olarak bilinir. İki popülasyon toplanır: zenginleştirilmiş RGC'ler ve diğer tüm hücre türleri. Ek popülasyonlar toplanacaksa, en çok iki popülasyon 4 yönlü bir şekilde ayrılabilir. Ek popülasyonlar toplanırsa, hücre ayırıcı farklı toplama tüpleri ve kurulum gerektirir. - Floroforlardan spektral örtüşme için düzeltme gerçekleştirin.
Not: Bu işlem manuel olarak ayarla yapılabilirHer ayarı yaparsınız veya kullanımdaki yazılımın bir parçası olarak otomatik olarak yapılabilir. Hücre ayırma ekipmanları için kullanılan çoğu yazılım otomatik bir tazminat seçeneğine sahiptir. Altın standart ve en doğru tazminat türüdür. Negatif (floresofor içermeyen) numune ve deneyde kullanılan tüm ilgili monoklonal antikorları bağlamak için spesifik olarak üretilen polysterene mikrokürelerle hazırlanan tek kontroller (basamaklarda) bu aşamada kullanılacaktır.- Deneme> Tazminat Ayarları> Tazminat Kontrolleri Oluştur'u seçin. Ekranda görüntülenen listeden fluorophore'a özgü kontrolleri ekleyin. Tamam'ı tıklayın.
Not: Kontrollerin her biri için bir kompanzasyon tüpü görüntülenir.- Ön dağınık ışığı (FSK), yan saçılmış ışığı (SSC) doğrulamak ve başlangıç popülasyonunu (P1) kontrol etmek için etiketsiz bir kontrol kullanın (hiçbir fluorofor, adım 4.2 ).
- Negatif kontrol tüpünü sitometrenin üzerine yerleştirin ve Yükle'yi tıklayın. İlgi çeken popülasyonun gösterildiğinden emin olun ve seçin. Bu nüfus 1 (P1). P1 kapısını sağ tıklayın ve Tüm Telafi Kontrollerine Uygula'yı seçin. Veri Kaydet'i tıklayın. Kayıt tamamlandıktan sonra, Kaldır'ı tıklayın ve boruyu çıkarın.
- Ekranda gösterildiği gibi bir sonraki tüp sitometrenin üzerine yerleştirilir. Kontrollerden gelen tüm veriler kaydedilinceye kadar 5.6.2. Adımı tekrarlayın.
- Deneme> Tazminat Ayarları> Telafiyi Hesapla'yı seçin . Kurulumu kaydedin ve denemeyi adlandırın. Bağla ve Kaydet'i tıklayın .
Not: Dedektörler arasındaki spektrum örtüşmesini ortadan kaldırdığı için telafi gerekli bir adımdır. - Manuel telafi gerekiyorsa, pozitif sinyaller vasıtalarını eac için negatiflere eşit olacak şekilde ayarlayarak bunu yapınKullanılan florokromlardan saat.
Not: Bu adım, hücre ayırıcı işlemi tarafından gerçekleştirilir ve 30 dakika sürebilir.
- Deneme> Tazminat Ayarları> Tazminat Kontrolleri Oluştur'u seçin. Ekranda görüntülenen listeden fluorophore'a özgü kontrolleri ekleyin. Tamam'ı tıklayın.
- Geçiş stratejisi ( Şekil 3A ).
- FSC'yi SSC'ye göre çizerek P1'i kurun; FSC büyüklüğün göstergesidir ve SSC, hücrelerin dahili karmaşıklığını gösterir. Bkz. Şekil 3A .
- 5.7.1 . Adımda (P1) seçilen popülasyonu kullanarak SSC-H (yükseklik) ile SSC-W (genişlik) arasında bir sahte renk şeması çizin; Yalancı renk çizimi, hücrelerin yoğunluğunun birbirine göre görsel olarak gösterilmesini sağlar.
Not: Düşük hücre yoğunluğu mavi ve yeşil ile gösterilirken, kırmızı ve turuncu bölgeler yüksek hücre yoğunluğunu temsil eder.- Yalnızca tek hücreleri toplamak için bu adımı uygulayın; Tek hücreli kapı P2 olarak adlandırılır. Bkz. Şekil 3A .
- Adım 5.7.2'yi tekrarlamakP2 kullanarak FSC-H'ye karşı FSC-W'yi çizin. Tek hücrelerin "çiftler" ya da hücre yığınları olarak seçilmesinin, yanlış pozitiflik sağlayan pozitif ve negatif bir işaretleyici içerdiğinden emin olun.
- CD48'e karşı CD48'e karşı bir sahte renk şeması çizin. RGC zenginleşmesinden monositleri yok etmek için tüm CD90.2 + CD48 negatif hücrelerini seçin; Bu kapıyı CD90.2 + CD48 negatif veya P3 olarak adlandırın. Bkz. Şekil 3A .
- Seçilen CD90.2 + CD48 negatif popülasyonunu veya P3 kapısını kullanarak, RGC zenginleşmesinden amacinal hücre kontaminantlarını ortadan kaldırmak için CD15'e karşı CD57 pseudocolor bir komutu çizin. CD15 negatif CD57 negatif popülasyonunu kapayın. Bkz. Şekil 3A .
- "Sort Layout" penceresinde örnek için toplanacak popülasyonları tanımlayın ve hücre sıralama işlemine devam edin; Toplamak için örnek CD90.2 + CD48 negatif CD15 negatif CD57 negatif p>.
Not: Sıralama yapılacak popülasyon, sıralama penceresindeki açılan Ekle menüsünden seçilir. Nüfusu ekledikten sonra, hedef olayları veya kaç olay toplanacağını sorar. Herhangi bir zamanda, sıralama düzenini, nüfusu içeren Sıralama Konumu alanını tıklayarak düzenleyebilirsiniz. Genç (5-7 haftalık) ve% 0.5 ± 0.3 ve yaşlı (> 12 aylık) C57BL / 6J farelerden, CD90.2 + CD48 negatif CD15 negatif CD57 negatif fenotipi olan RGC'lerin% 0.9 ± 0.3'ü elde edildi 23 . - 25.000 hücre kullanarak, saflık kontrolü yapın 23 . Bakınız Şekil 3B- E.
Not: Saflık kontrolü, hücre sıralamasının doğruluğunu doğrulamak için sıralanmış hücreleri yeniden analiz etme işlemi olur. Sıralamış hücrelerin küçük bir bölümü, sitometrenin üzerine yüklenerek etkinliğinin doğrulanması sağlanır.
- Hücre içi etiketleme.
- Hücreleri metabolik olarak pasif hale getirmek ve hücre içi antikorların nüfuz etmesine izin vermek için 1 saat süreyle sıralanmış hücreleri düzeltin ve 4 ° C'de permeabilize edin.
- Aşağıdaki antikorları, permeabilizasyon çözeltisinde seyreltin: 100 μg / mL'lik bir stokta 1: 100 seyreltmeyle çoklu ekleme (RBPMS) ile anti-RNA bağlama proteini; Anti-sinüklein gama (SNCG), 1 mg / mL stokta 1: 100; Beyine özgü homeobox / POU alan protein 3A (BRN3A), 1: 100, 200 ug / mL stokta; Ve anti-nörona spesifik sınıf III beta tübülin (TUJ1), 1: 100, 1 mg / mL'lik bir stokta. Hücreleri ve antikor solüsyonlarını kapalı buz kovasında 1 saat inkübe edin.
- Numuneleri iki kez PBS /% 1 FBS ile yıkayın.
- Hücreleri uygun bir AF488 etiketli sekonder antikorda bir buz kovasında 30 dakika süreyle 1: 200 seyreltme ile tekrar süspanse edin.
- Numuneleri, adım 6.1.3'te olduğu gibi yıkayın . Hücreleri tutunPBS /% 1 FBS (250 uL) ilave edin.
7. Hücrenin Validasyonu, qPCR Analizi ile Sırala
Not: Bkz. Şekil 4 .
- RNA ekstraksiyonu 23 .
- Hücre lizisi ve homojenleştirme ile RNA 5.0 x 10 5 sıralanır, ardından kloroform ilave edilir.
- Alkolle çöktürmek için üst, renksiz fazı temiz bir mikrotüpe aktarın, bunu takiben bir spin sütununda konsantrasyon elde edin. Sütun üzerinde DNAse sindirimini yapın.
- RNA elüsyonu için kolonu RNaz içermeyen su ile yıkayın.
- Spektrofotometri ile RNA konsantrasyonunu değerlendirin.
- CDNA sentezi ve ön amplifikasyon.
- 100 ng RNA materyali kullanın ve ters transkriptaz enzimi, rekombinant ribonükleaz inhibitörü (RNA bozunumunu önlemek için), magnezyum klorür (MgCL 2 ) ve deoksinükleotidleri içerir.
- Tüp içeriğini karıştırın ve 25 ° C'de 10 dakika inkübe edin, ardından 42 ° C'de 60 dakika inkübe edin. Reaksiyonu 85 ° C'de 5 dakika inkübasyon ile tamamlayın. Elde edilen cDNA'yı kullanıma hazır olana kadar -20 ° C'de saklayın.
Not: cDNA materyali, ön amplifikasyon basamağı derhal uygulanamazsa, bir aya kadar -20 ° C'de saklanabilir.
- CDNA'nın ön amplifikasyonu.
- CDNA materyalini Referans 23 ve Tablo'da detaylandırıldığı gibi retina ganglion hücreleri, amacrine hücreleri, astrositler, Müller, bipolar, yatay, fotoreseptörler ve retinal pigment epitel hücreleri dahil olmak üzere çoklu retinal hücre tipleri için spesifik bir dizi primer kullanarak önceden amplifiye edin Malzemeler .
Not: Ön amplifikasyon reaksiyonu, miktar tespiti için duyarlılığı arttırmak için hazırlanmıştır. Ön amplifikasyon reaksiyonu, primerinMalzeme Tablosundan harmanlar; 100 ng RNA'da başlayan 2.5 uL cDNA; Ters transkriptaz enzimi; Ve 10 uL'lik nihai bir hacimde nükleaz içermeyen su. - Enzim aktivasyon basamağını 95 ° C'de 10 dakika boyunca uygulayın, bunu takiben 95 ° C'de 15 saniye süreyle 14 döngü takiben 4 dakika 60 ° C uygulayın. Önceden güçlendirilmiş materyali 1:10 oranında Tris EDTA tamponunda seyreltin ve kullanıma hazır olana kadar -20 ° C'de saklayın.
- CDNA materyalini Referans 23 ve Tablo'da detaylandırıldığı gibi retina ganglion hücreleri, amacrine hücreleri, astrositler, Müller, bipolar, yatay, fotoreseptörler ve retinal pigment epitel hücreleri dahil olmak üzere çoklu retinal hücre tipleri için spesifik bir dizi primer kullanarak önceden amplifiye edin Malzemeler .
- 7.4 qPCR reaksiyonu.
- Seyreltilmiş, önceden güçlendirilmiş cDNA (2.5 μL), primerler ( Malzemelerin Tablosunda listelenmiştir), nükleaz içermeyen su ve DNA polimeraz ve deoksinükleotitler içeren bir konsantre kullanılarak 10 μL son hacimdeki tüm qPCR reaksiyonlarını hazırlayın.
- QPCR'yi çalıştırmak için aşağıdaki enstrüman koşullarını kullanın: 2 dakika boyunca 50 ° C'de tutma basamağı, ardından 10 dakika boyunca 95 ° C. 95 ° C'de 15 saniye boyunca, ardından 60 ° C'de 1 dakika boyunca toplam 40 devir çalıştırın. Tüm ölçüleri uygulaEments üç kopyalar halinde.
- Her bir numunede oda temizliği geni ve hedef genler için C T değerlerini belirledikten sonra karşılaştırma eşiğini (C T ) kullanarak göreceli niceleme uygulayın. Aşağıdaki denklemi kullanarak göreli katlanma değişimini (R q ) hesaplayın: R q = 2 T -ΔC , burada ΔC T = C T hedef gen - C T referans geni 23 .
Not: C T , raportör boyasının flüoresan sinyalinin keyfi olarak yerleştirilmiş bir eşiği 26 geçtiği PCR döngüsü olarak tanımlanır. C T , tepkimedeki amplikon (PCR ürünü) miktarıyla ters orantılıdır.
Sonuçlar
RGC'lerin derinlemesine incelenmesi, düşük frekansları ve izolasyonları için sağlam ve standartlaştırılmış bir metodolojinin olmaması da dahil olmak üzere birçok faktör tarafından engellenmektedir. Şekil 1 , retina izolasyonu için kullanılan metodolojiyi göstermektedir. Enükleasyon prosedüründeki değişiklikler, enükleasyon in vivo deneyin bir parçası olup olmadığı gibi analiz türüne dayanır 27 . Bu protokoldeki enükleasyon, ötenazen farelerde gerçekleştirilir. Şekil 1A -B'de gösterildiği gibi, forseps gözün altına yerleştirilir ve asgari kanamaya neden olmak için yukarı doğru çekilir ve sağlam bir optik siniri olan bir göz küresi çıkarılır.
Farklı fare suşlarındaki RGC sayısındaki, özellikle genetik olarak değiştirilmiş farelerde 23 , 28 ,Ef "> 29 , 30. Bu farklılıkların farkında olmak, kullanılacak farelerin sayısını belirlerken önemlidir Eski C57BL / 6J farelerden alınan retina, genç yaş grubuna göre daha az sayıda canlı retinal hücreye sahiptir 23 Bu nedenle, retina diseksiyonu dikkatlice yapılmalıdır Hücre verimini en üst düzeye çıkarın.RTT diseksiyonu için adım adım prosedür Şekil 1C- J'de sunulmuştur.Retinal hücreler kırılgandır.Böylece disseke retinalar naylon süzgeçlere yerleştirilir veya şırınganın arka ucu ile maceraya tabi tutulur; Şekil 2A'da gösterilen ya da hücre süzgeçleri için bir havaneli hücre süzgeci doğrudan hücrenin süzgeçte macerasyonu hızlıdır ve hücre kümelerini azaltır.Hücre süspansiyonunun temsili bir görüntüsü Şekil 2B'de gösterilmiştir, Çoklu iç retina hücreleri görselleştirilebilir. Bu noktada, RGCler imza morfolojisini kaybettilerHücre izolasyonu sırasında aksotomi ve hücre süspansiyonunun hazırlanması nedeniyle.
Bu metodolojinin en emek yoğun olan adımı hücre sıralama ayarıdır. Bu faz, çok renkli FACS sırasında sinyal-gürültü çözünürlüğünü en üst düzeye çıkaran kritik bir adımdır. Şekil 3A , RGC'lerin izolasyonu için kullanılan geçiş stratejisini göstermektedir. Bu strateji, monosit, glial, amacrine ve fotoreseptör hücreleri içeren kirletici hücrelerin hücre süspansiyonundan uzaklaştırılmasını hedef aldı. Metodolojinin bir parçası olarak ek yüzey markörleri, dışlama stratejisinin bir parçası olarak kullanılmadan önce immünhistokimyasal analizle teyit edildi. Önceki veriler CD90.2 + hücrelerinin küçük bir yüzdesinin CD48 + olduğunu göstermiştir . Bu hücrelerin dışlanması monositleri ve muhtemelen mikrogliayı retinadaki hücre havuzundan çıkardı. Daha önce klasik Thy1 + CD48 negatif yüzey fenotipi, bu hücreler amacrine, Müller, bipolar, yatay fotoreseptör ve retinal pigment epitel hücreleriyle ilişkili genleri eksprese ettiği için fare RGC'lerini tanımlamak ve izole etmek için yeterli değildir ( Şekil 4A ). Bu durum, hücre eksklüzyonu için ek belirteçlerin araştırılmasıyla da ele alınmaktadır. CD15, amacrine ve bipolar hücrelerin 31 bir markeri olarak tanımlandı ve negatif seleksiyon için ilave bir marker olarak kullanımına neden oldu. Uusitalo ve ark. 32 , glial hücreler ve fotoreseptörler için bir tanımlama markörü olarak CD57'yi tanımladı. Bu nedenle, bu antikor hücre ayırma stratejisine eklendi.
Daha sonra, bu hücreler, fare RGC'lerinin izolasyonu için kullanılan metodolojiyi doğrulamak üzere karakterize edildi. CD90.2 + CD48 negatif CD15 negatif CD57 negatif sıralı hücrelerin fenotipleri (<Şekil 3B), RGC 10 , 11 , 12 , 33 ile bağlantılı aşağıdaki hücre içi markörlerin ekspresyonu için değerlendirildi: SNCG, BRN3A, TUJ1 ve RBPMS. Şekil 3C'de gösterildiği gibi, sıralanmış hücreler dört RGC ile ilişkili hücre içi proteinleri ifade etmiştir. Daha sonra, Şekil 3D'de RBPMS'nin hücre içi lokalizasyonu ve CD90.2'nin hücre yüzeyi ekspresyonunu göstermek için görüntüleme akış sitometrisi kullanıldı. Bu sonuçlar çoğaltılabilirlik ve standardizasyonu teyit eden çoklu sitometri sistemlerinde test edildi. Şekil 3E'de gösterildiği gibi, sıralanmış hücrelerin bir kısmı, in vitro hücre kültüründen sonra RGC'lerle ilişkili morfolojiyi göstermeye başlamıştır.
Son olarak, zenginleşmeden ve post-ce'den önce hücrelerin karşılaştırılmasıAnaliz, qPCR analizi ile gerçekleştirildi. Thy1 + CD48 neg fenotipinin CD90.2 + CD48 negatif CD15 negatif CD57 negatif sıralı hücrelere kıyaslanması, Thy1 + CD48 negatif fenotipin RGC'lerle ilişkili genleri değil diğer retinal hücrelerle de ifade ettiğini ortaya koymuştur. Bununla birlikte, zenginleştirilmiş sıralanmış hücre popülasyonu ( Şekil 4B ), Sncg (SNCG), Pouf4l (BRN3A), Tubb3 (TUJ1) ve Rbpms (RBPMS) RGC'ye spesifik hücre içi işaretleyicilerini kodlayan genlerde çok katlı bir artış gösterdi. Toplu olarak, mRNA ve protein değerlendirmeleri metodolojiyi doğrulamıştır.
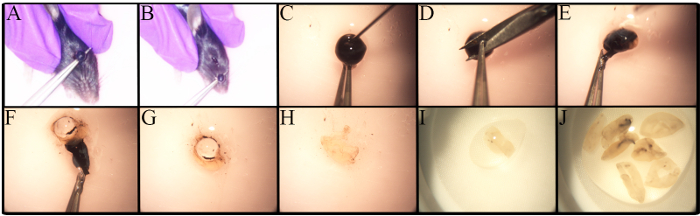
Şekil 1 . Retinal İzolasyon için Enükleasyon ve Oküler Diseksiyon. Genç C57BL / 6J fareleri tO CO 2 ve servikal dislokasyon ile göz küresinin çıkarılması. A) Gözün altına forseps yerleştirin ve gözü tek bir hareketle yukarı çekin. B) Göz optik sinir de dahil olmak üzere çıkarılır. CJ) Retinayı kaldırmak için adım adım kılavuz. C) Ponksiyon, sulu mizahın gözlerden çıkmasına izin vermek için korneanın çıkarılmasından önce bir 30G iğne kullanılarak yapılır. D) Küçük bir kesi yapmak için kornea forseps ile tutulur. EF) Forseps kullanımı, korneanın, retinal pigment epitelyumun, koroidin ve skleranın soyulmasını sağlar. Retina skleradan koparılır, yuvarlanır ve çıkarılır. G) Objektif çıkarılır ve atılır. HJ) Toplanan retina, her zaman onları nemli tutmak için PBS /% 1 FBS içeren küçük bir çanak yerleştirilir. Bunun daha büyük bir sürümünü görmek için lütfen buraya tıklayınız.rakam.
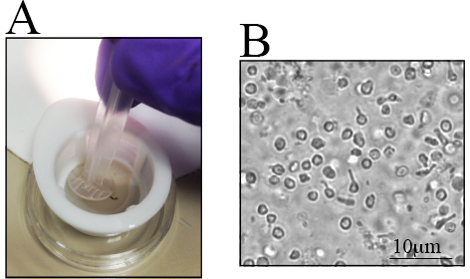
Şekil 2 . Toplanan Retina Üretimi Sonrası Retinal Hücre Süspansiyonu. Toplanan retina, hücreleri izole etmek için küçük bir tabağa konur. A) Retina 70 μm'lik bir naylon süzgeç içine yerleştirilir ve bir şırınganın arka ucunu kullanarak yumuşatılır. B) Farklı retinal hücrelerin bulunduğu hücre süspansiyonunun temsili görüntüsü. Ölçek çubuğu 10 μm'dir.

Şekil 3 . CD90.2 + CD48 negatif CD15 negatif CD57 ile Hücrelerin İzolasyonu için Sıralama Stratejisi negatif fenotip ve post-sıralama analizi. Sıralama stratejisi CD90.2 hücrelerinin dahil edilmesine ve kirletici hücreler olan CD48, CD15 ve CD57 pozitif hücrelerin hariç tutulmasına dayanır. A) İlk adım olarak, hücre popülasyonuna genel bir bakış sağlamak için parsel büyüklüğü (FSC) ve dahili karmaşıklık (SSC). Başlangıç kapılı nüfus (P1), SSC-yüksekliği (H) genişliğe (W), P2 göre tek hücreli ve yığılmış hücreler veya agregalar arasında ayrım yapmak için kullanılır. Tek hücre seçimi CD90.2 + CD48 negatif hücrelerini seçmek için kullanılır. Tüm çiftleşmelerin giderildiğini teyit etmek için FSC-H'ye karşı FSC-W'ye ait bir arsa, P3 ( orta panel) uygulanır. Hücreler, AF700 konjuge anti-fare CD90.2, PE-Siyanin7-konjuge anti-fare CD48, PE-konjuge CD15 ve anti-fare CD57 ile etiketlendi. Anti-fare CD57'sini etiketlemek için ikincil bir antikor olarak anti-fare BV421 kullanıldı. Nüfus 3 (P3) dördüncü </ Em> panelinden CD90.2 + CD48 negatif hücrelerini seçerek kirletici hücrelerin çoğunu kaldırın. Daha sonra, seçilen CD90.2 + CD48 negatif hücreleri kullanılarak bir CD57 karşı CD15 arsası üretilir. Çeyrek 4 (Q4), hem CD15 hem de CD57 için negatif olan CD90.2 + CD48 negatif hücreleri temsil ettiği için seçilir. Kapılı nüfusun sonuç fenotipi CD90.2 + CD48 negatif CD15 negatif CD57 negatiftir. B) A) 'da kullanılan yüzey markörlerinin sıralama sonrası analizi. Sıralama panelleri ilk panelde gösterildiği gibi homojen boyuttadır. Sonraki histogramlar, A) 'da ayrıntılandırılan sıralama stratejisinde kullanılan her bir yüzey markörünün yüzdesini gösterir. Hücrelerin toplam% 95'i, katı histogramla temsil edilen Ig kontrolüne kıyasla siyah çizgide gösterildiği gibi CD90.2 + ' dır. Bu hücreler, CD48, CD15 ve CD57'nin kırmızı, mavi ve gree ile temsil edilen yüzdelerini değerlendirmek için kapılandıN sırasıyla. Sonuçlar, bu hücre yüzeyi markörlerinin minimal ekspresyonunu göstermektedir. C) RGC fenotipinin, SNCG, BRN3A, TUJ1 ve RBPMS'nin RGC'ye özgü hücre içi markörleri kullanılarak teyidi. Siyah çizgiler, her hücreiçi işaretleyiciyi ifade eden hücrelerin yüzdesini temsil eder. D) Bir RGP'ye spesifik intrasellüler işaretleyici olan RBPMS'nin hücre içi lokalizasyonu ve hücre yüzeyi markörü CD90.2 gösteren bir görüntüleme hücresi sıralayıcıda alınan temsili görüntüler. Ölçek çubuğu 20 μm'dir. E) Konfokal mikroskop kullanılarak kültürde 24 saat sonra sıralanmış RGC'lerin temsili görüntüsü. Ölçek çubuğu 20 μm'dir. Images BE, daha önce yayınlanmış izin belgesiyle uyarlanmıştır 23 . Resimler DE 20X'de çekildi. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.

Şekil 4 . Önceden ve Post-sıralama mRNA Analizi. CD90.2 + CD48 negatif CD15 negatif CD57 negatif fenotipi olan Thy1 + CD48 negatif ve sınıflandırılmış hücreler, retinal hücreler tarafından eksprese edilen 25 gen panelini kullanarak qPCR analizi ile değerlendirildi. Hedef gen ekspresyon seviyeleri, Hprt'yi bir temizlik geni ve su olarak negatif bir kontrol olarak kullanan Log 2 kat değişikliği olarak sunulmaktadır. Hesaplama, ΔC T yöntemine dayanılarak yapılmıştır. Ortalama ± SEM; N = 3 biyolojik çoğaltma üçlü olarak gerçekleştirildi. Daha önce yayımlanmış izinle yapılan çalışmadan elde edilen rakamlar 23 .
Tartışmalar
FACS, hücre popülasyonlarını saflaştırmak için tercih edilen bir tekniktir. Diğer izolasyon yöntemleri arasında bağışıklık kazandırma, manyetik boncuklar ve kompleman sabitleme tükenmesi bulunur. FACS'nin bu diğer metodolojilere göre avantajı, değişik derecelerde yoğunluk gösteren hücre yüzeyi markörlerinin eşzamanlı tanımlanmasına dayanır. Molekülün flüoresan yoğunluğu protein ifade miktarı ile orantılıdır. Şimdiye dek, RGC'lerin izolasyonu kullanılan izolasyon yöntemine bakılmaksızın sadece Thy1 (CD90) pozitifliği ve CD48 negatifliği 15 , 16 , 22 , 34'e dayanıyordu. Son zamanlarda, Thy1 + CD48 negatif fenotipin, RGC hücreiçi işaretleyicilerini ifade eden homojen bir hücre popülasyonunu izole etmek için yeterli olmadığı gösterilmiştir 23 . RGC nüfusunun belirlenmesi, onların izolasyonu için özellikle önemlidirY çünkü retinal hücreler 7 , 8 , 9'un küçük bir yüzdesini oluştururlar. RGC'lerin çoğunluğu retina'nın en içteki tabakasında bulunurken, iç kısımdaki pleksiform tabakalarda (yerinden edilmiş RGC'ler 35 ) az sayıda bulunur. Bu nedenle, üstün koliküllerden stereotaktik enjeksiyonlarla RGC'leri izlemek ve hidroksystillbamidine (nöronları özetleyen retrograd bir izleyici) ile izlemek birçok laboratuvar için çekici seçimler haline geldi 36 , 37 , 38 . Bu sistemler, eğer doğru yapılmazlarsa, bazı retinal bölgelerin izi bırakılmasına neden olan tracer enjeksiyonunu gerektirir. Buna ek olarak, daha teknik olarak talep ederler ve bağışıklama gibi diğer metodolojiler gibi uzun sürelerdir. Anti-Thy1 ve -CD48 antikorlarını kullanarak immünoplanmanın tamamlanması 48 saat sürer ve 95'den fazla antikor elde edilemez% saflık. Bu çalışma, CD90.2 + CD48 negatif CD15 negatif CD57 neg fenotipi ile canlı RGC'lerin homojen bir popülasyonunu izole etmek için herhangi bir izleyici, manyetik boncuk veya immünopanlama tekniği kullanmadan hızlı ve tekrarlanabilir bir protokol sunan bir FACS tabanlı metodoloji tanımlamaktadır .
Saf RGC'lerin FACS tarafından başarıyla izole edilmesi için aşağıdaki faktörler gereklidir: 1) kullanılan ekipmana büyük oranda bağlı olan sıralama etkinliği; 2) gürültüyü en aza indirgemek için, antikorla etiketlenmiş florokromların optimum kombinasyonu; Ve 3) hücre ayırma düzeni. Sıralama etkinliği, sıralama için seçilen hedef olayların sayısını bölünerek tespit edilen hedef olayların sayısına bölünerek yüzde olarak ifade edilir. Sınıf etkinliği, ekipman tarafından sağlanan bir hesaplamadır. Bu verimlilik, sıralama sisteminin kurulmasına ve hücre sıralama moduna bağlıdır. Optimum florokrom kombinasyonunu seçmek karmaşık bir süreçtir. Her gripOrokrom ayrı özelliklere sahiptir ve uyarım ve emisyon dalga boyları ile karakterizedir. Uyarıcı bir lazerle okunurken, emisyon, FACS ayırma donanımında bulunan optik filtrelerle sınırlandırılan foto-çoğaltıcı tüplerle okunur. Burada, antikorla etiketlenmiş florokromlar PE, PE-Siyanin 7, AF700 ve BV421'in bir kombinasyonu sağlanmıştır. Bu, spektral örtüşmeyi azaltırken en iyi çözünürlüğü sağlayan çoklu florokrom kombinasyonlarını düşündükten sonra belirlendi. Son olarak, sıralama kurulumu kritiktir. Genel olarak, retina hücreleri kırılabilir. Bu nedenle, hücreler üzerindeki gerilimi en aza indirgemek için numuneleri çalıştırmak için daha düşük bir basınç kullanmak daha iyidir. 4 ° C'de numunenin tutulması kritik önem taşır çünkü oda sıcaklığında uzun süre murin RGC'lerin tutulması özellikle çok sayıda hücreyi ayırırken hücre verimini düşürebilir.
FACS tabanlı sıralama, avans oluşturan hücrelerin izolasyonu için ideal bir metodolojidir.Hücre süspansiyonunun küçük bir yüzdesi. Retina diseksiyonundan hücre ayırma işleminin tamamlanmasına kadar olan süreç, tamamlanması günlerce geçen ımmunopanning ve tracer sistemlerine kıyasla yaklaşık 5-6 saat sürer. FACS'nin çok boyutlu analizi ve ekipmanın birkaç canlı popülasyonu toplaması, hücrelerin daha işlevsel analizlerine izin verir. Burada açıklanan protokol, primer murin RGC'lerin izolasyonu için güçlü bir araçtır. Hassasiyeti, tekrarlanabilirliği ve canlı hücrelerin derhal tanımlanması dahil olmak üzere birçok avantajına rağmen bazı kısıtlamalar bulunmaktadır. Birincisi, pahalı aletler ve çok eğitimli bir operatör gerektirir. Genellikle, operatör, alanda deneyimli bir kimseyle kurulmuş bir immünolog veya deneyimli bir kişidir. Günümüzde, akademik tesislerin, bu tür deneyleri gerçekleştirmeyi kolaylaştırabilecek çok sayıda çekirdek tesisi bulunmaktadır. İkincisi, RGC'ler kaybederAtakomiye bağlı piküler morfoloji, onları çok küçük boyutlarda kılar. Şu anda, atoksomi nedeniyle genlerinden bazılarının modüle edilebileceği bilinmiyor.
Burada sunulan metodoloji , in vitro RGC fonksiyonunun aşağı doğru analiz edilmesini sağlar ve görsel ve sağlık bilimleri alanlarında kullanılmak için değerli bir araçtır. Görme algılaması için beynin gangliyon hücresi çıktısının korunması gereklidir ve birden fazla hastalıkta risk altındadır. Bu hücreler hem sağlıklı hem de hastalık modellerinde kontrollü in vitro deneyler için kullanılabilir. Bu hücreler üzerinde elektrofizyolojik, farmakolojik, biyokimyasal ve moleküler araştırmalar yapılabilir ve gelecekteki tedavi hedeflerinin geliştirilmesi için idealdir.
Açıklamalar
Yazarlar rakip mali çıkarlarının olmadığını beyan ettiler.
Teşekkürler
Yazarlar teknik video yardımı için Mikrobiyoloji, İmmünoloji ve Biyokimya Bölümü'nden Kıdemli Illustrator Sayın Tim Higgins'e teşekkür etmek istiyorlar; Matthew W. Wilson'la tartışmalar ve Jablonski ve Morales-Tirado laboratuvarlarının üyeleri, yararlı yorumları için teşekkür eder. Bu çalışma, Alcon Araştırma Enstitüsü Genç Araştırmacı Ödülü (VMM-T), Tennessee Araştırma Vakfı (VMM-T) Üniversitesi, Ulusal Göz Enstitüsü EY021200 (MMJ), Gerwin Kardeşliği (VMM-T) tarafından desteklendi; Gerwin Ön Doktora Arkadaş Grubu (ZKG), Savunma Ordusu Tıbbi Araştırma ve Materiel Komutanlığı (VMM-T) ve Körlüğü Önleme Araştırması'ndan Sınırsız Hibe.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Anti-mouse CD15 PE | BioLegend | 125606 | Clone MC-480 |
| Anti-mouse CD48 PE-Cy7 | BioLegend | 103424 | Clone HM48-1 |
| Anti-mouse CD57 | Sigma Aldrich | C6680-100TST | Clone VC1.1 |
| Anti-mouse CD90.2 AF700 | BioLegend | 105320 | Clone 30-H12 |
| Brilliant Violet 421 Goat Anti-mouse IgG | BioLegend | 405317 | Clone Poly4053 |
| Purified Anti-mouse CD16/32 | BioLegend | 101302 | FcgRII/III block, Clone 93 |
| Zombie Aqua | BioLegend | 423102 | Live cell/ Dead cell discrimination |
| Fetal Bovine Serum | Hyclone | SH30071.03 | U.S. origin |
| AbC Total Antibody Compensation Bead Kit | Thermo Fisher Scientific | A10497 | Multi-species Ig |
| Neurobasal Medium | Thermo Fisher Scientific | 21103049 | Add serum to media prior to culture. |
| Phosphate-Buffered Saline (PBS) | Thermo Fisher Scientific | 10010049 | Saline solution |
| Dissection Microscope | Olympus | SZ-PT Model | Stereo Microscope |
| Sorvall Centrifuge | Thermo Scientific | ST 16R | All centrifugation performed at RT |
| Base Plate – Dissection Pan | Fisher Scientific | SB15233FIM | A wax plate can also be used |
| Forceps | Aesculap | 5002-7 | 4 ½ inches |
| Iris Scissors, Straight | Aesculap | 1360 | 5 ½ inches |
| Falcon 15 mL conical tubes | Fisher Scientific | 352097 | Polypropylene tubes |
| Falcon 50 mL conical tubes | Fisher Scientific | 352098 | Polypropylene tubes |
| BD FACS Tubes | Fisher Scientific | 352003 | Polypropylene tubes |
| 40 mm dishes | MidSci | TP93040 | Tissue culture treated |
| 70 μm nylon strainer | MidSci | 70ICS | sterile |
| 40 μm nylon strainer | MidSci | 40ICS | sterile |
| BD 10 mL syringe | Fisher Scientific | 301604 | Disposable Syringe without needle |
| Pestles | MidSci | PEST | sterile |
| Wheaton Vials | Fisher Scientific | 986734 | No Liner |
| BD 30 G needle | Fisher Scientific | 305128 | 1 inch |
| Hausser Scientific Bright-Line Glass Counting Chamber | Fisher Scientific | 0267151B | Hemocytometer |
| Gibco Trypan blue 0.4% Solution | Fisher Scientific | 15250061 | Viability Dye |
| Eppendorf tubes | Fisher Scientific | 05-402-25 | 1.5mL |
| EVOS Floid Cell Imaging | Thermo Fisher Scientific | 447113 | Fluorescence Imaging with a 20X objective |
| 100% Ethanol | Fisher Scientific | 04-355-452 | Used to make 70% Ethanol |
| Pipet-Lite LTS Pipette L-1000XLS+ | Rainin | 17014282 | LTS Pipette |
| Pipet-Lite LTS Pipette L-200XLS+ | Rainin | 17014391 | LTS Pipette |
| Pipet-Lite LTS Pipette L-20XLS+ | Rainin | 17014392 | LTS Pipette |
| Rack LTS 1000 mL – GPS-L1000S | Rainin | 17005088 | Blue Rack Sterile Tips |
| Rack LTS 250 mL – GPS-L250S | Rainin | 17005092 | Green Rack Sterile Tips |
| Rack LTS 20 mL – GPS-L10S | Rainin | 17005090 | Red Rack Sterile Tips |
| FACSAria II Cell Sorter | BD Biosciences | N/A | Custom order |
| LSR II Cytometer | BD Biosciences | N/A | Custom order |
| Abca8a | Thermo Fisher Scientific | Mm00462440_m1 | Müller cells |
| Aldh1al | Thermo Fisher Scientific | Mm00657317_m1 | Müller cells |
| Aqp4 | Thermo Fisher Scientific | Mm00802131_m1 | Astrocytes |
| Calb2 | Thermo Fisher Scientific | Mm00801461_m1 | Amacrine, Horizontal |
| Cd68 | Thermo Fisher Scientific | Mm03047340_m1 | Retinal Pigment Epithelial Cells |
| Gad2 | Thermo Fisher Scientific | Mm00484623_m1 | Amacrine |
| Hprt | Thermo Fisher Scientific | Mm01545399_m1 | House keeping gene |
| Lhx1 | Thermo Fisher Scientific | Mm01297482_m1 | Horizontal |
| Lim2 | Thermo Fisher Scientific | Mm00624623_m1 | Horizontal |
| Nrl | Thermo Fisher Scientific | Mm00476550_m1 | Photoreceptors |
| Ntrk1 | Thermo Fisher Scientific | Mm01219406_m1 | Horizontal |
| Pcp4 | Thermo Fisher Scientific | Mm00500973_m1 | Bipolar, Amacrine |
| Pou4f1 | Thermo Fisher Scientific | Mm02343791_m1 | Retinal Ganglion Cells |
| Prdx6 | Thermo Fisher Scientific | Mm00725435_s1 | Astrocytes |
| Prkca | Thermo Fisher Scientific | Mm00440858_m1 | Bipolar |
| Prox1 | Thermo Fisher Scientific | Mm00435969_m1 | Horizontal |
| Pvalb | Thermo Fisher Scientific | Mm00443100_m1 | Amacrine |
| Rbpms | Thermo Fisher Scientific | Mm02343791_m1 | Retinal Ganglion Cells |
| Rom1 | Thermo Fisher Scientific | Mm00436364_g1 | Photoreceptors |
| Rpe65 | Thermo Fisher Scientific | Mm00504133_m1 | Retinal Pigment Epithelial cells |
| Slc1a3 | Thermo Fisher Scientific | Mm00600697_m1 | Astrocytes |
| Slc6a9 | Thermo Fisher Scientific | Mm00433662_m1 | Amacrine |
| Sncg | Thermo Fisher Scientific | Mm00488345_m1 | Retinal Ganglion Cells |
| Tubb3 | Thermo Fisher Scientific | Mm00727586_s1 | Retinal Ganglion Cells |
| Vim | Thermo Fisher Scientific | Mm01333430_m1 | Müller cells |
| Taqman Universal Master Mix | Thermo Fisher Scientific | 4440047 | qPCR Reagent |
| miRNeasy Mini Kit | Qiagen | 217004 | RNA Isolation |
| SuperScript VILO cDNA Synthesis Kit | Thermo Fisher Scientific | 11754250 | cDNA synthesis |
| Taqman PreAmp Master Mix | Thermo Fisher Scientific | 4391128 | Pre-Amplification step |
| BD Cytofix/ Cytoperm | BD Biosciences | 554714 | Fixation/ Permeabilization Buffer |
| BD Perm/ Wash | BD Biosciences | 554723 | Permeabilization Solution |
| RBPMS | Santa Cruz Biotechnology | sc-86815 | intracellular antibody |
| SNCG | Gene Tex | GTX110483 | intracellular antibody |
| BRN3A | Santa Cruz Biotechnology | sc-8429 | intracellular antibody |
| TUJ1 | BioLegend | 801202 | intracellular antibody |
Referanslar
- Flammer, J., Orgul, S. Optic nerve blood-flow abnormalities in glaucoma. Prog Retin Eye Res. 17 (2), 267-289 (1998).
- Bathija, R. Optic nerve blood flow in glaucoma. Clin Exp Optom. 83 (3), 180-184 (2000).
- Osborne, N. N., Melena, J., Chidlow, G., Wood, J. P. A hypothesis to explain ganglion cell death caused by vascular insults at the optic nerve head: possible implication for the treatment of glaucoma. Br J Ophthalmol. 85 (10), 1252-1259 (2001).
- Morgan, J. E. Circulation and axonal transport in the optic nerve. Eye (Lond). 18 (11), 1089-1095 (2004).
- Tian, N., Hwang, T. N., Copenhagen, D. R. Analysis of excitatory and inhibitory spontaneous synaptic activity in mouse retinal ganglion cells. J Neurophysiol. 80 (3), 1327-1340 (1998).
- Schmidt, K. G., Bergert, H., Funk, R. H. Neurodegenerative diseases of the retina and potential for protection and recovery. Curr Neuropharmacol. 6 (2), 164-178 (2008).
- Dreher, B., Sefton, A. J., Ni, S. Y., Nisbett, G. The morphology, number, distribution and central projections of Class I retinal ganglion cells in albino and hooded rats. Brain Behav Evol. 26 (1), 10-48 (1985).
- Williams, R. W., Strom, R. C., Rice, D. S., Goldowitz, D. Genetic and environmental control of variation in retinal ganglion cell number in mice. J Neurosci. 16 (22), 7193-7205 (1996).
- Jeon, C. J., Strettoi, E., Masland, R. H. The major cell populations of the mouse retina. J Neurosci. 18 (21), 8936-8946 (1998).
- Surgucheva, I., Weisman, A. D., Goldberg, J. L., Shnyra, A., Surguchov, A. Gamma-synuclein as a marker of retinal ganglion cells. Mol Vis. 14, 1540-1548 (2008).
- Nadal-Nicolas, F. M., et al. Brn3a as a marker of retinal ganglion cells: qualitative and quantitative time course studies in naive and optic nerve-injured retinas. Invest Ophthalmol Vis Sci. 50 (8), 3860-3868 (2009).
- Kwong, J. M., Caprioli, J., Piri, N. RNA binding protein with multiple splicing: a new marker for retinal ganglion cells. Invest Ophthalmol Vis Sci. 51 (2), 1052-1058 (2010).
- Van Bergen, N. J., et al. Recharacterization of the RGC-5 retinal ganglion cell line. Invest Ophthalmol Vis Sci. 50 (9), 4267-4272 (2009).
- Wood, J. P., Chidlow, G., Tran, T., Crowston, J. G., Casson, R. J. A comparison of differentiation protocols for RGC-5 cells. Invest Ophthalmol Vis Sci. 51 (7), 3774-3783 (2010).
- Barres, B. A., Silverstein, B. E., Corey, D. P., Chun, L. L. Immunological, morphological, and electrophysiological variation among retinal ganglion cells purified by panning. Neuron. 1 (9), 791-803 (1998).
- Hong, S., Iizuka, Y., Kim, C. Y., Seong, G. J. Isolation of primary mouse retinal ganglion cells using immunopanning-magnetic separation. Mol Vis. 18, 2922-2930 (2012).
- Julius, R. S. The sensitivity of exponentials and other curves to their parameters. Comput Biomed Res. 5 (5), 473-478 (1972).
- Reif, A. E., Allen, J. M. The Akr Thymic Antigen and Its Distribution in Leukemias and Nervous Tissues. J Exp Med. 120, 413-433 (1964).
- Watanabe, M., Noguchi, T., Tsukada, Y. Regional, cellular, and subcellular distribution of Thy-1 antigen in rat nervous tissues. Neurochem Res. 6 (5), 507-519 (1981).
- Haeryfar, S. M., Hoskin, D. W. Thy-1: more than a mouse pan-T cell marker. J Immunol. 173 (6), 3581-3588 (2004).
- Sahagun, G., Moore, S. A., Fabry, Z., Schelper, R. L., Hart, M. N. Purification of murine endothelial cell cultures by flow cytometry using fluorescein-labeled griffonia simplicifolia agglutinin. Am J Pathol. 134 (6), 1227-1232 (1989).
- Shoge, K., et al. Rat retinal ganglion cells culture enriched with the magnetic cell sorter. Neurosci Lett. 259 (2), 111-114 (1999).
- Chintalapudi, S. R., et al. Isolation and Molecular Profiling of Primary Mouse Retinal Ganglion Cells: Comparison of Phenotypes from Healthy and Glaucomatous Retinas. Front Aging Neurosci. 8, 93(2016).
- Nagdeve, N. G., Yaddanapudi, S., Pandav, S. S. The effect of different doses of ketamine on intraocular pressure in anesthetized children. J Pediatr Ophthalmol Strabismus. 43 (4), 219-223 (2006).
- Ding, C., Wang, P., Tian, N. Effect of general anesthetics on IOP in elevated IOP mouse model. Exp Eye Res. 92 (6), 512-520 (2011).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative C(T) method. Nat Protoc. 3 (6), 1101-1108 (2008).
- Aerts, J., Nys, J., Arckens, L. A highly reproducible and straightforward method to perform in vivo ocular enucleation in the mouse after eye opening. J Vis Exp. (92), e51936(2014).
- Li, X., et al. Loss of AP-2delta reduces retinal ganglion cell numbers and axonal projections to the superior colliculus. Mol Brain. 9 (1), 62(2016).
- Moshiri, A., et al. Near complete loss of retinal ganglion cells in the math5/brn3b double knockout elicits severe reductions of other cell types during retinal development. Dev Biol. 316 (2), 214-227 (2008).
- Danias, J., et al. Quantitative analysis of retinal ganglion cell (RGC) loss in aging DBA/2NNia glaucomatous mice: comparison with RGC loss in aging C57/BL6 mice. Invest Ophthalmol Vis Sci. 44 (12), 5151-5162 (2003).
- Jakobs, T. C., Ben, Y., Masland, R. H. CD15 immunoreactive amacrine cells in the mouse retina. J Comp Neurol. 465 (3), 361-371 (2003).
- Uusitalo, M., Schlotzer-Schrehardt, U., Kivela, T. Ultrastructural localization of the HNK-1 carbohydrate epitope to glial and neuronal cells of the human retina. Invest Ophthalmol Vis Sci. 44 (3), 961-964 (2003).
- Jackson, C. J., Garbett, P. K., Nissen, B., Schrieber, L. Binding of human endothelium to Ulex europaeus I-coated Dynabeads: application to the isolation of microvascular endothelium. J Cell Sci. 96 ( Pt 2), 257-262 (1990).
- Pennartz, S., Perraut, M., Pfrieger, F. Purification of retinal ganglion cells from postnatal rats by magnetic cell sorting. MACSmore. 12 (2), 16-18 (2010).
- Nadal-Nicolas, F. M., et al. Displaced retinal ganglion cells in albino and pigmented rats. Front Neuroanat. 8, 99(2014).
- Nadal-Nicolas, F. M., Salinas-Navarro, M., Vidal-Sanz, M., Agudo-Barriuso, M. Two methods to trace retinal ganglion cells with fluorogold: from the intact optic nerve or by stereotactic injection into the optic tract. Exp Eye Res. 131, 12-19 (2015).
- Barnstable, C. J., Drager, U. C. Thy-1 antigen: a ganglion cell specific marker in rodent retina. Neuroscience. 11 (4), 847-855 (1984).
- Chiu, K., Lau, W. M., Yeung, S. C., Chang, R. C., So, K. F. Retrograde labeling of retinal ganglion cells by application of fluoro-gold on the surface of superior colliculus. J Vis Exp. (16), (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır