Method Article
Isolamento de células de gânglio retiniano murino primário (RGCs) por citometria de fluxo
Neste Artigo
Resumo
Milhões de pessoas sofrem de doenças degenerativas da retina que resultam em cegueira irreversível. Um elemento comum de muitas dessas doenças é a perda de células ganglionares da retina (RGCs). Este protocolo detalhado descreve o isolamento de RGC murinos primários por seleção positiva e negativa com citometria de fluxo.
Resumo
As doenças neurodegenerativas muitas vezes têm um impacto devastador sobre os afetados. A perda de células ganglionares retinianas (RGC) está implicada em uma série de doenças, incluindo retinopatia diabética e glaucoma, além do envelhecimento normal. Apesar da sua importância, os RGCs têm sido extremamente difíceis de estudar até agora devido em parte ao fato de que eles compreendem apenas uma pequena porcentagem da grande variedade de células na retina. Além disso, os métodos de isolamento atuais usam marcadores intracelulares para identificar RGCs, que produzem células não viáveis. Essas técnicas também envolvem longos protocolos de isolamento, portanto, há uma falta de métodos práticos, padronizados e confiáveis para obter e isolar RGCs. Este trabalho descreve um método eficiente, abrangente e confiável para isolar RGC primários de retinae de camundongos usando um protocolo baseado em critérios de seleção positivos e negativos. Os métodos apresentados permitem o estudo futuro de RGCs, com o objetivo de melhor compreender o maiorDeclínio na acuidade visual que resulta da perda de RGCs funcionais em doenças neurodegenerativas.
Introdução
Os RGCs são neurônios terminalmente diferenciados e, portanto, células primárias são necessárias para a experimentação. O desenvolvimento de um protocolo para isolamento e enriquecimento de células de gânglios retinianos murinos primários (RGCs) é fundamental para revelar os mecanismos de saúde e degeneração de RGC in vitro . Isto é especialmente importante para estudos que buscam gerar terapias potenciais para promover a função RGC e para minimizar sua morte. A degeneração de RGCs está associada a doenças degenerativas da retina, como glaucoma, retinopatia diabética e envelhecimento normal. Embora os mecanismos celulares específicos subjacentes à perda de RGC não estejam claros, uma série de fatores de risco foram identificados. A falta de oxigenação na cabeça do nervo óptico 1 , 2 , 3 causa a morte RGC 4 e atua como o distúrbio da homeostase entre a ativação de excitatório e iReceptores nibitórios dentro de RGCs individuais 5 , 6 . Uma série de desafios impede o progresso no sentido do uso dessas células para estudos aprofundados. Primeiro, o número de RGCs presentes em uma retina murina é pequeno. Os RGCs representam menos de 1% das células da retina 7 , 8 , 9 . Em segundo lugar, a maioria dos marcadores específicos de RGC são proteínas intracelulares 10 , 11 , 12 . A seleção com base nesses marcadores deixa as células não viáveis, o que impede análises funcionais a jusante. Finalmente, os protocolos atualmente disponíveis são longos e falta padronização 13 , 14 . Os protocolos de isolamento RGC precoce basearam-se em métodos de imunoparingologia. Barres et al. 15 Adaptou o immunop clássicoE acrescentou um segundo passo, que excluiu os monócitos e as células endoteliais da maior parte das células da retina antes da seleção positiva com base na imunopositividade ao antígeno anti-timócito (também conhecido como Thy1), um marcador de superfície celular. Anos mais tarde, Hong et al. Técnicas combinadas de isolamento de grânulos magnéticos com estratégias de triagem celular para isolar RGC com maior pureza 16 . O uso de pérolas magnéticas ainda é usado em muitas aplicações científicas. Juntos, os grânulos magnéticos e os protocolos de citometria de fluxo melhoraram a pureza das células isoladas. No entanto, estes sistemas de purificação ainda não foram padronizados para o isolamento de RGC murinos a partir de retina dissociada.
A citometria de fluxo é um poderoso método analítico que mede as características ópticas e fluorescentes das suspensões celulares. As células são analisadas quantitativa e qualitativamente com um alto nível de sensibilidade, fornecendo uma análise multidimensional da população celularAtion. A discriminação celular baseia-se em duas propriedades físicas principais: tamanho da célula ou área de superfície e granularidade ou complexidade interna 17 . Uma análise multidimensional pode ser realizada combinando anticorpos marcados com fluorocromos que possuem comprimentos de onda de excitação semelhantes e diferentes emissões. A citometria de fluxo é rápida, reproduzível e sensível. Os laseras Multitpe permitem análises multidimensionais ainda maiores de células individuais por citometria de fluxo. Assim, é uma metodologia atraente para o estudo de espécimes citológicos. A classificação de células ativadas por fluorescência (FACS) usa as diferenças fenotípicas multidimensionais identificadas pela citometria de fluxo para classificar células individuais em subpopulações distintas.
Na última década, múltiplas proteínas superficiais e intracelulares foram identificadas como biomarcadores potenciais para a seleção de células, incluindo neurônios. Estudos iniciais que procuraram isolar RGCs de ratos usaram Thy1 como um ganglion celL marcador. Infelizmente, Thy1, também conhecido como CD90, tem múltiplas isoformas em outras espécies de roedores 18 , 19 , 20 e é expresso por vários tipos de células da retina 19 , 20 , tornando-se um marcador não específico para RGCs. Outro marcador de superfície, CD48, é encontrado em populações monocíticas na retina, incluindo macrófagos e microglia. Usando estes dois marcadores de superfície, uma assinatura RGC modificada - células Thy1 + e CD48 neg - foi desenvolvida 15 , 16 , 21 , 22 . Infelizmente, esses dois critérios de seleção não são suficientes para selecionar uma população RGC altamente enriquecida. Para resolver esta necessidade não atendida, foi desenvolvido um protocolo de citometria de fluxo 23 com base em critérios de seleção positiva e negativa de várias camadas usiNg conhecidos marcadores de superfície celular para enriquecer e purificar RGCs murinos primários.
Protocolo
Todos os procedimentos detalhados no seguinte protocolo foram aprovados pelo conselho de avaliação institucional do Comité de Consumo e Uso Animal (IACUC) do Centro de Ciências da Saúde da Universidade do Tennessee (UTHSC) e seguiram a Associação para Pesquisa em Visão e Oftalmologia (ARVO) Declarações para o Uso De Pesquisa de Animais em Oftálmica e Visão, além das diretrizes para experimentos em laboratório de animais (Instituto de Recursos de Laboratório de Animais, Política de Serviço de Saúde Pública sobre Cuidados Humanos e Uso de Animais de Laboratório).
1. Preparação de instrumentos, soluções e mídia
Nota: Todas as informações sobre materiais, reagentes, ferramentas e instrumentos relatados no protocolo estão especificadas na Tabela de Materiais .
- Autoclave todos os instrumentos de dissecação e armazená-los em uma área estéril. Use os seguintes instrumentos: 4 pinças padrão (2 longas e 2 curtas) e 2 tesouras,Bem como 2 fórceps (1 longo e 1 curto) e 1 tesoura para a dissecação; Mantenha um conjunto extra como um backup.
- Prepare 100 mL de solução de PBS estéril / 1% FBS para usar durante lavagens, procedimentos de imunomarcação e etapas de triagem celular. Mantenha a solução arrefecida a 4 ° C.
Nota: Não adicione azida de sódio (NaN 3 ) à solução, pois pode ser tóxico para células vivas.- Prepare 100 mL de PBS / FBS a 1% com 99 mL de PBS e 1 mL de FBS.
- Prepare 100 mL de meio de célula neural estéril suplementado com 3% de FBS (veja a Tabela de Materiais ) para uso como coleta e meio de cultura. Mantenha o meio de cultura celular estéril a 4 ° C. Apenas aqueça a temperatura ambiente (RT) antes de usar.
- Prepare 100 mL de meio celular neural suplementado com FBS a 3% utilizando 97 mL de meio celular neural e 3 mL de FBS.
- Tubos de coleta pré-chill (tubos de 15 mL) pré-revestidos com 5 mL de meio de colheita colocando tBainha de gelo em um balde de gelo. Use apenas tubos de polipropileno para evitar que as células aderem à superfície do tubo.
- Coloque pratos de 40 mm, filtros de nylon de 70 μm, seringas, pilões para o filtro de células e tubos de polipropileno estéril no gabinete de biossegurança. Esterilize todos os itens antes dos procedimentos e mantenha-os de forma estéril ao longo dos procedimentos.
Nota: Todas as etapas após a coleta da retina serão realizadas no gabinete de biossegurança.
2. Enucleação
Nota: Um número total de 10 ratos jovens (5-7 semanas de idade) C57BL / 6J foram utilizados nesta experiência para isolar 1,0 x 10 6 RGCs com o fenótipo CD90.2 + CD48 neg CD15 neg CD57 neg .
- Eutanizar os ratos usando inalação de CO 2 seguido de deslocamento cervical. Use sempre um método secundário de eutanásia para garantir que o animal eutanizado esteja morto.
Nota: O isofluorano pode ser usado como alternativa ao CO 2 . A ketamina não é recomendada, uma vez que está associada a um aumento da pressão intra-ocular (PIO) quando utilizado como indutor de anestesia 24 , 25 . - Insira fórceps sob o globo do olho, aperte o nervo óptico e puxe-o; O globo será enucleado, com o nervo óptico intacto. Coloque os olhos coletados em um frasco contendo PBS e mantenha o frasco em gelo até o próximo passo.
Nota: Qualquer pessoal pode realizar este passo depois de receber o treinamento apropriado da Unidade de Cuidados de Animais de Laboratório (LACU).
3. Preparação da Suspensão da Célula Retinal
- Coloque o olho recolhido na placa base de um microscópio de dissecação para iniciar a dissecção da córnea. Dissecte cada olho individualmente.
- Mantenha cuidadosamente o globo na base do nervo óptico usando fórceps. Para este passo, use um lonG, e uma pinça padrão curta.
- Use uma agulha afiada de calibre 30 (30G) para perfurar a córnea para permitir que o humor aquoso evacue dos olhos, facilitando a retenção do olho com a pinça.
- Segure a córnea com a pinça e use uma tesoura para fazer uma pequena incisão na córnea. Retire gentilmente a córnea e a esclerótica usando a pinça. Quando o globo é descascado a meio caminho, role a retina e a lente usando a pinça. Descarte a córnea, a esclerótica e as lentes.
Nota: Este método garante que a retina se separe completamente do restante do olho. - Coloque a retina em uma pequena placa de Petri de 40 mm contendo PBS / FBS a 1%.
Nota: Como alternativa à placa de Petri, um prato de cultura celular pode ser usado. Certifique-se de manter sempre o retinae úmido, como em condições fisiológicas.- Lave cada retina três vezes com PBS estéril fresco / 1% FBS dentro do gabinete de biossegurança.
- Coloque até 12 retina emUm filtro de nylon esterilizado de 70 μm umedecido com PBS / FBS a 1%. Usando o back-end de uma seringa de 10 mL, macerar gentilmente a retina usando um movimento circular para separar as células.
- Alternativamente, use um pilão para a maceração do filtro celular ou use digestão enzimática com uma combinação de 15 UI / mL de papaína, 5 mM de L-cisteína e 200 U / mL de DNase I durante 15 minutos a 37 ° C, seguida de inativação com PBS / 10% FBS.
Nota: Não foram observadas alterações na porcentagem de células recuperadas quando a digestão enzimática foi comparada à maceração com o back-end da seringa ou o pilão.
- Alternativamente, use um pilão para a maceração do filtro celular ou use digestão enzimática com uma combinação de 15 UI / mL de papaína, 5 mM de L-cisteína e 200 U / mL de DNase I durante 15 minutos a 37 ° C, seguida de inativação com PBS / 10% FBS.
- Para transferir as células isoladas, coloque o filtro de nylon estéril de 70 μm sobre o tubo de recolha de polipropileno. Passe as células coletadas através do filtro usando uma pipeta P1000. Enxaguar o filtro ( passo 3.6 ) com PBS / 1% FBS para libertar as células restantes e transferi-las para o tubo de recolha.
- Adicionar PBS / 1% FBS a achUm volume final de 1 mL por retina. Centrifugar a suspensão celular durante 7 min a 200 xg e RT.
Nota: Dependendo do número de retina macerada (<6 retinae), o sedimento celular pode ser muito pequeno para ser visível.- Descarte o sobrenadante celular e ressuspenda o sedimento celular em PBS / FBS a 1% usando uma proporção de 1 mL por 5 retina.
- Contar as células usando um hemocitómetro.
- Limpe um hemocitômetro de vidro e lamínula com 70% de álcool. Gire suavemente o tubo contendo as células para garantir que a suspensão de células da retina seja distribuída uniformemente. Coloque 20 μL de 0,4% de azul de tripano em um tubo de microcentrífuga e misture com 20 μL da suspensão celular.
- Misture suavemente e aplique 10 μL da mistura de 0,4% de azul de tripa / célula no hemocitómetro, enchendo ambas as câmaras; A ação capilar atrairá a mistura de suspensão de azul / célula tripanal de 0,4% sob o lamínula. Usando um microscópio, conta com todas as células negativas do trypan; ThiO número s representa as células vivas.
- Determine a viabilidade celular usando a seguinte fórmula: contagem de células vivas / contagem total de células =% de viabilidade.
Nota: Se a viabilidade das células é inferior a 95%, o uso de corante fluorescente para discriminação de viabilidade celular é requerido durante FACS.
- Use um corante de viabilidade fluorescente que não seja permeável às células vivas. Lave as células com PBS para remover qualquer vestígio de soro. Adicione 1 μL de corante fluorescente para discriminação de viabilidade celular por 5,0 x 10 6 células em um volume final de 100 μL. Incubar à TA por 15 min, protegido da luz. Adicione 10x o volume de PBS / 1% FBS. Centrifugar por 5 min a 200 xg e RT.
- Incubar a suspensão celular durante a noite a 4 ° C, se necessário. Se isso for feito, encha o tubo de suspensão celular com o meio celular neural em vez de PBS / FBS a 1%. Coloque o tubo horizontalmente e mantenha-o a 4 ° C.
4. Immunomarcando o ReCélulas tinal
- Use a seguinte conversão para determinar o volume de anticorpo por número celular: 2 μL de anticorpo por 5,0 x 10 6 células em um volume de 100 μL.
- Lavar as células e mantê-las em PBS / FBS a 1%. Pegue uma pequena alíquota de células (5,0 x 10 6 células) para usar como controle negativo (não marcado) no momento da configuração do tipo.
Nota: Este controle negativo é crítico para a calibração adequada do classificador de células. - Para minimizar a ligação não específica de anticorpos a células que expressam os receptores Fcγ II e III, adicionar 1 μL de um anticorpo anti-rato CD16 / 32 por 1,0 x 10 6 células num volume final de 50 μL utilizando PBS / 1% FBS. Incubar durante 10 min à TA.
- Adicione o coquetel de anticorpos à amostra e misture suavemente por pipetagem. Incube durante 30 min numa balde de gelo. Certifique-se de que o balde de gelo esteja coberto, pois a luz pode comprometer o experimento devido ao fotobloco do fluoro marcadoPhores.
- Prepare o coquetel de anticorpos usando os seguintes anticorpos anti-mouse marcados com fluorescência: CD90.2 AF-700, CD48 PE-Cyanine7, CD15 PE e CD57 não marcado.
Nota: Para cada anticorpo, use as seguintes concentrações por 5,0 x 10 6 células: CD90.2 AF700, 1 μg; CD48 PE-Cyanine7, 0,4 μg; CD15 PE, 0,02 μg; E CD57 não marcado, 0,4 μg.- Use volumes de acordo com os seguintes cálculos (com base nos anticorpos comercialmente disponíveis listados na Tabela de Materiais ): total de 5,0 x 10 7 células a serem rotuladas; 2 μL por 5,0 x 10 6 células = 20 μL de cada anticorpo; 4 anticorpos diferentes = 80 μL de coquetel de anticorpos; Volume final = [(5,0 x 10 7 células totais) /5,0 x 10 6 células] x 100 = 1000 μL; 80 μL de Abs + 50 μL de CD16 anti-rato / 32 + 870 μL de PBS / FBS a 1% = 1000 μL.
Nota: Esta combinação forneceu oCombinação ideal de fluorocromos para a configuração do instrumento. Os seguintes parâmetros resumem a emissão e a excitação: AF-700, emissão de 719 nm quando excitada com um laser de diodo vermelho de 638 nm; PE-Cyanine7, emissão de 767 nm quando excitada com um laser de diodo azul de 488 nm; E PE, emissão de 575 nm quando excitada com um laser de diodo azul de 488 nm.
- Use volumes de acordo com os seguintes cálculos (com base nos anticorpos comercialmente disponíveis listados na Tabela de Materiais ): total de 5,0 x 10 7 células a serem rotuladas; 2 μL por 5,0 x 10 6 células = 20 μL de cada anticorpo; 4 anticorpos diferentes = 80 μL de coquetel de anticorpos; Volume final = [(5,0 x 10 7 células totais) /5,0 x 10 6 células] x 100 = 1000 μL; 80 μL de Abs + 50 μL de CD16 anti-rato / 32 + 870 μL de PBS / FBS a 1% = 1000 μL.
- Prepare o coquetel de anticorpos usando os seguintes anticorpos anti-mouse marcados com fluorescência: CD90.2 AF-700, CD48 PE-Cyanine7, CD15 PE e CD57 não marcado.
- Após a incubação de 30 minutos, leve volume até 5 mL usando PBS / FBS a 1%. Lave as amostras centrifugando-as durante 7 min a 200 xg e RT. Repita o procedimento uma vez para remover todos os anticorpos não ligados.
- Adicionar 2 μL de anticorpo secundário (0,1 μg), que irá ligar a CD57 de 5,0 x 10 6 células. Incube durante 30 min num balde de gelo, como no passo 4.4 . Lave as células duas vezes, como no passo 4.5 .
- Rotular as células com anticorpo secundário se um anticorpo primário não marcado fosse usado no passo 4.4 .
Nota: o segundoO anticorpo de escolha para esta configuração está listado na Tabela de Materiais ; Tem um comprimento de onda de emissão de 421 nm. Use-o com um filtro passa-banda de 450/50 nm quando excitado com o laser de diodo violeta a 405 nm. - Use volumes conforme os seguintes cálculos (com base no anticorpo comercialmente disponível listado na Tabela de Materiais ): 2 μL por 5,0 x 10 6 células = 20 μL de anticorpo secundário; Volume final = [(5,0 x 10 7 células totais) /5,0 x 10 6 células] x 50 = 500 μL; 20 μL de Abs + 480 μL de PBS / 1% FBS = 500 μL.
- Rotular as células com anticorpo secundário se um anticorpo primário não marcado fosse usado no passo 4.4 .
- Mantenha as células rotuladas em PBS / FBS a 1%. Contar as células usando um hemocitómetro; Use uma concentração final de células da retina de 3,0 - 4,0 x 10 7 células / mL.
Nota: Não use meio de cultura de células para diluir as células porque o vermelho de fenol pode aumentar a autofluorescência, reduzindo assim a resolução entre negativosCélulas positivas e positivas. A concentração celular final por volume depende muito do caudal volumétrico da configuração do instrumento. - Use controles de uma única cor durante a configuração para minimizar o vazamento de fluorescência.
Nota: Esta etapa, também conhecida como compensação, é aplicada para corrigir o ruído criado pela combinação de fluoróforos. As microesferas de poliestireno em PBS / 0,1% de BSA / NaN3 2 mM com a capacidade de se ligar a isotipos de imunoglobulina (Ig) com marcação fluorescente de múltiplas espécies fornecem controles positivos para estabelecer a compensação.- Coloque 3 gotas de microesferas de poliestireno em tubos estéril FACS, distribuindo um por fluoróforo. Adicione 1 μg do respectivo fluoróforo a cada tubo. Incubar durante 15 minutos à RT, protegido da luz. Adicione 3 mL de PBS / 1% de FBS aos tubos de amostra. Centrifugar por 5 min a 200 xg e RT. Retire cuidadosamente o sobrenadante e ressuspenda em 250 μL de PBS / FBS a 1%.
- Para configurar o controle negativoOls, use microesferas de poliestireno que não se ligam a Ig. Execute este passo no dia anterior, se necessário.
5. Estratégia de classificação de células
Nota: Instruções específicas para a configuração do instrumento para FACS com 355 nm, UV; 405 nm, violeta; 488 nm, azul; E 640 nm, lasers vermelhos com distribuição de canal de fluorescência 2, 2, 5 e 3, respectivamente. O software operacional foi DIVA versão 8.0.1. A classificação das células foi realizada com um bocal de 70 μm, pressão de bainha de 70 psi, freqüência de 87,5, amplitude de 48,6 com queda de primeira queda em 333, vazamento de 6, classificação de precisão ajustada para a pureza de quatro vias com máscara de pureza padrão (32) e queda Atraso ajustado para 42,98 usando esferas.
- Utilize tubos cônicos de polipropileno de 15 mL como vasos coletores. Adicione 5 mL do meio de colheita (meio de cultura de células) a cada tubo e gire o tubo para revestir as paredes.
Nota: Esta etapa impede que as células se encaixem nos lados de tEle coletou o tubo. Como alternativa, o tubo pode ser revestido com FBS não diluído. - Tome em consideração a eficiência do classificador celular para estimar o rendimento final das células.
Nota: A eficiência do tipo varia com base no citómetro de fluxo usado. Os RGCs com CD90.2 + CD48 neg CD15 neg CD57 neg fenótipo compreendem cerca de 1% de todas as células da retina. - A classificação celular é realizada por um operador treinado (geralmente em uma instalação básica). Certifique-se de que o instrumento seja limpo e esterilizado com etanol a 70% antes da aquisição da amostra. Limpe cuidadosamente o exterior dos tubos de recolha com 70% de etanol também.
- Se as células se estabeleceram ou agregaram, pipetar as células para cima e para baixo e filtrar a suspensão através de um filtro de nylon esterilizado de 40 μm antes da aquisição. Certifique-se de controlar a temperatura e mantê-la a 4 ° C enquanto a classificação celular está sendo realizada; A falta de fazê-lo reduzirá o celEu cedo.
- Discuta os detalhes do tipo com o operador de classificador de células antes de realizar as experiências.
Nota: No momento da experiência, o operador do classificador de células clicou em uma série de botões da barra de ferramentas do espaço de trabalho do software de aquisição para o citómetro. Estes são o navegador , o citometro , o inspetor , a planilha e o painel de compras . A estratégia de classificação de células usada aqui é conhecida como um tipo de 2 vias. São coletadas duas populações: as RGC enriquecidas e todos os outros tipos de células. Se forem coletadas populações adicionais, podem ser isoladas até duas populações adicionais como um tipo de 4 vias. Se forem coletadas populações adicionais, o classificador de células requer diferentes tubos de coleta e configuração. - Execute uma compensação para corrigir a sobreposição espectral dos fluoróforos.
Nota: Este processo pode ser feito manualmente por ajusteCada configuração, ou pode ser feito automaticamente como parte do software em uso. A maioria dos programas para equipamentos de classificação de células tem a opção de uma compensação automática. É considerado o padrão-ouro e o tipo mais preciso de compensação. A amostra negativa (sem fluoróforo) e os controles individuais preparados com microesferas de poliestereno (grânulos de compensação) especificamente fabricados para ligar todos os anticorpos monoclonais relevantes utilizados na experiência serão utilizados nesta etapa.- Selecione Experiência> Configuração de compensação> Criar controles de compensação . Adicione os controles específicos do fluoróforo da lista exibida na tela. Clique em OK .
Nota: Um tubo de compensação para cada um dos controles será exibido.- Use um controle não marcado (sem fluoróforo, passo 4.2 ) para verificar a luz dispersa para a frente (FSC), a luz paralela (SSC) e para a porta inicial da população (P1).
- Instale o tubo de controle negativo no citómetro e clique em Carregar. Verifique se a população de interesse é exibida e selecione-a. Esta é a população 1 (P1). Clique com o botão direito do mouse no portão P1 e selecione Aplicar em Todos os Controles de Compensação . Clique em Registrar dados . Quando terminar a gravação, clique em Descarregar e remova o tubo.
- Instale o próximo tubo no citómetro, conforme mostrado na tela. Repita a etapa 5.6.2 até que todos os dados dos controles tenham sido gravados.
- Selecione Experiência> Configuração de Compensação> Calcular Compensação . Salve a configuração e nomeie a experiência. Clique em Link e Salvar .
Nota: Compensação é um passo necessário, pois remove a sobreposição do espectro entre os detectores. - Se for necessária uma compensação manual, faça isso ajustando os meios dos sinais positivos para que eles sejam iguais aos negativos para o eacH dos fluorocromos utilizados.
Nota: Este passo é feito pela operação do classificador de células e pode demorar 30 min.
- Selecione Experiência> Configuração de compensação> Criar controles de compensação . Adicione os controles específicos do fluoróforo da lista exibida na tela. Clique em OK .
- Estratégia Gating ( Figura 3A ).
- Configure P1 ao traçar FSC versus SSC; O FSC é indicativo do tamanho e o SSC indica a complexidade interna das células. Veja a Figura 3A .
- Desenhe um gráfico pseudocolor de SSC-H (altura) versus SSC-W (largura) usando a população selecionada no passo 5.7.1 (P1); O gráfico pseudocolor permite a representação visual da densidade de células em relação um ao outro.
Nota: uma menor densidade celular é representada por azul e verde, enquanto as áreas vermelha e laranja representam alta densidade celular.- Execute este passo para colecionar células únicas apenas; O portão de célula única é chamado de P2. Veja a Figura 3A .
- Repita o passo 5.7.2 paraTrama FSC-H versus FSC-W usando P2. Certifique-se de que a seleção de células únicas como "dupletos" ou aglomerados de células contém um marcador positivo e negativo, proporcionando falsas positividade.
- Desenhe um gráfico pseudocolor de CD90.2 versus CD48. Selecione todas as células negativas CD90.2 + CD48 para eliminar monócitos do enriquecimento RGC; Chame este portão CD90.2 + CD48 neg , ou P3. Veja a Figura 3A .
- Usando a população negativa CD90.2 + CD48 selecionada ou o portão P3, desenhe um gráfico pseudocolor de CD57 versus CD15 para eliminar contaminantes de células amacrinas do enriquecimento de RGC. Porta a população CD15 neg CD57 neg . Veja a Figura 3A .
- Defina as populações a serem coletadas para a amostra na janela "Ordenar Layout" e continue com a classificação celular; A amostra a recolher é CD90.2 + CD48 neg CD15 neg CD57 neg P>.
Nota: A população a ser ordenada é selecionada no menu suspenso de Adicionar na janela de classificação. Depois de adicionar a população, ele irá solicitar eventos alvo ou quantos eventos serão coletados. A qualquer momento, o layout de classificação pode ser editado clicando no campo Classificar Localização que contém a população. 0,9% ± 0,3 de RGCs com o fenótipo CD90.2 + CD48 neg CD15 neg CD57 neg são obtidos de ratinhos C57BL / 6J jovens (5-7 semanas de idade) e 0,5% ± 0,3 e idosos (> 12 meses de idade) 23 . - Usando 25 mil células, execute uma verificação de pureza 23 . Veja a Figura 3B -E.
Nota: A verificação de pureza é o processo para reanalisar as células ordenadas para verificar a precisão do tipo de célula. Uma pequena alíquota de células ordenadas será carregada no citómetro para verificar a eficácia do tipo.
- Rotulagem intracelular.
- Corrigir as células ordenadas por 1 h e permeabilizar a 4 ° C para tornar as células metabolicamente inativas e permitir a penetração de anticorpos intracelulares.
- Diluir os seguintes anticorpos na solução de permeabilização: proteína de ligação anti-ARN com splicing múltiplo (RBPMS) a uma diluição de 1: 100 em um estoque de 100 μg / mL; Gama de anti-sinucleína (SNCG), 1: 100 em um estoque de 1 mg / mL; Proteína de domínio homeobox / POU específico do cérebro 3A (BRN3A), 1: 100 em um estoque de 200 μg / mL; E tubulina beta de classe III específica para o neurônio (TUJ1), 1: 100 em um estoque de 1 mg / mL. Incube as células e soluções de anticorpos durante 1 h em uma cubeta de gelo coberta.
- Lavar as amostras duas vezes com PBS / FBS a 1%.
- Ressuspender as células no anticorpo secundário marcado AF488 apropriado a uma diluição de 1: 200 durante 30 min em uma balde de gelo.
- Lavar as amostras como no passo 6.1.3. Mantenha as células emPBS / 1% de FBS (250 μL) até estar pronto para analisar.
7. Validação da classificação de células por análise de qPCR
Nota: veja a Figura 4 .
- Extração de RNA 23 .
- Extrair o ARN de 5,0 x 10 5 células classificadas por lise celular e homogeneização seguida pela adição de clorofórmio.
- Transfira a fase superior e incolor para um microtube limpo para precipitação de álcool seguido de concentração de extrato em uma coluna de rotação. Execute a digestão DNAse na coluna.
- Lave a coluna com água livre de RNase para eluição de ARN.
- Avalie a concentração de ARN por espectrofotometria.
- Síntese de cDNA e pré-amplificação.
- Use 100 ng de material de ARN e misture com uma solução contendo enzima de transcriptase reversa, inibidor de ribonuclease recombinante (para evitar a degradação de ARN), cloreto de magnésio (MgCL 2 ), e desoxinucleótidos.
- Misturar o conteúdo do tubo e incubar durante 10 min a 25 ° C seguido de 60 min a 42 ° C. Conclua a reação com uma incubação de 5 min a 85 ° C. Armazene o cDNA resultante a -20 ° C até estar pronto para usar.
Nota: o material de cDNA pode ser armazenado a -20 ° C por até um mês se o passo de pré-amplificação não puder ser realizado imediatamente.
- Pré-amplificação do cDNA.
- Preamplificar o material de cDNA usando uma série de iniciadores específicos para múltiplos tipos de células da retina, incluindo células de gânglios retinianos, células amacrinas, astrócitos, Müller, bipolar, horizontal, fotorreceptores e células epiteliais de pigmento da retina, conforme detalhado na Referência 23 e na Tabela De Materiais .
Nota: A reação de pré-amplificação está preparada para aumentar a sensibilidade da detecção para quantificação. A reação de pré-amplificação contém uma mistura do iniciadorMisturas da tabela de materiais ; 2,5 μL de cDNA, que começou a 100 ng de RNA; Enzima transcriptase reversa; E água livre de nuclease em um volume final de 10 μL. - Execute o passo de ativação da enzima a 95 ° C durante 10 minutos, seguido de 14 ciclos a 95 ° C durante 15 s, seguido por 60 ° C durante 4 min. Diluir o material pré-amplificado 1:10 no tampão Tris EDTA e mantê-lo a -20 ° C até estar pronto para uso.
- Preamplificar o material de cDNA usando uma série de iniciadores específicos para múltiplos tipos de células da retina, incluindo células de gânglios retinianos, células amacrinas, astrócitos, Müller, bipolar, horizontal, fotorreceptores e células epiteliais de pigmento da retina, conforme detalhado na Referência 23 e na Tabela De Materiais .
- 7,4 qPCR reação.
- Prepare todas as reações de qPCR em um volume final de 10 μL utilizando o cDNA diluído, pré-amplificado (2,5 μL), iniciadores (listados na Tabela de Materiais ), água livre de nuclease e um concentrado com DNA polimerase e desoxinucleótidos.
- Use as seguintes condições de instrumento para executar o qPCR: um passo de espera de 50 ° C durante 2 minutos, seguido de 95 ° C por 10 min. Execute um total de 40 ciclos a 95 ° C durante 15 s seguido por 60 ° C durante 1 min. Execute todas as medidasEm repetições de três.
- Execute quantificação relativa usando o limite comparativo (C T ) após determinar os valores de C T para o gene de limpeza e os genes alvo em cada amostra. Calcule a mudança de dobra relativa (R q ) usando a seguinte equação: R q = 2 T -ΔC , onde ΔC T = C T gene alvo - gene de referência C T 23 .
Nota: O C T é definido como o ciclo de PCR no qual o sinal fluorescente do tinteiro repórter cruza um limite 26 colocado arbitrariamente. O C T é inversamente relacionado à quantidade de amplicão (produto de PCR) na reação.
Resultados
O estudo aprofundado de RGCs é impedido por muitos fatores, incluindo sua baixa freqüência e a falta de uma metodologia robusta e padronizada para seu isolamento. A Figura 1 mostra a metodologia utilizada para isolamento de retina. As variações no procedimento de enucleação existem com base no tipo de análise, como se a enucleação faz parte da experimentação in vivo 27 . A enucleação neste protocolo é realizada em ratinhos eutanizados. Conforme mostrado na Figura 1A- B , a pinça é colocada sob o olho e puxada para causar sangramento mínimo e para remover um globo ocular com um nervo óptico intacto.
Existem diferenças no número de RGCs em diferentes cepas de mouse, especialmente em camundongos geneticamente alterados 23 , 28 ,A consciência dessas diferenças é importante ao determinar o número de camundongos a serem utilizados. Retinae de ratos C57BL / 6J antigos tem menos células retinianas vivas do que as contrapartes mais jovens 23. Portanto, a dissecção da retina deve ser cuidadosamente realizada para Maximizar o rendimento das células. Um procedimento passo-a-passo para a dissecção da retina é apresentado na Figura 1C- J . As células da retina são frágeis. Assim, as retina dissecadas são colocadas em filtros de nylon e são maceradas com a extremidade traseira de uma seringa, como Mostrado na Figura 2A , ou com um pilão para filtros celulares. A maceração de células diretamente no filtro celular é rápida e reduz os aglomerados celulares. Uma imagem representativa da suspensão celular é ilustrada na Figura 2B . Podem visualizar-se várias células retinais internas. Neste ponto, os RGC perderam seu morfo de assinaturaDevido à axotomia durante o isolamento celular e à preparação da suspensão celular.
O passo mais intensivo em mão-de-obra desta metodologia é a configuração de classificação de células. Esta fase é um passo crítico durante os FACS multicoloridos, pois maximiza a resolução de sinal para ruído. A Figura 3A mostra a estratégia de gating utilizada para o isolamento de RGCs. Esta estratégia visou a remoção de células contaminantes da suspensão celular, que incluía células monocitárias, gliais, amacrinas e fotorreceptoras. Como parte da metodologia, os marcadores de superfície adicionais foram confirmados por análise imuno-histoquímica antes de serem utilizados como parte da estratégia de exclusão. Os dados anteriores demonstraram que uma pequena porcentagem de células CD90.2 + são CD48 + . A exclusão dessas células removeu monócitos e possivelmente microglia do grupo de células retinae. Foi mostrado anteriormente que o clássico Thy1 + CD48 neg o fenótipo superficial não é suficiente para identificar e isolar RGCs murinos 23 , uma vez que estas células expressam genes associados com amitrina, Müller, fotorreceptor bipolar, fotoreceptor horizontal e células epiteliais de pigmento da retina ( Figura 4A ). Isso também é abordado pela investigação de marcadores adicionais para exclusão celular. CD15 foi descrito como um marcador de células amacrinas e bipolares 31 , levando seu uso como marcador adicional para seleção negativa. Trabalho de Uusitalo et al. 32 descreveram CD57 como um marcador de identificação para células gliais e fotorreceptores. Portanto, este anticorpo foi adicionado à estratégia de triagem celular.
Em seguida, essas células foram caracterizadas para validar a metodologia para o isolamento de RGC murinos. Os fenótipos do CD90.2 + CD48 neg CD15 neg células CD57 neg classificadas ( Figura 3B) foram avaliados quanto à expressão dos seguintes marcadores intracelulares associados a RGCs 10 , 11 , 12 , 33 : SNCG, BRN3A, TUJ1 e RBPMS. Conforme mostrado na Figura 3C , as células classificadas expressaram as quatro proteínas intracelulares associadas ao RGC. Em seguida, a citometria de fluxo de imagem foi usada na Figura 3D para mostrar a localização intracelular de RBPMS e a expressão da superfície celular de CD90.2. Estes resultados foram testados em múltiplos sistemas de citómetro, confirmando a reprodutibilidade e a padronização. Conforme mostrado na Figura 3E , algumas das células ordenadas começaram a mostrar a morfologia associada aos RGC após a cultura celular in vitro .
Por fim, uma comparação de células antes do enriquecimento e pós-ceA análise foi realizada pela análise qPCR. Comparação do fenótipo Thy1 + CD48 neg ao CD90.2 + CD48 neg O CD15 neg CD57 neg classificou células revelou que o Thy1 + CD48 neg fenótipo expressa genes associados com RGCs, mas também com outras células da retina. No entanto, a população de células triadas altamente enriquecidas ( Figura 4B ) mostrou um aumento muito frequente nos genes que codificam os marcadores intracelulares específicos de RGC Sncg (SNCG), Pouf4l (BRN3A), Tubb3 (TUJ1) e Rbpms (RBPMS). Coletivamente, as avaliações de mRNA e proteína validadaram a metodologia.
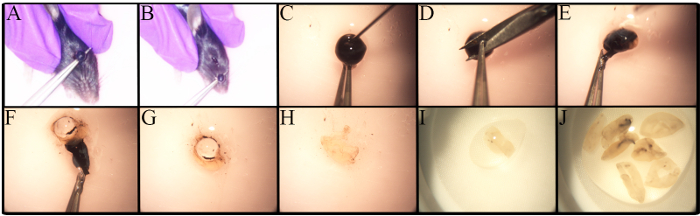
Figura 1 . Enucleação e dissecção ocular para isolamento da retina. Os jovens ratinhos C57BL / 6J foram eutanizados antes de tO remoção do globo ocular com CO 2 e deslocamento cervical. A) Coloque a pinça sob o olho e puxe o olho em um movimento. B) O olho é removido, incluindo o nervo óptico. CJ) Guia passo a passo para remover a retina. C) Uma punção é realizada usando uma agulha 30G antes da remoção da córnea para permitir que o humor aquoso saia do olho. D) A córnea é mantida com fórceps para fazer uma pequena incisão. EF) O uso de fórceps permite a descolagem da córnea, epitélio pigmentar da retina, coróide e esclerótica. A retina é separada da esclerótica, enrolada e removida. G) A lente é removida e descartada. HJ) As retina recolhidas são colocadas em um pequeno prato contendo PBS / 1% FBS para mantê-los úmidos em todos os momentos. Clique aqui para ver uma versão maior destefigura.
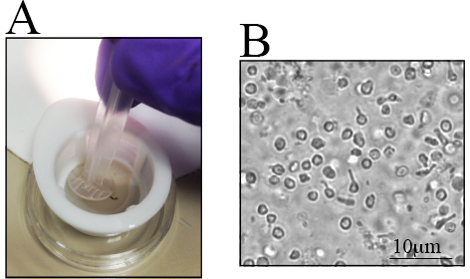
Figura 2 . Suspensão da célula retiniana após a maceração das retina recolhidas. As retina recolhidas são colocadas em um pequeno prato para isolar as células. A) Retinae são colocados em um filtro de nylon de 70 μm e são macerados usando o back-end de uma seringa. B) Imagem representativa da suspensão celular, onde são observadas células retinianas distintas. A barra de escala é de 10 μm.

Figura 3 . Estratégia de classificação para o isolamento de células com CD90.2 + CD48 neg CD15 neg CD57 neg Phenotype e análise pós-triagem. A estratégia de classificação baseia-se na inclusão de células CD90.2 e na exclusão de células positivas para CD48, CD15 e CD57, que são células contaminantes. A) Como um primeiro passo, tamanho da parcela (FSC) e complexidade interna (SSC) para obter uma visão geral da população de células. A população inicial fechada (P1) é usada para discriminar entre células únicas e células ou agregados agrupados usando o SSC-height (H) versus a largura (W), P2. A seleção das células individuais é usada para escolher as células negativas CD90.2 + CD48. Para confirmar a remoção de todos os dupletos, um traçado de FSC-H versus FSC-W é executado, P3 (painel do meio ). As células foram marcadas com CD90.2 conjugado anti-rato conjugado com AF700, CD15 conjugado anti-rato conjugado com PE-Cyanine7, CD15 conjugado com PE e CD57 anti-rato. Como um anticorpo secundário para marcar o CD57 anti-rato, foi utilizado o BV421 anti-rato. A população 3 (P3) foi plotada no quarto </ Em> para selecionar as células negativas CD90.2 + CD48, removendo a maioria das células contaminantes. Em seguida, um gráfico CD57 versus CD15 é gerado usando as células negativas CD90.2 + CD48 selecionadas. Quadrante 4 (Q4) é selecionado, pois representa as células negativas CD90.2 + CD48 negativas para CD15 e CD57. O fenótipo resultante da população fechada é CD90.2 + CD48 neg CD15 neg CD57 neg . B) Análise pós-ordenação dos marcadores de superfície usados em A). As células classificadas são de tamanho homogêneo, como mostrado no primeiro painel. Os histogramas subsequentes mostram a porcentagem de cada marcador de superfície usado na estratégia de classificação detalhada em A). Um total de 95% das células são CD90.2 + , como mostrado na linha preta em comparação com o controle de Ig, representado pelo histograma sólido. Essas células foram fechadas para avaliar as porcentagens de CD48, CD15 e CD57, representadas pelo vermelho, o azul e o greeN linhas, respectivamente. Os resultados mostram a expressão mínima desses marcadores de superfície celular. C) Confirmação do fenótipo RGC usando os marcadores intracelulares específicos de RGC SNCG, BRN3A, TUJ1 e RBPMS. As linhas negras representam a porcentagem de células que expressam cada marcador intracelular. D) Imagens representativas tiradas em um classificador de células de imagem mostrando a localização intracelular de RBPMS, um marcador intracelular específico de RGC e o marcador de superfície celular CD90.2. A barra de escala é de 20 μm. E) Imagem representativa de RGCs ordenados após 24 h em cultura usando um microscópio confocal. A barra de escala é de 20 μm. As imagens BE são adaptadas do trabalho previamente publicado com permissão 23 . As imagens DE foram tomadas em 20X. Clique aqui para ver uma versão maior dessa figura.

Figura 4 . Análise de mRNA pré e pós-classificação. As células Thy1 + CD48 neg e triadas com o fenótipo CD90.2 + CD48 neg CD15 neg CD57 neg foram avaliadas por análise de qPCR usando um painel de 25 genes expressos pelas células da retina. Os níveis de expressão de genes alvo são apresentados como uma mudança de Log 2 usando Hprt como um gene de limpeza e água como um controle negativo. O cálculo foi feito com base no método ΔC T. Média ± SEM; N = 3 repetições biológicas foram realizadas em triplicado. Figuras obtidas do trabalho anteriormente publicado com permissão 23 .
Discussão
FACS é a técnica de escolha para purificar populações celulares. Outros métodos de isolamento incluem imunopanning, esferas magnéticas e depleção de fixação do complemento. A vantagem do FACS sobre essas outras metodologias baseia-se na identificação simultânea de marcadores de superfície celular com diferentes graus de intensidade. A intensidade fluorescente da molécula é proporcional à quantidade de expressão da proteína. Até agora, o isolamento de RGCs baseava-se unicamente na positividade Thy1 (CD90) e na negatividade CD48 15 , 16 , 22 , 34 , independentemente do método de isolamento utilizado. Foi recentemente demonstrado que o fenótipo Thy1 + CD48 neg não é suficiente para isolar uma população homogénea de células que expressam marcadores intracelulares RGC 23 . A identificação da população RGC é essencial para o seu isolamento, em particularE porque eles compreendem uma pequena porcentagem de células da retina 7 , 8 , 9 . A maioria dos RGCs está localizada na camada mais interna da retina, enquanto um pequeno número está localizado nas camadas plexiformes internas (RGCs 35 deslocadas). Assim, o rastreamento de RGCs da collicina superior por injeções estereotáxicas e rastreamento com hidroxistilbamidina (um rastreador retrógrado para descrever neurônios) tornou-se opções atraentes para muitos laboratórios 36 , 37 , 38 . Esses sistemas exigem a injeção do traçador, o que, se não for realizado corretamente, pode levar a algumas regiões retinianas deixadas sem cicatrização. Além disso, são mais exigentes tecnicamente e, como outras metodologias, como a imunoparingologia, são longas. A imunopanagem usando os anticorpos anti-Thy1 e -CD48 leva 48 h para completar e não atinge mais de 95% De pureza. Este trabalho descreve uma metodologia baseada em FACS que oferece um protocolo rápido e reprodutível para isolar uma população homogênea de RGCs vivos com CD90.2 + CD48 neg CD15 neg CD57 neg fenótipo, sem o uso de traçadores, esferas magnéticas ou técnicas de imunopanagem .
Os seguintes fatores são necessários para o isolamento bem sucedido de RGCs puros por FACS: 1) eficiência de classificação, que depende muito do equipamento utilizado; 2) combinação ótima de fluorocromos marcados com anticorpos, para minimizar o ruído; E 3) configuração de classificação de células. A eficiência de classificação é calculada tomando o número de eventos alvo selecionados para classificação dividido pelo número de eventos alvo detectados, expressos em porcentagem. A eficiência de classificação é um cálculo fornecido pelo equipamento. Essa eficiência depende da configuração do sistema de classificação e do modo de classificação celular. Escolher uma combinação ótima de fluoroquromes é um processo complexo. Cada gripeO orochrome tem propriedades distintas e é caracterizado por seus comprimentos de onda de excitação e emissão. Enquanto a excitação é lida com um laser, a emissão é lida por tubos fotomultiplicadores, que são limitados pelos filtros ópticos disponíveis no equipamento de classificação FACS. Aqui, é fornecida uma combinação de fluoroquromos marcados com anticorpos PE, PE-Cyanine7, AF700 e BV421. Isto foi determinado depois de considerar múltiplas combinações de fluorochrome que proporcionaram a melhor resolução ao mesmo tempo em que reduzem a sobreposição espectral. Por fim, a configuração do tipo é crítica. Em geral, as células da retina são frágeis. Assim, é melhor usar uma pressão menor para executar as amostras, para minimizar o estresse nas células. É fundamental manter a amostra a 4 ° C, porque manter RGC murinos por longos períodos de tempo à temperatura ambiente pode reduzir o rendimento celular, especialmente quando se classificam grandes quantidades de células.
A classificação baseada em FACS é uma metodologia ideal para o isolamento de células que compõem avPequena porcentagem da suspensão celular. O processo, desde a dissecção da retina até a conclusão da triagem celular, leva aproximadamente 5 a 6 h, em comparação com os sistemas de imunopantes e traçadores, que levam dias para serem concluídos. A análise multidimensional de FACS ea capacidade do equipamento para coletar várias populações viáveis permitem análises funcionais adicionais de células. O protocolo descrito aqui é uma ferramenta poderosa para o isolamento de RGC murinos primários. Apesar de suas múltiplas vantagens, incluindo sua sensibilidade, reprodutibilidade e a identificação imediata de células viáveis, existem algumas limitações. Em primeiro lugar, requer uma instrumentação cara e um operador altamente treinado. Normalmente, o operador é um imunologista ou um indivíduo altamente treinado no campo, com quem é necessário atender no momento da instalação da experiência. Hoje em dia, as instalações acadêmicas possuem múltiplas instalações essenciais, o que pode facilitar a realização desses tipos de experiências. Em segundo lugar, os RGC perdem a sua forçaMorfologia pical devido à atoxomia, tornando-os muito pequenos em tamanho. Neste momento, não se sabe se alguns de seus genes podem ser modulados devido a atoxomia.
A metodologia apresentada aqui permite a análise a jusante da função RGC in vitro e é uma ferramenta valiosa para ser utilizada nos campos das ciências visuais e da saúde. A manutenção da produção de células ganglionares no cérebro é necessária para a percepção visual e está em risco em múltiplas doenças. Essas células podem ser usadas para experimentação in vitro controlada, tanto em modelos saudáveis como em modelos de doenças. Estudos eletrofisiológicos, farmacológicos, bioquímicos e moleculares podem ser realizados nessas células, o que é ideal para o desenvolvimento de futuros alvos terapêuticos.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes.
Agradecimentos
Os autores agradecem ao Sr. Tim Higgins, Ilustrador Sénior do Departamento de Microbiologia, Imunologia e Bioquímica, para assistência técnica em vídeo; Dr. Matthew W. Wilson para discussões e os membros dos laboratórios Jablonski e Morales-Tirado por seus comentários úteis. Este trabalho foi apoiado pelo Alcon Research Institute Young Investigator Award (VMM-T), a Fundação de Pesquisa da Universidade do Tennessee (VMM-T), o National Eye Institute EY021200 (MMJ), o Gerwin Fellowship (VMM-T); A Gerwin Pre-doctoral Fellowship (ZKG), o Departamento de Defesa Army Medical Research and Materiel Command (VMM-T), e a concessão irrestrita da pesquisa para prevenir a cegueira.
Materiais
| Name | Company | Catalog Number | Comments |
| Anti-mouse CD15 PE | BioLegend | 125606 | Clone MC-480 |
| Anti-mouse CD48 PE-Cy7 | BioLegend | 103424 | Clone HM48-1 |
| Anti-mouse CD57 | Sigma Aldrich | C6680-100TST | Clone VC1.1 |
| Anti-mouse CD90.2 AF700 | BioLegend | 105320 | Clone 30-H12 |
| Brilliant Violet 421 Goat Anti-mouse IgG | BioLegend | 405317 | Clone Poly4053 |
| Purified Anti-mouse CD16/32 | BioLegend | 101302 | FcgRII/III block, Clone 93 |
| Zombie Aqua | BioLegend | 423102 | Live cell/ Dead cell discrimination |
| Fetal Bovine Serum | Hyclone | SH30071.03 | U.S. origin |
| AbC Total Antibody Compensation Bead Kit | Thermo Fisher Scientific | A10497 | Multi-species Ig |
| Neurobasal Medium | Thermo Fisher Scientific | 21103049 | Add serum to media prior to culture. |
| Phosphate-Buffered Saline (PBS) | Thermo Fisher Scientific | 10010049 | Saline solution |
| Dissection Microscope | Olympus | SZ-PT Model | Stereo Microscope |
| Sorvall Centrifuge | Thermo Scientific | ST 16R | All centrifugation performed at RT |
| Base Plate – Dissection Pan | Fisher Scientific | SB15233FIM | A wax plate can also be used |
| Forceps | Aesculap | 5002-7 | 4 ½ inches |
| Iris Scissors, Straight | Aesculap | 1360 | 5 ½ inches |
| Falcon 15 mL conical tubes | Fisher Scientific | 352097 | Polypropylene tubes |
| Falcon 50 mL conical tubes | Fisher Scientific | 352098 | Polypropylene tubes |
| BD FACS Tubes | Fisher Scientific | 352003 | Polypropylene tubes |
| 40 mm dishes | MidSci | TP93040 | Tissue culture treated |
| 70 μm nylon strainer | MidSci | 70ICS | sterile |
| 40 μm nylon strainer | MidSci | 40ICS | sterile |
| BD 10 mL syringe | Fisher Scientific | 301604 | Disposable Syringe without needle |
| Pestles | MidSci | PEST | sterile |
| Wheaton Vials | Fisher Scientific | 986734 | No Liner |
| BD 30 G needle | Fisher Scientific | 305128 | 1 inch |
| Hausser Scientific Bright-Line Glass Counting Chamber | Fisher Scientific | 0267151B | Hemocytometer |
| Gibco Trypan blue 0.4% Solution | Fisher Scientific | 15250061 | Viability Dye |
| Eppendorf tubes | Fisher Scientific | 05-402-25 | 1.5mL |
| EVOS Floid Cell Imaging | Thermo Fisher Scientific | 447113 | Fluorescence Imaging with a 20X objective |
| 100% Ethanol | Fisher Scientific | 04-355-452 | Used to make 70% Ethanol |
| Pipet-Lite LTS Pipette L-1000XLS+ | Rainin | 17014282 | LTS Pipette |
| Pipet-Lite LTS Pipette L-200XLS+ | Rainin | 17014391 | LTS Pipette |
| Pipet-Lite LTS Pipette L-20XLS+ | Rainin | 17014392 | LTS Pipette |
| Rack LTS 1000 mL – GPS-L1000S | Rainin | 17005088 | Blue Rack Sterile Tips |
| Rack LTS 250 mL – GPS-L250S | Rainin | 17005092 | Green Rack Sterile Tips |
| Rack LTS 20 mL – GPS-L10S | Rainin | 17005090 | Red Rack Sterile Tips |
| FACSAria II Cell Sorter | BD Biosciences | N/A | Custom order |
| LSR II Cytometer | BD Biosciences | N/A | Custom order |
| Abca8a | Thermo Fisher Scientific | Mm00462440_m1 | Müller cells |
| Aldh1al | Thermo Fisher Scientific | Mm00657317_m1 | Müller cells |
| Aqp4 | Thermo Fisher Scientific | Mm00802131_m1 | Astrocytes |
| Calb2 | Thermo Fisher Scientific | Mm00801461_m1 | Amacrine, Horizontal |
| Cd68 | Thermo Fisher Scientific | Mm03047340_m1 | Retinal Pigment Epithelial Cells |
| Gad2 | Thermo Fisher Scientific | Mm00484623_m1 | Amacrine |
| Hprt | Thermo Fisher Scientific | Mm01545399_m1 | House keeping gene |
| Lhx1 | Thermo Fisher Scientific | Mm01297482_m1 | Horizontal |
| Lim2 | Thermo Fisher Scientific | Mm00624623_m1 | Horizontal |
| Nrl | Thermo Fisher Scientific | Mm00476550_m1 | Photoreceptors |
| Ntrk1 | Thermo Fisher Scientific | Mm01219406_m1 | Horizontal |
| Pcp4 | Thermo Fisher Scientific | Mm00500973_m1 | Bipolar, Amacrine |
| Pou4f1 | Thermo Fisher Scientific | Mm02343791_m1 | Retinal Ganglion Cells |
| Prdx6 | Thermo Fisher Scientific | Mm00725435_s1 | Astrocytes |
| Prkca | Thermo Fisher Scientific | Mm00440858_m1 | Bipolar |
| Prox1 | Thermo Fisher Scientific | Mm00435969_m1 | Horizontal |
| Pvalb | Thermo Fisher Scientific | Mm00443100_m1 | Amacrine |
| Rbpms | Thermo Fisher Scientific | Mm02343791_m1 | Retinal Ganglion Cells |
| Rom1 | Thermo Fisher Scientific | Mm00436364_g1 | Photoreceptors |
| Rpe65 | Thermo Fisher Scientific | Mm00504133_m1 | Retinal Pigment Epithelial cells |
| Slc1a3 | Thermo Fisher Scientific | Mm00600697_m1 | Astrocytes |
| Slc6a9 | Thermo Fisher Scientific | Mm00433662_m1 | Amacrine |
| Sncg | Thermo Fisher Scientific | Mm00488345_m1 | Retinal Ganglion Cells |
| Tubb3 | Thermo Fisher Scientific | Mm00727586_s1 | Retinal Ganglion Cells |
| Vim | Thermo Fisher Scientific | Mm01333430_m1 | Müller cells |
| Taqman Universal Master Mix | Thermo Fisher Scientific | 4440047 | qPCR Reagent |
| miRNeasy Mini Kit | Qiagen | 217004 | RNA Isolation |
| SuperScript VILO cDNA Synthesis Kit | Thermo Fisher Scientific | 11754250 | cDNA synthesis |
| Taqman PreAmp Master Mix | Thermo Fisher Scientific | 4391128 | Pre-Amplification step |
| BD Cytofix/ Cytoperm | BD Biosciences | 554714 | Fixation/ Permeabilization Buffer |
| BD Perm/ Wash | BD Biosciences | 554723 | Permeabilization Solution |
| RBPMS | Santa Cruz Biotechnology | sc-86815 | intracellular antibody |
| SNCG | Gene Tex | GTX110483 | intracellular antibody |
| BRN3A | Santa Cruz Biotechnology | sc-8429 | intracellular antibody |
| TUJ1 | BioLegend | 801202 | intracellular antibody |
Referências
- Flammer, J., Orgul, S. Optic nerve blood-flow abnormalities in glaucoma. Prog Retin Eye Res. 17 (2), 267-289 (1998).
- Bathija, R. Optic nerve blood flow in glaucoma. Clin Exp Optom. 83 (3), 180-184 (2000).
- Osborne, N. N., Melena, J., Chidlow, G., Wood, J. P. A hypothesis to explain ganglion cell death caused by vascular insults at the optic nerve head: possible implication for the treatment of glaucoma. Br J Ophthalmol. 85 (10), 1252-1259 (2001).
- Morgan, J. E. Circulation and axonal transport in the optic nerve. Eye (Lond). 18 (11), 1089-1095 (2004).
- Tian, N., Hwang, T. N., Copenhagen, D. R. Analysis of excitatory and inhibitory spontaneous synaptic activity in mouse retinal ganglion cells. J Neurophysiol. 80 (3), 1327-1340 (1998).
- Schmidt, K. G., Bergert, H., Funk, R. H. Neurodegenerative diseases of the retina and potential for protection and recovery. Curr Neuropharmacol. 6 (2), 164-178 (2008).
- Dreher, B., Sefton, A. J., Ni, S. Y., Nisbett, G. The morphology, number, distribution and central projections of Class I retinal ganglion cells in albino and hooded rats. Brain Behav Evol. 26 (1), 10-48 (1985).
- Williams, R. W., Strom, R. C., Rice, D. S., Goldowitz, D. Genetic and environmental control of variation in retinal ganglion cell number in mice. J Neurosci. 16 (22), 7193-7205 (1996).
- Jeon, C. J., Strettoi, E., Masland, R. H. The major cell populations of the mouse retina. J Neurosci. 18 (21), 8936-8946 (1998).
- Surgucheva, I., Weisman, A. D., Goldberg, J. L., Shnyra, A., Surguchov, A. Gamma-synuclein as a marker of retinal ganglion cells. Mol Vis. 14, 1540-1548 (2008).
- Nadal-Nicolas, F. M., et al. Brn3a as a marker of retinal ganglion cells: qualitative and quantitative time course studies in naive and optic nerve-injured retinas. Invest Ophthalmol Vis Sci. 50 (8), 3860-3868 (2009).
- Kwong, J. M., Caprioli, J., Piri, N. RNA binding protein with multiple splicing: a new marker for retinal ganglion cells. Invest Ophthalmol Vis Sci. 51 (2), 1052-1058 (2010).
- Van Bergen, N. J., et al. Recharacterization of the RGC-5 retinal ganglion cell line. Invest Ophthalmol Vis Sci. 50 (9), 4267-4272 (2009).
- Wood, J. P., Chidlow, G., Tran, T., Crowston, J. G., Casson, R. J. A comparison of differentiation protocols for RGC-5 cells. Invest Ophthalmol Vis Sci. 51 (7), 3774-3783 (2010).
- Barres, B. A., Silverstein, B. E., Corey, D. P., Chun, L. L. Immunological, morphological, and electrophysiological variation among retinal ganglion cells purified by panning. Neuron. 1 (9), 791-803 (1998).
- Hong, S., Iizuka, Y., Kim, C. Y., Seong, G. J. Isolation of primary mouse retinal ganglion cells using immunopanning-magnetic separation. Mol Vis. 18, 2922-2930 (2012).
- Julius, R. S. The sensitivity of exponentials and other curves to their parameters. Comput Biomed Res. 5 (5), 473-478 (1972).
- Reif, A. E., Allen, J. M. The Akr Thymic Antigen and Its Distribution in Leukemias and Nervous Tissues. J Exp Med. 120, 413-433 (1964).
- Watanabe, M., Noguchi, T., Tsukada, Y. Regional, cellular, and subcellular distribution of Thy-1 antigen in rat nervous tissues. Neurochem Res. 6 (5), 507-519 (1981).
- Haeryfar, S. M., Hoskin, D. W. Thy-1: more than a mouse pan-T cell marker. J Immunol. 173 (6), 3581-3588 (2004).
- Sahagun, G., Moore, S. A., Fabry, Z., Schelper, R. L., Hart, M. N. Purification of murine endothelial cell cultures by flow cytometry using fluorescein-labeled griffonia simplicifolia agglutinin. Am J Pathol. 134 (6), 1227-1232 (1989).
- Shoge, K., et al. Rat retinal ganglion cells culture enriched with the magnetic cell sorter. Neurosci Lett. 259 (2), 111-114 (1999).
- Chintalapudi, S. R., et al. Isolation and Molecular Profiling of Primary Mouse Retinal Ganglion Cells: Comparison of Phenotypes from Healthy and Glaucomatous Retinas. Front Aging Neurosci. 8, 93 (2016).
- Nagdeve, N. G., Yaddanapudi, S., Pandav, S. S. The effect of different doses of ketamine on intraocular pressure in anesthetized children. J Pediatr Ophthalmol Strabismus. 43 (4), 219-223 (2006).
- Ding, C., Wang, P., Tian, N. Effect of general anesthetics on IOP in elevated IOP mouse model. Exp Eye Res. 92 (6), 512-520 (2011).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative C(T) method. Nat Protoc. 3 (6), 1101-1108 (2008).
- Aerts, J., Nys, J., Arckens, L. A highly reproducible and straightforward method to perform in vivo ocular enucleation in the mouse after eye opening. J Vis Exp. (92), e51936 (2014).
- Li, X., et al. Loss of AP-2delta reduces retinal ganglion cell numbers and axonal projections to the superior colliculus. Mol Brain. 9 (1), 62 (2016).
- Moshiri, A., et al. Near complete loss of retinal ganglion cells in the math5/brn3b double knockout elicits severe reductions of other cell types during retinal development. Dev Biol. 316 (2), 214-227 (2008).
- Danias, J., et al. Quantitative analysis of retinal ganglion cell (RGC) loss in aging DBA/2NNia glaucomatous mice: comparison with RGC loss in aging C57/BL6 mice. Invest Ophthalmol Vis Sci. 44 (12), 5151-5162 (2003).
- Jakobs, T. C., Ben, Y., Masland, R. H. CD15 immunoreactive amacrine cells in the mouse retina. J Comp Neurol. 465 (3), 361-371 (2003).
- Uusitalo, M., Schlotzer-Schrehardt, U., Kivela, T. Ultrastructural localization of the HNK-1 carbohydrate epitope to glial and neuronal cells of the human retina. Invest Ophthalmol Vis Sci. 44 (3), 961-964 (2003).
- Jackson, C. J., Garbett, P. K., Nissen, B., Schrieber, L. Binding of human endothelium to Ulex europaeus I-coated Dynabeads: application to the isolation of microvascular endothelium. J Cell Sci. 96 ( Pt 2), 257-262 (1990).
- Pennartz, S., Perraut, M., Pfrieger, F. Purification of retinal ganglion cells from postnatal rats by magnetic cell sorting. MACSmore. 12 (2), 16-18 (2010).
- Nadal-Nicolas, F. M., et al. Displaced retinal ganglion cells in albino and pigmented rats. Front Neuroanat. 8, 99 (2014).
- Nadal-Nicolas, F. M., Salinas-Navarro, M., Vidal-Sanz, M., Agudo-Barriuso, M. Two methods to trace retinal ganglion cells with fluorogold: from the intact optic nerve or by stereotactic injection into the optic tract. Exp Eye Res. 131, 12-19 (2015).
- Barnstable, C. J., Drager, U. C. Thy-1 antigen: a ganglion cell specific marker in rodent retina. Neuroscience. 11 (4), 847-855 (1984).
- Chiu, K., Lau, W. M., Yeung, S. C., Chang, R. C., So, K. F. Retrograde labeling of retinal ganglion cells by application of fluoro-gold on the surface of superior colliculus. J Vis Exp. (16), (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados