Method Article
عزل الخلايا العقدة الشبكية الفئران الأولية (رغس) عن طريق التدفق الخلوي
In This Article
Summary
يعاني الملايين من الناس من أمراض تنكسية في شبكية العين تؤدي إلى عمى لا رجعة فيه. وهناك عنصر شائع في العديد من هذه الأمراض هو فقدان خلايا العقدة الشبكية (رغس). يصف هذا البروتوكول تفصيلا عزل رغس الفئران الأولية عن طريق اختيار الإيجابية والسلبية مع التدفق الخلوي.
Abstract
وغالبا ما يكون للأمراض العصبية تأثير مدمر على المتضررين. تتورط خسارة خلية العقدة الشبكية (رجك) في مجموعة من الأمراض، بما في ذلك اعتلال الشبكية السكري والزرق، بالإضافة إلى الشيخوخة الطبيعية. على الرغم من أهميتها، كانت رغس صعبة للغاية لدراسة حتى الآن ويرجع ذلك جزئيا إلى أنها لا تشكل سوى نسبة صغيرة من مجموعة واسعة من الخلايا في شبكية العين. وبالإضافة إلى ذلك، أساليب العزل الحالية تستخدم علامات داخل الخلايا لتحديد رغس، التي تنتج خلايا غير قابلة للحياة. وتشمل هذه التقنيات أيضا بروتوكولات عزل طويلة، لذلك هناك عدم وجود أساليب عملية، موحدة، ويمكن الاعتماد عليها للحصول على وعزل رغس. يصف هذا العمل طريقة فعالة وشاملة وموثوق بها لعزل رغس الأولية من الشبكية الفئران باستخدام بروتوكول على أساس كل من معايير الاختيار الإيجابية والسلبية. الطرق المعروضة تسمح للدراسة المستقبلية لل رغس، بهدف فهم أفضل الرئيسيانخفاض في حدة البصر التي تنتج عن فقدان رغس وظيفية في الأمراض العصبية.
Introduction
رغس هي متباينة الخلايا العصبية متباينة، وبالتالي، مطلوب الخلايا الأولية للتجريب. تطوير بروتوكول لعزل وإثراء خلايا العقدة الشبكية الفئران الأولية (رغس) أمر أساسي للكشف عن آليات الصحة رجك وانحطاط في المختبر . وهذا مهم بشكل خاص للدراسات التي تسعى إلى توليد العلاجات المحتملة لتعزيز وظيفة رجك وتقليل وفاتها. ويرتبط انحطاط رغس مع الأمراض التنكسية في شبكية العين، مثل الجلوكوما، واعتلال الشبكية السكري، والشيخوخة الطبيعية. على الرغم من أن الآليات الخلوية محددة الكامنة وراء فقدان رجك غير واضحة، تم تحديد سلسلة من عوامل الخطر. عدم وجود الأوكسجين في الرأس العصب البصري 1 ، 2 ، 3 يسبب رغك الموت 4 ويعمل بمثابة اضطراب التوازن بين تفعيل إثارة و iمستقبلات المهبل داخل رغس الفردية 5 ، 6 . وهناك سلسلة من التحديات تعرقل التقدم نحو استخدام هذه الخلايا لإجراء دراسات متعمقة. أولا، عدد رغس الموجودة في شبكية العين الفئران هو صغير. رغس تمثل أقل من 1٪ من مجموع خلايا الشبكية 7 ، 8 ، 9 . ثانيا، معظم علامات رجك محددة هي البروتينات داخل الخلايا 10 ، 11 ، 12 . اختيار على أساس هذه علامات يترك الخلايا غير قابلة للحياة، مما يحول دون التحليلات الوظيفية المصب. وأخيرا، والبروتوكولات المتاحة حاليا هي طويلة ونقص التوحيد 13 ، 14 . واستندت بروتوكولات العزلة رجك في وقت مبكر على أساليب إمونوبانينغ. باريز وآخرون. 15 تكييفها إمونوب الكلاسيكيةأنينينغ تقنية وأضافت الخطوة الثانية، التي تستبعد الخلايا الأحادية والخلايا البطانية من الجزء الأكبر من خلايا الشبكية قبل اختيار إيجابي على أساس إمونوبوسيتيفيتي لمستضد التوتية المضادة للثيمية (ويعرف أيضا باسم Thy1)، علامة سطح الخلية. بعد سنوات، هونغ وآخرون. جنبا إلى جنب تقنيات العزلة حبة المغناطيسي مع استراتيجيات فرز الخلايا لعزل رغس مع أعلى النقاء 16 . لا يزال استخدام الخرز المغناطيسي المستخدمة في العديد من التطبيقات العلمية. معا، وحبات المغناطيسي والبروتوكولات التدفق الخلوي تحسين نقاء الخلايا المعزولة. ومع ذلك، فإن هذه النظم تنقية لم يتم بعد موحدة لعزل رغس الفئران من الشبكية فصلها.
التدفق الخلوي هو وسيلة تحليلية قوية يقيس الخصائص البصرية والمضان من تعليق الخلية. يتم تحليل الخلايا على حد سواء كميا ونوعيا مع مستوى عال من الحساسية، وتوفير تحليل متعدد الأبعاد للخلية بوبولأوجه. ويستند التمييز الخلوي على اثنين من الخصائص الفيزيائية الرئيسية: حجم الخلية أو مساحة السطح والتفاصيل أو التعقيد الداخلي 17 . ويمكن إجراء تحليل متعدد الأبعاد من خلال الجمع بين الأجسام المضادة الموسومة مع فلوروكروميس التي لها موجات الإثارة مماثلة وانبعاثات مختلفة. التدفق الخلوي سريع، استنساخه، وحساسة. يسمح ليزر مولتيتب حتى أكبر تحليلات متعددة الأبعاد من خلايا واحدة عن طريق التدفق الخلوي. وبالتالي، فإنه هو منهجية جذابة لدراسة العينات الخلوية. مضان تنشيط الخلايا الفرز (فاكس) يستخدم الاختلافات المظهري متعدد الأبعاد التي حددتها التدفق الخلوي لفرز الخلايا الفردية في مجموعات سكانية متميزة.
في العقد الماضي، تم تحديد العديد من البروتينات السطحية وداخل الخلايا على أنها المؤشرات الحيوية المحتملة لاختيار الخلايا، بما في ذلك الخلايا العصبية. الدراسات الأولية التي سعت لعزل رغس من الفئران تستخدم Thy1 كما سل العقدةل ماركر. لسوء الحظ، Thy1، ويعرف أيضا باسم CD90، لديها الأشكال الإسوية متعددة في أنواع القوارض الأخرى 18 و 19 و 20 ويعبر عنها أنواع الخلايا الشبكية متعددة 19 ، 20 ، مما يجعلها علامة غير محددة ل رغس. تم العثور على علامة سطح أخرى، CD48، على السكان أحادي في شبكية العين، بما في ذلك الضامة والخلايا الدبقية الصغيرة. باستخدام هذين السطحين علامات، تعديل رجك التوقيع Thy1 + و CD48 خلايا نيغ -وضعت 15 ، 16 ، 21 ، 22 . ولسوء الحظ، فإن هذين المعيارين من معايير الاختيار غير كافيين لاختيار مجموعة سكانية عالية التخصيب. لمعالجة هذه الاحتياجات غير الملباة، تم تطوير بروتوكول التدفق الخلوي 23 على أساس متعدد الطبقات معايير الاختيار الإيجابية والسلبية وسينغ المعروفة علامات سطح الخلية لإثراء وتنقية رغس الفئران الأولية.
Protocol
تمت الموافقة على جميع الإجراءات المفصلة في البروتوكول التالي من قبل لجنة رعاية الحيوان واستخدام اللجنة (إاكوك) مجلس مراجعة في جامعة تينيسي مركز العلوم الصحية (وثسك) واتبع جمعية للبحوث في الرؤية وعيون العيون (أرفو) بيانات للاستخدام من الحيوانات في بحوث العيون والرؤية، بالإضافة إلى المبادئ التوجيهية للتجارب الحيوانية المختبرية (معهد الموارد الحيوانية المختبرية، سياسة خدمة الصحة العامة على الرعاية الإنسانية واستخدام الحيوانات المختبرية).
1. إعداد الأدوات والحلول ووسائل الإعلام
ملاحظة: يتم تحديد جميع المعلومات حول المواد والكواشف والأدوات والأدوات المذكورة في البروتوكول في جدول المواد .
- الأوتوكلاف جميع الصكوك تشريح وتخزينها في منطقة معقمة. استخدام الأدوات التالية: 4 ملقط القياسية (2 طويلة و 2 قصيرة) و 2 مقص،وكذلك 2 ملقط (1 طويلة و 1 قصيرة) و 1 مقص لتشريح. الاحتفاظ بمجموعة إضافية كنسخة احتياطية.
- إعداد 100 مل من العقيمة بس / 1٪ فبس الحل لاستخدامها خلال غسل، إجراءات إمونولابيلينغ، وخلايا فرز الخطوات. إبقاء الحل المبردة في 4 درجات مئوية.
ملاحظة: لا تضيف أزيد الصوديوم (نان 3 ) إلى الحل، كما يمكن أن تكون سامة للخلايا الحية.- إعداد 100 مل من بس / 1٪ فبس مع 99 مل من برنامج تلفزيوني و 1 مل من فبس.
- إعداد 100 مل من معقم الخلايا العصبية المتوسطة تستكمل مع 3٪ فبس (انظر جدول المواد ) لاستخدامها في جمع ووسط الثقافة. الحفاظ على ثقافة الخلية المتوسطة معقمة في 4 درجات مئوية. فقط دافئ لدرجة حرارة الغرفة (رت) قبل الاستخدام.
- إعداد 100 مل من الخلايا العصبية المتوسطة تستكمل مع 3٪ فبس باستخدام 97 مل من الخلايا العصبية المتوسطة و 3 مل من فبس.
- أنابيب التبريد قبل البرد (أنابيب 15 مل) قبل المغلفة مع 5 مل من وسط جمع عن طريق وضع رتنحنح في دلو الثلج. فقط استخدام أنابيب البولي بروبلين لمنع الخلايا من التمسك سطح الأنبوب.
- وضع أطباق 40 ملم، مصافي النايلون 70 ميكرون، والمحاقن، بيستليس لمصفاة الخلية، وأنابيب البولي بروبيلين العقيمة في مجلس الوزراء السلامة الأحيائية. تعقيم جميع البنود قبل الإجراءات والحفاظ عليها بطريقة معقمة في جميع الإجراءات.
ملاحظة: سيتم تنفيذ جميع الخطوات بعد جمع الشبكية في مجلس الوزراء السلامة الأحيائية.
2. استئصال
ملاحظة: تم استخدام ما مجموعه 10 الشباب (5-7 أسابيع من العمر) الفئران C57BL / 6J في هذه التجربة لعزل 1.0 × 10 6 رغس مع النمط الظاهري CD90.2 + CD48 نيغ CD15 نيغ CD57 نيغ .
- الموت ببطء الفئران باستخدام ثاني أكسيد الكربون استنشاق تليها خلع عنق الرحم. دائما استخدام طريقة القتل الرحيم الثانوية لضمان أن الحيوان الموت الرحيم ميت.
ملاحظة: إيسوفلوران يمكن أن تستخدم كبديل ل كو 2 . لا ينصح الكيتامين، كما أنه يرتبط مع زيادة في ضغط العين (إيوب) عند استخدامها كمحفز للتخدير 24 ، 25 . - إدراج ملقط تحت الكرة في العين، وقبضة العصب البصري، وسحب ما يصل. سيتم استئصال الكرة الأرضية، مع العصب البصري سليمة. مكان جمعت العينين في قارورة تحتوي على برنامج تلفزيوني والحفاظ على قارورة على الجليد حتى الخطوة التالية.
ملاحظة: يمكن لأي موظف تنفيذ هذه الخطوة بعد تلقي التدريب المناسب من وحدة رعاية الحيوان المخبرية (لاكو).
3. إعداد تعليق خلية الشبكية
- وضع العين التي تم جمعها على لوحة قاعدة من المجهر تشريح لبدء تشريح القرنية. تشريح كل عين على حدة.
- عقد بعناية العالم في قاعدة العصب البصري باستخدام ملقط. لهذه الخطوة، استخدم لون واحدز، وملقط معيار قصير واحد.
- استخدام إبرة حادة 30 (30G) حادة لثقب القرنية للسماح الفكاهة المائية لإخلاء من العين، مما يجعل من الاسهل لعقد العين مع ملقط.
- عقد القرنية مع ملقط واستخدام مقص لجعل شق صغير في القرنية. قشر بلطف القرنية الصلبة باستخدام ملقط. عندما يتم تقشير الكرة الأرضية في منتصف الطريق، لفة الشبكية وعدسة خارج باستخدام ملقط. تجاهل القرنية، الصلبة، والعدسة.
ملاحظة: هذا الأسلوب يضمن أن شبكية العين منفصلة تماما عن ما تبقى من العين. - وضع شبكية العين في صحن بيتري صغير 40 ملم تحتوي على بس / 1٪ فبس.
ملاحظة: كبديل للطبق بيتري، طبق ثقافة الخلية يمكن استخدامها. تأكد من أن تبقي دائما رطبة الشبكية، كما هو الحال في الظروف الفسيولوجية.- غسل كل شبكية العين ثلاث مرات مع العقيمة بس / 1٪ فبس داخل مجلس الوزراء السلامة الأحيائية.
- وضع ما يصل إلى 12 الشبكية جرامعقم 70 ميكرون النايلون مصفاة مبلل مع بس / 1٪ فبس. باستخدام الجزء الخلفي من حقنة 10 مل، تقشير بلطف الشبكية باستخدام حركة دائرية لفصل الخلايا.
- بدلا من ذلك، استخدم مدقة للخلية مصفاة حشو أو استخدام الهضم الأنزيمي مع مزيج من 15 إيو / مل غراء، 5 ملي L- السيستين، و 200 U / مل الدناز I لمدة 15 دقيقة عند 37 درجة مئوية، تليها تعطيل مع برنامج تلفزيوني / 10٪ فبس.
ملاحظة: لم يلاحظ أي تغييرات في النسبة المئوية للخلايا المستردة عندما تمت مقارنة الهضم الأنزيمي إلى التخدير مع إما في نهاية المحقنة أو المدقة.
- بدلا من ذلك، استخدم مدقة للخلية مصفاة حشو أو استخدام الهضم الأنزيمي مع مزيج من 15 إيو / مل غراء، 5 ملي L- السيستين، و 200 U / مل الدناز I لمدة 15 دقيقة عند 37 درجة مئوية، تليها تعطيل مع برنامج تلفزيوني / 10٪ فبس.
- لنقل الخلايا المعزولة، ووضع العقيمة 70 ميكرون النايلون مصفاة على أنبوب جمع البولي بروبيلين. تمرير الخلايا التي تم جمعها من خلال مصفاة باستخدام ماصة P1000. شطف مصفاة ( الخطوة 3.6 ) مع بس / 1٪ فبس للافراج عن أي الخلايا المتبقية ونقلها إلى أنبوب جمع.
- إضافة بس / 1٪ فبس إلى أشإييف الحجم النهائي من 1 مل لكل شبكية العين. الطرد المركزي تعليق خلية لمدة 7 دقائق في 200 x ج و رت.
ملاحظة: اعتمادا على عدد من الشبكية ماهيراتد (<6 ريتيناي)، بيليه الخلية قد تكون صغيرة جدا لتكون مرئية.- تجاهل طاف الخلية و ريسوسبيند بيليه الخلية في برنامج تلفزيوني / 1٪ فبس باستخدام نسبة 1 مل لكل 5 الشبكية.
- عد الخلايا باستخدام عدادة الكريات.
- تنظيف الكريات الزجاجية و ساترة مع 70٪ الكحول. دوامة بلطف أنبوب يحتوي على الخلايا للتأكد من أن تعليق خلية الشبكية موزعة بالتساوي. وضع 20 ميكرولتر من 0.4٪ تريبان الأزرق في أنبوب ميكروسنتريفوج وتخلط مع 20 ميكرولتر من تعليق الخلية.
- مزيج بلطف وتطبيق 10 ميكرولتر من 0.4٪ تريبان الأزرق / خلية تعليق مزيج إلى عدادة الكريات، وملء كل من الغرف. العمل الشعري سوف رسم 0.4٪ تريبان الأزرق / خلية تعليق مزيج تحت ساترة. باستخدام المجهر، عد جميع الخلايا التريبان الأزرق السلبية. ثيs يمثل عدد الخلايا الحية.
- تحديد بقاء الخلية باستخدام الصيغة التالية: عدد الخلايا الحية / إجمالي عدد الخلايا =٪ الجدوى.
ملاحظة: إذا كانت صلاحية الخلايا أقل من 95٪، واستخدام صبغة الفلورسنت للتمييز بقاء الخلية مطلوب خلال فاكس.
- استخدام صبغة الفلورسنت البقاء على قيد الحياة التي هي غير-- تتخلل الخلايا الحية. غسل الخلايا مع برنامج تلفزيوني لإزالة أي أثر من المصل. إضافة 1 ميكرولتر من صبغة الفلورسنت للتمييز بقاء الخلية لكل 5.0 × 10 6 خلايا في حجم النهائي 100 ميكرولتر. احتضان في رت لمدة 15 دقيقة، محمية من الضوء. إضافة 10x حجم بس / 1٪ فبس. أجهزة الطرد المركزي لمدة 5 دقائق في 200 زغ و رت.
- احتضان تعليق الخلية بين عشية وضحاها في 4 درجات مئوية، إذا لزم الأمر. إذا تم ذلك، وملء أنبوب تعليق خلية مع المتوسطة خلية العصبية بدلا من بس / 1٪ فبس. وضع أنبوب أفقيا والاحتفاظ بها في 4 درجات مئوية.
4. إمونولابيلينغ ريخلايا تينال
- استخدام التحويل التالي لتحديد حجم الأجسام المضادة لكل رقم الخلية: 2 ميكرولتر من الأجسام المضادة لكل 5.0 × 10 6 خلايا في حجم 100 ميكرولتر.
- غسل الخلايا والحفاظ عليها في بس / 1٪ فبس. تأخذ قسامة صغيرة من الخلايا (5.0 × 10 6 خلايا) لاستخدامها كعنصر تحكم سلبي (غير المسماة) في وقت الإعداد الفرز.
ملاحظة: هذه السيطرة السلبية أمر بالغ الأهمية للمعايرة المناسبة للفرز الخلية. - لتقليل ملزمة غير محددة من الأجسام المضادة للخلايا التي تعبر عن مستقبلات Fc II الثاني والثالث، إضافة 1 ميكرولتر من الأجسام المضادة CD16 / 32 المضادة للماوس في 1.0 × 10 6 خلايا في حجم النهائي 50 ميكرولتر باستخدام برنامج تلفزيوني / 1٪ FBS. احتضان لمدة 10 دقيقة في رت.
- إضافة كوكتيل الأجسام المضادة للعينة وتخلط بلطف بيبتينغ. احتضان لمدة 30 دقيقة في دلو الثلج. تأكد من تغطية دلو الثلج، حيث أن الضوء قد يضر التجربة بسبب فوتوبلاشينغ من الفلورو الموسومةphores.
- إعداد كوكتيل الأجسام المضادة باستخدام التالية فلورزنتلي الموسومة المضادة للماوس الأجسام المضادة: CD90.2 أف-700، CD48 بي-Cyanine7، CD15 بي، و CD57 الامم المتحدة الموسومة.
ملاحظة: لكل الأجسام المضادة، استخدم تركيزات التالية في 5.0 × 10 6 خلايا: CD90.2 AF700، 1 ميكروغرام. CD48 بي-Cyanine7، 0.4 ميكروغرام؛ CD15 بي، 0.02 ميكروغرام؛ و CD57 غير الموسومة، 0.4 ميكروغرام.- استخدام وحدات التخزين وفقا للحسابات التالية (على أساس الأجسام المضادة المتاحة تجاريا المدرجة في جدول المواد ): مجموع 5.0 × 10 7 خلايا ليتم وصفها؛ 2 ميكرولتر لكل 5.0 × 10 6 خلايا = 20 ميكرولتر من كل الأجسام المضادة. 4 الأجسام المضادة مختلفة = 80 ميكرولتر من كوكتيل الأجسام المضادة. الحجم النهائي = [(5.0 × 10 7 مجموع الخلايا) /5.0 × 10 6 خلايا] × 100 = 1000 ميكرولتر. 80 ميكرولتر عبس + 50 ميكرولتر من مكافحة الماوس CD16 / 32 + 870 ميكرولتر بس / 1٪ فبس = 1،000 ميكرولتر.
ملاحظة: قدمت هذه المجموعةمزيج مثالي من فلوروكروميس لتكوين الصك. المعلمات التالية تلخيص الانبعاثات والإثارة: أف-700، انبعاث 719 نانومتر عندما متحمس مع ليزر ديود أحمر 638 نانومتر. بي-Cyanine7، انبعاث 767 نانومتر عندما متحمس مع ليزر ديود الأزرق 488 نانومتر. و بي، انبعاث 575 نانومتر عندما متحمس مع ليزر ديود 488 نانومتر الأزرق.
- استخدام وحدات التخزين وفقا للحسابات التالية (على أساس الأجسام المضادة المتاحة تجاريا المدرجة في جدول المواد ): مجموع 5.0 × 10 7 خلايا ليتم وصفها؛ 2 ميكرولتر لكل 5.0 × 10 6 خلايا = 20 ميكرولتر من كل الأجسام المضادة. 4 الأجسام المضادة مختلفة = 80 ميكرولتر من كوكتيل الأجسام المضادة. الحجم النهائي = [(5.0 × 10 7 مجموع الخلايا) /5.0 × 10 6 خلايا] × 100 = 1000 ميكرولتر. 80 ميكرولتر عبس + 50 ميكرولتر من مكافحة الماوس CD16 / 32 + 870 ميكرولتر بس / 1٪ فبس = 1،000 ميكرولتر.
- إعداد كوكتيل الأجسام المضادة باستخدام التالية فلورزنتلي الموسومة المضادة للماوس الأجسام المضادة: CD90.2 أف-700، CD48 بي-Cyanine7، CD15 بي، و CD57 الامم المتحدة الموسومة.
- بعد الحضانة 30 دقيقة، وجلب حجم يصل إلى 5 مل باستخدام بس / 1٪ فبس. غسل العينات عن طريق الطرد المركزي لهم لمدة 7 دقائق في 200 x ج و رت. كرر الإجراء مرة واحدة لإزالة جميع الأجسام المضادة غير منضم.
- إضافة 2 ميكرولتر من الأجسام المضادة الثانوية (0.1 ميكروغرام)، والتي سوف تربط CD57 من 5.0 × 10 6 خلايا. احتضان لمدة 30 دقيقة في دلو الثلج، كما هو الحال في الخطوة 4.4 . غسل الخلايا مرتين، كما هو الحال في الخطوة 4.5 .
- تسمية الخلايا مع الأجسام المضادة الثانوية إذا تم استخدام الأجسام المضادة الأولية غير الموسومة في الخطوة 4.4 .
ملاحظة: الثانيةويرد الأجسام المضادة من اختيار لهذا التكوين في جدول المواد . لديها الطول الموجي الانبعاثات من 421 نانومتر. استخدامه مع مرشح ممر الموجة من 450/50 نانومتر عندما متحمس مع ليزر الصمام الثنائي البنفسجي في 405 نانومتر. - استخدام وحدات التخزين وفقا للحسابات التالية (على أساس الأجسام المضادة المتاحة تجاريا المدرجة في جدول المواد ): 2 ميكرولتر لكل 5.0 × 10 6 خلايا = 20 ميكرولتر من الأجسام المضادة الثانوية. الحجم النهائي = [(5.0 × 10 7 مجموع الخلايا) /5.0 × 10 6 خلايا] × 50 = 500 ميكرولتر. 20 ميكرولتر من عبس + 480 ميكرولتر بس / 1٪ فبس = 500 ميكرولتر.
- تسمية الخلايا مع الأجسام المضادة الثانوية إذا تم استخدام الأجسام المضادة الأولية غير الموسومة في الخطوة 4.4 .
- الحفاظ على الخلايا المسمى في بس / 1٪ فبس. عد الخلايا باستخدام عدادة الكريات. استخدام تركيز خلية الشبكية النهائي من 3.0 - 4.0 × 10 7 خلايا / مل.
ملاحظة: لا تستخدم وسط ثقافة الخلية لتخفيف الخلايا لأن الفينول الأحمر يمكن أن تزيد من تألق ذاتي، وبالتالي الحد من القرار بين نيغاتخلايا إيجابية وإيجابية. تركيز الخلية النهائي لكل حجم يعتمد بشكل كبير على معدل تدفق حجم تكوين الجهاز. - استخدام الضوابط لون واحد أثناء الإعداد للحد من انتشار مضان.
ملاحظة: يتم تطبيق هذه الخطوة، والمعروفة أيضا باسم التعويض، لتصحيح الضوضاء الناتجة عن مزيج من فلوروفوريس. المجهرية البوليستيرين في برنامج تلفزيوني / 0.1٪ بسا / 2 ملي نان 3 مع القدرة على ربط فلورزنتلي الموسومة الغلوبولين المناعي (إيغ) إيزوتيبس من أنواع متعددة توفر ضوابط إيجابية لتحديد التعويض.- وضع 3 قطرات من المجهرية البوليسترين في أنابيب فاكس العقيمة، وتخصيص واحد في فلورفور. إضافة 1 ميكروغرام من فلورفور منها لكل أنبوب. احتضان لمدة 15 دقيقة في رت، محمية من الضوء. إضافة 3 مل من بس / 1٪ فبس إلى أنابيب العينة. أجهزة الطرد المركزي لمدة 5 دقائق في 200 زغ و رت. إزالة بعناية طاف و ريسوسبيند في 250 ميكرولتر من بس / 1٪ فبس.
- لإعداد كونتر السلبيةأولس، استخدام المجهرية البوليسترين التي لا ترتبط إيغ. تنفيذ هذه الخطوة في اليوم السابق، إذا لزم الأمر.
5. خلية فرز الاستراتيجية
ملاحظة: تعليمات محددة لإعداد أداة ل فاكس مع 355 نانومتر، الأشعة فوق البنفسجية. 405 نانومتر، البنفسج؛ 488 نانومتر، الأزرق؛ و 640 نانومتر، وأشعة الليزر الحمراء مع 2، 2، 5، و 3 توزيع قناة مضان، على التوالي. كان برنامج التشغيل ديفا الإصدار 8.0.1. تم إجراء الفرز الخلوي مع فوهة 70 ميكرون و 70 يسي ضغط غمد، 87.5 تردد، 48.6 السعة مع أول قطرة كسر في 333، الفجوة أسيتينغ من 6، نوع الدقة مجموعة إلى نقاء رباعية مع الافتراضي (32) قناع النقاء، وانخفاض تأخير تعديلها إلى 42.98 باستخدام الخرز.
- استخدام 15-مل أنابيب البولي بروبيلين مخروطي كما الأوعية جمع. إضافة 5 مل من وسط جمع (خلية ثقافة المتوسطة) إلى كل أنبوب وتدوير أنبوب لطلاء الجدران.
ملاحظة: هذه الخطوة تمنع الخلايا من الالتصاق إلى جانبي tانه جمع أنبوب. كبديل، يمكن أن تكون مغلفة أنبوب مع فبس غير مخفف. - تأخذ في الاعتبار كفاءة فارز الخلية لتقدير العائد النهائي للخلايا.
ملاحظة: كفاءة هذا النوع يختلف على أساس تدفق مقياس الكريات المستخدمة. رغس مع CD90.2 + CD48 نيغ CD15 نيغ CD57 نيغ النمط الظاهري تشمل حوالي 1٪ من جميع خلايا الشبكية. - يكون الفرز الخلية التي يقوم بها عامل مدرب (عادة في منشأة الأساسية). تأكد من أن الصك يتم تنظيفها وتعقيمها مع الايثانول 70٪ قبل الحصول على عينة. مسح بعناية خارج أنابيب جمع مع الايثانول 70٪ كذلك.
- إذا كانت الخلايا قد استقر أو تجميعها، ماصة الخلايا صعودا وهبوطا وتصفية التعليق من خلال مصفاة النايلون 40 ميكرون العقيمة قبل الاستحواذ. تأكد من السيطرة على درجة الحرارة والاحتفاظ بها في 4 درجات مئوية في حين يتم تنفيذ الفرز الخلية. والفشل في القيام بذلك سوف يقلل من سلل العائد.
- ناقش تفاصيل هذا النوع مع مشغل فارز الخلية قبل إجراء التجارب.
ملاحظة: في وقت التجربة، سيقوم عامل فارز الخلية بالنقر فوق سلسلة من الأزرار من شريط أدوات مساحة العمل لبرنامج اقتناء جهاز قياس الكريات. هذه هي المستعرض ، عداد الخلوي ، المفتش ، ورقة العمل ، واكتساب لوحة التحكم . استراتيجية الفرز الخلية المستخدمة هنا يعرف باسم نوع 2 في اتجاه. يتم جمع مجموعتين: رغس المخصب وجميع أنواع الخلايا الأخرى. إذا تم جمع عدد إضافي من السكان، يمكن عزل ما يصل إلى مجموعتين إضافيتين كصنف من 4 اتجاهات. إذا سيتم جمع السكان إضافية، فارز الخلية يتطلب أنابيب جمع مختلفة والإعداد. - أداء تعويض لتصحيح التداخل الطيفي من فلوروفوريس.
ملاحظة: هذه العملية يمكن القيام به يدويا عن طريق ضبطفي كل إعداد، أو يمكن أن يتم تلقائيا كجزء من البرنامج المستخدم. معظم البرمجيات لمعدات فرز الخلايا لديها خيار التعويض الآلي. ويعتبر المعيار الذهبي ونوع التعويض الأكثر دقة. سيتم استخدام العينة السلبية (لا فلورفور) والضوابط واحدة أعدت مع المجهرية بوليسترين (الخرز التعويض) المصنعة خصيصا لربط جميع الأجسام المضادة وحيدة النسيلة ذات الصلة المستخدمة في التجربة في هذه الخطوة.- حدد التجربة> إعداد التعويض> إنشاء عناصر التحكم في التعويض . إضافة الضوابط فلورفور محددة من القائمة المعروضة في الشاشة. انقر فوق موافق .
ملاحظة: سيتم عرض أنبوب تعويض لكل من عناصر التحكم.- استخدام عنصر تحكم غير المسمى (لا فلورفور، الخطوة 4.2 ) للتحقق من الضوء المتناثرة إلى الأمام (فسك)، والضوء المتناثرة الجانب (سك)، وبوابة السكان الأولي (P1).
- تثبيت أنبوب التحكم السلبي على عداد الكريات وانقر فوق تحميل. تحقق من أن يتم عرض السكان المعنيين وتحديده. هذا هو عدد السكان 1 (P1). انقر بزر الماوس الأيمن فوق بوابة P1 وحدد تطبيق على كافة عناصر التحكم في التعويض . انقر على تسجيل البيانات . بمجرد الانتهاء من التسجيل، انقر فوق إلغاء تحميل الأنبوب وإزالته.
- تثبيت أنبوب المقبل على مقياس الكريات، كما هو موضح على الشاشة. كرر الخطوة 5.6.2 حتى يتم تسجيل كافة البيانات من عناصر التحكم.
- حدد التجربة> إعداد التعويض> حساب التعويض . احفظ الإعداد واسم التجربة. انقر على الرابط والحفظ .
ملاحظة: التعويض هو خطوة ضرورية، لأنه يزيل التداخل الطيف بين أجهزة الكشف. - إذا كان هناك حاجة إلى التعويض اليدوي، القيام بذلك عن طريق ضبط وسائل الإشارات الإيجابية بحيث تساوي السلبيات ل إيكساعة من فلوروكروميس المستخدمة.
ملاحظة: تتم هذه الخطوة من قبل عملية فارز الخلية وقد يستغرق 30 دقيقة.
- حدد التجربة> إعداد التعويض> إنشاء عناصر التحكم في التعويض . إضافة الضوابط فلورفور محددة من القائمة المعروضة في الشاشة. انقر فوق موافق .
- استراتيجية غابينغ ( الشكل 3A ).
- إعداد P1 عن طريق التآمر فسك مقابل سك؛ و فسك يدل على حجم و سك يشير إلى التعقيد الداخلي للخلايا. انظر الشكل 3 أ .
- رسم مؤامرة بسيودوكولور من سك-H (الارتفاع) مقابل سك-W (العرض) باستخدام السكان المحدد في الخطوة 5.7.1 (P1). مؤامرة بسيودوكولور يسمح للتمثيل البصري لكثافة الخلايا بالنسبة لبعضها البعض.
ملاحظة: يتم تمثيل كثافة الخلايا الأقل باللون الأزرق والأخضر، في حين تمثل المناطق الحمراء والبرتقالية كثافة الخلايا العالية.- تنفيذ هذه الخطوة لجمع خلايا واحدة فقط. وتسمى بوابة خلية واحدة P2. انظر الشكل 3 أ .
- كرر الخطوة 5.7.2 إلىمؤامرة فسك-H مقابل فسك-W باستخدام P2. تأكد من أن اختيار الخلايا واحدة باسم "دوبلتس" أو كتل الخلية يحتوي على كل علامة إيجابية وسلبية، وتوفير الإيجابية الكاذبة.
- رسم مؤامرة بسيودوكولور من CD90.2 مقابل CD48. حدد جميع الخلايا CD90.2 + CD48 نيغ للقضاء على الخلايا الأحادية من إثراء رغك. استدعاء هذه البوابة CD90.2 + CD48 نيغ ، أو P3. انظر الشكل 3 أ .
- باستخدام CD90.2 + CD48 نيج السكان المحدد أو بوابة P3، رسم مؤامرة بسيودوكولور من CD57 مقابل CD15 للقضاء على الملوثات خلية أمكرين من إثراء رغك. بوابة CD15 نيغ CD57 نيغ السكان. انظر الشكل 3 أ .
- تحديد السكان التي سيتم جمعها للعينة في إطار "فرز تخطيط" والمضي قدما في الفرز الخلية. العينة لجمع CD90.2 + CD48 نيغ CD15 نيغ CD57 نيغ ص>.
ملاحظة: يتم تحديد السكان المراد فرزهم من القائمة المنسدلة إضافة في نافذة الفرز. بعد إضافة السكان، وسوف يطلب الأحداث المستهدفة أو عدد الأحداث التي سيتم جمعها. في أي وقت، يمكن تعديل تخطيط النوع من خلال النقر على الحقل " تصنيف الموقع" الذي يحتوي على عدد السكان. 0.9٪ ± 0.3 من رغس مع النمط الظاهري CD90.2 + CD48 نيغ CD15 نيغ CD57 نيغ يتم الحصول عليها من الشباب (5-7 أسابيع من العمر) و 0.5٪ ± 0.3 و القديمة (> 12 شهرا من العمر) الفئران C57BL / 6J 23 . - باستخدام 25،000 خلية، وإجراء فحص النقاء 23 . انظر الشكل 3B -E.
ملاحظة: الاختيار نقاء هو عملية لإعادة تحليل الخلايا فرزها للتحقق من دقة من نوع الخلية. سيتم تحميل قسامة صغيرة من الخلايا فرزها على مقياس الكريات للتحقق من فعالية هذا النوع.
- وضع العلامات داخل الخلايا.
- إصلاح الخلايا فرزها لمدة 1 ساعة و بيرمابيليز في 4 درجات مئوية لجعل الخلايا غير نشطة الأيض والسماح لاختراق الأجسام المضادة داخل الخلايا.
- تمييع الأجسام المضادة التالية في حل بيرمابيليزاتيون: مكافحة رنا البروتين ملزمة مع الربط المتعدد (ربمس) في التخفيف 1: 100 في 100 ميكروغرام / مل الأسهم. المضادة للالتهابات غاما (سنسغ)، 1: 100 في 1 ملغ / مل الأسهم؛ هوموبوكس محددة في الدماغ / بو بروتين المجال 3A (BRN3A)، 1: 100 في 200 ميكروغرام / مل الأسهم؛ والطبقة المضادة للالعصبية الخاصة الثالث بيتا بيتولين (TUJ1)، 1: 100 في 1 ملغ / مل الأسهم. احتضان الخلايا وحلول الأجسام المضادة لمدة 1 ساعة في دلو الجليد المغطاة.
- غسل العينات مرتين مع بس / 1٪ فبس.
- ريسوسبيند الخلايا في الأجسام المضادة الثانوية AF488 الموسومة المناسبة في التخفيف 1: 200 لمدة 30 دقيقة في دلو الثلج.
- غسل العينات كما في الخطوة 6.1.3. الحفاظ على الخلايا فيبس / 1٪ فبس (250 ميكرولتر) حتى جاهزة للتحليل.
7. التحقق من الخلية فرز حسب تحليل قر
ملاحظة: انظر الشكل 4 .
- استخراج الحمض النووي الريبي 23 .
- استخراج الحمض النووي الريبي من 5.0 × 10 5 خلايا فرزها عن طريق تحلل الخلية والتجانس تليها إضافة الكلوروفورم.
- نقل المرحلة العليا، عديم اللون إلى ميكروتوب نظيفة لكحول هطول الأمطار تليها تركيز استخراج في عمود الدوران. أداء دناز الهضم على العمود.
- غسل العمود مع ريبونوكلياز خالية من المياه لشطف الحمض النووي الريبي.
- تقييم تركيز الحمض النووي الريبي بواسطة الطيف.
- كدنا التوليف وقبل التضخيم.
- استخدام 100 نانوغرام من المواد رنا وتخلط مع محلول يحتوي على انزيم ترانسكريبتاس العكسي، مثبط ريبونوكلياز المؤتلف (لتجنب تدهور الحمض النووي الريبي)، كلوريد المغنيسيوم (مغكلتر 2 )، و ديوكسينوكليوتيدس.
- مزيج محتويات أنبوب واحتضان لمدة 10 دقيقة في 25 درجة مئوية تليها 60 دقيقة في 42 درجة مئوية. الانتهاء من رد فعل مع حضانة 5 دقائق في 85 درجة مئوية. تخزين كدنا الناتجة في -20 درجة مئوية حتى جاهزة للاستخدام.
ملاحظة: يمكن تخزين المواد [كدنا] في -20 درجة مئوية لمدة تصل إلى شهر إذا كانت الخطوة ما قبل التضخيم لا يمكن القيام بها على الفور.
- قبل التضخيم من [كدنا].
- قبل تضخيم المواد [كدنا] باستخدام سلسلة من الاشعال محددة لأنواع متعددة من خلايا الشبكية بما في ذلك: خلايا العقدة الشبكية والخلايا إماكرين، الخلايا النجمية، مولر، القطبين، الأفقي، مستقبلات الضوء، والخلايا الشبكية الصباغية الصباغية، على النحو المفصل في المرجع 23 وفي الجدول من المواد .
ملاحظة: يتم إعداد تفاعل ما قبل التضخيم لزيادة حساسية الكشف عن القياس الكمي. يحتوي تفاعل ما قبل التضخيم على خليط من التمهيدييمزج من جدول المواد ؛ 2.5 ميكرولتر من [كدنا]، والتي بدأت في 100 نانوغرام من الحمض النووي الريبي. انزيم ترانسكريبتاس العكس؛ و نوكليس خالية من المياه في الحجم النهائي من 10 ميكرولتر. - تنفيذ خطوة تنشيط الانزيم في 95 درجة مئوية لمدة 10 دقيقة، تليها 14 دورات في 95 درجة مئوية لمدة 15 ثانية، تليها 60 درجة مئوية لمدة 4 دقائق. تمييع المواد قبل تضخيم 1:10 في تريس إدتا العازلة والاحتفاظ بها في -20 درجة مئوية حتى جاهزة للاستخدام.
- قبل تضخيم المواد [كدنا] باستخدام سلسلة من الاشعال محددة لأنواع متعددة من خلايا الشبكية بما في ذلك: خلايا العقدة الشبكية والخلايا إماكرين، الخلايا النجمية، مولر، القطبين، الأفقي، مستقبلات الضوء، والخلايا الشبكية الصباغية الصباغية، على النحو المفصل في المرجع 23 وفي الجدول من المواد .
- 7.4 رد فعل قر.
- إعداد جميع ردود الفعل قر في 10 ميكرولتر الحجم النهائي باستخدام المخفف، قبل تضخيم [كدنا (2.5 ميكرولتر)، الاشعال (المدرجة في جدول المواد )، نوكليس خالية من المياه، والتركيز مع البلمرة دنا و ديوكسينوكليوتيدس.
- استخدام الشروط أداة التالية لتشغيل قر: خطوة عقد من 50 درجة مئوية لمدة 2 دقيقة، تليها 95 درجة مئوية لمدة 10 دقيقة. تشغيل ما مجموعه 40 دورة في 95 درجة مئوية لمدة 15 ثانية تليها 60 درجة مئوية لمدة 1 دقيقة. تنفيذ كل قياسإيمنتس في مكررات من ثلاثة.
- إجراء القياس الكمي باستخدام عتبة المقارنة (C T ) بعد تحديد قيم C T لجينات التدبير المنزلي والجينات المستهدفة في كل عينة. احسب التغير النسبي النسبي (R q ) باستعمال المعادلة التالية: R q = 2 T -ΔC ، حيث الجينات المستهدفة ΔC T = C T - الجينات المرجعية T T 23 .
ملاحظة: يتم تعريف C T على أنها دورة ير التي إشارة الفلورسنت صبغ مراسل يعبر عتبة وضعت بشكل تعسفي 26 . و C T يرتبط عكسيا إلى كمية أمبليكون (المنتج ير) في رد الفعل.
النتائج
وتعرقل الدراسة المتعمقة للمجموعات رغس عوامل كثيرة، منها انخفاض تواترها وعدم وجود منهجية قوية وموحدة لعزلها. ويبين الشكل 1 المنهجية المستخدمة لعزل الشبكية. الاختلافات في إجراء استئصال موجودة على أساس نوع التحليل، مثل إذا كان استئصال جزء من التجريب في الجسم الحي 27 . يتم تنفيذ استئصال في هذا البروتوكول على الفئران الموت الرحيم. كما هو مبين في الشكل 1A -B ، يتم وضع ملقط تحت العين وسحبت ما يصل إلى الحد الأدنى من النزيف وإزالة الكرة العين مع العصب البصري سليمة.
توجد اختلافات في عدد رغس في سلالات الماوس المختلفة، وخاصة في الفئران المعدلة وراثيا 23 ، 28 ،إف "> 29 ، 30. الوعي بهذه الاختلافات مهم عند تحديد عدد الفئران لاستخدامها.الشبكية من الفئران القديمة C57BL / 6J لديها خلايا الشبكية الحية أقل من نظرائهم الأصغر سنا 23. لذلك، يجب أن يتم تشريح الشبكية بعناية إلى تعظيم العائد الخلية.يتم عرض الإجراء خطوة بخطوة لتشريح الشبكية في الشكل 1C -J . خلايا الشبكية هي هشة، وبالتالي، يتم وضع الشبكية تشريح في مصافي النايلون ويتم تقشر إما مع نهاية الجزء الخلفي من حقنة، كما كما هو موضح في الشكل 2A ، أو مع مدقة مصافي الخلية.تطهير الخلايا مباشرة في مصفاة الخلية بسرعة ويقلل من كتل الخلايا.وتظهر صورة تمثيلية للتعليق الخلية في الشكل 2.B يمكن تصور خلايا الشبكية الداخلية متعددة. في هذه المرحلة، فقد رغس توقيعها مورفولوغراي بسبب أكسوتومي أثناء عزل الخلية وإعداد تعليق الخلية.
أكثر خطوة كثيفة العمالة لهذه المنهجية هي الخلية الفرز الإعداد. هذه المرحلة هي خطوة حاسمة خلال فاكس متعدد الألوان، لأنه يزيد من دقة الإشارة إلى الضوضاء. ويبين الشكل 3A استراتيجية النابضة المستخدمة لعزل رغس. واستهدفت هذه الاستراتيجية إزالة الخلايا الملوثة من تعليق الخلية، والتي تضم الخلايا الأحادية، الدبقية، أماكرين، والخلايا المستقبلة للضوء. وكجزء من المنهجية، تم تأكيد علامات سطح إضافية بواسطة التحليل المناعي قبل استخدامها كجزء من استراتيجية الاستبعاد. أظهرت البيانات السابقة أن نسبة صغيرة من الخلايا CD90.2 + CD48 + . استبعاد هذه الخلايا إزالة الخلايا الأحادية وربما الدبقية الصغيرة من تجمع الخلايا الشبكية. وقد تبين سابقا أن الكلاسيكية Thy1 + CD48 نيغ النمط الظاهري السطح ليست كافية لتحديد وعزل رغس الفئران 23 ، وهذه الخلايا تعبر عن الجينات المرتبطة أمكرين، مولر، ثنائي القطب، مستقبلة للضوء الأفقي، والشبكية الخلايا الظهارية الصباغية ( الشكل 4A ). ويتناول هذا الأمر مزيدا من البحث عن علامات إضافية لاستبعاد الخلايا. وقد وصفت CD15 كعلامة من أمكرين والخلايا الثنائية القطب 31 ، مما دفع استخدامه كعلامة إضافية للاختيار السلبي. العمل من أوسيتالو وآخرون. 32 وصف CD57 كعلامة تحديد للخلايا الدبقية والمستقبلات الضوئية. لذلك، تمت إضافة هذا الضد إلى استراتيجية فرز الخلايا.
بعد ذلك، اتسمت هذه الخلايا للتحقق من صحة منهجية لعزل رغس الفئران. المظاهر من CD90.2 + CD48 نيغ CD15 نيغ CD57 نيغ فرز الخلايا (<صنف قوي = "زفيغ"> الشكل 3B) للتعبير عن علامات الخلايا التالية المرتبطة مع رغس 10 ، 11 ، 12 ، 33 : سنسغ، BRN3A، TUJ1، و ربمس. كما هو مبين في الشكل 3C ، أعربت الخلايا فرزها عن أربعة البروتينات المرتبطة ركك داخل الخلايا. بعد ذلك، تم استخدام التصوير الخلوي التدفق في الشكل 3D لإظهار توطين الخلايا من ربمس والتعبير سطح الخلية من CD90.2. وقد تم اختبار هذه النتائج في أنظمة متعددة لقياس التدفق الخلوي، مؤكدة استنساخها وتوحيدها. كما هو مبين في الشكل 3E ، بدأت بعض الخلايا فرزها تظهر التشكل المرتبطة رغس بعد في الخلايا الخلوية الثقافة.
وأخيرا، مقارنة الخلايا قبل إثراء وبعد مرحلة ماوسيتم تحليل ليرة لبنانية تحليل قر. مقارنة النمط الظاهري ثي + CD48 نيغ إلى CD90.2 + CD48 نيج CD15 نيغ CD57 نيغ فرز الخلايا كشفت أن النمط الظاهري Thy1 + CD48 يعبر عن الجينات المرتبطة رغس، ولكن أيضا مع خلايا الشبكية الأخرى. ومع ذلك، أظهر السكان الخلية الفرز المخصب للغاية ( الشكل 4B ) زيادة عدة أضعاف في الجينات الترميز للعلامات محددة الخلايا رجك سنسغ (سنسغ)، Pouf4l (BRN3A)، Tubb3 (TUJ1)، و ربمس (ربمس). بشكل جماعي، فإن تقييم مرنا والبروتين التحقق من صحة المنهجية.
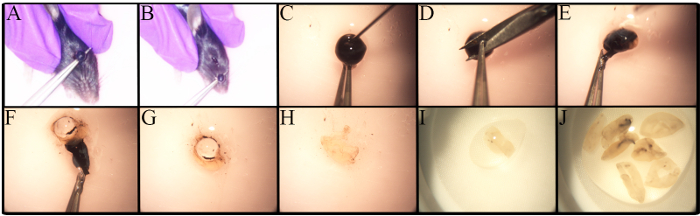
الشكل 1 . استئصال وتشريح العين لعزل الشبكية. يوثانيزد الشباب C57BL / 6J الموت الرحيم قبل رس إزالة العين الكرة مع كو 2 وخلع عنق الرحم. أ) مكان ملقط تحت العين وسحب ما يصل العين في حركة واحدة. ب) إزالة العين، بما في ذلك العصب البصري. سغ) خطوة بخطوة دليل لإزالة الشبكية. ج) يتم تنفيذ ثقب باستخدام إبرة 30G قبل إزالة القرنية للسماح للنكتة المائية للخروج من العين. د) يتم عقد القرنية مع ملقط لجعل شق صغير. إف) استخدام ملقط يسمح لتقشير قبالة القرنية، الشبكية الظهارة الصباغية، المشيمية، والصلبة. يتم فصل الشبكية من الصلبة، توالت، وإزالتها. G) تتم إزالة العدسة والتخلص منها. هج) يتم وضع الشبكية التي تم جمعها في طبق صغير يحتوي على بس / 1٪ فبس للحفاظ عليها رطبة في جميع الأوقات. الرجاء انقر هنا لعرض نسخة أكبر من هذاالشكل.
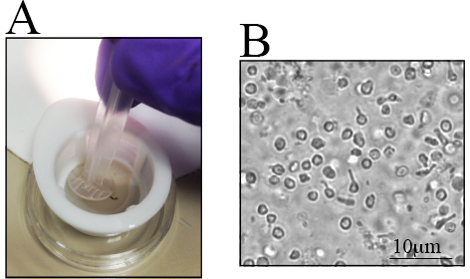
الشكل 2 . الشبكية تعليق خلية بعد تعتيم الشبكية التي تم جمعها. يتم وضع الشبكية التي تم جمعها في طبق صغير لعزل الخلايا. أ) يتم وضع الشبكية في مصفاة النايلون 70 ميكرون ومقرحة باستخدام الجزء الخلفي من حقنة. B) صورة ممثل للتعليق الخلية، حيث لوحظت خلايا الشبكية متميزة. شريط مقياس هو 10 ميكرون.

الشكل 3 . فرز استراتيجية لعزل الخلايا مع CD90.2 + CD48 نيغ CD15 نيغ CD57 نيغ النمط الظاهري وبعد التحليل الفرز. وتستند استراتيجية الفرز على إدراج الخلايا CD90.2 واستبعاد الخلايا CD48- CD15-، و CD57 إيجابية، والتي هي الخلايا الملوثة. أ) كخطوة أولى، حجم المؤامرة (فسك) والتعقيد الداخلي (سك) للحصول على لمحة عامة عن السكان الخلية. ويستخدم السكان المسورون الأولي (P1) للتمييز بين الخلايا المفردة والخلايا المجدولة أو المجاميع باستخدام سك-هيت (H) مقابل العرض (W)، P2. يتم استخدام اختيار الخلايا واحدة لاختيار الخلايا السلبية CD90.2 + CD48. لتأكيد إزالة كل دوبلتس، يتم تنفيذ مؤامرة من فسك-H مقابل فسك-W، P3 (لوحة الأوسط ). وقد وصفت الخلايا مع AF700 مترافق مكافحة الماوس CD90.2، بي-Cyanine7 مترافق CD48 المضادة للماوس، CD15 مترافق بي، ومكافحة CD57 الماوس. كما الأجسام المضادة الثانوية لوضع علامة على المضادة للماوس CD57، تم استخدام المضادة للماوس BV421. تم رسم السكان 3 (P3) في الرابع </ إم> لتحديد الخلايا السلبية CD90.2 + CD48، وإزالة معظم الخلايا الملوثة. بعد ذلك، يتم إنشاء CD57 مقابل مؤامرة CD15 باستخدام الخلايا السلبية CD90.2 + CD48 المحدد. يتم اختيار رباعي 4 (Q4)، لأنها تمثل الخلايا السلبية CD90.2 + CD48 السلبية لكل من CD15 و CD57. والنمط الظاهري الناتجة من السكان المسور هو CD90.2 + CD48 نيج CD15 نيغ CD57 نيغ . ب) تحليل ما بعد نوع من علامات السطح المستخدمة في A). الخلايا المصنفة متجانسة في الحجم، كما هو مبين في اللوحة الأولى . وتظهر الرسوم البيانية اللاحقة النسبة المئوية لكل علامة سطحية مستخدمة في استراتيجية الفرز المفصلة في A). ما مجموعه 95٪ من الخلايا هي CD90.2 + ، كما هو مبين في الخط الأسود مقارنة مع السيطرة إيغ، ممثلة في الرسم البياني الصلبة. وكانت هذه الخلايا بوابات لتقييم النسب المئوية لل CD48، CD15، و CD57، ممثلة الأحمر والأزرق، و غري n، على التوالي. تظهر النتائج الحد الأدنى من التعبير عن هذه علامات سطح الخلية. C) تأكيد النمط الظاهري رجك باستخدام رغك محددة علامات الخلايا إسنسغ، BRN3A، TUJ1، و ربمس. خطوط سوداء تمثل النسبة المئوية للخلايا معربا عن كل علامة داخل الخلايا. D) صور الممثل التي اتخذت في فارز خلية التصوير تظهر توطين الخلايا من ربمس، علامة محددة الخلايا رجك، وعلامة سطح الخلية CD90.2. شريط مقياس هو 20 ميكرون. E) صورة الممثل من رغس فرزها بعد 24 ساعة في الثقافة باستخدام المجهر متحد البؤر. شريط مقياس هو 20 ميكرون. يتم تكييف الصور بي من العمل المنشورة سابقا مع إذن 23 . وقد اتخذت الصور دي في 20X. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
العمر = "1"> 
الشكل 4 . تحليل ما قبل وبعد فرز مرنا. Thy1 + CD48 نيغ وفرز الخلايا مع النمط الظاهري CD90.2 + CD48 نيغ تم تقييم CD15 نيغ CD57 نيغ عن طريق تحليل قر باستخدام لوحة من 25 الجينات التي أعربت عنها خلايا الشبكية. يتم عرض مستويات التعبير الجيني الهدف كتغيير 2- أضعاف السجل باستخدام هبرت كجينة التدبير المنزلي والمياه باعتبارها السيطرة السلبية. تم الحساب على أساس طريقة ΔC T. متوسط ± سيم؛ تم إجراء 3 مكررات بيولوجية في ثلاث نسخ. الأرقام التي تم الحصول عليها من العمل المنشورة سابقا بإذن 23 .
Discussion
فاكس هو الأسلوب المفضل لتنقية السكان الخلية. وتشمل طرق العزل الأخرى إمونوبانينغ، الخرز المغناطيسي، واستكمال تثبيت نضوب. وتستند ميزة فاكس على هذه المنهجيات الأخرى إلى التحديد المتزامن لعلامات سطح الخلية بدرجات متفاوتة من الشدة. كثافة الفلورسنت من جزيء يتناسب مع كمية التعبير البروتين. حتى الآن، كانت العزلة من رغس تستند فقط على Thy1 (CD90) الإيجابية والسلبية CD48 15 ، 16 ، 22 ، 34 ، بغض النظر عن طريقة العزلة المستخدمة. وقد تبين مؤخرا أن Thy1 + CD48 نيغ النمط الظاهري ليست كافية لعزل السكان متجانسة من الخلايا معربا عن رغك علامات داخل الخلايا 23 . تحديد السكان رغك أمر ضروري لعزلهم، على وجه الخصوصy لأنها تشكل نسبة صغيرة من خلايا الشبكية 7 ، 8 ، 9 . وتقع غالبية رغس في الطبقة الأعمق من شبكية العين، في حين أن عدد قليل تقع في الطبقات الضفيرية الداخلية (النازحين رغس 35 ). وهكذا، فإن تتبع رغس من كوليولي متفوقة عن طريق الحقن المجسم والتعقب مع هيدروكسيستيلباميدين (التتبع الوراء للخلايا العصبية الموجزة) أصبحت خيارات جذابة للعديد من المختبرات 36 ، 37 ، 38 . هذه النظم تتطلب حقن التتبع، والتي، إذا لم يتم تنفيذها بشكل صحيح، قد يؤدي إلى بعض مناطق شبكية العين تركت دون معالجة. وبالإضافة إلى ذلك، فهي أكثر تطلبا من الناحية الفنية، ومثل غيرها من المنهجيات مثل إمونوبانينغ، هي طويلة. إمونوبانينغ باستخدام المضادة لل Thy1 و CD48 الأجسام المضادة يستغرق 48 ساعة لإكمال ولا يحقق أكثر من 95٪ نقاء. يصف هذا العمل منهجية تستند إلى فاكس التي توفر بروتوكول سريع وقابلة للتكرار لعزل السكان متجانسة من رغس الحية مع CD90.2 + CD48 نيغ CD15 نيغ CD57 نيغ النمط الظاهري، من دون استخدام أي التتبع، الخرز المغناطيسي، أو تقنيات إمونوبانينغ .
العوامل التالية مطلوبة لعزلة ناجحة رغس نقية من قبل فاكس: 1) كفاءة الفرز، والذي يعتمد إلى حد كبير على المعدات المستخدمة. 2) مزيج مثالي من فلوروكروميس الأجسام المضادة الموسومة، للحد من الضوضاء. و 3) خلية الفرز الإعداد. يتم حساب كفاءة الفرز من خلال اتخاذ عدد من الأحداث المستهدفة المحددة للفرز مقسوما على عدد من الأحداث المستهدفة الكشف عنها، وأعرب كنسبة مئوية. كفاءة النوع هي عملية حسابية تقدمها المعدات. هذه الكفاءة تعتمد على إعداد نظام الفرز ووضع الفرز الخلية. اختيار مزيج مثالي من فلوروكروميس هو عملية معقدة. كل انفلونزاأوروكروم له خصائص متميزة ويتميز بأشكاله الإثارة والانبعاثات. في حين يتم قراءة الإثارة مع الليزر، وقراءة الانبعاثات من قبل أنابيب المضاعفات الضوئية، والتي تقتصر على المرشحات البصرية المتوفرة في معدات فرز فاكس. هنا، يتم توفير مزيج من فلوكروميس الأجسام المضادة الموسومة بي، بي-Cyanine7، AF700، و BV421. وقد تم تحديد هذا بعد النظر في تركيبات متعددة فلوريكروم التي قدمت أفضل قرار مع الحد من التداخل الطيفي. وأخيرا، يعد إعداد النوع أمرا بالغ الأهمية. بشكل عام، خلايا الشبكية هشة. وبالتالي، فمن الأفضل لاستخدام ضغط أقل لتشغيل العينات، للحد من التوتر على الخلايا. فمن الأهمية بمكان للحفاظ على العينة في 4 درجات مئوية، لأن حفظ رغس الفئران لفترات أطول من الوقت في درجة حرارة الغرفة يمكن أن تقلل من عائد الخلية، وخاصة عند فرز أعداد كبيرة من الخلايا.
فاكس القائم على الفرز هو منهجية مثالية لعزل الخلايا التي تشكل أفإري نسبة صغيرة من تعليق الخلية. العملية، من تشريح الشبكية إلى الانتهاء من الفرز الخلية، ويأخذ ما يقرب من 5 - 6 ح، بالمقارنة مع نظم إمونوبانينغ وتتبع، والتي تستغرق أيام لإكمال. تحليل متعدد الأبعاد من فاكس وقدرة المعدات لجمع العديد من السكان قابلة للحياة يسمح لإجراء مزيد من التحليلات الوظيفية للخلايا. بروتوكول الموصوفة هنا هو أداة قوية لعزل رغس الفئران الأولية. على الرغم من المزايا المتعددة، بما في ذلك حساسية، استنساخه، وتحديد فوري من خلايا قابلة للحياة، وهناك بعض القيود. أولا، أنها تتطلب أجهزة مكلفة ومشغل تدريبا عاليا. عادة، المشغل هو أخصائي المناعة أو فرد المدربين تدريبا عاليا في هذا المجال، الذي هو ضروري للقاء في وقت الإعداد التجربة. في الوقت الحاضر، والمرافق الأكاديمية لديها العديد من المرافق الأساسية، والتي قد تسهل تنفيذ هذه الأنواع من التجارب. ثانيا، رغس تفقد تيبيكال مورفولوغي بسبب الأتكسومي، مما يجعلها صغيرة جدا في الحجم. في هذا الوقت، ليس من المعروف ما إذا كان قد تم تشكيل بعض جيناتها بسبب الأتكسومي.
المنهجية المعروضة هنا يسمح لتحليل المصب من وظيفة رجك في المختبر ، وهو أداة قيمة لاستخدامها في مجالات العلوم البصرية والصحية. الحفاظ على إنتاج خلية العقدة إلى الدماغ مطلوب للإدراك البصري ويتعرض للخطر في أمراض متعددة. ويمكن استخدام هذه الخلايا للتحكم في المختبر في المختبر ، في كل من النماذج الصحية والمرضية. الدراسات الكهربية، الدوائية، البيوكيميائية، والجزيئية يمكن أن يؤديها على هذه الخلايا، وهو أمر مثالي لتطوير الأهداف العلاجية في المستقبل.
Disclosures
ويعلن المؤلفون أنه ليس لديهم مصالح مالية متنافسة.
Acknowledgements
ويود المؤلفون أن يشكروا السيد تيم هيغينز، كبير المصورين من قسم علم الأحياء الدقيقة والمناعة والكيمياء الحيوية، للمساعدة التقنية الفيديوية؛ الدكتور ماثيو و. ويلسون للمناقشات وأعضاء مختبرات جابلونسكي ومورالس-تيرادو على تعليقاتهم المفيدة. وأيد هذا العمل من قبل معهد أبحاث ألكون جائزة المحقق الشاب (فمم-T)، ومؤسسة أبحاث جامعة تينيسي (فمم-T)، والمعهد الوطني للعيون EY021200 (مج)، زمالة جيروين (فمم-T). وزمالة جيروين قبل الدكتوراه (زكغ)، وإدارة البحوث الطبية وقيادة العتاد التابعة لوزارة الدفاع (فمم-T)، والمنحة غير المقيدة من البحوث لمنع العمى.
Materials
| Name | Company | Catalog Number | Comments |
| Anti-mouse CD15 PE | BioLegend | 125606 | Clone MC-480 |
| Anti-mouse CD48 PE-Cy7 | BioLegend | 103424 | Clone HM48-1 |
| Anti-mouse CD57 | Sigma Aldrich | C6680-100TST | Clone VC1.1 |
| Anti-mouse CD90.2 AF700 | BioLegend | 105320 | Clone 30-H12 |
| Brilliant Violet 421 Goat Anti-mouse IgG | BioLegend | 405317 | Clone Poly4053 |
| Purified Anti-mouse CD16/32 | BioLegend | 101302 | FcgRII/III block, Clone 93 |
| Zombie Aqua | BioLegend | 423102 | Live cell/ Dead cell discrimination |
| Fetal Bovine Serum | Hyclone | SH30071.03 | U.S. origin |
| AbC Total Antibody Compensation Bead Kit | Thermo Fisher Scientific | A10497 | Multi-species Ig |
| Neurobasal Medium | Thermo Fisher Scientific | 21103049 | Add serum to media prior to culture. |
| Phosphate-Buffered Saline (PBS) | Thermo Fisher Scientific | 10010049 | Saline solution |
| Dissection Microscope | Olympus | SZ-PT Model | Stereo Microscope |
| Sorvall Centrifuge | Thermo Scientific | ST 16R | All centrifugation performed at RT |
| Base Plate – Dissection Pan | Fisher Scientific | SB15233FIM | A wax plate can also be used |
| Forceps | Aesculap | 5002-7 | 4 ½ inches |
| Iris Scissors, Straight | Aesculap | 1360 | 5 ½ inches |
| Falcon 15 mL conical tubes | Fisher Scientific | 352097 | Polypropylene tubes |
| Falcon 50 mL conical tubes | Fisher Scientific | 352098 | Polypropylene tubes |
| BD FACS Tubes | Fisher Scientific | 352003 | Polypropylene tubes |
| 40 mm dishes | MidSci | TP93040 | Tissue culture treated |
| 70 μm nylon strainer | MidSci | 70ICS | sterile |
| 40 μm nylon strainer | MidSci | 40ICS | sterile |
| BD 10 mL syringe | Fisher Scientific | 301604 | Disposable Syringe without needle |
| Pestles | MidSci | PEST | sterile |
| Wheaton Vials | Fisher Scientific | 986734 | No Liner |
| BD 30 G needle | Fisher Scientific | 305128 | 1 inch |
| Hausser Scientific Bright-Line Glass Counting Chamber | Fisher Scientific | 0267151B | Hemocytometer |
| Gibco Trypan blue 0.4% Solution | Fisher Scientific | 15250061 | Viability Dye |
| Eppendorf tubes | Fisher Scientific | 05-402-25 | 1.5mL |
| EVOS Floid Cell Imaging | Thermo Fisher Scientific | 447113 | Fluorescence Imaging with a 20X objective |
| 100% Ethanol | Fisher Scientific | 04-355-452 | Used to make 70% Ethanol |
| Pipet-Lite LTS Pipette L-1000XLS+ | Rainin | 17014282 | LTS Pipette |
| Pipet-Lite LTS Pipette L-200XLS+ | Rainin | 17014391 | LTS Pipette |
| Pipet-Lite LTS Pipette L-20XLS+ | Rainin | 17014392 | LTS Pipette |
| Rack LTS 1000 mL – GPS-L1000S | Rainin | 17005088 | Blue Rack Sterile Tips |
| Rack LTS 250 mL – GPS-L250S | Rainin | 17005092 | Green Rack Sterile Tips |
| Rack LTS 20 mL – GPS-L10S | Rainin | 17005090 | Red Rack Sterile Tips |
| FACSAria II Cell Sorter | BD Biosciences | N/A | Custom order |
| LSR II Cytometer | BD Biosciences | N/A | Custom order |
| Abca8a | Thermo Fisher Scientific | Mm00462440_m1 | Müller cells |
| Aldh1al | Thermo Fisher Scientific | Mm00657317_m1 | Müller cells |
| Aqp4 | Thermo Fisher Scientific | Mm00802131_m1 | Astrocytes |
| Calb2 | Thermo Fisher Scientific | Mm00801461_m1 | Amacrine, Horizontal |
| Cd68 | Thermo Fisher Scientific | Mm03047340_m1 | Retinal Pigment Epithelial Cells |
| Gad2 | Thermo Fisher Scientific | Mm00484623_m1 | Amacrine |
| Hprt | Thermo Fisher Scientific | Mm01545399_m1 | House keeping gene |
| Lhx1 | Thermo Fisher Scientific | Mm01297482_m1 | Horizontal |
| Lim2 | Thermo Fisher Scientific | Mm00624623_m1 | Horizontal |
| Nrl | Thermo Fisher Scientific | Mm00476550_m1 | Photoreceptors |
| Ntrk1 | Thermo Fisher Scientific | Mm01219406_m1 | Horizontal |
| Pcp4 | Thermo Fisher Scientific | Mm00500973_m1 | Bipolar, Amacrine |
| Pou4f1 | Thermo Fisher Scientific | Mm02343791_m1 | Retinal Ganglion Cells |
| Prdx6 | Thermo Fisher Scientific | Mm00725435_s1 | Astrocytes |
| Prkca | Thermo Fisher Scientific | Mm00440858_m1 | Bipolar |
| Prox1 | Thermo Fisher Scientific | Mm00435969_m1 | Horizontal |
| Pvalb | Thermo Fisher Scientific | Mm00443100_m1 | Amacrine |
| Rbpms | Thermo Fisher Scientific | Mm02343791_m1 | Retinal Ganglion Cells |
| Rom1 | Thermo Fisher Scientific | Mm00436364_g1 | Photoreceptors |
| Rpe65 | Thermo Fisher Scientific | Mm00504133_m1 | Retinal Pigment Epithelial cells |
| Slc1a3 | Thermo Fisher Scientific | Mm00600697_m1 | Astrocytes |
| Slc6a9 | Thermo Fisher Scientific | Mm00433662_m1 | Amacrine |
| Sncg | Thermo Fisher Scientific | Mm00488345_m1 | Retinal Ganglion Cells |
| Tubb3 | Thermo Fisher Scientific | Mm00727586_s1 | Retinal Ganglion Cells |
| Vim | Thermo Fisher Scientific | Mm01333430_m1 | Müller cells |
| Taqman Universal Master Mix | Thermo Fisher Scientific | 4440047 | qPCR Reagent |
| miRNeasy Mini Kit | Qiagen | 217004 | RNA Isolation |
| SuperScript VILO cDNA Synthesis Kit | Thermo Fisher Scientific | 11754250 | cDNA synthesis |
| Taqman PreAmp Master Mix | Thermo Fisher Scientific | 4391128 | Pre-Amplification step |
| BD Cytofix/ Cytoperm | BD Biosciences | 554714 | Fixation/ Permeabilization Buffer |
| BD Perm/ Wash | BD Biosciences | 554723 | Permeabilization Solution |
| RBPMS | Santa Cruz Biotechnology | sc-86815 | intracellular antibody |
| SNCG | Gene Tex | GTX110483 | intracellular antibody |
| BRN3A | Santa Cruz Biotechnology | sc-8429 | intracellular antibody |
| TUJ1 | BioLegend | 801202 | intracellular antibody |
References
- Flammer, J., Orgul, S. Optic nerve blood-flow abnormalities in glaucoma. Prog Retin Eye Res. 17 (2), 267-289 (1998).
- Bathija, R. Optic nerve blood flow in glaucoma. Clin Exp Optom. 83 (3), 180-184 (2000).
- Osborne, N. N., Melena, J., Chidlow, G., Wood, J. P. A hypothesis to explain ganglion cell death caused by vascular insults at the optic nerve head: possible implication for the treatment of glaucoma. Br J Ophthalmol. 85 (10), 1252-1259 (2001).
- Morgan, J. E. Circulation and axonal transport in the optic nerve. Eye (Lond). 18 (11), 1089-1095 (2004).
- Tian, N., Hwang, T. N., Copenhagen, D. R. Analysis of excitatory and inhibitory spontaneous synaptic activity in mouse retinal ganglion cells. J Neurophysiol. 80 (3), 1327-1340 (1998).
- Schmidt, K. G., Bergert, H., Funk, R. H. Neurodegenerative diseases of the retina and potential for protection and recovery. Curr Neuropharmacol. 6 (2), 164-178 (2008).
- Dreher, B., Sefton, A. J., Ni, S. Y., Nisbett, G. The morphology, number, distribution and central projections of Class I retinal ganglion cells in albino and hooded rats. Brain Behav Evol. 26 (1), 10-48 (1985).
- Williams, R. W., Strom, R. C., Rice, D. S., Goldowitz, D. Genetic and environmental control of variation in retinal ganglion cell number in mice. J Neurosci. 16 (22), 7193-7205 (1996).
- Jeon, C. J., Strettoi, E., Masland, R. H. The major cell populations of the mouse retina. J Neurosci. 18 (21), 8936-8946 (1998).
- Surgucheva, I., Weisman, A. D., Goldberg, J. L., Shnyra, A., Surguchov, A. Gamma-synuclein as a marker of retinal ganglion cells. Mol Vis. 14, 1540-1548 (2008).
- Nadal-Nicolas, F. M., et al. Brn3a as a marker of retinal ganglion cells: qualitative and quantitative time course studies in naive and optic nerve-injured retinas. Invest Ophthalmol Vis Sci. 50 (8), 3860-3868 (2009).
- Kwong, J. M., Caprioli, J., Piri, N. RNA binding protein with multiple splicing: a new marker for retinal ganglion cells. Invest Ophthalmol Vis Sci. 51 (2), 1052-1058 (2010).
- Van Bergen, N. J., et al. Recharacterization of the RGC-5 retinal ganglion cell line. Invest Ophthalmol Vis Sci. 50 (9), 4267-4272 (2009).
- Wood, J. P., Chidlow, G., Tran, T., Crowston, J. G., Casson, R. J. A comparison of differentiation protocols for RGC-5 cells. Invest Ophthalmol Vis Sci. 51 (7), 3774-3783 (2010).
- Barres, B. A., Silverstein, B. E., Corey, D. P., Chun, L. L. Immunological, morphological, and electrophysiological variation among retinal ganglion cells purified by panning. Neuron. 1 (9), 791-803 (1998).
- Hong, S., Iizuka, Y., Kim, C. Y., Seong, G. J. Isolation of primary mouse retinal ganglion cells using immunopanning-magnetic separation. Mol Vis. 18, 2922-2930 (2012).
- Julius, R. S. The sensitivity of exponentials and other curves to their parameters. Comput Biomed Res. 5 (5), 473-478 (1972).
- Reif, A. E., Allen, J. M. The Akr Thymic Antigen and Its Distribution in Leukemias and Nervous Tissues. J Exp Med. 120, 413-433 (1964).
- Watanabe, M., Noguchi, T., Tsukada, Y. Regional, cellular, and subcellular distribution of Thy-1 antigen in rat nervous tissues. Neurochem Res. 6 (5), 507-519 (1981).
- Haeryfar, S. M., Hoskin, D. W. Thy-1: more than a mouse pan-T cell marker. J Immunol. 173 (6), 3581-3588 (2004).
- Sahagun, G., Moore, S. A., Fabry, Z., Schelper, R. L., Hart, M. N. Purification of murine endothelial cell cultures by flow cytometry using fluorescein-labeled griffonia simplicifolia agglutinin. Am J Pathol. 134 (6), 1227-1232 (1989).
- Shoge, K., et al. Rat retinal ganglion cells culture enriched with the magnetic cell sorter. Neurosci Lett. 259 (2), 111-114 (1999).
- Chintalapudi, S. R., et al. Isolation and Molecular Profiling of Primary Mouse Retinal Ganglion Cells: Comparison of Phenotypes from Healthy and Glaucomatous Retinas. Front Aging Neurosci. 8, 93(2016).
- Nagdeve, N. G., Yaddanapudi, S., Pandav, S. S. The effect of different doses of ketamine on intraocular pressure in anesthetized children. J Pediatr Ophthalmol Strabismus. 43 (4), 219-223 (2006).
- Ding, C., Wang, P., Tian, N. Effect of general anesthetics on IOP in elevated IOP mouse model. Exp Eye Res. 92 (6), 512-520 (2011).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative C(T) method. Nat Protoc. 3 (6), 1101-1108 (2008).
- Aerts, J., Nys, J., Arckens, L. A highly reproducible and straightforward method to perform in vivo ocular enucleation in the mouse after eye opening. J Vis Exp. (92), e51936(2014).
- Li, X., et al. Loss of AP-2delta reduces retinal ganglion cell numbers and axonal projections to the superior colliculus. Mol Brain. 9 (1), 62(2016).
- Moshiri, A., et al. Near complete loss of retinal ganglion cells in the math5/brn3b double knockout elicits severe reductions of other cell types during retinal development. Dev Biol. 316 (2), 214-227 (2008).
- Danias, J., et al. Quantitative analysis of retinal ganglion cell (RGC) loss in aging DBA/2NNia glaucomatous mice: comparison with RGC loss in aging C57/BL6 mice. Invest Ophthalmol Vis Sci. 44 (12), 5151-5162 (2003).
- Jakobs, T. C., Ben, Y., Masland, R. H. CD15 immunoreactive amacrine cells in the mouse retina. J Comp Neurol. 465 (3), 361-371 (2003).
- Uusitalo, M., Schlotzer-Schrehardt, U., Kivela, T. Ultrastructural localization of the HNK-1 carbohydrate epitope to glial and neuronal cells of the human retina. Invest Ophthalmol Vis Sci. 44 (3), 961-964 (2003).
- Jackson, C. J., Garbett, P. K., Nissen, B., Schrieber, L. Binding of human endothelium to Ulex europaeus I-coated Dynabeads: application to the isolation of microvascular endothelium. J Cell Sci. 96 ( Pt 2), 257-262 (1990).
- Pennartz, S., Perraut, M., Pfrieger, F. Purification of retinal ganglion cells from postnatal rats by magnetic cell sorting. MACSmore. 12 (2), 16-18 (2010).
- Nadal-Nicolas, F. M., et al. Displaced retinal ganglion cells in albino and pigmented rats. Front Neuroanat. 8, 99(2014).
- Nadal-Nicolas, F. M., Salinas-Navarro, M., Vidal-Sanz, M., Agudo-Barriuso, M. Two methods to trace retinal ganglion cells with fluorogold: from the intact optic nerve or by stereotactic injection into the optic tract. Exp Eye Res. 131, 12-19 (2015).
- Barnstable, C. J., Drager, U. C. Thy-1 antigen: a ganglion cell specific marker in rodent retina. Neuroscience. 11 (4), 847-855 (1984).
- Chiu, K., Lau, W. M., Yeung, S. C., Chang, R. C., So, K. F. Retrograde labeling of retinal ganglion cells by application of fluoro-gold on the surface of superior colliculus. J Vis Exp. (16), (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved