Method Article
通过流式细胞术分离原代小鼠视网膜神经节细胞(RGC)
摘要
数百万人患有导致不可逆失明的视网膜退行性疾病。许多这些疾病的常见因素是视网膜神经节细胞(RGC)的丧失。该详细方案描述了通过流式细胞术的阳性和阴性选择分离原代鼠RGC。
摘要
神经退行性疾病往往对受影响者有破坏性的影响。除了正常老化之外,视网膜神经节细胞(RGC)损失也涉及一系列疾病,包括糖尿病性视网膜病变和青光眼。尽管它们的重要性,RGC迄今为止非常难以研究,部分原因在于它们仅占视网膜中各种细胞的一小部分。此外,目前的分离方法使用细胞内标记来鉴定产生非活细胞的RGC。这些技术还涉及冗长的分离方案,因此缺乏获得和分离RGC的实用,标准化和可靠的方法。这项工作描述了一种有效,全面和可靠的方法,使用基于正选择标准和阴性选择标准的方案从小鼠视网膜分离原代RGC。所提出的方法允许未来RGCs的研究,目的是更好地了解专业由神经退行性疾病中功能性RGCs的丧失导致的视力下降。
引言
RGC是终末分化的神经元,因此,原代细胞是实验所必需的。用于分离和富集原代小鼠视网膜神经节细胞(RGC)的方案的开发是揭示RGC健康和体外变性的机制的基础。这对于寻求产生潜在疗法以促进RGC功能并尽量减少死亡率的研究尤为重要。 RGC的变性与视网膜退行性疾病如青光眼,糖尿病性视网膜病变和正常衰老有关。虽然RGC损失的具体细胞机制尚不清楚,但已经确定了一系列危险因素。缺乏视神经头1,2,3的氧合导致RGC死亡4 ,并且作为兴奋性和i激活之间的动态平衡的干扰个体RGCs内的抑制性受体5,6 。一系列挑战妨碍了使用这些细胞进行深入研究的进展。首先,鼠视网膜中RGCs的数量很少。 RGC占总视网膜细胞7,8,9的不到1%。第二,大多数RGC特异性标记物是细胞内蛋白质10,11,12 。基于这些标记的选择使细胞不可行,这排除了下游功能分析。最后,目前可用的协议冗长,缺乏标准化13,14 。早期RGC分离方案是基于免疫方法。 Barres 等人 15 适应经典免疫基于对抗胸腺细胞抗原(也称Thy1)(细胞表面标记)的免疫阳性,在阳性选择之前,将大部分视网膜细胞从单核细胞和内皮细胞排除第二步。几年后,Hong et al。组合磁珠分离技术与细胞分选策略分离更高纯度的RGC 16 。在许多科学应用中仍然使用磁珠。一起,磁珠和流式细胞术方案提高了分离细胞的纯度。然而,这些纯化系统尚未被标准化用于从解离的视网膜分离鼠RGCs。
流式细胞仪是一种强大的分析方法,可以测量细胞悬浮液的光学和荧光特性。以高水平的灵敏度定量和定性分析细胞,为细胞群体提供多维分析通货膨胀。细胞鉴别基于两个主要物理性质:细胞大小或表面积,粒度或内部复杂性17 。可以通过组合具有类似激发波长和不同排放物的荧光染料标记的抗体来进行多维分析。流式细胞术是快速,可重复和敏感的。多重激光器通过流式细胞术允许单个细胞的更多的多维分析。因此,它是研究细胞学标本的有吸引力的方法。荧光激活细胞分选(FACS)使用通过流式细胞术鉴定的多维表型差异将单个细胞分类为不同的亚群。
在过去十年中,多种表面和细胞内蛋白已被鉴定为用于选择细胞(包括神经元)的潜在生物标志物。试图从大鼠中分离RGC的初步研究使用Thy1作为神经节细胞l标记。不幸的是,Thy1, 也就是 CD90,在其他啮齿动物物种18,19,20中具有多个同种型,并且由多个视网膜细胞类型19,20表达,使其成为RGC的非特异性标记。在视网膜中的单核细胞群体中发现另一个表面标志物CD48,包括巨噬细胞和小神经胶质细胞。使用这两个表面标记,修饰的RGC特征-Thy1 +和CD48 neg细胞 - 被开发出15,16,21,22。不幸的是,这两个选择标准不足以选择高度富集的研资局人口。为了解决这一未满足的需求,基于多层次正,负选择标准,开发了流式细胞仪方案23已知的细胞表面标志物以富集和纯化原代鼠RGC。
研究方案
以下议定书中详细列出的所有程序均由田纳西大学健康科学中心(UTHSC)的机构动物护理和使用委员会(IACUC)审查委员会批准,并遵循视力与眼科研究协会(ARVO)声明使用协议动物实验动物实验指南(实验室动物资源研究所,人体护理和实验动物使用公共卫生服务政策)。
准备仪器,解决方案和媒体
注意:有关材料,试剂,工具和仪器报告的所有信息,请参见材料表 。
- 高压灭菌所有解剖仪器,并将其存放在无菌区域。使用以下仪器:4个标准镊子(2长2短)和2把剪刀,以及2个镊子(1长和1短)和1个剪刀用于解剖;保留额外的设置作为备份。
- 准备100ml无菌PBS / 1%FBS溶液以在洗涤,免疫标记程序和细胞分选步骤中使用。将溶液冷却至4°C。
注意:不要向溶液中加入叠氮化钠(NaN 3 ),因为它可能对活细胞有毒。- 用99 mL PBS和1 mL FBS制备100 mL PBS / 1%FBS。
- 准备100毫升补充有3%FBS的无菌神经细胞培养基(见材料表 )用作收集和培养基。保持细胞培养基在4℃无菌。使用前仅将其温热至室温(RT)。
- 使用97 mL神经细胞培养基和3 mL FBS制备100 mL补充有3%FBS的神经细胞培养基。
- 预先冷藏收集管(15-mL管),预先用5mL的收集介质通过放置t在冰桶下摆。只能使用聚丙烯管来防止细胞粘附在管表面。
- 在生物安全柜中放置40毫米盘,70微米尼龙过滤器,注射器,细胞过滤器的杵和无菌聚丙烯管。在程序之前对所有物品进行灭菌,并在整个程序中以无菌方式维持它们。
注意:收集视网膜后的所有步骤将在生物安全柜内进行。
去核
注意:本实验中共使用10只年轻(5-7周龄)C57BL / 6J小鼠,分离出具有表型CD90.2 + CD48 neg CD15 neg CD57 neg的 1.0×10 6个 RGC。
- 使用二氧化碳吸入,然后颈椎脱位安乐死小鼠。始终使用次要安乐死方法确保安乐死的动物死亡。
注意事项:可以使用异丙烷作为二氧化碳的替代品。不推荐使用氯胺酮,因为它与用作麻醉诱导剂24,25时眼内压(IOP)的增加有关。 - 将镊子插入眼球下方,夹住视神经,拉起;全球将被摘除,视神经完整无缺。将收集的眼睛放在含有PBS的小瓶中,并将小瓶保持在冰上直到下一步。
注意:任何人员在接受实验动物护理部门(LACU)的适当培训后,都可以执行此步骤。
3.视网膜细胞悬浮液的制备
- 将收集的眼睛放置在解剖显微镜的底板上,开始角膜剥离。分别解剖每只眼睛。
- 用镊子小心地握住视神经基底。对于这一步,使用一个long和一个短标准镊子。
- 使用30号(30G)锋利的针刺穿角膜,以使房水从眼睛中排出,从而更容易用镊子握住眼睛。
- 用镊子握住角膜,用剪刀在角膜上做一个小切口。使用镊子轻轻剥离角膜和巩膜。当地球半球剥离时,用镊子将视网膜和镜片卷起来。舍弃角膜,巩膜和镜片。
注意:该方法可确保视网膜完全脱离眼睛的其余部分。 - 将视网膜置于含有PBS / 1%FBS的小型40-mm培养皿中。
注意:作为培养皿的替代品,可以使用细胞培养皿。确保始终保持视网膜潮湿,如生理条件。- 用生物安全柜内的新鲜无菌PBS / 1%FBS清洗每个视网膜三次。
- 放置最多12个视网膜用PBS / 1%FBS润湿的无菌70-μm尼龙过滤器。使用10 mL注射器的后端,使用圆形运动轻轻地浸渍视网膜以分离细胞。
- 或者,使用研杵进行细胞过滤器浸渍,或者在37℃下用15IU / mL木瓜蛋白酶,5mM L-半胱氨酸和200U / mL DNA酶I的组合使用酶消化15分钟,然后用PBS灭活/ 10%FBS。
注意:当酶消化与注射器或研杵的后端与浸渍相比较时,未观察到回收细胞百分比的变化。
- 或者,使用研杵进行细胞过滤器浸渍,或者在37℃下用15IU / mL木瓜蛋白酶,5mM L-半胱氨酸和200U / mL DNA酶I的组合使用酶消化15分钟,然后用PBS灭活/ 10%FBS。
- 为了转移分离的细胞,将无菌的70-μm尼龙过滤器放在聚丙烯收集管上。使用P1000移液管将收集的细胞通过过滤器。用PBS / 1%FBS冲洗过滤器( 步骤3.6 )以释放任何剩余的细胞并将其转移到收集管中。
- 添加PBS / 1%FBS每个视网膜的最终体积为1 mL。以200×g和RT离心细胞悬浮液7分钟。
注意:根据浸没的视网膜(<6视网膜)的数量,细胞沉淀可能太小,无法看到。- 弃去细胞上清液,并将细胞沉淀重悬于PBS / 1%FBS中,每5个视网膜的比例为1 mL。
- 使用血细胞计数器计数细胞。
- 用70%酒精清洗玻璃血细胞计数器和盖玻片。轻轻旋转含有细胞的管,确保视网膜细胞悬浮液均匀分布。将20μL0.4%台盼蓝置于微量离心管中,并与20μL细胞悬浮液混合。
- 轻轻混合,并将10μL的0.4%台盼蓝/细胞悬浮液混合物加到血细胞计数器中,填充两个腔室;毛细管作用将在盖玻片下画出0.4%的台盼蓝/细胞悬浮液混合物。使用显微镜计数所有台盼蓝阴性细胞; THI数字代表活细胞。
- 使用以下公式确定细胞活力:活细胞计数/总细胞计数=%存活力。
注意:如果细胞的存活率小于95%,则在FACS期间需要使用荧光染料进行细胞活力鉴别。
- 使用不活细胞的荧光活性染料。用PBS洗涤细胞以除去任何血清痕迹。在100μL最终体积中,每5.0 x 10 6个细胞添加1μL荧光染料,用于细胞活力鉴别。在室温下孵育15分钟,防止光照。加入PBS / 1%FBS的体积的10倍。在200 xg和RT下离心5分钟。
- 如果需要,在4℃下孵育细胞悬液过夜。如果这样做,用神经细胞培养基填充细胞悬液管,而不是PBS / 1%FBS。水平放置管并保持在4°C。
4.免疫标记Re细胞
- 使用以下转换来确定每个细胞数量的抗体体积:每100μL体积中每5.0×10 6个细胞2μL的抗体。
- 洗涤细胞并将其保持在PBS / 1%FBS中。在排序设置时,取一小部分细胞(5.0×10 6个细胞)作为阴性对照(未标记)。
注意:这种阴性对照细胞分选仪的正确校准至关重要。 - 为了最小化抗体对表达Fcγ受体II和III的细胞的非特异性结合,在50μL最终体积中使用PBS / 1%添加1μL每1.0×10 6细胞中的抗小鼠CD16 / 32抗体, FBS。在室温下孵育10分钟。
- 将抗体混合物加入到样品中,并通过移液轻轻混合。在冰桶中孵育30分钟。确保冰桶被覆盖,因为光可能会损害实验,因为标记的荧光素漂白phores。
- 使用以下荧光标记的抗小鼠抗体制备抗体混合物:CD90.2AF-700,CD48 PE-Cyanine7,CD15PE和未标记的CD57。
注意:对于每种抗体,每5.0 x 10 6细胞使用以下浓度:CD90.2AF700,1μg; CD48 PE-Cyanine7,0.4μg; CD15 PE,0.02μg;和未标记的CD57,0.4μg。- 根据以下计算使用体积(基于材料表中列出的市售抗体):总共标记5.0×10 7个细胞;每5.0×10 6个细胞2μL=每个抗体20μL; 4种不同抗体=80μL抗体混合物;最终体积= [(5.0×10 7总细胞)/5.0×10 6个细胞]×100 =1,000μL; 80μLAbs +50μL抗小鼠CD16 / 32 +870μLPBS / 1%FBS =1,000μL。
注意:这个组合提供了用于仪器配置的荧光染料的最佳组合。以下参数总结了发射和激发:AF-700,用638nm红色二极管激光器激发时发射719nm; PE-Cyanine7,当用488nm蓝色二极管激光器激发时发射767nm;和PE,当用488nm蓝色二极管激光器激发时发射575nm。
- 根据以下计算使用体积(基于材料表中列出的市售抗体):总共标记5.0×10 7个细胞;每5.0×10 6个细胞2μL=每个抗体20μL; 4种不同抗体=80μL抗体混合物;最终体积= [(5.0×10 7总细胞)/5.0×10 6个细胞]×100 =1,000μL; 80μLAbs +50μL抗小鼠CD16 / 32 +870μLPBS / 1%FBS =1,000μL。
- 使用以下荧光标记的抗小鼠抗体制备抗体混合物:CD90.2AF-700,CD48 PE-Cyanine7,CD15PE和未标记的CD57。
- 孵育30分钟后,使用PBS / 1%FBS使体积达到5 mL。通过在200×g和RT下离心7分钟来洗涤样品。重复该过程一次以除去所有未结合的抗体。
- 加入2μL二抗(0.1μg),其将结合5.0×10 6个细胞的CD57。在冰桶中孵育30分钟,如步骤4.4 。洗涤细胞两次,如步骤4.5 。
- 如果在步骤4.4中使用未标记的一级抗体,则用二级抗体标记细胞。
注:第二该配置选择的ary抗体列于材料表中 ;其发射波长为421nm。当使用405nm的紫外二极管激光器激发时,使用450 / 50nm的带通滤波器。 - 根据以下计算使用体积(基于材料表中列出的市售抗体):每5.0×10 6个细胞2μL=20μL的二次抗体;最终体积= [(5.0×10 7总细胞)/5.0×10 6个细胞]×50 =500μL; 20μL的Abs +480μLPBS / 1%FBS =500μL。
- 如果在步骤4.4中使用未标记的一级抗体,则用二级抗体标记细胞。
- 将标记的细胞保留在PBS / 1%FBS中。使用血细胞计数器计数细胞;使用3.0-4.0×10 7个细胞/ mL的最终视网膜细胞浓度。
注意:不要使用细胞培养基稀释细胞,因为酚红可以增加自发荧光,从而降低阴性之间的分辨率阳性细胞。每体积的最终细胞浓度高度取决于仪器配置的体积流量。 - 在设置过程中使用单色控件可以最大限度地减少荧光溢出。
注意:此步骤也称为补偿,用于校正由荧光团组合产生的噪音。 PBS / 0.1%BSA / 2mM NaN 3中的聚苯乙烯微球具有结合来自多个物种的荧光标记的免疫球蛋白(Ig)同种型的能力,提供阳性对照以设定补偿。- 将3滴聚苯乙烯微球放入无菌FACS管中,每个荧光团分配一个。向每个管中加入1μg各自的荧光团。在室温下孵育15分钟,防止光照。向样品管中加入3 mL PBS / 1%FBS。在200 xg和RT下离心5分钟。仔细取出上清液,并重悬于250μLPBS / 1%FBS中。
- 设置消极对照使用不结合Ig的聚苯乙烯微球。如果有必要,请在前一天进行此步骤。
细胞分选策略
注意:具有355 nm,UV的FACS仪器设置的具体说明; 405nm,紫色; 488nm,蓝色;和640nm,分别具有2,2,5和3个荧光通道分布的红色激光。操作软件是DIVA 8.0.1版。细胞分选用70微米喷嘴,70磅/平方英寸皮套压力,87.5频率,48.6振幅,第一滴脱离在333,间隙设置为6,分级精度设置为四通纯度,默认(32)纯度掩模,和滴延迟调整为42.98使用珠。
- 使用15 mL聚丙烯锥形管作为收集容器。向每个管中加入5 mL收集培养基(细胞培养基),并旋转管以涂覆墙壁。
注意:此步骤可防止细胞粘附到t的两侧他收集管。作为替代方案,管可以涂覆未稀释的FBS。 - 考虑到细胞分选机的效率来估计细胞的最终产量。
注意:排序效率根据流式细胞仪使用而有所不同。具有CD90.2 + CD48 neg CD15 neg CD57 neg表型的RGC占所有视网膜细胞的约1%。 - 由经过培训的操作员进行细胞分选(通常在核心设施中)。在样品采集之前,确保仪器被清洗并用70%乙醇消毒。小心地用70%乙醇擦拭收集管的外面。
- 如果细胞沉降或聚集,则可以在收集之前上下移动细胞并通过无菌的40-μm尼龙过滤器过滤悬浮液。确保在进行细胞分选时控制温度并保持在4°C;不这样做会减少细胞l产量。
- 在进行实验之前,请与细胞分选操作员讨论排序细节。
注意:在实验时,细胞分选器操作员将从用于细胞计数器的采集软件的工作区工具栏中点击一系列按钮。这些是浏览器 , 细胞计数器 , 检查器 , 工作表和采集仪表板 。这里使用的细胞分选策略被称为双向排序。收集两个群体:富集的RGC和所有其他细胞类型。如果要收集额外的群体,最多可以分离两个人口,作为4路排序。如果收集额外的人口,细胞分选机需要不同的收集管和设置。 - 执行补偿以校正荧光团的光谱重叠。
注意:此过程可以通过调整手动完成或者它可以作为使用的软件的一部分自动完成。用于细胞分选设备的大多数软件都可以选择自动补偿。它被认为是黄金标准和最准确的赔偿类型。在该步骤中将使用负(无荧光团)样品和用专门制造以结合实验中使用的所有相关单克隆抗体的聚苯乙烯微球(补偿珠)制备的单一对照。- 选择实验>补偿设置>创建补偿控件 。从显示在屏幕上的列表中添加荧光团特定的控件。单击确定 。
注意:将显示每个控件的补偿管。- 使用未标记的控制(无荧光团, 步骤4.2 )来验证前向散射光(FSC),侧向散射光(SSC),并对初始群体(P1)进行门控。
- 将阴性对照管安装到细胞仪上,然后单击加载。验证感兴趣的人群是否显示并选择它。这是人口1(P1)。右键单击P1门,然后选择应用于所有补偿控制 。单击记录数据 。记录完成后,单击卸载并取出管。
- 将下一个管安装到细胞仪上,如屏幕上所示。重复步骤5.6.2,直到记录了所有控件的数据。
- 选择实验>补偿设置>计算补偿 。保存设置并命名实验。点击链接并保存 。
注意:补偿是必要的步骤,因为它消除了探测器之间的光谱重叠。 - 如果需要手动补偿,可以通过调整积极信号的方法,使它们等于eac的负值h所用的荧光染料。
注意:此步骤由细胞分选仪操作完成,可能需要30分钟。
- 选择实验>补偿设置>创建补偿控件 。从显示在屏幕上的列表中添加荧光团特定的控件。单击确定 。
- 门控策略( 图3A )。
- 通过绘制FSC与SSC建立P1; FSC指示大小,SSC表示细胞的内部复杂性。参见图3A 。
- 在步骤5.7.1 (P1)中使用所选群体绘制SSC-H(高度)相对于SSC-W(宽度)的伪色图;伪色图允许细胞相对于彼此的密度的视觉表示。
注意:较低的细胞密度由蓝色和绿色表示,而红色和橙色区域表示高细胞密度。- 执行此步骤仅收集单个单元;单电池门称为P2。参见图3A 。
- 重复步骤5.7.2至使用P2绘制FSC-H与FSC-W。确保将单细胞选择为"双峰"或细胞团包含阳性和阴性标记,提供假阳性。
- 绘制CD90.2与CD48的伪色图。选择所有CD90.2 + CD48 neg细胞以消除RGC富集中的单核细胞;叫这个门CD90.2 + CD48 neg ,或P3。参见图3A 。
- 使用选定的CD90.2 + CD48 阴性人群或P3门,绘制CD57与CD15的假色图,以消除RGC富集中的无长突细胞污染物。门CD15 neg CD57 neg人口。参见图3A 。
- 在"排序布局"窗口中定义要为样品收集的种群,并继续进行细胞分选;收集的样本是CD90.2 + CD48 neg CD15 neg CD57 neg P>。
注意:排序窗口中的下拉菜单中选择要排序的群体。添加人口后,将要求进行目标事件或要收集多少事件。在任何时候,可以通过单击包含人口的排序位置字段来编辑排序布局。从年轻(5-7周龄)和0.5%±0.3岁(> 12个月大)C57BL / 6J小鼠23获得表型CD90.2 + CD48 neg CD15 neg CD57 neg的RGC的0.9%±0.3。 - 使用25,000个细胞,进行纯度检查23 。参见图3B- E。
注意:纯度检查是重新分析排序细胞以验证细胞分类的准确性的过程。分选的细胞的一小部分将被加载到细胞计数器上以验证排序的有效性。
- 细胞内标记。
- 将分选的细胞固定1小时,并在4℃透化,使细胞代谢无活性并允许细胞内抗体的穿透。
- 在渗透溶液中稀释以下抗体:在100μg/ mL原液中以1:100稀释的多重剪接(RBPMS)的抗-RNA结合蛋白;抗突触核蛋白γ(SNCG),1:100在1mg / mL原料中;脑特异性同源盒/ POU结构域蛋白3A(BRN3A),100μg/ mL原料中的1:100;和抗神经元特异性III类β微管蛋白(TUJ1),1:100在1mg / mL原液中。在覆盖的冰桶中孵育细胞和抗体溶液1小时。
- 用PBS / 1%FBS洗涤样品两次。
- 在冰桶中以1:200稀释度将细胞重悬在合适的AF488标记的第二抗体中30分钟。
- 洗涤样品,如步骤6.1.3。保持细胞PBS / 1%FBS(250μL),直到准备分析。
7.通过qPCR分析验证细胞排序
注意: 见图4 。
- RNA提取23 。
- 通过细胞裂解和匀浆从5.0×10 5分选细胞中提取RNA,然后加入氯仿。
- 将上部无色相转移至干净的微管,进行醇沉淀,然后在旋转柱中提取浓缩物。在柱上进行DNAse消化。
- 用无RNA酶的水冲洗柱子进行RNA洗脱。
- 通过分光光度法评估RNA浓度。
- cDNA合成和预扩增。
- 使用100ng RNA材料,并与含有逆转录酶,重组核糖核酸酶抑制剂(避免RNA降解)),氯化镁(MgC)12 )和脱氧核苷酸。
- 混合管内容物并在25℃下孵育10分钟,然后在42℃孵育60分钟。在85℃温育5分钟后完成反应。将所得cDNA存储在-20℃直到准备使用。
注意:如果不能立即进行预扩增步骤,cDNA材料可以在-20°C下储存长达一个月。
- cDNA的预扩增。
- 使用一系列针对多种视网膜细胞类型的引物预扩增cDNA材料,包括:视网膜神经节细胞,无长角细胞,星形胶质细胞,Müller,双极,水平,光感受器和视网膜色素上皮细胞,如参考文献23和表的材料 。
注意:预扩增反应是为了提高检测的灵敏度进行定量。预扩增反应包含引物的混合物材料表中的混合物; 2.5μLcDNA,以100ng RNA开始;逆转录酶;和无核酸酶的水,最终体积为10μL。 - 在95℃进行酶活化步骤10分钟,然后在95℃下进行14个循环15秒,然后60℃4分钟。在Tris EDTA缓冲液中稀释预扩增物质1:10,并保持在-20°C直到准备使用。
- 使用一系列针对多种视网膜细胞类型的引物预扩增cDNA材料,包括:视网膜神经节细胞,无长角细胞,星形胶质细胞,Müller,双极,水平,光感受器和视网膜色素上皮细胞,如参考文献23和表的材料 。
- 7.4 qPCR反应。
- 使用稀释的预扩增cDNA(2.5μL),引物(在材料表中列出),无核酸酶的水和含有DNA聚合酶和脱氧核苷酸的浓缩物,在10μL终体积中制备所有qPCR反应。
- 使用以下仪器条件运行qPCR:50°C的保持步骤2分钟,然后95℃10分钟。在95℃下共运行40个循环15秒,然后在60℃下运行1分钟。执行所有测量复制三个。
- 在确定每个样本中管家基因和目标基因的C T值之后,使用比较阈值(C T )进行相对定量。使用以下等式计算相对折叠变化(R q ):R q = 2 T - ΔC,其中ΔCT = C T靶基因-CT参考基因23 。
注意: C T被定义为报告染料的荧光信号穿过任意设置的阈值26的PCR循环。 C T与反应中扩增子(PCR产物)的量成反比。
结果
RGC的深入研究受到许多因素的阻碍,包括其频率低,缺乏强大和标准化的隔离方法。 图1显示了用于视网膜分离的方法。根据分析方法存在摘除程序的变化,例如摘除核素是体内实验的一部分27 。在安乐死小鼠中进行该方案的摘除。 如图1A- B所示,镊子被放置在眼睛下方并被拉起以引起最小的出血并用完整的视神经去除眼球。
在不同小鼠品系中RGC的数量存在差异,特别是在遗传改变的小鼠中,当确定使用的小鼠数量时,意识到这些差异是重要的,老的C57BL / 6J小鼠的视网膜比其年轻的对应物23具有更少的活的视网膜细胞,因此必须仔细地进行视网膜剥离视网膜剥离的逐步程序如图1C -J 所示,视网膜细胞是脆弱的,因此,将解剖的视网膜置于尼龙过滤器中,并用注射器的后端浸渍,如如图2A所示,或用于细胞过滤器的研杵,直接在细胞过滤器中浸泡细胞是快速的并且减少细胞团块, 图2B中示出了细胞悬浮液的代表性图像,可以观察到多个内部视网膜细胞。在这一点上,RGCs已经失去了他们的签名形象由于细胞分离期间的轴突切除术和细胞悬浮液的制备。
该方法的劳动密集度最高的步骤是细胞分选设置。这个阶段是多色FACS中的关键步骤,因为它可以最大限度地提高信噪比。 图3A显示了用于分离RGC的门控策略。该策略旨在从细胞悬浮液中除去污染细胞,其包括单核细胞,胶质细胞,无长大细胞和感光细胞。作为方法的一部分,在作为排除策略的一部分使用额外的表面标记物之前,通过免疫组织化学分析确认。以前的数据表明,少量的CD90.2 +细胞是CD48 + 。排除这些细胞从视网膜细胞池中除去单核细胞和可能的小胶质细胞。之前已经显示出经典的Thy1 + CD48 neg 表面表型不足以鉴定和分离鼠RGCs 23 ,因为这些细胞表达与无远处,Müller,双极,水平感光体和视网膜色素上皮细胞相关的基因( 图4A )。通过调查细胞排斥的其他标记来进一步解决这个问题。 CD15已被描述为无远处和双极细胞的标志物31 ,促使其作为负选择的附加标记物。 Uusitalo 等人的工作32描述了CD57作为胶质细胞和光感受器的鉴定标记。因此,将该抗体加入到细胞分选策略中。
接下来,这些细胞的特征在于验证分离鼠RGC的方法。 CD90.2 + CD48 阴性 CD15 阴性 CD57 阴性分类细胞(<评估与RGC 10,11,12,33 :SNCG,BRN3A,TUJ1和RBPMS相关的以下细胞内标志物的表达的强力类="xfig">图3B)。 如图3C所示,分选的细胞表达所有四种与RGC相关的细胞内蛋白质。接下来, 图3D中使用成像流式细胞术显示RBPMS的细胞内定位和CD90.2的细胞表面表达。这些结果在多个细胞仪系统中进行了测试,证实了其重现性和标准化。 如图3E所示,一些分选的细胞开始显示体外细胞培养后与RGC相关的形态。
最后,比较浓缩前后细胞通过qPCR分析进行了分析。 Thy1 + CD48 neg表型与CD90.2 + CD48 neg CD15 neg CD57 neg分选细胞的比较表明Thy1 + CD48 neg表型与RGC相关的基因,也与其他视网膜细胞相关。然而,高度富集的分选细胞群体( 图4B )显示编码RGC特异性细胞内标志物Sncg (SNCG), Pouf4I (BRN3A), Tubb3 (TUJ1)和Rbpms (RBPMS)的基因的多倍增加。总的来说,mRNA和蛋白质评估验证了该方法。
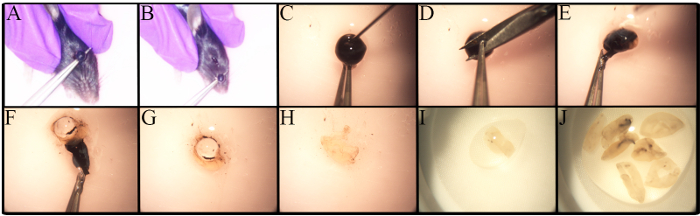
图1 。视网膜分离的摘除和眼部解剖。年轻C57BL / 6J小鼠在t前进行安乐死o眼球去除与二氧化碳和子宫颈脱位。 A)将镊子放在眼睛下方,并在一个运动中拉起眼睛。 B)眼睛被去除,包括视神经。 CJ)逐步引导去除视网膜。 C)在去除角膜之前使用30G针进行穿刺,以允许房水离开眼睛。 D)用镊子保持角膜,做一个小切口。 EF)使用镊子可以剥离角膜,视网膜色素上皮,脉络膜和巩膜。视网膜与巩膜分离,滚动并移除。 G)将镜头取出并丢弃。 HJ)将收集的视网膜置于含有PBS / 1%FBS的小盘中,以保持其始终保持湿润。 请点击这里查看更大的版本数字。
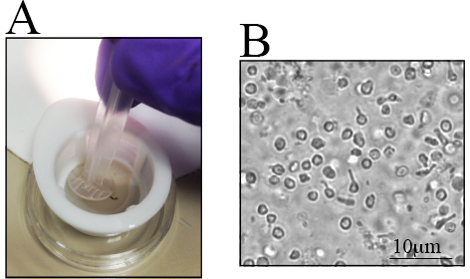
图2 。收集视网膜后视网膜细胞悬浮液。将收集的视网膜置于小盘中以分离细胞。 A)将视网膜置于70μm尼龙过滤器中,并使用注射器的后端浸渍。 B)细胞悬浮液的代表性图像,其中观察到不同的视网膜细胞。刻度棒为10μm。

图3 。用CD90.2 + CD48 neg CD15 neg CD57 分离细胞的分选策略 neg 表型和后排序分析。分选策略基于CD90.2细胞的包含以及作为污染细胞的CD48-,CD15-和CD57-阳性细胞的排除。 A)作为第一步,绘图尺寸(FSC)和内部复杂度(SSC)以获得细胞群体的概述。初始门控群体(P1)用于使用SSC高度(H)对宽度(W),P2来区分单个细胞和结块细胞或聚集体。单细胞的选择用于选择CD90.2 + CD48 neg细胞。为了确认所有双峰的去除,执行FSC-H与FSC-W的图,P3( 中间图 )。用AF700缀合的抗小鼠CD90.2,PE-Cyanine7缀合的抗小鼠CD48,PE缀合的CD15和抗小鼠CD57标记细胞。作为标记抗小鼠CD57的二抗,使用抗小鼠BV421。人口3(P3)绘制在第四个</ em>面板选择CD90.2 + CD48 neg细胞,去除大部分污染细胞。接下来,使用所选择的CD90.2 + CD48 neg细胞产生CD57对CD15图。选择象限4(Q4),因为它代表对CD15和CD57均为阴性的CD90.2 + CD48 neg细胞。所得门控群体的表型是CD90.2 + CD48 neg CD15 neg CD57 neg 。 B) A)中使用的表面标记的分类分析。排序的细胞的大小是均匀的,如第一个图所示。随后的直方图显示在A)中详细列出的排序策略中使用的每个表面标记的百分比。总共95%的细胞是CD90.2 + ,如黑色线所示,与Ig对照相比,由实心直方图表示。将这些细胞门控以评估由红色,蓝色和灰色代表的CD48,CD15和CD57的百分比n行。结果显示这些细胞表面标记的最小表达。 C)通过使用RGC特异性细胞内标记SNCG,BRN3A,TUJ1和RBPMS来确认RGC表型。黑线代表表达每个细胞内标志物的细胞的百分比。 D)在成像细胞分选器中拍摄的代表性图像,其显示RBPMS的细胞内定位,RGC特异性细胞内标志物和细胞表面标志物CD90.2。比例尺为20μm。 E)使用共焦显微镜培养24小时后分类的RGC的代表性图像。比例尺为20μm。图像BE改编自以前发布的工作,许可23 。图像DE在20X拍摄。 请点击此处查看此图的较大版本。

图4 。前后分选mRNA分析。通过使用一组由视网膜细胞表达的25个基因的qPCR分析评估Thy1 + CD48 阴性和具有表型CD90.2 + CD48 neg CD15 neg CD57 neg的分选细胞。目标基因表达水平作为Log 2倍变化,使用Hprt作为管家基因,水作为阴性对照。基于ΔCT法进行计算。平均值±SEM; n = 3次生物重复进行一式三份。从以前出版的作品获得的数字23 。
讨论
FACS是净化细胞群体的首选技术。其他分离方法包括免疫沉淀,磁珠和补体固定消耗。 FACS与这些其他方法的优点是基于同时鉴别具有不同程度的强度的细胞表面标志物。分子的荧光强度与蛋白质表达量成比例。到目前为止,RGC的分离仅基于Thy1(CD90)阳性和CD48阴性15,16,22,34,而不管使用的分离方法如何。最近已经显示,Thy1 + CD48 neg表型不足以分离表达RGC细胞内标志物23的细胞的均匀群体。鉴定RGC群体对其分离至关重要,特别是因为它们包含小百分比的视网膜细胞7,8,9 。大多数RGC位于视网膜的最内层,而少数位于内丛状层(置换RGC35)中。因此,通过立体定向注射和跟踪羟睾丸素(用于引导神经元的逆行示踪剂)追踪RGC,成为许多实验室36,37,38的有吸引力的选择。这些系统需要注射示踪剂,如果不适当地执行,可能导致一些视网膜区域未被标记。此外,它们在技术上要求更高,并且像其他方法如免疫方法一样冗长。使用抗Thy1和-CD48抗体的免疫染色需要48小时才能完成,不能达到95以上%纯度。该工作描述了基于FACS的方法,其提供了快速和可重现的方案,以分离具有CD90.2 + CD48 阴性 CD15 阴性 CD57 阴性表型的活的RGC的均质群体,而不使用任何示踪剂,磁珠或免疫调节技术。
通过FACS成功分离纯RGC需要以下因素:1)分类效率,这取决于所使用的设备; 2)抗体标记的荧光染料的最佳组合,以减少噪音;和3)细胞分选设置。排序效率是通过将所选择的目标事件的数量除以检测到的目标事件的数量,以百分比表示来计算的。排序效率是由设备提供的计算。这种效率取决于分选系统的设置和细胞分选模式。选择荧光染料的最佳组合是一个复杂的过程。每次流感色相具有不同的特性,其特征在于其激发和发射波长。当用激光读取激发时,发射由光电倍增管读取,该光电倍增管由FACS分选设备中可用的光学滤波器限制。在此,提供抗体标记的荧光染料PE,PE-Cyanine7,AF700和BV421的组合。这是考虑到提供最佳分辨率同时减少光谱重叠的多种荧光染料组合来确定的。最后,排序设置至关重要。一般来说,视网膜细胞是脆弱的。因此,最好使用较低的压力来运行样品,以最小化细胞上的应力。将样品保持在4°C是关键的,因为在室温下保持鼠RGCs较长时间可以降低细胞产量,特别是当分选大量细胞时。
基于FACS的排序是隔离组成细胞的理想方法少量细胞悬液。与免疫沉淀和示踪剂系统相比,从视网膜剥离到细胞分选完成的过程需要大约5-6小时,这需要几天的时间才能完成。 FACS的多维分析和设备收集几个可行的群体的能力允许细胞的进一步功能分析。这里描述的方案是分离原代鼠RGCs的有力工具。尽管它具有多重优点,包括其灵敏度,重现性和立即鉴定活细胞,但是存在一些限制。首先,它需要昂贵的仪器和高度训练的操作员。通常,操作者是实地的免疫学家或训练有素的个人,在实验设置时与他们会面。如今,学术设施有多个核心设施,可以促进执行这些类型的实验。其次,RGCs失去了自己的力量由于排毒引起的皮肤形态,使其尺寸非常小。在这个时候,不知道他们的一些基因是否可能由于排毒而被调节。
本文介绍的方法可以在体外对RGC功能进行下游分析,是在视觉和健康科学领域中使用的有价值的工具。维持神经节细胞输出到大脑是视觉感知所必需的,并且在多种疾病中处于危险之中。这些细胞可以在健康和疾病模型中用于受控的体外实验。可以对这些细胞进行电生理,药理,生物化学和分子研究,这对于未来治疗靶标的发展是理想的。
披露声明
作者宣称他们没有竞争的经济利益。
致谢
作者要感谢微生物学,免疫学和生物化学系高级插图师Tim Higgins先生提供技术视频协助; Matthew W. Wilson博士进行讨论,还有Jablonski和Morales-Tirado实验室的成员对他们的帮助意见。这项工作得到了阿尔康研究院青年研究员奖(VMM-T),田纳西大学研究基金会(VMM-T),国家眼科学院EY021200(MMJ),格温奖学金(VMM-T)等的支持。格温博士后研究金(ZKG),国防军医学研究和物资司令部(VMM-T)以及研究预防盲人无限制赠款。
材料
| Name | Company | Catalog Number | Comments |
| Anti-mouse CD15 PE | BioLegend | 125606 | Clone MC-480 |
| Anti-mouse CD48 PE-Cy7 | BioLegend | 103424 | Clone HM48-1 |
| Anti-mouse CD57 | Sigma Aldrich | C6680-100TST | Clone VC1.1 |
| Anti-mouse CD90.2 AF700 | BioLegend | 105320 | Clone 30-H12 |
| Brilliant Violet 421 Goat Anti-mouse IgG | BioLegend | 405317 | Clone Poly4053 |
| Purified Anti-mouse CD16/32 | BioLegend | 101302 | FcgRII/III block, Clone 93 |
| Zombie Aqua | BioLegend | 423102 | Live cell/ Dead cell discrimination |
| Fetal Bovine Serum | Hyclone | SH30071.03 | U.S. origin |
| AbC Total Antibody Compensation Bead Kit | Thermo Fisher Scientific | A10497 | Multi-species Ig |
| Neurobasal Medium | Thermo Fisher Scientific | 21103049 | Add serum to media prior to culture. |
| Phosphate-Buffered Saline (PBS) | Thermo Fisher Scientific | 10010049 | Saline solution |
| Dissection Microscope | Olympus | SZ-PT Model | Stereo Microscope |
| Sorvall Centrifuge | Thermo Scientific | ST 16R | All centrifugation performed at RT |
| Base Plate – Dissection Pan | Fisher Scientific | SB15233FIM | A wax plate can also be used |
| Forceps | Aesculap | 5002-7 | 4 ½ inches |
| Iris Scissors, Straight | Aesculap | 1360 | 5 ½ inches |
| Falcon 15 mL conical tubes | Fisher Scientific | 352097 | Polypropylene tubes |
| Falcon 50 mL conical tubes | Fisher Scientific | 352098 | Polypropylene tubes |
| BD FACS Tubes | Fisher Scientific | 352003 | Polypropylene tubes |
| 40 mm dishes | MidSci | TP93040 | Tissue culture treated |
| 70 μm nylon strainer | MidSci | 70ICS | sterile |
| 40 μm nylon strainer | MidSci | 40ICS | sterile |
| BD 10 mL syringe | Fisher Scientific | 301604 | Disposable Syringe without needle |
| Pestles | MidSci | PEST | sterile |
| Wheaton Vials | Fisher Scientific | 986734 | No Liner |
| BD 30 G needle | Fisher Scientific | 305128 | 1 inch |
| Hausser Scientific Bright-Line Glass Counting Chamber | Fisher Scientific | 0267151B | Hemocytometer |
| Gibco Trypan blue 0.4% Solution | Fisher Scientific | 15250061 | Viability Dye |
| Eppendorf tubes | Fisher Scientific | 05-402-25 | 1.5mL |
| EVOS Floid Cell Imaging | Thermo Fisher Scientific | 447113 | Fluorescence Imaging with a 20X objective |
| 100% Ethanol | Fisher Scientific | 04-355-452 | Used to make 70% Ethanol |
| Pipet-Lite LTS Pipette L-1000XLS+ | Rainin | 17014282 | LTS Pipette |
| Pipet-Lite LTS Pipette L-200XLS+ | Rainin | 17014391 | LTS Pipette |
| Pipet-Lite LTS Pipette L-20XLS+ | Rainin | 17014392 | LTS Pipette |
| Rack LTS 1000 mL – GPS-L1000S | Rainin | 17005088 | Blue Rack Sterile Tips |
| Rack LTS 250 mL – GPS-L250S | Rainin | 17005092 | Green Rack Sterile Tips |
| Rack LTS 20 mL – GPS-L10S | Rainin | 17005090 | Red Rack Sterile Tips |
| FACSAria II Cell Sorter | BD Biosciences | N/A | Custom order |
| LSR II Cytometer | BD Biosciences | N/A | Custom order |
| Abca8a | Thermo Fisher Scientific | Mm00462440_m1 | Müller cells |
| Aldh1al | Thermo Fisher Scientific | Mm00657317_m1 | Müller cells |
| Aqp4 | Thermo Fisher Scientific | Mm00802131_m1 | Astrocytes |
| Calb2 | Thermo Fisher Scientific | Mm00801461_m1 | Amacrine, Horizontal |
| Cd68 | Thermo Fisher Scientific | Mm03047340_m1 | Retinal Pigment Epithelial Cells |
| Gad2 | Thermo Fisher Scientific | Mm00484623_m1 | Amacrine |
| Hprt | Thermo Fisher Scientific | Mm01545399_m1 | House keeping gene |
| Lhx1 | Thermo Fisher Scientific | Mm01297482_m1 | Horizontal |
| Lim2 | Thermo Fisher Scientific | Mm00624623_m1 | Horizontal |
| Nrl | Thermo Fisher Scientific | Mm00476550_m1 | Photoreceptors |
| Ntrk1 | Thermo Fisher Scientific | Mm01219406_m1 | Horizontal |
| Pcp4 | Thermo Fisher Scientific | Mm00500973_m1 | Bipolar, Amacrine |
| Pou4f1 | Thermo Fisher Scientific | Mm02343791_m1 | Retinal Ganglion Cells |
| Prdx6 | Thermo Fisher Scientific | Mm00725435_s1 | Astrocytes |
| Prkca | Thermo Fisher Scientific | Mm00440858_m1 | Bipolar |
| Prox1 | Thermo Fisher Scientific | Mm00435969_m1 | Horizontal |
| Pvalb | Thermo Fisher Scientific | Mm00443100_m1 | Amacrine |
| Rbpms | Thermo Fisher Scientific | Mm02343791_m1 | Retinal Ganglion Cells |
| Rom1 | Thermo Fisher Scientific | Mm00436364_g1 | Photoreceptors |
| Rpe65 | Thermo Fisher Scientific | Mm00504133_m1 | Retinal Pigment Epithelial cells |
| Slc1a3 | Thermo Fisher Scientific | Mm00600697_m1 | Astrocytes |
| Slc6a9 | Thermo Fisher Scientific | Mm00433662_m1 | Amacrine |
| Sncg | Thermo Fisher Scientific | Mm00488345_m1 | Retinal Ganglion Cells |
| Tubb3 | Thermo Fisher Scientific | Mm00727586_s1 | Retinal Ganglion Cells |
| Vim | Thermo Fisher Scientific | Mm01333430_m1 | Müller cells |
| Taqman Universal Master Mix | Thermo Fisher Scientific | 4440047 | qPCR Reagent |
| miRNeasy Mini Kit | Qiagen | 217004 | RNA Isolation |
| SuperScript VILO cDNA Synthesis Kit | Thermo Fisher Scientific | 11754250 | cDNA synthesis |
| Taqman PreAmp Master Mix | Thermo Fisher Scientific | 4391128 | Pre-Amplification step |
| BD Cytofix/ Cytoperm | BD Biosciences | 554714 | Fixation/ Permeabilization Buffer |
| BD Perm/ Wash | BD Biosciences | 554723 | Permeabilization Solution |
| RBPMS | Santa Cruz Biotechnology | sc-86815 | intracellular antibody |
| SNCG | Gene Tex | GTX110483 | intracellular antibody |
| BRN3A | Santa Cruz Biotechnology | sc-8429 | intracellular antibody |
| TUJ1 | BioLegend | 801202 | intracellular antibody |
参考文献
- Flammer, J., Orgul, S. Optic nerve blood-flow abnormalities in glaucoma. Prog Retin Eye Res. 17 (2), 267-289 (1998).
- Bathija, R. Optic nerve blood flow in glaucoma. Clin Exp Optom. 83 (3), 180-184 (2000).
- Osborne, N. N., Melena, J., Chidlow, G., Wood, J. P. A hypothesis to explain ganglion cell death caused by vascular insults at the optic nerve head: possible implication for the treatment of glaucoma. Br J Ophthalmol. 85 (10), 1252-1259 (2001).
- Morgan, J. E. Circulation and axonal transport in the optic nerve. Eye (Lond). 18 (11), 1089-1095 (2004).
- Tian, N., Hwang, T. N., Copenhagen, D. R. Analysis of excitatory and inhibitory spontaneous synaptic activity in mouse retinal ganglion cells. J Neurophysiol. 80 (3), 1327-1340 (1998).
- Schmidt, K. G., Bergert, H., Funk, R. H. Neurodegenerative diseases of the retina and potential for protection and recovery. Curr Neuropharmacol. 6 (2), 164-178 (2008).
- Dreher, B., Sefton, A. J., Ni, S. Y., Nisbett, G. The morphology, number, distribution and central projections of Class I retinal ganglion cells in albino and hooded rats. Brain Behav Evol. 26 (1), 10-48 (1985).
- Williams, R. W., Strom, R. C., Rice, D. S., Goldowitz, D. Genetic and environmental control of variation in retinal ganglion cell number in mice. J Neurosci. 16 (22), 7193-7205 (1996).
- Jeon, C. J., Strettoi, E., Masland, R. H. The major cell populations of the mouse retina. J Neurosci. 18 (21), 8936-8946 (1998).
- Surgucheva, I., Weisman, A. D., Goldberg, J. L., Shnyra, A., Surguchov, A. Gamma-synuclein as a marker of retinal ganglion cells. Mol Vis. 14, 1540-1548 (2008).
- Nadal-Nicolas, F. M., et al. Brn3a as a marker of retinal ganglion cells: qualitative and quantitative time course studies in naive and optic nerve-injured retinas. Invest Ophthalmol Vis Sci. 50 (8), 3860-3868 (2009).
- Kwong, J. M., Caprioli, J., Piri, N. RNA binding protein with multiple splicing: a new marker for retinal ganglion cells. Invest Ophthalmol Vis Sci. 51 (2), 1052-1058 (2010).
- Van Bergen, N. J., et al. Recharacterization of the RGC-5 retinal ganglion cell line. Invest Ophthalmol Vis Sci. 50 (9), 4267-4272 (2009).
- Wood, J. P., Chidlow, G., Tran, T., Crowston, J. G., Casson, R. J. A comparison of differentiation protocols for RGC-5 cells. Invest Ophthalmol Vis Sci. 51 (7), 3774-3783 (2010).
- Barres, B. A., Silverstein, B. E., Corey, D. P., Chun, L. L. Immunological, morphological, and electrophysiological variation among retinal ganglion cells purified by panning. Neuron. 1 (9), 791-803 (1998).
- Hong, S., Iizuka, Y., Kim, C. Y., Seong, G. J. Isolation of primary mouse retinal ganglion cells using immunopanning-magnetic separation. Mol Vis. 18, 2922-2930 (2012).
- Julius, R. S. The sensitivity of exponentials and other curves to their parameters. Comput Biomed Res. 5 (5), 473-478 (1972).
- Reif, A. E., Allen, J. M. The Akr Thymic Antigen and Its Distribution in Leukemias and Nervous Tissues. J Exp Med. 120, 413-433 (1964).
- Watanabe, M., Noguchi, T., Tsukada, Y. Regional, cellular, and subcellular distribution of Thy-1 antigen in rat nervous tissues. Neurochem Res. 6 (5), 507-519 (1981).
- Haeryfar, S. M., Hoskin, D. W. Thy-1: more than a mouse pan-T cell marker. J Immunol. 173 (6), 3581-3588 (2004).
- Sahagun, G., Moore, S. A., Fabry, Z., Schelper, R. L., Hart, M. N. Purification of murine endothelial cell cultures by flow cytometry using fluorescein-labeled griffonia simplicifolia agglutinin. Am J Pathol. 134 (6), 1227-1232 (1989).
- Shoge, K., et al. Rat retinal ganglion cells culture enriched with the magnetic cell sorter. Neurosci Lett. 259 (2), 111-114 (1999).
- Chintalapudi, S. R., et al. Isolation and Molecular Profiling of Primary Mouse Retinal Ganglion Cells: Comparison of Phenotypes from Healthy and Glaucomatous Retinas. Front Aging Neurosci. 8, 93(2016).
- Nagdeve, N. G., Yaddanapudi, S., Pandav, S. S. The effect of different doses of ketamine on intraocular pressure in anesthetized children. J Pediatr Ophthalmol Strabismus. 43 (4), 219-223 (2006).
- Ding, C., Wang, P., Tian, N. Effect of general anesthetics on IOP in elevated IOP mouse model. Exp Eye Res. 92 (6), 512-520 (2011).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative C(T) method. Nat Protoc. 3 (6), 1101-1108 (2008).
- Aerts, J., Nys, J., Arckens, L. A highly reproducible and straightforward method to perform in vivo ocular enucleation in the mouse after eye opening. J Vis Exp. (92), e51936(2014).
- Li, X., et al. Loss of AP-2delta reduces retinal ganglion cell numbers and axonal projections to the superior colliculus. Mol Brain. 9 (1), 62(2016).
- Moshiri, A., et al. Near complete loss of retinal ganglion cells in the math5/brn3b double knockout elicits severe reductions of other cell types during retinal development. Dev Biol. 316 (2), 214-227 (2008).
- Danias, J., et al. Quantitative analysis of retinal ganglion cell (RGC) loss in aging DBA/2NNia glaucomatous mice: comparison with RGC loss in aging C57/BL6 mice. Invest Ophthalmol Vis Sci. 44 (12), 5151-5162 (2003).
- Jakobs, T. C., Ben, Y., Masland, R. H. CD15 immunoreactive amacrine cells in the mouse retina. J Comp Neurol. 465 (3), 361-371 (2003).
- Uusitalo, M., Schlotzer-Schrehardt, U., Kivela, T. Ultrastructural localization of the HNK-1 carbohydrate epitope to glial and neuronal cells of the human retina. Invest Ophthalmol Vis Sci. 44 (3), 961-964 (2003).
- Jackson, C. J., Garbett, P. K., Nissen, B., Schrieber, L. Binding of human endothelium to Ulex europaeus I-coated Dynabeads: application to the isolation of microvascular endothelium. J Cell Sci. 96 ( Pt 2), 257-262 (1990).
- Pennartz, S., Perraut, M., Pfrieger, F. Purification of retinal ganglion cells from postnatal rats by magnetic cell sorting. MACSmore. 12 (2), 16-18 (2010).
- Nadal-Nicolas, F. M., et al. Displaced retinal ganglion cells in albino and pigmented rats. Front Neuroanat. 8, 99(2014).
- Nadal-Nicolas, F. M., Salinas-Navarro, M., Vidal-Sanz, M., Agudo-Barriuso, M. Two methods to trace retinal ganglion cells with fluorogold: from the intact optic nerve or by stereotactic injection into the optic tract. Exp Eye Res. 131, 12-19 (2015).
- Barnstable, C. J., Drager, U. C. Thy-1 antigen: a ganglion cell specific marker in rodent retina. Neuroscience. 11 (4), 847-855 (1984).
- Chiu, K., Lau, W. M., Yeung, S. C., Chang, R. C., So, K. F. Retrograde labeling of retinal ganglion cells by application of fluoro-gold on the surface of superior colliculus. J Vis Exp. (16), (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。