Method Article
Aislamiento de células primarias de ganglio retiniano murino (RGC) por citometría de flujo
En este artículo
Resumen
Millones de personas sufren de enfermedades degenerativas retinianas que resultan en ceguera irreversible. Un elemento común de muchas de estas enfermedades es la pérdida de células ganglionares de la retina (RGCs). Este protocolo detallado describe el aislamiento de los RGC murinos primarios mediante selección positiva y negativa con citometría de flujo.
Resumen
Las enfermedades neurodegenerativas a menudo tienen un impacto devastador en los afectados. La pérdida de células ganglionares de la retina (RGC) está implicada en una serie de enfermedades, incluyendo retinopatía diabética y glaucoma, además del envejecimiento normal. A pesar de su importancia, RGCs han sido extremadamente difíciles de estudiar hasta ahora debido en parte al hecho de que comprenden sólo un pequeño porcentaje de la gran variedad de células en la retina. Además, los métodos actuales de aislamiento utilizan marcadores intracelulares para identificar RGC, que producen células no viables. Estas técnicas también implican largos protocolos de aislamiento, por lo que hay una falta de métodos prácticos, estandarizados y confiables para obtener y aislar los RGC. Este trabajo describe un método eficiente, completo y confiable para aislar RGC primaria de ratones retinae utilizando un protocolo basado en ambos criterios de selección positivos y negativos. Los métodos presentados permiten el estudio futuro de los CGR, con el objetivo de comprender mejor lasDisminución de la agudeza visual que resulta de la pérdida de RGC funcional en las enfermedades neurodegenerativas.
Introducción
Los RGC son neuronas diferenciadas terminalmente, y por lo tanto, las células primarias son necesarias para la experimentación. El desarrollo de un protocolo para el aislamiento y enriquecimiento de las células ganglionares primarias de la retina murina (RGCs) es fundamental para revelar los mecanismos de la salud y la degeneración de RGC in vitro . Esto es especialmente importante para los estudios que buscan generar terapias potenciales para promover la función de RGC y para minimizar su muerte. La degeneración de RGC se asocia con enfermedades degenerativas de la retina, como el glaucoma, la retinopatía diabética y el envejecimiento normal. Aunque los mecanismos celulares específicos subyacentes a la pérdida de RGC no están claros, se han identificado una serie de factores de riesgo. La falta de oxigenación en la cabeza 1 , 2 , 3 del nervio óptico causa la muerte 4 de RGC y actúa como la alteración de la homeostasis entre la activación de la excitación e iNhibitory receptores dentro de RGCs individuales 5 , 6 . Una serie de desafíos impiden el progreso hacia el uso de estas células para estudios en profundidad. En primer lugar, el número de RGC presentes en una retina murina es pequeño. RGCs representan menos del 1% de las células retinianas totales 7 , 8 , 9 . En segundo lugar, la mayoría de los marcadores específicos de RGC son proteínas intracelulares 10 , 11 , 12 . La selección basada en estos marcadores deja las células no viables, lo que impide el análisis funcional posterior. Finalmente, los protocolos actualmente disponibles son largos y carecen de estandarización 13 , 14 . Los primeros protocolos de aislamiento de RGC se basaron en métodos de inmunopanning. Barres et al. 15 Adaptado el clásico immunopY añadió un segundo paso, que excluyó monocitos y células endoteliales de la mayor parte de las células de la retina antes de la selección positiva basada en la inmunopositividad al antígeno anti-timocito (aka Thy1), un marcador de la superficie celular. Años después, Hong et al. Combinado técnicas de aislamiento magnético de grano con estrategias de clasificación celular para aislar RGCs con mayor pureza [ 16] . El uso de cuentas magnéticas todavía se utiliza en muchas aplicaciones científicas. Juntos, las perlas magnéticas y los protocolos de citometría de flujo mejoraron la pureza de las células aisladas. Sin embargo, estos sistemas de purificación aún no han sido estandarizados para el aislamiento de RGC murinos a partir de retina disociada.
La citometría de flujo es un poderoso método analítico que mide las características ópticas y de fluorescencia de las suspensiones celulares. Las células son analizadas tanto cuantitativa como cualitativamente con un alto nivel de sensibilidad, proporcionando un análisis multidimensional de la población celularCión. La discriminación celular se basa en dos propiedades físicas principales: tamaño o superficie de las células y granularidad o complejidad interna 17 . Se puede realizar un análisis multidimensional combinando anticuerpos marcados con fluorocromos que tienen longitudes de onda de excitación similares y diferentes emisiones. La citometría de flujo es rápida, reproducible y sensible. Los láseres multipunto permiten un análisis multidimensional aún mayor de células individuales mediante citometría de flujo. Por lo tanto, es una metodología atractiva para el estudio de especímenes citológicos. Selección de células activadas por fluorescencia (FACS) utiliza las diferencias fenotípicas multidimensionales identificadas por citometría de flujo para clasificar las células individuales en distintas subpoblaciones.
En la última década, se han identificado múltiples proteínas superficiales e intracelulares como biomarcadores potenciales para la selección de células, incluidas las neuronas. Los estudios iniciales que buscaban aislar RGC de ratas utilizaron Thy1 como un ganglio celL marcador. Desafortunadamente, Thy1, también conocido como CD90, tiene múltiples isoformas en otras especies de roedores 18 , 19 , 20 y se expresa por múltiples tipos de células de retina 19 , 20 , lo que lo convierte en un marcador no específico para RGCs. Otro marcador de superficie, CD48, se encuentra en poblaciones monocíticas en la retina, incluyendo macrófagos y microglia. Usando estos dos marcadores de superficie, se desarrolló una firma RGC modificada-Thy1 + y células CD48 neg - 15 , 16 , 21 , 22 . Lamentablemente, estos dos criterios de selección no son suficientes para seleccionar una población RGC altamente enriquecida. Para abordar esta necesidad insatisfecha, se desarrolló un protocolo de citometría de flujo 23 basado en criterios de selección positiva y negativa multicapa usiNg marcadores de superficie celular conocidos para enriquecer y purificar RGCs murinos primarios.
Protocolo
Todos los procedimientos detallados en el siguiente protocolo fueron aprobados por la Junta de Revisión del Comité Institucional de Cuidado y Uso de Animales (IACUC) en el Centro de Ciencias de la Salud de la Universidad de Tennessee (UTHSC) y siguieron las Declaraciones de la Asociación de Investigación en Visión y Oftalmología (ARVO) De Animales en la Investigación Oftálmica y de la Visión, además de las directrices para experimentos con animales de laboratorio (Instituto de Recursos de Animales de Laboratorio, Política de Servicios de Salud Pública sobre Cuidado Humano y Uso de Animales de Laboratorio).
1. Preparación de instrumentos, soluciones y medios
Nota: Toda la información sobre materiales, reactivos, herramientas e instrumentos reportados en el protocolo se especifican en la Tabla de Materiales .
- Autoclave todos los instrumentos de disección y almacenarlos en un área estéril. Utilice los siguientes instrumentos: 4 fórceps estándar (2 largos y 2 cortos) y 2 tijeras,Así como 2 fórceps (1 largo y 1 corto) y 1 tijeras para la disección; Mantener un conjunto adicional como copia de seguridad.
- Prepare 100 mL de PBS estéril / solución de FBS al 1% para usar durante lavados, procedimientos de inmunomarcaje y pasos de clasificación de células. Mantenga la solución refrigerada a 4 ° C.
Nota: No agregue azida sódica (NaN 3 ) a la solución, ya que puede ser tóxica para las células vivas.- Preparar 100 ml de PBS / FBS al 1% con 99 ml de PBS y 1 ml de FBS.
- Preparar 100 ml de medio celular neural estéril suplementado con FBS al 3% (véase la Tabla de Materiales ) para su uso como medio de cultivo y de recogida. Mantener el medio de cultivo celular estéril a 4 ° C. Sólo caliente a temperatura ambiente (RT) antes de usarlo.
- Preparar 100 ml de medio de células neurales suplementado con FBS al 3% usando 97 ml de medio de células neurales y 3 ml de FBS.
- Los tubos de recolección previos al enfriamiento (tubos de 15 mL) pre-recubiertos con 5 mL de medio deDobladillo en un cubo de hielo. Utilice sólo tubos de polipropileno para evitar que las células se adhieran a la superficie del tubo.
- Coloque platos de 40 mm, filtros de nylon de 70 μm, jeringas, pilones para el filtro de células y tubos de polipropileno estériles en el gabinete de bioseguridad. Esterilizar todos los artículos antes de los procedimientos y mantenerlos de una manera estéril a lo largo de los procedimientos.
Nota: Todos los pasos posteriores a la recolección de la retina se realizarán en el gabinete de bioseguridad.
2. Enucleación
Nota: En este experimento se utilizaron un total de 10 ratones C57BL / 6J jóvenes (de 5 a 7 semanas de edad) para aislar 1,0 x 106 RGC con el fenotipo CD90.2 + CD48 neg CD15 neg CD57 neg .
- Eutanasia los ratones usando inhalación de CO 2 seguido de dislocación cervical. Siempre use un método de eutanasia secundario para asegurar que el animal eutanasiado está muerto.
Nota: El isofluorano puede utilizarse como alternativa al CO 2 . La ketamina no se recomienda, ya que está asociada con un aumento de la presión intraocular (PIO) cuando se utiliza como inductor de la anestesia 24 , 25 . - Inserte la pinza debajo del globo ocular, agarre el nervio óptico y tire hacia arriba; El globo será enucleado, con el nervio óptico intacto. Coloque los ojos recogidos en un vial que contenga PBS y guarde el vial en hielo hasta el siguiente paso.
Nota: Cualquier personal puede realizar este paso después de recibir la capacitación apropiada de la Unidad de Cuidado de Animales de Laboratorio (LACU).
3. Preparación de la suspensión de células retinianas
- Coloque el ojo recogido en la placa base de un microscopio de disección para comenzar la disección corneal. Disecar cada ojo individualmente.
- Cuidadosamente mantener el globo en la base del nervio óptico con fórceps. Para este paso, use one lonG, y una pinza estándar corta.
- Utilice una aguja afilada 30-gauge (30G) para perforar la córnea para permitir que el humor acuoso evacue del ojo, haciéndolo más fácil de sostener el ojo con el fórceps.
- Sostener la córnea con la pinza y el uso de tijeras para hacer una pequeña incisión en la córnea. Pelar suavemente la córnea y la esclerótica con la pinza. Cuando el globo se despega a medio camino, retire la retina y la lente usando la pinza. Deseche la córnea, la esclerótica y la lente.
Nota: Este método garantiza que la retina se separe completamente del resto del ojo. - Coloque la retina en una pequeña placa de Petri de 40 mm que contenga PBS / 1% de FBS.
Nota: Como alternativa a la placa de Petri, se puede usar un plato de cultivo celular. Asegúrese de mantener siempre la retina húmeda, como en condiciones fisiológicas.- Lavar cada retina tres veces con PBS estéril fresco / 1% FBS dentro del gabinete de bioseguridad.
- Coloque hasta 12 retina enUn filtro estéril de nylon de 70 μm humedecido con PBS / 1% de FBS. Utilizando el extremo posterior de una jeringa de 10 ml, macerar suavemente las retina con un movimiento circular para separar las células.
- Alternativamente, use un mazo para la maceración del tamiz celular o use digestión enzimática con una combinación de 15 UI / ml de papaína, 5 mM de L-cisteína y 200 U / mL de ADNasa I durante 15 min a 37ºC, seguido de inactivación con PBS / 10% de FBS.
Nota: No se observaron cambios en el porcentaje de células recuperadas cuando se comparó la digestión enzimática con la maceración con el extremo posterior de la jeringa o el mazo.
- Alternativamente, use un mazo para la maceración del tamiz celular o use digestión enzimática con una combinación de 15 UI / ml de papaína, 5 mM de L-cisteína y 200 U / mL de ADNasa I durante 15 min a 37ºC, seguido de inactivación con PBS / 10% de FBS.
- Para transferir las células aisladas, coloque el filtro estéril de nylon de 70 μm sobre el tubo de recolección de polipropileno. Pase las células recogidas a través del colador usando una pipeta P1000. Enjuague el colador ( paso 3.6 ) con PBS / 1% de FBS para liberar las células restantes y transferirlas al tubo de recolección.
- Añadir PBS / 1% FBS a achPara un volumen final de 1 ml por retina. Centrifugar la suspensión de células durante 7 min a 200 xg y RT.
Nota: Dependiendo del número de retina macerada (<6 retinae), el gránulo celular puede ser demasiado pequeño para ser visible.- Deseche el sobrenadante celular y resuspenda el sedimento celular en PBS / 1% de FBS usando una proporción de 1 ml por 5 retinae.
- Cuente las células usando un hemocitómetro.
- Limpie un hemocitómetro de vidrio y cubreobjetos con alcohol al 70%. Remueva suavemente el tubo que contiene las células para asegurar que la suspensión de la célula de la retina se distribuye uniformemente. Colocar 20 μL de azul de tripán al 0,4% en un tubo de microcentrífuga y mezclar con 20 μl de la suspensión celular.
- Mezclar suavemente y aplicar 10 μl de la mezcla de suspensión de azul / célula de tripán al 0,4% al hemocitómetro, llenando ambas cámaras; La acción capilar extraerá la mezcla de suspensión de azul / célula de trypan del 0,4% bajo la cubreobjetos. Usando un microscopio, cuente todas las células azul-negativas del trypan; EsteS representa las células vivas.
- Determinar la viabilidad celular utilizando la siguiente fórmula: recuento de células vivas / recuento total de células =% de viabilidad.
Nota: Si la viabilidad de las células es inferior al 95%, el uso de colorante fluorescente para la discriminación de viabilidad celular se requiere durante FACS.
- Utilice un colorante de viabilidad fluorescente que no sea permeante a las células vivas. Lavar las células con PBS para eliminar cualquier rastro de suero. Añadir 1 μl de colorante fluorescente para la discriminación de viabilidad celular por 5,0 x 10 6 células en un volumen final de 100 μL. Incubar a RT durante 15 minutos, protegido de la luz. Añadir 10 veces el volumen de PBS / 1% de FBS. Centrifugar durante 5 min a 200 xg y RT.
- Incubar la suspensión celular durante la noche a 4 ° C, si es necesario. Si esto se hace, llenar el tubo de suspensión de células con medio de células neuronales en lugar de PBS / 1% FBS. Coloque el tubo horizontalmente y manténgalo a 4 ° C.
4. Immunomarcación del ReCélulas Tinal
- Utilice la conversión siguiente para determinar el volumen de anticuerpo por número de células: 2 μl de anticuerpo por 5,0 x 106 células en un volumen de 100 μl.
- Lavar las células y mantenerlas en PBS / 1% de FBS. Tome una pequeña parte alícuota de células (5.0 x 10 6 células) para usar como un control negativo (sin marcar) en el momento de la configuración de clasificación.
Nota: Este control negativo es crítico para la calibración adecuada del clasificador de células. - Para minimizar la unión no específica de anticuerpos a células que expresan los receptores II y III de Fcγ, añadir 1 μl de un anticuerpo CD16 / 32 anti-ratón por 1,0 x 106 células en un volumen final de 50 μl utilizando PBS / 1% FBS. Incubar durante 10 min a TA.
- Añadir el anticuerpo cóctel a la muestra y mezclar suavemente por pipeteado. Incubar durante 30 minutos en un cubo de hielo. Asegúrese de que el cubo de hielo esté cubierto, ya que la luz podría comprometer el experimento debido al fotoblanqueo del fluoro etiquetadoPhores.
- Preparar el anticuerpo de cóctel usando los siguientes anticuerpos anti-ratón etiquetados fluorescentemente: CD90.2 AF-700, CD48 PE-Cyanine7, CD15 PE y CD57 no marcado.
Nota: Para cada anticuerpo, utilice las siguientes concentraciones por 5,0 x 106 células: CD90.2 AF700, 1 μg; CD48 PE - Cianina7, 0,4 mu g; CD15 PE, 0,02 mu g; Y CD57 sin marcar, 0,4 mu g.- Utilizar volúmenes según los siguientes cálculos (basados en los anticuerpos comercialmente disponibles enumerados en la Tabla de Materiales ): total de 5,0 x 10 ^ { 7} células a marcar; 2 μL por 5,0 x 106 células = 20 μl de cada anticuerpo; 4 anticuerpos diferentes = 80 μl de cóctel de anticuerpos; Volumen final = [(5,0 x 107 células totales) / 5,0 x 106 células] x 100 = 1.000 μl; 80 mu l de Abs + 50 mu l de CD16 / 32 + 870 mu l de PBS anti - ratón / FBS al 1% = 1.000 mu l.
Nota: Esta combinación proporcionó laCombinación óptima de fluorocromos para la configuración del instrumento. Los siguientes parámetros resumen la emisión y la excitación: AF-700, emisión de 719 nm cuando se excita con un láser de diodo rojo de 638 nm; PE-Cyanine7, emisión de 767 nm cuando se excita con un láser de diodo azul de 488 nm; Y PE, emisión de 575 nm cuando se excita con un láser de diodo azul de 488 nm.
- Utilizar volúmenes según los siguientes cálculos (basados en los anticuerpos comercialmente disponibles enumerados en la Tabla de Materiales ): total de 5,0 x 10 ^ { 7} células a marcar; 2 μL por 5,0 x 106 células = 20 μl de cada anticuerpo; 4 anticuerpos diferentes = 80 μl de cóctel de anticuerpos; Volumen final = [(5,0 x 107 células totales) / 5,0 x 106 células] x 100 = 1.000 μl; 80 mu l de Abs + 50 mu l de CD16 / 32 + 870 mu l de PBS anti - ratón / FBS al 1% = 1.000 mu l.
- Preparar el anticuerpo de cóctel usando los siguientes anticuerpos anti-ratón etiquetados fluorescentemente: CD90.2 AF-700, CD48 PE-Cyanine7, CD15 PE y CD57 no marcado.
- Después de la incubación de 30 minutos, llevar volumen hasta 5 ml usando PBS / 1% de FBS. Lavar las muestras centrifugándolas durante 7 min a 200 xg y RT. Repita el procedimiento una vez para eliminar todos los anticuerpos no unidos.
- Añadir 2 μl de anticuerpo secundario (0,1 μg), que se unirá al CD57 de 5,0 x 10 6 células. Incubar durante 30 minutos en un cubo de hielo, como en el paso 4.4 . Lavar las células dos veces, como en el paso 4.5 .
- Etiquetar las células con anticuerpos secundarios si se utilizó un anticuerpo primario no marcado en el paso 4.4 .
Nota: El segundoAry anticuerpo de elección para esta configuración se enumera en la Tabla de Materiales ; Tiene una longitud de onda de emisión de 421 nm. Utilícelo con un filtro de paso de banda de 450/50 nm cuando se excita con el láser de diodo violeta a 405 nm. - Utilice los volúmenes según los cálculos siguientes (basados en el anticuerpo comercialmente disponible enumerado en la Tabla de Materiales ): 2 μL por 5,0 x 106 células = 20 μl de anticuerpo secundario; Volumen final = [(5,0 x 107 células totales) / 5,0 x 106 células] x 50 = 500 mu l; 20 μl de Abs + 480 μL de PBS / 1% de SFB = 500 μL.
- Etiquetar las células con anticuerpos secundarios si se utilizó un anticuerpo primario no marcado en el paso 4.4 .
- Mantenga las células marcadas en PBS / 1% de FBS. Contar las células utilizando un hemocitómetro; Utilizar una concentración final de células de la retina de 3,0 - 4,0 x 10 7 células / ml.
Nota: No utilice el medio de cultivo celular para diluir las células porque el rojo de fenol puede aumentar la autofluorescencia, reduciendo así la resolución entre negatY las células positivas. La concentración final de células por volumen depende en gran medida del caudal volumétrico de la configuración del instrumento. - Utilice controles de un solo color durante la instalación para minimizar el derrame de fluorescencia.
Nota: Este paso, también conocido como compensación, se aplica para corregir el ruido creado por la combinación de fluoróforos. Las microesferas de poliestireno en PBS / BSA al 0,1% / NaN 3 2 mM con la capacidad de unirse a isotipos de inmunoglobulina marcada fluorescentemente (Ig) de múltiples especies proporcionan controles positivos para establecer la compensación.- Coloque 3 gotas de las microesferas de poliestireno en tubos FACS estériles, asignando una por fluoróforo. Añadir 1 μg del fluoróforo respectivo a cada tubo. Incubar durante 15 min a RT, protegido de la luz. Añadir 3 ml de PBS / 1% de FBS a los tubos de muestra. Centrifugar durante 5 min a 200 xg y RT. Retire cuidadosamente el sobrenadante y resuspenda en 250 μL de PBS / 1% de FBS.
- Para configurar el control negativoOls, utilizar microesferas de poliestireno que no se unen a Ig. Realizar este paso el día anterior, si es necesario.
5. Estrategia de Clasificación de Células
Nota: Instrucciones específicas para la configuración del instrumento para FACS con 355 nm, UV; 405 nm, violeta; 488 nm, azul; Y 640 nm, láseres rojos con 2, 2, 5 y 3 canales de fluorescencia, respectivamente. El software operativo era DIVA versión 8.0.1. La clasificación de las células se realizó con una boquilla de 70 μm, una presión de la vaina de 70 psi, una frecuencia de 87,5, una amplitud de 48,6 con una primera rotura de la gota a 333, un ajuste de la separación de 6, una precisión de orden ajustada a una pureza de cuatro vías con una máscara de pureza predeterminada Retardo ajustado a 42,98 utilizando perlas.
- Utilice tubos cónicos de polipropileno de 15 mL como recipientes de recogida. Añadir 5 ml del medio de recogida (medio de cultivo celular) a cada tubo y girar el tubo para recubrir las paredes.
Nota: Este paso impide que las células se peguen a los lados de tEl tubo de recogida. Como alternativa, el tubo puede recubrirse con FBS no diluido. - Tenga en cuenta la eficiencia del clasificador de células para estimar el rendimiento final de las células.
Nota: La eficiencia del género varía en función del citómetro de flujo utilizado. RGCs con CD90.2 + CD48 negativo CD15 neg CD57 neg fenotipo comprenden alrededor del 1% de todas las células de la retina. - Haga que la clasificación de células sea realizada por un operador capacitado (generalmente en una instalación principal). Asegúrese de que el instrumento se limpia y esteriliza con etanol al 70% antes de la adquisición de la muestra. Limpie cuidadosamente el exterior de los tubos de recogida con etanol al 70%.
- Si las células se han asentado o agregado, pipetee las células hacia arriba y hacia abajo y filtre la suspensión a través de un colador estéril de nylon de 40 μm antes de la adquisición. Asegúrese de controlar la temperatura y mantenerla a 4 ° C mientras se realiza la clasificación de células; Si no lo hace, se reducirá la celL rendimiento.
- Discutir los detalles de la clase con el operador clasificador de células antes de realizar los experimentos.
Nota: En el momento del experimento, el operador clasificador de células habrá hecho clic en una serie de botones de la barra de herramientas Espacio de trabajo del software de adquisición para el citómetro. Estos son el navegador , el citómetro , el inspector , la hoja de trabajo y el panel de adquisición . La estrategia de clasificación de células utilizada aquí se conoce como una clasificación de 2 vías. Dos poblaciones son recolectadas: las RGC enriquecidas y todos los otros tipos celulares. Si se van a recolectar poblaciones adicionales, se pueden aislar hasta dos poblaciones adicionales como una especie de 4 vías. Si se recolectan poblaciones adicionales, el clasificador de células requiere diferentes tubos de recolección y configuración. - Realice una compensación para corregir la superposición espectral de los fluoróforos.
Nota: Este proceso puede realizarse manualmente ajustandoCada ajuste, o puede hacerse automáticamente como parte del software en uso. La mayoría del software para equipos de clasificación de células tiene la opción de una compensación automatizada. Se considera el patrón oro y el tipo más preciso de compensación. En este paso se utilizará la muestra negativa (sin fluoróforo) y los controles individuales preparados con microesferas de poliestereno (perlas de compensación) fabricadas específicamente para unir todos los anticuerpos monoclonales relevantes utilizados en el experimento.- Seleccione Experimento> Configuración de compensación> Crear controles de compensación . Agregue los controles específicos del fluoróforo de la lista que se muestra en la pantalla. Haga clic en Aceptar .
Nota: Aparecerá un tubo de compensación para cada uno de los controles.- Utilizar un control no marcado (sin fluoróforo, paso 4.2 ) para verificar la luz difundida hacia adelante (FSC), la luz dispersada por el lado (SSC), y para mostrar la población inicial (P1).
- Instale el tubo de control negativo en el citómetro y haga clic en Cargar. Compruebe que la población de interés se muestra y selecciónela. Esta es la población 1 (P1). Haga clic con el botón derecho en la puerta P1 y seleccione Aplicar a todos los controles de compensación . Haga clic en Grabar datos . Una vez realizada la grabación, haga clic en Descargar y quitar el tubo.
- Instale el siguiente tubo en el citómetro, como se muestra en la pantalla. Repita el paso 5.6.2 hasta que se hayan grabado todos los datos de los controles.
- Seleccione Experimento> Configuración de compensación> Calcular compensación . Guarde la configuración y el nombre del experimento. Haga clic en Vincular y guardar .
Nota: La compensación es un paso necesario, ya que elimina la superposición de espectro entre los detectores. - Si se necesita compensación manual, hágalo ajustando los medios de las señales positivas para que igualen los negativos para eacH de los fluorocromos utilizados.
Nota: Este paso se realiza mediante la operación del clasificador de células y puede tomar 30 min.
- Seleccione Experimento> Configuración de compensación> Crear controles de compensación . Agregue los controles específicos del fluoróforo de la lista que se muestra en la pantalla. Haga clic en Aceptar .
- Gating estrategia ( Figura 3A ].
- Establezca P1 trazando FSC contra SSC; El FSC es indicativo del tamaño y el SSC indica la complejidad interna de las células. Véase la figura 3A .
- Dibujar un gráfico de pseudocolor de SSC-H (altura) frente a SSC-W (ancho) usando la población seleccionada en el paso 5.7.1 (P1); El diagrama de pseudocolor permite la representación visual de la densidad de células en relación entre sí.
Nota: Una densidad celular más baja está representada por el azul y el verde, mientras que las áreas rojas y anaranjadas representan alta densidad celular.- Lleve a cabo este paso para recolectar células únicas; La puerta de célula única se llama P2. Véase la figura 3A .
- Repita el paso 5.7.2 aParcela FSC-H frente a FSC-W utilizando P2. Asegúrese de que la selección de células individuales como "dobletes" o grupos de células contiene tanto un positivo como un marcador negativo, proporcionando falsa positividad.
- Dibujar un gráfico pseudocolor de CD90.2 frente a CD48. Seleccionar todas las células CD90.2 + CD48 neg para eliminar los monocitos del enriquecimiento RGC; Llame a esta puerta CD90.2 + CD48 neg o P3. Véase la figura 3A .
- Utilizando la población de CD90.2 + CD48 neg o la puerta P3 seleccionada, dibuje un gráfico de pseudocolor de CD57 frente a CD15 para eliminar contaminantes de células amacrinas del enriquecimiento de RGC. Puerta la población CD15 neg negativa CD57. Véase la figura 3A .
- Definir las poblaciones que se recogerán para la muestra en la ventana "Clasificar diseño" y proceder con la clasificación de células; La muestra a recoger es CD90.2 + CD48 neg CD15 neg CD57 neg P
Nota: La población a ordenar se selecciona en el menú desplegable Agregar en la ventana de ordenación. Después de agregar la población, pedirá eventos de destino o cuántos eventos serán recolectados. En cualquier momento, el diseño de clasificación se puede editar haciendo clic en el campo Ordenar ubicación que contiene la población. Se obtienen 0,9% ± 0,3 de RGCs con el fenotipo CD90.2 + CD48 neg CD15 neg CD57 neg de ratones jóvenes (5-7 semanas de edad) y 0,5% ± 0,3 y viejos (12 meses de edad) C57BL / 6J 23 . - Utilizando 25.000 células, realice un control de pureza 23 . Véase la figura 3B -E.
Nota: La verificación de pureza es el proceso para volver a analizar las celdas ordenadas para verificar la exactitud de la clasificación de celdas. Se cargará una pequeña parte alícuota de células clasificadas en el citómetro para verificar la eficacia del género.
- Etiquetado intracelular.
- Fijar las células clasificadas durante 1 h y permeabilizar a 4 ° C para hacer las células metabólicamente inactivas y permitir la penetración de anticuerpos intracelulares.
- Diluir los siguientes anticuerpos en la solución de permeabilización: proteína de unión a ARN con empalme múltiple (RBPMS) a una dilución 1: 100 en un stock de 100 μg / mL; Anti-sinucleína gamma (SNCG), 1: 100 en un stock de 1 mg / ml; Proteína de dominio homeostático / dominio de POU específica para el cerebro 3A (BRN3A), 1: 100 en una población de 200 μg / ml; Y tubulina beta de clase III específica de anti-neurona (TUJ1), 1: 100 en un stock de 1 mg / ml. Incubar las células y las soluciones de anticuerpos durante 1 h en un cubo de hielo cubierto.
- Lavar las muestras dos veces con PBS / 1% de FBS.
- Resuspender las células en el anticuerpo secundario marcado con AF488 adecuado a una dilución de 1: 200 durante 30 minutos en un cubo de hielo.
- Lavar las muestras como en el paso 6.1.3. Mantenga las celdas enPBS / FBS al 1% (250 mu l) hasta que esté listo para analizar.
7. Validación de la Clasificación de Células por Análisis de qPCR
Nota: Consulte la Figura 4 .
- Extracción de RNA 23 .
- Extraer el ARN de 5,0 x 105 células clasificadas por lisis celular y homogeneización seguido por la adición de cloroformo.
- Transferir la fase superior incolora a un microtubo limpio para la precipitación con alcohol, seguido por la concentración del extracto en una columna giratoria. Realizar la digestión de DNAse en la columna.
- Lavar la columna con agua libre de RNasa para la elución de ARN.
- Evaluar la concentración de ARN por espectrofotometría.
- Síntesis y preamplificación de cDNA.
- Utilizar 100 ng de material de ARN y mezclar con una solución que contenga enzima transcriptasa inversa, inhibidor de la ribonucleasa recombinante (para evitar la degradación del ARN), cloruro de magnesio (MgCL2), y desoxinucleótidos.
- Mezclar el contenido del tubo e incubar durante 10 min a 25 ° C seguido de 60 min a 42 ° C. Finalizar la reacción con una incubación de 5 minutos a 85 ° C. Almacenar el cDNA resultante a -20 ° C hasta que esté listo para su uso.
Nota: El material de cDNA se puede almacenar a -20 ° C durante un máximo de un mes si la etapa de preamplificación no puede llevarse a cabo inmediatamente.
- Pre-amplificación de cDNA.
- Pre-amplificar el material de cDNA usando una serie de cebadores específicos para múltiples tipos de células retinianas incluyendo: células ganglionares retinales, células amacrinas, astrocitos, Müller, bipolares, horizontales, fotorreceptores y células epiteliales de pigmento retiniano, como se detalla en la Referencia 23 y en la Tabla De Materiales .
Nota: La reacción de preamplificación se prepara para aumentar la sensibilidad de detección para la cuantificación. La reacción de preamplificación contiene una mezcla del cebadorMezcla de la Tabla de Materiales ; 2,5 mu l de cDNA, que comenzó a 100 ng de ARN; Enzima transcriptasa inversa; Y agua libre de nucleasa en un volumen final de 10 μl. - Llevar a cabo la etapa de activación enzimática a 95 ° C durante 10 min, seguido de 14 ciclos a 95 ° C durante 15 s, seguido por 60 ° C durante 4 min. Diluir el material preamplificado 1:10 en tampón Tris EDTA y mantenerlo a -20 ° C hasta que esté listo para su uso.
- Pre-amplificar el material de cDNA usando una serie de cebadores específicos para múltiples tipos de células retinianas incluyendo: células ganglionares retinales, células amacrinas, astrocitos, Müller, bipolares, horizontales, fotorreceptores y células epiteliales de pigmento retiniano, como se detalla en la Referencia 23 y en la Tabla De Materiales .
- 7.4 reacción qPCR.
- Preparar todas las reacciones de qPCR en un volumen final de 10 μL utilizando los cDNA diluidos, preamplificados (2,5 μL), los cebadores (enumerados en la Tabla de Materiales ), el agua libre de nucleasa y un concentrado con ADN polimerasa y desoxinucleótidos.
- Utilice las siguientes condiciones del instrumento para ejecutar el qPCR: un paso de espera de 50 ° C durante 2 min, seguido por 95 ° C durante 10 min. Ejecutar un total de 40 ciclos a 95 ° C durante 15 s seguido de 60 ° C durante 1 min. Realizar todas las medidasEn repeticiones de tres.
- Realizar la cuantificación relativa utilizando el umbral comparativo (C T ) después de determinar los valores de C T para el gen de limpieza y los genes diana en cada muestra. Calcular el cambio de plegado relativo ( Rq ) usando la siguiente ecuación: Rq = 2 T -ΔC , donde ΔC T = C T gen objetivo - C T de referencia del gen 23 .
Nota: El C T se define como el ciclo de PCR en el que la señal fluorescente del colorante indicador cruza un umbral arbitrariamente colocado 26 . El C T está inversamente relacionado con la cantidad de amplicón (producto de PCR) en la reacción.
Resultados
El estudio en profundidad de los CGR se ve obstaculizado por muchos factores, entre ellos su baja frecuencia y la falta de una metodología robusta y estandarizada para su aislamiento. La Figura 1 muestra la metodología utilizada para el aislamiento de las retina. Existen variaciones en el procedimiento de enucleación basado en el tipo de análisis, como si la enucleación es parte de la experimentación in vivo [ 27] . La enucleación en este protocolo se realiza en ratones eutanasiados. Como se muestra en la Figura 1A- B , los fórceps se colocan debajo del ojo y se tiran hacia arriba para causar sangrado mínimo y para retirar un globo ocular con un nervio óptico intacto.
Existen diferencias en el número de RGCs en diferentes cepas de ratón, especialmente en ratones genéticamente alterados 23 , 28 ,Los autores consideran que estas últimas son importantes cuando se determina el número de ratones que se van a utilizar.Las retinas de ratones C57BL / 6J viejos tienen menos células retinales vivas que sus homólogas más jóvenes 23. Por lo tanto, la disección de la retina debe realizarse cuidadosamente para Maximizando el rendimiento celular.Un procedimiento paso a paso para la disección de la retina se presenta en la Figura 1C- J . Las células retinianas son frágiles, por lo que las retina disecadas se colocan en filtros de nylon y se maceran con el extremo posterior de una jeringa, Mostrada en la Figura 2A o con un mazo para filtros de células.La maceración de células directamente en el filtro de células es rápida y reduce grupos de células.Una imagen representativa de la suspensión de células se ilustra en la Figura 2.B Se pueden visualizar múltiples células de retina interna. En este punto, los RGC han perdido su morfología de firmaGy debido a axotomía durante el aislamiento celular y la preparación de la suspensión celular.
El paso más intensivo en mano de obra de esta metodología es la configuración de clasificación de células. Esta fase es un paso crítico durante FACS multicolor, ya que maximiza la resolución de señal a ruido. La Figura 3A muestra la estrategia de bloqueo usada para el aislamiento de RGC. Esta estrategia se dirigió a la eliminación de las células contaminantes de la suspensión celular, que incluía monocitos, glial, amacrina y células fotorreceptoras. Como parte de la metodología, los marcadores de superficie adicionales se confirmaron mediante análisis inmunohistoquímico antes de ser utilizados como parte de la estrategia de exclusión. Los datos anteriores demostraron que un pequeño porcentaje de células CD90.2 + son CD48 + . La exclusión de estas células eliminó monocitos y posiblemente microglia de la piscina de células de retina. Se ha demostrado previamente que el clásico Thy1 + CD48 neg fenotipo de superficie no es suficiente para identificar y aislar RGCs murino 23 , ya que estas células expresan genes asociados con amacrina, Müller, bipolar, fotorreceptor horizontal, y las células epiteliales del pigmento retiniano ( Figura 4A ). Esto se aborda adicionalmente investigando marcadores adicionales para la exclusión celular. CD15 ha sido descrito como un marcador de amacrina y las células bipolares [ 31] , lo que indica su uso como marcador adicional para la selección negativa. Trabajo de Uusitalo et al. 32 describieron CD57 como un marcador de identificación para células gliales y fotorreceptores. Por lo tanto, este anticuerpo se añadió a la estrategia de clasificación celular.
A continuación, se caracterizaron estas células para validar la metodología para el aislamiento de RGC murinos. Los fenotipos de CD90.2 + CD48 neg CD15 negativo CD57 neg ordenados células (10 , 11 , 12 , 33 : SNCG, BRN3A, TUJ1 y RBPMS. Como se muestra en la Figura 3C , las células clasificadas expresaron las cuatro proteínas intracelulares asociadas a RGC. A continuación, se usó citometría de flujo de imagen en la Figura 3D para mostrar la localización intracelular de RBPMS y la expresión de CD90.2 en la superficie celular. Estos resultados fueron probados en sistemas de citometría múltiple, lo que confirma la reproducibilidad y estandarización. Como se muestra en la Figura 3E , algunas de las células clasificadas comenzaron a mostrar la morfología asociada a RGC después de cultivo celular in vitro .
Por último, una comparación de las células antes del enriquecimiento y post-ceEl análisis se realizó mediante análisis de qPCR. Comparación del fenotipo Thy1 + CD48 neg a CD90.2 + CD48 negativo CD15 Neg CD57 neg clasificado células reveló que el Thy1 + CD48 neg fenotipo expresa genes asociados con RGCs, sino también con otras células de la retina. Sin embargo, la población de células altamente enriquecida ( Figura 4B ) mostró un aumento de muchos veces en los genes que codifican los marcadores intracelulares específicos de RGC Sncg (SNCG), Pouf4l (BRN3A), Tubb3 (TUJ1) y Rbpms (RBPMS). Colectivamente, las evaluaciones de ARNm y proteína validaron la metodología.
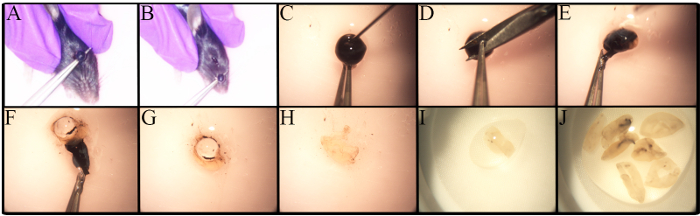
Figura 1 . Enucleación y Disección Ocular para Aislamiento Retinal. Los ratones C57BL / 6J jóvenes fueron eutanasiados antes de tO eliminación del globo ocular con CO 2 y dislocación cervical. A) Coloque la pinza debajo del ojo y levante el ojo en un solo movimiento. B) Se retira el ojo, incluyendo el nervio óptico. CJ) Guía paso a paso para eliminar la retina. C) Se realiza una punción usando una aguja 30G antes de la eliminación corneal para permitir que el humor acuoso salga del ojo. D) La córnea se sostiene con fórceps para realizar una pequeña incisión. EF) El uso de fórceps permite pelar la córnea, el epitelio pigmentario de la retina, la coroides y la esclerótica. La retina se separa de la esclerótica, se enrolla y se elimina. G) La lente se retira y se desecha. HJ) Las retina recogidas se colocan en un plato pequeño que contiene PBS / 1% FBS para mantenerlos húmedos en todo momento. Haga clic aquí para ver una versión más grande de estafigura.
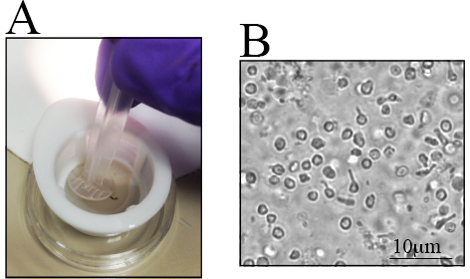
Figura 2 . Suspensión de la célula retiniana después de la maceración de las retinas recogidas. Las retina recogidas se colocan en un plato pequeño para aislar las células. A) Las retinas se colocan en un colador de nylon de 70 μm y se maceran usando el extremo posterior de una jeringa. B) Imagen representativa de la suspensión celular, donde se observan distintas células retinianas. La barra de escala es de 10 μm.

Figura 3 . Estrategia de clasificación para el aislamiento de células con CD90.2 + CD48 neg CD15 neg CD57 neg Análisis de fenotipos y post-clasificación. La estrategia de clasificación se basa en la inclusión de células CD90.2 y la exclusión de células CD48, CD15 y CD57 positivas, que son células contaminantes. A) Como primer paso, el tamaño de la parcela (FSC) y la complejidad interna (SSC) para obtener una visión general de la población celular. La población cerrada inicial (P1) se utiliza para discriminar entre células individuales y células agrupadas o agregados usando la altura SSC (H) frente a la anchura (W), P2. La selección de las células individuales se utiliza para elegir las células CD90.2 + CD48 neg . Para confirmar la eliminación de todos los dobletes, se realiza un gráfico de FSC-H frente a FSC-W, P3 (panel del medio ). Las células fueron marcadas con AF700 conjugado anti-ratón CD90.2, PE-Cyanine7 conjugado anti-ratón CD48, PE-conjugado CD15, y anti-ratón CD57. Como anticuerpo secundario para marcar el CD57 anti-ratón, se utilizó BV421 anti-ratón. Población 3 (P3) se representó en el cuarto </ Em> para seleccionar las células CD90.2 + CD48 neg , eliminando la mayoría de las células contaminantes. A continuación, se genera un gráfico CD57 frente a CD15 usando las células negativas CD90.2 + CD48 seleccionadas. Se selecciona el Cuadrante 4 (Q4), ya que representa las células negativas CD90.2 + CD48 negativo para CD15 y CD57. El fenotipo resultante de la población cerrada es CD90.2 + CD48 neg CD15 neg CD57 neg . B) Análisis posterior a la clasificación de los marcadores de superficie utilizados en A). Las células clasificadas son homogéneas en tamaño, como se muestra en el primer panel. Los histogramas posteriores muestran el porcentaje de cada marcador de superficie utilizado en la estrategia de clasificación detallada en A). Un total de 95% de las células son CD90.2 + , como se muestra en la línea negra comparado con el control de Ig, representado por el histograma sólido. Estas células se cerraron para evaluar los porcentajes de CD48, CD15 y CD57, representados por el rojo, el azul y el grN líneas, respectivamente. Los resultados muestran una expresión mínima de estos marcadores de superficie celular. C) Confirmación del fenotipo RGC usando los marcadores intracelulares específicos de RGC SNCG, BRN3A, TUJ1 y RBPMS. Las líneas negras representan el porcentaje de células que expresan cada marcador intracelular. D) Imágenes representativas tomadas en un clasificador de células de imagen que muestra la localización intracelular de RBPMS, un marcador intracelular específico de RGC y el marcador de superficie celular CD90.2. La barra de escala es de 20 μm. E) Imagen representativa de RGCs clasificadas después de 24 h en cultivo usando un microscopio confocal. La barra de escala es de 20 μm. Las imágenes BE se adaptan de trabajos previamente publicados con permiso 23 . Las imágenes DE se tomaron a 20X. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4 . Análisis de mRNA pre y post-clasificación. Thy1 + CD48 neg y clasificado células con el fenotipo CD90.2 + CD48 neg CD15 neg CD57 neg fueron evaluados por qPCR análisis utilizando un panel de 25 genes expresados por las células de la retina. Los niveles de expresión génica diana se presentan como un cambio Log 2- fold usando Hprt como un gen doméstico y el agua como control negativo. El cálculo se realizó con base en el método ΔC T. Media ± SEM; N = 3 repeticiones biológicas se realizaron por triplicado. Cifras obtenidas de trabajos previamente publicados con permiso 23 .
Discusión
FACS es la técnica de elección para purificar poblaciones celulares. Otros métodos de aislamiento incluyen el inmunopanning, las perlas magnéticas y el agotamiento de la fijación del complemento. La ventaja de FACS sobre estas otras metodologías se basa en la identificación simultánea de marcadores de superficie celular con diferentes grados de intensidad. La intensidad fluorescente de la molécula es proporcional a la cantidad de expresión de la proteína. Hasta ahora, el aislamiento de RGCs se basó únicamente en la positividad de Thy1 (CD90) y negatividad de CD48 15 , 16 , 22 , 34 , independientemente del método de aislamiento utilizado. Recientemente se ha demostrado que el fenotipo Thy1 + CD48 neg no es suficiente para aislar una población homogénea de células que expresan marcadores intracelulares RGC [ 23] . La identificación de la población RGC es esencial para su aislamiento,Y porque comprenden un pequeño porcentaje de células retinianas 7 , 8 , 9 . La mayoría de los RGC están localizados en la capa más interna de la retina, mientras que un pequeño número se localiza en las capas plexiformes internas (RGCs 35 desplazados). Por lo tanto, el rastreo de RGCs de los colliculi superior por inyecciones estereotácticas y el rastreo con hidroxiestillbamidina (un trazador retrógrado para contornear las neuronas) se convirtió en opciones atractivas para muchos laboratorios [ 36 , 37 , 38] . Estos sistemas requieren la inyección de trazador, que, si no se lleva a cabo correctamente, puede conducir a algunas regiones de la retina dejó sin rastrear. Además, son técnicamente más exigentes y, al igual que otras metodologías como el inmunopanning, son largas. El inmunopanning usando los anticuerpos anti-Thy1 y -CD48 tarda 48 h en completarse y no logra más de 95% pureza. Este trabajo describe una metodología basada en FACS que ofrece un protocolo rápido y reproducible para aislar una población homogénea de RGCs vivas con el fenotipo Neg CD57 neg CD57 neg CD90.2 + CD48, sin el uso de trazadores, bolas magnéticas o técnicas de inmunopanning .
Los factores siguientes son necesarios para el aislamiento exitoso de RGC puros por FACS: 1) eficiencia de clasificación, que depende en gran medida del equipo utilizado; 2) combinación óptima de fluorocromos marcados con anticuerpos, para minimizar el ruido; Y 3) configuración de clasificación de células. La eficiencia de clasificación se calcula tomando el número de eventos objetivo seleccionados para la clasificación dividido por el número de eventos objetivo detectados, expresado como un porcentaje. La eficiencia de clasificación es un cálculo proporcionado por el equipo. Esta eficiencia depende de la configuración del sistema de clasificación y del modo de clasificación de células. La elección de una combinación óptima de fluorocromos es un proceso complejo. Cada gripeOrochrome tiene propiedades distintas y se caracteriza por sus longitudes de onda de excitación y emisión. Mientras la excitación se lee con un láser, la emisión se lee mediante tubos fotomultiplicadores, que están limitados por los filtros ópticos disponibles en el equipo de clasificación FACS. Aquí, se proporciona una combinación de fluorocromos marcados con anticuerpos PE, PE-Cyanine7, AF700 y BV421. Esto se determinó después de considerar múltiples combinaciones de fluorocromo que proporcionaron la mejor resolución al tiempo que reducían la superposición espectral. Por último, la configuración de clasificación es crítica. En general, las células retinianas son frágiles. Por lo tanto, es mejor utilizar una presión más baja para ejecutar las muestras, para minimizar la tensión sobre las células. Es crítico mantener la muestra a 4 ° C, porque mantener los RGC murinos durante períodos más largos de tiempo a temperatura ambiente puede reducir el rendimiento celular, especialmente cuando se clasifican grandes cantidades de células.
La clasificación basada en FACS es una metodología ideal para el aislamiento de células que componen avPequeño porcentaje de la suspensión celular. El proceso, desde la disección de la retina hasta la finalización de la clasificación celular, toma aproximadamente de 5 a 6 h, en comparación con los sistemas de inmunopanación y trazador, que tardan días en completarse. El análisis multidimensional de FACS y la capacidad del equipo para recolectar varias poblaciones viables permite análisis funcionales adicionales de las células. El protocolo descrito aquí es una poderosa herramienta para el aislamiento de RGC murinos primarios. A pesar de sus múltiples ventajas, incluyendo su sensibilidad, reproducibilidad y la identificación inmediata de células viables, existen algunas limitaciones. En primer lugar, requiere una instrumentación costosa y un operador altamente capacitado. Por lo general, el operador es un inmunólogo o un individuo altamente capacitado en el campo, con quien es necesario reunirse en el momento de la configuración del experimento. Hoy en día, las instalaciones académicas tienen múltiples instalaciones básicas, lo que puede facilitar la realización de este tipo de experimentos. En segundo lugar, los CGR pierden suDebido a la atoxomía, haciéndolos muy pequeños en tamaño. En este momento, no se sabe si algunos de sus genes pueden ser modulados debido a la atoxomía.
La metodología presentada aquí permite el análisis en sentido descendente de la función RGC in vitro y es una herramienta valiosa para ser utilizada en los campos de las ciencias visuales y de la salud. El mantenimiento de la producción de células ganglionares en el cerebro es necesario para la percepción visual y está en riesgo en múltiples enfermedades. Estas células pueden utilizarse para la experimentación controlada in vitro , tanto en modelos sanos como en los de enfermedad. Es posible realizar estudios electrofisiológicos, farmacológicos, bioquímicos y moleculares sobre estas células, lo cual es ideal para el desarrollo de futuras dianas terapéuticas.
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
Agradecimientos
Los autores desean agradecer al Sr. Tim Higgins, Illustrator Senior del Departamento de Microbiología, Inmunología y Bioquímica, por la asistencia técnica de video; Dr. Matthew W. Wilson para las discusiones y los miembros de los laboratorios Jablonski y Morales-Tirado por sus útiles comentarios. Este trabajo fue apoyado por el Premio al Investigador Joven del Instituto de Investigación Alcon (VMM-T), la Fundación de Investigación de la Universidad de Tennessee (VMM-T), el Instituto Nacional del Ojo EY021200 (MMJ), el Gerwin Fellowship (VMM-T); La Beca de Pre-doctorado Gerwin (ZKG), el Departamento de Defensa del Ejército de Investigación Médica y el Comando de Materiales (VMM-T), y la subvención no restringida de la investigación para prevenir la ceguera.
Materiales
| Name | Company | Catalog Number | Comments |
| Anti-mouse CD15 PE | BioLegend | 125606 | Clone MC-480 |
| Anti-mouse CD48 PE-Cy7 | BioLegend | 103424 | Clone HM48-1 |
| Anti-mouse CD57 | Sigma Aldrich | C6680-100TST | Clone VC1.1 |
| Anti-mouse CD90.2 AF700 | BioLegend | 105320 | Clone 30-H12 |
| Brilliant Violet 421 Goat Anti-mouse IgG | BioLegend | 405317 | Clone Poly4053 |
| Purified Anti-mouse CD16/32 | BioLegend | 101302 | FcgRII/III block, Clone 93 |
| Zombie Aqua | BioLegend | 423102 | Live cell/ Dead cell discrimination |
| Fetal Bovine Serum | Hyclone | SH30071.03 | U.S. origin |
| AbC Total Antibody Compensation Bead Kit | Thermo Fisher Scientific | A10497 | Multi-species Ig |
| Neurobasal Medium | Thermo Fisher Scientific | 21103049 | Add serum to media prior to culture. |
| Phosphate-Buffered Saline (PBS) | Thermo Fisher Scientific | 10010049 | Saline solution |
| Dissection Microscope | Olympus | SZ-PT Model | Stereo Microscope |
| Sorvall Centrifuge | Thermo Scientific | ST 16R | All centrifugation performed at RT |
| Base Plate – Dissection Pan | Fisher Scientific | SB15233FIM | A wax plate can also be used |
| Forceps | Aesculap | 5002-7 | 4 ½ inches |
| Iris Scissors, Straight | Aesculap | 1360 | 5 ½ inches |
| Falcon 15 mL conical tubes | Fisher Scientific | 352097 | Polypropylene tubes |
| Falcon 50 mL conical tubes | Fisher Scientific | 352098 | Polypropylene tubes |
| BD FACS Tubes | Fisher Scientific | 352003 | Polypropylene tubes |
| 40 mm dishes | MidSci | TP93040 | Tissue culture treated |
| 70 μm nylon strainer | MidSci | 70ICS | sterile |
| 40 μm nylon strainer | MidSci | 40ICS | sterile |
| BD 10 mL syringe | Fisher Scientific | 301604 | Disposable Syringe without needle |
| Pestles | MidSci | PEST | sterile |
| Wheaton Vials | Fisher Scientific | 986734 | No Liner |
| BD 30 G needle | Fisher Scientific | 305128 | 1 inch |
| Hausser Scientific Bright-Line Glass Counting Chamber | Fisher Scientific | 0267151B | Hemocytometer |
| Gibco Trypan blue 0.4% Solution | Fisher Scientific | 15250061 | Viability Dye |
| Eppendorf tubes | Fisher Scientific | 05-402-25 | 1.5mL |
| EVOS Floid Cell Imaging | Thermo Fisher Scientific | 447113 | Fluorescence Imaging with a 20X objective |
| 100% Ethanol | Fisher Scientific | 04-355-452 | Used to make 70% Ethanol |
| Pipet-Lite LTS Pipette L-1000XLS+ | Rainin | 17014282 | LTS Pipette |
| Pipet-Lite LTS Pipette L-200XLS+ | Rainin | 17014391 | LTS Pipette |
| Pipet-Lite LTS Pipette L-20XLS+ | Rainin | 17014392 | LTS Pipette |
| Rack LTS 1000 mL – GPS-L1000S | Rainin | 17005088 | Blue Rack Sterile Tips |
| Rack LTS 250 mL – GPS-L250S | Rainin | 17005092 | Green Rack Sterile Tips |
| Rack LTS 20 mL – GPS-L10S | Rainin | 17005090 | Red Rack Sterile Tips |
| FACSAria II Cell Sorter | BD Biosciences | N/A | Custom order |
| LSR II Cytometer | BD Biosciences | N/A | Custom order |
| Abca8a | Thermo Fisher Scientific | Mm00462440_m1 | Müller cells |
| Aldh1al | Thermo Fisher Scientific | Mm00657317_m1 | Müller cells |
| Aqp4 | Thermo Fisher Scientific | Mm00802131_m1 | Astrocytes |
| Calb2 | Thermo Fisher Scientific | Mm00801461_m1 | Amacrine, Horizontal |
| Cd68 | Thermo Fisher Scientific | Mm03047340_m1 | Retinal Pigment Epithelial Cells |
| Gad2 | Thermo Fisher Scientific | Mm00484623_m1 | Amacrine |
| Hprt | Thermo Fisher Scientific | Mm01545399_m1 | House keeping gene |
| Lhx1 | Thermo Fisher Scientific | Mm01297482_m1 | Horizontal |
| Lim2 | Thermo Fisher Scientific | Mm00624623_m1 | Horizontal |
| Nrl | Thermo Fisher Scientific | Mm00476550_m1 | Photoreceptors |
| Ntrk1 | Thermo Fisher Scientific | Mm01219406_m1 | Horizontal |
| Pcp4 | Thermo Fisher Scientific | Mm00500973_m1 | Bipolar, Amacrine |
| Pou4f1 | Thermo Fisher Scientific | Mm02343791_m1 | Retinal Ganglion Cells |
| Prdx6 | Thermo Fisher Scientific | Mm00725435_s1 | Astrocytes |
| Prkca | Thermo Fisher Scientific | Mm00440858_m1 | Bipolar |
| Prox1 | Thermo Fisher Scientific | Mm00435969_m1 | Horizontal |
| Pvalb | Thermo Fisher Scientific | Mm00443100_m1 | Amacrine |
| Rbpms | Thermo Fisher Scientific | Mm02343791_m1 | Retinal Ganglion Cells |
| Rom1 | Thermo Fisher Scientific | Mm00436364_g1 | Photoreceptors |
| Rpe65 | Thermo Fisher Scientific | Mm00504133_m1 | Retinal Pigment Epithelial cells |
| Slc1a3 | Thermo Fisher Scientific | Mm00600697_m1 | Astrocytes |
| Slc6a9 | Thermo Fisher Scientific | Mm00433662_m1 | Amacrine |
| Sncg | Thermo Fisher Scientific | Mm00488345_m1 | Retinal Ganglion Cells |
| Tubb3 | Thermo Fisher Scientific | Mm00727586_s1 | Retinal Ganglion Cells |
| Vim | Thermo Fisher Scientific | Mm01333430_m1 | Müller cells |
| Taqman Universal Master Mix | Thermo Fisher Scientific | 4440047 | qPCR Reagent |
| miRNeasy Mini Kit | Qiagen | 217004 | RNA Isolation |
| SuperScript VILO cDNA Synthesis Kit | Thermo Fisher Scientific | 11754250 | cDNA synthesis |
| Taqman PreAmp Master Mix | Thermo Fisher Scientific | 4391128 | Pre-Amplification step |
| BD Cytofix/ Cytoperm | BD Biosciences | 554714 | Fixation/ Permeabilization Buffer |
| BD Perm/ Wash | BD Biosciences | 554723 | Permeabilization Solution |
| RBPMS | Santa Cruz Biotechnology | sc-86815 | intracellular antibody |
| SNCG | Gene Tex | GTX110483 | intracellular antibody |
| BRN3A | Santa Cruz Biotechnology | sc-8429 | intracellular antibody |
| TUJ1 | BioLegend | 801202 | intracellular antibody |
Referencias
- Flammer, J., Orgul, S. Optic nerve blood-flow abnormalities in glaucoma. Prog Retin Eye Res. 17 (2), 267-289 (1998).
- Bathija, R. Optic nerve blood flow in glaucoma. Clin Exp Optom. 83 (3), 180-184 (2000).
- Osborne, N. N., Melena, J., Chidlow, G., Wood, J. P. A hypothesis to explain ganglion cell death caused by vascular insults at the optic nerve head: possible implication for the treatment of glaucoma. Br J Ophthalmol. 85 (10), 1252-1259 (2001).
- Morgan, J. E. Circulation and axonal transport in the optic nerve. Eye (Lond). 18 (11), 1089-1095 (2004).
- Tian, N., Hwang, T. N., Copenhagen, D. R. Analysis of excitatory and inhibitory spontaneous synaptic activity in mouse retinal ganglion cells. J Neurophysiol. 80 (3), 1327-1340 (1998).
- Schmidt, K. G., Bergert, H., Funk, R. H. Neurodegenerative diseases of the retina and potential for protection and recovery. Curr Neuropharmacol. 6 (2), 164-178 (2008).
- Dreher, B., Sefton, A. J., Ni, S. Y., Nisbett, G. The morphology, number, distribution and central projections of Class I retinal ganglion cells in albino and hooded rats. Brain Behav Evol. 26 (1), 10-48 (1985).
- Williams, R. W., Strom, R. C., Rice, D. S., Goldowitz, D. Genetic and environmental control of variation in retinal ganglion cell number in mice. J Neurosci. 16 (22), 7193-7205 (1996).
- Jeon, C. J., Strettoi, E., Masland, R. H. The major cell populations of the mouse retina. J Neurosci. 18 (21), 8936-8946 (1998).
- Surgucheva, I., Weisman, A. D., Goldberg, J. L., Shnyra, A., Surguchov, A. Gamma-synuclein as a marker of retinal ganglion cells. Mol Vis. 14, 1540-1548 (2008).
- Nadal-Nicolas, F. M., et al. Brn3a as a marker of retinal ganglion cells: qualitative and quantitative time course studies in naive and optic nerve-injured retinas. Invest Ophthalmol Vis Sci. 50 (8), 3860-3868 (2009).
- Kwong, J. M., Caprioli, J., Piri, N. RNA binding protein with multiple splicing: a new marker for retinal ganglion cells. Invest Ophthalmol Vis Sci. 51 (2), 1052-1058 (2010).
- Van Bergen, N. J., et al. Recharacterization of the RGC-5 retinal ganglion cell line. Invest Ophthalmol Vis Sci. 50 (9), 4267-4272 (2009).
- Wood, J. P., Chidlow, G., Tran, T., Crowston, J. G., Casson, R. J. A comparison of differentiation protocols for RGC-5 cells. Invest Ophthalmol Vis Sci. 51 (7), 3774-3783 (2010).
- Barres, B. A., Silverstein, B. E., Corey, D. P., Chun, L. L. Immunological, morphological, and electrophysiological variation among retinal ganglion cells purified by panning. Neuron. 1 (9), 791-803 (1998).
- Hong, S., Iizuka, Y., Kim, C. Y., Seong, G. J. Isolation of primary mouse retinal ganglion cells using immunopanning-magnetic separation. Mol Vis. 18, 2922-2930 (2012).
- Julius, R. S. The sensitivity of exponentials and other curves to their parameters. Comput Biomed Res. 5 (5), 473-478 (1972).
- Reif, A. E., Allen, J. M. The Akr Thymic Antigen and Its Distribution in Leukemias and Nervous Tissues. J Exp Med. 120, 413-433 (1964).
- Watanabe, M., Noguchi, T., Tsukada, Y. Regional, cellular, and subcellular distribution of Thy-1 antigen in rat nervous tissues. Neurochem Res. 6 (5), 507-519 (1981).
- Haeryfar, S. M., Hoskin, D. W. Thy-1: more than a mouse pan-T cell marker. J Immunol. 173 (6), 3581-3588 (2004).
- Sahagun, G., Moore, S. A., Fabry, Z., Schelper, R. L., Hart, M. N. Purification of murine endothelial cell cultures by flow cytometry using fluorescein-labeled griffonia simplicifolia agglutinin. Am J Pathol. 134 (6), 1227-1232 (1989).
- Shoge, K., et al. Rat retinal ganglion cells culture enriched with the magnetic cell sorter. Neurosci Lett. 259 (2), 111-114 (1999).
- Chintalapudi, S. R., et al. Isolation and Molecular Profiling of Primary Mouse Retinal Ganglion Cells: Comparison of Phenotypes from Healthy and Glaucomatous Retinas. Front Aging Neurosci. 8, 93 (2016).
- Nagdeve, N. G., Yaddanapudi, S., Pandav, S. S. The effect of different doses of ketamine on intraocular pressure in anesthetized children. J Pediatr Ophthalmol Strabismus. 43 (4), 219-223 (2006).
- Ding, C., Wang, P., Tian, N. Effect of general anesthetics on IOP in elevated IOP mouse model. Exp Eye Res. 92 (6), 512-520 (2011).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative C(T) method. Nat Protoc. 3 (6), 1101-1108 (2008).
- Aerts, J., Nys, J., Arckens, L. A highly reproducible and straightforward method to perform in vivo ocular enucleation in the mouse after eye opening. J Vis Exp. (92), e51936 (2014).
- Li, X., et al. Loss of AP-2delta reduces retinal ganglion cell numbers and axonal projections to the superior colliculus. Mol Brain. 9 (1), 62 (2016).
- Moshiri, A., et al. Near complete loss of retinal ganglion cells in the math5/brn3b double knockout elicits severe reductions of other cell types during retinal development. Dev Biol. 316 (2), 214-227 (2008).
- Danias, J., et al. Quantitative analysis of retinal ganglion cell (RGC) loss in aging DBA/2NNia glaucomatous mice: comparison with RGC loss in aging C57/BL6 mice. Invest Ophthalmol Vis Sci. 44 (12), 5151-5162 (2003).
- Jakobs, T. C., Ben, Y., Masland, R. H. CD15 immunoreactive amacrine cells in the mouse retina. J Comp Neurol. 465 (3), 361-371 (2003).
- Uusitalo, M., Schlotzer-Schrehardt, U., Kivela, T. Ultrastructural localization of the HNK-1 carbohydrate epitope to glial and neuronal cells of the human retina. Invest Ophthalmol Vis Sci. 44 (3), 961-964 (2003).
- Jackson, C. J., Garbett, P. K., Nissen, B., Schrieber, L. Binding of human endothelium to Ulex europaeus I-coated Dynabeads: application to the isolation of microvascular endothelium. J Cell Sci. 96 ( Pt 2), 257-262 (1990).
- Pennartz, S., Perraut, M., Pfrieger, F. Purification of retinal ganglion cells from postnatal rats by magnetic cell sorting. MACSmore. 12 (2), 16-18 (2010).
- Nadal-Nicolas, F. M., et al. Displaced retinal ganglion cells in albino and pigmented rats. Front Neuroanat. 8, 99 (2014).
- Nadal-Nicolas, F. M., Salinas-Navarro, M., Vidal-Sanz, M., Agudo-Barriuso, M. Two methods to trace retinal ganglion cells with fluorogold: from the intact optic nerve or by stereotactic injection into the optic tract. Exp Eye Res. 131, 12-19 (2015).
- Barnstable, C. J., Drager, U. C. Thy-1 antigen: a ganglion cell specific marker in rodent retina. Neuroscience. 11 (4), 847-855 (1984).
- Chiu, K., Lau, W. M., Yeung, S. C., Chang, R. C., So, K. F. Retrograde labeling of retinal ganglion cells by application of fluoro-gold on the surface of superior colliculus. J Vis Exp. (16), (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados