Method Article
Floresan Probları Kullanan Kültürlü Nöronlarda Endozom ve Lizozom Hareketlerinin Nicelendirilmesi
Bu Makalede
Özet
Membran kaçakçılığının araştırılması, nöronal işlevleri anlamada çok önemlidir. Burada, nöronlarda vezikül hareketliliğini ölçmek için bir yöntem sunuyoruz. Bu, sinir sistemindeki zar ticaretinin miktarına uyarlanabilen uygun bir yöntemdir.
Özet
Beyinde, zar ticaret sistemi, nöronal morfoloji, sinaptik esneklik, hayatta kalma ve glial iletişim gibi nöronal fonksiyonların düzenlenmesinde önemli roller oynar. Bugüne kadar çok sayıda çalışma, bu sistemlerin kusurlarının çeşitli nöronal hastalıklara neden olduğunu bildirmiştir. Böylece vezikül dinamiklerinin altında yatan mekanizmaları anlamak, çeşitli nöronal bozuklukların tedavisinde yardımcı olabilecek etkili ipuçları sağlayabilir. Burada, hareket noktası mesafesi ve hareket hızı gibi vezikül hareketlerini ImageJ platformu için bir yazılım eklentisi kullanarak ölçmek için bir yöntem açıklıyoruz. Niceleme için görüntü elde etmek için, EGFP ile etiketlenmiş vezikül işaretleyici proteinleri olan nöronal endozom-lizozom yapılarını etiketledik ve veziküllerin bir zaman atlamalı mikroskobi ile hareketi gözlemledik. Bu yöntem son derece yararlıdır ve aksonlar ve dendritler gibi nöritlerin ve hem nöronların hem de glial hücrelerin soma'sındaki vezikül hareketliliğinin ölçülmesini basitleştirir. FurthermoYeniden, bu yöntem fibroblastlar ve endotel hücreleri gibi diğer hücre hatlarına da uygulanabilir. Bu yaklaşım, zar ticareti anlayışımızı değerli bir ilerleme sağlayabilir.
Giriş
Endozom-lizozom ticaretinin hassas kontrolü, nöronal fonksiyonu düzenlemek için vazgeçilmezdir. Özellikle, bu veziküllerin dinamik hareketi, nöronal morfolojinin, gelişimin ve hayatta kalmanın düzenlenmesinde temel faktördür. Bu sistemdeki kusurlar ciddi nöronal bozukluklara neden olur 1 , 2 . Vezikül ticaretini nöronal hastalıklarla ilişkilendiren moleküler mekanizmalar karmaşık kabul edilir ve birçok grup bu önemi incelemeye çalıştı. Örneğin, tedirgin geç endozom motilitesinin, lizozom defektlerinin yol açtığı kalıtsal bir nörodejeneratif bozukluk olan Niemann-Pick C hastalığı 3 ile önemli derecede ilişkili olduğu bildirilmiştir. Başka bir örnek, lizozomal Ca 2+ kanalındaki trpml 1'deki mutasyon olup, lizozomal hareketliliği bozarak lizozomal depolama hastalıkları 4 , 5 , 6 . Grubumuz PtdIns'in (3,5) P 2 devresinin düzenlenmesinin nöronlarda endozom ve lizozom motilitesini baskıladığını ve bunun da stres tepkisine karşı savunmasızlıktan 7 , 8 arttığını bildirmiştir. Çoğunlukla geç endozomlar ve lizozomlarda lokalize olan PtdIns (3,5) P2'nin metabolik düzenlenmesi, vezikül ticareti ve füzyon-fisyon işlemleri gibi çok çeşitli hücresel işlevlerde önemli bir rol oynamaktadır 9,10. Zayıflamış PtdIns (3,5) P 2 ciro şiddetli nörodejenerasyon 11,12'ye neden olduğu için, endozom-lizozom motilitesinin sapması regülasyonu, nörodejenerasyon patogenezini anlamak için önemli bir faktör olabilir. Vesikül hareketliliğinin altında yatan moleküler mekanizmaların araştırılması, bu nedenle, bizim vefizimizi derinleştiren umut verici ipuçları sağlayabilirBirkaç nöronal rahatsızlığın kavranması.
Bu yazıda, Manuel İzleme adlı özgür yazılım paketini kullanarak nöronlarda vezikül hareketliliğini ölçmek için değerli bir yöntem sunuyoruz. Amaç, vezikül hareketliliğini analiz etmek için hızlı bir kantifikasyon yöntemi geliştirmekti. Bu niceleme, zaman atlamalı filmin her karesinde bir referans noktasına tıklayarak standart bir yaklaşımla yönlendirilir. Manuel İzleme yazılımının kullanılması, bu yaklaşımı diğer uygulamalardan farklı olarak oldukça basit ve geniş yarar sağlar. Dahası, bu yaklaşım glial hücreler gibi diğer hücrelere de uygulanabilir. Bu yöntem ilkel olmasına rağmen, hücresel motilite ve morfolojik değişim de dahil olmak üzere çeşitli analizlere uygulanabilir. Örneğin, bir görüntü dizisi boyunca bir referans noktası tanımladıktan sonra, referans noktalarının konumları ve her bir konumdaki zamana ilişkin bilgiler, veri analizi ve görüntü işleme yumuşaklığı kullanılarak ardışık görüntülerden çıkarılabilirmaldır. Birlikte ele alındığında, bu yöntem basit ama güçlüdür ve endosome-lizozom fonksiyonunu inceleyenler gibi membran ticaretine dayalı çalışmaların geliştirilmiş etkinliğinin geliştirilmesine katkıda bulunur.
Protokol
Tüm hayvan işlemleri, Tsukuba Üniversitesi Hayvan Bakımı ve Kullanımı Komitesi (IACUC) onayı ile gerçekleştirildi.
1. Diseksiyon
- Embriyonik 13-14 ICR veya C57BL / 6 fetüslerini hazırlamak için servikal dislokasyonla hamile fareleri euthanize edin. Uterusu çıkarıp Hank'in Dengeli Tuz Çözeltisi (HBSS) ile bir petri tabağına koyun. Kanı temizlemek için iyice durulayın.
- Forseps kullanarak sterilize etmek için rahim% 70 etanol ile yeni bir petri kabına aktarın.
- Uterusu HBSS ile yeni bir petri kabına aktarın. Fetusları sterilize edilmiş diseksiyon forsepsleri ve cerrahi makas kullanarak uterusdan alın.
- Cerrahi makas kullanarak fötusları dekapetleyin. Bunları HBSS ile yeni bir petri kabına koyun.
- Deriyi ve kafatayı çıkarın ve sterilize edilmiş diseksiyon forsepsini kullanarak beyinlerini çıkarın. HBSS ile bir petri tablasına koyun.
NOT: Bu adımdan itibaren, işlemi temizlemek için en iyisidirBank. - Stero mikroskop altında sterilize edilmiş diseksiyon forseps kullanarak meninksleri çıkarın. Forseps kullanarak bazal gangliyon, hipokampus ve serebellumu kesin. Kıvrımlı uçlu forseps kullanarak, korteksleri HBSS ile yeni bir petri kabına aktarın.
- Tek kullanımlık bir damlalık veya 25 mL'lik bir pipet kullanarak tüm korteksleri toplayın. Onları 15 mL'lik bir tüp içine koyun ve daha sonra pipetle HBSS'yi çıkarın.
- Korteksleri içeren tüp üzerine 3 mL serebral kortikal enzim çözeltisi ekleyin. Bu tüp bir su banyosu içine koyun ve 37 ° C'de 5 dakika inkübe edin.
NOT:% 0.25 tripsin ve 1 mM EDTA ile Fosfat Tamponlu Tuz (PBS) içeren bir serebral kortikal kültür enzimi hazırlayın. 0.22 μm'lik bir filtreyle sterilize edin. - Korteks içeren tüp içine serebral kortikal enzim solüsyonu ilave 3 mL ekleyin ve ilave bir 5 dakika boyunca bir su banyosu 37 ° C'de inkübe edin.
- 5 mL'lik bir pipet kullanarak serebral kortikal enzim solüsyonunu çıkarın ve 5 mL Dulbe'yi ekleyin% 10 Fetal Sığır Serumu (FBS) içeren cco'nun Modifiye Kartal Ortamı (DMEM).
- Steril bir P1000 ucu olan 5 mL'lik bir pipet kullanarak hafifçe pipetleme yaparak korteklikleri çözün. P200 ucu olan 5 mL pipet kullanarak tekrar pipetleyin.
- 50 mL'lik bir tüp üzerine 40 μm'lik bir naylon hücre süzgeci koyun ve enkazı çıkarmak için süspansiyonu filtreleyin.
- Oda sıcaklığında 5 dakika boyunca 420 xg'de santrifüjleyin ve daha sonra DMEM ortamını çıkarın.
- Serebral kortikal kültür ortamı 5 mL ekleyin ve yavaşça hücre peletini tekrar süspansiyon haline getirin.
NOT: 1x B-27 takviyeleri, 2 mM L-glutamin ve 100 U / mL penisilin streptomis ile desteklenmiş nöron bazal ortamdan oluşan serebral bir kortikal kültür ortamı hazırlayın. - Hemocytometer kullanarak hücreleri sayın ve serebral kortikal kültür ortamı kullanarak hücre konsantrasyonunu (arzu edildiği gibi) ayarlayın.
- Tabak başına 3.0 x 10 6 cortical nöron, kaplanmış 35 mm cam tabaka kaplarında 2.0 mL'dir.
NOT: Kaplamadan önce,0.1 mg / mL Poli-D-Lizin hidrobromid (PDL) veya% 0.01 Poli-L-Ornitin (PLO) ile 35 mm.lik cam tabanlı tabaklar. 3 saat süreyle inkübe edin - O / N, 37 ° C'de ve PBS ile en az 3 kez yıkayın.
2. Görüntüleme Vesikül Hareketi
- Her vezikül türünü etiketleyecek plazmidleri hazırlayın. Örneğin, erken endozomlar için EGFP-Rab5, geç endozomlar için EGFP-Rab7, lizozomlar için LAMP-EGFP ve otofagozomlar 8 , 13 için EGFP-LC3 kullanın.
NOT: Bu plasmidler tsuruta.fuminori.fn@u.tsukuba.ac.jp adresinden talep edilebilir. Tipik olarak, 3 ila 5 gün in vitro (DIV) nöronlar bu plazmidlerle transfeksiyon reaktifleri kullanılarak transfekte edilebilir. - Pipetleme ile 4.0 μg plazmid 200 μL serum barındırmayan ortam ile karıştırılır. Ayrı bir tüpte, 200 μL serum serbest ortamda 8 μL transfeksiyon reaktifini (bkz . Malzeme Tablosu ) seyreltin . Oda sıcaklığında 5 dakika inkübe edin.
- Plazmid çözeltisini ve transfeksiyon rejent solüsyonunu pipetleme ile adım 2.2'de karıştırın. Oda sıcaklığında 20 dakika inkübe edin.
- Her kaplanmış cam alt tabağa saf olmayan ortam ve adım 2.3'ten 400 μL plazmid çözeltisi ilave edin. Nöronları 37 ° C'de 30 dakika boyunca% 5 CO2 inkübatörde inkübe edin. Ortamı 2 mL serebral kortikal kültür ortamı ile değiştirin. Nöronları 37 ° C'de% 5 CO2 inkübatöre 1-2 gün inkübe edin.
- 1 - 2 d transfeksiyondan sonra, transfekte edilen hücreleri görüntü alımı için seçin.
NOT: 7 DIV'den küçük erken sinir hücreleri, dinamik vezikül hareketliliğini gösterme eğilimindedir. Floresans probunu orta derecede ifade eden nöronları seçin, çünkü oldukça ifade eden bir nöron seçildiğinde net görüntüler elde edilemez. Ayrıca, akson ve dendritlerin tanımlanmasını kolaylaştırmak için uzun aksonları ve karmaşık dendritleri olan piramidal nöronlar gibi tipik bir nöronal şekli seçin (bakınız Şekil 1A). - Bir zaman atlamalı görüntüleme sistemi kullanarak görüntü elde etme:
Görüntüleme için, 40X Plan Apo 0.95NA veya 100X Plan Apo VC NA1.4 objektif mercekleri bulunan bir Charge-Coupled Device (CCD) kamera ile donatılmış bir fluoresans mikroskop kullanın. Bir inkübasyon sistemi kullanılarak sıcaklığı 37 ° C'de kontrol edin. Görüntü edinme yazılımı tarafından kontrol edilen 100 saniyelik bir periyot boyunca bir çerçeve / 5 sn'de nöron görüntüleri elde edin. Alternatif olarak, görüntüleri daha kısa aralıklarla ve 300 saniyelik bir süre boyunca 2 s'de bir karede olduğu gibi daha uzun zaman periyotlarında elde edebilirsiniz.
NOT: Ardışık resimler çekmek için çeşitli uygulamalar kullanılabilir, bunların çoğu bu yöntem için uygundur. Bu nedenle, özel bir uygulama önerilmemektedir; Bunun yerine, her araştırmacı mevcut olan her hangi bir uygulamayı kullanmalıdır.
3. Görüntü Analizi
- Manifest İzleme 14 ile ImageJ yazılımındaki ardışık görüntüleri açın.
NOT: Bugüne kadar, Manuel TakipDeneyleri 15 , 16 , 17 , 18 , 19'da kullanılan dely. Elle İzleme Dr. Fabrice Cordelières tarafından geliştirildi. Ayrıntılı yazılı talimatlar çevrimiçi 20'de mevcuttur. Analiz için görüntüleme verisinin kalitesi yeterli sayıda görüntü ile geliştirilir. 20'den fazla resim kullanmanız önerilir. - Sıralı resimleri birleştirmek için → → seçimini yapın. 'ı tıklayın.
- → seçimini yapın; Bir izleme penceresi açılacaktır.
- Onay kutusunu tıklayın ve parametreler bölümünde izleme parametrelerini tanımlayın.
NOT: Zaman aralığı, x / y kalibrasyonu, z kalibrasyonu, merkez için arama kare boyutu dahil olmak üzere birçok parametre ayarlanabilirIng, nokta boyutu, çizgi genişliği ve yazı tipi boyutu. Bu basitleştirilmiş analizde hem zaman aralığı hem de x / y kalibrasyonu tanımlandı. Diğer deneysel koşullar altında, diğer parametreleri de tanımlamak gerekebilir. Burada kullanılan parametreler aşağıdaki gibidir: 5 s'dir ve 40X Plan Apo 0.95NA objektif lensi için 0.26642 μm veya 100X Plan Apo VC NA1.4 için 0.10657 μm'dir objektif lens. - Parametreler tanımlandıktan sonra, yeni bir parça başlatmak için 'ye tıklayın.
- İlgili salyangozları belirledikten sonra ( örneğin, Şekil 1A'daki mavi ve kırmızı ok uçlarıyla gösterilen veziküller (sağ panel)), xy koordinatlarını kaydetmek için ardışık görüntülerdeki sinyallerin ortasına tıklayın. Kaydedilen XY koordinatlarının, mesafenin ve hızın sonuçları yeni bir pencerede gösterilir.
NOT: Lizozom durumunda, büyük parlak floresan sinyalleri ( ör. Fig.Ür 1A (sağ panel), turuncu ok başı) nöronlarda sıklıkla görülür. Bu sinyaller bazen ya biriken veziküller ya da patolojik varikoziteler sergilediğinden, motiliteyi nicelleştirmek için bu sinyallerden kaçınılmalıdır. - Tüm ardışık görüntülerden veziküllerin xy koordinatlarını toplamak için 3.6 adımını tekrarlayın; Her görüntü, referans noktası seçildikten sonra otomatik olarak ardışık görüntüye geçer.
- Bu verileri yeni bir tabloya ( örneğin, bir e-tablo) dışa aktarın. Uygun bir grafik oluşturmak için uygun bir yazılım kullanın (bkz . Malzeme Listesi ).
NOT: Verileri analiz etmek için sütununu seçin, bu sütunun tüm değerlerini özetleyin ve bir hareketlilik mesafesini çubuk grafik olarak gösterin (ör. Şekil 1B) . Ek olarak, bu adımı tekrarlayın, toplam hareketlilik mesafesinin ortalamasını hesaplayın ve Şekil 1C'deki gibi bir çubuk grafiği olarak gösterin. Çubuk grafik ve dalga formu verileri oluşturmak için yazılımMalzeme Tablosu.
Sonuçlar
Bu deney, in vitro kültürde vezikül dinamiklerini ölçmek için tasarlandı. Bu tahlil, nöronal morfoloji ve hayatta kalma ile ilişkili vezikül hareketliliğini saptamak için kullanılmıştır. Şekil 1A ve B, nöronlarda lizozom motilitesini gösteren temsili verileri göstermektedir. Kortikal nöronlar, lizozom işaretleyici LAMP-EGFP ile transfekte edildi ve standart bir fluoresans mikroskopu kullanılarak gözlendi. Daha önce, spesifik endozom-lizozom veziküllerin dinlenme nöronlarında bile oldukça hareketli olduğu bildirilmiştir ( 8) . Gerçekten de, bu sonuçlar, aynı dendrite ait hem dinlenme hem de hareketli kesecikleri göstermektedir ( Şekil 1A ve B ). Normal olarak, dinlenme veziküller, nöronal dendritlerde Brown hareketleri gibi titreşim hareketi gösterir. Aksine, hareketli veziküller düzensiz hareketlilik göstermektedir. Her bir vezikülün farklı olduğunu düşünüyoruzLizozom veziküllerde bile fonksiyonun belirlenmesinin altında yatan kompozisyon. 8 . Böylece, veziküllerin bu yaklaşımla sınıflandırılması faydalı bilgiler sağlayabilir. Bu sistemi kullanarak, bu veziküller ( Şekil 1C ) ortalama hareketliliğini ölçmek kolaydır ( Şekil 1C ) ve etkili bir şekilde bu sistemi kullanarak vezikül özelliklerini analiz etmek.
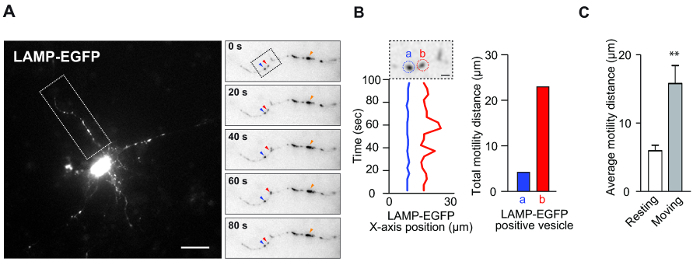
Şekil 1: Nöronal Dendritlerde Lizozom Hareketliliği. ( A ) Fare korteks nöronları (4 DIV) LAMP-EGFP plazmiti ile 2 gün boyunca transfekte edildi. Bu görüntü, dendritlerdeki LAMP-EGFP içeren veziküllerin hareketliliğini gösterir. Giriş, LAMP-EGFP pozitif veziküllerinin zaman atlamalı görüntüsünü gösterir. Kırmızı ok başında hareket eden bir vezikül, mavi ok başı dinlendirici bir vezikülü gösterir. Turuncu ok uçları, daha büyük flüoresan sinyallerine işaret ederYukarıya. Ölçek çubuğu = 20 μm. ( B ) Şekil A'daki LAMP-EGFP pozitif veziküllerinin zaman bağımlı x ekseni konumu. (B) etiketli kırmızı daire içindeki vezikül hareket ediyor ve (a) etiketli mavi daire içindeki vezikül dinleniyor. Ölçek çubuğu: 5 μm (solda). Çubuk grafik, LAMP-EGFP hareketinin toplam mesafesini (sağ) gösterir. ( C ) Çubuk grafik LAMP-EGFP içeren veziküllerin ortalama hareketlilik mesafesini göstermektedir. (N = 5, ortalama ± standart hata [SEM], ** p <0.01 Student's t- testi). Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
Tartışmalar
Bu protokol vezikül hareketliliğini ölçmek için prosedür tanıtır. Primer nöronlarda, endozomlar ve lizozomlar, genç nöronlarda yüksek motilite gösterme eğilimindedir (4-6 DIV). Sinirsel süreçleri uzatmak için nöronların öncü kısımlara bazı bileşenler vermesi gerektiği göz önüne alındığında, bu aşamada zar ticareti dinamik bir şekilde gerçekleşmelidir. Bu nedenle, genç nöronları nöronal dendritlerde dinamik motilite gözlemlemek için kullanmak önemlidir. Buna ek olarak, daha büyük veziküller, daha genç sinir hücrelerinde bile yüksek motilite gösterme eğiliminde değildirler. Vesikül boyutunun düzenlenmesi muhtemelen füzyon-fisyon adımlarının frekansı ile ilgilidir. Dinamik olarak hareket etmeyen spesifik veziküller, diğer vezikülleri kolayca kabul edebilir ve hareketlerini sona erdirebilir. Böylece, veziküllerin seçilmesi bu analiz için önemli bir işlemdir.
Nesneleri izlemek için birkaç ücretsiz eklenti yazılım paketi mevcuttur 21 . Örneğin, İzMate paketi nesneleri 22 izleyebilir ve bir dizi matematiksel bilgi sağlayarak sayısal yazılımla değiştirilebilir. Öte yandan, bu protokolde nispeten basit bir görüntü analizi için kullanımı biraz karmaşıktır. Mtrack2 başka bir eklentidir ve MultiTracker eklentisine 23 dayalıdır. Mtrack2, hedefleri belirleyebildiğinden ve takip eden karelerde hangi hedeflerin en yakın olduğunu belirleyebildiği için de yararlıdır. Bu yaklaşım, muazzam miktarda veriyi ölçmek için kullanışlıdır; Bununla birlikte, manuel izleme daha küçük hacimlerde görüntü verilerinde daha güvenilir olabilir. Bu nedenle, daha küçük veri kümelerini belirlemek için Manuel İzleme'yi öneriyoruz ve daha büyük hacimleri izlemek için diğer yazılımları kullanmanın daha iyi olabileceğini kabul ediyoruz.
Bu yaklaşımda çeşitli önlemler alınmalıdır. İlk olarak, sıkı veriler elde etmek için örnekleme oranı yüksek olmalıdır. Bunun nedeni, bazı veziküller hızlı hareket sergilemek veFüzyon fisyonu ve görünüm-kaybolma olayları gibi ani değişiklikler gözlemlenmekte ve sık görülen görüntülemenin herhangi bir değişikliğin işaretini kaçırmamak için çok önemli olduğunu göstermektedir. Bir başka nokta, tarama-diskli konfokal mikroskoplar ve toplam iç yansıma flüoresan mikroskopları gibi yüksek-sonlu mikroskopların kullanılması, yüksek çözünürlüklü, ilginç veriler elde etmek için anahtar olabileceğidir. Donanımsal sınırlamalardan ötürü her 5 saniyede görüntüler alınmasına rağmen, üst düzey bir mikroskop kullanılarak daha kısa aralıklarla görüntüler almanız önerilir.
Büyük araştırmalar zar travmatiği ve nöronal bozukluklar arasında biyolojik bir bağ olduğunu ileri sürmüştür 2 . Örneğin, lizozomal defektlerin, Niemann-Pick hastalığı ve Gaucher hastalığı 24 gibi ağır nöronal bozukluklarda yer aldığı gösterilmiştir. İlginç olarak, birçok çalışma, lizozomal hareketin ve lokalizasyonun,Lizozomal depolama bozukluğunun başlangıcı 6 . Vesikül hareketliliğinin bu bozuklukların bir biyolojik belirteçi olarak kullanılabilmesi mümkündür. İnsan kaynaklı Pluripotent Kök Hücrelerin (iPSC'lerin) varlığı ilginç bir yaklaşım ortaya çıkabilir. IPSC'lerden türetilmiş nöronlar kullanarak vezikül hareketliliğini araştırmak, lizozomal depolama bozuklukları için bir biyolojik belirteç ortaya koyabilir. Bu yaklaşım, hastalık riskinin altında yatan süreçlere bazı ipuçları sağlar.
Bu tahlil basit olduğu için hareketlilik verisi elde etmek kolaydır. Ayrıca, göç ve morfolojik değişiklikler de dahil olmak üzere diğer hücresel olayların analizi için de geçerlidir. Bu yaklaşımın basitliği nedeniyle çeşitli sınırlamaları olduğunu unutmamak önemlidir. Bu nedenle, nöronal trafik işleminin kesin fizyolojik önemini anlamak için elektrofizyoloji, biyokimya ve elektron mikroskop analizi gibi diğer yaklaşımları kullanmak gereklidir. Bununla birlikte, bu yaklaşım değerli bir yöntemdirBu, trafik işlemlerini doğrudan ve zaman etkili bir şekilde analiz etmek isteyen araştırmacılar için uygundur.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu analizin geliştirilmesine yardımcı olduğumuz Dr. Ricardo Dolmetsch'e (Stanford Üniversitesi Tıp Fakültesi, bugünkü üyelik: Novartis Biyomedikal Araştırmalar Enstitüsü) ve makalenin eleştirel okumalarından dolayı Dr. Matthew Wood, Takuma Aihara ve Dongsook Kim'e teşekkür ediyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Neurobasal medium | Thermo Fisher | 21103-049 | |
| Dulbecco's modified eagle medium | Wako | 044-29765 | |
| Opti-MEM | Thermo Fisher | 31985070 | Serum free medium |
| Hank's balanced salt solution | Thermo Fisher | 14170112 | |
| Penicilin Streptmycin | Thermo Fisher | 15140122 | |
| L-Glutamine | Thermo Fisher | 25030081 | |
| B-27 Supplements | Thermo Fisher | 17504044 | |
| 2.5% Trypsine | Thermo Fisher | 15090046 | |
| poly-D-lysine hydrobromide | Sigma | P7280 | |
| poly-L-ornithine | Sigma | P4957 | |
| Nylon cell strainer | Corning | 431750 | |
| Lipofectamine 2000 | Thermo Fisher | 11668027 | Transfection reagent |
| Polyethyleneimine "Max" | polysciences | 24765 | Transfection reagent. As an alternative to Lipofectamine2000, 0.1mg/ml Polyethyleneimine dissolved in sterilized water is available. But it is low efficiency and high toxicity. |
| BIOREVO BZ-9000 | Keyence | NA | |
| Incubation system INUG2-K13 | Tokay Hit | NA | |
| GraphPad Prism version 6.0 | GraphPad Software | NA | |
| Excel version 15 | Microsoft | NA | |
| ImageJ verion 1.47 | NA | NA |
Referanslar
- Nicot, A. S., Laporte, J. Endosomal phosphoinositides and human diseases. Traffic. 9 (8), 1240-1249 (2008).
- De Matteis, M. A., Luini, A. Mendelian disorders of membrane trafficking. N Engl J Med. 365 (10), 927-938 (2011).
- Lebrand, C. Late endosome motility depends on lipids via the small GTPase Rab7. EMBO J. 21 (6), 1289-1300 (2002).
- Chen, C. S., Bach, G., Pagano, R. E. Abnormal transport along the lysosomal pathway in mucolipidosis, type IV disease. Proc Natl Acad Sci U S A. 95 (11), 6373-6378 (1998).
- Venugopal, B. Neurologic, gastric, and opthalmologic pathologies in a murine model of mucolipidosis type IV. Am J Hum Genet. 81 (5), 1070-1083 (2007).
- Li, X. A molecular mechanism to regulate lysosome motility for lysosome positioning and tubulation. Nat Cell Biol. 18 (4), 404-417 (2016).
- Tsuruta, F., Green, E. M., Rousset, M., Dolmetsch, R. E. PIKfyve regulates CaV1.2 degradation and prevents excitotoxic cell death. J Cell Biol. 187 (2), 279-294 (2009).
- Tsuruta, F., Dolmetsch, R. E. PIKfyve mediates the motility of late endosomes and lysosomes in neuronal dendrites. Neurosci Lett. 605, 18-23 (2015).
- McCartney, A. J., Zhang, Y., Weisman, L. S. Phosphatidylinositol 3,5-bisphosphate: low abundance, high significance. Bioessays. 36 (1), 52-64 (2014).
- Shisheva, A., Sbrissa, D., Ikonomov, O. Plentiful PtdIns5P from scanty PtdIns(3,5)P2 or from ample PtdIns? PIKfyve-dependent models: Evidence and speculation (response to: DOI 10.1002/bies.201300012). Bioessays. 37 (3), 267-277 (2015).
- Chow, C. Y. Mutation of FIG4 causes neurodegeneration in the pale tremor mouse and patients with CMT4J. Nature. 448 (7149), 68-72 (2007).
- Zhang, Y. Loss of Vac14, a regulator of the signaling lipid phosphatidylinositol 3,5-bisphosphate, results in neurodegeneration in mice. Proc Natl Acad Sci U S A. 104 (44), 17518-17523 (2007).
- Mizushima, N., Yamamoto, A., Matsui, M., Yoshimori, T., Ohsumi, Y. In vivo analysis of autophagy in response to nutrient starvation using transgenic mice expressing a fluorescent autophagosome marker. Mol Biol Cell. 15 (3), 1101-1111 (2004).
- . Manual Tracking, a plug-in for ImageJ software [Internet] Available from: https://imagej.nih.gov/ij/plugins/track/track.html (2017)
- Hu, W. Exopolysaccharide-independent social motility of Myxococcus xanthus. PLoS One. 6 (1), e16102 (2011).
- Tan, Z. Characterization of four type IV pilin homologues in Stigmatella aurantiaca DSM17044 by heterologous expression in Myxococcus xanthus. PLoS One. 8 (9), e75105 (2013).
- Choi, S. A genetic variant of cortactin linked to acute lung injury impairs lamellipodia dynamics and endothelial wound healing. Am J Physiol Lung Cell Mol Physiol. 309 (9), L983-L994 (2015).
- Dahirel, M. Movement propensity and ability correlate with ecological specialization in European land snails: comparative analysis of a dispersal syndrome. J Anim Ecol. 84 (1), 228-238 (2015).
- Hu, W. Interplay between type IV pili activity and exopolysaccharides secretion controls motility patterns in single cells of Myxococcus xanthus. Sci Rep. 6, 17790 (2016).
- . Manual Tracking [Internet] Available from: https://imagej.nih.gov/ij/plugins/track/Manual (2017)
- . ImageJ Tracking plug-in [Internet] Available from: https://imagej.net/Category:Tracking (2017)
- Tinevez, J. Y. TrackMate: An open and extensible platform for single-particle tracking. Methods. , (2016).
- Ekvall, M. T. Three-dimensional tracking of small aquatic organisms using fluorescent nanoparticles. PLoS One. 8 (11), e78498 (2013).
- Jeyakumar, M., Dwek, R. A., Butters, T. D., Platt, F. M. Storage solutions: treating lysosomal disorders of the brain. Nat Rev Neurosci. 6 (9), 713-725 (2005).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır