Method Article
Quantification des molécules d'endosome et de lysosome dans les neurones cultivés utilisant des sondes fluorescentes
Dans cet article
Résumé
L'étude du trafic membranaire est cruciale pour comprendre les fonctions neuronales. Ici, nous introduisons un procédé pour quantifier la motilité des vésicules dans les neurones. C'est une méthode pratique qui peut être adaptée à la quantification du trafic membranaire dans le système nerveux.
Résumé
Dans le cerveau, les systèmes de trafic membranaire jouent un rôle important dans la régulation des fonctions neuronales, telles que la morphologie neuronale, la plasticité synaptique, la survie et les communications gliaires. À ce jour, de nombreuses études ont rapporté que les défauts dans ces systèmes provoquent diverses maladies neuronales. Ainsi, la compréhension des mécanismes sous-jacents à la dynamique des vésicules peut fournir des indices influents qui pourraient aider au traitement de plusieurs troubles neuronaux. Ici, nous décrivons une méthode pour quantifier les motilités de vésicules, telles que la distance de motilité et le taux de mouvement, en utilisant un plug-in logiciel pour la plate-forme ImageJ. Pour obtenir des images pour la quantification, nous avons identifié des structures d'endosome-lysosome neuronaux avec des protéines marqueurs de vésicules etiquées par EGFP et observé le mouvement des vésicules à l'aide d'un microscopie temporelle. Cette méthode est très utile et simplifie la mesure de la motilité des vésicules dans les neurites, comme les axones et les dendrites, ainsi que dans le soma des neurones et des cellules gliales. FurthermoRe, cette méthode peut être appliquée à d'autres lignées cellulaires, telles que les fibroblastes et les cellules endothéliales. Cette approche pourrait apporter un précieux progrès à notre compréhension du trafic de la membrane.
Introduction
Un contrôle précis du trafic d'endosome-lysosome est indispensable pour réguler la fonction neuronale. Notamment, les mouvements dynamiques de ces vésicules sont un facteur clé qui sous-tend la régulation de la morphologie, du développement et de la survie des neurones. Les défauts dans ce système provoquent des troubles neuronaux sévères 1 , 2 . Les mécanismes moléculaires qui relient le trafic de vésicules aux maladies neuronales sont considérés comme compliqués, et plusieurs groupes ont cherché à examiner cette pertinence. Par exemple, il a été signalé que la motilité perturbée de l'endosome tardif est significativement associée à la maladie de Niemann-Pick C 3 , un trouble neurodégénératif héréditaire causé par des défauts de lysosome. Un autre exemple est une mutation dans un canal lysosomal Ca 2+ , trpml 1, qui altère la motilité lysosomale, entraînant des maladies de stockage lysosomique 4 , 5 , 6 . Notre groupe a signalé que la dysrégulation du renouvellement de PtdIns (3,5) P 2 supprime la motilité de l'endosome et du lysosome dans les neurones, entraînant une augmentation de la vulnérabilité à la réponse au stress 7 , 8 . La régulation métabolique de PtdIns (3,5) P 2 , qui se localise principalement sur les endosomes tardifs et les lysosomes, joue un rôle important dans une grande variété de fonctions cellulaires, y compris le trafic de vésicules et les processus de fusion-fission 9 , 10 . Étant donné que le renversement de PtdIns (3,5), le renouvellement de P 2 provoque une neurodégénérescence grave 11 , 12 , la régulation aberrante de la motilité de l'endosome-lysosome pourrait être un facteur clé pour comprendre la pathogenèse de la neurodégénérescence. Une enquête sur les mécanismes moléculaires qui sous-tendent la motilité des vésicules peut donc fournir des indices prometteurs qui peuvent approfondir notre volontéRépétation de plusieurs troubles neuronaux.
Dans cet article, nous introduisons une méthode précieuse pour quantifier la motilité des vésicules dans les neurones à l'aide d'un logiciel gratuit appelé Manuel Tracking. L'objectif était de développer une méthode de quantification rapide pour analyser la motilité des vésicules. Cette quantification est dirigée par une approche standard de cliquer sur un point de référence dans chaque image d'un film temporel. L'utilisation du logiciel de suivi manuel rend cette approche assez simple et d'une large utilité, contrairement à d'autres applications. En outre, cette approche s'applique également aux autres cellules, telles que les cellules gliales. Bien que cette méthode soit primitive, elle peut être appliquée à diverses analyses, y compris la motilité cellulaire et les changements morphologiques. Par exemple, après avoir défini un point de référence sur une séquence d'images, les informations sur les positions des points de référence et l'heure à chaque position peuvent être extraites à partir d'images séquentielles en utilisant l'analyse de données et le traitement d'image douxWare. Ensemble, cette méthode est simple mais puissante et contribue au développement d'une efficacité améliorée dans les études basées sur le trafic membranaire, telles que celles qui examinent la fonction endosome-lysosome.
Protocole
Toutes les procédures animales ont été effectuées avec l'approbation du Comité d'aide et de protection des animaux de l'Université de Tsukuba (IACUC).
1. Dissection
- Pour préparer les jours embryonnaires 13-14 ICR ou C57BL / 6, éuthanaser les souris enceintes par dislocation cervicale. Retirez l'utérus et placez-le dans une boîte de Petri avec Hank's Balanced Salt Solution (HBSS). Rincez-le bien pour enlever le sang.
- En utilisant une pince, transférez l'utérus dans une nouvelle boîte de Petri avec 70% d'éthanol pour la stériliser.
- Transférer l'utérus dans une nouvelle boîte de Petri avec HBSS. Enlevez les fœtus de l'utérus en utilisant des pinces de dissection stérilisées et des ciseaux chirurgicaux.
- Décapiter les fœtus à l'aide de ciseaux chirurgicaux. Placez-les dans une nouvelle boîte de Petri avec HBSS.
- Retirez la peau et le crâne et retirez le cerveau en utilisant des pinces de dissection stérilisées. Mettez-les dans une boîte de Petri avec HBSS.
REMARQUE: à partir de cette étape, il est préférable de procéder à la procédure sur un nettoyagebanc. - Enlevez les méninges à l'aide d'une pince à dissection stérilisée sous un microscope stéréo. Couper les ganglions de la base, l'hippocampe et le cervelet à l'aide d'une pince. À l'aide de pinces à pointe courbe, transférez les cortices à une nouvelle boîte de Petri avec HBSS.
- Recueillir tous les cortises à l'aide d'un compte-gouttes jetable ou d'une pipette de 25 ml. Mettez-les dans un tube de 15 ml, puis retirez le HBSS en pipettant.
- Ajouter 3 ml de solution d'enzyme corticale cérébrale dans le tube contenant les cortices. Mettre ce tube dans un bain d'eau et incuber à 37 ° C pendant 5 min.
REMARQUE: Préparez une enzyme de culture corticale cérébrale constituée de solution salée tamponnée au phosphate (PBS) avec 0,25% de trypsine et 1 mM d'EDTA. Stériliser avec un filtre de 0,22 μm. - Ajouter 3 mL supplémentaire de solution d'enzyme corticale cérébrale dans le tube contenant les corticaux et incuber à 37 ° C dans un bain d'eau pendant 5 minutes supplémentaires.
- Retirer la solution d'enzyme corticale cérébrale en utilisant une pipette de 5 mL et ajouter 5 mL de DulbeLe milieu Eagle Eagle modifié par le cco (DMEM) contenant 10% de sérum bovin fœtal (FBS).
- Dissocier les cortices en pipetant doucement vers le haut et vers le bas en utilisant une pipette de 5 mL avec une pointe stérile P1000. Pipeter à nouveau en utilisant une pipette de 5 mL avec une pointe P200.
- Mettez un filtre de cellule de nylon de 40 μm sur un tube de 50 mL et filtrez la suspension pour enlever les débris.
- Centrifuger à 420 xg pendant 5 min à la température ambiante, puis retirer le milieu DMEM.
- Ajouter 5 ml de milieu de culture corticale cérébrale et resuspendre doucement le culot cellulaire.
REMARQUE: Préparez un milieu de culture corticale cérébrale consistant en un milieu basal de neurones complété par 1x compléments B-27, 2 mM L-glutamine et 100 U / mL de pénicilline streptomycine. - Compter les cellules en utilisant un hémocytomètre et ajuster la concentration cellulaire (comme on le souhaite) en utilisant le milieu de culture corticale cérébrale.
- Plaque 3,0 × 10 6 neurones corticaux dans 2,0 mL par plats en verre de 35 mm revêtus.
REMARQUE: Avant le placage, revêtir lePlats à fond de verre de 35 mm avec 0,1 mg / ml de bromhydrate de poly-D-Lysine (PDL) ou 0,01% de poly-L-ornithine (OLP). Incuber pendant 3 h - O / N à 37 ° C et laver avec du PBS au moins 3x.
2. Impression de la motilité de la vésicule
- Préparez les plasmides qui étiqueteront chaque type de vésicule. Par exemple, utilisez EGFP-Rab5 pour les endosomes précoces, EGFP-Rab7 pour les endosomes tardifs, LAMP-EGFP pour les lysosomes et EGFP-LC3 pour les autophagosomes 8 , 13 .
REMARQUE: Ces plasmides sont disponibles sur demande à partir de tsuruta.fuminori.fn@u.tsukuba.ac.jp. Typiquement, 3 à 5 jours de neurones in vitro (DIV) peuvent être transfectés avec ces plasmides en utilisant des réactifs de transfection. - Mélanger 4,0 μg de plasmides avec 200 μL de milieu sans sérum par pipettage. Dans un tube séparé, diluer 8 μL de réactif de transfection (voir Tableau de matériaux ) dans 200 μL de milieu sans sérum. Incuber pendant 5 min à la RT.
- Mélanger la solution de plasmide et la solution de régénération de transfection à l'étape 2.2 par pipettage. Incuber pendant 20 min à la RT.
- Ajouter un milieu sans sérum et 400 μl de la solution de plasmide de l'étape 2.3 à chaque plat de fond de verre revêtu. Incuber les neurones à 37 ° C dans un incubateur à 5% de CO 2 pendant 30 minutes. Remplacer le milieu par 2 ml de milieu de culture corticale cérébrale. Incuber les neurones à 37 ° C dans un incubateur à 5% de CO 2 pendant 1 à 2 jours.
- Après 1 à 2 jours de transfection, sélectionnez les cellules transfectées pour l'acquisition d'image.
NOTE: Les neurones prématurés de moins de 7 DIV ont tendance à présenter une motilité dynamique des vésicules. Sélectionnez les neurones qui expriment de façon modérée la sonde de fluorescence car des images claires ne peuvent être obtenues lorsqu'un neurone hautement exprimant est sélectionné. De plus, sélectionnez une forme neuronale typique, comme les neurones pyramidaux, qui ont des axones longs et des dendrites complexes, pour faciliter l'identification de l'axone et des dendrites (voir la figure 1A). - Acquisition d'image à l'aide d'un système d'imagerie temporel:
Pour l'imagerie, utilisez un microscope à fluorescence équipé d'une caméra de type Charge-Coupled (CCD) avec des objectifs 40X Plan Apo 0.95NA ou 100X Plan Apo VC NA1.4. Contrôler la température à 37 ° C à l'aide d'un système d'incubation. Acquérir des images neuronales à un cadre / 5 s sur une période de 100 s contrôlée par le logiciel d'acquisition d'image. Sinon, procurez-vous des images à des intervalles plus courts et pour des périodes de temps plus longues, par exemple sur une image par 2 s sur une période de 300 s.
REMARQUE: une variété d'applications sont disponibles pour prendre des images séquentielles, dont beaucoup seraient adaptées à cette méthode. Par conséquent, aucune application particulière n'est recommandée; Plutôt, chaque chercheur devrait utiliser n'importe quelle application disponible.
3. Analyse d'image
- Ouvrez toutes les images séquentielles dans le logiciel ImageJ avec Manual Tracking 14 .
REMARQUE: à ce jour, le suivi manuel a été wiUtilisé dans les expériences de suivi 15 , 16 , 17 , 18 , 19 . Le suivi manuel a été développé par le Dr Fabrice Cordelières. Des instructions écrites détaillées sont disponibles en ligne 20 . Pour l'analyse, la qualité des données d'imagerie est améliorée avec un nombre suffisant d'images. Il est recommandé d'utiliser plus de 20 images. - Pour combiner les images séquentielles, choisissez
→ → . Cliquez sur .
- Choisissez → ; Une fenêtre de suivi apparaîtra.
- Cliquez sur la case à cocher de Et définissez les paramètres de suivi dans la section des paramètres.
REMARQUE: Plusieurs paramètres peuvent être définis, y compris l'intervalle de temps, l'étalonnage x / y, l'étalonnage z, la taille carrée de recherche pour le centreLa taille des points, la largeur de la ligne et la taille de la police. Dans ce test simplifié, l'intervalle de temps et l'étalonnage x / y ont été définis. Dans d'autres circonstances expérimentales, il peut être nécessaire de définir d'autres paramètres. Les paramètres utilisés ici sont les suivants: est de 5 s, et l'étalonnage est soit 0,26642 μm pour un objectif d'objectif Plan Apo 0.95NA 40X ou 0,10657 μm pour un plan 100X Apo VC NA1.4 objectif. - Une fois les paramètres définis, cliquez sur pour lancer une nouvelle piste.
- Après avoir déterminé les vésicules d'intérêt ( p. Ex., Les vésicules indiquées par les pointes de flèche bleues et rouges de la figure 1A (panneau de droite), cliquez sur le centre des signaux dans les images séquentielles pour enregistrer les coordonnées xy. Les résultats des coordonnées xy enregistrées, de la distance et de la vitesse s'affichent dans une nouvelle fenêtre.
NOTE: Dans le cas des lysosomes, de grands signaux fluorescents lumineux ( p. Ex., Fig.Ure 1A (panneau de droite), pointe de flèche orange) sont souvent observés dans les neurones. Comme ces signaux présentent parfois des vésicules accumulées ou des varices pathologiques, ces signaux doivent être évités pour quantifier la motilité. - Répétez l'étape 3.6 pour collecter les coordonnées xy des vésicules de toutes les images séquentielles; Chaque image avance automatiquement à l'image successive après la sélection du point de référence.
- Exportez ces données dans une nouvelle table ( par exemple, une feuille de calcul). Utilisez un logiciel approprié pour créer un graphique approprié (voir la table des matières ).
REMARQUE: pour analyser les données, sélectionnez la colonne , résumez toutes les valeurs de cette colonne et indiquez une distance de motilité en tant que graphique à barres, comme dans la Figure 1B . De plus, répétez cette étape, calculez la moyenne de la distance de motilité totale et affichez-la comme graphique à barres, comme dans la figure 1C . Le logiciel pour créer un graphique à barres et des données de forme d'onde est affiché dansLa table des matières.
Résultats
Ce test a été conçu pour mesurer la dynamique des vésicules dans la culture in vitro . Ce dosage a été utilisé pour déterminer la motilité des vésicules associée à la morphologie neuronale et à la survie. Les figures 1A et B montrent des données représentatives montrant la motilité du lysosome dans les neurones. Les neurones corticaux ont été transfectés avec le marqueur de lysosome, LAMP-EGFP, et ont été observés en utilisant un microscope à fluorescence standard. Il a déjà été rapporté que les vésicules spécifiques de l'endosome-lysosome sont très mobiles, même dans les neurones de repos 8 . En effet, ces résultats démontrent des vésicules de repos et de déplacement dans le même dendrite ( Figure 1A et B ). Normalement, les vésicules de repos présentent un mouvement vibratoire, comme le mouvement brownien, dans les dendrites neuronales. En revanche, les vésicules en mouvement présentent une motilité irrégulière. Nous supposons que chaque vésicule a un différentCaractéristique compositionnelle qui sous-tend la détermination de la fonction, même dans les vésicules de lysosome 8 . Ainsi, la classification des vésicules à l'aide de cette approche peut fournir des informations utiles. En utilisant ce système, il est facile de quantifier la motilité moyenne de ces vésicules ( Figure 1C ) et d'analyser les propriétés des vésicules à l'aide de ce système de manière efficace dans le temps.
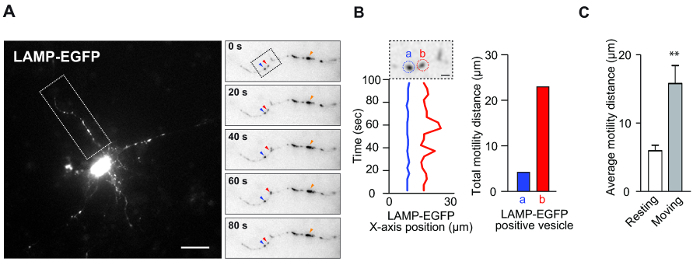
Figure 1: Motilité des lysosomes dans les dendrites neuronales. ( A ) Les neurones corticaux de la souris (4 DIV) ont été transfectés avec du plasmide LAMP-EGFP pendant 2 jours. Cette image montre la motilité des vésicules contenant des LAMP-EGFP dans les dendrites. L'encart montre l'image temporelle des vésicules LAMP-EGFP positives. La pointe de flèche rouge indique une vésicule en mouvement, et la pointe de flèche bleue indique une vésicule de repos. Les pointes de flèches orange indiquent des signaux fluorescents plus importants, tels que mentionnésci-dessus. Barre d'échelle = 20 μm. ( B ) La position de l'axe X dépend du temps des vésicules LAMP-EGFP positives de la Figure A. La vésicule dans le cercle rouge marqué (b) se déplace et la vésicule dans le cercle bleu marqué (a) repose. Barre d'échelle: 5 μm (gauche). Le graphique à barres indique la distance totale du mouvement LAMP-EGFP (à droite). ( C ) Le graphique à barres indique la distance moyenne de motilité des vésicules contenant LAMP-EGFP. (N = 5, moyenne ± erreur standard de la moyenne [SEM], ** p <0,01 par t- test de Student ). Cliquez ici pour voir une version plus grande de ce chiffre.
Discussion
Ce protocole introduit la procédure de quantification de la motilité des vésicules. Dans les neurones primaires, les endosomes et les lysosomes ont tendance à présenter une motilité élevée chez les neurones plus jeunes (4-6 DIV). Étant donné que les neurones doivent fournir certains composants aux bords d'attaque pour allonger les processus neuronaux, le trafic membranaire devrait se produire dynamiquement pendant cette étape. Ainsi, il est important d'utiliser des neurones plus jeunes pour observer la motilité dynamique dans les dendrites neuronales. En outre, les vésicules plus grandes ne présentent pas une motilité élevée, même chez les jeunes neurones. La régulation de la taille de la vésicule est probablement impliquée dans la fréquence des étapes de fusion-fission. Il se peut que des vésicules spécifiques qui ne se déplacent pas dynamiquement acceptent facilement d'autres vésicules facilement et mettent fin à leurs mouvements. Ainsi, la sélection des vésicules est un processus important pour cette analyse.
Plusieurs logiciels de plug-in gratuits sont disponibles pour les objets de suivi 21 . Par exemple, la pisteLe paquet Mate peut suivre les objets 22 et peut être modifié par un logiciel numérique, fournissant une gamme d'informations mathématiques. D'autre part, il est légèrement compliqué d'utiliser pour l'analyse d'image relativement simple dans ce protocole. Mtrack2 est un autre plug-in et est basé sur le plug-in MultiTracker 23 . Mtrack2 est également utile car il permet d'identifier les cibles, puis de déterminer quelles cibles dans les cadres suivants sont les plus proches. Cette approche est utile pour quantifier d'énormes volumes de données; Cependant, le suivi manuel peut être plus fiable pour de plus petits volumes de données d'image. Par conséquent, nous recommandons le suivi manuel pour quantifier les petits ensembles de données et reconnaître qu'il serait préférable d'utiliser d'autres logiciels pour surveiller de plus grands volumes.
Plusieurs mesures de précaution devraient être prises dans cette approche. Tout d'abord, le taux d'échantillonnage devrait être élevé afin d'obtenir des données strictes. C'est parce que certaines vésicules présentent un mouvement rapide etDes changements abrupts, tels que la fusion-fission, et les événements apparence-disparition sont parfois observés, ce qui indique que l'imagerie fréquente est cruciale pour éviter de manquer le signe de tout changement. Un autre point est que l'utilisation de microscopes haut de gamme, tels que les microscopes confocaux à disque et les microscopes de fluorescence à réflexion totale, peuvent être essentiels pour obtenir des données intéressantes et à haute résolution. Il est recommandé de prendre des images à des intervalles plus courts à l'aide d'un microscope haut de gamme, mais ici, les images ont été prises toutes les 5 s en raison des limitations de l'équipement.
Des études importantes ont suggéré un lien biologique entre le trafic membranaire et les troubles neuronaux 2 . Par exemple, il a été démontré que des défauts lysosomaux sont impliqués dans des troubles neuronaux sévères, tels que la maladie de Niemann-Pick et la maladie de Gaucher 24 . Curieusement, plusieurs études ont révélé que le mouvement et la localisation lysosomales sont impliqués dans laDébut du trouble de stockage lysosomal 6 . Il est possible que la motilité des vésicules puisse être utilisée comme biomarqueur pour ces troubles. Une approche intéressante peut résulter de la disponibilité de cellules souches pluripotentes induites par l'homme (iPSC). L'étude de la motilité des vésicules à l'aide de neurones dérivés d'iPSC peut révéler un biomarqueur pour les troubles de stockage lysosomaux. Cette approche fournit des indices sur les processus qui sous-tendent le risque de maladie.
Comme ce test est simple, il est facile d'obtenir des données sur la motilité. En outre, il est applicable à l'analyse d'autres événements cellulaires, y compris les migrations et les changements morphologiques. Il est important de noter que cette approche présente plusieurs limites en raison de sa simplicité. En tant que tel, il est nécessaire d'utiliser d'autres approches, y compris l'électrophysiologie, la biochimie et l'analyse par microscope électronique, pour comprendre la pertinence physiologique précise du trafic neuronal. Néanmoins, cette approche est un métier précieuxD qui convient aux chercheurs qui veulent analyser le trafic de façon simple et efficace dans le temps.
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Nous remercions le Dr Ricardo Dolmetsch (Faculté de médecine de l'Université de Stanford, affiliation actuelle: Novartis Institutes for Biomedical Research) pour aider à développer cette analyse et le Dr Matthew Wood, Takuma Aihara et Dongsook Kim pour leur lecture critique du manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| Neurobasal medium | Thermo Fisher | 21103-049 | |
| Dulbecco's modified eagle medium | Wako | 044-29765 | |
| Opti-MEM | Thermo Fisher | 31985070 | Serum free medium |
| Hank's balanced salt solution | Thermo Fisher | 14170112 | |
| Penicilin Streptmycin | Thermo Fisher | 15140122 | |
| L-Glutamine | Thermo Fisher | 25030081 | |
| B-27 Supplements | Thermo Fisher | 17504044 | |
| 2.5% Trypsine | Thermo Fisher | 15090046 | |
| poly-D-lysine hydrobromide | Sigma | P7280 | |
| poly-L-ornithine | Sigma | P4957 | |
| Nylon cell strainer | Corning | 431750 | |
| Lipofectamine 2000 | Thermo Fisher | 11668027 | Transfection reagent |
| Polyethyleneimine "Max" | polysciences | 24765 | Transfection reagent. As an alternative to Lipofectamine2000, 0.1mg/ml Polyethyleneimine dissolved in sterilized water is available. But it is low efficiency and high toxicity. |
| BIOREVO BZ-9000 | Keyence | NA | |
| Incubation system INUG2-K13 | Tokay Hit | NA | |
| GraphPad Prism version 6.0 | GraphPad Software | NA | |
| Excel version 15 | Microsoft | NA | |
| ImageJ verion 1.47 | NA | NA |
Références
- Nicot, A. S., Laporte, J. Endosomal phosphoinositides and human diseases. Traffic. 9 (8), 1240-1249 (2008).
- De Matteis, M. A., Luini, A. Mendelian disorders of membrane trafficking. N Engl J Med. 365 (10), 927-938 (2011).
- Lebrand, C. Late endosome motility depends on lipids via the small GTPase Rab7. EMBO J. 21 (6), 1289-1300 (2002).
- Chen, C. S., Bach, G., Pagano, R. E. Abnormal transport along the lysosomal pathway in mucolipidosis, type IV disease. Proc Natl Acad Sci U S A. 95 (11), 6373-6378 (1998).
- Venugopal, B. Neurologic, gastric, and opthalmologic pathologies in a murine model of mucolipidosis type IV. Am J Hum Genet. 81 (5), 1070-1083 (2007).
- Li, X. A molecular mechanism to regulate lysosome motility for lysosome positioning and tubulation. Nat Cell Biol. 18 (4), 404-417 (2016).
- Tsuruta, F., Green, E. M., Rousset, M., Dolmetsch, R. E. PIKfyve regulates CaV1.2 degradation and prevents excitotoxic cell death. J Cell Biol. 187 (2), 279-294 (2009).
- Tsuruta, F., Dolmetsch, R. E. PIKfyve mediates the motility of late endosomes and lysosomes in neuronal dendrites. Neurosci Lett. 605, 18-23 (2015).
- McCartney, A. J., Zhang, Y., Weisman, L. S. Phosphatidylinositol 3,5-bisphosphate: low abundance, high significance. Bioessays. 36 (1), 52-64 (2014).
- Shisheva, A., Sbrissa, D., Ikonomov, O. Plentiful PtdIns5P from scanty PtdIns(3,5)P2 or from ample PtdIns? PIKfyve-dependent models: Evidence and speculation (response to: DOI 10.1002/bies.201300012). Bioessays. 37 (3), 267-277 (2015).
- Chow, C. Y. Mutation of FIG4 causes neurodegeneration in the pale tremor mouse and patients with CMT4J. Nature. 448 (7149), 68-72 (2007).
- Zhang, Y. Loss of Vac14, a regulator of the signaling lipid phosphatidylinositol 3,5-bisphosphate, results in neurodegeneration in mice. Proc Natl Acad Sci U S A. 104 (44), 17518-17523 (2007).
- Mizushima, N., Yamamoto, A., Matsui, M., Yoshimori, T., Ohsumi, Y. In vivo analysis of autophagy in response to nutrient starvation using transgenic mice expressing a fluorescent autophagosome marker. Mol Biol Cell. 15 (3), 1101-1111 (2004).
- . Manual Tracking, a plug-in for ImageJ software [Internet] Available from: https://imagej.nih.gov/ij/plugins/track/track.html (2017)
- Hu, W. Exopolysaccharide-independent social motility of Myxococcus xanthus. PLoS One. 6 (1), e16102 (2011).
- Tan, Z. Characterization of four type IV pilin homologues in Stigmatella aurantiaca DSM17044 by heterologous expression in Myxococcus xanthus. PLoS One. 8 (9), e75105 (2013).
- Choi, S. A genetic variant of cortactin linked to acute lung injury impairs lamellipodia dynamics and endothelial wound healing. Am J Physiol Lung Cell Mol Physiol. 309 (9), L983-L994 (2015).
- Dahirel, M. Movement propensity and ability correlate with ecological specialization in European land snails: comparative analysis of a dispersal syndrome. J Anim Ecol. 84 (1), 228-238 (2015).
- Hu, W. Interplay between type IV pili activity and exopolysaccharides secretion controls motility patterns in single cells of Myxococcus xanthus. Sci Rep. 6, 17790 (2016).
- . Manual Tracking [Internet] Available from: https://imagej.nih.gov/ij/plugins/track/Manual (2017)
- . ImageJ Tracking plug-in [Internet] Available from: https://imagej.net/Category:Tracking (2017)
- Tinevez, J. Y. TrackMate: An open and extensible platform for single-particle tracking. Methods. , (2016).
- Ekvall, M. T. Three-dimensional tracking of small aquatic organisms using fluorescent nanoparticles. PLoS One. 8 (11), e78498 (2013).
- Jeyakumar, M., Dwek, R. A., Butters, T. D., Platt, F. M. Storage solutions: treating lysosomal disorders of the brain. Nat Rev Neurosci. 6 (9), 713-725 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon