Method Article
Количественная оценка подвижности эндосомы и лизосом в культивируемых нейронах с помощью флуоресцентных зондов
В этой статье
Резюме
Исследование переноса мембран имеет решающее значение для понимания функций нейронов. Здесь мы вводим метод количественного определения везикулярной подвижности в нейронах. Это удобный метод, который может быть адаптирован к количественной оценке переноса мембраны в нервной системе.
Аннотация
В мозге системы переноса мембран играют важную роль в регулировании нейронных функций, таких как морфология нейронов, синаптичная пластичность, выживаемость и глиальные коммуникации. На сегодняшний день в многочисленных исследованиях сообщается, что дефекты в этих системах вызывают различные нейрональные заболевания. Таким образом, понимание механизмов, лежащих в основе динамики везикулы, может дать важные указания, которые могли бы помочь в лечении нескольких нейрональных нарушений. Здесь мы описываем метод количественной оценки везикулярных подвижностей, таких как дистанция подвижности и скорость движения, используя программный плагин для платформы ImageJ. Чтобы получить изображения для количественной оценки, мы пометили нейронные структуры эндосомно-лизосомы с EGFP-меченными везикулярными маркерными белками и наблюдали движение везикул с помощью микроскопии с интервалом времени. Этот метод очень полезен и упрощает измерение подвижности везикул в нейритах, таких как аксоны и дендриты, а также в соме как нейронов, так и глиальных клеток. FurthermoRe, этот метод может быть применен к другим клеточным линиям, таким как фибробласты и эндотелиальные клетки. Такой подход мог бы стать ценным прогрессом в нашем понимании переноса мембран.
Введение
Точный контроль за оборотом эндосомных лизосом необходим для регуляции функции нейронов. Примечательно, что динамические движения этих везикул являются ключевым фактором, регулирующим морфологию, развитие и выживаемость нейронов. Дефекты в этой системе вызывают тяжелые нейрональные нарушения 1 , 2 . Молекулярные механизмы, связывающие перенос везикул с заболеваниями нейронов, считаются сложными, и несколько групп пытались изучить эту актуальность. Например, сообщалось, что нарушенная подвижность концевых эндосом значительно связана с болезнью Ниманна-Пика С 3 , наследственным нейродегенеративным расстройством, вызванным дефектами лизосомы. Другим примером является мутация в лизосомальном канале Ca 2+ , trpml 1, который нарушает лизосомальную подвижность, приводя к лизосомальным заболеваниям 4 , 5 , 6 . Наша группа сообщила, что дисрегуляция оборота PtdIns (3,5) P 2 подавляет эндосому и подвижность лизосом в нейронах, что приводит к увеличению уязвимости к стрессовому ответу 7,8 . Метаболическая регуляция PtdIns (3,5) P 2 , которая главным образом локализуется на поздних эндосомах и лизосомах, играет важную роль в широком спектре клеточных функций, включая торможение пузырьков и процессы деления слиянием-делением 9 , 10 . Так как нарушение PtdIns (3,5) P 2 вызывает тяжелую нейродегенерацию 11 , 12 , аберрантная регуляция подвижности эндосом-лизосом может быть ключевым фактором для понимания патогенеза нейродегенерации. Исследование молекулярных механизмов, лежащих в основе везикулярной подвижности, может, таким образом, давать многообещающие подсказки, которые могут углубить наше undeВыявление нескольких нейрональных нарушений.
В этой статье мы представляем ценный метод для количественной оценки везикулярной подвижности в нейронах с использованием пакета бесплатного программного обеспечения под названием «Ручное отслеживание». Целью было разработать метод быстрого количественного анализа подвижности везикул. Эта количественная оценка направлена с использованием стандартного подхода при нажатии на опорную точку в каждом кадре видеоролика с замедленным воспроизведением. Использование программного обеспечения для ручного отслеживания делает этот подход довольно простым и имеет широкую функциональность, в отличие от других приложений. Кроме того, этот подход также применим к другим клеткам, таким как глиальные клетки. Хотя этот метод примитивен, его можно применять для различных анализов, в том числе в отношении подвижности клеток и морфологических изменений. Например, после определения опорной точки по последовательности изображений информация о положениях опорных точек и времени в каждой позиции может быть извлечена из последовательных изображений, используя анализ данных и мягкую обработку изображенийпосуда. В совокупности этот метод прост, но эффективен и способствует повышению эффективности исследований, основанных на переносе мембран, таких как исследование функции эндосомы-лизосомы.
протокол
Все процедуры на животных были проведены с согласия Комитета по уходу и использованию животных Университета Цукуба (IACUC).
1. Препарирование
- Чтобы подготовить эмбриональный день 13-14 ICR или C57BL / 6 эмбрионы, усыпить беременных мышей путем вывиха шейки матки. Удалите матку и положите ее в чашку Петри с сбалансированным солевым раствором Хенкса (HBSS). Хорошо промыть, чтобы удалить кровь.
- Используя щипцы, перенесите матку в новую чашку Петри с 70% этанолом для стерилизации.
- Перенесите матку на новую чашку Петри с HBSS. Удалите плоды из матки с помощью стерилизованных рассекающих щипцов и хирургических ножниц.
- Обезглавить плоды с помощью хирургических ножниц. Поместите их в новую чашку Петри с HBSS.
- Удалите кожу и череп и вытащите мозги с помощью стерилизованных рассекающих щипцов. Поместите их в чашку Петри с HBSS.
ПРИМЕЧАНИЕ. Начиная с этого шага, лучше всего провести процедуру на чистомскамейка. - Удалите мозговые оболочки с помощью стерилизованных рассекающих щипцов под стерео микроскопом. С помощью щипцов отрезают базальные ганглии, гиппокамп и мозжечок. Используя щипцы с изогнутыми наконечниками, перенесите коры на новую чашку Петри с HBSS.
- Соберите все кортики, используя одноразовые пипетки или 25 мл пипетки. Поместите их в 15 мл пробирку, а затем удалите HBSS с помощью пипетки.
- Добавьте 3 мл раствора кортикального фермента церебрального в трубку, содержащую кору. Поместите эту пробирку в водяную баню и инкубируйте при 37 ° С в течение 5 мин.
ПРИМЕЧАНИЕ. Подготовьте церебральный кортикальный фермент культуры, состоящий из фосфатно-буферного соляного раствора (PBS) с 0,25% трипсина и 1 мМ ЭДТА. Стерилизуют с помощью фильтра 0,22 мкм. - Добавьте еще 3 мл раствора коры головного мозга в пробирку с корой и инкубируйте при 37 ° С на водяной бане еще 5 минут.
- Удалите раствор ферментного раствора коры головного мозга с помощью 5 мл пипетки и добавьте 5 мл ДульбеCoded's Modified Eagle Medium (DMEM), содержащая 10% фетальную бычью сыворотку (FBS).
- Диссоциируйте кору, осторожно пипетируя вверх и вниз, используя пипетку объемом 5 мл со стерильным кончиком P1000. Снова пипетируйте с помощью пипетки объемом 5 мл с наконечником P200.
- Нанесите сито с нейлоновой ячейкой 40 мкм на пробирку объемом 50 мл и отфильтруйте суспензию для удаления мусора.
- Центрифугируют при 420 xg в течение 5 мин при комнатной температуре и затем удаляют среду DMEM.
- Добавьте 5 мл культуральной среды коры головного мозга и осторожно ресуспендируйте клеточный осадок.
ПРИМЕЧАНИЕ. Подготовьте культуральную среду для головного мозга, состоящую из основной среды нейронов, дополненной 1x добавками B-27, 2 мМ L-глутамином и 100 ед / мл стрептомицином пенициллина. - Подсчитайте клетки, используя гемоцитометр, и отрегулируйте концентрацию клеток (по желанию), используя культуральную среду головного мозга.
- Планшетах 3,0 × 10 6 кортикальных нейронов в 2,0 мл на стеклянные чашки с покрытием 35 мм.
ПРИМЕЧАНИЕ. Перед нанесением покрытия нанесите слой35 мм стеклянные чашки с 0,1 мг / мл гидробромида поли-D-лизина (PDL) или 0,01% поли-L-орнитина (PLO). Инкубировать в течение 3 ч - O / N при 37 ° C и промыть PBS не менее 3 раз.
2. Переносимость подвижных изображений
- Подготовьте плазмиды, которые будут маркировать каждый тип везикулы. Например, для ранних эндосом используют EGFP-Rab5 для ранних эндосом, EGFP-Rab7 для поздних эндосом, LAMP-EGFP для лизосом и EGFP-LC3 для аутофагосом 8,13.
ПРИМЕЧАНИЕ. Эти плазмиды доступны по запросу tsuruta.fuminori.fn@u.tsukuba.ac.jp. Обычно 3-5 дней in vitro (DIV) нейронов могут быть трансфецированы этими плазмидами с использованием трансфекционных реагентов. - Смешайте 4,0 мкг плазмид с 200 мкл бессывороточной среды с помощью пипетирования. В отдельной пробирке разбавьте 8 мкл трансфекционного реагента (см. Таблицу материалов ) в 200 мкл бессывороточной среды. Инкубируйте в течение 5 мин при комнатной температуре.
- Смешайте раствор плазмиды и раствор трансгенного регента на этапе 2.2 с помощью пипетки. Инкубируйте в течение 20 мин при комнатной температуре.
- Добавьте бессывороточную среду и 400 мкл раствора плазмиды со стадии 2.3 к каждой чашке со стеклянным дном. Инкубируйте нейроны при 37 ° С в инкубаторе с 5% СО 2 в течение 30 мин. Замените среду 2 мл церебральной кортикальной питательной среды. Инкубируйте нейроны при 37 ° C в инкубаторе с 5% CO 2 в течение 1-2 дней.
- После 1 - 2 г трансфекции выберите трансфецированные клетки для получения изображения.
ПРИМЕЧАНИЕ: Преждевременные нейроны менее 7 DIV имеют тенденцию проявлять подвижность подвижных везикул. Выберите нейроны, которые умеренно экспрессируют зонд флуоресценции, потому что четкие изображения не могут быть получены, когда выбран высоковыражающийся нейрон. Кроме того, выберите типичную нейронную форму, такую как пирамидальные нейроны, которые имеют длинные аксоны и сложные дендриты, для облегчения идентификации аксона и дендритов (см . Рис. 1A). - Получение изображения с использованием системы замедленной съемки:
Для получения изображения используйте флуоресцентный микроскоп, оборудованный камерой с зарядовым соединением (CCD) с объективом 40X Plan Apo 0.95NA или 100X Plan Apo VC NA1.4. Контролировать температуру при 37 ° C с помощью инкубационной системы. Приобретайте изображения нейронов в одном кадре / 5 с в течение 100 с, контролируемых программным обеспечением для получения изображений. В качестве альтернативы, можно получать изображения с более короткими интервалами и в течение более длительных периодов времени, например, в одном кадре за 2 с в течение 300-секундного периода.
ПРИМЕЧАНИЕ. Для получения последовательных изображений доступно множество приложений, многие из которых подходят для этого метода. Поэтому не рекомендуется использовать какое-либо конкретное приложение; Скорее, каждый исследователь должен использовать любое приложение.
3. Анализ изображений
- Откройте все последовательные изображения в программном обеспечении ImageJ с помощью функции Manual Tracking 14 .
ПРИМЕЧАНИЕ. На сегодняшний день ручное отслеживание было выполнено с использованием wiDely, используемых в экспериментах по отслеживанию 15 , 16 , 17 , 18 , 19 . Ручное отслеживание было разработано доктором Фабрисом Корделиером. Подробные письменные инструкции доступны онлайн 20 . Для анализа качество данных изображения улучшается с достаточным количеством изображений. Рекомендуется использовать более 20 изображений. - Чтобы объединить последовательные изображения, выберите <Изображение> → <Стеки> → <Изображения для стека>. Нажмите <ОК>.
- Выберите <Плагины> → <Ручное отслеживание>; Появится окно отслеживания.
- Установите флажок <Показать параметры?> И определите параметры отслеживания в разделе параметров.
ПРИМЕЧАНИЕ. Можно задать несколько параметров, включая временной интервал, калибровку x / y, калибровку z, размер квадрата поиска для центра, Размер точки, ширина строки и размер шрифта. В этом упрощенном анализе были определены как временной интервал, так и калибровка х / у. В других экспериментальных условиях может потребоваться определить и другие параметры. Используются следующие параметры: <Временной интервал> - 5 с, а калибровка - 0.26642 мкм для объектива 40X Plan Apo 0.95NA или 0.10657 мкм для 100X Plan Apo VC NA1.4 объектив. - После того, как параметры определены, нажмите <Добавить трек>, чтобы начать новый трек.
- После определения представляющих интерес везикул ( например, пузырьки, обозначенные синими и красными стрелками на рис. 1А (правая панель)), щелкните по центру сигналов в последовательных изображениях, чтобы записать координаты xy. Результаты записанных координат xy, расстояния и скорости отображаются в новом окне.
ПРИМЕЧАНИЕ. В случае лизосом большие яркие флуоресцентные сигналы ( например, рис.Ure 1A (правая панель), оранжевая стрелка) часто наблюдаются в нейронах. Поскольку эти сигналы иногда проявляют либо накопленные везикулы, либо патологические варикозности, эти сигналы следует избегать для количественной оценки моторики. - Повторите шаг 3.6, чтобы собрать координаты xy везикул со всех последовательных изображений; Каждое изображение автоматически переходит к следующему изображению после выбора опорной точки.
- Экспортируйте эти данные в новую таблицу ( например, электронную таблицу). Используйте соответствующее программное обеспечение для создания подходящего графика (см. Таблицу материалов ).
ПРИМЕЧАНИЕ. Чтобы проанализировать данные, выберите столбец <Расстояние>, суммируйте все значения этого столбца и покажите расстояние подвижности в виде гистограммы, как на рисунке 1B . Кроме того, повторите этот шаг, вычислите среднее значение общего расстояния подвижности и покажите как гистограмму, как на рисунке 1C . Программное обеспечение для создания гистограммы и данных осциллограмм показано вТаблица материалов.
Результаты
Этот анализ был разработан для измерения динамики везикулы в культуре in vitro . Этот анализ был использован для определения подвижности везикул, связанной с морфологией и выживаемостью нейронов. На фигурах 1А и В показаны репрезентативные данные, показывающие подвижность лизосом в нейронах. Корковые нейроны трансфицировали маркером лизосом LAMP-EGFP и наблюдали с использованием стандартного флуоресцентного микроскопа. Ранее сообщалось, что конкретные эндосомы-лизосомные везикулы очень подвижны, даже в покоящихся нейронах 8 . Действительно, эти результаты демонстрируют как покоящиеся, так и движущиеся везикулы в одном дендрите ( рис. 1А и В ). Обычно в покоящихся везикулах проявляются вибрационные движения, такие как броуновское движение, в нервных дендритах. Наоборот, движущиеся везикулы проявляют нерегулярную подвижность. Мы предполагаем, что каждая везикула имеет различнуюКомпозиционный признак, лежащий в основе определения функции, даже в лизосомных везикулах 8 . Таким образом, классификация везикул с использованием этого подхода может предоставить полезную информацию. Используя эту систему, легко количественно определить среднюю подвижность этих пузырьков ( рис. 1С ) и проанализировать свойства пузырьков с использованием этой системы эффективным по времени образом.
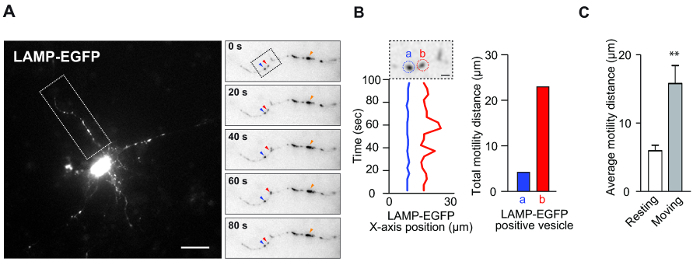
Рисунок 1: подвижность лизосом в нейронных дендритах. ( A ) Корковые нейроны мыши (4 DIV) трансфицировали плазмидой LAMP-EGFP в течение 2 дней. Это изображение показывает подвижность везикул, содержащих LAMP-EGFP, в дендритах. На вставке показано временное изображение LAMP-EGFP-положительных везикул. Красная стрелка указывает на движущуюся везикулу, а синяя стрелка указывает на покоящийся пузырек. Оранжевые стрелки указывают большие флуоресцентные сигналы, как указаноВыше. Шкала шкалы = 20 мкм. ( B ) Зависимое от времени положение оси X позитивных везикул LAMP-EGFP на рисунке A. Везикула в красном круге, помеченном (b), движется, и везикула в синем круге, помеченном (a), отдыхает. Шкала: 5 мкм (слева). Гистограмма показывает общее расстояние движения LAMP-EGFP (справа). ( C ) Гистограмма показывает среднее расстояние подвижности LAMP-EGFP-содержащих везикул. (N = 5, средняя ± стандартная ошибка среднего значения [SEM], ** p <0,01 по t- критерию Стьюдента). Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Этот протокол вводит процедуру количественного определения везикулярной подвижности. В первичных нейронах эндосомы и лизосомы имеют тенденцию демонстрировать высокую подвижность в более молодых нейронах (4-6 DIV). Учитывая, что нейроны должны доставлять некоторые компоненты к передним краям для удлинения нервных процессов, перенос мембран должен происходить динамически на этой стадии. Таким образом, важно использовать более молодые нейроны для наблюдения динамической подвижности в нейронных дендритах. Кроме того, большие везикулы не проявляют высокой подвижности даже у более молодых нейронов. Регулирование размера везикулы, вероятно, связано с частотой ступеней слияния-деления. Возможно, что определенные везикулы, которые не движутся динамически, легко легко принимают другие везикулы и прекращают их движение. Таким образом, отбор везикул является важным процессом для этого анализа.
Для отслеживания объектов доступно несколько бесплатных программных пакетов. 21 . Например, трекПакет Mate может отслеживать объекты 22 и может быть модифицирован с помощью численного программного обеспечения, предоставляя диапазон математической информации. С другой стороны, его немного сложно использовать для относительно простого анализа изображений в этом протоколе. Mtrack2 является другим подключаемым модулем и основан на подключаемом модуле MultiTracker 23 . Mtrack2 также полезен, потому что он может идентифицировать цели и затем определять, какие цели в следующих кадрах являются самыми близкими. Этот подход полезен для количественной оценки огромных объемов данных; Однако ручное отслеживание может быть более надежным для меньших объемов данных изображения. Поэтому мы рекомендуем ручное отслеживание для количественной оценки меньших наборов данных и признаем, что может быть лучше использовать другое программное обеспечение для мониторинга больших объемов.
В этом подходе следует соблюдать несколько предосторожностей. Во-первых, частота дискретизации должна быть высокой для получения строгих данных. Это объясняется тем, что некоторые везикулы демонстрируют быстрое движение иИногда наблюдаются резкие изменения, такие как деление слияния и явления исчезновения, указывающие на то, что частое получение изображений имеет решающее значение, чтобы избежать пропустить знак каких-либо изменений. Другое дело, что использование высококачественных микроскопов, таких как сканирующие дисковые конфокальные микроскопы и флуоресцентные микроскопы с полным внутренним отражением, может стать ключом к получению высокоразрешающих интересных данных. Рекомендуется делать снимки через короткие промежутки времени с помощью высококачественного микроскопа, хотя здесь изображения снимались каждые 5 секунд из-за ограничений оборудования.
Существенные исследования предложили биологическую связь между переносом мембран и нейрональными нарушениями 2 . Например, было показано, что лизосомальные дефекты участвуют в тяжелых нарушениях нейронов, таких как болезнь Ниманна-Пика и болезнь Гоше 24 . Интересно, что в нескольких исследованиях сообщалось, что лизосомальное движение и локализация участвуют вНачало расстройства лизосомного хранения 6 . Возможно, что везикулярная подвижность может быть использована в качестве биомаркера для этих расстройств. Один интересный подход может возникнуть из-за наличия индуцированных человеком плюрипотентных стволовых клеток (iPSCs). Исследование подвижности везикул с использованием нейронов, полученных из iPSCs, может выявить биомаркер лизосомных нарушений памяти. Этот подход дает некоторые ключи к процессам, которые лежат в основе риска заболевания.
Поскольку этот анализ прост, легко получить данные о подвижности. Кроме того, он применим к анализу других клеточных событий, включая миграцию и морфологические изменения. Важно отметить, что этот подход имеет несколько ограничений из-за его простоты. Таким образом, необходимо использовать другие подходы, включая электрофизиологию, биохимию и электронный микроскопический анализ, чтобы понять точную физиологическую значимость нейронной торговли. Тем не менее, этот подход является ценным методомD, который подходит для исследователей, которые хотят анализировать торговлю людьми в прямом и эффективном времени.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим доктора Рикардо Долметша (Школа медицины Стэнфордского университета, нынешняя организация: Институты Новартис для биомедицинских исследований) за помощь в разработке этого анализа, а также доктора Мэтью Вуда, Такума Айхара и Донгсука Кима за их критическое чтение рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| Neurobasal medium | Thermo Fisher | 21103-049 | |
| Dulbecco's modified eagle medium | Wako | 044-29765 | |
| Opti-MEM | Thermo Fisher | 31985070 | Serum free medium |
| Hank's balanced salt solution | Thermo Fisher | 14170112 | |
| Penicilin Streptmycin | Thermo Fisher | 15140122 | |
| L-Glutamine | Thermo Fisher | 25030081 | |
| B-27 Supplements | Thermo Fisher | 17504044 | |
| 2.5% Trypsine | Thermo Fisher | 15090046 | |
| poly-D-lysine hydrobromide | Sigma | P7280 | |
| poly-L-ornithine | Sigma | P4957 | |
| Nylon cell strainer | Corning | 431750 | |
| Lipofectamine 2000 | Thermo Fisher | 11668027 | Transfection reagent |
| Polyethyleneimine "Max" | polysciences | 24765 | Transfection reagent. As an alternative to Lipofectamine2000, 0.1mg/ml Polyethyleneimine dissolved in sterilized water is available. But it is low efficiency and high toxicity. |
| BIOREVO BZ-9000 | Keyence | NA | |
| Incubation system INUG2-K13 | Tokay Hit | NA | |
| GraphPad Prism version 6.0 | GraphPad Software | NA | |
| Excel version 15 | Microsoft | NA | |
| ImageJ verion 1.47 | NA | NA |
Ссылки
- Nicot, A. S., Laporte, J. Endosomal phosphoinositides and human diseases. Traffic. 9 (8), 1240-1249 (2008).
- De Matteis, M. A., Luini, A. Mendelian disorders of membrane trafficking. N Engl J Med. 365 (10), 927-938 (2011).
- Lebrand, C. Late endosome motility depends on lipids via the small GTPase Rab7. EMBO J. 21 (6), 1289-1300 (2002).
- Chen, C. S., Bach, G., Pagano, R. E. Abnormal transport along the lysosomal pathway in mucolipidosis, type IV disease. Proc Natl Acad Sci U S A. 95 (11), 6373-6378 (1998).
- Venugopal, B. Neurologic, gastric, and opthalmologic pathologies in a murine model of mucolipidosis type IV. Am J Hum Genet. 81 (5), 1070-1083 (2007).
- Li, X. A molecular mechanism to regulate lysosome motility for lysosome positioning and tubulation. Nat Cell Biol. 18 (4), 404-417 (2016).
- Tsuruta, F., Green, E. M., Rousset, M., Dolmetsch, R. E. PIKfyve regulates CaV1.2 degradation and prevents excitotoxic cell death. J Cell Biol. 187 (2), 279-294 (2009).
- Tsuruta, F., Dolmetsch, R. E. PIKfyve mediates the motility of late endosomes and lysosomes in neuronal dendrites. Neurosci Lett. 605, 18-23 (2015).
- McCartney, A. J., Zhang, Y., Weisman, L. S. Phosphatidylinositol 3,5-bisphosphate: low abundance, high significance. Bioessays. 36 (1), 52-64 (2014).
- Shisheva, A., Sbrissa, D., Ikonomov, O. Plentiful PtdIns5P from scanty PtdIns(3,5)P2 or from ample PtdIns? PIKfyve-dependent models: Evidence and speculation (response to: DOI 10.1002/bies.201300012). Bioessays. 37 (3), 267-277 (2015).
- Chow, C. Y. Mutation of FIG4 causes neurodegeneration in the pale tremor mouse and patients with CMT4J. Nature. 448 (7149), 68-72 (2007).
- Zhang, Y. Loss of Vac14, a regulator of the signaling lipid phosphatidylinositol 3,5-bisphosphate, results in neurodegeneration in mice. Proc Natl Acad Sci U S A. 104 (44), 17518-17523 (2007).
- Mizushima, N., Yamamoto, A., Matsui, M., Yoshimori, T., Ohsumi, Y. In vivo analysis of autophagy in response to nutrient starvation using transgenic mice expressing a fluorescent autophagosome marker. Mol Biol Cell. 15 (3), 1101-1111 (2004).
- . Manual Tracking, a plug-in for ImageJ software [Internet] Available from: https://imagej.nih.gov/ij/plugins/track/track.html (2017)
- Hu, W. Exopolysaccharide-independent social motility of Myxococcus xanthus. PLoS One. 6 (1), e16102 (2011).
- Tan, Z. Characterization of four type IV pilin homologues in Stigmatella aurantiaca DSM17044 by heterologous expression in Myxococcus xanthus. PLoS One. 8 (9), e75105 (2013).
- Choi, S. A genetic variant of cortactin linked to acute lung injury impairs lamellipodia dynamics and endothelial wound healing. Am J Physiol Lung Cell Mol Physiol. 309 (9), L983-L994 (2015).
- Dahirel, M. Movement propensity and ability correlate with ecological specialization in European land snails: comparative analysis of a dispersal syndrome. J Anim Ecol. 84 (1), 228-238 (2015).
- Hu, W. Interplay between type IV pili activity and exopolysaccharides secretion controls motility patterns in single cells of Myxococcus xanthus. Sci Rep. 6, 17790 (2016).
- . Manual Tracking [Internet] Available from: https://imagej.nih.gov/ij/plugins/track/Manual (2017)
- . ImageJ Tracking plug-in [Internet] Available from: https://imagej.net/Category:Tracking (2017)
- Tinevez, J. Y. TrackMate: An open and extensible platform for single-particle tracking. Methods. , (2016).
- Ekvall, M. T. Three-dimensional tracking of small aquatic organisms using fluorescent nanoparticles. PLoS One. 8 (11), e78498 (2013).
- Jeyakumar, M., Dwek, R. A., Butters, T. D., Platt, F. M. Storage solutions: treating lysosomal disorders of the brain. Nat Rev Neurosci. 6 (9), 713-725 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены