Method Article
Cuantificación de endosomas y de las motilidades de los lisosomas en neuronas cultivadas utilizando sondas fluorescentes
En este artículo
Resumen
La investigación del tráfico de membranas es crucial para entender las funciones neuronales. Aquí, se introduce un método para la cuantificación de la motilidad vesicular en las neuronas. Este es un método conveniente que puede adaptarse a la cuantificación del tráfico de membranas en el sistema nervioso.
Resumen
En el cerebro, los sistemas de tráfico de membrana desempeñan un papel importante en la regulación de las funciones neuronales, como la morfología neuronal, la plasticidad sináptica, la supervivencia y las comunicaciones gliales. Hasta la fecha, numerosos estudios han informado de que los defectos en estos sistemas causan diversas enfermedades neuronales. Por lo tanto, la comprensión de los mecanismos subyacentes dinámica de las vesículas puede proporcionar influyentes pistas que podrían ayudar en el tratamiento de varios trastornos neuronales. Aquí, describimos un método para cuantificar las motilidades vesicales, tales como la distancia de motilidad y la velocidad de movimiento, utilizando un plug-in de software para la plataforma ImageJ. Para obtener imágenes para la cuantificación, que etiquetados neuronal endosoma-lisosoma estructuras con EGFP marcado vesícula marcador proteínas y observó el movimiento de vesículas utilizando un lapso de tiempo microscopía. Este método es muy útil y simplifica la medición de la motilidad vesicular en las neuritas, tales como axones y dendritas, así como en el soma de ambas neuronas y células gliales. Más alláRe, este método puede aplicarse a otras líneas celulares, tales como fibroblastos y células endoteliales. Este enfoque podría proporcionar un valioso avance en nuestra comprensión del tráfico de membranas.
Introducción
El control preciso del tráfico de endosomas y lisosomas es indispensable para regular la función neuronal. En particular, los movimientos dinámicos de estas vesículas son un factor clave que subyace a la regulación de la morfología neuronal, el desarrollo y la supervivencia. Los defectos en este sistema causan trastornos neuronales graves 1 , 2 . Los mecanismos moleculares que vinculan el tráfico de vesículas a las enfermedades neuronales se consideran complicados, y varios grupos han tratado de examinar esta relevancia. Por ejemplo, se ha informado de que la motilidad endosómica tardía perturbada está significativamente asociada con la enfermedad de Niemann-Pick C 3 , un trastorno neurodegenerativo hereditario causado por defectos de lisosomas. Otro ejemplo es una mutación en un canal de Ca 2+ lisosomal , trpml 1, que altera la motilidad lisosomal, dando como resultado enfermedades de almacenamiento lisosomal 4 , 5 , 6 . Nuestro grupo ha informado de que la desregulación de PtdIns (3,5) P 2 volumen de negocios suprime endosoma y lisosoma motilidad en las neuronas, lo que conduce a un aumento de la vulnerabilidad a la respuesta al estrés 7 , 8 . La regulación metabólica de PtdIns (3,5) P 2 , que en su mayoría se localiza en endosomas tardíos y lisosomas, juega un papel importante en una amplia variedad de funciones celulares, incluyendo el tráfico de vesículas y los procesos de fusión-fisión 9,10. Dado que el deterioro de PtdIns (3,5) P 2 volumen de negocios causa neurodegeneración grave 11 , 12 , la regulación aberrante de la motilidad endosoma-lisosoma podría ser un factor clave para la comprensión de la patogénesis de la neurodegeneración. Una investigación de los mecanismos moleculares que subyacen a la motilidad vesicular puede proporcionar pistas prometedoras que pueden profundizar nuestroDe varios trastornos neuronales.
En este artículo, introducimos un valioso método para cuantificar la motilidad de las vesículas en las neuronas utilizando un paquete de software gratuito llamado Manual Tracking. El objetivo fue desarrollar un método de cuantificación rápida para analizar la motilidad vesicular. Esta cuantificación se dirige a través de un enfoque estándar de hacer clic en un punto de referencia en cada fotograma de una película de tiempo transcurrido. El uso del software de seguimiento manual hace este enfoque bastante simple y de amplia utilidad, a diferencia de otras aplicaciones. Además, este enfoque es también aplicable a otras células, como las células gliales. Aunque este método es primitivo, puede aplicarse a diversos análisis, incluyendo la motilidad celular y el cambio morfológico. Por ejemplo, después de definir un punto de referencia a través de una secuencia de imágenes, la información sobre las posiciones de los puntos de referencia y el tiempo en cada posición se pueden extraer de imágenes secuenciales utilizando análisis de datos y procesamiento de imagen suavemercancía. En conjunto, este método es simple pero potente y contribuye al desarrollo de una mayor eficiencia en los estudios basados en el tráfico de membranas, como los que examinan la función del endosoma-lisosoma.
Protocolo
Todos los procedimientos con animales se realizaron con la aprobación del Comité de Uso y Cuidado de Animales de la Universidad de Tsukuba (IACUC).
1. Disección
- Para preparar fetos embrionarios del día 13-14 ICR o C57BL / 6, eutanasia ratones embarazadas por dislocación cervical. Retire el útero y póngalo en una placa de Petri con la solución de sal equilibrada de Hank (HBSS). Enjuague bien para eliminar la sangre.
- Usando fórceps, transfiera el útero a una nueva placa de Petri con etanol al 70% para esterilizar.
- Transferir el útero a una nueva placa de Petri con HBSS. Retire los fetos del útero usando pinzas de disección esterilizadas y tijeras quirúrgicas.
- Decapitar los fetos con tijeras quirúrgicas. Colóquelas en una nueva placa de Petri con HBSS.
- Quitar la piel y el cráneo y sacar los cerebros con fórceps de disección esterilizada. Póngalos en una placa de Petri con HBSS.
NOTA: A partir de este paso, es mejor llevar a cabo el procedimiento en unbanco. - Retire las meninges con pinzas de disección esterilizadas bajo un microscopio estéreo. Corte los ganglios basales, el hipocampo y el cerebelo usando fórceps. Usando pinzas de punta curvada, transfiera las cortezas a una nueva placa de Petri con HBSS.
- Recoger todas las cortezas usando un gotero desechable o una pipeta de 25 ml. Póngalos en un tubo de 15 mL y luego retire el HBSS pipeteando.
- Añadir 3 mL de solución de enzima cortical cerebral al tubo que contiene los cortices. Colocar este tubo en un baño de agua e incubar a 37 ° C durante 5 min.
NOTA: Prepare una enzima de cultivo cortical cerebral que consista en solución salina tamponada con fosfato (PBS) con tripsina al 0,25% y EDTA 1 mM. Esterilizar con un filtro de 0,22 μm. - Añadir otros 3 ml de solución de enzima cortical cerebral en el tubo que contiene las cortezas e incubar a 37 ° C en un baño de agua durante 5 minutos adicionales.
- Retire la solución de la enzima cortical cerebral con una pipeta de 5 ml y agregue 5 ml de DulbeCco modificado medio Eagle (DMEM) que contiene 10% de suero fetal bovino (FBS).
- Disociar las cortezas pipeteando suavemente hacia arriba y hacia abajo usando una pipeta de 5 ml con una punta estéril P1000. Pipetear nuevamente con una pipeta de 5 ml con una punta P200.
- Coloque un filtro de nylon de 40 μm en un tubo de 50 ml y filtre la suspensión para eliminar los desechos.
- Centrifugar a 420 xg durante 5 min a RT y luego eliminar el medio DMEM.
- Añadir 5 ml de medio de cultivo cortical cerebral y resuspender suavemente el sedimento celular.
NOTA: Preparar un medio de cultivo cortical cerebral consistente en un medio basal neuronal suplementado con 1x suplementos de B-27, 2 mM de L-glutamina y 100 U / mL de penicilina estreptomicina. - Contar las células utilizando un hemocitómetro y ajustar la concentración celular (como se desea) utilizando el medio de cultivo cortical cerebral.
- Placa 3,0 × 10 6 neuronas corticales en 2,0 ml por platos revestidos de vidrio de 35 mm de fondo.
NOTA: Antes de chapar, cubra elPlatos de fondo de vidrio de 35 mm con 0,1 mg / ml de bromhidrato de poli-D-lisina (PDL) o 0,01% de poli-L-ornitina (PLO). Incubar durante 3 h - O / N a 37 ° C y lavar con PBS al menos 3x.
2. Motilidad de la vesícula de imagen
- Prepare los plásmidos que marcarán cada tipo de vesícula. Por ejemplo, el uso de EGFP-Rab5 para endosomes temprana, EGFP-Rab7 para los endosomas tardíos, LAMP-EGFP para los lisosomas, y EGFP-LC3 para los autofagosomas [ 8 , 13] .
NOTA: Estos plásmidos están disponibles a solicitud de tsuruta.fuminori.fn@u.tsukuba.ac.jp. Típicamente, las neuronas de 3 - 5 días in vitro (DIV) pueden ser transfectadas con estos plásmidos usando reactivos de transfección. - Mezclar 4,0 μg de plásmidos con 200 μl de medio exento de suero por pipeteado. En un tubo separado, diluir 8 μl de reactivo de transfección (ver Tabla de Materiales ) en 200 μl de medio exento de suero. Incubar durante 5 min a RT.
- Mezclar la solución de plásmido y la solución regente de transfección en la etapa 2.2 pipeteando. Incubar durante 20 min a TA.
- Añadir medio libre de suero y 400 μl de la solución de plásmido de la etapa 2.3 a cada plato de fondo de vidrio recubierto. Incubar las neuronas a 37 ° C en un 5% CO 2 incubadora durante 30 min. Sustituir el medio por 2 ml de medio de cultivo cortical cerebral. Incubar las neuronas a 37 ° C en un 5% CO 2 incubadora durante 1-2 días.
- Después de 1 - 2 d de transfección, seleccione las células transfectadas para la adquisición de imágenes.
NOTA: Las neuronas prematuras menores de 7 DIV tienen una tendencia a exhibir movilidad dinámica de las vesículas. Seleccione las neuronas que moderadamente expresan la sonda de fluorescencia porque no se pueden obtener imágenes claras cuando se selecciona una neurona que expresa mucho. Además, seleccione una forma neuronal típica, como las neuronas piramidales, que tienen axones largos y dendritas intrincadas, para facilitar la identificación del axón y las dendritas (ver Figura 1A). - Adquisición de imágenes mediante un sistema de imágenes de lapso de tiempo:
Para la obtención de imágenes, utilice un microscopio de fluorescencia equipado con una cámara de dispositivo de carga acoplada (CCD) con 40x Plan Apo 0.95NA o 100X Plan Apo VC NA1.4 objetivos. Controlar la temperatura a 37 ° C utilizando un sistema de incubación. Adquirir imágenes neuronales en un fotograma / 5 s durante un período de 100 s controlado por el software de adquisición de imágenes. Como alternativa, adquirir imágenes a intervalos más cortos y para períodos de tiempo más largos, como en un fotograma por 2 s en un período de 300 s.
NOTA: Hay una variedad de aplicaciones disponibles para tomar imágenes secuenciales, muchas de las cuales serían adecuadas para este método. Por lo tanto, no se recomienda ninguna aplicación en particular; Más bien, cada investigador debe usar cualquier aplicación disponible.
3. Análisis de la imagen
- Abra todas las imágenes secuenciales en el software ImageJ con seguimiento manual 14 .
NOTA: Hasta la fecha, el seguimiento manual ha sidoDely utilizado en rastrear experimentos 15 , 16 , 17 , 18 , 19 . Manual Tracking fue desarrollado por el Dr. Fabrice Cordelières. Las instrucciones por escrito detalladas están disponibles en línea 20 . Para el análisis, la calidad de los datos de imagen se mejora con un número suficiente de imágenes. Se recomienda utilizar más de 20 imágenes. - Para combinar las imágenes secuenciales, seleccione → → . Haga clic en .
- Elija → ; Aparecerá una ventana de seguimiento.
- Haga clic en la casilla de verificación de Y defina los parámetros de seguimiento en la sección de parámetros.
NOTA: Se pueden configurar varios parámetros, incluyendo el intervalo de tiempo, calibración x / y, calibración z, tamaño cuadrado de búsqueda para el centroTamaño de punto, ancho de línea y tamaño de fuente. En este ensayo simplificado, tanto el intervalo de tiempo como la calibración x / y se definieron. Bajo otras circunstancias experimentales, puede ser necesario definir otros parámetros también. Los parámetros utilizados son los siguientes: el es de 5 s y la calibración es de 0,26642 μm para una lente de objetivo Plan Apo 0,95NA de 40X o 0,10657 μm para un Plan Apo VC NAX de 100X Objetivo. - Después de definir los parámetros, haga clic en para iniciar una nueva pista.
- Después de determinar las vesículas de interés ( por ejemplo, las vesículas indicadas por las puntas de flecha azules y rojas en la Figura 1A (panel derecho)), haga clic en el centro de las señales en las imágenes secuenciales para registrar las coordenadas xy. Los resultados de las coordenadas xy registradas, la distancia y la velocidad aparecen en una nueva ventana.
NOTA: En el caso de los lisosomas, las grandes señales fluorescentes brillantes ( por ejemplo, FigUre 1A (panel derecho), punta de flecha naranja) se observan a menudo en neuronas. Como estas señales ocasionalmente presentan vesículas acumuladas o varicosidades patológicas, estas señales deben evitarse para cuantificar la motilidad. - Repita el paso 3.6 para recoger las coordenadas xy de las vesículas de todas las imágenes secuenciales; Cada imagen avanza automáticamente a la imagen sucesiva después de seleccionar el punto de referencia.
- Exporte estos datos a una nueva tabla ( por ejemplo, una hoja de cálculo). Utilice un software adecuado para crear un gráfico adecuado (consulte la Tabla de materiales ).
NOTA: Para analizar los datos, seleccione la columna , sume todos los valores de esta columna y muestre una distancia de motilidad como gráfico de barras, como en la Figura 1B . Además, repita este paso, calcule el promedio de la distancia total de motilidad, y muestre como un gráfico de barras, como en la Figura 1C . El software para crear un gráfico de barras y los datos de forma de onda se muestran enLa Tabla de Materiales.
Resultados
Este ensayo fue diseñado para medir la dinámica vesicular en cultivo in vitro . Este ensayo se utilizó para determinar la motilidad vesicular asociada con morfología neuronal y supervivencia. Las Figuras 1A y B muestran datos representativos que muestran la motilidad de los lisosomas en las neuronas. Las neuronas corticales se transfectaron con el marcador de lisosoma, LAMP-EGFP, y se observaron usando un microscopio de fluorescencia estándar. Se ha informado previamente de que las vesículas de endosoma-lisosoma específicas son altamente móviles, incluso en las neuronas de reposo [ 8] . De hecho, estos resultados demuestran tanto en reposo y moviendo vesículas en la misma dendrita ( Figura 1A y B ). Normalmente, las vesículas en reposo exhiben movimiento vibratorio, como el movimiento browniano, en las dendritas neuronales. Por el contrario, las vesículas en movimiento presentan una motilidad irregular. Se especula que cada vesícula tiene unaComposición característica que subyace a la determinación de la función, incluso en las vesículas de lisosoma 8 . Por lo tanto, la clasificación de vesículas utilizando este enfoque puede proporcionar información útil. Utilizando este sistema, es fácil cuantificar la motilidad media de estas vesículas ( Figura 1C ) y analizar las propiedades de las vesículas utilizando este sistema de una manera eficaz en el tiempo.
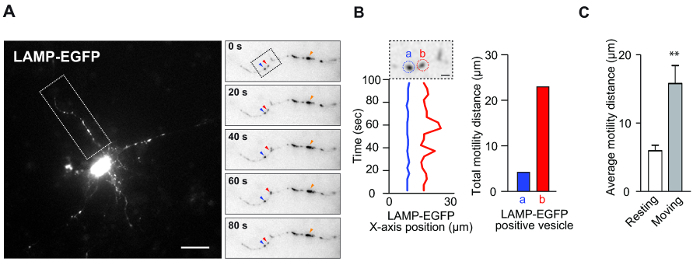
Figura 1: Motilidad de Lisosoma en Dendritas Neuronales. ( A ) Se transfectaron neuronas corticales de ratón (4 DIV) con plásmido LAMP-EGFP durante 2 días. Esta imagen muestra la motilidad de vesículas que contienen LAMP-EGFP en las dendritas. La inserción muestra la imagen de lapso de tiempo de las vesículas positivas a LAMP-EGFP. La punta de flecha roja indica una vesícula en movimiento, y la punta de flecha azul indica una vesícula de reposo. Las puntas de flecha naranja indican señales fluorescentespor arriba. Barra de escala = 20 μm. ( B ) La posición en el eje x dependiente del tiempo de las vesículas positivas a LAMP-EGFP de la figura A. La vesícula en el círculo rojo marcado con (b) se mueve y la vesícula en el círculo azul marcada con (a) está en reposo. Barra de escala: 5 μm (izquierda). El gráfico de barras indica la distancia total del movimiento LAMP-EGFP (derecha). ( C ) El gráfico de barras indica la distancia media de motilidad de las vesículas que contienen LAMP-EGFP. (N = 5, media ± error estándar de la media [SEM], ** p <0,01 por el test t de Student). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este protocolo introduce el procedimiento para cuantificar la motilidad vesicular. En las neuronas primarias, los endosomas y los lisosomas tienden a mostrar una alta motilidad en las neuronas más jóvenes (4-6 DIV). Dado que las neuronas deben entregar algunos componentes a los bordes delanteros a los procesos neurales alargados, el tráfico de la membrana debe ocurrir dinámicamente durante esta etapa. Por lo tanto, es importante utilizar las neuronas más jóvenes para observar la motilidad dinámica en las dendritas neuronales. Además, las vesículas más grandes no tienden a mostrar alta motilidad, incluso en neuronas más jóvenes. Es probable que la regulación del tamaño de las vesículas esté implicada en la frecuencia de las etapas de fisión de fusión. Puede ser posible que las vesículas específicas que no se mueven dinámicamente fácilmente aceptan fácilmente otras vesículas y terminan sus movimientos. Por lo tanto, la selección de vesículas es un proceso importante para este análisis.
Existen varios paquetes de software de plug-in disponibles para el seguimiento de objetos 21 . Por ejemplo, la pistaMate puede rastrear objetos 22 y puede ser modificado por software numérico, proporcionando una gama de información matemática. Por otra parte, es un poco complicado de usar para el análisis de imagen relativamente simple en este protocolo. Mtrack2 es otro plug-in y se basa en el complemento MultiTracker 23 . Mtrack2 también es útil porque puede identificar objetivos y luego determinar qué objetivos en los siguientes marcos son los más cercanos. Este enfoque es útil para cuantificar enormes volúmenes de datos; Sin embargo, el seguimiento manual puede ser más confiable para volúmenes más pequeños de datos de imagen. Por lo tanto, recomendamos el seguimiento manual para cuantificar conjuntos de datos más pequeños y reconocer que puede ser mejor utilizar otro software para supervisar volúmenes mayores.
Se deben tomar varias precauciones en este enfoque. Primero, la tasa de muestreo debe ser alta para obtener datos estrictos. Esto se debe a que algunas vesículas exhiben movimiento rápido ySe observan ocasionalmente cambios abruptos, como fisión de fusión y aparición-desaparición, lo que indica que la imagenología frecuente es crucial para evitar perder el signo de cualquier cambio. Otro punto es que el uso de microscopios de alta gama, como microscopios confocales de disco de exploración y microscopios de fluorescencia de reflexión interna total, puede ser clave para obtener datos de alta resolución e interesantes. Se recomienda tomar imágenes a intervalos más cortos utilizando un microscopio de alta gama, aunque aquí, las imágenes se tomaron cada 5 s debido a las limitaciones del equipo.
Estudios sustanciales han sugerido un vínculo biológico entre el tráfico de membrana y trastornos neuronales [ 2] . Por ejemplo, se ha demostrado que los defectos lisosómicos están implicados en trastornos neuronales graves, como la enfermedad de Niemann-Pick y la enfermedad de Gaucher 24 . Curiosamente, varios estudios han informado de que el movimiento lisosómico y la localización están involucrados en laInicio del trastorno de almacenamiento lisosomal 6 . Es posible que la motilidad vesicular pueda usarse como biomarcador para estos trastornos. Un enfoque interesante puede surgir de la disponibilidad de células madre pluripotentes inducidas por el hombre (iPSCs). La investigación de la motilidad vesicular utilizando iPSCs derivado de las neuronas puede revelar un biomarcador para los trastornos de almacenamiento lisosómico. Este enfoque proporciona algunas pistas sobre los procesos que subyacen al riesgo de enfermedad.
Dado que este ensayo es simple, es fácil obtener datos de motilidad. Además, es aplicable al análisis de otros eventos celulares, incluyendo migración y cambios morfológicos. Es importante señalar que este enfoque tiene varias limitaciones debido a su simplicidad. Como tal, es necesario emplear otros enfoques, incluyendo electrofisiología, bioquímica y análisis de microscopio electrónico, para comprender la importancia fisiológica precisa del tráfico neuronal. Sin embargo, este enfoque es unD que es conveniente para los investigadores que desean analizar tráfico en una manera directa y time-effective.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos al Dr. Ricardo Dolmetsch (Escuela de Medicina de la Universidad de Stanford, afiliación actual: Novartis Institutes for Biomedical Research) por ayudar a desarrollar este análisis y al Dr. Matthew Wood, Takuma Aihara y Dongsook Kim por su lectura crítica del manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| Neurobasal medium | Thermo Fisher | 21103-049 | |
| Dulbecco's modified eagle medium | Wako | 044-29765 | |
| Opti-MEM | Thermo Fisher | 31985070 | Serum free medium |
| Hank's balanced salt solution | Thermo Fisher | 14170112 | |
| Penicilin Streptmycin | Thermo Fisher | 15140122 | |
| L-Glutamine | Thermo Fisher | 25030081 | |
| B-27 Supplements | Thermo Fisher | 17504044 | |
| 2.5% Trypsine | Thermo Fisher | 15090046 | |
| poly-D-lysine hydrobromide | Sigma | P7280 | |
| poly-L-ornithine | Sigma | P4957 | |
| Nylon cell strainer | Corning | 431750 | |
| Lipofectamine 2000 | Thermo Fisher | 11668027 | Transfection reagent |
| Polyethyleneimine "Max" | polysciences | 24765 | Transfection reagent. As an alternative to Lipofectamine2000, 0.1mg/ml Polyethyleneimine dissolved in sterilized water is available. But it is low efficiency and high toxicity. |
| BIOREVO BZ-9000 | Keyence | NA | |
| Incubation system INUG2-K13 | Tokay Hit | NA | |
| GraphPad Prism version 6.0 | GraphPad Software | NA | |
| Excel version 15 | Microsoft | NA | |
| ImageJ verion 1.47 | NA | NA |
Referencias
- Nicot, A. S., Laporte, J. Endosomal phosphoinositides and human diseases. Traffic. 9 (8), 1240-1249 (2008).
- De Matteis, M. A., Luini, A. Mendelian disorders of membrane trafficking. N Engl J Med. 365 (10), 927-938 (2011).
- Lebrand, C. Late endosome motility depends on lipids via the small GTPase Rab7. EMBO J. 21 (6), 1289-1300 (2002).
- Chen, C. S., Bach, G., Pagano, R. E. Abnormal transport along the lysosomal pathway in mucolipidosis, type IV disease. Proc Natl Acad Sci U S A. 95 (11), 6373-6378 (1998).
- Venugopal, B. Neurologic, gastric, and opthalmologic pathologies in a murine model of mucolipidosis type IV. Am J Hum Genet. 81 (5), 1070-1083 (2007).
- Li, X. A molecular mechanism to regulate lysosome motility for lysosome positioning and tubulation. Nat Cell Biol. 18 (4), 404-417 (2016).
- Tsuruta, F., Green, E. M., Rousset, M., Dolmetsch, R. E. PIKfyve regulates CaV1.2 degradation and prevents excitotoxic cell death. J Cell Biol. 187 (2), 279-294 (2009).
- Tsuruta, F., Dolmetsch, R. E. PIKfyve mediates the motility of late endosomes and lysosomes in neuronal dendrites. Neurosci Lett. 605, 18-23 (2015).
- McCartney, A. J., Zhang, Y., Weisman, L. S. Phosphatidylinositol 3,5-bisphosphate: low abundance, high significance. Bioessays. 36 (1), 52-64 (2014).
- Shisheva, A., Sbrissa, D., Ikonomov, O. Plentiful PtdIns5P from scanty PtdIns(3,5)P2 or from ample PtdIns? PIKfyve-dependent models: Evidence and speculation (response to: DOI 10.1002/bies.201300012). Bioessays. 37 (3), 267-277 (2015).
- Chow, C. Y. Mutation of FIG4 causes neurodegeneration in the pale tremor mouse and patients with CMT4J. Nature. 448 (7149), 68-72 (2007).
- Zhang, Y. Loss of Vac14, a regulator of the signaling lipid phosphatidylinositol 3,5-bisphosphate, results in neurodegeneration in mice. Proc Natl Acad Sci U S A. 104 (44), 17518-17523 (2007).
- Mizushima, N., Yamamoto, A., Matsui, M., Yoshimori, T., Ohsumi, Y. In vivo analysis of autophagy in response to nutrient starvation using transgenic mice expressing a fluorescent autophagosome marker. Mol Biol Cell. 15 (3), 1101-1111 (2004).
- . Manual Tracking, a plug-in for ImageJ software [Internet] Available from: https://imagej.nih.gov/ij/plugins/track/track.html (2017)
- Hu, W. Exopolysaccharide-independent social motility of Myxococcus xanthus. PLoS One. 6 (1), e16102 (2011).
- Tan, Z. Characterization of four type IV pilin homologues in Stigmatella aurantiaca DSM17044 by heterologous expression in Myxococcus xanthus. PLoS One. 8 (9), e75105 (2013).
- Choi, S. A genetic variant of cortactin linked to acute lung injury impairs lamellipodia dynamics and endothelial wound healing. Am J Physiol Lung Cell Mol Physiol. 309 (9), L983-L994 (2015).
- Dahirel, M. Movement propensity and ability correlate with ecological specialization in European land snails: comparative analysis of a dispersal syndrome. J Anim Ecol. 84 (1), 228-238 (2015).
- Hu, W. Interplay between type IV pili activity and exopolysaccharides secretion controls motility patterns in single cells of Myxococcus xanthus. Sci Rep. 6, 17790 (2016).
- . Manual Tracking [Internet] Available from: https://imagej.nih.gov/ij/plugins/track/Manual (2017)
- . ImageJ Tracking plug-in [Internet] Available from: https://imagej.net/Category:Tracking (2017)
- Tinevez, J. Y. TrackMate: An open and extensible platform for single-particle tracking. Methods. , (2016).
- Ekvall, M. T. Three-dimensional tracking of small aquatic organisms using fluorescent nanoparticles. PLoS One. 8 (11), e78498 (2013).
- Jeyakumar, M., Dwek, R. A., Butters, T. D., Platt, F. M. Storage solutions: treating lysosomal disorders of the brain. Nat Rev Neurosci. 6 (9), 713-725 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados