Method Article
Bir HS-MRM tahlil için Protein Biyofarmasötikler sıvı Kromatografi iyon hareketlilik QTOF kütle spektrometresi tarafından Host-hücre proteinleri miktar
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, yüksek çözünürlüklü (~ 30.000) MS-algılama, peptid parçacıkları Monoklonal antikor çivili peptid standartları miktar için ardından peptid öncüleri iyon hareketlilik ayrılması ile birleştiğinde bir Kromatografik tahlil açıklamak Özet.
Özet
Alt düzey (1-100 ppm) protein kirleri (Örneğin, ana bilgisayar-hücre proteinleri (diyetteki)) protein biotherapeutics yüksek hassasiyet ve geniş dinamik alan gerektiren zorlu bir tahlil analizidir. Kütle spektrometresi tabanlı miktar deneyleri proteinler için genellikle protein sindirimi seçmeli reaksiyon izleme/çoklu reaksiyon (SRM/MRM) miktar düşük çözünürlüklü (Rs ~ 1000) tandem kullanarak peptidler, izleme tarafından takip içerir Quadrupole Kütle Spektrometre. Bir bu yaklaşımın sınırlamaları peptid ilgi "aynı" öncü ve parça kütle (m/z değerleri) açısından olarak ortak eluting diğer peptidler örnek (içinde 1-Da pencere) mevcut olduğunda gözlenen girişim olgudur. Başka bir kitle spektrometrik yaklaşım, peptid öncüleri iyon hareketlilik ayrılması yüksek çözünürlüklü (Rs ~ 30.000) ile birleştirir bir yüksek seçicilik (HS) MRM tahlil önerdiğimiz bu fenomen önlemek için MS algılama, peptid parçacıkları. Biz bir Monoklonal antikor (mAb) özetinde çivili ve duyarlılık ve dinamik alan (en az 3 büyüklük) genellikle HCP içinde elde sahip olduğunu göstermiştir düşük-bereket peptid standartları ölçmek için bu yaklaşım yeteneklerini incelemiş analiz. Tüm altı peptid standartları 0.1 düşük konsantrasyonlarda tespit edildi nM (1 femtomole 2.1 mm ID Kromatografik sütun üzerinde yüklü) yüksek-bereket peptid arka plan (mAb yüklenen Özet olarak-sütun 2 µg) huzurunda. Tavşan phosphorylase (97.2 kDa), hangi çivili peptidler elde, MW göz önünde bulundurarak bu tahlil LOQ 50 ppm düşüktür. Göreli standart sapmalar (RSD) en yüksek alanların (n 4 çoğaltır =) % 15'den az araştırılan tüm konsantrasyon aralığında olduğunu (0,1-100 nM veya 1-1000 ppm) Bu çalışmada.
Giriş
Şu anda ağırlıklı olarak çeşitli avantajlar nedeniyle (Örneğin, ELISAs), uzun dayanır büyük biomolecules (protein) endüstriyel ayarlarında miktar: hassasiyet, yüksek performans, kullanım kolaylığı ve örnek başına düşük maliyet. Düşük-bereket protein yabancı maddelerin (ana bilgisayar-hücre proteinleri (diyetteki) 1-100 ppm) protein tedavi mevcut analiz etmek için uygulandığında, bu biyolojik deneyleri genellikle (genellikle ppm veya ng HCP/mg mAb ifade), toplam HCP yoğunluğu ama onlar sağlar tanımlamak ve ölçmek bireysel HCP kirletici. Birkaç MS tabanlı deneyleri ELISAs tamamlayacak veya ELISAs1,2,3,4,5,6 sunmak için başarısız bilgi sağlamak için geliştirilen , 7 , 8 , 9. örnek karmaşıklığı ve konsantrasyon (en az 3 büyüklük) geniş dinamik aralık arasında HCP peptidler tespit zorunluluğu nedeniyle, kapsamlı örnek ayırma ihale çok boyutlu Kromatografik yöntemler var geleneksel olarak düşük-bereket diyetteki1,2,3,4,5,6,7tanımlamanıza yardımcı olması için istihdam edilmiştir.
Doğal bir HCP kimlik takip ve doğrulama HCP izleme (Biyofarmasötikler birden çok toplu işlem arasında izleme). Bu durumda, tek-boyut LC/MS yöntemleri örnek işlem hacmi8,9geliştirmek için önerilmiştir. Ancak, HCP dinamik aralığı ölçümleri ve doğruluğu biyofarmasotik peptidler ezici varlığı ile 1 D LC/MS assay olarak etkilenebilir. Çok boyutlu bir ayrılık karşılaştırıldığında, Sinyal parazit19,20,21,22 için potansiyel bir tek-boyut Kromatografik ayırma için artar için olasılık Co eluting olmak daha fazla peptid öncüleri artırılır. Kromatografik ayırma zaman genişletmeden peptid öncüleri ayırmak için ortogonal anlamına gelir birleşme açıkça avantajlı olur. Dalga iyon hareketlilik (TWIM)10 seyahat sıkışık MS spectra milisaniye cinsinden gidermek için yeteneğine sahiptir. Yaklaşık 500 hareketlilik ayrımları tam Kromatografik pik genişliği 10 varsayarak bir tek peptid, elüsyon sırasında gerçekleştirilen s ve iyon hareketlilik cihazda bir IM ayrılması çalışma zamanı 20 ms olduğunu düşünüyor.
Protein miktar için kitle spektrometrik deneyleri başarılı bir şekilde geliştirilmiştir son on yıl iyi kabul edilen kullanarak seçili (birden fazla) tepki tandem Kütle Spektrometreleri11tarihinde, uygulanan yaklaşım (SRM/MRM yöntemi) izleme 12,13,14,15,16,17,18,19,20,21 ,22,23. Bu düşük çözünürlüklü kitle spektrometrik tahlil sınırlamaları biri peptid ilgi "aynı" olduğunda gözlenen girişim fenomen19,20,21,22 öncü ve parça ortak eluting kitle gibi diğer peptidler (içinde 1-Da pencere) örnek mevcut. SRM/MRM yöntemleri doğruluğunu artırmak için iki yol vardır: bir seçenek diğer seçenek habercisi/parça algılama için MS çözünürlüğü artırmak için ise müdahale habercisi iyonları, kaldırmak için habercisi düzeyinde bir ilave ayrılık adım gerektirir üst üste gelen MS sinyalleri kaçının. Açıklanan yüksek seçicilik (HS) MRM edinme modu burada bu yaklaşımların her ikisi de yüksek çözünürlüklü (Rs ~ 30.000) ile peptid öncüleri iyon hareketlilik ayrılması kaplin tarafından yararlanır MS algılama, peptid parçacıkları. Tahlil burada SRM/MRM proteomik deneyler17,18,24' te en az üç dinamik alan, genelde olan büyüklük, gözlenen kapaklar açıklanan.
Belgili tanımlık yarar HCP miktar için HS-MRM testin farklı konsantrasyonlarda (0,1 - 100 nM aralığı) Monoklonal antikor Özet, çivili altı peptid standartlarına göre üretilen sinyal doğrusallık izleyerek gösterilmiştir.
Protokol
1. infliksimab Özet (~ 24 h yordam) hazırlık
- 50 mM amonyum bikarbonat, %1 50 mM NH4HCO3, 500 mM dithiothreitol (DTT) 50 mM NH4HCO3ve 500 mM iodoacetamide (IAM) 50 mM NH4HCO3Anyonik yüzey aktif taze çözümleri hazırlayın.
- 750 µL 50 mM NH4HCO3için eklemek infliksimab mAb (10 mg/mL) 200 µL ve 50 µL % 1 Anyonik yüzey aktif çözüm ve varlığında % 0.05 Anyonik yüzey aktif 60 ° C'de 15 dakika için protein denatüre.
- 500 mm DTT 40 µL ekleyin ve 20 mM DTT huzurunda 60 ° C'de 60 dk için örnek azaltmak.
- 500 mm IAM 20 µL ekleyin ve örnek ~ 10 mM IAM huzurunda karanlıkta oda sıcaklığında 30 dakika alkylate.
- Microcentrifuge tüp içeriği MS sıralama sınıf Lys C/tripsin 20 µg içeren bir cam şişe ekleyin ve 37 ° C'de 3 h için örnek sindirmek
- MS sıralama sınıf Lys C/tripsin ve Özet örnek gecede (12-15 h) 37 ° C'de 20 µg içeren başka bir cam şişe için sindirilmiş örnek aktararak ikinci enzim aliquot (20 µg) Ekle
- Gecede proteolizis sonra %100 formik asit (FA) 5 µL ekleyin ve sindirmek için 30 dk 37 ° C'de asit değişken Anyonik yüzey aktif çürümeye kuluçkaya.
- Spin aşağı sindirmek için Anyonik yüzey aktif çözünmez bileşeni çökelti santrifüj 4.000 x g, 15 dak.
- ~ 1000 µL infliksimab Özet, yeniden elde etmek ve bir LC otomatik örnekleyici şişede yerleştirin; Özet konsantrasyon ~ 2 mg/mL olması gerekir. LC/MS sistem analiz için hazır olması ne kadar "denemeler" den bir dondurucu-20 ° C'de depolayın.
2. spiking peptid standartları (~ 30 dk)
- İnfliksimab Özet donmuş örnek oda sıcaklığında bir bankta cam şişe koyarak çözülme.
- 1 mL %0.1 1 µM hisse senedi çözümleri PHO tüm altı peptid standartları hazırlamak için SK H2O bir tavşan phosphorylase b (PHO) Özet şişe içinde (şişe her peptid 1 nmol içerir) şişede bulunan ekleyin.
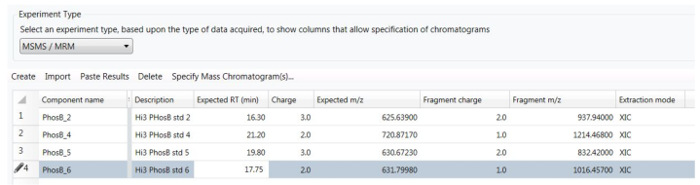
- 4 x 1-mL dilutions 0,1, 1, 10 ve 100 nM peptidler, % 0,1 kullanarak içeren çözümler elde etmek için PHO hisse senedi çözümün hazırlamak seyreltme solvent olarak SK. Cam şişe (LC otomatik örnekleyici şişeleri) içinde tüm dilutions hazırlamak ve 100 µL infliksimab Özet arka plan matris için tüm şişeleri ekleyin. Özet arka plan üzerinde-sütun 2 µg her 10 µL enjeksiyon ile yükleyin. Seyreltilmiş infliksimab Özet içeren boş bir örnek hazırlamak (aynı 1:10 seyreltme), çivili yok peptidler ile.
3. Kurulum LC/HDMS E veri alma yöntemi
Not: bir HS-MRM Alım ayarlamak için gerekli adımları özetleyen iş akışı şekil 1'de tasvir ve ayrıntılı bölümleri 3-6 açıklanmıştır. Bir veri bağımsız HDMSE veri kümesi edinimi izlenen her peptid, üst m/z electrospray iyonlaşma, takip en bol peptid iyon tutma zamanı kurmak için gerekli ve ilgili CCS (collisional cross Bölüm) iyon hareketlilik ayrılması türetilmiş. Buna ek olarak, veri-bağımsız veri kümesi her peptid öncü için üç en bol parçası iyonlar m/z ilgili bilgiler sağlar. İş akışı (CE optimization) İkinci adımda, testin duyarlılığı her parçası iyon için en yüksek iyon yoğunluğu elde etmek için çarpışma hücre enerji tuning tarafından artırılır. Son olarak, son adımda, yukarıda açıklanan tüm parametreleri için izlenen her peptid HS-MRM Düzenleyicisi tanıtılmaktadır.
- LC/MS deneyler bir veri bağımsız Alım yöntemi (HDMSE) kullanarak bir ultra performanslı sıvı Kromatografi Sistemi birleştiğinde bir quadrupole uçuş saat (QTOF) Kütle Spektrometre gerçekleştirin.
Not: Malzeme bölümünde enstrüman yapılandırması hakkında daha ayrıntılı bilgi eklenmiştir. Bu araç bir seyahat eden dalga iyon hareketlilik aygıtı peptid öncüleri10ayrılması için kullanır. - %0.1 SK (a Solvent) suda ve %0,1 içeren iki mobil aşama hazırlamak SK Asetonitril (Solvent B) içinde.
Not: çivili mAb digests ayrılması için bir şarj edilmiş yüzey hibrid (CSH) C18 sütun (2.1 x 150 mm, 1.7-µm parçacıkları ile Paketli) kullanın. - Veri toplama yazılımı "Oluştur/analiz yöntemi"'ı tıklatın ve seçin "Işleme yöntem ve bir satın alma oluşturur." Yöntem adı yazın, yöntem klasörü (dizin) bulun ve "Next".
- "Analiz türü," için "peptid harita (IMS)" seçin ve "Kuaterner Solvent Yöneticisi" enstrüman "Enstrüman sistem" sekmesinde seçin. Peptid ayrılık 200 µL/dk. kullanım % 40'a Solvent B 30 dk içinde ardından 2-min sütun yıkama ve 9-min denge bir degrade elüsyon-1 akış hızında elde etmek, bir toplam 50 dk. çalışma zamanı ile bu deneysel tanıtmak için degrade ayarlarını düzenle LC yöntemi düzenleyicisi parametrelerinde.
- "Araç sistemi" sekmesinde "Örnek Yöneticisi" aracı seçin. Numune sıcaklığı 10 ° C ile 60 ° C'ye sütun sıcaklık için ayarla
- QTOF Kütle Spektrometre pozitif iyon 30.000 FWHM tipik bir çözme gücü ile ESI duyarlı tarz içinde çalışır.
Not: LC/HDMSE hızla çarpışma enerjiler (çarpışma hücresinde) alternatif ile inceden inceye gözden geçirmek toplayarak çalışır bir veri bağımsız edinme (DIA) modu düşük enerji (MS Kanal 1 inceden inceye gözden geçirmek için 6 V) ve (15 - 40 V rampa için yükseltilmiş bir enerji arasındadır «««üretmek) parçalanma spectra 2 MS kanaldaki habercisi seçimi olmadan.- Veri toplama yazılımı varsayılan kaynak ile ilgili MS parametrelerini girin: "Benim çalışma/enstrüman sistem," dan "Vion IMS Qtof" sekmesini seçin ve "Araçlar" menüsünden, bu parametreleri girin: 3.0 kV kapiller gerilim, 100 ° C kaynak sıcaklık, 100 V kaynak ofset, 50 L/h gaz akışı ve 40 V koni gerilim koni. 250 ° C, desolvation gaz debisi 500 L/h ve 3.0 için başvuru kapiller voltaj desolvation sıcaklığı ayarlamak kV.
- Veri toplama yazılımı "Oluştur/analiz yöntemi"'ı tıklatın ve seçin "Işleme yöntem ve bir satın alma oluşturur." Yöntem adı yazın ve yöntem klasörü (dizin) bulun ve sonra "İleri" düğmesini tıklatın
- "Analiz türü," için "peptid harita (IMS)" seçin ve "Vion IMS QTof" enstrüman "Enstrüman sistem" sekmesini seçin. "Son" u tıklatın
Not: Yeni oluşturulan LC/HDMSE yöntemi otomatik olarak "Enstrüman yöntemi yapılandırma" ekranı açılır. - "Koyma" etiket, bu parametreleri girin: 3.0 kV kapiller gerilim, 100 ° C kaynak sıcaklık, 250 ° C'ye kadar desolvation sıcaklığı, 50 L/h koni gaz akışı ve 500 L/h desolvation gaz akışı.
- "Deney" sekme ayarlarını "Yüksek çözünürlüklü MSE"ve "Analiz yöntemi çalışma zamanı." u seçin "Tarama koyma" etiket, bu parametreleri girin: düşük kütle, 100; yüksek kitle, 2000; ve zaman, "CE" sekmesinde 400 Bayan inceden inceye gözden geçirmek, "6 V" düşük enerjili ayarı için yazın ve yüksek enerjili bir rampa 15 ila 40 f. "kontrol sakatlar veri azaltma" var emin olun seçin.
- % 0,1 ile % 50 Asetonitril hazırlanan 50 ng/mL lösin enkephalin (LE) bir çözüm demlemek SK 10 µL/dk'ya kilit-kütle kalibrasyon veri toplama sırasında akış hızında.
Not: Kilit-kütle veri her 5 dk aynı kitle aralığında aynı edinme kuru kullanılarak elde edilir.
- Enjekte etme 10 µL (yüklü miktar üzerinde-sütununu her peptid standart için 100 fmol IS) örneği tarafından yukarıda açıklanan LC/HDMSE tahlil kullanarak 10 nM, PHO çivili örneğini analiz.
4. Kurulum Tof-MRM yönteminin çarpışma enerji (CE) en iyi duruma getirme
- LC/HDMSE kümesinden tutma zamanı, habercisi ve parça iyon m/z her PHO peptid için edinin. M/z ve en bol için şarj durumunu korumak habercisi iyon ve karşılık gelen üç en bol parçası iyonları.
Not: Bu şekil 2'genellikle LC/HDMSE tahlil tarafından kaydedilen düşük enerjili ve yüksek enerjili spectra ürününün bir örnek gösterilmiştir. - Çarpışma enerji (CE) en iyi duruma getirme bir SRM/MRM denemede her peptid23en iyi sinyal almak için kullanın.
- Veri toplama yazılımı "Oluştur/analiz yöntemi"'ı tıklatın ve seçin "Işleme yöntem ve bir satın alma oluşturur." Yöntem adı yazın, yöntem klasörü (dizin) bulun ve "Next".
- "Analiz türü" için "Sayabilirsiniz." seçin "Miktarını tahlil 2D Tof Kromatografik" seçin ve "Next" tıklayın "Araç sistemi" sekmesinde, "Vion IMS QTof" seçin ve "Son" u tıklatın
Not: Yeni oluşturulan Tof-MRM yöntemi otomatik olarak "Enstrüman yöntemi yapılandırma" ekranı açılır. - "Koyma" etiket, bu parametreleri girin: 3.0 kV kapiller gerilim, 100 ° C kaynak sıcaklık, 250 ° C'ye kadar desolvation sıcaklığı, 50 L/h koni gaz akışı ve 500 L/h desolvation gaz akışı.
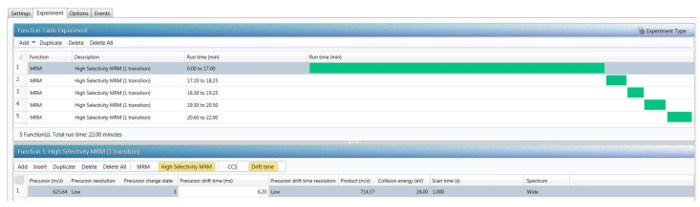
- "Deney" sekmesi ayarları "İşlev tablosu" ve "bir veya daha fazla MS, MSMS veya MRM fonksiyonları." u seçin Aşağı ok tuşlarını kullanarak, her peptid "Tof-MRM" işlevi üç "geçiş" (en bol habercisi ve üç en bol onun parçası iyonlar kombinasyonları) girerek ayarlayın.
Not: Tof-MRM modunda bir zamanlanmış MRM yaklaşım kullanarak en yüksek hassasiyet elde edilir. - "Tof-MRM" fonksiyon Düzenleyicisi'nde, peptid elüsyon sırasına göre düzenlenmiş bir tutma zaman penceresi her peptid (en az 1 dakika uzun), için seçin. "Tof-MRM" fonksiyon Düzenleyicisi'nde, peptid habercisi m/z ve ürün m/z Ekle; Çift yalıtım pencere için peptid habercisi "düşük" (4-Da pencere) seçin; Sabit tarama süresi 100 MS seçin; ve on iki farklı çarpışma enerji değerleri 14-36 V, aralığı içinde aşağıdaki gibi seçin: 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34 ve 36, şekil 3 örnekte gösterildiği gibi.
Not: yukarıda açıklanan Tof-MRM yöntemi ile belirtilen her CE, her geçiş için en az 10 veri noktaları Kromatografik tepe başına toplanır. Veri dosya boyutunu azaltmak için parça iyon sinyal için "Geniş" seçeneği (6-Da pencere) seçin. CE en iyi duruma getirilmiş değer örnekleri tablo 2'de gösterilmiştir. - Enjekte etme 10 µL (yüklü miktar üzerinde-sütununu her peptid standart için 100 fmol IS) örneği tarafından yukarıda açıklanan Tof-MRM tahlil kullanarak 10 nM, PHO çivili örneğini analiz.
5. Kurulum iyon hareketlilik ayrılması peptid öncüleri kullanarak peptid miktar için son HS-MRM satın alma yönteminin
- Veri toplama yazılımı "Araştır" menüde her CE her peptid için oluşturulan tüm 11 Kromatografik izlemeler görüntülemek ve tepeler "işleme seçenekleri/çalıştırma" araç çubuğundan "Entegre" düğmesini kullanarak entegre; en yüksek tepe alan her bir geçiş için en iyi CE belirtir.
- Görsel olarak iyi pik alanları her peptid 3 parçaları için karşılaştırın ve sadece en iyi "geçiş" (parça iyon); en yoğun sinyal üreten korumak Tablo 2 en iyi "dört PHO peptidler elde edilen geçişler" görüntüler.
- Peptid başına yalnızca bir parçası iyon içeren bir HS-MRM yöntemi kur. LC/HDMSE veri kümesinden gelen her peptid habercisi CCS değerlerini kullanın.
- (Bölüm 4) önceki bölümde oluşturduğunuz Tof-MRM yöntemi "Tof-MRM" işlevi yerine "HS-MRM" işlevi seçerek değiştirin.
- "HS-MRM" fonksiyon Düzenleyicisi'nde, öncül ile ilgili aşağıdaki parametreleri girin: m/z, quadrupole çözünürlüğü: düşük (4 Da), şarj durumu, öncü CCS değeri ve öncü CCS çözünürlüğü: düşük. Ürün iyon için onun m/z, optimum çarpışma enerji girin, bir inceden inceye gözden geçirmek zaman 0.4 s ve seçin seçin tüm onun izotoplar içerecek şekilde bir "Geniş" spektrum ayarı (6 Da). Şekil 4'te bu son HS-MRM edinme yöntem tüm dört peptidler için bir örnek gösterilmiştir.
- 4 Çoğalt enjeksiyonlari aşağıdaki konsantrasyonları tarafından (10 µL her) takip boş mAb Özet ile başlayan HS-MRM yöntemini kullanarak tüm örnekleri (örnek) sigara çivili, analiz: 0.1, 1, 10 ve 100 nM PHO peptidler.
6. HS-MRM veri kümesi analizi için işleme yöntemi oluşturulması
- HS-MRM veri kümesi analizi için işleme yöntemi oluşturun.
- Analiz yöntemi, "HS-MRM" veri toplama yöntemi için oluşturulan "Amaç" sekmesinde tıklatın ve seçin "Yönetme bileşenlerin."
- "Deneme türü" altında açılan menüden "HS MS/MS/HS-MRM" seçeneğini seçin.
- Tıklayın "Oluştur/New girişindeki" ve işleme yöntemi düzenleyicisi Aşağıdaki parametrelerde tanıtmak: peptid tutma zamanı (RT), öncül şarj durumu, öncü m/z ve habercisi drift zamanı (DT). Parça iyon için m/z ve şarj durumunu girin ve "XIC" izleme ayıklama modu olarak belirtin.
- Aynı "HS-MRM" satın alma yöntemi "Amaç" sekmesinde, "Varsayılan tutarları" tıklatın ve aşağıdaki konsantrasyonları girin: 0.1, 1, 10 ve 100 nM PHO peptidler.
- "İşleme/ayıklama ayarlar" aşağıdaki parametreleri girin: varsayılan yığın hoşgörü, 10 ppm (için tüm parça iyonları m/z) ve varsayılan saat, % 5; drift PHO peptid işleme yöntemi örneği Şekil 5'te gösterilmiştir.
- Doğrusal eğri uydurma 1 / X2 ağırlık kalibrasyon türü için seçin.
- Tüm chromatograms entegre etmek ve her PHO peptid kalibrasyon eğriler oluşturmak için HS-MRM verileri işlemek.
Sonuçlar
Altı phosphorylase b peptid standartları PHO peptid karışım içinde yer alan bireysel dizisi tablo 1'ile birlikte onların saklama kez gösterilir ve en bol onların öncüleri HDMSE gözlenen deneme. Bir yüksek-seçicilik (HS) MRM tahlil gelişiminde ilk adım bir HDMSE dataset edinimi ile birlikte ilgili en her PHO peptid elüsyon zamanlarında kurmaktır bol habercisi ve üç en bol parçaları. Şekil 2 bir PHO peptidler (Pep 6) infliksimab özetinde çivili için alınan HDMSE spectra görüntüler. 3 en iyi "geçiş" (öncü ve parça kitleler kombinasyonları) her peptid için kurulduktan sonra Tof-MRM deney sinyaller her peptid için üretilen en üst düzeye çıkarmak için optimum çarpışma enerji bulmak için gerçekleştirilir. CE optimization denemenin sonuçları tablo 2'de özetlenmiştir. Son HS-MRM tahlil sadece en iyi "geçiş" her peptid için korur ve tüm çivili örnekleri analiz etmek için kullanılır (bkz. Şekil 4). HS-MRM chromatograms için 4 PHO peptidler araştırıldı konsantrasyonları arasında oluşturulan örnek şekil 7'de sunulmaktadır. Şekil 7'vurgulanmış HS-MRM doruklarına entegrasyon şekil 8'görüntülenir her peptid takip için dört kalibrasyon eğriler elde. Buna ek olarak, en yüksek alan göreli standart sapma, hesaplanan dayalı olarak 4 Çoğalt enjeksiyonları, tablo 3'te gösterilen 4 tabloları özetlenir.
| Peptid | Peptid | Saklama | Şarj Birleşik | ||||
| KİMLİĞİ | Sıra | süresi (dk) | + 1 | + 2 | + 3 | + 4 | |
| Moral 1 | VLYPNDNFFEGK | 19,4 | 1442.6951 | 721.8512 | 481.5699 | 361.4292 | |
| Moral 2 | TCAYTNHTVLPEALER | 16.0 | 1874.9065 | 937.9569 | 625.6404 | 469.4821 | |
| Moral 3 | IGEEYISDLDQLRK | 18,9 | 1678.8646 | 839.9360 | 560.2931 | 420.4716 | |
| Moral 4 | LLSYVDDEAFIR | 21,1 | 1440.7369 | 720.8721 | 480.9172 | 360.9397 | |
| Moral 5 | LITAIGDVVNHDPVVGDR | 19,7 | 1890.0080 | 945.5076 | 630.6742 | 473.2574 | |
| Moral 6 | VFADYEEYVK | 17,7 | 1262.5939 | 631.8006 | 421.5362 | 316.4039 | |
Tablo 1. İnfliksimab özetinde çivili kitle hazırlık karışımında yer alan PHO peptid standartları. Peptid saklama süreleri ve onların en bol öncüleri (kalın olarak vurgulanan) tablo biçiminde görüntülenir.
| Peptid | Peptid | Saklama | Peptid habercisi | En bol parçası iyonları/şarj | Optimum | ||||
| KİMLİĞİ | Sıra | süresi (dk) | m/z & şarj | Drift süresi (ms) | Ben | II | III | CE (V) | |
| Moral 2 | TCAYTNHTVLPEALER | 16.0 | 625.6404 (+ 3) | 6.2 | 714.3781 (+ 1) | 807.4177 (+ 2) | 827.4621 (+ 1) | 24 | |
| Moral 4 | LLSYVDDEAFIR | 21,1 | 720.8721 (+ 2) | 7.5 | 865.4050 (+ 1) | 964.4734 (+ 1) | 1214.5688 (+ 1) | 22 | |
| Moral 5 | LITAIGDVVNHDPVVGDR | 19,7 | 630.6742 (+ 3) | 6.3 | 642.3570 (+ 1) | 689.8391 (+ 2) | 832.4236 (+ 2) | 20 | |
| Moral 6 | VFADYEEYVK | 17,7 | 631.8006 (+ 2) | 7.0 | 830.3931 (+ 1) | 945.4200 (+ 2) | 1016.4571 (+ 1) | 24 | |
Tablo 2. Tof-MRM optimizasyonu denemenin sonuçları: Bu çalışmada sayısal her PHO peptid üç en bol parçaları, karşılık gelen en iyi duruma getirilmiş çarpışma enerji ile birlikte gösterilir.
| Konsantrasyon | Tutar | Moral 2 pik alanları (tablo 3A) | |||||
| (nM) | sütun üzerinde (fmoles) | Rep01 | Rep02 | Rep03 | Rep04 | Demek | RSD (%) |
| 0,1 | 1 | 490 | 439 | 462 | 431 | 456 | 5.8 |
| 1 | 10 | 5121 | 4842 | 5198 | 4842 | 5001 | 3.7 |
| 10 | 100 | 63853 | 64279 | 66111 | 62509 | 64188 | 2.3 |
| 100 | 1000 | 612392 | 605553 | 613229 | 611004 | 610545 | 0,6 |
| Konsantrasyon | Tutar | Moral 4 pik alanları (tablo 3B) | |||||
| (nM) | sütun üzerinde (fmoles) | Rep01 | Rep02 | Rep03 | Rep04 | Demek | RSD (%) |
| 0,1 | 1 | 275 | 359 | 325 | 288 | 312 | 12,2 |
| 1 | 10 | 3559 | 3694 | 3287 | 3754 | 3574 | 5.8 |
| 10 | 100 | 45259 | 45775 | 42976 | 45548 | 44890 | 2,9 |
| 100 | 1000 | 459374 | 467927 | 436272 | 458994 | 455642 | 3.0 |
| Konsantrasyon | Tutar | Moral 5 pik alanları (Tablo 3 c) | |||||
| (nM) | sütun üzerinde (fmoles) | Rep01 | Rep02 | Rep03 | Rep04 | Demek | RSD (%) |
| 0,1 | 1 | 3194 | 3243 | 3202 | 3257 | 3224 | 1.0 |
| 1 | 10 | 31464 | 31150 | 31464 | 31433 | 31378 | 0,5 |
| 10 | 100 | 313638 | 320712 | 311943 | 311943 | 314559 | 1.3 |
| 100 | 1000 | 2845736 | 2840031 | 2882006 | 2864052 | 2857956 | 0,7 |
| Konsantrasyon | Tutar | Moral 6 tepe alanları (tablo 3B) | |||||
| (nM) | sütun üzerinde (fmoles) | Rep01 | Rep02 | Rep03 | Rep04 | Demek | RSD (%) |
| 0,1 | 1 | 490 | 583 | 440 | 440 | 488 | 13,8 |
| 1 | 10 | 6429 | 6429 | 6848 | 6623 | 6582 | 3.0 |
| 10 | 100 | 71295 | 70400 | 71563 | 70400 | 70915 | 0,9 |
| 100 | 1000 | 707640 | 707640 | 694461 | 729490 | 709808 | 2.0 |
Tablo 3. HS-MRM chromatograms pik alanları içeren bir tablo 4 PHO peptidler (Pep 2, 4, 5 ve 6) için her LC/MS enjeksiyon (16 LC/MS çalışır ve 4 konsantrasyonları test) için kaydedildi.
Göreli standart sapma araştırıldı tüm konsantrasyon aralığında tüm peptidler için % 15 daha iyiydi.

Şekil 1. İş akışı diyagramı bir HS-MRM edinme yöntemini ayarlamak için gerekli üç adım özetleme. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
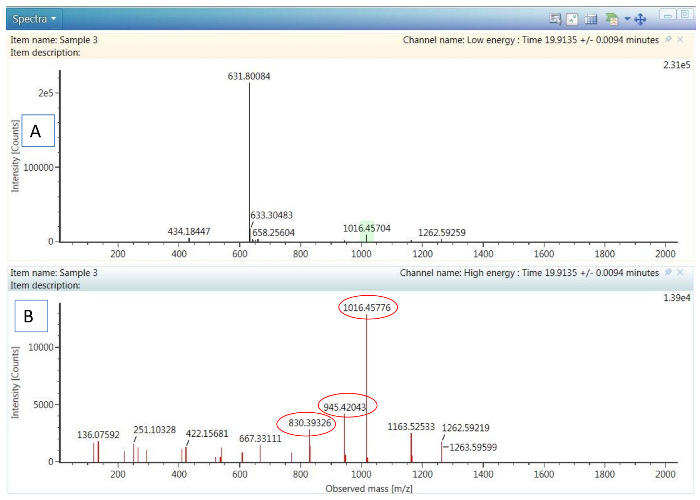
Şekil 2. HDMSE veri örneği:
(A) düşük enerjili spektrum Pep 6 habercisi iyon gösterilen. (B) Tof-MRM çarpışma enerji optimizasyonu için seçili (Daire içinde) ilk 3 en bol parçası iyonları görüntüleme aynı peptid yüksek enerjili parçalanma spektrum. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 3. Tof-MRM optimizasyonu ayarlamak için kullanılan parametreler deneme.
Her geçiş için on çarpışma enerjiler (16-36 V aralığında) test edildi. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Şekil 4. Son HS-MRM yöntem örneği.
Birkaç parametre "peptid habercisi m/z, şarj durumuna ve iyon hareketlilik drift zaman, m/z en bol parçası iyon, optimum çarpışma enerji ve MS satın alma süresi de dahil olmak üzere her bir geçiş için" gerekli değildir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Şekil 5. HS-MRM veri kümesi analiz etmek için işleme yöntemi tarafından kullanılan ayarlar.
Her peptid tek bir "geçiş" peptid habercisi m/z tarafından açıklanan tarafından izlenen, devlet ücret ve tutma zamanı, başından beri en bol parçası ve şarj durumuna m/z ile beklenen. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 6. İyon hareketlilik Kütle Spektrometre diyagramı.
HS-MRM satın alma modunda, diğer ortak eluting (müdahale) peptid öncüleri quadrupole tarafından izole ve bir sabit çarpışma enerji ile parçalanmış iyon hareketlilik hücre sayısal peptid öncüleri ayrılır çarpışma hücre. Peptid parçası iyonlar tarafından üretilen sinyal itici frekans ayarlayarak artırılmış ve peptid miktar yüksek-MS-çözünürlük kullanılarak gerçekleştirilir (> 30.000) her peptid en yoğun parçası iyon tarafından üretilen sinyalleri. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 7. HS-MRM chromatograms kaydedilen 4 PHO peptidler 3 büyüklük kapsayan 4 farklı konsantrasyonlarda için (0,1, 1, 10 ve 100 nM).
(A) pep 2 chromatograms, (B) Pep 4 chromatograms, (C) Pep 5 chromatograms ve (D) Pep 6 chromatograms. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
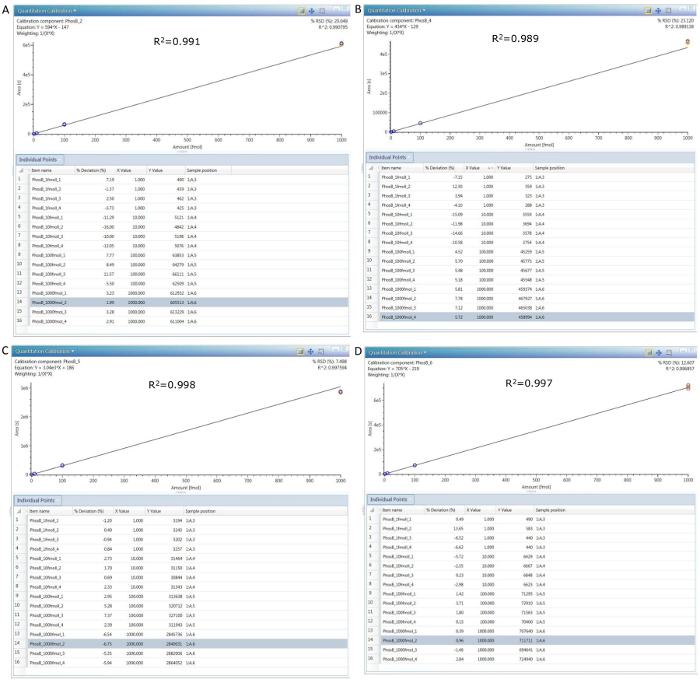
Şekil 8. 4 farklı konsantrasyonları arasında 4 PHO peptidler için kalibrasyon eğrileri (0,1, 1, 10 ve 100 nM).
Tablolar her eğri altındaki her tablodan ikinci sütun beklenen Dorusal tepki yüzde sapma gösterirken her enjeksiyon için kaydedilen bireysel pik alanları (Y-değerleri) görüntüler. (A) pep 2 kalibrasyon, (B) Pep 4 kalibrasyon, (C) Pep 5 kalibrasyon ve (D) Pep 6 kalibrasyon. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Tartışmalar
Yüksek çözünürlüklü (Rs > 20.000) kütle spektrometresi enstrüman platformları çeşitli tedavi amaçlı proteinleri yapısal karakterizasyonu için rutin olarak kullanılan. Buna ek olarak, MS tabanlı protein miktar genellikle SRM/MRM tarafından imza peptidler proteinler11,12 enzimatik bölünme tarafından oluşturulan kullanarak düşük çözünürlüklü (Rs ~ 1000) tandem quadrupole Kütle Spektrometreleri gerçekleştirilir , 13 , 14 , 15 , 16 , 17 , 18 , 19 , 20 , 21 , 22 , 23. tek-boyut Kromatografik ayrımları tam olarak Enzimatik sindirim tarafından üretilen karmaşık peptid karışımları çözümlenemiyor peptid co elüsyon tek-protein Özet durumunda bile ortak bir olay olduğu. Çok karmaşık protein digests (Örneğin, diyetteki 1-100 ppms terapötik protein tarafından üretilen bir peptid zengini arka plan huzurunda miktar için), hassasiyet, doğruluk ve SRM/MRM doğrusallık için tahlil tarafından etkilenebilir parazit var.
SRM/MRM deneyleri Venüslüdür seçicilik, sadece öncü/parça kitleler "benzersiz" kombinasyonuna güvenerek var. Bu nedenle, bu deneyleri peptid arka plan beklenmedik bir şekilde değiştiğinde durumlarda başarısız (Örneğin, biyofarmasotik örnekleri için farklı arıtma yordamlardan sağlanır). Biz burada bir iyon yüksek çözünürlüklü quadrupole hareketlilik etkin uçuş saat (QTOF) hibrid Kütle Spektrometre üzerinde uygulanan yüksek seçicilik (HS) MRM tahlil bu sınırlamalarını aşmak için teklif (alet diyagram için bkz: şekil 6).
Enstrüman diğer ortak eluting (müdahale) peptid öncüleri iyon hareketlilik hücredeki peptid ilgi öncüleri ayıran quadrupole habercisi tam izotopik zarf yalıtır ve sabit bir CE ile parçaları çarpışma hücre. Onun en bol peptid parçası tarafından üretilen sinyal seçmeli olarak ilgi kitle bölgeler tüm iyonları, yerine uçuş tüp tam tarama gibi ile iter itici frekans (hedef geliştirme), ayarlayarak daha da geliştirilmiştir. Peptid miktar bu parça iyon tarafından üretilen yüksek-MS-çözünürlük (Rs ~ 30.000) sinyallerini kullanarak gerçekleştirilir. SRM/MRM deneyleri ile karşılaştırıldığında, HS-MRM tahlil seçicilik iki ek düzeyini sağlar: ikinci TOF analyzer artan kitle kararı ile sunulan bir öncül düzeyi iyon hareketlilik ayırma tarafından sağlanır. Bu seçicilik gelişmeler tarafından getirdiği sonuçlar üç büyüklük arasında etkileşimler özgür Şekil 7'de görüntülenen HS-MRM chromatograms görünür.
SRM/MRM deneyleri HS-MRM deneyleri optimize etmek için ayarlanabilir bazı parametreler bulunur: RT pencere (genellikle 0.2 dk az ayarla) peptid habercisi, quadrupole yalıtım pencere (4 Da), drift-zaman penceresi etrafında çevreleyen öncü (± FWHM karşılık gelen iyon mobilogram üzerinden habercisi tepe) ve parçası iyon (20,000-40,000) MS çözümü. HS-MRM deneyleri çok duyarlıdır: her PHO peptidler için en düşük tespit edilen miktar 1 femtomole Tarih-sütundur (veya 0,1 nM peptid konsantrasyon açısından). Peptid MW göz önünde bulundurarak (bkz. Tablo 1 için doğru MWs), miktar sütun üzerinde 1-2 sayfa sırasını, sütun arka plan peptidler mAb Özet dan anlamlı olarak daha yüksek miktarda (2 µg) yüklenirken algılandığında.
Çivili peptidler türetildiği tam uzunlukta PHO protein (97.2 kDa) molekül ağırlığı dikkate alarak, tahlil 50 ppm yüksek-bereket arka plan iyonlarının varlığında bir protein kirlilik tespit edebilmektedir. Algılama (5-10 ppm) daha düşük limitler düşük moleküler ağırlıklı diyetteki (10-20 kDa) için ulaşılabilir vardır. Tahlil üç (kalibrasyon eğrileri şekil 8 gösterildiği) büyüklük, 1-1000 ppm aralığında diyetteki ölçebilirsiniz anlamına gelir kapsamaktadır. Ayrıca, tablo 3'te gösterilen HS-MRM deneyleri, tekrarlanabilirlik çok iyi küçük molekül SRM/MRM deneyleri, pik alanı RSDs %15 iyi tekrarlanabilirlik ile eşleşir.
Biz bir roman tahlil Monoklonal antikor (mAb) Özet çivili peptid standartları miktar için yeteneklerini incelemiş ve yarar-e doğru geniş dinamik aralık (en az üç büyüklük) tipik olarak kapsar ve hassasiyeti gösterdi HCP analizde karşılaştı. Tüm altı peptid standartları 0.1 düşük konsantrasyonlarda tespit edildi nM (1 femtomole 2.1 mm ID Kromatografik sütun üzerinde yüklü) yüksek-bereket peptid arka plan (mAb yüklenen Özet olarak-sütun 2 µg) huzurunda. Hedeflenen HRMS ve iyon hareketlilik habercisi ayırma birleşmeyle, HS-MRM tahlil hızlı, yüksek üretilen iş izleme tahlil için birden fazla diyetteki Biyofarmasötikler birden çok toplu işlem arasında olmak için büyük bir potansiyele sahiptir.
Açıklamalar
Tüm yazarlar birkaç reaktifler ve bu makalede kullanılan aletleri üreticisi olan Waters şirketi çalışanları olan.
Teşekkürler
Yazarlar Lesley Malouin ve Tony Catlin suları Corporation şekilde alt alta yazılmalıdır şekil 6 hazırlamak için teşekkür etmek istiyorum.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Vion IMS Qtof mass spectrometer | Waters | 186009214 | |
| Acquity H-Class Quaternary solvent manager (QSM) | Waters | 186015041 | |
| Acquity H-Class FTN Sample Manager (SM) | Waters | 186015040 | |
| Acquity H-Class Column Manager (CM) | Waters | 186015043 | |
| Acetonitrile (ACN) | Fisher Chemical | A996-4 | |
| Ammonium bicarbonate | Sigma Aldrich | 40867-50G-F | |
| 2.1 x 150 mm CSH C18 UPLC column, 1.8 µm particles | Waters | 186005298 | |
| Dithiothreitol (DTT) | Sigma Aldrich | D5545-5G | |
| Formic acid, eluent additive for LC/MS | Sigma Aldrich | 56302-10X1ML-F | |
| Hi3 rabbit phosphorylase (PHO) MassPREP standard | Waters | 186006011 | |
| Iodoacetamide (IAM) | Sigma Aldrich | I-1149-5G | |
| LC vials (12x32 mm glass vials, screw neck) | Waters | 186000327c | |
| Leucine Enkephalin acetate salt hydrate | Sigma Aldrich | L9133-10MG | |
| Protein LoBind 2.0 mL tubes (2x50) | Eppendorf | 22431102 | |
| RapiGest SF | Waters | 186001861 | |
| Trypsin/Lys-C enzyme mix, mass spec grade (5 x 20 µg) | Promega | V5073 | |
| Water, LC/MS grade | Sigma Aldrich | 39253-1L-R |
Referanslar
- Doneanu, C. E., et al. Analysis of host-cell proteins in biotherapeutic proteins by comprehensive online two-dimensional liquid chromatography/mass spectrometry. MAbs. 4, 24-44 (2012).
- Schenauer, M. R., Flynn, G. C., Goetze, A. M. Identification of host-cell protein impurities in biotherapeutics using mass spectrometry. Anal Biochem. 428, 150-157 (2012).
- Zhang, Q., et al. Comprehensive tracking of host-cell proteins during monoclonal antibody purifications using mass spectrometry. MAbs. 6, 659-670 (2014).
- Farrell, A., et al. Quantitative host-cell protein analysis using two-dimensional data independent LC-MS(E). Anal Chem. 87, 9186-9193 (2015).
- Doneanu, C. E., et al. Enhanced detection of low-abundance host cell protein impurities in high-purity monoclonal antibodies down to 1 ppm using ion mobility mass spectrometry coupled with multidimensional liquid chromatography. Anal Chem. 87, 10283-10291 (2015).
- Doneanu, C. E., et al. Improved identification and quantification of host cell proteins (HCPs) in biotherapeutics using liquid chromatography mass spectrometry. Technologies for therapeutic monoclonal antibody characterization, vol. 3: Defining the next generation of analytical and biophysical techniques. , Washington DC. ACS Symposium series 1202 357-393 (2015).
- Zhang, Q., et al. Characterization of the co-elution of host-cell proteins with monoclonal antibodies during protein A purification. Biotechnol Prog. 32, 708-717 (2016).
- Reisinger, V., Toll, H., Mayer, R. E., Visser, J., Wolschin, F. A mass spectrometry based approach to host cell protein identification and its application in a comparatibility exercise. Anal Biochem. , 1-6 (2014).
- Madsen, J. A., et al. Toward the complete characterization of host-cell proteins in biotherapeutics via affinity depletions, LC/MS/MS and multivariate analysis. MAbs. 7, 1128-1137 (2015).
- Giles, K., et al. Applications of a trevelling wave-based radio-frequency-only stacked ring ion guide. Rapid Commun Mass Spectrom. 18, 2401-2414 (2004).
- Anderson, V., Hunter, C. L. Quantitative mass spectrometric multiple reaction monitoring assays for major plasma proteins. Mol Cell Proteomics. 5, 573-588 (2006).
- Lange, V., Picotti, P., Domon, B., Aebersold, R. Selected reaction monitoring for quantitative proteomics: a tutorial. Mol Syst Biol. 4, 1-14 (2008).
- Picotti, P., et al. High-throughput generation of selected reaction-monitoring assays for proteins and proteomes. Nat Methods. 7, 43-46 (2010).
- Zhao, L., et al. Quantification of proteins using peptide immunoaffinity enrichment coupled with mass spectrometry. J Vis Exp. (53), (2011).
- Liebler, D. C., Zimmerman, L. J. Targeted quantitation of proteins by mass spectrometry. Biochemistry. 52, 3797-3806 (2013).
- Manes, N. P., Mann, J. M., Nita-Lazar, A. Selected reaction monitoring mass spectrometry for absolute protein quantification. J Vis Exp. (102), (2015).
- Ebhardt, H. A., Sabido, E., Huttenhain, R., Collins, B., Aebersold, R. Range of protein detection by selected/multiple reaction monitoring mass spectrometry in an unfractioned human cell culture lysate. Proteomics. 12, 1185-1193 (2012).
- Picotti, P., Bodenmiller, B., Mueller, L. N., Domon, B., Aebersold, R. Full dynamic range proteome analysis of S. cerevisiae by targetted proteomics. Cell. 138, 795-806 (2009).
- Sherman, J., McKay, M. J., Ashman, K., Molloy, M. P. How specific is my SRM: the issue of precursor and product ion reductancy. Proteomics. 9, 1120-1123 (2009).
- Abbatiello, S. E., Mani, D. R., Keshishian, H., Carr, S. A. Automated detection of innacurate and imprecise transitions in peptide quantification by multiple reaction monitoring mass spectrometry. Clin Chem. 56, 291-305 (2010).
- Rost, H., Malmstrom, L., Aebersold, R. A computational tool to detect and avoid redundancy in selected reaction monitoring. Mol Cell Proteomics. 11, 540-549 (2012).
- Bao, Y., et al. Detection and correction of interference in SRM analysis. Methods. 61, 299-303 (2013).
- Maclean, B., et al. Effect of collision energy optimization on the measurement of peptides by selected reaction monitoring (SRM) mass spectrometry. Anal Chem. 82, 10116-10124 (2010).
- Mbasu, R. J., et al. Advances in quadrupole and time-of-flight mass spectrometry for peptide MRM based translational reserch analysis. Proteomics. 16, 2206-2220 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır