Method Article
液相色谱离子迁移 QTOF 质谱测定蛋白质生物中宿主细胞蛋白的 HS-MRM 法
摘要
在这里, 我们描述了一种色谱检测, 再加上多肽前体离子迁移分离的高分辨率 (~ 3万) MS-肽片段的检测, 用于定量测定单克隆抗体中的尖肽标准消化。
摘要
对蛋白质 biotherapeutics 中的低级 (1-100 ppm) 蛋白质杂质 (例如,宿主细胞蛋白 (HCPs)) 的分析是一项挑战性的试验, 需要高灵敏度和广泛的动态范围。基于质谱的蛋白质定量测定通常涉及蛋白质消化, 其次是选择性反应监测/多反应监测 (SRM/MRM) 使用低分辨率 (Rs ~ 1000) 串联的肽量化四极质谱仪。这种方法的一个局限性是, 当感兴趣的肽具有 "相同的" 前体和片段质量 (以 m-/z 值表示) 时, 就会出现干扰现象, 如样品中的其他共洗脱肽 (在 1-Da 窗口内)。为了避免这种现象, 我们提出了一种替代质谱方法, 一种高选择性 (HS) MRM 检测, 将肽前体离子迁移分离与高分辨率 (Rs ~ 3万) MS 检测肽片段结合起来。我们探讨了这种方法的能力, 以量化低丰度肽标准在单克隆抗体 (抗体) 文摘, 并证明它具有灵敏度和动态范围 (至少3级数量) 通常达到在分析。所有六肽标准检测的浓度低至 0.1 nM (1 femtomole 载于2.1 毫米的 ID 色谱柱) 存在高丰度肽背景 (2 µg 的单克隆人的摘要载列)。在考虑了家兔磷酸化酶 (97.2 kDa) 的兆瓦, 从其中提取了尖刺肽, loq 矿用的含量低于 50 ppm。在本研究中, 在整个浓度范围 (0.1-100 nM 或 1-1, 000 ppm) 中, 峰值区 (n = 4 复制) 的相对标准偏差小于15%。
引言
在工业环境中对大型生物分子 (蛋白质) 的量化目前基于免疫 (例如, ELISAs), 主要是由于以下几个优点: 灵敏度、高通量、易用性以及每个样本的低成本。当应用于分析蛋白质治疗中存在的低丰度蛋白质杂质 (1-100 ppm 的宿主细胞蛋白 (HCPs)) 时, 这些生物检测通常提供总的浓度 (通常用 ppm 或 ng/毫克单克隆表达), 但它们无法识别和测量单个的污染物。最近开发了几种基于 MS 的检测方法来补充 ELISAs 或提供 ELISAs 无法提供1、2、3、4、5、6的信息。,7,8,9. 由于样本复杂度和要求检测的范围广泛的动态范围内的浓度 (至少3级), 多维色谱方法招标广泛的样品分馏有传统上用于帮助识别低丰度的 HCPs1,2,3,4,5,6,7。
在生物识别和验证之后, 一个自然的步骤是跨多个批次的跟踪 (监视)。在这种情况下, 建议采用单维 LC/MS 方法来提高示例吞吐量8,9。然而, 在 1D LC/MS 检测中, 由于生物制药肽的压倒性存在, 其准确性和动态范围可能受到影响。与多维分离相比, 信号干扰的可能性19,20,21,22在单维色谱分离中增加, 因为概率为更多的肽前体是共同洗脱的增加。在不延长色谱分离时间的情况下, 采用正交方法分离肽前体显然是有利的。行波离子移动性 (TWIM)10具有解决拥塞的 MS 频谱的能力, 以毫秒为单位。在单肽的洗脱过程中, 大约500的移动分离可以进行, 假设全色谱峰值宽度为十年代, 并考虑到离子移动仪器上的 IM 分离的运行时间为 20 ms。
在过去十年中, 使用公认的 (多) 反应监测方法 (SRM/MRM 方法) 在串联质谱仪上实施的质量分光光度测定法已经成功地开发了11, 12,13,14,15,16,17,18,19,20,21 ,22,23。这种低分辨率质谱检测的局限性之一是干扰现象19,20,21,22在感兴趣的肽有 "相同" 时观察到。前体和片段质量作为其他共同洗脱肽在样品 (在 1 Da 窗口之内) 存在。提高 SRM/MRM 方法的准确性有两种方法: 一种选择是在前体级别上额外的分离步骤, 以去除干扰前体离子, 而另一种选择是增加前体/片段检测的 MS 分辨率, 以避免重复 MS 信号。此处描述的高选择性 (HS) MRM 捕获模式利用这两种方法, 将肽前体的离子迁移分离与高分辨率 (Rs ~ 3万) MS 检测肽片段相结合。这里描述的检测至少包含三级的数量, 这是在 SRM/MRM 蛋白质组学实验中通常观察到的动态范围17,18,24。
通过监测单克隆抗体文摘中不同浓度 (0.1 至 100 nM 范围) 的六肽标准所产生的信号的线性度, 证明了 HS-MRM 检测方法的实用性。
研究方案
1. 英文摘的编写 (24 h 程序)
- 准备50毫米碳酸氢铵的新鲜溶液, 1% 个阴离子表面活性剂在50毫米 nh4HCO3, 500 毫米 dithiothreitol (德勤) 在50毫米 nh4HCO3和500毫米 iodoacetamide (IAM) 在50毫米 NH4HCO3。
- 到750µL 50 毫米 NH4HCO3, 添加200µL 英单克隆 (10 毫克/毫升) 和50µL 的1% 阴离子表面活性剂溶液和变性蛋白质15分钟在60°c 存在0.05% 阴离子表面活性剂。
- 添加40µL 500 毫米, 并减少60分钟的样品, 在60摄氏度的存在20毫米的德勤。
- 添加20µL 500 毫米 iam 和烷基化的样品30分钟在室温下在黑暗中的存在, 10 毫米 IAM。
- 将离心管的内容添加到含有20µg 的 MS 序级赖氨酸 C/胰蛋白酶的玻璃瓶中, 并在37摄氏度处消化样品3小时。
- 添加第二种酶整除 (20 µg), 将所消化的样品转移到另一个含有20µg MS 序级赖氨酸 C/胰蛋白酶的玻璃瓶中, 并在37摄氏度的一夜之间消化样品 (12-15 小时)。
- 在隔夜蛋白质水解后, 添加5µL 100% 甲酸 (FA), 并孵化消化30分钟在37°c, 以分解酸不稳定的阴离子表面活性剂。
- 在离心机中, 在 4000 x g 处旋转15分钟的文摘, 以沉淀阴离子表面活性剂的不溶成分。
- 恢复 ~ 1000 µL 的英文摘, 并将其放置在 LC 自动取样瓶;文摘浓度应为2毫克/毫升。将摘要存储在冰箱中-20 摄氏度, 直到 LC/MS 系统准备好进行分析。
2. 肽标准的峰值 (~ 30 分钟)
- 在室温下将冷冻样品放在长凳上的玻璃瓶中, 解冻英消化。
- 添加1毫升 0.1% FA 在 H2O 到一兔磷酸化酶 b (µM) 消化瓶为所有六肽标准准备 1-从瓶中所含的 (小瓶包含 1 nmol 每肽)。
- 准备 4 x 1 毫升的稀释溶液, 以获得含有 0.1, 1, 10 和 100 nM 肽的溶液, 使用 0.1% FA 作为稀释溶剂。准备所有稀释在玻璃瓶 (LC 自动取样瓶) 和添加100µL 的英文摘作为背景矩阵的所有瓶子。加载2µg 的摘要背景上的每10µL 注射。准备一个空白样品, 其中含有稀释的英消化 (相同的1:10 稀释), 没有尖刺肽。
3. LC/HDMS E数据采集方法的设置
注意: 概述了设置 HS MRM 购置所需步骤的工作流, 如图1所示, 并在3-6 节中详细介绍。需要获取与数据无关的 HDMSE数据集, 以确定每个被监视的肽的保留时间、在电喷雾电离后最丰富的肽离子的父 m/z 以及相应的 CCS (碰撞交叉部分) 来源于离子流动分离。此外, 数据无关数据集提供有关每种肽前驱体三个最丰富片段离子的 m-/z 的信息。在工作流的第二步 (CE 优化) 中, 通过调整碰撞细胞能量来提高每个片段离子的最高离子强度, 从而增加了检测的灵敏度。最后, 在最后一步中, 将上述所有参数都引入到 HS-MRM 方法编辑器中, 用于每个监测的肽。
- 使用与数据无关的采集方法 (HDMSE), 在四极飞行时间 (QTOF) 质谱仪上进行 LC/MS 实验, 并将其与超高性能液相色谱系统耦合。
注: 有关仪器配置的详细信息包括在材料部分。该仪器使用行波离子移动装置分离肽前体10。 - 在乙腈 (溶剂 B) 中制备两个流动相, 其中含有 0.1% fa 的水 (溶剂 A) 和 0.1% fa。
注: 使用带电的表面混合 (CSH) C18 柱 (2.1 x 150 毫米, 包装 1.7-µm 粒子), 以分离的单克隆抗体文摘。 - 在数据采集软件中, 点击 "创建/分析方法" 并选择 "生成获取和处理方法"。键入方法名称, 浏览到方法文件夹 (目录), 然后单击 "下一步"。
- 对于 "分析型", 选择 "肽图 (IMS)", 并在 "仪表系统" 选项卡中, 选择 "第四纪溶剂管理器" 仪器。编辑渐变设置以实现200µL/分钟的流速率的多肽分离. 在30min 中使用梯度洗脱从1到40% 溶剂 B, 后跟2分钟的柱洗和9分钟的平衡, 总运行时间为50分钟. 介绍这些实验LC 方法编辑器中的参数。
- 在 "仪表系统" 选项卡中, 选择 "示例管理器" 工具。将样品温度设置为10摄氏度, 柱温为60摄氏度。
- 在正离子 ESI 灵敏度模式下操作 QTOF 质谱仪, 典型的分辨力为 3万 FWHM。
注意: LC/HDMSE是一种独立于数据的获取 (DIA) 模式, 它通过快速收集与交替碰撞能量 (在碰撞细胞中) 之间的低能量 (6 V 为 MS 通道1扫描) 和一个高能量 (15 到 40 v 的斜坡) 的扫描来操作。在 MS 通道2中产生无前驱体选择的碎片谱。- 在数据采集软件中输入默认的与源相关的 MS 参数: 从 "我的工作/仪器系统", 选择 "Vion IMS Qtof" 选项卡, 并在 "工具" 菜单中输入以下参数: 3.0 kV 毛细管电压, 100 °c 源温度, 100 V 源偏移量, 50 升/小时锥气流, 40 伏锥电压。将 desolvation 温度设置为250摄氏度, desolvation 气体流速为500升/小时, 参考毛细管电压为3.0 伏。
- 在数据采集软件中, 点击 "创建/分析方法" 并选择 "生成获取和处理方法"。键入方法名称并浏览到方法文件夹 (目录), 然后单击 "下一步"。
- 对于 "分析类型", 选择 "肽图 (IMS)", 并在 "仪表系统" 选项卡中, 选择 "Vion IMS QTof" 仪器。单击 "完成"。
注意: 新创建的 LC/HDMSE方法在 "仪表方法配置" 屏幕中自动打开。 - 在 "设置" 选项卡中, 输入以下参数: 3.0 kV 毛细管电压, 100 °c 源温度, 250 °c desolvation 温度, 50 升/小时锥气流, 500 升/小时 desolvation 气体流量。
- 在 "实验" 选项卡设置中, 选择 "高清晰度 MSE", 然后选择 "分析方法运行时"。在 "扫描设置" 选项卡中, 输入以下参数: 低质量, 100;高质量, 2000;和扫描时间, 400 毫秒在 "CE" 选项卡中, 键入 "6 V" 为低能量设置, 并选择一个高能斜坡从15到 40 v 确保已检查 "禁用数据缩减"。
- 注入 50 ng/毫升亮氨酸脑啡肽 (LE) 的解决方案, 50% 乙腈和 0.1% FA 的流速为10µL/分钟, 用于锁质量校准在数据采集过程中。
注: 锁质量数据每5分钟获得一次, 使用相同质量范围内相同的采集速率。
- 用上述的 LC/HDMSE检测方法分析 10 nM、有刺的样品, 注射10µL 样品 (在柱上加载的量为每个肽标准的 100 fmol)。
4. 碰撞能量 (CE) 优化的飞行过程-MRM 方法的建立
- 从 LC/HDMSE数据集中, 获取每种钠肽的保留时间、前体和片段离子 m/z。保留的 m-/z 和电荷状态为最丰富的前体离子和相应的三最丰富的片段离子。
注: 由 LC/HDMSE分析所记录的低能和高能谱的例子如图2所示。 - 在 SRM/MRM 实验中使用碰撞能量 (CE) 优化来获取每个肽23的最佳信号。
- 在数据采集软件中, 点击 "创建/分析方法" 并选择 "生成获取和处理方法"。键入方法名称, 浏览到方法文件夹 (目录), 然后单击 "下一步"。
- 对于 "分析类型", 选择 "量化"。选择 "定量检测飞行2D 色谱", 然后点击 "下一步"。在 "仪表系统" 选项卡中, 选择 "Vion IMS QTof", 然后单击 "完成"。
注意: 新创建的飞行时 MRM 方法在 "仪器方法配置" 屏幕中自动打开。 - 在 "设置" 选项卡中, 输入以下参数: 3.0 kV 毛细管电压, 100 °c 源温度, 250 °c desolvation 温度, 50 升/小时锥气流, 500 升/小时 desolvation 气体流量。
- 在 "实验" 选项卡设置中, 选择 "函数表" 并选择 "一个或多个 MS、MSMS 或 MRM 函数"。使用向下箭头, 通过输入三 "过渡" (最丰富的前驱体和三最丰富的片段离子的组合), 为每个肽建立一个 "飞行-MRM" 功能。
注意: 在时间-mrm 模式下, 使用计划的 MRM 方法达到最高灵敏度。 - 在 "时间-MRM" 功能编辑器中, 为每个肽选择一个保留时间窗口 (至少1分钟长), 根据肽洗脱顺序排列。在 "飞行时 MRM" 功能编辑器中, 插入肽前体 m/z 和产品的 m-/z;选择四隔离窗口作为多肽前驱体的 "低" (4 Da 窗口);选择固定扫描时间为100毫秒;在 14-36 V 的范围内选择十二种不同的碰撞能量值, 如下所示:14、16、18、20、22、24、26、28、30、32、34和 36, 如图3中的示例所显示。
注意: 使用上述的飞行时 MRM 方法, 每个色谱峰的每一个过渡都至少收集10个数据点。要减小数据文件大小, 请为片段离子的信号选择 "宽" 选项 (6 Da 窗口)。表2显示了 CE 优化值的示例。 - 通过注射10µL 样品 (在柱上加载的量为每种肽标准的 100 fmol), 分析 10 nM 的、有刺的样品。
5. 采用离子迁移分离肽类前体, 建立最后的 HS-MRM 捕获方法
- 在 "调查" 菜单的数据采集软件, 显示所有11色谱迹为每一个肽生成的每一个, 并集成的峰值使用 "集成" 按钮从 "处理选项/操作" 工具栏;最高峰值区域将表示每个过渡的最佳 CE。
- 在视觉上比较每个肽的3个片段的最佳峰值区域, 只保留最佳的 "过渡" (产生最强烈信号的片段离子);表2显示了从四多肽中获得的最佳 "过渡"。
- 设置一个 HS MRM 方法, 只包含一个片段离子每肽。使用 LC/HDMSE数据集中的每个肽前驱体的 CCS 值。
- 修改上一节 (第4节) 中创建的. mrm 方法, 选择 "HS mrm" 函数, 而不是 "飞行时 mrm" 函数。
- 在 "HS-MRM" 函数编辑器中, 输入以下与前体相关的参数: m-/z, 四极分辨率: 低 (4 Da), 电荷状态, 前体 ccs 值和前体 ccs 分辨率: 低。对于产品离子, 输入其 m-/z, 最佳碰撞能量, 选择扫描时间为0.4 秒, 并选择一个 "宽" 频谱设置 (6 Da), 包括其所有的同位素。图4给出了所有四多肽的最终 HS-MRM 捕获方法的一个例子。
- 使用 HS-MRM 方法分析所有样本, 从单克隆 (非尖刺样本) 开始, 接着4个重复注射 (10 µL) 以下浓度: 0.1、1、10和 100 nM 多肽。
6. 为分析 HS-MRM 数据集建立一个处理方法
- 创建用于分析协 MRM 数据集的处理方法。
- 在为 "HS-MRM" 数据采集方法创建的分析方法中, 单击 "目的" 选项卡, 然后选择 "管理组件"。
- 在 "实验类型" 下的下拉菜单中, 选择 "hs ms/毫秒/hs-MRM" 选项。
- 单击 "创建/新条目" 并在处理方法编辑器中引入以下参数: 肽保留时间 (RT)、前体电荷状态、前体 m/z 和前体漂移时间 (DT)。对于片段离子, 输入其 m-/z 和电荷状态, 并指定 "XIC" 跟踪作为抽取模式。
- 在相同的 "HS-MRM" 捕获方法的 "目的" 选项卡中, 单击 "默认金额", 然后输入以下浓度: 0.1、1、10和 100 nM 多肽。
- 在 "处理/提取设置" 中输入以下参数: 缺省质量公差, 10 ppm (对于所有片段离子的 m/z) 和缺省漂移时间, 5%;如图5所示, 为一例。
- 对于校准类型, 选择 1/X2加权的线性曲线拟合。
- 处理 HS 数据, 整合所有的图谱, 构建每种肽的校准曲线。
结果
表1中列有六种磷酸化酶 b 肽标准的单个序列, 以及它们的保留时间及其在 HDMSE实验中观察到的最丰富的前体。开发高选择性 (HS) MRM 检测的第一步是获取 HDMSE数据集, 以建立每种酸肽的洗脱时间, 以及其相应的最丰富的前驱体和三最丰富的碎片。图2显示了为英摘要中的一个 HDMS 肽 (Pep 6) 而获取的E光谱。在建立了每个肽的3最佳 "过渡" (前体和片段质量的组合) 之后, 进行了一次 MRM 实验, 寻找最佳的碰撞能量, 以最大限度地提高每种肽产生的信号。表2总结了 CE 优化实验的结果。最后的 HS-MRM 检测 (见图 4) 只保留了每个肽的最佳 "过渡", 用于分析所有的尖刺样品。图7给出了在所有浓度调查中产生的4种图谱肽的 HS-MRM 的例子。图8显示了在图7中突出显示的 HS-MRM 峰值集成后为每个肽获得的四校准曲线。此外, 在表3所示的4表中总结了基于4复制注射的峰值面积相对标准偏差。
| 肽 | 肽 | 保留 | 充电状态 | ||||
| Id | 序列 | 时间 (分钟) | + 1 | + 2 | + 3 | + 4 | |
| Pep 1 | VLYPNDNFFEGK | 19。4 | 1442.6951 | 721.8512 | 481.5699 | 361.4292 | |
| Pep 2 | TCAYTNHTVLPEALER | 16。0 | 1874.9065 | 937.9569 | 625.6404 | 469.4821 | |
| Pep 3 | IGEEYISDLDQLRK | 18。9 | 1678.8646 | 839.9360 | 560.2931 | 420.4716 | |
| Pep 4 | LLSYVDDEAFIR | 21。1 | 1440.7369 | 720.8721 | 480.9172 | 360.9397 | |
| Pep 5 | LITAIGDVVNHDPVVGDR | 19。7 | 1890.0080 | 945.5076 | 630.6742 | 473.2574 | |
| Pep 6 | VFADYEEYVK | 17。7 | 1262.5939 | 631.8006 | 421.5362 | 316.4039 | |
表1。在英文摘中, 大量准备混合中含有的含肽标准。肽保留时间及其最丰富的前体 (以粗体突出显示) 以表格格式显示。
| 肽 | 肽 | 保留 | 肽前驱体 | 最丰富的片段离子/电荷 | 优化 | ||||
| Id | 序列 | 时间 (分钟) | m/z & 充电 | 漂移时间 (毫秒) | 我 | 第二 | 第三 | 行政长官 (V) | |
| Pep 2 | TCAYTNHTVLPEALER | 16。0 | 625.6404 (升 3) | 6。2 | 714.3781 (升 1) | 807.4177 (升 2) | 827.4621 (升 1) | 24 | |
| Pep 4 | LLSYVDDEAFIR | 21。1 | 720.8721 (升 2) | 7。5 | 865.4050 (升 1) | 964.4734 (升 1) | 1214.5688 (升 1) | 22 | |
| Pep 5 | LITAIGDVVNHDPVVGDR | 19。7 | 630.6742 (升 3) | 6。3 | 642.3570 (升 1) | 689.8391 (升 2) | 832.4236 (升 2) | 20 | |
| Pep 6 | VFADYEEYVK | 17。7 | 631.8006 (升 2) | 7。0 | 830.3931 (升 1) | 945.4200 (升 2) | 1016.4571 (升 1) | 24 | |
表2。实验结果表明: 本研究中每种骨肽的三个最丰富的片段, 以及相应的最佳碰撞能量。
| 轻质 | 量 | Pep 2 高峰区 (表 3A) | |||||
| 毫微米) | 专栏 (fmoles) | Rep01 | Rep02 | Rep03 | Rep04 | 意味 着 | 区署 (%) |
| 0。1 | 1 | 490 | 439 | 462 | 431 | 456 | 5。8 |
| 1 | 10 | 5121 | 4842 | 5198 | 4842 | 5001 | 3。7 |
| 10 | 100 | 63853 | 64279 | 66111 | 62509 | 64188 | 2。3 |
| 100 | 1000 | 612392 | 605553 | 613229 | 611004 | 610545 | 0。6 |
| 轻质 | 量 | Pep 4 高峰区 (表 3B) | |||||
| 毫微米) | 专栏 (fmoles) | Rep01 | Rep02 | Rep03 | Rep04 | 意味 着 | 区署 (%) |
| 0。1 | 1 | 275 | 359 | 325 | 288 | 312 | 12。2 |
| 1 | 10 | 3559 | 3694 | 3287 | 3754 | 3574 | 5。8 |
| 10 | 100 | 45259 | 45775 | 42976 | 45548 | 44890 | 2。9 |
| 100 | 1000 | 459374 | 467927 | 436272 | 458994 | 455642 | 3。0 |
| 轻质 | 量 | Pep 5 高峰区 (表 3C) | |||||
| 毫微米) | 专栏 (fmoles) | Rep01 | Rep02 | Rep03 | Rep04 | 意味 着 | 区署 (%) |
| 0。1 | 1 | 3194 | 3243 | 3202 | 3257 | 3224 | 1。0 |
| 1 | 10 | 31464 | 31150 | 31464 | 31433 | 31378 | 0。5 |
| 10 | 100 | 313638 | 320712 | 311943 | 311943 | 314559 | 1。3 |
| 100 | 1000 | 2845736 | 2840031 | 2882006 | 2864052 | 2857956 | 0。7 |
| 轻质 | 量 | Pep 6 高峰区 (表 3D) | |||||
| 毫微米) | 专栏 (fmoles) | Rep01 | Rep02 | Rep03 | Rep04 | 意味 着 | 区署 (%) |
| 0。1 | 1 | 490 | 583 | 440 | 440 | 488 | 13。8 |
| 1 | 10 | 6429 | 6429 | 6848 | 6623 | 6582 | 3。0 |
| 10 | 100 | 71295 | 70400 | 71563 | 70400 | 70915 | 0。9 |
| 100 | 1000 | 707640 | 707640 | 694461 | 729490 | 709808 | 2。0 |
表3。表中包含的 HS-MRM 图谱的峰值面积 (Pep 2, 4, 5 和 6) 为每一个 lc/ms 注射液 (16 lc/ms 运行和4浓度测试)。
相对标准偏差优于15% 为所有肽在整个浓度范围调查。

图1。工作流图总结了设置 HS MRM 捕获方法所需的三步骤.请单击此处查看此图的较大版本.
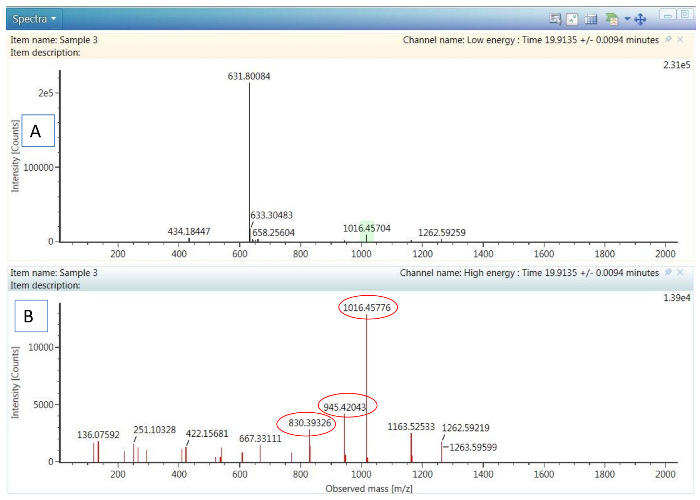
图2。HDMSE 数据示例:
(A) 显示 Pep 6 前体离子的低能谱。(B) 同一肽的高能碎片谱, 显示3最丰富的碎片离子 (带圆圈), 用于飞行时-MRM 碰撞能量优化。请单击此处查看此图的较大版本.

图3。用于设置飞行时 MRM 优化实验的参数。
对于每个过渡, 测试了十一个碰撞能量 (在16到 36 V 的范围内)。请单击此处查看此图的较大版本.
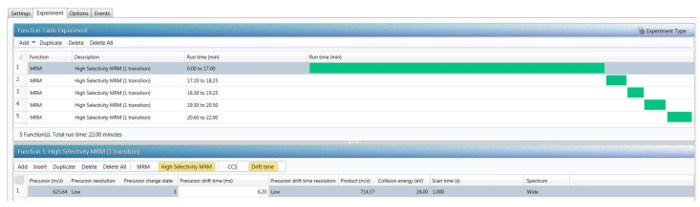
图4。最后的 HS-MRM 方法的示例。
每个 "过渡" 都需要几个参数, 包括肽前体 m-/z、电荷态和离子迁移时间、最丰富片段离子的 m-/z、最佳碰撞能量和 MS 采集时间。请单击此处查看此图的较大版本.
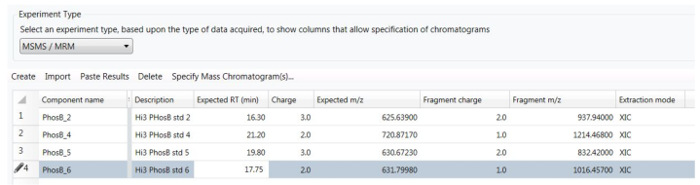
图5。处理方法用于分析 HS MRM 数据集的设置。
每一个肽由肽前体 m/z、电荷状态和预期保留时间所描述的单一 "过渡" 来监测, 以及最丰富片段及其电荷状态的 m-/z。请单击此处查看此图的较大版本.

图6。离子流动质谱仪的图。
在 HS-MRM 捕获模式中, 正在量化的肽的前体与离子迁移细胞中的其他共洗脱 (干扰) 肽前体分离, 由四极分离, 并在碰撞细胞。通过调整推板频率来增强肽片段离子产生的信号, 并利用各肽最强片段离子产生的高分辨率 (> 3万) 信号进行肽量化。请单击此处查看此图的较大版本.

图7。HS-MRM 图谱记录了4种在4不同浓度, 3 级 (0.1, 1, 10, 100 毫微米) 的多肽。
(A) pep 2 图谱, (B) pep 4 图谱, (C) pep 5 图谱和 (D) pep 6 图谱。请单击此处查看此图的较大版本.
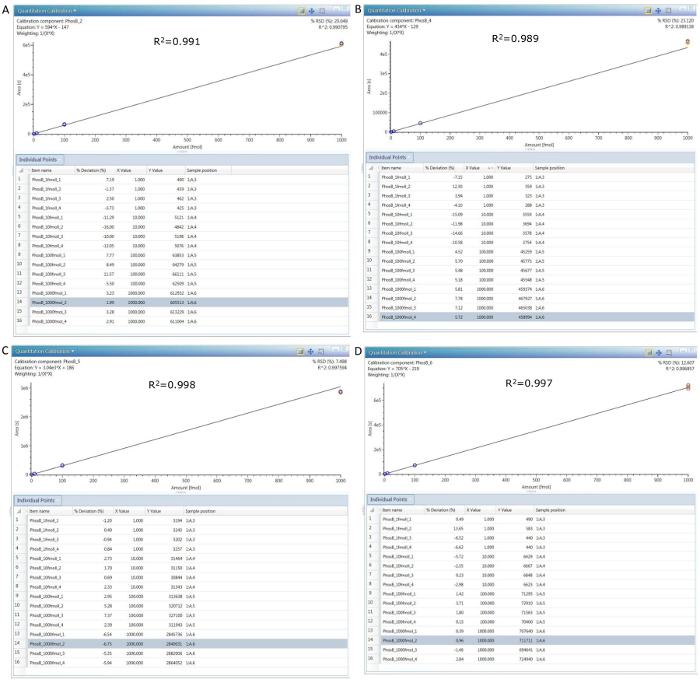
图8。4种不同浓度 (0.1、1、10和 100 nM) 的4米多肽的校准曲线。
每个曲线下的表显示每个注入记录的单个峰值区域 (Y 值), 而每个表中的第二列显示预期线性响应的百分比偏差。(A) pep 2 校准, (B) pep 4 校准, (C) pep 5 校准, (D) pep 6 校准。请单击此处查看此图的较大版本.
讨论
高分辨率 (Rs > 2万) 质谱法通常用于各种仪器平台上治疗蛋白的结构表征。相比之下, 基于 MS 的蛋白质量化通常是用 SRM/MRM 在低分辨率 (Rs ~ 1000) 串联四极质谱仪上使用由蛋白质酶解裂解产生的特征肽11,12,13,14,15,16,17,18,19,20,21,22,23. 由于单维色谱分离不能完全解决酶消化产生的复杂肽混合物, 因此, 即使是单蛋白消化, 肽共洗也是常见的现象。对于非常复杂的蛋白质文摘 (例如,在治疗蛋白产生的富含多肽背景的情况下量化 1-100 ppms HCPs), SRM/MRM 测定的灵敏度、准确度或线性度可能受干扰。
SRM/MRM 检测具有维选择性, 只依赖于 "独特" 的前体/片段质量组合。因此, 当肽背景发生意外变化 (例如从不同的纯化过程获得的生物制药样品) 时, 这些化验结果会失败。为了克服这些局限性, 我们提出了一种高选择性 (HS) MRM 检测方法, 该方法在离子移动性高分辨率四极飞行时间 (QTOF) 混合质谱仪 (仪表图 6) 上实现。
该仪器将感兴趣肽的前体与离子迁移细胞中的其他共洗脱 (干扰) 肽前体分离, 将四极中前驱体的完整同位素包层分离, 并将其与固定的 CE 分割在碰撞细胞。通过调整推送频率 (目标增强), 可选择性地将感兴趣的质量区域推送到飞行管中, 而不是所有的离子, 就像完全扫描一样, 由其最丰富的肽片段产生的信号进一步增强。肽量化是使用该片段离子产生的高 MS 分辨率 (Rs ~ 3万) 信号进行的。与 SRM/mrm 测定法相比, HS mrm 检测提供了两种额外的选择性: 一种是由前驱体级离子流动分离提供的, 而第二种则是由飞行时间分析仪的质量分辨率增加而提供的。这些选择性改进所带来的结果在图7中显示的 HS MRM 图谱中可见, 在三级范围内没有干扰。
与 SRM/mrm 检测不同, 有几个参数可以调整以优化 HS-mrm 检测: 在肽前驱体周围的 RT 窗口 (通常设置在0.2 分钟), 四极隔离窗口 (4 Da), 漂移时间窗口围绕前体 (FWHM 的前驱峰从相应的离子 mobilogram), 和 MS 分辨率的片段离子 (2000万)。HS-MRM 检测是非常敏感的: 每种 femtomole 肽含量最低的测定量是1在柱上 (或 0.1 nM 在肽浓度方面)。当考虑肽兆瓦 (参见表1为准确 MWs), 在专栏被发现的数量是以 1-2 pg 的顺序, 而专栏被装载与一个显著地更高的数量 (2 µg) 背景肽从抗体文摘。
通过考虑提取尖肽的全长 kDa 蛋白 (97.2) 的分子量, 该检测能够检测出高丰度背景离子存在下蛋白质杂质的 50 ppm。更低的检测限度 (5-10 ppm) 是可以实现的低分子量 HCPs (10-20 kDa)。该检测涵盖三级 (如图8中的校准曲线所示), 这意味着它可以测量1-1、000 ppm 范围内的 HCPs。此外, 表3所示的 HS MRM 测定的重现性与小分子 SRM/MRM 测定的重现性非常吻合, 峰值面积 RSDs 优于15%。
我们探讨了一种新的检测方法, 以定量的尖刺肽标准的单克隆抗体 (克隆) 文摘, 并表明其灵敏度和效用, 以涵盖广泛的动态范围 (至少三级数量) 通常在分析中遇到。所有六肽标准检测的浓度低至 0.1 nM (1 femtomole 载于2.1 毫米的 ID 色谱柱) 存在高丰度肽背景 (2 µg 的单克隆人的摘要载列)。通过将靶向 HRMS 和离子流动前体分离结合起来, HS MRM 检测具有很大的潜力, 能够成为跨多批次生物的多 HCPs 的快速、高通量监测检测。
披露声明
所有作者都是水公司的雇员, 这是本文使用的几种试剂和仪器的生产者。
致谢
作者要感谢 Malouin 和托尼卡特林从水公司准备的手稿图6。
材料
| Name | Company | Catalog Number | Comments |
| Vion IMS Qtof mass spectrometer | Waters | 186009214 | |
| Acquity H-Class Quaternary solvent manager (QSM) | Waters | 186015041 | |
| Acquity H-Class FTN Sample Manager (SM) | Waters | 186015040 | |
| Acquity H-Class Column Manager (CM) | Waters | 186015043 | |
| Acetonitrile (ACN) | Fisher Chemical | A996-4 | |
| Ammonium bicarbonate | Sigma Aldrich | 40867-50G-F | |
| 2.1 x 150 mm CSH C18 UPLC column, 1.8 µm particles | Waters | 186005298 | |
| Dithiothreitol (DTT) | Sigma Aldrich | D5545-5G | |
| Formic acid, eluent additive for LC/MS | Sigma Aldrich | 56302-10X1ML-F | |
| Hi3 rabbit phosphorylase (PHO) MassPREP standard | Waters | 186006011 | |
| Iodoacetamide (IAM) | Sigma Aldrich | I-1149-5G | |
| LC vials (12x32 mm glass vials, screw neck) | Waters | 186000327c | |
| Leucine Enkephalin acetate salt hydrate | Sigma Aldrich | L9133-10MG | |
| Protein LoBind 2.0 mL tubes (2x50) | Eppendorf | 22431102 | |
| RapiGest SF | Waters | 186001861 | |
| Trypsin/Lys-C enzyme mix, mass spec grade (5 x 20 µg) | Promega | V5073 | |
| Water, LC/MS grade | Sigma Aldrich | 39253-1L-R |
参考文献
- Doneanu, C. E., et al. Analysis of host-cell proteins in biotherapeutic proteins by comprehensive online two-dimensional liquid chromatography/mass spectrometry. MAbs. 4, 24-44 (2012).
- Schenauer, M. R., Flynn, G. C., Goetze, A. M. Identification of host-cell protein impurities in biotherapeutics using mass spectrometry. Anal Biochem. 428, 150-157 (2012).
- Zhang, Q., et al. Comprehensive tracking of host-cell proteins during monoclonal antibody purifications using mass spectrometry. MAbs. 6, 659-670 (2014).
- Farrell, A., et al. Quantitative host-cell protein analysis using two-dimensional data independent LC-MS(E). Anal Chem. 87, 9186-9193 (2015).
- Doneanu, C. E., et al. Enhanced detection of low-abundance host cell protein impurities in high-purity monoclonal antibodies down to 1 ppm using ion mobility mass spectrometry coupled with multidimensional liquid chromatography. Anal Chem. 87, 10283-10291 (2015).
- Doneanu, C. E., et al. Improved identification and quantification of host cell proteins (HCPs) in biotherapeutics using liquid chromatography mass spectrometry. Technologies for therapeutic monoclonal antibody characterization, vol. 3: Defining the next generation of analytical and biophysical techniques. , Washington DC. ACS Symposium series 1202 357-393 (2015).
- Zhang, Q., et al. Characterization of the co-elution of host-cell proteins with monoclonal antibodies during protein A purification. Biotechnol Prog. 32, 708-717 (2016).
- Reisinger, V., Toll, H., Mayer, R. E., Visser, J., Wolschin, F. A mass spectrometry based approach to host cell protein identification and its application in a comparatibility exercise. Anal Biochem. , 1-6 (2014).
- Madsen, J. A., et al. Toward the complete characterization of host-cell proteins in biotherapeutics via affinity depletions, LC/MS/MS and multivariate analysis. MAbs. 7, 1128-1137 (2015).
- Giles, K., et al. Applications of a trevelling wave-based radio-frequency-only stacked ring ion guide. Rapid Commun Mass Spectrom. 18, 2401-2414 (2004).
- Anderson, V., Hunter, C. L. Quantitative mass spectrometric multiple reaction monitoring assays for major plasma proteins. Mol Cell Proteomics. 5, 573-588 (2006).
- Lange, V., Picotti, P., Domon, B., Aebersold, R. Selected reaction monitoring for quantitative proteomics: a tutorial. Mol Syst Biol. 4, 1-14 (2008).
- Picotti, P., et al. High-throughput generation of selected reaction-monitoring assays for proteins and proteomes. Nat Methods. 7, 43-46 (2010).
- Zhao, L., et al. Quantification of proteins using peptide immunoaffinity enrichment coupled with mass spectrometry. J Vis Exp. (53), (2011).
- Liebler, D. C., Zimmerman, L. J. Targeted quantitation of proteins by mass spectrometry. Biochemistry. 52, 3797-3806 (2013).
- Manes, N. P., Mann, J. M., Nita-Lazar, A. Selected reaction monitoring mass spectrometry for absolute protein quantification. J Vis Exp. (102), (2015).
- Ebhardt, H. A., Sabido, E., Huttenhain, R., Collins, B., Aebersold, R. Range of protein detection by selected/multiple reaction monitoring mass spectrometry in an unfractioned human cell culture lysate. Proteomics. 12, 1185-1193 (2012).
- Picotti, P., Bodenmiller, B., Mueller, L. N., Domon, B., Aebersold, R. Full dynamic range proteome analysis of S. cerevisiae by targetted proteomics. Cell. 138, 795-806 (2009).
- Sherman, J., McKay, M. J., Ashman, K., Molloy, M. P. How specific is my SRM: the issue of precursor and product ion reductancy. Proteomics. 9, 1120-1123 (2009).
- Abbatiello, S. E., Mani, D. R., Keshishian, H., Carr, S. A. Automated detection of innacurate and imprecise transitions in peptide quantification by multiple reaction monitoring mass spectrometry. Clin Chem. 56, 291-305 (2010).
- Rost, H., Malmstrom, L., Aebersold, R. A computational tool to detect and avoid redundancy in selected reaction monitoring. Mol Cell Proteomics. 11, 540-549 (2012).
- Bao, Y., et al. Detection and correction of interference in SRM analysis. Methods. 61, 299-303 (2013).
- Maclean, B., et al. Effect of collision energy optimization on the measurement of peptides by selected reaction monitoring (SRM) mass spectrometry. Anal Chem. 82, 10116-10124 (2010).
- Mbasu, R. J., et al. Advances in quadrupole and time-of-flight mass spectrometry for peptide MRM based translational reserch analysis. Proteomics. 16, 2206-2220 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。