Method Article
Denatüre edici olmayan poliakrilamid jel elektroforez kullanılarak insan mxa Çok alt birim protein kompleksleri karakterizasyonu
Bu Makalede
Özet
This article describes a simple and rapid protocol to evaluate the oligomeric state of the dynamin-like GTPase MxA protein from lysates of human cells using a combination of non-denaturing PAGE with western blot analysis.
Özet
The formation of oligomeric complexes is a crucial prerequisite for the proper structure and function of many proteins. The interferon-induced antiviral effector protein MxA exerts a broad antiviral activity against many viruses. MxA is a dynamin-like GTPase and has the capacity to form oligomeric structures of higher order. However, whether oligomerization of MxA is required for its antiviral activity is an issue of debate. We describe here a simple protocol to assess the oligomeric state of endogenously or ectopically expressed MxA in the cytoplasmic fraction of human cell lines by non-denaturing polyacrylamide gel electrophoresis (PAGE) in combination with Western blot analysis. A critical step of the protocol is the choice of detergents to prevent aggregation and/or precipitation of proteins particularly associated with cellular membranes such as MxA, without interfering with its enzymatic activity. Another crucial aspect of the protocol is the irreversible protection of the free thiol groups of cysteine residues by iodoacetamide to prevent artificial interactions of the protein. This protocol is suitable for a simple assessment of the oligomeric state of MxA and furthermore allows a direct correlation of the antiviral activity of MxA interface mutants with their respective oligomeric states.
Giriş
Bir proteinin kuaterner yapı, birçok hücresel süreçlerde önemli bir rol oynar. Sinyal yolları, gen ifadesi ve enzim devreye alma / devreden tüm protein kompleksleri 1-4 doğru montaj güveniyor. Ayrıca, homo veya hetero-oligomerizasyonu olarak da bilinen bu proses geri dönüşü olmayan kovalent ya da geri dönüşümlü, elektrostatik ve hidrofobik protein-protein etkileşimleri kaynaklanmaktadır. Oligomerizasyon genom boyutunu artırmadan farklı hücresel süreçleri çeşitlendirmektedir, ancak proteinler denatürasyon ve yıkımı 5 karşı daha dirençli kararlı kompleksler inşa etmek için de bir strateji sağlar sadece. oligomerizasyonu bozukluklar protein fonksiyonu üzerinde bir etkisi vardır ve hastalığın gelişmesine yol açar. Örneğin, enzim, fenilalanin hidroksilaz tetrameric kompleks oluşturur. Protein kompleksi içindeki bazı mutasyonlar tetramer oluşumu zayıflatmak ve hastalık fenilketonüri 6 yol açabilir.
insan MxA proteini anti-viral, çeşitli RNA karşı geniş bir anti-viral aktivitesi uygulayıcı efektör protein hem de DNA virüslerini 7 indüklenen bir interferon (IFN) 'dir. Bu Dynamin-gibi büyük GTPases üst ailesine ait olan ve in vitro 8 büyük oligomerik yapıları oluşturma kapasitesine sahiptir. Oligomerizasyonu, hızlı bozulmaya 9,10 arasında mxa korumak için önerilmiştir. Birçok araştırma grubu tarafından yoğun çabalarına rağmen, eylem moleküler mekanizması büyük ölçüde belirsiz kalır ve antiviral işlevi için mxa oligomerizasyon devletin rolü tartışma 9,11,12 altındadır. Bu bağlamda, Gao ve ark MxA büyük halka benzeri oligomerik yapılarının 11 şeklinde viral Nükleoproteinlerin ile etkileşerek antiviral aktivite sergiler bir model önerdi. Ancak, son zamanlarda biz MxA dimerleri antivirütik aktivite sergilerler ve grip A virüsü 12 nükleoprotein ile etkileşim olduğu gösterilmiştir. Bmxa kristal yapısına ased Gao ve çalışma arkadaşları, in vitro olarak oligomerizasyonu ve antiviral fonksiyonu 11,13 için kritik olan arayüz bölgelerde çeşitli amino asit kalıntıları tespit edilmiştir. Bu nedenle, anti-viral aktivite sergiler mxa oligomerik çizen aydınlatmak üzere, hızla endojen MxA IFNa uyarıldıktan sonra ifade hem de insan hücrelerinde ifade edilen bir MxA arayüz mutantlarının oligmeric durumunu belirlemek için basit bir protokol için çalışmıştır.
Gibi yaygın bölünmüş Yeşil Floresan Protein olarak proteinler arasındaki etkileşimi araştırmak için kullanılan birçok teknik olmasına rağmen (split-GFP) tamamlama deneyi 14, yüzey plazmon rezonans 15 ve Förster rezonans enerji transferi (FRET) 16, onlar vermeyin bir oligomerik bir protein kompleksinin tam stokiyometri bilgiler. bu özel yanının araştırılması için teknikler gibiçok açılı bir ışık saçılım (MALS) 17 ve analitik ultrasantrifügasyon 18 çok kullanışlıdır. Genellikle, bu yöntemler kullanılarak analiz proteinler saflaştırılmış proteinlerdir. Oligomerleştirme işlemleriyle, diğer hücresel faktörlere bağlı olabilir. Bu faktörler bilinmiyorsa, analiz çok daha zordur. Ayrıca, bazı proteinler E. ifade etmek zordur E. coli ve saflaştırılması için. Bu nedenle, bu yöntemler hücresel ortamda protein oligomerizasyon analiz için en uygun seçenek değildir. Buna ek olarak, bu teknikler hazır olmayan pahalı aletleri gerektirir.
Denatüre edici olmayan poliakrilamid jel elektroforezi (PAGE), boyut dışlama kromatografisi ya da geleneksel sodyum dodesil sülfat (SDS) sayfalık, ardından kimyasal çapraz bağlama hücre lizatları 2,19,20 gelen oligomerlerin oluşma özellikleri için yararlı araçlardır. Bu yöntemler özel ekipman gerektirmez ve kolayca pe olabilirStandart bir laboratuarda rformed. Başlangıçta değişmez spesifik olmayan birleşimine ve mxa çökelmesine yol çeşitli kimyasal çapraz bağlama protokolleri değerlendirildi. Bu nedenle, önümüzdeki olmayan denatüre SAYFA protokolleri test etti. olmayan denatüre SAYFA SDS kullanımını hariç olarak, proteinlerin göç kendi ana şarj bağlıdır. Mavi yerel PAGE SDS benzer bir negatif yük, proteinleri yüklemek için Coomassie parlak mavisi G250 kullanır, ancak protein 21 denatüre etmez. Ne yazık ki, yüksek tuzlar ve genellikle lizis tampon içerdiği iki değerlikli katyonlar (örneğin, Mg + 2) varlığında, parlak mavi çökeltileri coomassie. kullanılan tamponlar bağlı olarak, oligomerik protein kompleksi üzerinde bir etkiye sahip olabilir adımların daha fazla optimizasyon yapmadan numuneyi analiz etmek zor olabilir.
Burada oligomerizasyonuna belirlemek için, daha önce yayınlanan bir yöntem 22 dayalı basit bir protokol mevcutdenatüre PAGE kullanılarak hücre lizatları elde edilen insan MxA proteini.
Protokol
NOT: Bu protokol daha önce yayınlanmış denatüre PAGE protokolü 12 dayanır. Bu çalışmada, bir MxA proteininin oligomerik durumu endojen mxa ifade mxa aşırı ifade Vero hücreleri ya da IFN-α-uyarılmış A549 hücreleri kullanılarak tayin edilmiştir. Aşağıda açıklanan protokol mxa ek olarak herhangi bir protein oligomerik durumunu analiz etmek için kullanılabilir. Ancak, daha fazla optimizasyon gerekli olabilir.
Denatüre edici olmayan PAGE için hücre lizatının hazırlanması 1.
Not: her iki Vero ve A549 hücrelerinde insan MxA proteininin oligomerik durumunu analiz etmek için, 1.0 x 10 6 hücre hasat edilmiştir. hücre tipi veya analiz etmek için protein bolluğu ile ilgili olarak, hücre sayısı ayarlanmalıdır. En kısa ışığa duyarlı iyodoasetamid eklendiğinde, ışığa maruz kalmaktan lizis tamponu korumak için de önemlidir.
- Kuyu başına Tohum 0,3 x 10 6 A549 veya Vero hücrelerinde6 iyi yemekleri. Oyuk başına 2 ml büyüme ortamı içinde hücre tutulur (bakınız Tablo 1). Bir hücre kültür inkübatörü içinde bir gece boyunca inkübe hücreleri (37 ° C,% 5 CO2).
- fosfat tamponlu tuzlu su (PBS), 1 ml ile yıkanır hücreleri hasat ve 0.5 ml 0.25% tripsin etilendiamintetraasetik asit (EDTA), oda sıcaklığında yaklaşık olarak 5 dakika boyunca 1 x çözeltisi ilave edilerek çıkarın.
- En kısa sürede hücreler çanak ayırmak gibi 0.5 ml besi ekleyin ve dikkatlice yukarı ve aşağı pipetleme karıştırın.
- iyi bir 2 ml tüp içine her hücreleri aktarın ve bir masa üstü santrifüj (5000 xg, 4 ° C, 5 dk) kullanarak onları pelet.
- Dikkatle hücre pelletini bozmadan pipetleme süpernatant kaldırmak.
- dikkatle yukarı ve aşağı hücre süspansiyonu pipetle 1 ml buz gibi soğuk PBS ile hücreleri yıkayın.
- bir masa üstü santrifüjde Pelet hücreleri (5,000 xg, 4 ° C, 5 dakika).
- Dikkatle wi pipetleme süpernatant kaldırmakHücre topaklarını ayırma thout.
- Yukarı ve aşağı pipetleme ve buz koymak tarafından 200 ul buz gibi soğuk lizis tamponu (bakınız Tablo 1) yeniden süspanse hücreleri.
- Hemen sonra, teneke folyo kullanarak ve buz üzerinde 30 dakika inkübe edilir tüpler kaplayarak ışıktan lizat korur.
Not: serbest tiol gruplarının korunması geri çevrilemez olduğu, buz üzerinde 30 dakika süre ile inkübe edildikten sonra, artık ışığa maruz kalmaktan lizat korumak için esastır. - önceden soğutulmuş bir masa üstü santrifüj (13,000 x g, 4 ° C, 20 dakika) içinde santrifüjleme ile hücre debrisini uzaklaştırmak.
- Santrifüj aşaması esnasında, 20 dakika boyunca 4 ° C 'de soğuk bir odada, diyaliz tampon maddesi (Tablo 1) diyaliz sütun dengelenmesi. 10.000 kesilmiş bir moleküler ağırlığa sahip bir sütun kullanarak.
- Bir şamandıra şamandıra sütunlar takın ve diyaliz tamponu ile dolu bir beher içine koydu. hafif karıştırma sağlamak için, bir manyetik karıştırıcı kullanın. membran dokunmayın.
NOT: Dialyssütun satın alınabilir veya Fiala ve çalışma arkadaşları 19 tarafından tarif edilen protokole göre 1.5 ml tüpler hazırlanabilir edilir.
- Bir şamandıra şamandıra sütunlar takın ve diyaliz tamponu ile dolu bir beher içine koydu. hafif karıştırma sağlamak için, bir manyetik karıştırıcı kullanın. membran dokunmayın.
- diyaliz tamponu ve şamandıra şamandıra sütunları çıkarın. membran dokunmadan pipetleme hazırlanmış diyaliz sütuna temizlenir lizatları aktarın. Bir şamandıra şamandıra sütunlar takın ve diyaliz tamponu ile dolu beher içine geri koyun.
- Dikkatli bir şekilde manyetik bir karıştırıcı kullanılarak karıştırılarak, 4 ° C'de en az 4 saat (ya da tercihen bir gece) buz soğukluğunda diyaliz tampon (Tablo 1) ihtiva eden bir beher içinde lizat dialyze. 200 ul lizat için en az 100 mi diyaliz tampon kullanın.
- 1.5 ml tüp içine diyaliz örnek aktarın. bir masa üstü santrifüj (13,000 x g, 4 ° C, 20 dakika) içinde santrifüjleme ile çökeltileri uzaklaştırmak. kompleksler hemen diyalizden sonra protokolü (bölüm 2) ile devam oligomerik protein ayrışmasını önlemek için. donma yokHazırlanan lizatları.
2. Elektroforez
Not: bazı değişiklikler 22 daha önce anlatıldığı gibi Elektroforez uygulandı. Aşağıda tarif edilen protokol, ön döküm gradyan jelleri (% 4-15 gradyan) kullanılmıştır. Seçenek olarak ise, jeller laboratuarda hazırlanabilir. SDS oligomerik protein kompleksleri ayrışmasını önlemek için gibi herhangi bir denatüre etme maddesini dahil etmek çok önemlidir. elektroforez Zaman insan MxA proteinin farklı oligomerik devletler için optimize edilmiştir. Bununla birlikte, bu oligomerik kompleksinin büyüklüğü gibi karmaşık analiz elde edilebilir gerekiyordu ayırma aralığına bağlı olarak, diğer proteinler için değişebilir. Bu nedenle, elektroforez optimal zaman deneysel olarak tespit edilmelidir. oligomerlerin optimal çözünürlük analiz edilmesi için akım 25 mA geçmemelidir.
- Jel odasında sigara denatüre SAYFA jel birleştirin. t doldurunÖnceden soğutulmuş çalışan tamponu (Tablo 1) de, iç ve dış oda.
- 4 ° C'de soğuk bir odada 15 dakika boyunca jel başına 25 mA önceden soğutulmuş çalışan tampon maddesi ile jel ön çalıştırın.
- 4x numune tamponu, 5 ul (Tablo 1), yukarıda hazırlanan lizatlar 15 ul karıştırın. örnek kaynatmayın.
- 15 örnek ul ve jel üzerinde seçim doğal protein standardı yükleyin. 4 ° C'de soğuk bir odada 4 saat 25 mA'da jel üzerinde çalıştırıldı.
Not: yarı-nicel analiz için, bir protein miktar protokol (örneğin, bir Bradford protein tahlili 23) şerit başına toplam protein eşit miktarlarda yükleme sağlamak için gerçekleştirilebilir.
3. Western Blot
NOT: Aşağıda açıklanan ıslak western blot sistemi protokolüdür. Herhangi bir kurutma membran kullanılabilir. tampon ile kurutma bölgesi dengeleme önce% 100 metanol poliviniliden florür (PVDF) zarlara etkinleştirmefer. Yarı-kuru western blot alternatif olarak kullanılabilir, ancak büyük oligomerik kompleksleri için optimize edilmiş olması gerekir.
- Jel sökün ve dikkatlice SDS tamponu (Tablo 1) içine aktarın.
- hafifçe çalkalanarak oda sıcaklığında 10 dakika boyunca inkübe edin.
- 2 süngerler, 4 selüloz filtre kağıdı çarşaf ve jel başına bir kurutma membran hazırlayın. Tampon (Tablo 1) blotting onları ıslatın.
- 1 sünger, 2 selüloz filtre kağıdı levhalar, membran, jel, 2 selüloz filtre kağıdı yaprak, 1 sünger: (aşağıdan yukarıya) aşağıdaki gibi sandviç birleştirin.
- lekeleme tankına sandviç koyun. Jel eksi kutup yüzleri ise membran artı kutbu karşı karşıya olduğundan emin olun.
- Önceden soğutulmuş lekeleme tampon ile blot doldurun.
- en iyi protein aktarımı sonucu, 4 ° C'de bir gece boyunca 90 mA'da kurutun.
- sandviç sökün ve Ponç membran inkübe edilerek protein standardı görselleştirmekOda sıcaklığında 5 dakika boyunca eau çözüm.
- açıkça protein standardı bantları görünceye kadar dikkatli deiyonize su ile Ponceau S yıkayarak membranın destain.
- Bir kalem kullanarak protein standardı bantları işaretleyin.
NOT: Artık Ponceau S immün engelleyebilir. Bunu önlemek için, membran deiyonize su ile 1 dakika ve daha sonra yıkama için 0.1 M NaOH içinde inkübe edilerek, daha boyası olabilir. - Blokaj tamponu ile membran bloke oda sıcaklığında en az 1 saat veya gece boyunca 4 ° C (Tablo 1 e bakınız).
- Analiz edilecek proteine karşı yöneltilmiş antikorlar kullanılarak imüno-boyama ile ilgili proteini (ler) görselleştirme.
Not: tampon (Tablo 1) bloke 1000: insan MxA proteininin insan MX1 özgü tavşan poliklonal antikoru kullanılarak görselleştirilmiştir 1 seyreltilmiştir. antikor çözeltisi 4 ° C'de gece boyunca inkübe edildi. Seçenek olarak ise, monoklonal birnti-MxA antikoru (klon 143) 24 (veriler gösterilmemiştir) kullanılabilir.
Sonuçlar
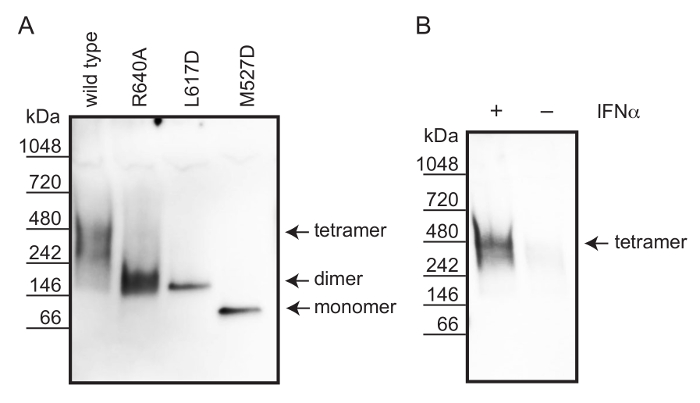
Denatüre PAGE kullanılarak, insan vahşi tip bir MxA, dimerik arayüz mutantlan MxA (R640A) ve MxA (L617D) yanı sıra hücre lizatları 12 monomerik arayüz mutant MxA (M527D) oligomerik durumunu analiz edilmiştir. Hücreler,% 1 oktilfenoksipolietoksietanoldür (NP-40) ve iyodoasetamid, protein çözünürlüğünü ve serbest tiol gruplarının korunmasını sağlamak için ihtiva eden bir tampon maddesi içinde lize edilmiştir (bakınız Şekil 1). Daha önce tarif edildiği gibi, bir tuzu ve küçük metabolitler diyaliz 19 yoluyla uzaklaştırılmıştır. Protein ayırma denatüre PAGE ile yapıldı. etkin Western blotting kolaylaştırmak için, jel lekeleme SDS tamponu içinde inkübe edildi. MxA proteinleri mxa karşı yönlendirilen bir tavşan poliklonal antikoru kullanılarak immün-boyama yoluyla görselleştirilmiştir. Iş akışı, Şekil 2'de açıklanmıştır.
IFN-a'dan endojen insan MxA proteininin oligomerik durumunu karşılaştırmak ; uyarılmış A549 hücreleri, rekombinant vahşi tipli, monomerik ve dimerik MxA varyantları ile (endojen mxa eksik) Vero hücreleri transfekte edildi. Lekelenmemiş doğal protein markeri (Şekil 3A) ile karşılaştırıldığında bu rekombinant yabani tipteki, monomerik ve dimerik MxA sırasıyla sabit tetramerleri, monomerler ve dimerler, oluşan varyantları. Bu nedenle, IFN-a türetilen endojen insan MxA proteininin oligomerik durumu A549 hücreleri stimüle. Şekil 3B, IFN-α-uyarılmış A549 hücrelerinin lizatları içinde mxa boyutu tetramer tekabül ortaya değerlendirmek için, bu yeniden birleştirici proteinler, kullanılan.
Birlikte ele alındığında, hücre lizatı insan MxA proteininin oligomerik durumunu belirlemek için bir yöntem açıklanmaktadır. Bizim denatüre sayfa yaklaşım, diğer oligomerik protein kompleksleri oligomerik durumunu değerlendirmek için de kullanılabilir.
83 / 54683fig1.jpg "/>
Şekil 1:. Iyodoasetamit Yapısı ve reaksiyon şeması İyodoasetamid geri dönüşü olmayan bir tiyoeter bağı oluşturularak serbest sistein tiyol grubu korur. Sistein kükürt atomu ile iyot nükleofilik ikamesi bu istikrarlı modifikasyon sonuçları. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Şekil 2:. Denatüre PAGE Akışı diyagramı hücre lizatlarının denatüre sayfa yaklaşımı sistematik temsili. Hücre lizizi sırasında deterjan proteinleri çözünür ve tiol grupları, protein agregasyonunu önlemek için iyodoasetamit ile korunmaktadır. Diyaliz olmayan denatüre PAGE ile müdahale edebilecek küçük metabolitleri ve tuzları kaldırır 19 kadar. karmaşık bir şekilde ayrılması denatüre edici olmayan koşullar altında gerçekleştirilir. Oligomerik kompleksleri tespiti immün tarafından takip Western Blot ile elde edilir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Şekil 3: denatüre PAGE ve Western blotting kullanılarak insan MxA proteininin oligomerik durum tayini (A) Rekombinant MxA ektopik Vero hücrelerinde ifade varyantları.. vahşi tip MxA (tetramer) arabirimi mutantlar mxa kompleksleri (R640A), MxA (L617D) (dimerler) ve MxA (M527D) onların oligomerik devlet teyit beklenen molekül ağırlıklarında göç ederler. (B) A549 hücreleri MxA ekspresyonunu indükleme IFN-a ml'si başına 1000 IU ile uyarıldı. endojen MxA shakımları dörtlü forma karşılık gelen bir grup. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
| tampon adı | içerik | Yorumlar | ||
| liziz tamponu | 20 mM Tris-HCI (pH 7.5), 150 mM NaCI, 5 mM MgCl2, 100 uM iyodoasetamit, 50 mM NaF, 1 mM Na 3 VO 4, % 1 NP-40, 50 mM β-gliserofosfat, 1 tablet 50 EDTA ml Lizis tamponu ücretsiz, proteaz inhibitörü kokteyl başına | Iodacetamide, NaF, Na 3 VO 4 oktilfenoksipolietoksietanoldür (NP-40), β-gliserofosfat ve proteaz inhibitörlerinin eklemehücre erimesi önce tor kokteyl hakkı Iodacetamide ışık duyarlı olduğunda çözelti içinde kararlı değildir. Işık maruz kalmayı önlemek ve kullanımdan önce sağa çözülür. | ||
| Diyaliz tamponu | 20 mM Tris-HCl (pH 6.8), % 10 gliserol, % 0.1 CHAPS, 0.5 mM DTT | CHAPS için diğer denatüre edici olmayan deterjanların raplaced edilebilir | ||
| Koşu tampon | 25 mM Tris-HCl (pH 8.3), 192 mM glisin, % 0.1 CHAPS, 0.5 mM DTT | pH 8.3, çoğu proteinler negatif tahsil edilir. Bununla birlikte, temel proteinlerin, bir asidik pH kullanılmalıdır. Aksi takdirde, proteinler ters yönde çalışacak ve kaybolacaktır. CHAPS için diğer denatüre edici olmayan deterjan ile ikame edilmiş olabilir | ||
| örnek tampon | 310 mM Tris-HCI (pH 6.8), % 0.05 bromofenol mavisi, % 50 gliserol | |||
| SDS tamponu | 25 mM Tris-HCl (pH 8.3), 192 mM glisin, % 0.1 SDS | |||
| benekleme tamponu, | 25 mM Tris, 192 mM glisin, % 20 metanol | Çok büyük kompleksler, metanol ommitted edilebilir | ||
| bloke edici tamponun | 50 mM Tris-HCI (pH 7.4) 150 mM NaCI % 0.05 Tween 20 % 5 Süt tozu | |||
| Büyüme ortamı | Dulbecco modifiye ortam 1x Penisilin / Streptomisin 2 mM Glutamin % 10 cenin dana serumu | |||
Tablo 1: non-denatüre PAGE için gerekli Tampon tarifleri.
Tartışmalar
Burada Western blot analizi ile, ardından denatüre PAGE ile memeli hücrelerinde ifade edilen proteinlerin oligomerik durum hızla belirlenmesini sağlayan basit bir yöntem tarif eder. Bu yaklaşımın en önemli avantajı, belirli bir proteinin oligomerik durumu önceden protein saflaştırma olmadan bütün hücre lizatları belirlenebilir olmasıdır. Bu oligomerize veya yardımcı faktörler ile birlikte kendi işlevini yerine proteinler için önemli olabilir. Buna ek olarak, proteinler, yerli durumunda hala ve daha da jelden ekstre için, enzimatik etkinlik ya da diğer protein fonksiyonları belirlenmiş ve oligomerik durumuna uyarlanabilmektedir.
Bu protokolün kritik yönü numune hazırlama sırasında deterjanların seçimdir. Bu hücre zarları ile ilişkili proteinler için özel bir önem taşımaktadır. MxA esas düz endoplazmik retikulum 25 zarları ile ilişkili gibi görünmektedir . Hücre lizizi için iyonik olmayan bir deterjan NP40 mxa çökelmesini engelleyen uygun idi. Daha önce tarif edildiği gibi 19 tampon değişimi ve diyaliz yoluyla lizatları düşük molekül ağırlıklı safsızlıkların çıkarılmasından sonra,% 0.1 3 varlığı - [(3-kolamidopropil) -dimetilamonyo] -1-propansülfonat (CHAPS) jel içinde mxa çökelmesini önlemek için gerekli olan Elektroforez. E. ifade saflaştırılmış rekombinant MxA proteini ile tespit edildiği üzere ek olarak, CHAPS mxa enzimatik aktivitesine müdahale etmez E. coli 12. Deterjan proteinleri denatüre veya liziz sırasında protein-protein etkileşimlerini bozan etmez büyük bir önem taşımaktadır. Bu NP40, Octoxinol 9 olarak denatüre edici olmayan deterjan, Digitonin ve CHAPS çözündürme için uygundur. Deterjan ve konsantrasyonu seçimi deneysel olarak tespit edilmelidir. Deterjan ayrıca deterjan gereken bazı deneyler için, örneğin alt deneyler etkileyebilirkaldırıldı kolayca diyaliz ile CHAPS elde değil Octoxinol 9 26 olan.
tarif edilen yöntem, denatüre edici olmayan koşullar altında, hücre lizatları elde edilen proteinleri analiz için, proteinlerin önceden saflaştırma gereklidir. Rekombinant proteinlerin saflaştırılması zaman toplama ya da çökeltme proteini önlemek için yüksek tuz ve diğer katkı maddelerinin eklenmesi ile tampon optimizasyonları gerektirir, çünkü bu bir avantajdır. Bununla birlikte, bu katkı maddeleri ve yüksek tuz konsantrasyonları, mutlaka doğal haliyle benzer olabilir protein oligomerizasyonu üzerinde bir etkiye sahip olabilir. Özellikle, insan MxA protein durumunda, tuz konsantrasyonu, ve nükleotidler varlığı daha yüksek oligomerik USA 27 oluşumunda önemli bir rol oynamaktadır. Hücresel sabitleme faktörler hala mevcut olduğu için, hücre lizatlarında, proteinler, daha kolay stabilize edilir. Nedenle pr analiz etmek mümkündürdaha fazla hücre fizyolojik koşullar altında otein kompleksleri (örneğin, fizyolojik tuz konsantrasyonu ve pH). Diğer proteinler yapısal olarak ilgili MXB ya Dynamin 8 örneğin, oligomerleri oluşturmak için Bu protokol, aynı zamanda uygulanabilir olmalıdır.
Protokol bir diğer önemli yönü liziz (Şekil 1), sitoplazmik proteinlerin yapay disülfid köprülerinin oluşumunu önlemek için serbest tiol gruplarının korunmasıdır. İlk deneyler, 1,4-ditiyotreitol (DTT) veya β-mercaptethanol eklenmesi numune hazırlama sırasında yapay disülfid bağlarının oluşumunu önlemek için yeterli olmadığını göstermiştir. Hem indirgeme maddeleri, disülfid köprülerini oluşturan arasında tersine çevrilebilir tiol grubunu korur. Bu geri dönüşümlü koruma kalıcı tüm tiyol grupları korumak için yeterli olmayabilir. MxA protein durumunda, bu proteinin tersinir olmayan toplanmayla yol açar. Bununla birlikte, iyodoasetamit eklenmesi irrevers buDTT ile muamele lizatları mxa karşılaştırıldığında ibly sistein büyük ölçüde azalır Ayrıca MxA protein agregasyonu, MxA memeli hücrelerini ifade hazırlanabilir lizatlarının iyodoasetamid tedavisi çökeltilir mxa ve GTPaz aktivitesi üzerinde herhangi bir etkiye sahip ait serbest tiol gruplarının koruma (veriler gösterilmemiştir ).
Bir oligomer protomerlerin sayısına tam olarak belirlenmesi için diğer önemli hususlar poliakrilamid konsantrasyon aralığının seçimi hem de bir protein molekül ağırlığı referansı vardır. poliakrilamid konsantrasyonu aralığı, ilk oligomer beklenen molekül kütleleri bantların maksimum ayrılmasını sağlamak için oluşturulmalıdır. Denatüre edici olmayan PAGE bir SDS içermez. SDS yük, moleküler kütlesi, protein şekli eksik elektroforetik hareketliliği belirler. Bu nedenle, protein moleküler ağırlık markerine seçimi çok önemlidir. İdeal olarak, bir molekül ağırlığı referansı ar olurBilinen oligomerik devletleri ile ilgi proteinin ecombinant saflaştırılmış formu. bu her zaman mevcut olmadığı için, bir denatüre olmayan ya da doğal bir protein markör kullanılmalıdır. MxA örneğin UAP56 ya Thogotovirus viral Nükleoproteinlerin gibi diğer hücresel proteinler ile ilişkilendirmek için gösterilmiş olduğu, La Crosse virüsü ya da influenza virüsü 12,28-30, daha da-farklı co edecek bir nükleoprotein UAP56 olup özel antikorlar kullanılarak ya da influenza immün test denatüre edici olmayan PA jelleri üzerinde mxa ile. Ancak biz MxA hetero-oligomerlerinin oluşumu için hiçbir kanıt bulunamadı. Bu muhtemelen MxA-UAP56 ve MxA-nükleoprotein etkileşimleri düşük afinite 12,24 arasında olduğu gerçeğidir. Ayrıca, UAP56 veya viral Nükleoproteinlerin ile ilişkilendirilmesi MxA protein fraksiyonu bu yöntemle tespit etmek için, çok düşük ve dolayısıyla zor olabilir.
Bundan başka, göz önüne protein pKa analiz edilecek çekmek için önemlidir. tarif olmayan Denat olarakön görülen PAGE protokolü, proteinler, pH 8.3 de elektroforez ile ayrılır. Çoğu protein olumsuz bu pH tahsil edilir. Ancak, temel proteinlerin pH 8.3 da pozitif bir net şarj sergilemez ve dolayısıyla ters yönde çalışır. temel proteinlerin analizi proteininin bir negatif yük sağlamak için çalışan tampon pH değerini ayarlamak için bir sonucu olarak, bu önemlidir.
Birlikte ele alındığında onun ön saflaştırma işlemine gerek kalmadan burada, memeli hücrelerinde ifade edilen proteinlerin oligomerik durumu hızlı bir şekilde değerlendirilmesi için bir protokol mevcut.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
This work was funded by a Grant from the Swiss National Science foundation (Grant nr. 31003A_143834) to JP.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Slide-A-Lyzer MINI Dialysis Units, 10K MWCO, 0.5 ml | Thermo Fisher Scientific | 69570 | Pre-equilibrate in dialysis buffer (if Glycerol removal is desired) Can be self-made according to Fiala et al. 2011 |
| 4–15% Mini-PROTEAN TGX Precast Protein Gels, 10-well, | Bio-Rad | 456-1083 | Pre-run in running buffer to adjust buffer system |
| cOmplete, Mini, EDTA-free | Roche | 11836170001 | use 1 tablet per 50 ml |
| PBS, pH 7.4 bottle a 500 ml Gibco | Thermo Fisher Scientific | 14190-094 | |
| Ponceau S solution | Sigma-Aldrich | P7170 | TOXIC wear gloves and protect eyes |
| NativeMark Unstained Protein Standard 50 µl | Invitrogen | P/N 57030 | load 5 µl/well |
| A549 cells | ATCC | ATCC CCL185 | Grow in growth medium (see Table 1) |
| Vero cells | ATCC | ATCC CCL81 | Grow in growth medium (see Table 1) |
| anti-Mx1 antibody | Novus Biologicals | H00004599_D01P | Use at a 1:1,000 dilution |
| ECL Anti-rabbit IgG, Horseradish Peroxidase linked whole antibody (from donkey) | GE-Healthcare | NA934V | Use at a 1:10,000 dilution |
| 0.5% Trypsin-EDTA (1x) Life Technologies | Thermo Fisher | 15400-054 | |
| Iodoacetamide 5 g | Sigma-Aldrich | I-6125 | stock 100 mM |
| Bromphenolblue | Sigma-Aldrich | B0126-25G | |
| DMEM +4.5g/l Gluc,+L-Glut,+Pyruvate life technologies | Thermo Fisher Scientific | 41966-029 | |
| Pen Strep 100 x 100ml life technologies | Thermo Fisher Scientific | 15140 - 130 | |
| Glutamax 100x Stock, 100 ml life technologies | Thermo Fisher Scientific | 350500-038 | |
| Fetal Bovine Serum, Dialyzed , US Origin 500 ml Gibco Lot:42G9552K | Thermo Fisher Scientific | 10270-106 | |
| Cellulose filter paper | Bio-Rad | 1703965 | |
| PVDF blotting membrane | GE-Healthcare | 10600022 | |
| Tris(hydroxymethyl)aminomethane | Biosolve | 0020092391BS | |
| sodium fluoride (NaF) | Sigma Aldrich | S-7920 | |
| NP-40 | Calbiochem | 492015 | |
| cOmplete, Mini, EDTA-free | Roche | 11836170001 | |
| Tween 20 | Calbiochem | 6555204 | |
| CHAPS 10% solution | Amresco | N907 | |
| DL-Dithiothreitol (DTT) | Sigma Aldrich | 43819 | |
| Glycine | Biosolve | 0007132391BS | |
| sodium orthovanadate (Na3VO4) | Sigma Aldrich | 450243 | |
| Glycerol | Sigma Aldrich | G7757 | |
| β-Glycerophospate | Sigma Aldrich | G9422 | |
| Milk powder | Migros/Switzerland | ||
| Methanol | Millipore | 1.06009 | |
| sodium cloride (NaCl) | Sigma Aldrich | 71380 | |
| magnesium chloride (MgCl2) | Amresco | 288 | |
| Sodium dodecyl sulphate (SDS) | Sigma Aldrich | L4509 | |
| sodium hydroxide (NaOH) | Sigma Aldrich | S-8045 |
Referanslar
- Baisamy, L., Jurisch, N., Diviani, D. Leucine zipper-mediated homo-oligomerization regulates the Rho-GEF activity of AKAP-Lbc. J Biol Chem. 280, 15405-15412 (2005).
- Chen, C. P., Posy, S., Ben-Shaul, A., Shapiro, L., Honig, B. H. Specificity of cell-cell adhesion by classical cadherins: Critical role for low-affinity dimerization through beta-strand swapping. Proc Natl Acad Sci U S A. 102, 8531-8536 (2005).
- Jackson-Fisher, A. J., Chitikila, C., Mitra, M., Pugh, B. F. A role for TBP dimerization in preventing unregulated gene expression. Mol Cell. 3, 717-727 (1999).
- Torshin, I. Activating oligomerization as intermediate level of signal transduction: analysis of protein-protein contacts and active sites in several glycolytic enzymes. Front Biosci. 4, 557-570 (1999).
- Goodsell, D. S., Olson, A. J. Structural symmetry and protein function. Annu Rev Biophys Biomol Struct. 29, 105-153 (2000).
- Flydal, M. I., Martinez, A. Phenylalanine hydroxylase: function, structure, and regulation. IUBMB Life. 65, 341-349 (2013).
- Haller, O., Kochs, G. Human MxA protein: an interferon-induced dynamin-like GTPase with broad antiviral activity. J Interferon Cytokine Res. 31, 79-87 (2011).
- Haller, O., Staeheli, P., Schwemmle, M., Kochs, G. Mx GTPases: dynamin-like antiviral machines of innate immunity. Trends Microbiol. 23, 154-163 (2015).
- Di Paolo, C., Hefti, H. P., Meli, M., Landis, H., Pavlovic, J. Intramolecular backfolding of the carboxyl-terminal end of MxA protein is a prerequisite for its oligomerization. J Biol Chem. 274, 32071-32078 (1999).
- Janzen, C., Kochs, G., Haller, O. A monomeric GTPase-negative MxA mutant with antiviral activity. J Virol. 74, 8202-8206 (2000).
- Gao, S., et al. Structure of myxovirus resistance protein a reveals intra- and intermolecular domain interactions required for the antiviral function. Immunity. 35, 514-525 (2011).
- Nigg, P. E., Pavlovic, J. Oligomerization and GTP-binding Requirements of MxA for Viral Target Recognition and Antiviral Activity against Influenza A Virus. J Biol Chem. 290, 29893-29906 (2015).
- Gao, S., et al. Structural basis of oligomerization in the stalk region of dynamin-like MxA. Nature. 465, 502-506 (2010).
- Ghosh, I., Hamilton, A. D., Regan, L. Antiparallel leucine zipper-directed protein reassembly: Application to the green fluorescent protein. J Am Chem Soc. 122, 5658-5659 (2000).
- Patching, S. G. Surface plasmon resonance spectroscopy for characterisation of membrane protein-ligand interactions and its potential for drug discovery. Biochim Biophys Acta. 1838, 43-55 (2014).
- Kenworthy, A. K. Imaging protein-protein interactions using fluorescence resonance energy transfer microscopy. Methods. 24, 289-296 (2001).
- Wyatt, P. J. Light-Scattering and the Absolute Characterization of Macromolecules. Analytica Chimica Acta. 272 (93), 1-40 (1993).
- Howlett, G. J., Minton, A. P., Rivas, G. Analytical ultracentrifugation for the study of protein association and assembly. Curr Opin Chem Biol. 10, 430-436 (2006).
- Fiala, G. J., Schamel, W. W., Blumenthal, B. Blue native polyacrylamide gel electrophoresis (BN-PAGE) for analysis of multiprotein complexes from cellular lysates. J Vis Exp. , (2011).
- Zou, H., Li, Y., Liu, X., Wang, X. An APAF-1.cytochrome c multimeric complex is a functional apoptosome that activates procaspase-9. J Biol Chem. 274, 11549-11556 (1999).
- Schagger, H., Cramer, W. A., von Jagow, G. Analysis of molecular masses and oligomeric states of protein complexes by blue native electrophoresis and isolation of membrane protein complexes by two-dimensional native electrophoresis. Anal Biochem. 217, 220-230 (1994).
- Walker, J. M. Nondenaturing polyacrylamide gel electrophoresis of proteins. Methods Mol Biol. 32, 17-22 (1994).
- Stoscheck, C. M. Quantitation of protein. Methods Enzymol. 182, 50-68 (1990).
- Wisskirchen, C., Ludersdorfer, T. H., Muller, D. A., Moritz, E., Pavlovic, J. Interferon-induced antiviral protein MxA interacts with the cellular RNA helicases UAP56 and URH49. J Biol Chem. 286, 34743-34751 (2011).
- Stertz, S., et al. Interferon-induced, antiviral human MxA protein localizes to a distinct subcompartment of the smooth endoplasmic reticulum. J Interferon Cytokine Res. 26, 650-660 (2006).
- Seddon, A. M., Curnow, P., Booth, P. J. Membrane proteins, lipids and detergents: not just a soap opera. Biochim Biophys Acta. 1666, 105-117 (2004).
- Kochs, G., Haener, M., Aebi, U., Haller, O. Self-assembly of human MxA GTPase into highly ordered dynamin-like oligomers. J Biol Chem. 277, 14172-14176 (2002).
- Kochs, G., Haller, O. GTP-bound human MxA protein interacts with the nucleocapsids of Thogoto virus (Orthomyxoviridae). J Biol Chem. 274, 4370-4376 (1999).
- Reichelt, M., Stertz, S., Krijnse-Locker, J., Haller, O., Kochs, G. Missorting of LaCrosse virus nucleocapsid protein by the interferon-induced MxA GTPase involves smooth ER membranes. Traffic. 5, 772-784 (2004).
- Wisskirchen, C., Ludersdorfer, T. H., Muller, D. A., Moritz, E., Pavlovic, J. The cellular RNA helicase UAP56 is required for prevention of double-stranded RNA formation during influenza A virus infection. J Virol. 85, 8646-8655 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır