Method Article
Характеристика Multi-субъединица белковых комплексов человеческого MxA Использование неденатурирующем электрофорез на полиакриламидном геле
В этой статье
Резюме
This article describes a simple and rapid protocol to evaluate the oligomeric state of the dynamin-like GTPase MxA protein from lysates of human cells using a combination of non-denaturing PAGE with western blot analysis.
Аннотация
The formation of oligomeric complexes is a crucial prerequisite for the proper structure and function of many proteins. The interferon-induced antiviral effector protein MxA exerts a broad antiviral activity against many viruses. MxA is a dynamin-like GTPase and has the capacity to form oligomeric structures of higher order. However, whether oligomerization of MxA is required for its antiviral activity is an issue of debate. We describe here a simple protocol to assess the oligomeric state of endogenously or ectopically expressed MxA in the cytoplasmic fraction of human cell lines by non-denaturing polyacrylamide gel electrophoresis (PAGE) in combination with Western blot analysis. A critical step of the protocol is the choice of detergents to prevent aggregation and/or precipitation of proteins particularly associated with cellular membranes such as MxA, without interfering with its enzymatic activity. Another crucial aspect of the protocol is the irreversible protection of the free thiol groups of cysteine residues by iodoacetamide to prevent artificial interactions of the protein. This protocol is suitable for a simple assessment of the oligomeric state of MxA and furthermore allows a direct correlation of the antiviral activity of MxA interface mutants with their respective oligomeric states.
Введение
Четвертичная структура белка, играет решающую роль во многих клеточных процессах. Сигнальных путей, экспрессии генов и ферментов активация / деактивация все полагаются на правильность сборки белковых комплексов 1-4. Этот процесс также известен как гомо- или гетеро-олигомеризации происходит из-за необратимого ковалентного или обратимых электростатических и гидрофобных взаимодействий белок-белок. Олигомеризации не только разнообразит различные клеточные процессы , без увеличения размера генома, но также обеспечивает стратегию для белков , чтобы построить устойчивые комплексы, которые более устойчивы по отношению к денатурации и деградации 5. Дефекты в олигомеризации оказывают влияние на функцию белков и может привести к развитию заболеваний. Например, фермент фенилаланин гидроксилазы образует тетрамерный комплекс. Некоторые мутации в белковом комплексе может ослабить образование тетрамерное и приводят к фенилкетонурии болезни 6.
Белок MxA человек представляет собой интерферон (ИФН) индуцированный противовирусную эффекторной белка , оказывающего широкий противовирусной активностью в отношении различных РНК, а также ДНК - вирусов 7. Он относится к надсемейства динамина подобных крупных ГТФаз и обладает способностью образовывать большие олигомерные структуры в пробирке 8. Олигомеризация было предложено , чтобы защитить MxA от быстрой деградации 9,10. Несмотря на интенсивные усилия многих исследовательских групп, молекулярный механизм действия остается в значительной степени неуловимым и роль олигомеризации состояния MxA для своей противовирусной функции находится на стадии обсуждения 9,11,12. В связи с этим, Гао и его коллеги предложили модель , где MxA проявляет свою противовирусную активность при взаимодействии с вирусными нуклеопротеидами в виде крупных кольцевых олигомерных структур 11. Тем не менее, в последнее время , мы показали , что MxA димеры обладают противовирусной активностью и взаимодействуют с нуклеопротеида вируса гриппа А 12. ВAsed на кристаллическую структуру MxA, Гао и его коллеги определили несколько аминокислотных остатков в интерфейсных областях , которые имеют решающее значение для его олигомеризации в пробирке и его противовирусной функции 11,13. Поэтому для того, чтобы выяснить, который олигомерные состояние MxA проявляет противовирусную активность, мы стремились создать простой протокол для быстрого определения oligmeric состояния интерфейса мутантов MxA, выраженные в клетках человека, а также эндогенными MxA выраженное после стимуляции IFN &.
Хотя существует много методов, которые обычно используются для исследования взаимодействия между белками , такими как белок сплит-зеленый флуоресцентный (сплит-GFP) комплементационная анализ 14, поверхностного плазмонного резонанса 15 и Ферстер резонансный перенос энергии (FRET) 16, они не обеспечивают информация о точной стехиометрии олигомерного белкового комплекса. Для исследования этого конкретного аспекта, методы, такие какмульти-угол рассеяния света (MALS) 17 и аналитической ультрацентрифугирования 18 очень полезны. Как правило, белки анализировали с помощью этих методов являются очищенные белки. Процессы олигомеризации может также зависеть от других клеточных факторов. Если эти факторы неизвестны, анализ является более трудным. Кроме того, некоторые белки трудно выразить в Е. палочки и очистить. Таким образом, эти методы не являются оптимальным выбором для анализа белка олигомеризации в клеточной среде. Кроме того, эти методы требуют дорогих инструментов, которые не легко доступны.
Non-денатурирующих электрофореза в полиакриламидном геле (ПААГ), гель -проникающей хроматографии или химического сшивания с последующим обычным додецилсульфата натрия (SDS) -page являются полезными инструментами для характеристики образования олигомеров из клеточных лизатов 2,19,20. Эти методы не требуют специального оборудования и может быть легко реrformed в стандартной лаборатории. Первоначально мы оценивали различные химические сшивающие протоколы, которые инвариантно привели к неспецифической агрегации и осаждению МХА. Таким образом, мы в следующий раз испытал протоколы СТР неденатурирующем. В качестве не денатурирующее СТР исключает использование SDS, миграция белков зависит от их родного заряда. Сине-нативный страница использует кумасси бриллиантовым синим G250 , чтобы загрузить белки с общим отрицательным зарядом, аналогично SDS, но не денатурации белка 21. К сожалению, кумасси бриллиантовый синий осаждается в присутствии высоких солей и двухвалентных катионов (например , Mg 2+) , которые часто включают в лизиса буферов. В зависимости от используемых буферов, может быть трудно анализировать образец без дальнейшей оптимизации шагов, которые могли бы оказать влияние на олигомерного белкового комплекса.
Здесь мы приведем простой протокол , основанный на ранее опубликованного метода 22 , чтобы определить , олигомеризациюбелок человеческого MxA полученный из клеточных лизатов с использованием неденатурирующем PAGE.
протокол
Примечание: Этот протокол основан на опубликованной ранее неденатурирующих протокола стр.12. В этом исследовании олигомерного состояния белка МхА оценивали с использованием либо клеток Vero с гиперэкспрессией MxA или ИФН-альфа-стимулированных клеток A549, экспрессирующих эндогенный МХА. Протокол, описанный ниже, может быть использован для анализа олигомерного состояния любого белка в дополнение к МХА. Тем не менее, может потребоваться дальнейшей оптимизации.
1. Получение клеточного лизата для неденатурирующем ПААГ
Примечание: Для анализа олигомерного состояния человеческого белка МхА либо в Vero или клетки А549, собирали 1,0 × 10 6 клеток. В зависимости от типа клеток или от избытка белка для анализа, количество клеток должно быть отрегулировано. Кроме того, важно, чтобы защитить лизис буфера от воздействия света, как только будет добавлен светочувствительный йодацетамида.
- Семенной 0,3 х 10 6 А549 или Vero клеток на лунку в6 а-х блюд. Сохранить клетки в 2 мл среды для роста на лунку (таблица 1). Инкубируйте клетки в течение ночи в инкубаторе для клеточных культур (37 ° С, 5% СО 2).
- Сбора клеток путем промывки 1 мл фосфатно-буферного раствора (PBS) и отделяться путем добавления 0,5 мл 0,25% трипсин-этилендиаминтетрауксусной кислоты (ЭДТА) 1x раствор в течение приблизительно 5 мин при комнатной температуре.
- Как только клетки отделяются от блюдо, добавьте 0,5 мл питательной среды и тщательно перемешать с помощью пипетки вверх и вниз.
- Передача клетки в каждую лунку в одну 2 мл пробирку и осадить их, используя настольную центрифугу (5000 XG, 4 ° C, 5 мин).
- Осторожно удалите супернатант с помощью пипетки, не нарушая клеточный осадок.
- Промывают клетки с 1 мл охлажденного льдом PBS, тщательно пипеткой клеточной суспензии вверх и вниз.
- Гранул клетки в настольную центрифугу (5000 XG, 4 ° С, 5 мин).
- Осторожно удалите супернатант с помощью пипетки Wiбез промежуточного отсоединением осадок клеток.
- Ресуспендируют клеток в 200 мкл охлажденного льдом буфера для лизиса (таблица 1) с помощью пипетки вверх и вниз и поставить на лед.
- Сразу же, защитить лизат от света путем покрытия труб с использованием оловянную фольгу и инкубировать в течение 30 минут на льду.
Примечание: После инкубации в течение 30 мин на льду, он больше не является необходимым для защиты лизат от воздействия света, так как защита от свободных тиоловых групп является необратимым. - Удалить остатков клеток путем центрифугирования в предварительно охлажденный настольную центрифугу (13 000 XG, 4 ° C, 20 мин).
- Равновесие диализных столбцы в буфере диализом (таблица 1) в холодном помещении при температуре 4 ° С в течение 20 мин во время стадии центрифугирования. Использование колонки с молекулярной массой от 10000.
- Прикрепите колонки к флоат буя и поместить их в стакан, наполненный диализного буфера. Для того, чтобы обеспечить осторожное перемешивание, используют магнитную мешалку. Не прикасайтесь к мембране.
ПРИМЕЧАНИЕ: Dialysкак столбцы могут быть приобретены или получены из 1,5 мл пробирки в соответствии с протоколом , описанным Фиала и его сотрудниками 19.
- Прикрепите колонки к флоат буя и поместить их в стакан, наполненный диализного буфера. Для того, чтобы обеспечить осторожное перемешивание, используют магнитную мешалку. Не прикасайтесь к мембране.
- Удалить столбцы из буфера диализ и поплавковой буем. Передача очищенных лизатов в подготовленную колонку диализной пипеткой, не касаясь мембраны. Прикрепите колонки к флоат буя и положил их обратно в стакан, наполненный диализного буфера.
- Диализировать лизата в химический стакан , содержащий ледяной буфера для диализа (таблица 1) , по крайней мере 4 ч (или предпочтительно в течение ночи) при температуре 4 ° С при тщательном перемешивании с использованием магнитной мешалки. Использование по меньшей мере, 100 мл буфера для диализа в течение 200 мкл лизата.
- Передача Диализованную пробу в 1,5 мл пробирку. Удалить преципитаты центрифугированием в настольную центрифугу (13 000 XG, 4 ° C, 20 мин). Для предотвращения диссоциации олигомерного белка комплексов продолжают с протоколом (раздел 2) сразу же после диализа. Не замораживатьподготовленные лизатов.
2. Электрофорез
Примечание: Электрофорез проводили , как описано ранее , с некоторыми изменениями 22. В протоколе, описанном ниже, были использованы предварительно литые градиентные гели (4-15% градиент). В качестве альтернативы, гели можно приготовить в лаборатории. Очень важно, чтобы исключить какого-либо денатурирующего агента, такого как SDS, чтобы предотвратить диссоциацию олигомерных белковых комплексов. Время электрофореза был оптимизирован для различных олигомерных состояний человеческого белка МхА. Тем не менее, он может варьироваться для других белков, в зависимости от размера олигомеров комплекса, а также диапазон разделения, которая должна быть достигнута, чтобы проанализировать комплекс. Таким образом, оптимальное время электрофореза должны быть определены эмпирически. Для Оптимальное разрешение олигомеров необходимо проанализировать ток не должен превышать 25 мА.
- Соберите гель PAGE без денатурации в гелевой камере. Заполните тон внутреннюю и внешнюю камеру с предварительно охлажденным рабочим буфером (таблица 1).
- Предварительно запустить гель с заранее охлажденный проточном буфере при 25 мА на гель в течение 15 мин в холодном помещении при температуре 4 ° С.
- Смешайте 15 мкл полученного выше лизатов с 5 мкл 4х буфера образца (таблица 1). Не кипятите образец.
- Нагрузка 15 мкл образца и нативный стандартного белка выбора на геле. Выполнить гель при 25 мА в течение 4 ч в холодном помещении при температуре 4 ° С.
Примечание: Для получения полуколичестветшых анализов, протокол Количественную оценку белка (например, анализ протеина по Брэдфорду 23) могут быть выполнены для того , чтобы обеспечить загрузку равных количеств общего белка на полосу.
3. Вестерн-блот
Примечание: Ниже описан протокол мокрой западной системы блоттинга. Любая промокательной мембрана может быть использована. Активировать поливинилиденфторид (PVDF) мембраны в 100% метанола, прежде чем уравновешивания в промокательной БУФФер. Полусухое западный метод блот может быть использован в качестве альтернативы, но должна быть оптимизирована для больших олигомерных комплексов.
- Разберите гель и осторожно перенести его в SDS - буфере (таблица 1).
- Инкубировать в течение 10 мин при комнатной температуре при осторожном встряхивании.
- Подготовьте 2 губки, 4 листов бумаги фильтра целлюлозы и промокательной мембрану на гель. Замочите их в буфере для блоттинга (таблица 1).
- Соберите бутерброд следующим образом (снизу вверх): 1 губка, 2 целлюлозные фильтры бумажные листы, мембраны, гель, 2 целлюлозы фильтровальной бумаги листов, 1 губка.
- Положите бутерброд в промокательной бак. Убедитесь, что мембрана обращена к положительному полюсу, а гель сталкивается с отрицательным полюсом.
- Заполните промокательную резервуар с предварительно охлажденном буфере блоттинга.
- Пятно при 90 мА в течение ночи при 4 ° С для получения наилучших результатов переноса белков.
- Разберите бутерброд и визуализировать стандарт белка путем инкубирования мембраны в PONÇEau S раствор в течение 5 мин при комнатной температуре.
- Destain мембраны, тщательно смывая пунцовый S деионизированной водой, пока вы можете ясно видеть полосы белкового стандарта.
- Отметьте полосы стандарта белка с помощью ручки.
Примечание: Остаточное Понсо S может помешать иммунным. Чтобы избежать этого, мембрана может быть обесцвечивают далее путем инкубации в 0,1 М NaOH в течение 1 мин и последующей промывки деионизированной водой. - Блок мембраны блокирующим буфером (см таблицу 1) в течение не менее 1 ч при комнатной температуре или в течение ночи при 4 ° С.
- Визуализируйте (ы) белка интереса иммунным окрашиванием с использованием антител, направленных против белка для анализа.
Примечание: Белок MxA человек визуализировали с использованием кроличьих поликлональных антител , специфичных для человеческого MX1 разводили 1: 1000 в блокирующем буфере (таблица 1). Раствор антител инкубировали в течение ночи при температуре 4 ° С. В качестве альтернативы, моноклональноеNTI-MxA антитела (клон 143) , могут быть использованы (данные не показаны) 24.
Результаты
Используя неденатурирующем PAGE, мы проанализировали олигомерного состояния дикого типа человека МхА, димерные интерфейс мутанты MxA (R640A) и MxA (L617D), а также мономерной интерфейса мутанта МхА (M527D) из клеточных лизатов 12. Клетки лизируют в буфере , содержащем 1% октилфеноксиполиэтоксиэтанол (NP-40) и иодацетамид , чтобы обеспечить солюбилизацию белка и защиты свободных тиоловых групп (см рисунок 1). Как было описано выше, соли и небольшие метаболиты удаляли диализом 19. разделение белков осуществляли неденатурирующем ПААГ. Для того, чтобы способствовать эффективной вестерн-блоттинга, гель инкубировали в буфере SDS до того блоттинга. Белки MxA визуализировали с помощью иммунологического окрашивания с использованием кроличьей поликлональной антитело, направленное против МХА. Рабочий процесс описан на рисунке 2.
Для сравнения олигомерного состояния эндогенного белка человека МхА из интерферона-альфа ; стимулированные клетки A549, мы трансфецировали клетки Vero (отсутствие эндогенного МХА) с рекомбинантной дикого типа, мономерных и димерных вариантов MxA. Эти рекомбинантные дикого типа, мономерных и димерных MxA варианты образуются стабильные тетрамеры, мономеров и димеров, соответственно, по сравнению с неокрашенной нативного белка маркера (фиг.3А). Таким образом, мы использовали эти рекомбинантные белки , чтобы оценить олигомерный состояние эндогенного белка человека МхА полученного из ИФН-a стимулировал клеток А549. Фигура 3В показывает , что размер МХА в лизатах ИФН-альфа-стимулированных клеток A549 соответствует тетрамера.
Взятые вместе, мы опишем метод для определения олигомерного состояния человеческого белка МхА из лизата клеток. Наш подход СТР неденатурирующих также может быть использован для оценки олигомерного состояния других олигомерных белковых комплексов.
83 / 54683fig1.jpg "/>
Рисунок 1:. Структура и реакционная схема йодацетамидом йодацетамид необратимо защищает тиольную группу свободных цистеинов путем формирования тиоэфирной связи. Это стабильные результаты модификации от нуклеофильного замещения йода с атомом серы из цистеина. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
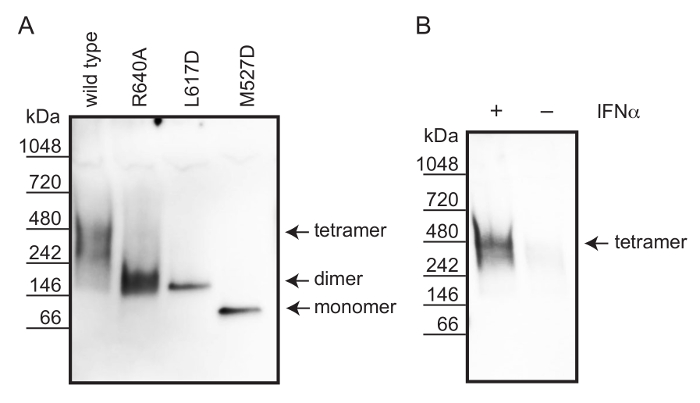
Рис . 2: Workflow диаграмма неденатурирующем PAGE Систематическое представление неденатурирующем PAGE подхода клеточных лизатов. Во время лизиса клеток, детергенты солюбилизации белков и тиоловых групп защищены йодацетамидом для предотвращения агрегации белка. Диализ удаляет небольшие метаболиты и соли, которые могут помешать неденатурирующем ПААГ 19. Комплекс разделение проводят в условиях неденатурирующих. Обнаружение олигомерных комплексов достигается с помощью Вестерн - блоттинга с последующим иммунным окрашиванием. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 3: Определение олигомерного состояния человеческого белка МхА с использованием не-денатурации PAGE и Вестерн - блоттинга (А) Рекомбинантный MxA варианты эктопически экспрессируется в клетках Vero.. Комплексы дикого типа MxA (тетрамер) мутантов интерфейса MxA (R640A), MxA (L617D) (димеры) и MxA (M527D) мигрируют в их ожидаемых молекулярных весов, подтверждающие их олигомерные состояние. (В) A549 клетки стимулировали 1000 МЕ на мл ИФН-a , чтобы индуцировать экспрессию МХА. Эндогенный MxA шOWS группа , которая соответствует форме тетрамерном. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
| имя буфера | содержание | Комментарии | ||
| буфер для лизиса | 20 мМ Трис-HCl (рН 7,5), 150 мМ NaCl, 5 мМ MgCl 2, 100 мкМ йодацетамида, 50 мМ NaF, 1 мМ Na 3 VO 4, 1% NP-40, 50 мМ β-глицерофосфата, 1 таблетка на 50 мл буфера для лизиса ЭДТА свободного, ингибиторов протеаз | Добавить iodacetamide, NaF, Na 3 VO 4, октилфеноксиполиэтоксиэтанол (NP-40), бета-глицерофосфат и протеазы inhibiТог коктейль непосредственно перед лизисом клеток Iodacetamide является светочувствительным и нестабильна, когда в растворе. Не допускать попадания света и растворить непосредственно перед использованием. | ||
| Диализ буфер | 20 мМ Трис-HCl (рН 6,8), 10% глицерина, 0,1% CHAPS, 0,5 мМ ДТТ | CHAPS, может быть raplaced другими неденатурирующих моющих средств | ||
| Запуск буфера | 25 мМ Трис-HCl (рН 8,3), 192 мМ глицин, 0,1% CHAPS, 0,5 мМ ДТТ | При рН 8,3, большинство белков заряжены отрицательно. Тем не менее, для основных белков, кислый рН следует использовать. В противном случае белки будут работать в противоположном направлении и будут потеряны. CHAPS, могут быть заменены другими неденатурирующих моющих средств | ||
| образец буфера | 310 мМ Трис-HCl (pH6.8), 0,05% бромфеноловый синий, 50% глицерина | |||
| буфер SDS | 25 мМ Трис-HCl (рН 8,3), 192 мМ глицин, 0,1% ДСН | |||
| буфере для блоттинга | 25 мМ Трис, 192 мМ глицин, 20% Метанол | Для очень больших комплексов, Метанол может быть пропущены | ||
| Блокирующий буфер | 50 мМ Трис-HCl (рН 7,4) 150 мМ NaCl 0,05% твин-20 5% сухого молока | |||
| среда роста | модифицированной среде Дульбекко 1x пенициллина / стрептомицина 2 мМ глутамина 10% фетальной телячьей сыворотки | |||
Таблица 1: буферная рецепты , необходимые для неденатурирующем ПААГ.
Обсуждение
Здесь мы опишем простой метод, который позволяет быстрое определение олигомерных состояния белков, экспрессированных в клетках млекопитающих путем неденатурирующем ПААГ с последующим Вестерн-блот-анализа. Основное преимущество этого подхода состоит в том, что олигомерные состояние данного белка может быть определена из целых клеточных лизатов без очистки предшествующего белка. Это может быть важно для белков, которые олигомеризации или проявляют свою функцию, в сочетании со вспомогательными факторами. Кроме того, белки, все еще находятся в нативном состоянии и, если дополнительно экстрагировали из геля, ферментативная активность или другие функции белка могут быть определены и коррелируют с олигомерных состояния.
Важным аспектом этого протокола является выбор моющих средств во время подготовки образца. Это имеет особое значение для белков, ассоциированных с клеточными мембранами. MxA , как представляется, в первую очередь связаны с мембранами гладкой эндоплазматической сети 25 . Для лизиса клеток неионогенный детергент NP40 был оптимальным, предотвращая осаждение МХА. После замены буфера и удаления низкомолекулярных примесей лизатов путем диализа , как описано выше 19 присутствие 0,1% 3 - [(3-холамидопропил) диметиламмонио] -1-пропансульфонат (CHAPS) требовалось , чтобы предотвратить выпадение в осадок MxA во время геля электрофорез. Кроме того, CHAPS не мешает ферментативной активности МХА , как определено с помощью очищенного рекомбинантного белка МхА экспрессируется в E. палочка 12. Это имеет большое значение, что моющее средство не денатурировать белки или нарушающей белок-белковых взаимодействий в процессе лизиса. Неденатурирующих моющие средства, такие как NP40, Octoxinol 9, дигитониновый и CHAPS подходят для солюбилизации. Выбор моющего средства и его концентрация должна быть определена эмпирически. Моющее средство может также влиять на нижестоящие эксперименты , например , для некоторых анализов моющее средство должно бытьудален , который легко достигается с CHAPS путем диализа, но не с Octoxinol 9 26.
Поскольку описанный метод анализирует белки, полученные из клеточных лизатов при неденатурирующих условиях, не предварительной очистки белков не требуется. Это является преимуществом, так как очистка рекомбинантных белков иногда требует буфера оптимизации путем добавления высоких солей и других добавок для предотвращения белка из агрегации или осаждения. Тем не менее, эти добавки и высокие концентрации солей могут иметь влияние на олигомеризации белка, который не обязательно может напоминать свое естественное состояние. Особенно в случае человеческого белка МхА, концентрация соли и наличие нуклеотидов играют решающую роль в формировании высших олигомерных 27 государств. В клеточных лизатов, белки более легко стабилизировать, так как клеточные факторы стабилизации все еще присутствуют. Поэтому можно проанализировать PRotein комплексов при более клеточных физиологических условиях (например , физиологические концентрации солей и рН). Этот протокол должен быть применим и для других белков , образуя олигомеры, например , для структурно родственным MxB или динамина 8.
Другим важным аспектом протокола является защита свободных тиоловых групп , чтобы предотвратить образование искусственных дисульфидными мостиками цитоплазматических белков в процессе лизиса (рисунок 1). Первоначальные эксперименты показали, что добавление 1,4-дитиотреитола (DTT) или бета-mercaptethanol не является достаточным, чтобы предотвратить образование искусственных дисульфидных связей в процессе подготовки пробы. Оба восстановители защищают группу тиольную обратимо от формирования дисульфидных мостика. Это обратимое защита не может быть достаточной для защиты всех тиоловых групп на постоянной основе. В случае белка МхА, это приводит к необратимой агрегации белка. Тем не менее, добавление йодацетамидом что irreversibly защищает свободные тиольные группы цистеинов значительно снижается агрегация белка МхА Кроме того, йодацетамида лечения лизатов, приготовленных из MxA экспрессии клеток млекопитающих, не имели никакого влияния на ГТФ активность Иммунопреципитированные MxA по сравнению с MxA из лизатов, обработанных DTT (данные не показаны ).
Другие важные соображения для точного определения количества протомерами в олигомера являются выбор диапазона концентраций полиакриламида, а также контрольный белок молекулярной массы. Диапазон концентрации полиакриламидного должен быть сначала создан, чтобы обеспечить максимальное разделение полос при ожидаемой молекулярной массы олигомеров. Неденатурирующем СТР не содержит SDS. Не имея ДСН, заряд, молекулярная масса и форма белка определяет его электрофоретической подвижности. Таким образом, выбор белка маркер молекулярной массы имеет решающее значение. В идеале, ссылка молекулярная масса будет агecombinant очищенная форма белка, представляющего интерес с известными олигомерных состояниями. Так как это не всегда доступен, неденатурированный или нативный белок маркер должен быть использован. Так как MxA было показано ассоциировать с другими клеточными белками , такими как UAP56 или вирусных нуклеопротеидов из Thogotovirus, Ла - Кроссе вирус или вирус гриппа 12,28-30, мы также тестировали иммунным окрашиванием с использованием специфических антител ли UAP56 или гриппа A нуклеопротеид бы совместно отдельный с MxA на неденатурирующих гели PA. Тем не менее, мы не обнаружили никаких доказательств для формирования MxA гетеро-олигомеров. Это , вероятно, связано с тем , что MxA-UAP56 и MxA-нуклеопротеида взаимодействия имеют низкое сродство 12,24. Кроме того, доля МхА белка, связывающего с UAP56 или вирусных нуклеопротеидов может быть очень низким, и, следовательно, трудно обнаружить с помощью этого метода.
Кроме того, важно учитывать рКа белка для анализа. В описанном не-denatПротокол СТР рительными, белки разделяют с помощью электрофореза при рН 8,3. Большинство белков заряжены отрицательно при этом значении рН. Тем не менее, основные белки проявляют положительный чистый заряд при рН 8,3, и, следовательно, будет работать в обратном направлении. Как следствие этого, важно, для анализа основных белков, чтобы регулировать рН подвижном буфере, чтобы обеспечить общий отрицательный заряд белка.
Взятые вместе мы представляем здесь протокол для быстрой оценки состояния олигомерных белков, выраженных в клетках млекопитающих без необходимости его предварительной очистки.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
This work was funded by a Grant from the Swiss National Science foundation (Grant nr. 31003A_143834) to JP.
Материалы
| Name | Company | Catalog Number | Comments |
| Slide-A-Lyzer MINI Dialysis Units, 10K MWCO, 0.5 ml | Thermo Fisher Scientific | 69570 | Pre-equilibrate in dialysis buffer (if Glycerol removal is desired) Can be self-made according to Fiala et al. 2011 |
| 4–15% Mini-PROTEAN TGX Precast Protein Gels, 10-well, | Bio-Rad | 456-1083 | Pre-run in running buffer to adjust buffer system |
| cOmplete, Mini, EDTA-free | Roche | 11836170001 | use 1 tablet per 50 ml |
| PBS, pH 7.4 bottle a 500 ml Gibco | Thermo Fisher Scientific | 14190-094 | |
| Ponceau S solution | Sigma-Aldrich | P7170 | TOXIC wear gloves and protect eyes |
| NativeMark Unstained Protein Standard 50 µl | Invitrogen | P/N 57030 | load 5 µl/well |
| A549 cells | ATCC | ATCC CCL185 | Grow in growth medium (see Table 1) |
| Vero cells | ATCC | ATCC CCL81 | Grow in growth medium (see Table 1) |
| anti-Mx1 antibody | Novus Biologicals | H00004599_D01P | Use at a 1:1,000 dilution |
| ECL Anti-rabbit IgG, Horseradish Peroxidase linked whole antibody (from donkey) | GE-Healthcare | NA934V | Use at a 1:10,000 dilution |
| 0.5% Trypsin-EDTA (1x) Life Technologies | Thermo Fisher | 15400-054 | |
| Iodoacetamide 5 g | Sigma-Aldrich | I-6125 | stock 100 mM |
| Bromphenolblue | Sigma-Aldrich | B0126-25G | |
| DMEM +4.5g/l Gluc,+L-Glut,+Pyruvate life technologies | Thermo Fisher Scientific | 41966-029 | |
| Pen Strep 100 x 100ml life technologies | Thermo Fisher Scientific | 15140 - 130 | |
| Glutamax 100x Stock, 100 ml life technologies | Thermo Fisher Scientific | 350500-038 | |
| Fetal Bovine Serum, Dialyzed , US Origin 500 ml Gibco Lot:42G9552K | Thermo Fisher Scientific | 10270-106 | |
| Cellulose filter paper | Bio-Rad | 1703965 | |
| PVDF blotting membrane | GE-Healthcare | 10600022 | |
| Tris(hydroxymethyl)aminomethane | Biosolve | 0020092391BS | |
| sodium fluoride (NaF) | Sigma Aldrich | S-7920 | |
| NP-40 | Calbiochem | 492015 | |
| cOmplete, Mini, EDTA-free | Roche | 11836170001 | |
| Tween 20 | Calbiochem | 6555204 | |
| CHAPS 10% solution | Amresco | N907 | |
| DL-Dithiothreitol (DTT) | Sigma Aldrich | 43819 | |
| Glycine | Biosolve | 0007132391BS | |
| sodium orthovanadate (Na3VO4) | Sigma Aldrich | 450243 | |
| Glycerol | Sigma Aldrich | G7757 | |
| β-Glycerophospate | Sigma Aldrich | G9422 | |
| Milk powder | Migros/Switzerland | ||
| Methanol | Millipore | 1.06009 | |
| sodium cloride (NaCl) | Sigma Aldrich | 71380 | |
| magnesium chloride (MgCl2) | Amresco | 288 | |
| Sodium dodecyl sulphate (SDS) | Sigma Aldrich | L4509 | |
| sodium hydroxide (NaOH) | Sigma Aldrich | S-8045 |
Ссылки
- Baisamy, L., Jurisch, N., Diviani, D. Leucine zipper-mediated homo-oligomerization regulates the Rho-GEF activity of AKAP-Lbc. J Biol Chem. 280, 15405-15412 (2005).
- Chen, C. P., Posy, S., Ben-Shaul, A., Shapiro, L., Honig, B. H. Specificity of cell-cell adhesion by classical cadherins: Critical role for low-affinity dimerization through beta-strand swapping. Proc Natl Acad Sci U S A. 102, 8531-8536 (2005).
- Jackson-Fisher, A. J., Chitikila, C., Mitra, M., Pugh, B. F. A role for TBP dimerization in preventing unregulated gene expression. Mol Cell. 3, 717-727 (1999).
- Torshin, I. Activating oligomerization as intermediate level of signal transduction: analysis of protein-protein contacts and active sites in several glycolytic enzymes. Front Biosci. 4, 557-570 (1999).
- Goodsell, D. S., Olson, A. J. Structural symmetry and protein function. Annu Rev Biophys Biomol Struct. 29, 105-153 (2000).
- Flydal, M. I., Martinez, A. Phenylalanine hydroxylase: function, structure, and regulation. IUBMB Life. 65, 341-349 (2013).
- Haller, O., Kochs, G. Human MxA protein: an interferon-induced dynamin-like GTPase with broad antiviral activity. J Interferon Cytokine Res. 31, 79-87 (2011).
- Haller, O., Staeheli, P., Schwemmle, M., Kochs, G. Mx GTPases: dynamin-like antiviral machines of innate immunity. Trends Microbiol. 23, 154-163 (2015).
- Di Paolo, C., Hefti, H. P., Meli, M., Landis, H., Pavlovic, J. Intramolecular backfolding of the carboxyl-terminal end of MxA protein is a prerequisite for its oligomerization. J Biol Chem. 274, 32071-32078 (1999).
- Janzen, C., Kochs, G., Haller, O. A monomeric GTPase-negative MxA mutant with antiviral activity. J Virol. 74, 8202-8206 (2000).
- Gao, S., et al. Structure of myxovirus resistance protein a reveals intra- and intermolecular domain interactions required for the antiviral function. Immunity. 35, 514-525 (2011).
- Nigg, P. E., Pavlovic, J. Oligomerization and GTP-binding Requirements of MxA for Viral Target Recognition and Antiviral Activity against Influenza A Virus. J Biol Chem. 290, 29893-29906 (2015).
- Gao, S., et al. Structural basis of oligomerization in the stalk region of dynamin-like MxA. Nature. 465, 502-506 (2010).
- Ghosh, I., Hamilton, A. D., Regan, L. Antiparallel leucine zipper-directed protein reassembly: Application to the green fluorescent protein. J Am Chem Soc. 122, 5658-5659 (2000).
- Patching, S. G. Surface plasmon resonance spectroscopy for characterisation of membrane protein-ligand interactions and its potential for drug discovery. Biochim Biophys Acta. 1838, 43-55 (2014).
- Kenworthy, A. K. Imaging protein-protein interactions using fluorescence resonance energy transfer microscopy. Methods. 24, 289-296 (2001).
- Wyatt, P. J. Light-Scattering and the Absolute Characterization of Macromolecules. Analytica Chimica Acta. 272 (93), 1-40 (1993).
- Howlett, G. J., Minton, A. P., Rivas, G. Analytical ultracentrifugation for the study of protein association and assembly. Curr Opin Chem Biol. 10, 430-436 (2006).
- Fiala, G. J., Schamel, W. W., Blumenthal, B. Blue native polyacrylamide gel electrophoresis (BN-PAGE) for analysis of multiprotein complexes from cellular lysates. J Vis Exp. , (2011).
- Zou, H., Li, Y., Liu, X., Wang, X. An APAF-1.cytochrome c multimeric complex is a functional apoptosome that activates procaspase-9. J Biol Chem. 274, 11549-11556 (1999).
- Schagger, H., Cramer, W. A., von Jagow, G. Analysis of molecular masses and oligomeric states of protein complexes by blue native electrophoresis and isolation of membrane protein complexes by two-dimensional native electrophoresis. Anal Biochem. 217, 220-230 (1994).
- Walker, J. M. Nondenaturing polyacrylamide gel electrophoresis of proteins. Methods Mol Biol. 32, 17-22 (1994).
- Stoscheck, C. M. Quantitation of protein. Methods Enzymol. 182, 50-68 (1990).
- Wisskirchen, C., Ludersdorfer, T. H., Muller, D. A., Moritz, E., Pavlovic, J. Interferon-induced antiviral protein MxA interacts with the cellular RNA helicases UAP56 and URH49. J Biol Chem. 286, 34743-34751 (2011).
- Stertz, S., et al. Interferon-induced, antiviral human MxA protein localizes to a distinct subcompartment of the smooth endoplasmic reticulum. J Interferon Cytokine Res. 26, 650-660 (2006).
- Seddon, A. M., Curnow, P., Booth, P. J. Membrane proteins, lipids and detergents: not just a soap opera. Biochim Biophys Acta. 1666, 105-117 (2004).
- Kochs, G., Haener, M., Aebi, U., Haller, O. Self-assembly of human MxA GTPase into highly ordered dynamin-like oligomers. J Biol Chem. 277, 14172-14176 (2002).
- Kochs, G., Haller, O. GTP-bound human MxA protein interacts with the nucleocapsids of Thogoto virus (Orthomyxoviridae). J Biol Chem. 274, 4370-4376 (1999).
- Reichelt, M., Stertz, S., Krijnse-Locker, J., Haller, O., Kochs, G. Missorting of LaCrosse virus nucleocapsid protein by the interferon-induced MxA GTPase involves smooth ER membranes. Traffic. 5, 772-784 (2004).
- Wisskirchen, C., Ludersdorfer, T. H., Muller, D. A., Moritz, E., Pavlovic, J. The cellular RNA helicase UAP56 is required for prevention of double-stranded RNA formation during influenza A virus infection. J Virol. 85, 8646-8655 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены