Method Article
אפיון של קומפלקסים חלבונים Multi-למקטע של MxA האדם שימוש ללא denaturing polyacrylamide ג'ל אלקטרופורזה
In This Article
Summary
This article describes a simple and rapid protocol to evaluate the oligomeric state of the dynamin-like GTPase MxA protein from lysates of human cells using a combination of non-denaturing PAGE with western blot analysis.
Abstract
The formation of oligomeric complexes is a crucial prerequisite for the proper structure and function of many proteins. The interferon-induced antiviral effector protein MxA exerts a broad antiviral activity against many viruses. MxA is a dynamin-like GTPase and has the capacity to form oligomeric structures of higher order. However, whether oligomerization of MxA is required for its antiviral activity is an issue of debate. We describe here a simple protocol to assess the oligomeric state of endogenously or ectopically expressed MxA in the cytoplasmic fraction of human cell lines by non-denaturing polyacrylamide gel electrophoresis (PAGE) in combination with Western blot analysis. A critical step of the protocol is the choice of detergents to prevent aggregation and/or precipitation of proteins particularly associated with cellular membranes such as MxA, without interfering with its enzymatic activity. Another crucial aspect of the protocol is the irreversible protection of the free thiol groups of cysteine residues by iodoacetamide to prevent artificial interactions of the protein. This protocol is suitable for a simple assessment of the oligomeric state of MxA and furthermore allows a direct correlation of the antiviral activity of MxA interface mutants with their respective oligomeric states.
Introduction
המבנה הרביעון של חלבון ממלא תפקיד מכריע בתהליכים תאיים רבים. מסלולי איתות, ביטוי גנים, ואנזים הפעלה / ביטול הפעלה כל מסתמכים על ההרכבה הנכונה של קומפלקסי חלבונים 1-4. תהליך זה ידוע גם בשם שָׁוֶה או-oligomerization הטרו נובע קוולנטי בלתי הפיך או הידרופובי אלקטרוסטטית הפיך אינטראקציות חלבון-חלבון. Oligomerization לא רק מגוונת את תהליכים תאיים שונים מבלי להגדיל את גודל הגנום, אלא גם מספק אסטרטגיה חלבונים לבנות מתחמי יציבה כי הם עמידים יותר כלפי denaturation והשפלה 5. פגמים oligomerization להשפיע על תפקודם של חלבונים והוא יכול להוביל להתפתחות של מחלות. לדוגמה, hydroxylase פנילאלנין האנזים יוצר מורכבות tetrameric. כמה מוטציות במתחם חלבון יכול להחליש את היווצרות tetramer ולהוביל פנילקטונוריה מחלת 6.
s = "jove_content"> חלבון MxA האדם הוא אינטרפרון (IFN) -induced חלבון מפעיל אנטי הפעלת פעילות אנטי רחבה נגד RNA השונה וכן נגיפי DNA 7. היא שייכת superfamily של GTPases גדול דמוי dynamin ויש לו את היכולת ליצור מבנים oligomeric גדול במבחנה 8. Oligomerization הוצע להגן MxA מפני השפלה המהירה 9,10. למרות ניסיונות נמרצים מצד קבוצות מחקר רבות, את המנגנון המולקולרי של פעולה נותר חמקמק בעיקר ואת תפקידה של מדינת oligomerization של MxA לתפקוד אנטי שלה נמצא תחת דיון 9,11,12. בהקשר זה, גאה ועמיתים לעבודה הציעו מודל שבו MxA מפעיל הפעילות אנטי שלה על ידי אינטראקציה עם נוקלאופרוטאינים ויראלי בצורה של מבני oligomeric גדולים דמוית טבעת 11. עם זאת, ולאחרונה, הראינו כי הדימרים MxA תערוכת פעילות אנטי אינטראקציה עם nucleoprotein של נגיף שפעת A 12. Based על המבנה הגבישי של MxA, גאו ועמיתים לעבודה זיהו מספר שאריות חומצת אמינו באזורי ממשק כי הם קריטיים עבור oligomerization שלה במבחנה ותפקוד אנטי שלה 11,13. לכן, על מנת להבהיר הקובעות oligomeric של MxA מפעיל פעילות אנטי, ביקשנו להקים פרוטוקול פשוט במהירות כדי לקבוע את המצב oligmeric של מוטציות ממשק MxA לידי ביטוי בתאים אנושיים, כמו גם אנדוגני MxA הביע לאחר גירוי IFNα.
אמנם יש טכניקות רבות שאינם בשימוש נפוץ כדי לחקור את האינטראקציה בין חלבונים כגון החלבון המפוצל גרין פלורסנט (פיצול-GFP) assay השלמה 14, תהודת plasmon משטח 15 והעברת אנרגית תהודת פורסטר (סריג) 16, הם אינם מספקים מידע של stoichiometry המדויק של קומפלקס חלבוני oligomeric. לקבלת חקירה של היבט מסוים זה, טכניקות כגוןפיזור רב-זווית אור (יונקים) 17 ו ultracentrifugation אנליטית 18 הם מאוד שימושיים. בדרך כלל, את החלבונים נותחו באמצעות שיטות אלה הם חלבונים מטוהרים. תהליכי oligomerization עשויים להיות תלויים גם בגורמים תאיים אחרים. אם הגורמים הללו אינם ידועים, הניתוח הוא יותר קשה. בנוסף, כמה חלבונים שקשה לבטא ב E. coli כדי לטהר. לכן, שיטות אלה אינן הבחירה האופטימלית לנתח oligomerization חלבון בסביבת הסלולר. בנוסף, טכניקות אלה דורשים מכשירים יקרים אשר אינם זמינים.
ג'ל polyacrylamide ללא denaturing אלקטרופורזה (עמוד), כרומטוגרפיה הדרה גודל או crosslinking כימיים ואחריו סולפט dodecyl נתרן קונבנציונאלי (SDS) -PAGE הם כלי שימושי לאפיון היווצרות של oligomers מ lysates תא 2,19,20. שיטות אלו אינן מחייבות ציוד מיוחד והוא יכול להיות בקלות PErformed במעבדה סטנדרטית. אנחנו בתחילה העריכו פרוטוקולים cross-linking כימיים שונים שהובילו invariantly להצטברות הלא ספציפית ומשקעים של MxA. לכן, אנחנו הבאים נבדקים פרוטוקולי עמוד הלא denaturing. כדף הלא denaturing כולל את השימוש SDS, הגירה של חלבונים תלוי תשלום מולדתם. עמוד כחול-יליד משתמש G250 הכחול המבריק coomassie לטעון חלבונים עם תשלום הכולל שלילי, בדומה SDS, אבל לא לפגל החלבון 21. למרבה הצער, coomassie משקע כחול מבריק בנוכחות מלחי גבוה קטיונים divalent (למשל Mg 2+) כלולים לעתים קרובות מאגרים תמוגה. בהתאם המאגרים בשימוש, זה עלול להיות קשה לנתח את המדגם מבלי אופטימיזציה נוספת של צעדים, עלול להיות בעל השפעה על החלבון המורכב oligomeric.
כאן אנו מציגים פרוטוקול פשוט המבוסס על שיטה שפורסמה בעבר 22 כדי לקבוע oligomerization שלחלבון אנושי MxA נגזר lysates הסלולר באמצעות עמוד הלא denaturing.
Protocol
הערה: פרוטוקול זה מבוסס על פרוטוקול העמוד הלא denaturing שפורסם בעבר 12. במחקר זה, המדינה oligomeric של החלבון MxA הוערכה באמצעות או תאים Vero overexpressing MxA או תאים A549 IFN מגורה-α להביע אנדוגני MxA. הפרוטוקול המתואר להלן ניתן להשתמש כדי לנתח את מצב oligomeric של כל חלבון בנוסף MxA. עם זאת, אופטימיזציה נוספת ייתכן שתידרש.
1. הכנת Cell Lysate עבור עמוד חדרים denaturing
הערה: כדי לנתח את מצב oligomeric של החלבון האנושי MxA בשני תאים Vero או A549, 1.0 x 10 6 התאים נקצרו. בהתאם לסוג התא או השפע של החלבון לנתח, את המספר הסלולרי צריך להיות מותאם. כמו כן, חשוב להגן על חיץ תמוגה מהחשיפה לאור, ברגע iodoacetamide הרגיש לאור מתווסף.
- זרע 0.3 x 10 6 A549 או Vero תאים לכל היטבעד 6-מנות היטב. שמור את התאים ב 2 מיליליטר צמיחה בינונית לכל טוב (ראה טבלה 1). דגירת תאי לילה חממת תרבית תאים (37 מעלות צלזיוס, 5% CO 2).
- קציר התאים על ידי שטיפה עם 1 מ"ל של בופר פוספט (PBS) ולנתק ידי הוספת 0.5 מ"ל של 0.25% חומצה טריפסין-ethylenediaminetetraacetic (EDTA) 1x פתרון כ 5 דקות בטמפרטורת החדר.
- ברגע תאים להתנתק המנה, להוסיף 0.5 מ"ל מדיום הגידול ומערבבים בזהירות על ידי pipetting למעלה ולמטה.
- העברת התאים של כל אחד גם לתוך צינור אחד 2 מ"ל ו גלולה אותם באמצעות צנטריפוגות בראש הטבלה (5,000 XG, 4 ° C, 5 דקות).
- מוציאים בזהירות את supernatant ידי pipetting מבלי להפריע גלולה התא.
- שוטפים את התאים עם PBS 1 מ"ל קר כקרח על ידי pipetting ההשעיה תא בקפידה מעלה ומטה.
- תאים גלולים בצנטריפוגה בראש טבלה (5,000 XG, 4 ° C, 5 דקות).
- מוציאים בזהירות את supernatant ידי pipetting without ניתוק התא גלולה.
- תאי Resuspend ב 200 חיץ μl קר כקרח תמוגה (ראה טבלה 1) על ידי pipetting למעלה ולמטה ולשים על קרח.
- מיד, להגן lysate מן האור על ידי כיסוי הצינורות באמצעות נייר אלומיניום דגירה במשך 30 דקות על הקרח.
הערה: לאחר הדגירה במשך 30 דקות על קרח, זה כבר לא חיוני בשמירה על lysate מחשיפה לאור, מאז להגנה על קבוצות תיאול חינם הוא בלתי הפיכה. - הסר פסולת התא על ידי צנטריפוגה בצנטריפוגה בראש הטבלה מראש צונן (13,000 XG, 4 ° C, 20 דקות).
- לאזן עמודות דיאליזת חיץ דיאליזה (טבלה 1) בחדר הקר על 4 מעלות צלזיוס למשך 20 דקות במהלך שלב צנטריפוגה. השתמש בעמודה עם משקל מולקולרי המנותק של 10,000.
- צרף את העמודות כדי מצוף לצוף ולשים אותם לתוך כוס המלאה עם חיץ דיאליזה. כדי להבטיח ערבוב עדין, להשתמש בוחש מגנטי. אל תיגע הממברנה.
הערה: Dialysניתן לרכוש או מכינים עמודות 1.5 מיליליטר צינורות לפי הפרוטוקול שתואר על ידי פיאלה ועמיתים לעבודה 19.
- צרף את העמודות כדי מצוף לצוף ולשים אותם לתוך כוס המלאה עם חיץ דיאליזה. כדי להבטיח ערבוב עדין, להשתמש בוחש מגנטי. אל תיגע הממברנה.
- הסר את העמודות מתוך מאגר דיאליזת המצוף לצוף. מעבירים את lysates פינה לתוך הטור דיאליזה מוכן ידי pipetting בלי לגעת קרום. צרף את העמודות כדי מצוף לצוף ולשים אותם בחזרה לתוך הכוס מלאה עם חיץ דיאליזה.
- Dialyze את lysate בתוך מבחנה המכילה מאגר דיאליזה קרים כקרח (טבלה 1) לפחות 4 שעות (או רצוי לילה) בשעה 4 ° C תוך ערבוב בזהירות בעזרת בוחש מגנטי. השתמש לפחות חיץ דיאליזה 100 מ"ל עבור lysate 200 μl.
- מעבירים את המדגם dialysed לתוך צינור 1.5 מ"ל. הסר משקעים ידי צנטריפוגה בצנטריפוגה בראש הטבלה (13,000 XG, 4 ° C, 20 דקות). כדי למנוע ניתוק של החלבון oligomeric מתחמי להמשיך עם פרוטוקול (סעיף 2) מיד לאחר דיאליזה. אין להקפיאאת lysates המוכן.
אלקטרופורזה 2.
הערה: אלקטרופורזה בוצע כפי שתואר קודם עם כמה שינויים 22. בפרוטוקול המתואר להלן, ג'לים שיפוע מראש יצוק שימשו (שיפוע 4-15%). לחלופין, ג'ל ניתן להכין במעבדה. זה מאוד חשוב לכלול כל סוכן denaturing כגון SDS כדי למנוע ניתוק של קומפלקסים חלבונים oligomeric. זמן של אלקטרופורזה הוטב מדינות oligomeric השונות של חלבון MxA אדם. עם זאת, זה יכול להשתנות עבור חלבונים אחרים, תלוי בגודל של מתחם oligomeric כמו גם המגוון של פרדה שאמורה להיות מושגת על מנת לנתח את המורכבות. לכן, הזמן האופטימלי של אלקטרופורזה צריך להיקבע באופן אמפירי. עבור הרזולוציה המיטבית של oligomers להיות מנותח הזרם לא יעלה על 25 מילי-אמפר.
- להרכיב את הג'ל עמוד הלא denaturing בתא ג'ל. מלאו tהוא תא פנימי וחיצוני עם חיץ ריצה מראש צונן (טבלה 1).
- טרום להפעיל את הג'ל עם חיץ ריצה מראש צונן במהירות של 25 מיליאמפר לכל ג'ל במשך 15 דקות בחדר הקר על 4 מעלות צלזיוס.
- מערבבים 15 μl של lysates מוכן לעיל עם 5 μl של חיץ מדגם 4x (טבלה 1). אין להרתיח את המדגם.
- טען 15 μl של מדגם ורמת חלבון יליד הבחירה על הג'ל. הפעל את הג'ל על 25 מילי-אמפר עבור 4 שעות בחדר קר ב 4 ° C..
הערה: עבור ניתוחים וכמותיות, פרוטוקול כימות חלבון (למשל ברדפורד חלבון assay 23) יכול להתבצע על מנת להבטיח טעינה של כמויות שוות של חלבון הכולל לכל נתיב.
3. כתם המערבי
הערה: מתוארת להלן הפרוטוקול של מערכת כתם מערבית רטובה. ניתן להשתמש בכל קרום סופג. הפעל פלואוריד polyvinylidene (PVDF) ממברנות מתנול 100% לפני איזון ב סופג buffer. טכניקת הכתם המערבית חצי היבשים יכולה לשמש לחלופין, אבל צריך להיות מותאם במיוחד מתחמי oligomeric גדולים.
- לפרק את הג'ל ובזהירות להעביר אותו למאגר SDS (טבלה 1).
- דגירה במשך 10 דקות בטמפרטורת החדר תוך רעד בעדינות.
- כן 2 ספוגים, 4 גיליונות נייר תאי מסנן קרום סופג לכל ג'ל. משרים אותם סופג חיץ (טבלה 1).
- הרכב את הכריך כדלקמן (מלמטה למעלה): 1 ספוג, 2 גיליונות נייר תאיים מסנן, קרום, ג'ל, 2 גיליונות נייר תאיים מסנן, 1 ספוג.
- מכניסים את הכריך לתוך הטנק סופג. ודא כי הקרום פונה קוטב בתוספת בעוד ג'ל פונה קוטב מינוס.
- מלאו את מיכל סופג עם חיץ סופג מראש צונן.
- כתם ב 90 mA הלילה ב 4 מעלות צלזיוס במשך תוצאות העברת חלבון הטובות ביותר.
- לפרק את הכריך ולדמיין תקן החלבון ידי דוגרי קרום Poncפתרון S eau במשך 5 דקות בטמפרטורת החדר.
- Destain הממברנה על ידי שטיפה את Ponceau S בזהירות עם מים ללא יונים עד שאתה יכול לראות את הלהקות בבירור התקן החלבון.
- סמן את הלהקות של תקן החלבון באמצעות עט.
הערה: שיורי Ponceau S יכול להפריע immunostaining. כדי למנוע זאת, הקרום ניתן destained עוד יותר על ידי דגירה ב 0.1 M NaOH 1 דקות ושטיפה לאחר מכן עם מים ללא יונים. - חסום את הממברנה עם חסימת חיץ (ראו טבלה 1) לפחות שעה 1 בטמפרטורת החדר או לילה ב 4 מעלות צלזיוס.
- דמיינו חלבון (ים) של עניין על ידי immunostaining באמצעות נוגדנים המכוונים נגד החלבון להיות מנותח.
הערה: החלבון האנושי MxA היה דמיין באמצעות נוגדן polyclonal הארנב ספציפי אדם MX1 מדולל 1: 1,000 בחסימת מאגר (טבלת 1). פתרון נוגדן הודגר הלילה ב 4 ° C.. לחלופין, א חד השבטיNTI-MxA נוגדן (שיבוט 143) יכול לשמש (מידע לא מוצג) 24.
תוצאות
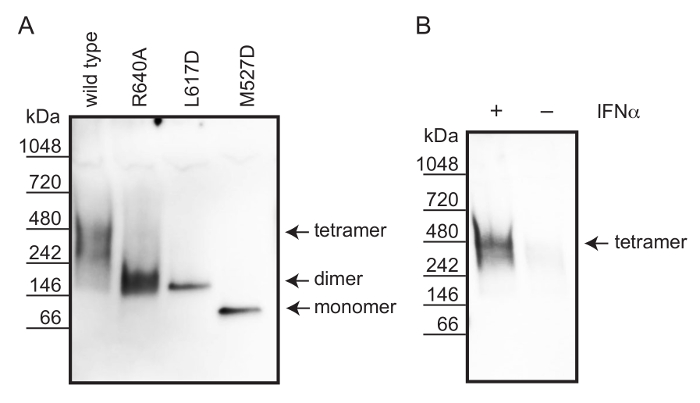
באמצעות עמוד הלא denaturing, ניתחנו את המדינה oligomeric של סוג בר האנושי MxA, את MxA מוטציות ממשק dimeric (R640A) ו MxA (L617D) וכן מוטציה ממשק monomeric MxA (M527D) מ lysates תא 12. התאים היו lysed במאגר המכיל 1% octylphenoxypolyethoxyethanol (NP-40) ו iodoacetamide כדי להבטיח חלבון solubilization והגנה על קבוצות תיאול בחינם (ראה איור 1). כפי שתוארו קודם לכן, מלח מטבוליטים קטנים הוסרו על ידי דיאליזה 19. הפרדת חלבון בוצעה על ידי עמוד הלא denaturing. כדי להקל המערבי סופג יעיל, הג'ל הודגר חיץ SDS לפני סופג. חלבוני MxA היו דמיינו ידי immunostaining באמצעות נוגדן polyclonal ארנב המכוון נגד MxA. זרימת העבודה מתוארת באיור 2.
כדי להשוות את מצב oligomeric של חלבון MxA האנושי אנדוגני מ-α IFN ; תאים A549 מגורה, אנחנו transfected תאים Vero (חסר אנדוגני MxA) עם wildtype רקומביננטי, גרסאות MxA monomeric ו dimeric. סוג בר רקומביננטי אלה, monomeric ו dimeric MxA גרסאות נוצר tetramers יציבה, מונומרים הדימרים, בהתאמה, בהשוואה סמן חלבון יליד בלא כתם (איור 3 א). לכן, השתמשנו חלבונים רקומביננטיים אלה כדי להעריך את מצב oligomeric של חלבון MxA האנושי אנדוגני נגזר IFN-α מגורה תאים A549. איור 3B מגלה שגודל MxA ב lysates של תאים A549 מגורה IFN-α מתאים tetramer.
יחדיו, אנו מתארים שיטה כדי לקבוע את מצב oligomeric של חלבון MxA אדם מן lysate תא. גישת העמוד הלא denaturing שלנו יכולה לשמש גם כדי להעריך את מצב oligomeric של קומפלקסי חלבוני oligomeric אחרים.
83 / 54683fig1.jpg "/>
איור 1:. מבנה ותגובה תוכנית של iodoacetamide iodoacetamide בלתי הפיך מגן הקבוצה תיאול של cysteins בחינם על ידי יצירת קשר thioether. תוצאות שינוי יציבות זה מן התמרה נוקלאופילית של יוד עם אטום הגופרית מן cystein. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
איור 2:. Workflow דיאגרמה של עמוד הלא denaturing ייצוג שיטתי של הגישה לדף שאינו denaturing של lysates התא. במהלך תמוגה תא, דטרגנטים solubilize החלבונים וקבוצות תיאול מוגנות על ידי iodoacetamide למנוע צבירת חלבון. דיאליזה מסירה מטבוליטים ומלחים קטנים שיכול להפריע עמוד הלא denaturing 19. ההפרדה המורכבת מבוצעת בתנאים הלא denaturing. איתור של מתחמי oligomeric מושג על ידי כתם המערבי ואחריו immunostaining. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 3: קביעת המדינה oligomeric של החלבון האנושי MxA באמצעות עמוד הלא denaturing סופג המערבי (א) רקומביננטי MxA גרסאות הביע ectopically בתאי Vero.. המתחמים של MxA סוג בר (tetramer) MxA מוטציות ממשק (R640A), MxA (L617D) (דימרים) ו MxA (M527D) נודדות משקלות מולקולריים וצפויים, מאשר מדינת oligomeric שלהם. (ב) בתאים A549 היו מגורה עם 1,000 IU לכל מ"ל של α IFN להשרות ביטוי MxA. Sh MxA אנדוגניOWS להקה שמקביל בצורה tetrameric. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
| שם מאגר | תוֹכֶן | תגובות | ||
| חיץ תמוגה | 20 mM Tris-HCl (pH 7.5), 150 מ"מ NaCl, 5 מ"מ MgCl 2, 100 מיקרומטר iodoacetamide, 50 מ"מ NaF, 1 מ"מ Na 3 VO 4, 1% NP-40, 50 מ"מ β-glycerophosphate, 1 טבליה לכל 50 חיץ תמוגה מ"ל של EDTA חינם, מעכבי פרוטאז קוקטייל | להוסיף iodacetamide, NaF, Na 3 VO 4, octylphenoxypolyethoxyethanol (NP-40), β-glycerophosphate ו פרוטאז inhibiטור קוקטייל ממש לפני תמוגה התא Iodacetamide הוא רגיש לאור, יציבה כאשר בתמיסה. למנוע חשיפה לאור לפזר ממש לפני השימוש. | ||
| חיץ דיאליזה | 20 mM Tris-HCl (pH 6.8), 10% גליצרול, 0.1%, חבר'ה, 0.5 מ"מ DTT | בחורים ניתן raplaced ידי דטרגנטים שאינם denaturing אחרים | ||
| חיץ ריצה | 25 mM Tris-HCl (pH 8.3), 192 מ"מ גליצין, 0.1%, חבר'ה, 0.5 מ"מ DTT | ב- pH 8.3, רוב החלבונים טעונים שלילית. עם זאת, עבור חלבונים בסיסיים, pH חומצי אמור לשמש. אחרת, את החלבונים יפעל בכיוון הפוך ויאבדו. יכולים להיות מוחלפים על ידי בחורי דטרגנטים שאינם denaturing אחרים | ||
| חיץ מדגם | 310 mM Tris-HCl (pH6.8), 0.05% כחולים bromophenol, גליצרול 50% | |||
| חיץ SDS | 25 mM Tris-HCl (pH 8.3), 192 מ"מ גליצין, 0.1% SDS | |||
| חיץ סופג | 25 מ"מ טריס, 192 מ"מ גליצין, מתנול 20% | עבור קומפלקסים גדולים מאוד, מתנול יכול להיות ommitted | ||
| חסימת חיץ | 50 mM Tris-HCl (pH 7.4) 150 מ"מ NaCl 0.05% Tween 20 5% אבקת חלב | |||
| מדיום גידול | בינוני שונה של Dulbecco 1x פניצילין / סטרפטומיצין 2 מ"מ גלוטמין 10% נסיוב העגל העוברי | |||
טבלה 1: מתכוני כרית הון הנדרשים עבור עמוד הלא denaturing.
Discussion
כאן אנו מתארים שיטה פשוטה המאפשרת הקביעה המהירה של מדינת oligomeric של חלבונים לידי ביטוי בתאי יונקים ידי עמוד הלא denaturing ואחריו ניתוח כתם מערבי. היתרון העיקרי של גישה זו היא כי המדינה oligomeric של חלבון נתון ניתן לקבוע מן lysates התא כולו ללא טיהור חלבון לפני. זו עשויה להיות חשובה עבור חלבוני oligomerize או להפעיל תפקידם בשיתוף עם גורמי עזר. בנוסף, החלבונים הם עדיין במצב הטבעי שלהם ואם חילוץ נוסף מן הג'ל, הפעילות האנזימטית או פונקציות חלבון אחרות ניתן לקביעה, בקורלציה למצב oligomeric.
היבט קריטי של פרוטוקול זה הוא הבחירה של דטרגנטים במהלך הכנת המדגם. זה הוא בעל חשיבות מיוחדת עבור חלבונים הקשורים ממברנות התאים. MxA נראה קשור בעיקר עם ממברנות של reticulum endoplasmic החלק 25 . עבור תמוגה תא NP40 הניקוי שאינו יוני היה אופטימלי, מניעת המשקעים של MxA. לאחר חילופי דברים חיץ והסרת זיהומים משקל מולקולרי נמוך של lysates ידי דיאליזה כפי שתואר לעיל 19 בנוכחות 0.1% 3 - [(3-cholamidopropyl) dimethylammonio] -1-propanesulfonate (פרקים) נדרשה כדי למנוע משקעים של MxA במהלך ג'ל אלקטרופורזה. בנוסף, בחורים לא להפריע לפעילות האנזימטית של MxA כפי שנקבע עם חלבונים מטוהרים רקומביננטי MxA לידי ביטוי E. coli 12. זה הוא בעל חשיבות רבה כי חומר הניקוי לא לפגל חלבונים או משבש אינטראקציות חלבון-חלבון במהלך תמוגה. דטרגנטים שאינם denaturing כגון NP40, 9 Octoxinol, digitonin בחורים מתאימים solubilization. הבחירה של חומר הניקוי ריכוזו צריכה להיקבע באופן אמפירי. הדטרגנט עלול גם להשפיע ניסויים במורד זרם למשל עבור מבחנים מסוימים דטרגנט צריך להיותסיר אשר מושג בקלות עם בחורים על ידי דיאליזה, אבל לא עם Octoxinol 9 26.
מאז השיטה המתוארת מנתח חלבונים שמקורם lysates תא בתנאים שאינם denaturing, לא טיהור מראש של החלבונים נדרשה. זהו יתרון מאז טיהור של חלבונים רקומביננטיים לפעמים דורשת אופטימיזציות חיץ על ידי התוספת של מלחים גבוה ותוספים אחרים כדי למנוע את החלבון מן הצבירה או משקעים. עם זאת, תוספים אלה ואת הריכוזים גבוה מלח עלולים להשפיע על oligomerization של החלבון שעשוי לא בהכרח דומה בצורתו הטבעית. במיוחד במקרה של חלבון MxA האנושי, ריכוז המלח ואת הנוכחות של נוקלאוטידים לשחק תפקיד מכריע ביצירת מדינות oligomeric גבוהה 27. Lysates תא, חלבונים הם התייצבו ביתר קלים מאז גורמי ייצוב הסלולר עדיין קיימים. לכן אפשר לנתח יחסי ציבורמתחמי otein בתנאים פיסיולוגיים תא יותר (ריכוז מלח פיסיולוגי למשל, ו- pH). פרוטוקול זה צריך להיות רלוונטי גם עבור להרכיב oligomers חלבונים אחרים, למשל עבור MXB המבנית הקשורה או dynamin 8.
היבט חשוב נוסף של הפרוטוקול הוא ההגנה על קבוצות תיאול חינם כדי למנוע ההיווצרות של גשרים דיסולפיד מלאכותיים של חלבונים ציטופלסמית במהלך תמוגה (איור 1). ניסויים ראשוניים הראו כי תוספת של 1,4-dithiothreitol (DTT) או β-mercaptethanol אינו מספיק כדי למנוע היווצרות של אג"ח דיסולפיד מלאכותית במהלך הכנת המדגם. סוכני הפחתת שני להגן על הקבוצה תיאול הפיכים מ טביעת גשרים דיסולפיד. הגנה הפיכה זה עשויה שלא להספיק כדי להגן על כל הקבוצות תיאול לצמיתות. במקרה של חלבון MxA, זה מוביל להצטברות בלתי הפיכה של החלבון. עם זאת, תוספת של iodoacetamide כי irreversibly מגן על קבוצות תיאול ללא cysteines צבירה פחותה בהרבה של חלבון MxA יתר על כן, טיפול iodoacetamide של lysates שהוכן MxA לבטא בתאי יונקים לא היתה שום השפעה על פעילות GTPase של immunoprecipitated MxA בהשוואה MxA מ lysates שטופלו DTT (מידע לא מוצג ).
שיקולים מכריעים אחרים עבור הקביעה המדויקת של המספר protomers בתוך oligomer הם הבחירה של טווח ריכוז polyacrylamide וכן התייחסות משקל החלבון המולקולרית. טווח ריכוז polyacrylamide יש להקים ראשונים לאפשר הפרדה מקסימלי של להקות ההמונים המולקולריים הצפויים של oligomers. עמוד ללא denaturing אינו מכיל SDS. בהעדר SDS, את החיוב, מסה מולקולרית ואת הצורה של החלבון קובע ניידות electrophoretic שלה. לכן, הבחירה של הסמן מולקולרי משקל החלבון חיונית. באופן אידיאלי, הפנית משקל מולקולרית תהיה arטופס מטוהרים ecombinant של החלבון של עניין עם מדינות oligomeric ידועות. מאז זה לא תמיד זמין, סמן חלבון שאינם מפוגל או יליד אמור לשמש. מאז MxA הוכח לקשר עם חלבונים תאיים אחרים כגון UAP56 או נוקלאופרוטאינים ויראלי של Thogotovirus, לה קרוס וירוס וירוס או שפעת 12,28-30, אנחנו גם נבדק על ידי immunostaining באמצעות נוגדנים ספציפיים אם UAP56 או שפעת nucleoprotein ישתפו נפרד עם MxA על ג'לים הרשות הלא denaturing. עם זאת לא מצאנו ראיות ליצירת הטרו-oligomers MxA. זה כנראה נובע מהעובדה MxA-UAP56 ו MxA-nucleoprotein אינטראקציות הם של זיקה נמוכה 12,24. יתר על כן, את החלק היחסי של חלבון MxA להתרועע עם UAP56 או נוקלאופרוטאינים ויראלי עשוי להיות נמוך מאד ולכן קשה לזהות לפי שיטה זו.
יתר על כן, חשוב לקחת בחשבון את pKa של החלבון להיות מנותח. בשנות ה תיאר הלא denatפרוטוקול עמוד uring, חלבונים מופרדים על ידי אלקטרופורזה ב- pH 8.3. רוב החלבונים טעונים שלילית ב- pH זה. עם זאת, חלבונים בסיסיים מפגינים מטען נטו חיובי ב- pH 8.3, ולכן יפעלו בכיוון ההפוך. כתוצאה מכך, חשוב עבור הניתוח של חלבונים בסיסיים כדי להתאים את ה- pH של למאגר פועל כדי להבטיח מטען שלילי כללי של החלבון.
יחדיו אנו מציגים כאן פרוטוקול ההערכה המהירה של מדינת oligomeric של חלבונים לידי ביטוי בתאי יונקים ללא הצורך של הטיהור המוקדמת שלה.
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was funded by a Grant from the Swiss National Science foundation (Grant nr. 31003A_143834) to JP.
Materials
| Name | Company | Catalog Number | Comments |
| Slide-A-Lyzer MINI Dialysis Units, 10K MWCO, 0.5 ml | Thermo Fisher Scientific | 69570 | Pre-equilibrate in dialysis buffer (if Glycerol removal is desired) Can be self-made according to Fiala et al. 2011 |
| 4–15% Mini-PROTEAN TGX Precast Protein Gels, 10-well, | Bio-Rad | 456-1083 | Pre-run in running buffer to adjust buffer system |
| cOmplete, Mini, EDTA-free | Roche | 11836170001 | use 1 tablet per 50 ml |
| PBS, pH 7.4 bottle a 500 ml Gibco | Thermo Fisher Scientific | 14190-094 | |
| Ponceau S solution | Sigma-Aldrich | P7170 | TOXIC wear gloves and protect eyes |
| NativeMark Unstained Protein Standard 50 µl | Invitrogen | P/N 57030 | load 5 µl/well |
| A549 cells | ATCC | ATCC CCL185 | Grow in growth medium (see Table 1) |
| Vero cells | ATCC | ATCC CCL81 | Grow in growth medium (see Table 1) |
| anti-Mx1 antibody | Novus Biologicals | H00004599_D01P | Use at a 1:1,000 dilution |
| ECL Anti-rabbit IgG, Horseradish Peroxidase linked whole antibody (from donkey) | GE-Healthcare | NA934V | Use at a 1:10,000 dilution |
| 0.5% Trypsin-EDTA (1x) Life Technologies | Thermo Fisher | 15400-054 | |
| Iodoacetamide 5 g | Sigma-Aldrich | I-6125 | stock 100 mM |
| Bromphenolblue | Sigma-Aldrich | B0126-25G | |
| DMEM +4.5g/l Gluc,+L-Glut,+Pyruvate life technologies | Thermo Fisher Scientific | 41966-029 | |
| Pen Strep 100 x 100ml life technologies | Thermo Fisher Scientific | 15140 - 130 | |
| Glutamax 100x Stock, 100 ml life technologies | Thermo Fisher Scientific | 350500-038 | |
| Fetal Bovine Serum, Dialyzed , US Origin 500 ml Gibco Lot:42G9552K | Thermo Fisher Scientific | 10270-106 | |
| Cellulose filter paper | Bio-Rad | 1703965 | |
| PVDF blotting membrane | GE-Healthcare | 10600022 | |
| Tris(hydroxymethyl)aminomethane | Biosolve | 0020092391BS | |
| sodium fluoride (NaF) | Sigma Aldrich | S-7920 | |
| NP-40 | Calbiochem | 492015 | |
| cOmplete, Mini, EDTA-free | Roche | 11836170001 | |
| Tween 20 | Calbiochem | 6555204 | |
| CHAPS 10% solution | Amresco | N907 | |
| DL-Dithiothreitol (DTT) | Sigma Aldrich | 43819 | |
| Glycine | Biosolve | 0007132391BS | |
| sodium orthovanadate (Na3VO4) | Sigma Aldrich | 450243 | |
| Glycerol | Sigma Aldrich | G7757 | |
| β-Glycerophospate | Sigma Aldrich | G9422 | |
| Milk powder | Migros/Switzerland | ||
| Methanol | Millipore | 1.06009 | |
| sodium cloride (NaCl) | Sigma Aldrich | 71380 | |
| magnesium chloride (MgCl2) | Amresco | 288 | |
| Sodium dodecyl sulphate (SDS) | Sigma Aldrich | L4509 | |
| sodium hydroxide (NaOH) | Sigma Aldrich | S-8045 |
References
- Baisamy, L., Jurisch, N., Diviani, D. Leucine zipper-mediated homo-oligomerization regulates the Rho-GEF activity of AKAP-Lbc. J Biol Chem. 280, 15405-15412 (2005).
- Chen, C. P., Posy, S., Ben-Shaul, A., Shapiro, L., Honig, B. H. Specificity of cell-cell adhesion by classical cadherins: Critical role for low-affinity dimerization through beta-strand swapping. Proc Natl Acad Sci U S A. 102, 8531-8536 (2005).
- Jackson-Fisher, A. J., Chitikila, C., Mitra, M., Pugh, B. F. A role for TBP dimerization in preventing unregulated gene expression. Mol Cell. 3, 717-727 (1999).
- Torshin, I. Activating oligomerization as intermediate level of signal transduction: analysis of protein-protein contacts and active sites in several glycolytic enzymes. Front Biosci. 4, 557-570 (1999).
- Goodsell, D. S., Olson, A. J. Structural symmetry and protein function. Annu Rev Biophys Biomol Struct. 29, 105-153 (2000).
- Flydal, M. I., Martinez, A. Phenylalanine hydroxylase: function, structure, and regulation. IUBMB Life. 65, 341-349 (2013).
- Haller, O., Kochs, G. Human MxA protein: an interferon-induced dynamin-like GTPase with broad antiviral activity. J Interferon Cytokine Res. 31, 79-87 (2011).
- Haller, O., Staeheli, P., Schwemmle, M., Kochs, G. Mx GTPases: dynamin-like antiviral machines of innate immunity. Trends Microbiol. 23, 154-163 (2015).
- Di Paolo, C., Hefti, H. P., Meli, M., Landis, H., Pavlovic, J. Intramolecular backfolding of the carboxyl-terminal end of MxA protein is a prerequisite for its oligomerization. J Biol Chem. 274, 32071-32078 (1999).
- Janzen, C., Kochs, G., Haller, O. A monomeric GTPase-negative MxA mutant with antiviral activity. J Virol. 74, 8202-8206 (2000).
- Gao, S., et al. Structure of myxovirus resistance protein a reveals intra- and intermolecular domain interactions required for the antiviral function. Immunity. 35, 514-525 (2011).
- Nigg, P. E., Pavlovic, J. Oligomerization and GTP-binding Requirements of MxA for Viral Target Recognition and Antiviral Activity against Influenza A Virus. J Biol Chem. 290, 29893-29906 (2015).
- Gao, S., et al. Structural basis of oligomerization in the stalk region of dynamin-like MxA. Nature. 465, 502-506 (2010).
- Ghosh, I., Hamilton, A. D., Regan, L. Antiparallel leucine zipper-directed protein reassembly: Application to the green fluorescent protein. J Am Chem Soc. 122, 5658-5659 (2000).
- Patching, S. G. Surface plasmon resonance spectroscopy for characterisation of membrane protein-ligand interactions and its potential for drug discovery. Biochim Biophys Acta. 1838, 43-55 (2014).
- Kenworthy, A. K. Imaging protein-protein interactions using fluorescence resonance energy transfer microscopy. Methods. 24, 289-296 (2001).
- Wyatt, P. J. Light-Scattering and the Absolute Characterization of Macromolecules. Analytica Chimica Acta. 272 (93), 1-40 (1993).
- Howlett, G. J., Minton, A. P., Rivas, G. Analytical ultracentrifugation for the study of protein association and assembly. Curr Opin Chem Biol. 10, 430-436 (2006).
- Fiala, G. J., Schamel, W. W., Blumenthal, B. Blue native polyacrylamide gel electrophoresis (BN-PAGE) for analysis of multiprotein complexes from cellular lysates. J Vis Exp. , (2011).
- Zou, H., Li, Y., Liu, X., Wang, X. An APAF-1.cytochrome c multimeric complex is a functional apoptosome that activates procaspase-9. J Biol Chem. 274, 11549-11556 (1999).
- Schagger, H., Cramer, W. A., von Jagow, G. Analysis of molecular masses and oligomeric states of protein complexes by blue native electrophoresis and isolation of membrane protein complexes by two-dimensional native electrophoresis. Anal Biochem. 217, 220-230 (1994).
- Walker, J. M. Nondenaturing polyacrylamide gel electrophoresis of proteins. Methods Mol Biol. 32, 17-22 (1994).
- Stoscheck, C. M. Quantitation of protein. Methods Enzymol. 182, 50-68 (1990).
- Wisskirchen, C., Ludersdorfer, T. H., Muller, D. A., Moritz, E., Pavlovic, J. Interferon-induced antiviral protein MxA interacts with the cellular RNA helicases UAP56 and URH49. J Biol Chem. 286, 34743-34751 (2011).
- Stertz, S., et al. Interferon-induced, antiviral human MxA protein localizes to a distinct subcompartment of the smooth endoplasmic reticulum. J Interferon Cytokine Res. 26, 650-660 (2006).
- Seddon, A. M., Curnow, P., Booth, P. J. Membrane proteins, lipids and detergents: not just a soap opera. Biochim Biophys Acta. 1666, 105-117 (2004).
- Kochs, G., Haener, M., Aebi, U., Haller, O. Self-assembly of human MxA GTPase into highly ordered dynamin-like oligomers. J Biol Chem. 277, 14172-14176 (2002).
- Kochs, G., Haller, O. GTP-bound human MxA protein interacts with the nucleocapsids of Thogoto virus (Orthomyxoviridae). J Biol Chem. 274, 4370-4376 (1999).
- Reichelt, M., Stertz, S., Krijnse-Locker, J., Haller, O., Kochs, G. Missorting of LaCrosse virus nucleocapsid protein by the interferon-induced MxA GTPase involves smooth ER membranes. Traffic. 5, 772-784 (2004).
- Wisskirchen, C., Ludersdorfer, T. H., Muller, D. A., Moritz, E., Pavlovic, J. The cellular RNA helicase UAP56 is required for prevention of double-stranded RNA formation during influenza A virus infection. J Virol. 85, 8646-8655 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved