Method Article
İzolasyon ve murin lenfositlerin aktivasyonu
Bu Makalede
Özet
Lymphocytes are the major players in adaptive immune responses. Here, we present a lymphocyte purification protocol to determine the physiological functions of the desired molecules in lymphocyte activation in vitro and in vivo. The described experimental procedures are suitable for comparing functional capacities between control and genetically modified lymphocytes.
Özet
B and T cells, with their extremely diverse antigen-receptor repertoires, have the ability to mount specific immune responses against almost any invading pathogen1,2. Understandably, such intricate abilities are controlled by a large number of molecules involved in various cellular processes to ensure timely and spatially regulated immune responses3. Here, we describe experimental procedures that allow rapid isolation of highly purified murine lymphocytes using magnetic cell sorting technology. The resulting purified lymphocytes can then be subjected to various in vitro or in vivo functional assays, such as the determination of lymphocyte signaling capacity upon stimulation by immunoblotting4 and the investigation of proliferative abilities by 3H-thymidine incorporation or carboxyfluorescein diacetate succinimidyl ester (CFSE) labeling5-7. In addition to comparing the functional capacities of control and genetically modified lymphocytes, we can also determine the T cell stimulatory capacity of antigen-presenting cells (APCs) in vivo, as shown in our representative results using transplanted CFSE-labeled OT-I T cells.
Giriş
Mature lymphocytes generally exist in the resting state if there is no pre-existing infection or inflammation in the individual. Therefore, it is important to retain the naïve status of lymphocytes during the isolation process before performing in vitro or in vivo functional assays. The key to ensuring consistent and reproducible results is to limit any unnecessary manipulation of the cells.
Magnetic cell sorting utilizes antibodies and microbeads to label cells so as to enrich the cell population of interest. With this approach, there are two purification strategies: positive enrichment and negative depletion. Positive enrichment enriches the cell population of interest using an antibody that binds to the target cells. Negative depletion, on the other hand, depletes non-target cells, leaving the cell population of interest. In our lab, we prefer negative depletion to positive enrichment because the binding of antibodies to the target cells could potentially alter cell features and behavior. In fact, many established cell surface markers suitable for the isolation of a particular cell population are also functional receptors.
Magnetic cell sorting not only yields highly pure populations of viable target cells, it is also less time-consuming and avoids the cellular stress induced by high-pressure flow used in fluorescence-activated cell sorting (FACS). By labeling the unwanted cell populations and depleting them using a magnetic separation column, we are able to perform rapid cell isolation without compromising the viability of the target cell population. In this protocol, we demonstrate the use of negative depletion strategies to purify naïve B cells or T cells.
Protokol
Tüm fareler yetiştirilen ve özel patojen içermeyen koşullar altında korunur ve tüm fare protokolleri Kurumsal Hayvan Bakım ve Kullanım Komitesi kurallarına uygun olarak yürütülmektedir vardır.
Tamponlar ve Reaktiflerin hazırlanması 1.
- 55 uM 2-merkaptoetanol tamamlandı Roswell Park Memorial Institute (RPMI) ortamında (% 10 ısı ile inaktive edilmiş fetal büyükbaş hayvan serumu (FBS), 2 mM L-glutamin, penisilin (100 lU / ml) / streptomisin (100 ug / ml) hazırlayın ).
- Ayrı, 20x Dengeli Tuz Çözeltisi (BSS) Stok 1 ve Stok 2 hazırlayın.
- 20x BSS stok 1 (1 L steril su içinde 111 mM dekstroz, 8.8 mM potasyum fosfat, 26.7 mM sodyum fosfat dibazik) hazırlanması ve son hacim ayarlamasından önce, 20x BSS stoklar 1-40 ml% 0.5 Fenol Kırmızısı ekleyin. 4 ° C'de depolamadan önce 0.2 mikron filtre kullanılarak steril filtre.
- 20x BSS stok 2 (25.8 mM kalsiyum klorür dihidrat, 107 mM potasyum klorür, 2.73 M sodyum ch hazırlayınloride, 19.6 mM magnezyum klorür hekzahidrat, 1 L'lik steril su içinde 16.6 mM magnezyum sülfat). 4 ° C'de depolamadan önce 0.2 mikron filtre kullanılarak steril filtre.
- 400 ml steril su her ayrı 50 ml BSS stok 1 ve 50 ml BSS stok 2 sulandırmak, deneysel kullanım için 1x BSS hazırlamak. , Seyreltilmiş çözüm birleştirin pH 7'ye ayarlamak ve 20 ml FBS (% 2) ilave edilir. 0.2 um filtre kullanılarak steril su ve steril filtre kullanılarak 1 L doldurun.
NOT: Konsantre BSS stoklarının karıştırılması doğrudan yağış neden olabilir çünkü BSS stok çözeltileri ayrı ayrı hazırlanmalıdır.
- Kırmızı kan hücresi (RBC) Liziz Tamponu
- RBC liziz tamponu kullanımdan önce 1 parçası hazır Tris-baz (steril su içinde 130 mM Tris (hidroksimetil) aminometan, pH 7.65) 9 parça hazır amonyum klorür (steril su içinde 155 mM amonyum klorür) karıştırın.
Not: 4 ° C'de amonyum klorür ve Tris-bazın mağazası steril stok çözeltileri. lizis b hazırlayınRBCs verimli parçalama sağlamak için taze Uffer.
- RBC liziz tamponu kullanımdan önce 1 parçası hazır Tris-baz (steril su içinde 130 mM Tris (hidroksimetil) aminometan, pH 7.65) 9 parça hazır amonyum klorür (steril su içinde 155 mM amonyum klorür) karıştırın.
Dalak veya lenf nodu gelen Lenfosit Süspansiyon 2. Nesil
NOT: fare ötanazi önce deney için gerekli tüm reaktifler ve ekipman hazırlamak ve yüksek hücre canlılığı korumak için mümkün olduğunca çabuk lenfositlerin tek hücre süspansiyonları üretmek için önemlidir.
- Servikal dislokasyon veya CO 2 boğulma tarafından deneysel fare Euthanize.
Not: itibaren Bu adımdan tüm deneysel işlemler aseptik olarak yapılmalıdır. - Herhangi bir kesiler yapmadan önce% 70 etanol içine tüm fare batırın. Dalak ve lenf düğümleri aseptik 8 çıkarın ve ya (aşama 1.2.3 den) BSS / FBS (% 2 FBS ile RPMI) 5 ml buz gibi soğuk RPMI / FBS ihtiva eden ayrı ayrı 15 ml tüpler yerleştirin.
Not: BSS etkin RBC parçalama engellediğinden, dalak hücre süspansiyonu hazırlamak için RPMI kullanmak afte BSS geçmekr RBC parçalama. - 2 ml buz gibi soğuk RPMI / FBS BSS / FBS içeren bir petri steril 100 um hücre filtresi örgü iki adet arasında organ (lar) yer, dalak ve lenf düğümleri, tek bir hücre süspansiyonu üretmek için. Çok ince parçalar halinde yırtılmış kadar 1 ml şırınga pistonu kullanarak, organı (ler) ezin.
- 15 ml tüp hücre süspansiyonu aktarın ve hücre süzgecinden buz soğukluğunda olarak RPMI / FBS BSS / FBS ile örgü yıkayın. Kalan hücre süspansiyonu toplayın aynı 15 ml tüp ekleyin ve 4 ° C'de 5 dakika boyunca 453 xg'de aşağı doğru döndürün. süpernatantı.
NOT: Sonraki adımda RBC parçalama tamponu veya orta eklemeden önce parmaklarıyla tüp hafifçe vurarak pelet hücreleri askıya Re. - Hücre süspansiyonu santrifüje esnasında oda sıcaklığında (RT) RBC liziz tamponu (adım 1.3 bkz.). Süpernatant hücrelerin peletleme ve çıkardıktan sonra, her 10 8 hücreleri için 1 ml RBC parçalama tamponu ile hücrelerin yeniden askıya. incukesmek 3-4 dakika boyunca oda sıcaklığında lizis reaksiyonu.
- 14 ml buz gibi soğuk BSS / FBS ile RBC lizis durdurun ve 4 ° C'de 5 dakika boyunca 453 xg'de aşağı doğru döndürün.
B ve T hücrelerinin 3. saflaştırılması
- B hücrelerinin saflaştırılması
- Bir hemasitometre kullanarak hücreleri saymak. 300 ul BSS / FBS kadar 10 8 dalak hücreleri yeniden askıya ve 50 ul anti-CD43 manyetik mikroboncukları 9,10 ekleyin. , Ölü hücreleri çıkarmak 30 ul Annexin V manyetik boncuklar ekleyin. 30 dakika boyunca 4 ° C'de buzdolabında hücre süspansiyonu inkübe edin.
- T hücreleri ile saflaştırılması
- Bir hemasitometre kullanarak hücreleri saymak. Olmayan T hücre tükenmesi antikor kokteyli 10 8 hücreleri (CD19, B220, Gr-1 karşı biotinlenmiş antikorlar kadar yeniden askıya TCR-γδ, CD49b, CD11c, CD11b, Ter119 ve CD4 veya CD8 hedef hücre popülasyonuna bağlı olarak / FBS 4,5 200 ul BSS 200:) arındırılmalıdır, 1 seyreltilmiş. Bir hücre süspansiyonu inkübe15 dakika boyunca 4 ° C'de bir buzdolabı.
- İnkübasyondan sonra, hücreler yıkama ve 4 ° C'de 5 dakika boyunca 453 x g'de döndürülür ve 10 mi BSS / FBS ekleyin. Süpernatantı ve 30 ul streptavidin mikro boncuklar ve 15 ul Annexin V manyetik boncuklar ile 165 ul BSS / FBS hücreleri yeniden askıya. 30 dakika boyunca 4 ° C'de buzdolabında hücre süspansiyonu inkübe edin.
NOT: bile manyetik mikro-ile etiketleme sağlamak 15 dakika boyunca mikro-hücreleri inkübe sonra 15 ml tüp dokunarak yavaşça hücre süspansiyonu karıştırın ve adım 3.1.1 sırasında başka bir 15 dakika inkübe etmek. ya da 3.2.2.
- Hücre Arıtma için Ayırma Sütunu hazırlanması
- Hücrelerin microbead etiketleme sırasında kullanılmayan bir ayırma kolonu hazırlayın (adım 3.1.1. ya da 3.2.2.). RT'ye (FBS olmadan) Pre-sıcak BSS ve yıkama ve aseptik sütun dengelenmeye 2 ml kullanın. BSS ile dengelendikten sonra, yıkanmış, kolon kurumasına izin verilmemelidir.
NOT: LS c kullanınolumn yerine tavsiye edilen LD sütun nedeniyle yeniden kullanılabilirlik (adım 3.4.). - Manyetik boncuklar ile etiketleme işleminden sonra, hücreler yıkama ve 4 ° C'de 5 dakika boyunca 453 x g'de döndürülür ve 14 ml BSS / FBS ekleyin. Süpernatantı ve 1-3 ml RT BSS hücreleri yeniden askıya.
- saflaştırma işlemi sırasında akış oranını azaltmak için sütunun ucuna steril 21 G iğne takın. dengelenmiş kolona hücre süspansiyonu yükleyin ve saflaştırılmış hedef hücreleri ihtiva eden akışı toplamak.
NOT: sütuna yükleme sırasında içine kabarcıkları tanıtan kaçının. - 1 mi BSS / FBS ile bir kez kolon yıkaması ve saflaştırılmış hedef hücreleri ihtiva eden akışı toplamak. bir kez daha içinden akışı ile sütun yeniden yükleyin. Aynı 15 ml tüp ikinci yüklemeden sonra akışı toplayın.
- 1 ml BSS / FBS ile sütun 3 kere yıkayın ve saflaştırılmış hedef hücreleri ihtiva eden akışı toplamak. Bundan sonra, th 5 ml BSS / FBS ekleyinBir dalgıç ile e kolon ve yeni bir 15 ml tüp içine sütun dışında manyetik etiketli hücreleri yıkayın.
- Saflaştırılmış B veya T hücrelerinin 4,5 antijenlerini yüzey bağlanan antikorlar kullanılarak akış sitometrisi ile toplanan hücreler saflığını kontrol edin.
- Hücrelerin microbead etiketleme sırasında kullanılmayan bir ayırma kolonu hazırlayın (adım 3.1.1. ya da 3.2.2.). RT'ye (FBS olmadan) Pre-sıcak BSS ve yıkama ve aseptik sütun dengelenmeye 2 ml kullanın. BSS ile dengelendikten sonra, yıkanmış, kolon kurumasına izin verilmemelidir.
- Yeniden kullanılması ayırma kolonunun
NOT: LS sütun arıtma verimini etkilemeden 4 kata kadar tekrar edilebilir.- 5 ml fosfat tamponlu tuz (PBS) ve pistonu kullanan üstten damıtılmış su, 5 ml 3 kez sütun 3 kez yıkayın.
- 5 ml% 70 etanol ile sütun yıkayın ve yoğun sütunda pas oluşumunu önlemek için bir hava musluğunu kullanarak sütun kurutun.
- ayn bir saflaştırma deneyi için el LS kolonu hazırlamak için, şırınga adaptörü kullanarak 5 mi,% 70 etanol ile aşağıdan yukarıya doğru sütun yıkayın. Daha sonra, sütun üst bir kez 5 ml PBS ve ardından, 5 ml steril PBS ile iki kez aşağıdan yukarıya doğru sütun yıkayın. 2 ekleml RT BSS sütun dengelenmesi ve ardından etiketli hücreleri ile kolon yükleme devam etmek.
4. KAKE Etiketleme ve Uyarım
Not: Saflaştırılmış hücreleri, in vitro çeşitli ve in vivo fonksiyonel deneylerde tabi tutulabilmektedir. Burada, APC '5 T hücresi uyarılması yeteneğini belirlemek için, saflaştırılmış T hücreleri kullanır.
- 37 ° C öncesinde CFSE yüklenmesi Pre-sıcak etiketleme çözümü (PBS içinde% 0.1 FBS).
Not: PBS içinde FBS düşük bir yüzde kullanarak CFSE yükleme esnasında hücre ölümünü azaltır ve santrifüj sırasında hücre kaybını en aza indirir. Ancak, çok fazla FBS KAKE yükleme engelleyebilir. - Etiketleme çözeltisi ile iki kez saflaştırıldı hücreler yıkanır, daha sonra 15 ml'lik bir tüp içinde önceden ısıtılmış markalama çözeltisi içinde 2 x 10 7 hücre / ml'de yeniden süspanse edilir.
- 10 uM KAKE çözeltisi hazırlayın (1: 500 seyreltme 5 mM KAKE stok solüsyon) önceden ısıtılmış etiketleme çözeltisi içinde. KAKE çözümü gerekirtaze optimum etiketleme elde etmek için her zaman hazır olun.
- CFSE ile hücrelerin yüklemek için, 37 ° C 'de 10 dakika süre ile karanlıkta, 15 ml'lik bir tüp içinde 1 kısım 10 uM CFSE çözeltisine 1 kısım hücre süspansiyonu ekleyin ve inkübe edilir. 5 uM CFSE bir son konsantrasyon elde 1 x 10 7 hücre / ml etiketlemek için kullanılır.
- CFSE yükleme esnasında hücre, homojen bir karışım sağlamak için tüpü her 2 dakikada ters çevirin.
- , Reaksiyonu durdurmak buz soğukluğunda tam RPMI ortamında bir çok sayıda ekleme ve 4 ° C'de 5 dakika boyunca 453 x g'de döndürülür ve. Başarılı KAKE yükleme üzerine, hücre pelet sarımsı görünecektir.
- Yıkama CFSE buz soğukluğundaki tam RPMI ortamı ile hücreler bir kez daha yüklenir ve in vitro kültür için ya da in vivo uyarılması kullanılmadan önce, 4 ° C'de 5 dakika boyunca 453 x g'de aşağı doğru döndürün.
5. İn vitro uyarma
- kullanımdan hemen önce uyaranların 2x stok solüsyonu (2x uyaranlara stok çözelti) hazırlayın 10 ve böylece2x uyaranlara stok çözeltisi 0 ul, 96 oyuklu bir plaka içerisinde, oyuk başına 200 ul nihai bir hacme 100 ul hücre ilave edilebilir.
- (B hücreleri ve T hücreleri için, CD3 ve CD28 için IgM veya CD40) uyaranlara ile kaplanmış bir tabak gerekli ise, bir gece boyunca 4 ° C'de PBS içinde uyaranlara ve ön-kaplama kültürü plakası seyreltin. Seçenek olarak ise, kültür plakası Deney gününde 1 saat boyunca 37 ° C 'de kaplanabilir. PBS (plaka, herhangi bir zamanda kurumasına izin vermeyin) ile iki kez kaplanmış plaka yıkayın.
| B hücreleri için | |
| uyaranlar | Nihai konsantrasyon |
| F (ab ') 2 keçi anti-fare IgM | 0,6-2,4 ug / ml |
| Fare karşıtı CD40 mAb | 0.5-2 ug / ml |
| rekombinantfare IL-4 | 25 U / ml |
| lipopolisakkarit | 0,1-10 ug / ml |
| E. (LPS) E. coli serotipi 055: B5 | |
| T hücreleri için, | |
| uyaranlar | Nihai konsantrasyon |
| Anti-CD3 (plaka kaplı) | 2-10 ug / ml |
| (50 ul / oyuk kaplama) | |
| Anti-CD28 (plaka kaplı) | 2 ug / ml |
| Rekombinant IL-2 | 40 U / ml |
| PDBu (forbol ester) | 5-50 ng / ml |
| A23187 (Kalsiyum İyonofor) | 250 ng / ml |
Tablo 1: in vitro kültür içinde lenfositleri uyarmak için kullanılan uyarıcı konsantrasyonu.
- CFSE, etiketli B hücreleri için, 3 x 10 5 hücre ile üç nüsha tam RPMI ortamı ve kültürde 6 ila 10 x 3 hücre / ml yeniden askıya / kuyuda 72 saat için 96-gözlü düz tabanlı plakalar.
- CFSE-etiketli T hücreleri için, 0.5-3 x 10 5 hücre ile üç nüsha tam RPMI ortamı ve kültür 0,5-3 x 10 6 hücre / ml'de yeniden askıya / kuyuda 48 ya da 72 saat süre ile, 96-gözenekli yuvarlak tabanlı plakalar .
6. in vivo uyarılmasına
- In vivo uyarılmasına, adoptif transferi için fare başına 4 x 10 6 KAKE etiketli T hücreleri (intravenöz (iv) 200 ul PBS) her MHC-uyumlu alıcı fare içine.
NOT: Bu protokol, KAKE etiketli T hücreleri adoptively ev gibi dalak ve lenf düğümleri olarak lenfoid organlara olacak bu hücrelerin olarak kuyruk ven ya da retro-orbital enjeksiyonu kullanılarak transfer edilebilir. - Bir gün sonra antijen ile alıcı fareler meydan.
NOT:OVA-spesıfik T hücresi reseptörü (TCR) -transgenic T hücrelerinin adoptif alıcı farelere aktarıldı, bu örnekte, antijen olarak ovalbumin (OVA proteini, 50 ug / fare) kullanın. Her alıcı farenin 5 içine, deri altı enjeksiyon (si) üzerinden, steril PBS OVA proteini hazırlayın ve OVA protein / PBS veya PBS kontrol 100 ul enjekte edilir. - Hasat ve 3 gün OVA proteini veya PBS ile immünizasyondan sonra alıcı farelerin bir lenfoid organlara hücre süspansiyonları (lenf düğümleri ve dalak) oluşturur. proksimal lenf nodlarının mezenterik, popliteal, inguinal, lomber ve kuyruklu lenf düğümleri içeren aksiller, brakial ve yüzeysel servikal lenf düğümleri) ve distal lenf nodları (DLN) içerir (PLN), içine ayrı lenf nodları. Uygun FACS antikorları kullanarak leke hücreler, T hücre çoğalması kontrol etmek için.
NOT: Bu KAKE hücre izleme deneyinde olmayan di için bir temel floresan kurmak PBS enjekte edilmiş kontrol farelerinden T hücrelerinin KAKE etiketliHücreleri sa¤layan. Çoğalan hücre bölünmeleri, antijen ile uyarılmış, KAKE etiketli hücreler floresan zirveleri 12,13 ölçülerek tarafından görüntülenmiştir. PBS kontrolü ile, çoğalan hücre bölünmeleri sayısı KAKE etiketli T hücreleri 12,13 belirlenebilir. - Örnekler arasında, hücre bölümleri veya tepe sayısını karşılaştırarak CFSE etiketli hücre proliferasyon verileri analiz (Şekil 1 ve 2).
Not: Örneğin, CFSE etiketli, adoptif OVA antijen alıcı alıcı farelere aktarıldı OVA spesifik T hücreleri, PBS enjekte edilmiş kontrol farelerine kıyasla 5,12 aktif proliferasyonunu uğrayacaktır. Ayrıca, Hawkins ve arkadaşları 14 tarafından gösterildiği gibi KAKE hücre çoğalma verileri analiz etmenin birçok yolu vardır işaret etmek çekicidir.
Sonuçlar
lenfositlerin manyetik hücre saflaştırma kullanıcılara zaman nispeten kısa bir miktarda bir hedef hücre popülasyonu arındırmak için izin verir. Bizim tükenmesi protokolü kullanarak, arıtıldıktan sonra 94.2% (için 72,8% (önceki arıtma) den (rekombinasyon aktive gen 1 (RAG-1) -açıklı farelerde OT-I) CD8 T hücrelerinin yüzdesini artırmak başardık; Şekil 1A) 4,5. Bu arıtılmış, lenfositler, daha sonra olan limfosit proliferasyon ve sinyal transdüksiyonunu 4,5 belirlemek için alt-fonksiyon deneyleri için de kullanılabilir. Örneğin, APC 'in vivo T hücresi uyarımı kapasitesini incelemek için vahşi tip (WT) ve uygun bir antijen 5 ile aşılanmış mutantı (MT) farelere CFSE etiketli antijen-spesifik T hücrelerinin aktararak.
Bizim Örnek deneyde, saflaştırılmış, CFSE etiketli, ovalbumin (OVA) belirli bir OT-I CD8 T C transferkontrol (WT) ve mutant (MT) farelere arşın ve OVA proteini ile bir gün sonra bu fareler bağışıklık kazandırılmış. Üç gün immünizasyondan sonra, lenf nodları (yakın ve uzak) ve dalaklar toplandı ve akış sitometrisi ile T hücrelerinin analiz edilmiştir. CD45 alelik formları daha etiketli olmayan alıcı CD8 T hücrelerinden bölünmesi CFSE etiketli verici OT-I CD8 hücreleri ayırmak için kullanılabilir. Bu örnekte, verici ve alıcı hücreler CD45.1 ve CD45.2 farelerde sırasıyla (Şekil 1B) vardır. Bu zaman noktasında hayatta kalma CFSE kat, uyarılmamış OT-I T hücreleri, proliferasyon hücreleri (Şekil 1 C, noktalı çizgi) için pik tanımlamak için kullanılır. stimülasyon üzerine, OT-I T hücrelerinde KAKE düzeylerinin yoğunluğu her bölümü ile yarı yarıya azaltacaktır. T hücresi proliferasyonu, böylece CFSE 6,12 zirvelerin sayısı sayımı ile tespit edilebilir. Bizim temsilcisi sonuçları, biz WT ve MT APC 'çapraz sunum kapasiteleri farklılıkları (görmüyorumŞekil 1C, düz çizgiler), T-hücreleri iki farede benzer oranlarda prolifere yana.
Ayrı bir deneyde, etkin kontrol ve MT T hücrelerinin hücre proliferasyonunu incelemek için [3H] -timidin katılması deneyi gerçekleştirilmiştir. Saflaştırılmış WT MT T hücreleri 48 saat için çeşitli uyaranlara ile uyarılır ve son 8 saat [3H] ııCi ile doldurulmuşlardır. Hücre döngüsünün S-fazında hücrelerin çoğalması radyo-etiketli nükleotid içerecektir, [3H] -timidin, yeni sentezlenmiş deoksiribonükleik asit (DNA) içine, bu nedenle, sıvı sintilasyon sayımı kullanılırsa, hücre çoğalması ölçülebilir [3H] -timidin alımı. Dakika (CPM) başına sayıyı doğrudan T hücrelerinin proliferasyon [3H] -timidin alım miktarı ile ilişkilidir. Bizim temsilcisi sonuçlarında, uyarılması üzerine MT T hücrelerinin elde edilen cpm sayısı azaltılmış c karşılaştırıldığındaWT T hücrelerinden tutarları MT T hücreleri (Şekil 1D) içindeki bir tehlikeye proliferatif kapasitesini gösterir.
B hücresi çoğalma kapasitesini belirlemek için, tarif edilen tüketim stratejisi kullanılarak splenik B hücrelerinin arıtıldı. Saflaştırma üzerine, 98,4% ile (saflaştırma önce) 63.9 den% B220 B hücreleri (WT fareler) yüzdesini artırmak için başardık (arıtmadan sonra; Şekil 2A) 4. T hücreleri arıtılmış, benzer şekilde, saflaştınlmış splenik B hücreleri, lenfosit proliferasyonunu ve sinyal transdüksiyonunu 4 değerlendirmek için alt fonksiyonel deneyleri için de kullanılabilir. Daha sonra biz CFSE ile saflaştırılmış WT splenik B hücrelerinin etiketlenmesi ve sitokin, IL-4 ile takviye edilmiş bir anti-CD40 ile kaplanmış plakalar kullanılarak bu hücrelerin in vitro uyarılmış. Üç gün uyarıldıktan sonra, biz flow sitometri canlı, aktif B hücreleri analiz. Hayatta kalma CFSE kat, bu zaman noktasında uyarılmamış B hücreleri için kullanılanproliferasyon hücreleri (Şekil 2B, noktalı çizgi) için pik tanımlar. T hücrelerine benzer, B hücrelerinde KAKE düzeylerinin yoğunluğu her bölüm 6,12 ile yarı yarıya azaltacaktır.
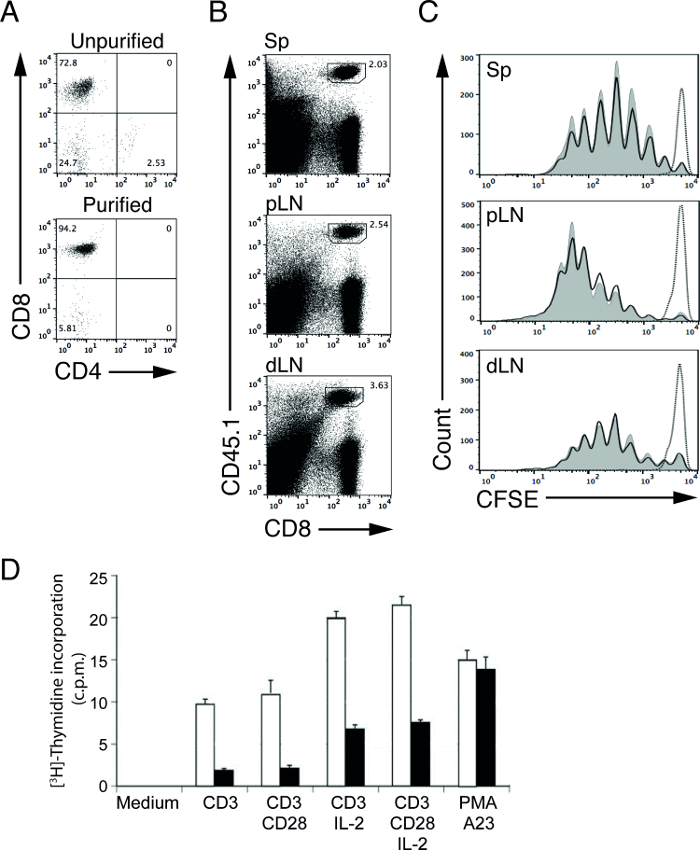
Şekil 1: aşılamadan sonra adoptif transfer saflaştınldı OT-I T hücrelerinin CFSE profilleri OT-I izole edilmiş hücrelerin (A) CD4 ve CD8 boyama;. RAG-1-eksikliği olan fareler daha önce (üst panel) ve (alt panel) T hücre dışı yok olmasından sonra. (B) dalak (Sp) T hücrelerinin Temsilcisi FACS araziler, proksimal lenf düğümleri (PLN) ve distal lenf düğümleri (DLN). Donör OT-I CD8 T hücreleri olumlu CD45.1 vardır. Dalak aktarılan, CFSE etiketli OT-I donör T hücrelerinin (C) Örnek CFSE profilleri (SP) yakın lenf nodları (PLN) ve distal lenf düğümleri WT (dLn) (eğrileri gölgeli) veMT (katı çizgiler) alıcı fareler 3 gün OVA proteini ve LPS ile aşılama sonrası. Noktalı çizgi (PBS enjekte) immünizasyon yapılmadan WT alıcı fareler OT-I T hücreleri göstermektedir. [3H] -timidin alım deneyi ile ölçüldüğü gibi aktive edilmiş kontrol veya MT T hücrelerinin (D) Hücre çoğalması. Sonuçlar dakika (CPM) sayım olarak sunulmaktadır. Saflaştırılmış kontrol (açık çubuk) ve MT (kapalı bar) T hücreleri sadece ortamla (ortam) 48 saat süre ile inkübe edildi ve ya da rekombinant IL-olmayan plaka bağlanan anti-CD3 veya anti-CD3 artı anti-CD28 mevcudiyetinde 2. Poliklonal hücre aktivasyonu PMA (forbol ester) ve A23 (kalsiyum iyonofor) tetikledi. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Şekil 2: KAKE profiliIn vitro stimülasyon üzerine B hücreleri (A). B220 ve (üst panel) önce ve (alt panel) non-B hücre tüketimi sonrasında WT farelerden izole dalak hücrelerinin CD3 boyaması. (B) anti-CD40 ve IL-4 ile kaplanmış plakaların in vitro uyarımın 3 gün sonra CFSE etiketli WT (gölgeli eğrisi) ve splenik B hücrelerinin CFSE Örnek profili. Noktalı çizgi uyarılma olmaksızın KAKE etiketli WT B hücreleri gösterir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Tartışmalar
Bu protokol, lenfoid organların lenfositlerin saflaştırılması için bir prosedürü göstermektedir. manyetik boncuk sıralama kullanılarak hücre arıtma canlı, yüksek düzeyde saflaştırılmış hedef hücreleri verimleri hızlı ve basit bir yöntemdir.
Protokol çerçevesinde kritik adımlar
Hücre canlılığı, ve hücre verimi
In vitro olarak hematopoietik kökenli hücrelerin canlılığını muhafaza başarılı ve tekrarlanabilir deneyler sağlamak için çok önemlidir. Kimyasal ve biyolojik reaktifler, sub-optimal deneysel koşullar ya da eksize organların yanlış saklama koşulları, tüm hücre canlılığını etkileyebilir. farelerden alınan eksizyon üzerine, lenfoid organlar buz ve mümkün olduğunca çabuk hazırlanan tek hücre süspansiyonları saklanan gerekir. hücre süspansiyonları yüksek hızlı santrifüj de kaçınılmalıdır. Bundan başka, hücre topakları Üstte yüzen maddenin çıkarılmasından sonra, parmak Tüpleri iterek gevşek olmalıdır. O değilpipetleme orta büyük miktarlarda doğrudan yeniden askıya pelet için önerilir.
Yaklaşık tüm büyük lenf düğümlerine 2-4 x 10 7 dalak B hücreleri ve 2 x 10 7 T hücreleri, bir 8-10 haftalık WT fare izole edilebilir. Daha önce belirtildiği gibi saflaştırılmış B ve (beklenen değerin altında) T hücrelerinin İndirimli sayılar, sub-optimal koşulları gösterir.
hücre saflık
Bu protokol kullanılarak izole hücrelerin ortalama saflığı vitro veya in vivo deneyler (Şekil 1A) sonraki için yeterince saf olan 90 ila 95,% aralığındadır. Nedeniyle sütunun sınırlı bağlama kapasitesi bunu yaparken hücre saflığını tehlikeye çünkü ayrılık sürecinde hücrelerin aşırı numaraları ile ayırma sütunu aşırı değil tavsiye edilir.
FBS Kalitesi
FBS kalite kültür ortamı lenfositlerinin in vitro yaşam için kritik olarak desteklenmesi için kullanılır. Farklı kaynaklardan gelen toplu FBS nitro lenfosit cevapları desteklemek için yetenekleri açısından farklılık gösterebilir. Bu nedenle, düşük arka plan yüksek spesifik bir yanıt veren aktiviteleri ile FBS farklı test edilmesi önemlidir. Şişe önemli bir sayı daha sonra bir stok olarak saklanmalıdır.
Değişiklikler ve Sorun Giderme
KAKE etiketleme koşulları
CFSE markalama düz RPMI çalışan olsa da, PBS içinde FBS düşük bir yüzde ile etiketleme etkinliğini ödün vermeden, yükleme işlemi esnasında hücre ölümünü azaltır bulmuşlardır. Ayrıca, FBS varlığı santrifüj sırasında hücre kaybını en aza indirir.
CFSE etiketleme önemli bir özelliği, belirgin bir maksimum nokta görselleştirmek için hücrelerin da etiketleme sağlamaktırs hücre bölünmesini temsil ettiğini. CFSE aşırı yüklenmesi, in vitro veya in vivo olarak etiketlenmiş hücrelerin zayıf kazanımı ile artan hücre ölümüne neden olabilir. Diğer yandan, etiketleme işlemi esnasında hedef hücre süspansiyonu yetersiz CFSE markalama veya heterojen CFSE 12 zirveleri zayıf biçimde çözülmüş neden olabilir. Nedenle, CFSE markalama koşullarını optimize etmek için önemlidir. Etiketleme için kullanılan CFSE miktarı aşırı yük potansiyel toksik etkileri azaltmak için mümkün olduğu kadar düşük tutulması, ama yine de, deneysel bir süre içinde stimülasyon üzerine güzel çözüldü ortaya çıkarmak için de yeterli bir etiketleme elde edilmelidir. Buna ek olarak, zayıf biçimde çözülmüş tepe önlemek için, hücre kümeleri CFSE yükleme öncesinde tek hücre süspansiyonları çıkarılmalıdır.
Hücre kümeleri ve hücre kaybı
Sürekli Removable çünkü bir sonraki adıma geçmeden önce hücreleri tamamen yeniden askıya olduğundan emin olmak için önemlidirdeney sırasında hücre kümeleri l ölçüde hücre sayıları azaltır. Hücre kümeleri genellikle düşük hücre canlılığı ve hücre peleti yetersiz yeniden süspansiyon ile ilişkilidir.
KAKE ve emisyon spektrumları örtüşme
Hücreler kültürde daha fazla bir gün sonra fluorofor konjuge antikor ile tanımlanabilir CFSE etiketli, bununla birlikte, bu CFSE etiketli hücreler hâlâ kültür içinde bir gün sonra, parlak flüoresan kalır. Örneğin fikoeritrin (PE) ve fikoeritrin-cyanine 7 (PeCy7) halinde CFSE ile emisyon spektrumu örtüşme asgari miktarda olan aydınlık floroforlar konjüge antikorların kombinasyonları kullanılarak optimal lekelenme sonuçları sağlar. Ancak, tazminat emisyon spektrumları örtüşme hala gereklidir azaltmak için. Ayrıca, bir opt elde etmek için FL-2 değerinin yüksek oranda düşülerek telafi FL-2 kanalına dökülür KAKE sinyali (FL-1 kanal) yüksek yoğunluğu, FL-2 kanal vardır nedeniyleminimal- KAKE profili. Bir Quah et al., Sorun giderme KAKE etiketleme ve sonuçların 12 analizi için çözümler sunar tarafından yayınlanan kağıda başvurabilirsiniz.
CFSE Alternatifler
CFSE emisyon spektrumu, yeşil flüoresan proteini (GFP) ve flüoresein izotiosianat (FITC) ile birleştirilmiş bayır antikorlar gibi flöresin türevleri ile CFSE kombinasyonlarının kullanımını sınırlar. , Sarı (CTY, 555/580 nm) kadar kırmızı (CTFR, 630: mor aynı derecede yüksek floresan yoğunluğu ve düşük hücre toksisitesi (405/450 nm CTV, uyarım / emisyon) diğer ticari olarak temin edilebilen hücre boyalar, ancak, var / 661 nm ya da CPD670, 647/670 nm) ve kırmızı (PKH26, 551/567 nm). Farklı emisyon spektrumları ile hücre etiketleme boyalar kullanılarak deney tasarımında esneklik sağlar. Diğer yandan, yukarıda tarif edilen hücre etiketleme boyaların tüm farklı hücre bölünmesi tepe oluşturabilir. Karşılaştırmalı çalışma kullanılarak yapılançeşitli hücre etiketleme boyalar CTV açıkça tanımlanmış hücre bölünmesi zirveleri 13 daha yüksek sayıda tespitini sağlar çünkü CTV KAKE için daha iyi bir yedek olduğu sonucuna varıldı.
Sınırlamalar
Manyetik hücre sıralama önemli sınırlama basit hücre sıralama için sadece uygun olmasıdır. Bizim örneğimizde, dalak olmayan tüm B hücrelerinin tüketilmesi amacı CD43 kullanabilir; Bununla birlikte, marjinal bölge B hücrelerinden foliküler B hücreleri ayırmak mümkün olmaz. Bu alt topluluklar sadece birden yüzey belirteçleri ile tanımlanabilir. Bu pozitif manyetik hücre kullanarak hücrelerin birden çok yüzey belirteçleri göre ayrılması seçmek mümkün olsa da, ikinci işaretleyici geçmeden önce sıralama birinci turdan sonra hedef hücrelerden mikro-salınımını sağlayacak özel olarak hazırlanmış, ticari olarak temin edilebilen reaktifler bağlıdır. Böylece, kullanıcı piyasada mevcut kitler tamamen bağımlı olacaktır. Böyle bir durumda, FACS Içok daha avantajlı rafine hücre popülasyonlarının ayrılmasında s.
Tekniğin Önemi
Manyetik hücre sıralama ve FACS olarak antikor bazlı hücre sıralama yaklaşımlar, 15 bugüne kadar sıralama teknikleri en güvenilir hücre vardır. Hücre ayrılması için diğer yöntemler, ancak lenfositler zayıf yapışan hücreler olan, yoğunluk-bazlı ve yapışma tabanlı teknikler de dahil olmak üzere, mevcut ve alt tipleri, böylece adherence- ve yoğunluğa dayalı uygulanabilir ya da değil teknikler, yoğunluğundaki nispeten benzer olan ya da çok verimsizdir 15 .
giriş, hızlı, basit, yüksek hücre canlılığı belirtilen ve herhangi bir gelişmiş donanım bağımsız olarak FACS üzerinde sıralama manyetik hücrenin kazanan özellikleridir. az modificatio hedef hücrelerin izole edilmesi sırasında, özellikle negatif azalması olarak, manyetik bir ayırma kolonu kullanılarak istenmeyen hücreleri etiket ayırma manyetik hücre kullanarak tüketirns hücre yüzeyine ve naif durumunu korumak.
gelecek Uygulamaları
Bu manyetik bazlı saflaştırma tekniği ile saflaştırılır, son derece zenginleştirilmiş uygulanabilir ve naif lenfositler lenfosit davranış çeşitli işlevsel tahlillerde ve in vitro ve in vivo olarak sinyal mekanizmaların tabi tutulabilir. Bu protokol, iki farklı hücre çoğalma tahlilleri kullanılarak ortaya - [3H] -timidin katılması deneyi ve CFSE, hücre çoğalma tahlili - aktive lenfositlerin hücre çoğalma kapasitelerini araştırmak.
Arasındaki seçim, [3H] -timidin katılması deneyi ve CFSE, hücre proliferasyon deneyi, büyük ölçüde örnek büyüklüğü ve deneysel koşullara bağlıdır. Büyük çaplı deneylerde [3H] -timidin'in deneyi kullanılarak yüksek verimli hücre çoğalması verilerini oluşturur. sırayla <[uygun sağlamak içinhücrelerin bir çoğunluğu aktif olarak bölünen zaman destek> 3H] -timidin alımı ve sonuçların tekrar üretilebilirliği, [3H] -timidin kültüre ilave edilmelidir. Etiketleme protokol optimizasyonu değişik hücre türleri ve uyarıcılar için gereklidir. Dahası, [3H] -timidin bu birleştirme yöntemi, sadece alıcı farelere nitro (Şekil 2B) serbest duruma ya adoptif transfer edilebilir hücrelerinin CFSE etiketleme, farklı olarak, in vitro olarak gerçekleştirilebilir (Şekil 1B radyoaktif doğasına ve 1C).
CFSE, hücre proliferasyon deneyi, diğer taraftan, [3H] -Timidin birleşimi, daha hücre çoğalması daha fazla bilgi sağlamaktadır. KAKE etiketli hücrelerde KAKE yoğunluğu her hücre bölünmesi ile yarı yarıya azalttığı için, bir hücre bölünmeleri sayısını ve zirveleri sayısını ve boyutunu sayarak her bölümün hücrelerin oranını belirlemek 12,13. Ayrıca, CFSE etiketli hücreler ayrıca, karşılık gelen fluorofor-konjuge antikor kullanılarak akış sitometrisi ile yüzey molekülü ekspresyonuna göre farklı alt-grup halinde tanımlanabilir. Daha da önemlisi, son zaman noktasında hücre çoğalmasını ölçer [3H] -timidin katılması tahlilinde farklı olarak, CFSE, hücre çoğalma tahlili Hücre çoğalma kapasitesi kinetikleri üzerinde daha fazla bilgi sağlamaktadır hücre bölünmesinin izleme sağlar. Ancak, KAKE hücre çoğalma deneyi büyük çaplı deneyler için uygun olmayabilir.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
Çalışma Eğitim, Singapur Bakanlığı (AcRF Tier1-RG40 / 13 ve Tier2-MOE2013-T2-2-038) tarafından desteklenmektedir. el yazması Obrizus Communications Amy Sullivan tarafından düzenlendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Materials | |||
| RPMI 1640 (without L-Glutamine) | Gibco | 31870025 | |
| Fetal Bovine Serum | Heat inactivated | ||
| L-glutamine | Gibco | 25030024 | |
| Penicillin/Streptomycin | Gibco | 15140114 | |
| 2-mercaptoethanol | Gibco | 21985023 | |
| Anti-CD43 magnetic microbeads | Miltenyi Biotec | 130-049-801 | Mix well prior use |
| Streptavidin microbeads | Miltenyi Biotec | 130-048-101 | Mix well prior use |
| Anti-Annexin V magnetic beads | Miltenyi Biotec | 130-090-201 | Mix well prior use |
| MACS LD | Miltenyi Biotec | 130-042-901 | |
| 96-well U-bottom sterile culture plate | Greiner Bio-one | 650180 | |
| 96-well F-bottom sterile culture plate | Greiner Bio-one | 655180 | |
| 100 μm cell strainer mesh | To sterilize using UV radiation prior use | ||
| 0.2 μm sterile disposable filter units | Nalgene | 567-0020 | Can be substituted with any sterile filter device |
| CellTrace Violet | Invitrogen | C34557 | CTV for short; alternative to CFSE |
| CellTrace Yellow | Invitrogen | C34567 | CTY for short; alternative to CFSE |
| CellTrace Far Red | Invitrogen | C34564 | CTFR for short; alternative to CFSE |
| Cell Proliferation Dye eFluor 670 | eBioscience | 65-0840 | CPD670 for short; alternative to CFSE |
| PKH26 | Sigma Aldrich | PKH26GL | PKH26, alternative to CFSE |
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Dextrose | Sigma Aldrich | G7021 | |
| Potassium phosphate monobasic | Sigma Aldrich | P5655 | |
| Sodium phosphate dibasic | Sigma Aldrich | S5136 | |
| Phenol Red | Sigma Aldrich | P0290 | |
| Calcium chloride dihydrate | Sigma Aldrich | C7902 | |
| Potassium chloride | Sigma Aldrich | P5405 | |
| Sodium chloride | Merck Millipore | S7653 | Can use from other sources |
| Magnesium chloride hexahydrate | Sigma Aldrich | M2393 | |
| Magnesium sulfate | Sigma Aldrich | M2643 | |
| Ammonium chloride | Sigma Aldrich | A9434 | |
| Tris-base | |||
| Dimethyl Sulfoxide | Sigma Aldrich | D8418 | |
| (5-(and 6-) carboxyfluorescein diacetate succinimidyl ester (CFSE) | Molecular Probes | C-1157 | Reconstitute in DMSO |
| Phorbol 12,13-dibutyrate (PBDU, Phorbol ester) | Sigma Aldrich | P1269 | |
| A23187 (Calcium ionophore) | Sigma Aldrich | C7522 | |
| Name | Company | Catalog Number | Comments |
| Antibodies and recombinant protein | |||
| CD11b biotin (clone m1/70) | Biolegend | 101204 | T cell depletion cocktail |
| CD11c biotin (clone N418) | Biolegend | 117304 | T cell depletion cocktail |
| Gr-1 biotin (clone RB6-8C5) | Biolegend | 108404 | T cell depletion cocktail |
| Ter119 biotin (clone Ter119) | Biolegend | 116204 | T cell depletion cocktail |
| TCR-γδ biotin (clone GL-3) | Biolegend | 118103 | T cell depletion cocktail |
| CD19 biotin (clone 6D5) | Biolegend | 115504 | T cell depletion cocktail |
| B220 biotin (clone RA3-6B2) | Biolegend | 103204 | T cell depletion cocktail |
| CD49b biotin (clone DX5) | Biolegend | 108904 | T cell depletion cocktail |
| CD4 biotin (clone GK1.5) | Biolegend | 100404 | T cell depletion cocktail |
| CD8 biotin (clone 53-6.7) | Biolegend | 100704 | T cell depletion cocktail |
| F(ab’)2 goat anti-mouse IgM (plate coated) | Jackson ImmunoResearch | 115-006-075 | 50 µl/well for coating (96-well) |
| Anti-mouse CD40 mAb (plate coated) | Pharmingen | 553722 | 50 µl/well for coating (96-well) |
| Recombinant IL-4 | ProSpec | Cyt-282 | |
| LPS from E. coli Serotype 055:B5 | Sigma Aldrich | L-4005 | |
| Anti-CD3 (clone clone OKT3) (plate coated) | eBioscience | 16-0037-85 | 50 µl/well for coating (96-well) |
| Anti-CD28 (clone clone 37.51) (plate coated) | eBioscience | 16-0281-85 | 50 µl/well for coating (96-well) |
| Recombinant IL-2 | ProSpec | Cyt-370 | |
| Albumin from chicken egg white, Ovalbumin | Sigma Aldrich | A7641 |
Referanslar
- Nikolich-Žugich, J., Slifka, M. K., Messaoudi, I. The many important facets of T-cell repertoire diversity. Nat. Rev. Immunol. 4 (2), 123-132 (2004).
- LeBien, T. W., Tedder, T. F. B lymphocytes: how they develop and function. Blood. 112 (5), 1570-1580 (2008).
- Brownlie, R., Zamoyska, R. T cell receptor signaling networks: branched, diversified and bound. Nat. Rev. Immunol. 13 (4), 257-269 (2013).
- Neo, W. H., Lim, J. F., Grumont, R., Gerondakis, S., Su, I. C-rel regulates ezh2 expression in activated lymphocytes and malignant lymphoid cells. J. Biol. Chem. 289 (46), 31693-31707 (2014).
- Gunawan, M., et al. The methyltransferase Ezh2 controls cell adhesion and migration through direct methylation of the extranuclear regulatory protein talin. Nat Immunol. 16 (5), 505-516 (2015).
- Lyons, A. B., Parish, C. R. Determination of lymphocyte division by flow cytometry. J. Immunol. Methods. 171 (1), 131-137 (1994).
- Cabatingan, M. S., Schmidt, M. R., Sen, R., Woodland, R. T. Naïve B lymphocytes undergo homeostatic proliferation in response to B cell deficit. J. Immunol. 169 (12), 6795-6805 (2002).
- Bedoya, S. K., Wilson, T. D., Collins, E. L., Lau, K., Larkin, J. Isolation and Th17 differentiation of naïve CD4 lymphocytes. J. Vis. Exp. (79), e50765(2013).
- Su, I., et al. Ezh2 controls B cell development through histone h3 methylation and Igh rearrangement. Nat. Immunol. 4 (2), 124-131 (2003).
- Mecklenbräuker, I., Saijo, K., Zheng, N., Leitges, M., Tarakhovsky, A. Protein kinase Cδ controls self-antigen-induced B-cell tolerance. Nature. 416 (6883), 860-865 (2002).
- Rush, J. S., Hodgkin, P. D. B cells activated via CD40 and IL-4 undergo a division burst but require continued stimulation to maintain division, survival and differentiation. Eur. J. Immunol. 31 (4), 1150-1159 (2001).
- Quah, B. J. C., Warren, H. S., Parish, C. R. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester. Nat. Protoc. 2 (9), 2049-2056 (2007).
- Quah, B. J. C., Parish, C. R. New and improved methods for measuring lymphocyte proliferation in vitro and in vivo using CFSE-like fluorescent dyes. J. Immunol. Methods. 379 (1-2), 1-14 (2012).
- Hawkins, E. D., Hommel, M., Turner, M. L., Battye, F. L., Markham, J. F., Hodgkin, P. D. Measuring lymphocyte proliferation, survival and differentiation using CFSE time-series data. Nat. Protoc. 2 (9), 2057-2067 (2007).
- Tomlinson, M. J., Tomlinson, S., Yang, X. B., Kirkham, J. Cell separation: Terminology and practical considerations. J. Tissue Eng. 4 (1), 1-14 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır