Method Article
L'isolamento e l'attivazione di linfociti murini
In questo articolo
Riepilogo
Lymphocytes are the major players in adaptive immune responses. Here, we present a lymphocyte purification protocol to determine the physiological functions of the desired molecules in lymphocyte activation in vitro and in vivo. The described experimental procedures are suitable for comparing functional capacities between control and genetically modified lymphocytes.
Abstract
B and T cells, with their extremely diverse antigen-receptor repertoires, have the ability to mount specific immune responses against almost any invading pathogen1,2. Understandably, such intricate abilities are controlled by a large number of molecules involved in various cellular processes to ensure timely and spatially regulated immune responses3. Here, we describe experimental procedures that allow rapid isolation of highly purified murine lymphocytes using magnetic cell sorting technology. The resulting purified lymphocytes can then be subjected to various in vitro or in vivo functional assays, such as the determination of lymphocyte signaling capacity upon stimulation by immunoblotting4 and the investigation of proliferative abilities by 3H-thymidine incorporation or carboxyfluorescein diacetate succinimidyl ester (CFSE) labeling5-7. In addition to comparing the functional capacities of control and genetically modified lymphocytes, we can also determine the T cell stimulatory capacity of antigen-presenting cells (APCs) in vivo, as shown in our representative results using transplanted CFSE-labeled OT-I T cells.
Introduzione
Mature lymphocytes generally exist in the resting state if there is no pre-existing infection or inflammation in the individual. Therefore, it is important to retain the naïve status of lymphocytes during the isolation process before performing in vitro or in vivo functional assays. The key to ensuring consistent and reproducible results is to limit any unnecessary manipulation of the cells.
Magnetic cell sorting utilizes antibodies and microbeads to label cells so as to enrich the cell population of interest. With this approach, there are two purification strategies: positive enrichment and negative depletion. Positive enrichment enriches the cell population of interest using an antibody that binds to the target cells. Negative depletion, on the other hand, depletes non-target cells, leaving the cell population of interest. In our lab, we prefer negative depletion to positive enrichment because the binding of antibodies to the target cells could potentially alter cell features and behavior. In fact, many established cell surface markers suitable for the isolation of a particular cell population are also functional receptors.
Magnetic cell sorting not only yields highly pure populations of viable target cells, it is also less time-consuming and avoids the cellular stress induced by high-pressure flow used in fluorescence-activated cell sorting (FACS). By labeling the unwanted cell populations and depleting them using a magnetic separation column, we are able to perform rapid cell isolation without compromising the viability of the target cell population. In this protocol, we demonstrate the use of negative depletion strategies to purify naïve B cells or T cells.
Protocollo
Tutti i topi sono allevati e mantenuti in specifiche condizioni di assenza di patogeni e tutti i protocolli del mouse sono condotte in conformità con le linee guida del Comitato Cura e uso istituzionale degli animali.
1. Preparazione di tamponi e reagenti
- Preparare completa Roswell Park Memorial Institute (RPMI) medium (siero 10% inattivato al calore bovino fetale (FBS), 2 mM L-glutammina, penicillina (100 UI / ml) / streptomicina (100 mcg / ml), 55 mM 2-mercaptoetanolo ).
- Preparare 20x soluzione salina bilanciata (BSS) 1 Stock e della 2, separatamente.
- Preparare 20x BSS magazzino 1 (111 mm destrosio, potassio fosfato 8,8 mm, 26,7 mM sodio fosfato bibasico in 1 L di acqua sterile) e aggiungere 40 ml di 0,5% rosso fenolo a 20x BSS giacenza 1 prima della messa a punto finale del volume. filtro sterile con 0,2 micron filtro prima di riporre a 4 ° C.
- Preparare 20x BSS magazzino 2 (25.8 mM cloruro di calcio diidrato, cloruro di potassio 107 mM, ch 2,73 M di sodioLoride, 19.6 mM di cloruro di magnesio esaidrato, 16,6 mM solfato di magnesio in 1 L di acqua sterile). filtro sterile con 0,2 micron filtro prima di riporre a 4 ° C.
- Per preparare 1x BSS per uso sperimentale, diluire 50 ml di BSS magazzino 1 e 50 ml BSS magazzino 2, separatamente, in 400 ml di acqua sterile ciascuno. Combinare entrambe le soluzioni diluite, regolare a pH 7, e aggiungere 20 ml di FBS (2%). Top fino a 1 L con acqua sterile e filtro sterile con 0,2 micron filtro.
NOTA: soluzioni madri BSS devono essere preparati separatamente perché la miscelazione delle scorte BSS concentrati direttamente può provocare precipitazioni.
- Globuli rossi (RBC) Lysis Buffer
- Per preparare tampone di lisi RBC, mescolare 9 parti magazzino cloruro di ammonio (155 mm cloruro di ammonio in acqua sterile) e 1 parte di magazzino Tris-base (130 mm Tris (idrossimetil) aminomethane in acqua sterile, pH 7,65) prima dell'uso.
NOTA: Conservare soluzioni madre sterili di cloruro di ammonio e Tris-base a 4 ° C. Preparare lisi BUffer fresco per garantire efficiente lisi dei globuli rossi.
- Per preparare tampone di lisi RBC, mescolare 9 parti magazzino cloruro di ammonio (155 mm cloruro di ammonio in acqua sterile) e 1 parte di magazzino Tris-base (130 mm Tris (idrossimetil) aminomethane in acqua sterile, pH 7,65) prima dell'uso.
2. Generazione di linfociti sospensione dalla milza o linfonodi
NOTA: E 'importante preparare tutti i reagenti e le attrezzature necessarie per l'esperimento prima che l'eutanasia del mouse e di generare sospensioni singola cella di linfociti nel più breve tempo possibile mantenere alti Viabilità cellulari.
- Eutanasia del mouse sperimentale di dislocazione cervicale o CO 2 asfissia.
NOTA: Da questo punto in poi, tutte le procedure sperimentali devono essere eseguite in modo asettico. - Immergere l'intero del mouse in etanolo al 70% prima di effettuare qualsiasi incisioni. Rimuovere la milza e linfonodi asettico 8, e metterli in separati da 15 ml provette contenenti 5 ml di ghiacciata RPMI / FBS (RPMI con il 2% FBS) o BSS / FBS (dal punto 1.2.3).
NOTA: Dal momento che BSS impedisce efficiente lisi RBC, usare RPMI per la preparazione della sospensione cellulare della milza e passare a BSS after RBC lisi. - Per generare una sospensione singola cella da milza o linfonodi, posizionare l'organo (s) tra due pezzi di sterile 100 mesh filtro micron delle cellule in una capsula di Petri contenente 2 ml di ghiacciata RPMI / FBS o BSS / FBS. Utilizzando lo stantuffo di una siringa da 1 ml, schiacciare l'organo (s) finché non è stato strappato in parti molto fini.
- Trasferire la sospensione di cellule in una provetta da 15 ml e lavare il filtro cella di maglia con ghiacciata RPMI / FBS o BSS / FBS. Raccogliere la sospensione cellulare residua, aggiungerlo alla stessa tubo da 15 ml, e spin down a 453 xg per 5 minuti a 4 ° C. Rimuovere il surnatante.
NOTA: risospendere le cellule in pellet muovendo il tubo con le dita prima di aggiungere buffer di lisi RBC o medio nelle fasi successive. - Preparare temperatura ambiente tampone di lisi (RT) RBC durante la centrifugazione della sospensione cellulare (vedi passo 1.3.). Dopo pellet cellule e rimuovere il surnatante, risospendere le cellule con 1 ml di tampone di lisi RBC per ogni 10 8 cellule. Incubate la reazione di lisi a temperatura ambiente per 3-4 min.
- Smettere di RBC lisi con 14 ml di BSS ghiacciata / FBS e spin down a 453 xg per 5 minuti a 4 ° C.
3. Purificazione di B e le cellule T
- Purificazione di cellule B
- Contare le cellule utilizzando un emocitometro. Risospendere fino a 10 8 cellule della milza in 300 ml BSS / FBS e aggiungere 50 ml di anti-CD43 microsfere magnetiche 9,10. Per rimuovere le cellule morte, aggiungere 30 ml annessina V sfere magnetiche. Incubare la sospensione cellulare in frigorifero a 4 ° C per 30 min.
- Purificazione di cellule T
- Contare le cellule utilizzando un emocitometro. Risospendere fino a 10 8 cellule in non-T anticorpi deplezione delle cellule cocktail (anticorpi biotinilati contro CD19, B220, Gr-1, TCR-γδ, CD49b, CD11c, CD11b, Ter119 e CD4 o CD8 seconda popolazione di cellule bersaglio per essere purificato), diluito 1: 200 in 200 ml BSS / FBS 4,5. Incubare la sospensione cellulare in un4 ° C frigorifero per 15 min.
- Dopo l'incubazione, aggiungere 10 ml BSS / FBS per lavare le cellule e spin down a 453 xg per 5 minuti a 4 ° C. Rimuovere il surnatante e risospendere le cellule in 165 microlitri BSS / FBS con 30 microlitri microsfere streptavidina e 15 microlitri annessina V sfere magnetiche. Incubare la sospensione cellulare in frigorifero a 4 ° C per 30 min.
NOTA: per garantire anche l'etichettatura con le microsfere magnetiche, incubare le cellule con microsfere per 15 minuti, poi mescolare la sospensione cellulare con delicatezza toccando il tubo da 15 ml e incubare un altro 15 minuti durante la fase 3.1.1. o 3.2.2.
- Preparazione di separazione colonna per Cell Purificazione
- Preparare una colonna di separazione non utilizzata durante l'etichettatura microperla delle cellule (fase 3.1.1. E 3.2.2.). Pre-caldo BSS (senza FBS) per RT e utilizzare 2 ml per lavare ed equilibrare la colonna in modo asettico. Dopo equilibrio con BSS, la colonna lavato non dovrebbe essere permesso di asciugare.
NOTA: Usiamo i LS column invece della colonna LD consigliato a causa della sua riutilizzabilità (vedi punto 3.4.). - Dopo l'etichettatura con le sfere magnetiche, aggiungere 14 ml BSS / FBS per lavare le cellule e spin down a 453 xg per 5 minuti a 4 ° C. Rimuovere il surnatante e risospendere le cellule in 1-3 ml di RT BSS.
- Attaccare sterile 21 ago G alla punta della colonna di ridurre la portata durante il processo di purificazione. Caricare la sospensione cellulare sulla colonna equilibrata e raccogliere il flusso attraverso contenente cellule bersaglio purificate.
NOTA: evitare l'introduzione di bolle nella colonna durante il caricamento. - Lavare la colonna una volta con 1 ml BSS / FBS e raccogliere il flusso attraverso contenente le cellule bersaglio purificate. Ricarica la colonna con il flusso attraverso nuovamente. Raccogliere il flusso attraverso dopo il secondo carico nello stesso tubo 15 ml.
- Lavare la colonna 3 volte con 1 ml BSS / FBS e raccogliere il flusso attraverso contenente le cellule bersaglio purificate. Successivamente, aggiungere 5 ml BSS / FBS a the colonna e, con stantuffo, lavare le cellule marcate magneticamente su colonna in un nuovo tubo 15 ml.
- Controllare la purezza delle cellule raccolte mediante citometria di flusso utilizzando anticorpi che si legano alla superficie antigeni di B purificati o cellule T 4,5.
- Preparare una colonna di separazione non utilizzata durante l'etichettatura microperla delle cellule (fase 3.1.1. E 3.2.2.). Pre-caldo BSS (senza FBS) per RT e utilizzare 2 ml per lavare ed equilibrare la colonna in modo asettico. Dopo equilibrio con BSS, la colonna lavato non dovrebbe essere permesso di asciugare.
- Riutilizzare la colonna di separazione
NOTA: La colonna LS può essere riutilizzato fino a 4 volte senza compromettere l'efficienza di purificazione.- Lavare la colonna 3 volte con 5 ml di tampone fosfato salino (PBS) e 3 volte con 5 ml di acqua distillata dall'alto con il pistone.
- Lavare la colonna con 5 ml di etanolo al 70% e asciugare la colonna ampiamente utilizzando un rubinetto dell'aria per evitare la formazione di ruggine nella colonna.
- Per preparare una colonna LS utilizzato per un esperimento di purificazione separata, lavare la colonna dal basso verso l'alto con 5 ml di etanolo al 70% utilizzando l'adattatore siringa. Successivamente, lavare la colonna dal basso verso l'alto due volte con 5 ml di PBS sterile, seguiti da 5 ml di PBS volta dalla sommità della colonna. Aggiungere 2ml RT BSS per equilibrare la colonna e quindi procedere al caricamento la colonna con cellule marcate.
4. CFSE Etichettatura e stimolazione
NOTA: Purified cellule possono essere sottoposte ad una varietà di in vitro e in vivo saggi funzionali. Qui, usiamo le cellule T purificate per determinare la capacità di stimolazione delle cellule T di APC 5.
- soluzione Pre-caldo etichettatura (0,1% FBS in PBS) per 37 ° C prima del CFSE carico.
NOTA: l'utilizzo di una bassa percentuale di FBS in PBS riduce la morte delle cellule durante CFSE carico e riduce al minimo la perdita di cellule durante la centrifugazione. Tuttavia, troppo FBS possono interferire con CFSE carico. - Lavare le cellule due volte con purificate soluzione di etichettatura, poi ri-sospese a 2 x 10 7 cellule / ml in soluzione di etichettatura pre-riscaldato in una provetta da 15 ml.
- Preparare 10 soluzione CFSE mM (1: 500 diluizione di 5 mm CFSE soluzione madre) in soluzione di etichettatura pre-riscaldato. soluzione CFSE dovrebbeessere preparato fresco ogni volta per ottenere l'etichettatura ottimale.
- Per caricare cellule con CFSE, aggiungere sospensione cellulare 1 parte a 1 parte 10 mM soluzione CFSE in una provetta da 15 ml e incubare al buio per 10 minuti a 37 ° C. Una concentrazione finale di 5 mM CFSE viene utilizzato per etichettare 1 x 10 7 cellule / ml.
- Invertire il tubo ogni 2 minuti per assicurare una miscela omogenea di cellule durante CFSE carico.
- Per arrestare la reazione, aggiungere diversi volumi di medie RPMI completo ghiacciata e spin down a 453 xg per 5 minuti a 4 ° C. Al successo CFSE di carico, il pellet cellulare apparirà giallastro.
- Lavare CFSE caricato cellule una volta con RPMI completo ghiacciata e spin giù a 453 xg per 5 minuti a 4 ° C prima dell'uso per la coltura in vitro o in vivo di stimolazione.
5. In Vitro Stimolazione
- Preparare una soluzione 2x magazzino di stimoli (2x stimoli soluzione stock) immediatamente prima dell'uso in modo che il 100 microlitri di 2x stimoli soluzione madre può essere aggiunto a 100 ml di cellule in un volume finale di 200 microlitri per pozzetto in una piastra da 96 pozzetti.
- Se è necessaria una piastra ricoperta di stimoli (IgM o CD40 per le cellule B o CD3 e CD28 per le cellule T), diluire gli stimoli in PBS e pre-coat la piastra di coltura a 4 ° C durante la notte. In alternativa, la piastra di coltura può essere rivestita a 37 ° C per 1 ora il giorno dell'esperimento. Lavare la piastra rivestita due volte con PBS (Non lasciare che la piastra si asciughi in qualsiasi momento).
| Per le cellule B | |
| Stimoli | concentrazione finale |
| (Ab ') 2 di capra anti-topo IgM F | 0.6-2.4 mg / ml |
| Anti-topo CD40 mAb | 0,5-2 mg / ml |
| ricombinanteMouse IL-4 | 25 U / ml |
| lipopolisaccaride | 0.1-10 mg / ml |
| (LPS) da E. coli sierotipo 055: B5 | |
| Per le cellule T | |
| Stimoli | concentrazione finale |
| Anti-CD3 (piatto rivestito) | 2-10 mg / ml |
| (50 ul / pozzetto per il rivestimento) | |
| Anti-CD28 (piatto rivestito) | 2 ug / ml |
| Ricombinante IL-2 | 40 U / ml |
| PDBu (Phorbol estere) | 5-50 ng / ml |
| A23187 (calcio ionoforo) | 250 ng / ml |
Tabella 1: Concentrazioni di stimoli utilizzati per stimolare i linfociti in coltura in vitro.
- Per le cellule B CFSE-etichettati, ri-sospendere o 3 x 10 6 cellule / ml in terreno completo RPMI e cultura in triplice copia con 3 x 10 5 cellule / pozzetto in piastre da 96 pozzetti fondo piatto per 72 ore.
- Per le cellule T CFSE-etichettati, ri-sospendere a 0,5-3 x 10 6 cellule / ml in terreno RPMI completo e la cultura in triplice copia con 0,5-3 x 10 5 cellule / pozzetto in piastre da 96 pozzetti a fondo sferico per 48 o 72 ore .
6. In Vivo Stimolazione
- Per la stimolazione in vivo, trasferimento adoptively 4 x 10 6 cellule T CFSE-etichettati per mouse (per via endovenosa (iv) in 200 ml di PBS) in ogni mouse destinatario MHC-abbinato.
NOTA: In questo protocollo, le cellule T CFSE-etichettati possono essere trasferiti utilizzando adoptively vena della coda o iniezione retro-orbitale come queste cellule saranno a casa per linfoidi organi come i milza e nei linfonodi. - Sfida i topi riceventi un giorno in più con l'antigene.
NOTA:In questo esempio, usiamo ovalbumina (proteina OVA, 50 mg / mouse) come antigene perché OVA-specifici, recettore delle cellule T (TCR), le cellule T sono state -transgenic adoptively trasferite in topi riceventi. Preparare proteine OVA in PBS sterile e iniettare 100 ml di OVA proteine / PBS o il controllo PBS, per via sottocutanea (SI), in ogni topo ricevente 5. - Harvest e generare sospensioni singola cellula da organi linfoidi (linfonodi e milza) di topi riceventi 3 giorni dopo l'immunizzazione con la proteina OVA o PBS. linfonodi separare in linfonodi prossimali (PLN), che comprende ascellare, brachiale e superficiali linfonodi cervicali) e linfonodi distali (DLN), che comprende mesenterica, poplitea, inguinali, lombari, e linfonodi caudale. cellule macchia con gli anticorpi FACS appropriate per verificare la presenza di proliferazione delle cellule T.
NOTA: In questo esperimento di monitoraggio delle cellule CFSE, CFSE-etichettati cellule T da topi di controllo PBS-iniettati stabilire una linea di base per la fluorescenza non dividing cellule. Divisioni cellulari di proliferare, le cellule, CFSE-etichettati antigene-stimolata sono visualizzati misurando i picchi di fluorescenza 12,13. Con il controllo PBS, il numero di divisioni cellulari di proliferanti, cellule T CFSE etichettati può essere determinato 12,13. - Analizzare i dati di proliferazione cellulare CFSE marcato confrontando il numero di divisioni cellulari o picchi tra i campioni (figure 1 e 2).
NOTA: Per esempio, CFSE marcato, le cellule T specifiche per OVA adoptively trasferite in topi riceventi ricevono l'antigene OVA saranno sottoposti proliferazione attiva rispetto ai topi di controllo PBS-iniettati 5,12. Inoltre, è degno di nota sottolineare che ci sono molti modi per analizzare i dati di proliferazione cellulare CFSE, come dimostrato da Hawkins e colleghi 14.
Risultati
depurazione cellule magnetica dei linfociti consente di purificare una popolazione di cellule bersaglio in un tempo relativamente breve lasso di tempo. Utilizzando il nostro protocollo di esaurimento, siamo stati in grado di aumentare la percentuale di cellule T CD8 (OT-I in ricombinazione attivante del gene-1 (RAG-1) topi -carente) dal 72,8% (prima della depurazione) al 94,2% (dopo la depurazione; Figura 1A) 4,5. Questi linfociti purificati possono poi essere utilizzati per test funzionali a valle per determinare la proliferazione dei linfociti e di trasduzione del segnale 4,5. Ad esempio, siamo in grado di studiare il vivo T capacità di stimolazione delle cellule APC trasferendo CFSE etichettati, le cellule T antigene-specifiche in di tipo selvatico (WT) e topi mutanti (MT) immunizzati con antigene adatto 5.
Nel nostro esperimento rappresentativo, abbiamo trasferito purificato, CFSE marcato, ovalbumina (OVA) specifica OT-I CD8 T cells in controllo (WT) e topi mutanti (MT) e immunizzati questi topi un giorno in più con proteine OVA. Tre giorni dopo l'immunizzazione, abbiamo raccolto i linfonodi (prossimale e distale) e milze e analizzato le cellule T di citometria a flusso. CD45 forme alleliche possono essere utilizzati per separare meglio la demarcazione, CFSE marcato, donatore cellule OT-I CD8 da cellule non marcate destinatario T CD8. In questo esempio, cellule del donatore e del ricevente sono da topi CD45.1 e CD45.2, rispettivamente (Figura 1B). I livelli CFSE di sopravvivenza, cellule OT-I T stimolate a questo punto di tempo vengono usati per definire il picco per cellule non proliferanti (Figura 1C, linea tratteggiata). Dopo stimolazione, l'intensità dei livelli CFSE nelle cellule OT-I T si dimezza ad ogni divisione. Proliferazione delle cellule T può quindi essere determinata contando il numero di picchi CFSE 6,12. Nei nostri risultati rappresentativi, non vediamo differenze nelle capacità di cross-presentazione di WT e MT APC (Figura 1C, linee continue), poiché le cellule T proliferano in percentuali simili in entrambi i topi.
In un esperimento separato, abbiamo effettuato a [3 H] timidina incorporazione assay per studiare la proliferazione delle cellule di controllo attivato e cellule MT T. Cellule purificate WT e MT T sono state stimolate con vari stimoli per 48 ore e impulsiva con [3 H] timidina per la finale 8 ore. Le cellule in proliferazione nella fase S del ciclo cellulare incorporerà il nucleotide radiomarcato, [3 H] timidina, in acido desossiribonucleico nuova sintesi (DNA), quindi utilizzando conteggio in scintillazione liquida, proliferazione cellulare può essere misurata con [3 H] assorbimento -timidina. Il numero di conteggi per minuto (cpm) correla direttamente con la quantità di [3 H] uptake timidina nelle cellule proliferanti T. Nei nostri risultati rappresentativi, il ridotto numero di cpm ottenute da cellule T MT dopo stimolazione rispetto al cI supporti di da cellule WT T indica una capacità proliferativa delle cellule compromesso MT T (Figura 1D).
Per determinare la capacità proliferativa delle cellule B, abbiamo purificato le cellule B della milza con la strategia di svuotamento descritto. Al momento di purificazione, siamo stati in grado di aumentare la percentuale di cellule B220 B (topi WT) dal 63,9% (prima della depurazione) al 98,4% (dopo la depurazione, la figura 2A) 4. Simili purificato cellule T, cellule B splenica purificate possono anche essere utilizzati per saggi funzionali a valle per valutare la proliferazione dei linfociti e trasduzione del segnale 4. Successivamente, abbiamo etichettato cellule B purificate WT milza con CFSE e stimolati queste cellule in vitro utilizzando piastre rivestite con anti-CD40 integrato con la citochina IL-4. Tre giorni dopo la stimolazione, abbiamo analizzato vitali, cellule B attivate mediante citometria di flusso. I livelli CFSE di sopravvivere, le cellule B non stimolate a questo punto ora vengono utilizzate perdefinire il picco per cellule non proliferanti (Figura 2B, linea tratteggiata). Simile a cellule T, l'intensità dei livelli CFSE nelle cellule B si dimezza ad ogni divisione 6,12.
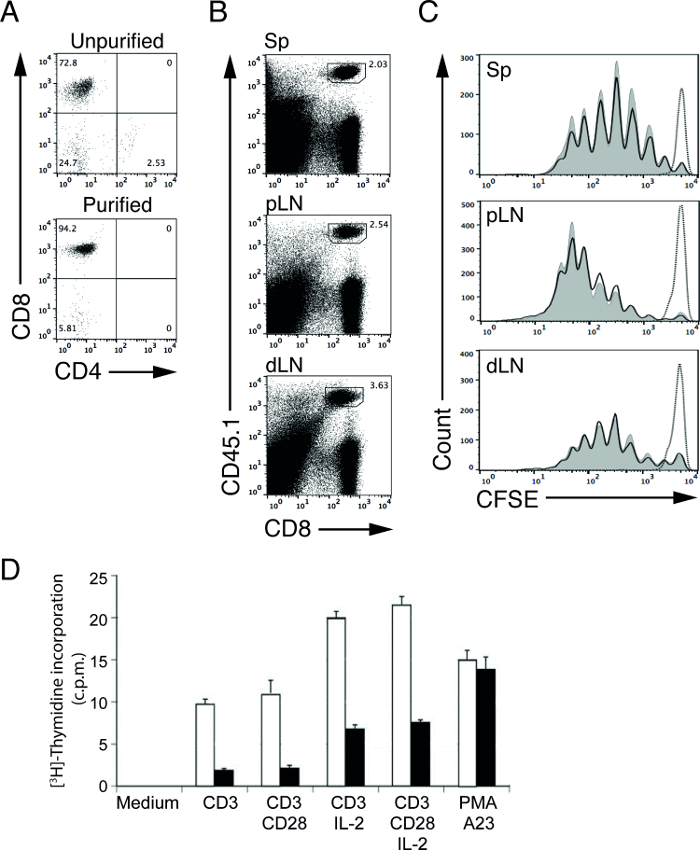
Figura 1: Profili CFSE di adoptively cellule OT-I T purificati trasferiti dopo l'immunizzazione (A) CD4 e CD8 colorazione di cellule isolate da OT-I;. topo RAG-1-deficienti prima (pannello superiore) e dopo (pannello inferiore) deplezione delle cellule non-T. (B) Rappresentante trame FACS di cellule T da milza (Sp), i nodi linfatici prossimali (PLN) e linfonodi distali (DLN). cellule del donatore OT-I T CD8 sono CD45.1 positivo. Profili (C) Rappresentante CFSE di cellule, trasferite CFSE marcato OT-I donatori T da milza (SP), linfonodi prossimali (PLN) e dei linfonodi distali (DLN) di WT (curve ombreggiato) etopi riceventi MT (linee continue) 3 giorni dopo l'immunizzazione con OVA proteine e LPS. La linea tratteggiata indica le cellule OT-I T da topi riceventi WT senza immunizzazione (PBS iniettato). (D) proliferazione cellulare del controllo attivo o cellule MT T misurato con [3 H] dosaggio uptake timidina. I risultati sono presentati in conteggi per minuto (cpm). Controllo purificata (bar aperto) o MT (bar chiuso) cellule T sono state incubate per 48 ore a solo mezzo (medio) o in presenza della piastra-bound anti-CD3 o anti-CD3 più anti-CD28 con o senza IL-ricombinante 2. Attivazione delle cellule policlonale è stata innescata da PMA (forbolo estere) e A23 (ionoforo del calcio). Clicca qui per vedere una versione più grande di questa figura.

Figura 2: il profilo CFSE diCellule B dopo stimolazione in vitro. (A) B220 e CD3 colorazione di cellule spleniche isolate da topi WT prima (pannello superiore) e dopo (pannello inferiore) deplezione di cellule non-B. (B) il profilo Rappresentante CFSE di CFSE marcato WT (curva ombreggiata) cellule B della milza dopo 3 giorni di stimolazione in vitro con piastre rivestite con anti-CD40 e IL4. La linea tratteggiata indica le cellule WT B CFSE-etichettati senza stimolazione. Clicca qui per vedere una versione più grande di questa figura.
Discussione
In questo protocollo, dimostriamo una procedura per purificare i linfociti da organi linfoidi. la purificazione delle cellule usando magnetica ordinamento tallone è un metodo semplice e veloce che produce vitali, cellule bersaglio altamente purificate.
I passaggi critici all'interno del protocollo
La vitalità cellulare e la resa delle cellule
Il mantenimento di vitalità delle cellule lignaggio ematopoietiche in vitro è fondamentale per garantire esperienze di successo e riproducibili. Chimica e reagenti biologici, condizioni sperimentali sub-ottimali o le condizioni di conservazione impropri di organi asportati possono influenzare la vitalità delle cellule. Dopo escissione da topi, organi linfoidi devono essere memorizzati su ghiaccio e sospensioni di cellule singole preparate appena possibile. Ad alta velocità centrifuga di sospensioni cellulari dovrebbe anche essere evitata. Inoltre, pellet cellulari dovrebbero essere allentati sfogliando tubi con le dita dopo la rimozione del surnatante. Non èconsigliato di ri-sospendere pellet direttamente con grandi quantità di media di pipettaggio.
Circa 2-4 x 10 7 cellule della milza B e 2 x 10 7 cellule T da tutte le principali linfonodi possono essere isolate da un 8-10 week-vecchio mouse WT. Ridotto numero di B purificato e le cellule T (al di sotto del valore atteso) indica le condizioni sub-ottimali, come accennato in precedenza.
cellulare purezza
La purezza media di cellule isolate usando questo protocollo è compreso nell'intervallo da 90 a 95%, che è sufficientemente pura per la successiva in vitro o in vivo (Figura 1A). Si consiglia di non sovraccaricare la colonna di separazione con un numero eccessivo di cellule durante il processo di separazione perché così facendo può compromettere la purezza delle cellule a causa della capacità di legame limitata della colonna.
Qualità di FBS
Ilqualità di FBS utilizzato in aggiunta al mezzo di coltura è cruciale per la sopravvivenza in vitro di linfociti. FBS da diverse fonti e lotti possono variare nella loro capacità di sostenere nelle risposte dei linfociti in vitro. Pertanto, è importante testare diversi tipi di FBS per trovare uno che dà risposta specifica-alto con basso background. Un numero consistente di bottiglie dovrebbe poi essere riservato come un magazzino.
Modifiche e risoluzione dei problemi
Condizioni di etichettatura CFSE
Anche se etichettatura CFSE funziona in pianura RPMI, abbiamo trovato che l'utilizzo di una bassa percentuale di FBS in PBS riduce morte cellulare durante il processo di caricamento, senza compromettere l'efficienza di etichettatura. Inoltre, la presenza di FBS minimizza la perdita di cellule durante la centrifugazione.
Un aspetto importante di etichettatura CFSE è assicurare anche etichettatura delle cellule al fine di visualizzare il picco distintos che rappresentano la divisione cellulare. Sovraccarico di CFSE potrebbe provocare un aumento della morte cellulare in vitro o scarso recupero di cellule marcate in vivo. D'altra parte, insufficienti etichettatura CFSE o eterogeneità nella sospensione cellulare di destinazione durante il processo di etichettatura può causare mal risolto CFSE picchi 12. Pertanto, è importante per ottimizzare le condizioni di etichettatura CFSE. La quantità di CFSE usata per l'etichettatura deve essere il più basso possibile per ridurre i potenziali effetti tossici da sovraccarico, ma ancora ottenere l'etichettatura sufficiente a rilevare i picchi ben deliberato stimolazione entro il lasso di tempo sperimentale. Inoltre, per evitare picchi mal risolto, grumi di cellule devono essere eliminati da sospensioni singola cella prima di CFSE carico.
Grumi di cellule e perdita di cellule
E 'fondamentale per garantire che le cellule siano completamente risospese prima di procedere al passo successivo, perché il remova perpetual di grumi di cellule durante l'esperimento riduce drasticamente il numero di cellule. grumi di cellule sono di solito associati con una ridotta vitalità cellulare o inadeguata risospensione del pellet.
CFSE e spettri di emissione si sovrappongono
CFSE marcato le cellule possono essere ulteriormente definita con anticorpi fluoroforo coniugato dopo una giornata di cultura, però, queste cellule CFSE marcato rimangono fluorescenza brillante dopo una giornata di cultura. Utilizzando una combinazione di anticorpi coniugati a fluorofori luminose con quantità minime di spettri di emissione si sovrappongono con CFSE, come ficoeritrina (PE) e ficoeritrina-cianina 7 (PeCy7), fornisce ottimi risultati di colorazione. Tuttavia, la compensazione per ridurre spettri di emissione sovrapposizione è ancora necessaria. Inoltre, a causa dell'elevata intensità del segnale CFSE (FL-1 canale) che si riversa nel canale FL-2, il canale FL-2 deve essere compensato deducendo l'elevata percentuale del valore FL-2 per ottenere un optprofilo IMAL CFSE. Si può fare riferimento al documento pubblicato da Quah et al., Che fornisce soluzioni per l'etichettatura di risoluzione dei problemi CFSE e l'analisi dei risultati 12.
Alternative alla CFSE
Lo spettro di emissione della CFSE limita l'uso di combinazioni di CFSE con derivati fluoresceina come la proteina fluorescente verde (GFP) e isotiocianato di fluoresceina (FITC) anticorpi coniugata. Vi sono, tuttavia, altri coloranti cellulari disponibili in commercio con intensità altrettanto elevata fluorescenza e tossicità cellulare bassa in viola (CTV, di eccitazione / emissione: 405/450 nm), giallo (CTY, 555/580 nm), rosso lontano (CTFR, 630 / 661 nm o CPD670, 647/670 nm) e rosso (PKH26, 551/567 nm). Utilizzando coloranti etichettatura delle cellule con differenti spettri di emissione fornisce flessibilità nel disegno sperimentale. D'altra parte, non tutti i coloranti etichettatura cellule sopra descritte possono generare distinte picchi divisione cellulare. Uno studio comparativo eseguito utilizzandocoloranti vari etichettatura cella concluso che CTV è un sostituto migliore per CFSE perché CTV consente il rilevamento di un maggior numero di picchi divisione cellulare chiaramente definiti 13.
limitazioni
La maggiore limitazione della separazione delle cellule magnetica è che è adatto solo per semplice separazione delle cellule. Nel nostro esempio, potremmo usare CD43 per esaurire tutte le cellule non-B da milza; tuttavia, non saremmo in grado di separare le cellule B follicolari dalle cellule B della zona marginale. Questi sotto-popolazioni possono essere definiti solo con più marcatori di superficie. Mentre è possibile selezionare positivamente celle usando cellule magnetica ordinamento basati su più marcatori di superficie, è dipendente reagenti appositamente preparati, disponibili in commercio che consentono il rilascio di microperle da cellule bersaglio dopo il primo ciclo di smistamento prima di procedere al secondo marcatore. Così, l'utente sarà completamente dipendente kit disponibili in commercio. In tal caso, i FACSs molto più vantaggiosa in separando raffinati popolazioni cellulari.
Importanza Tecnica
Separazione delle cellule approcci a base di anticorpi, come l'ordinamento delle cellule magnetica e FACS, sono la cellula più affidabile di smistamento tecniche fino ad oggi 15. Altri metodi di separazione cellulare esistono, comprese le tecniche densità-based e adesione a base, tuttavia, i linfociti sono cellule scarsamente aderenti e loro sottopopolazioni sono relativamente simili in densità, dunque adherence- e la densità a base tecniche sono o non sono applicabili o sono molto inefficienti 15 .
Come accennato nell'introduzione, rapida, semplice, alta vitalità cellulare, e indipendente da qualsiasi apparecchiature sofisticate sono le caratteristiche vincenti di cella magnetica di smistamento su FACS. In particolare, l'esaurimento negativo utilizzando cellule magnetica ordinamento etichette e impoverisce le cellule indesiderate utilizzando una colonna di separazione magnetica, mentre isolando le cellule bersaglio con il minimo modifications alla superficie delle cellule e mantenere lo stato ingenuo.
Applicazioni future
I linfociti altamente arricchito, vitali e naive purificati usando questa tecnica di purificazione magnetica-based possono essere sottoposti a vari saggi funzionali di comportamento linfociti e meccanismi di segnalazione in vitro e in vivo. In questo protocollo, abbiamo dimostrato utilizzando due diversi saggi di proliferazione delle cellule - [3 H] saggio -timidina e test di proliferazione cellulare CFSE - per indagare le capacità proliferative delle cellule dei linfociti attivati.
La scelta tra [3 H] saggio -timidina e test di proliferazione cellulare CFSE dipende in larga misura la dimensione del campione e condizioni sperimentali. Utilizzando la [3 H] saggio -timidina in esperimenti con campioni di grandi dimensioni genera dati di proliferazione cellulare high-throughput. Al fine di garantire ottimale [ 3 H] timidina assorbimento e la riproducibilità dei risultati, [3 H] timidina dovrebbe essere aggiunto alla coltura quando la maggioranza delle cellule sono attivamente dividendo. è necessaria l'ottimizzazione del protocollo di etichettatura per i diversi tipi di cellule e stimoli. Inoltre, a causa della natura radioattiva di [3 H] timidina, questo saggio di incorporazione può essere effettuata solo in vitro, a differenza etichettatura CFSE delle cellule, che può essere attivato in vitro (Figura 2B) o adoptively trasferito in topi riceventi (Figura 1B e 1C).
Il saggio di proliferazione delle cellule CFSE, d'altra parte, offre ulteriori informazioni sulla proliferazione cellulare di [3 H] -timidina. Poiché l'intensità CFSE in cellule CFSE marcato dimezza ad ogni divisione cellulare, si può determinare il numero di divisioni cellulari e la percentuale di cellule in ogni divisione contando il numero e le dimensioni dei picchi 12,13. Inoltre, le cellule CFSE-etichettati possono essere ulteriormente definite in diversi sottogruppi in base alla loro superficie espressione molecola mediante citometria di flusso utilizzando i corrispondenti anticorpi fluoroforo-coniugati. Soprattutto, a differenza del [3 H] timidina incorporazione saggio che misura la proliferazione delle cellule al punto finale di tempo, il saggio di proliferazione delle cellule CFSE consente l'inseguimento della divisione cellulare, che fornisce ulteriori informazioni sulla cinetica di capacità proliferazione cellulare. Tuttavia, il saggio di proliferazione delle cellule CFSE può non essere adatto per esperimenti con campioni di grandi dimensioni.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
Lo studio è sostenuto dal Ministero della Pubblica Istruzione, Singapore (ACRF Tier1-RG40 / 13 e Tier2-MOE2013-T2-2-038). Il manoscritto è stato curato da Amy Sullivan da Obrizus Communications.
Materiali
| Name | Company | Catalog Number | Comments |
| Materials | |||
| RPMI 1640 (without L-Glutamine) | Gibco | 31870025 | |
| Fetal Bovine Serum | Heat inactivated | ||
| L-glutamine | Gibco | 25030024 | |
| Penicillin/Streptomycin | Gibco | 15140114 | |
| 2-mercaptoethanol | Gibco | 21985023 | |
| Anti-CD43 magnetic microbeads | Miltenyi Biotec | 130-049-801 | Mix well prior use |
| Streptavidin microbeads | Miltenyi Biotec | 130-048-101 | Mix well prior use |
| Anti-Annexin V magnetic beads | Miltenyi Biotec | 130-090-201 | Mix well prior use |
| MACS LD | Miltenyi Biotec | 130-042-901 | |
| 96-well U-bottom sterile culture plate | Greiner Bio-one | 650180 | |
| 96-well F-bottom sterile culture plate | Greiner Bio-one | 655180 | |
| 100 μm cell strainer mesh | To sterilize using UV radiation prior use | ||
| 0.2 μm sterile disposable filter units | Nalgene | 567-0020 | Can be substituted with any sterile filter device |
| CellTrace Violet | Invitrogen | C34557 | CTV for short; alternative to CFSE |
| CellTrace Yellow | Invitrogen | C34567 | CTY for short; alternative to CFSE |
| CellTrace Far Red | Invitrogen | C34564 | CTFR for short; alternative to CFSE |
| Cell Proliferation Dye eFluor 670 | eBioscience | 65-0840 | CPD670 for short; alternative to CFSE |
| PKH26 | Sigma Aldrich | PKH26GL | PKH26, alternative to CFSE |
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Dextrose | Sigma Aldrich | G7021 | |
| Potassium phosphate monobasic | Sigma Aldrich | P5655 | |
| Sodium phosphate dibasic | Sigma Aldrich | S5136 | |
| Phenol Red | Sigma Aldrich | P0290 | |
| Calcium chloride dihydrate | Sigma Aldrich | C7902 | |
| Potassium chloride | Sigma Aldrich | P5405 | |
| Sodium chloride | Merck Millipore | S7653 | Can use from other sources |
| Magnesium chloride hexahydrate | Sigma Aldrich | M2393 | |
| Magnesium sulfate | Sigma Aldrich | M2643 | |
| Ammonium chloride | Sigma Aldrich | A9434 | |
| Tris-base | |||
| Dimethyl Sulfoxide | Sigma Aldrich | D8418 | |
| (5-(and 6-) carboxyfluorescein diacetate succinimidyl ester (CFSE) | Molecular Probes | C-1157 | Reconstitute in DMSO |
| Phorbol 12,13-dibutyrate (PBDU, Phorbol ester) | Sigma Aldrich | P1269 | |
| A23187 (Calcium ionophore) | Sigma Aldrich | C7522 | |
| Name | Company | Catalog Number | Comments |
| Antibodies and recombinant protein | |||
| CD11b biotin (clone m1/70) | Biolegend | 101204 | T cell depletion cocktail |
| CD11c biotin (clone N418) | Biolegend | 117304 | T cell depletion cocktail |
| Gr-1 biotin (clone RB6-8C5) | Biolegend | 108404 | T cell depletion cocktail |
| Ter119 biotin (clone Ter119) | Biolegend | 116204 | T cell depletion cocktail |
| TCR-γδ biotin (clone GL-3) | Biolegend | 118103 | T cell depletion cocktail |
| CD19 biotin (clone 6D5) | Biolegend | 115504 | T cell depletion cocktail |
| B220 biotin (clone RA3-6B2) | Biolegend | 103204 | T cell depletion cocktail |
| CD49b biotin (clone DX5) | Biolegend | 108904 | T cell depletion cocktail |
| CD4 biotin (clone GK1.5) | Biolegend | 100404 | T cell depletion cocktail |
| CD8 biotin (clone 53-6.7) | Biolegend | 100704 | T cell depletion cocktail |
| F(ab’)2 goat anti-mouse IgM (plate coated) | Jackson ImmunoResearch | 115-006-075 | 50 µl/well for coating (96-well) |
| Anti-mouse CD40 mAb (plate coated) | Pharmingen | 553722 | 50 µl/well for coating (96-well) |
| Recombinant IL-4 | ProSpec | Cyt-282 | |
| LPS from E. coli Serotype 055:B5 | Sigma Aldrich | L-4005 | |
| Anti-CD3 (clone clone OKT3) (plate coated) | eBioscience | 16-0037-85 | 50 µl/well for coating (96-well) |
| Anti-CD28 (clone clone 37.51) (plate coated) | eBioscience | 16-0281-85 | 50 µl/well for coating (96-well) |
| Recombinant IL-2 | ProSpec | Cyt-370 | |
| Albumin from chicken egg white, Ovalbumin | Sigma Aldrich | A7641 |
Riferimenti
- Nikolich-Žugich, J., Slifka, M. K., Messaoudi, I. The many important facets of T-cell repertoire diversity. Nat. Rev. Immunol. 4 (2), 123-132 (2004).
- LeBien, T. W., Tedder, T. F. B lymphocytes: how they develop and function. Blood. 112 (5), 1570-1580 (2008).
- Brownlie, R., Zamoyska, R. T cell receptor signaling networks: branched, diversified and bound. Nat. Rev. Immunol. 13 (4), 257-269 (2013).
- Neo, W. H., Lim, J. F., Grumont, R., Gerondakis, S., Su, I. C-rel regulates ezh2 expression in activated lymphocytes and malignant lymphoid cells. J. Biol. Chem. 289 (46), 31693-31707 (2014).
- Gunawan, M., et al. The methyltransferase Ezh2 controls cell adhesion and migration through direct methylation of the extranuclear regulatory protein talin. Nat Immunol. 16 (5), 505-516 (2015).
- Lyons, A. B., Parish, C. R. Determination of lymphocyte division by flow cytometry. J. Immunol. Methods. 171 (1), 131-137 (1994).
- Cabatingan, M. S., Schmidt, M. R., Sen, R., Woodland, R. T. Naïve B lymphocytes undergo homeostatic proliferation in response to B cell deficit. J. Immunol. 169 (12), 6795-6805 (2002).
- Bedoya, S. K., Wilson, T. D., Collins, E. L., Lau, K., Larkin, J. Isolation and Th17 differentiation of naïve CD4 lymphocytes. J. Vis. Exp. (79), e50765 (2013).
- Su, I., et al. Ezh2 controls B cell development through histone h3 methylation and Igh rearrangement. Nat. Immunol. 4 (2), 124-131 (2003).
- Mecklenbräuker, I., Saijo, K., Zheng, N., Leitges, M., Tarakhovsky, A. Protein kinase Cδ controls self-antigen-induced B-cell tolerance. Nature. 416 (6883), 860-865 (2002).
- Rush, J. S., Hodgkin, P. D. B cells activated via CD40 and IL-4 undergo a division burst but require continued stimulation to maintain division, survival and differentiation. Eur. J. Immunol. 31 (4), 1150-1159 (2001).
- Quah, B. J. C., Warren, H. S., Parish, C. R. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester. Nat. Protoc. 2 (9), 2049-2056 (2007).
- Quah, B. J. C., Parish, C. R. New and improved methods for measuring lymphocyte proliferation in vitro and in vivo using CFSE-like fluorescent dyes. J. Immunol. Methods. 379 (1-2), 1-14 (2012).
- Hawkins, E. D., Hommel, M., Turner, M. L., Battye, F. L., Markham, J. F., Hodgkin, P. D. Measuring lymphocyte proliferation, survival and differentiation using CFSE time-series data. Nat. Protoc. 2 (9), 2057-2067 (2007).
- Tomlinson, M. J., Tomlinson, S., Yang, X. B., Kirkham, J. Cell separation: Terminology and practical considerations. J. Tissue Eng. 4 (1), 1-14 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon