Method Article
Isolation und Aktivierung von murinen Lymphozyten
In diesem Artikel
Zusammenfassung
Lymphocytes are the major players in adaptive immune responses. Here, we present a lymphocyte purification protocol to determine the physiological functions of the desired molecules in lymphocyte activation in vitro and in vivo. The described experimental procedures are suitable for comparing functional capacities between control and genetically modified lymphocytes.
Zusammenfassung
B and T cells, with their extremely diverse antigen-receptor repertoires, have the ability to mount specific immune responses against almost any invading pathogen1,2. Understandably, such intricate abilities are controlled by a large number of molecules involved in various cellular processes to ensure timely and spatially regulated immune responses3. Here, we describe experimental procedures that allow rapid isolation of highly purified murine lymphocytes using magnetic cell sorting technology. The resulting purified lymphocytes can then be subjected to various in vitro or in vivo functional assays, such as the determination of lymphocyte signaling capacity upon stimulation by immunoblotting4 and the investigation of proliferative abilities by 3H-thymidine incorporation or carboxyfluorescein diacetate succinimidyl ester (CFSE) labeling5-7. In addition to comparing the functional capacities of control and genetically modified lymphocytes, we can also determine the T cell stimulatory capacity of antigen-presenting cells (APCs) in vivo, as shown in our representative results using transplanted CFSE-labeled OT-I T cells.
Einleitung
Mature lymphocytes generally exist in the resting state if there is no pre-existing infection or inflammation in the individual. Therefore, it is important to retain the naïve status of lymphocytes during the isolation process before performing in vitro or in vivo functional assays. The key to ensuring consistent and reproducible results is to limit any unnecessary manipulation of the cells.
Magnetic cell sorting utilizes antibodies and microbeads to label cells so as to enrich the cell population of interest. With this approach, there are two purification strategies: positive enrichment and negative depletion. Positive enrichment enriches the cell population of interest using an antibody that binds to the target cells. Negative depletion, on the other hand, depletes non-target cells, leaving the cell population of interest. In our lab, we prefer negative depletion to positive enrichment because the binding of antibodies to the target cells could potentially alter cell features and behavior. In fact, many established cell surface markers suitable for the isolation of a particular cell population are also functional receptors.
Magnetic cell sorting not only yields highly pure populations of viable target cells, it is also less time-consuming and avoids the cellular stress induced by high-pressure flow used in fluorescence-activated cell sorting (FACS). By labeling the unwanted cell populations and depleting them using a magnetic separation column, we are able to perform rapid cell isolation without compromising the viability of the target cell population. In this protocol, we demonstrate the use of negative depletion strategies to purify naïve B cells or T cells.
Protokoll
Alle Mäuse gezüchtet und unter spezifischen pathogenfreien Bedingungen und alle Maus-Protokolle werden in Übereinstimmung mit den Richtlinien der Institutional Animal Care und Use Committee geführt gehalten.
1. Herstellung von Puffer und Reagenzien
- Bereiten vollständige Roswell Park Memorial Institute (RPMI) Medium (10% hitzeinaktiviertem fötalem Rinderserum (FBS), 2 mM L-Glutamin, Penicillin (100 IU / ml) / Streptomycin (100 ug / ml), 55 uM 2-Mercaptoethanol ).
- Bereiten Sie 20x Balanced Salt Solution (BSS) Lager 1 und Lager 2, getrennt.
- Bereiten Sie 20x BSS Lager 1 (111 mM Dextrose, 8,8 mM Kaliumphosphat, 26,7 mM Dinatriumhydrogenphosphat in 1 l sterilem Wasser) und 40 ml 0,5% Phenolrot bis 20x BSS Lager 1 vor Endvolumeneinstellung. Sterilfilter unter Verwendung von 0,2-um-Filter, bevor bei 4 ° C lagern.
- Bereiten Sie 20x BSS Lager 2 (25,8 mM Calciumchloriddihydrat, 107 mM Kaliumchlorid, 2,73 M Natrium chloride, 19,6 mM Magnesiumchlorid-Hexahydrat, 16,6 mM Magnesiumsulfat in 1 l sterilem Wasser). Sterilfilter unter Verwendung von 0,2-um-Filter, bevor bei 4 ° C lagern.
- 1x BSS für den experimentellen Einsatz, verdünnen 50 ml BSS Lager 1 und 50 ml BSS Lager 2, getrennt, in 400 ml sterilem Wasser je vorzubereiten. Kombinieren Sie beide verdünnten Lösungen, passen auf pH 7 und 20 ml FBS (2%). Top bis zu 1 L mit sterilem Wasser und Sterilfilter mit 0,2 um Filter.
HINWEIS: BSS Stammlösungen separat hergestellt werden sollte, weil die Mischung von konzentrierter BSS Aktien direkt in Ausfällen führen kann.
- Rote Blutkörperchen (RBC) Lysepuffer
- RBC Lysispuffer, mischen 9 Teile Lager Ammoniumchlorid (155 mM Ammoniumchlorid in sterilem Wasser) zu 1 Teil Lager Tris-Base (130 mM Tris (hydroxymethyl) aminomethan in sterilem Wasser, pH-Wert 7,65) vor dem Gebrauch zu bereiten.
HINWEIS: Shop sterilen Stammlösungen von Ammoniumchlorid und Tris-Base bei 4 ° C. Bereiten Sie die Lyse bUffer frisch effiziente Lyse von roten Blutkörperchen zu gewährleisten.
- RBC Lysispuffer, mischen 9 Teile Lager Ammoniumchlorid (155 mM Ammoniumchlorid in sterilem Wasser) zu 1 Teil Lager Tris-Base (130 mM Tris (hydroxymethyl) aminomethan in sterilem Wasser, pH-Wert 7,65) vor dem Gebrauch zu bereiten.
2. Erzeugung von Lymphozytensuspension aus Milz oder Lymphknoten
Hinweis: Es ist wichtig, dass alle Reagenzien und Geräte für das Experiment vor Maus Euthanasie und zur Erzeugung Einzelzellsuspensionen von Lymphozyten so schnell wie möglich zu halten hohe Zellviabilitäten erforderlich vorzubereiten.
- Euthanize experimentellen Maus durch Genickbruch oder CO 2 Ersticken.
HINWEIS: Von diesem Schritt an gelten alle experimentellen Verfahren unter aseptischen Bedingungen durchgeführt werden sollte. - Tauchen Sie die gesamte Maus in 70% Ethanol, bevor irgendwelche Schnitte zu machen. Entfernen Sie die Milz und Lymphknoten aseptisch 8, und legen Sie sie in einem separaten 15 - ml - Röhrchen , die 5 ml eiskaltem RPMI / FBS (RPMI mit 2% FBS) oder BSS / FBS (aus Schritt 1.2.3).
HINWEIS: Da BSS effiziente RBC-Lyse verhindert, verwenden RPMI für die Herstellung der Milz- Zellsuspension und wechseln Sie zu BSS nacr RBC-Lyse. - Um eine einzelne Zellsuspension aus der Milz oder Lymphknoten, legen Sie das Organ (e) zwischen zwei Stücken von sterilen 100 & mgr; m Zellsieb mesh in einer Petrischale mit 2 ml eiskaltem RPMI / FBS oder BSS / FBS erzeugen. Mit dem Kolben einer 1-ml-Spritze, zerdrücken die Orgel (n), bis er in sehr feine Teile zerrissen wurde.
- Übertragen Sie die Zellsuspension in ein 15-ml-Röhrchen und waschen Sie die Zelle Sieb mit eiskaltem RPMI / FBS oder BSS / FBS Netz. Sammeln Sie die restlichen Zellsuspension, fügen Sie ihn auf den gleichen 15-ml-Tube und Spin-down bei 453 × g für 5 Minuten bei 4 ° C. Entfernen Sie den Überstand.
HINWEIS: Die pelletierten Zellen erneut zu suspendieren, indem das Rohr mit den Fingern Ausklopfen vor RBC-Lyse Puffer oder Medium in den nachfolgenden Schritten hinzugefügt wird. - Vorbereitung Raumtemperatur (RT) RBC-Lyse-Puffer während der Zentrifugation der Zellsuspension (siehe Schritt 1.3.). Nachdem die Zellen pelletiert und Entfernen des Überstands, resuspendieren der Zellen mit 1 ml Puffer RBC - Lyse je 10 8 Zellen. Incubate die Lysereaktion bei RT für 3-4 min.
- Stopp RBC Lyse mit 14 ml eiskaltem BSS / FBS und Spin-down bei 453 × g für 5 Minuten bei 4 ° C.
3. Reinigung von B und T-Zellen
- Reinigung von B-Zellen
- Zählen Sie die Zellen mit einer Zählkammer. Re-suspendieren bis zu 10 8 Milzzellen in 300 & mgr; l BSS / FBS und 50 & mgr; l anti-CD43 9,10 magnetischen Mikrokügelchen hinzuzufügen. Zum Entfernen von toten Zellen, fügen Sie 30 ul Annexin V magnetischen Kügelchen. Inkubieren der Zellsuspension in einem 4 ° C Kühlschrank für 30 min.
- Reinigung von T-Zellen
- Zählen Sie die Zellen mit einer Zählkammer. Re-suspendieren bis zu 10 8 Zellen in nicht-T - Zell - Depletion - Antikörper - Cocktail (biotinylierter Antikörper gegen CD19, B220, Gr-1, TCR-γδ, CD49b, CD11c, CD11b, Ter119 und CD4 oder CD8 abhängig von der Zielzellpopulation gereinigt werden), 1: 200 verdünnt in 200 & mgr; l BSS / FBS 4,5. Inkubieren der Zellsuspension in ein4 ° C Kühlschrank für 15 min.
- Nach der Inkubation, 10 ml BSS / FBS die Zellen und Spin-down bei 453 × g für 5 Minuten bei 4 ° C zu waschen. Entfernen Sie den Überstand und resuspendieren die Zellen in 165 & mgr; l BSS / FBS mit 30 & mgr; l Streptavidin-Mikrokügelchen und 15 & mgr; l Annexin V magnetischen Kügelchen. Inkubieren der Zellsuspension in einem 4 ° C Kühlschrank für 30 min.
HINWEIS: Um sicherzustellen, dass auch mit den magnetischen Mikrokügelchen Markierung, die Zellen mit Microbeads für 15 min inkubieren, dann die Zellsuspension vorsichtig mischen, indem die 15-ml-Röhrchen klopfen und weitere 15 min bei Schritt 3.1.1 inkubiert. oder 3.2.2.
- Herstellung von Trennsäule für Zellreinigung
- Bereiten Sie eine nicht verwendete Trennsäule während Mikrobead Markierung der Zellen (Schritt 3.1.1. Oder 3.2.2.). Vorwärmen BSS (ohne FBS) auf RT und verwenden 2 ml die Säule aseptisch zu waschen und ins Gleichgewicht. Nach Äquilibrierung mit BSS sollte die gewaschene Säule nicht austrocknen gelassen werden.
HINWEIS: Wir verwenden die LS cPALTE anstelle der Spalte empfohlen LD aufgrund seiner Wiederverwendbarkeit (siehe Schritt 3.4.). - Nach der Markierung mit den magnetischen Kügelchen, fügen Sie 14 ml BSS / FBS die Zellen und Spin-down bei 453 × g für 5 Minuten bei 4 ° C zu waschen. Entfernen Sie den Überstand und erneut die Zellen in 1-3 ml RT BSS.
- Befestigen eines sterilen 21 G Nadel an der Spitze der Säule, die Durchflussrate während des Prozesses der Reinigung zu reduzieren. Laden die Zellsuspension auf die äquilibrierte Säule und Sammeln des Durchflusses durch die gereinigten Zielzellen enthält.
HINWEIS: Vermeiden Sie Blasen in die Spalte während des Ladens einzuführen. - Die Säule wird einmal mit 1 ml BSS / FBS und sammle die Strömung durch die gereinigten Zielzellen enthält. Neuladen der Säule mit dem Fluss durch wieder. Sammeln Sie die Strömung durch nach dem zweiten Laden in der gleichen 15-ml-Tube.
- Die Säule wird 3-mal mit 1 ml BSS / FBS und sammeln die Strömung durch die gereinigten Zielzellen enthält. Danach werden 5 ml BSS / FBS zu the-Säule und mit einem Kolben, spülen Sie die magnetisch markierten Zellen aus der Säule in ein neues 15-ml-Tube.
- Überprüfen Sie die Reinheit der durch Strömungs gesammelten Zellen Zytometrie unter Verwendung von Antikörpern , die Antigene binden , 4,5 gereinigtes B oder T - Zellen an die Oberfläche.
- Bereiten Sie eine nicht verwendete Trennsäule während Mikrobead Markierung der Zellen (Schritt 3.1.1. Oder 3.2.2.). Vorwärmen BSS (ohne FBS) auf RT und verwenden 2 ml die Säule aseptisch zu waschen und ins Gleichgewicht. Nach Äquilibrierung mit BSS sollte die gewaschene Säule nicht austrocknen gelassen werden.
- Die Wiederverwendung von der Trennsäule
HINWEIS: Die LS Spalte bis 4 Mal wiederverwendet werden kann, ohne Reinigungswirkungsgrad zu beeinträchtigen.- Die Säule wird 3-mal mit 5 ml phosphatgepufferter Salzlösung (PBS) und 3-mal mit 5 ml destilliertem Wasser von oben den Kolben verwendet wird.
- Die Säule wird mit 5 ml 70% Ethanol und trocknet die Säule ausgiebig einen Lufthahn mit dem Aufbau von Rost in der Säule zu verhindern.
- Um eine gebrauchte LS-Säule für eine separate Reinigung Experiment vorzubereiten, waschen Sie die Säule von unten nach oben mit 5 ml 70% Ethanol mit dem Spritzenadapter. Als nächstes waschen Sie die Spalte von unten einmal von der Spitze der Säule mit 5 ml PBS zweimal mit 5 ml sterilem PBS, gefolgt. In 2ml RT BSS die Säule und dann fahren Sie mit dem Laden der Säule mit markierten Zellen zu äquilibrieren.
4. CFSE Labeling und Stimulation
HINWEIS: Gereinigte Zellen können auf eine Vielzahl von in vitro und in vivo funktionellen Assays unterzogen werden. Hier verwenden wir gereinigten T - Zellen , die T - Zell - Stimulation Fähigkeit von APCs 5 zu bestimmen.
- Vorwärmen Markierungslösung (0,1% FBS in PBS) auf 37 ° C vor der CFSE Belastung.
HINWEIS: einen geringen Prozentsatz an FBS in PBS Verwendung reduziert Zelltod während CFSE Laden und minimiert Zellverlust während der Zentrifugation. Doch zu viel FBS kann mit CFSE Laden stören. - Bei 2 x 10 7 Zellen / ml in vorgewärmten Markierungslösung in einem Rohr 15 ml Waschen gereinigt Zellen zweimal mit Markierungslösung, dann wieder suspendiert.
- Bereiten Sie 10 & mgr; M CFSE-Lösung (1: 500 Verdünnung von 5 mM CFSE Stammlösung) in vorgewärmten Markierungslösung. CFSE Lösung solltewerden jeweils frisch zu erreichen optimale Kennzeichnung vorbereitet.
- Um Zellen mit CFSE laden, fügen 1 Teil Zellsuspension zu 1 Teil 10 & mgr; M CFSE-Lösung in einem 15-ml-Röhrchen und Inkubation im Dunkeln für 10 min bei 37 ° C. Eine Endkonzentration von 5 & mgr; M CFSE verwendet ml zu etikettieren 1 x 10 7 Zellen /.
- Drehen Sie das Röhrchen alle 2 Minuten eine homogene Mischung von Zellen während der CFSE Belastung zu gewährleisten.
- Um die Reaktion zu stoppen, mehrere Bände eiskaltem komplettem RPMI Medium hinzufügen und Spin-down bei 453 × g für 5 Minuten bei 4 ° C. Nach dem erfolgreichen CFSE Laden wird das Zellpellet gelblich erscheinen.
- Wash CFSE Zellen ein weiteres Mal mit eiskaltem kompletten RPMI - Medium und Spin - down bei 453 × g für 5 Minuten bei 4 ° C geladen , bevor sie für in - vitro - Kultivierung oder in vivo Stimulation verwendet wird .
5. In - vitro - Stimulation
- Bereiten Sie eine 2x-Stammlösung von Reizen (2x Stimuli Stammlösung) unmittelbar vor der Anwendung, so dass 100 & mgr; l 2x Stimuli Stammlösung kann in einer 96-Well-Platte zu 100 ul Zellen zu einem Endvolumen von 200 & mgr; l pro Vertiefung zugegeben werden.
- Wenn eine Platte mit Stimuli (IgM oder CD40 für B-Zellen oder CD3 und CD28 für T-Zellen), aufgetragen erforderlich ist, verdünnt die Stimuli in PBS und pre-coat der Kulturplatte bei 4 ° C über Nacht. Alternativ kann der Kulturplatte bei 37 ° C für 1 Stunde am Tag des Versuchs überzogen werden. Waschen Sie die beschichtete Platte zweimal mit PBS (Nicht in die Platte zu jeder Zeit zu trocknen).
| Für B - Zellen | |
| Stimuli | Die Endkonzentration |
| F (ab ') 2 Ziegen-anti-Maus-IgM | 0,6-2,4 & mgr; g / ml |
| Anti-Maus-CD40 mAb | 0,5-2 & mgr; g / ml |
| RekombinanteMaus-IL-4 | 25 U / ml |
| Lipopolysaccharide | 0,1-10 & mgr; g / ml |
| (LPS) aus E. coli Serotyp 055: B5 | |
| Für T - Zellen | |
| Stimuli | Die Endkonzentration |
| Anti-CD3 (Platte beschichtet) | 2-10 & mgr; g / ml |
| (50 & mgr; l / Vertiefung für die Beschichtung) | |
| Anti-CD28 (Platte beschichtet) | 2 & mgr; g / ml |
| Rekombinantes IL-2 | 40 U / ml |
| PDBu (Phorbol ester) | 5-50 ng / ml |
| A23187 (Calciumionophor) | 250 ng / ml |
Tabelle 1: Die Konzentrationen von Stimuli Lymphozyten in in - vitro - Kultur zu stimulieren.
- Für CFSE-markierten B - Zellen, resuspendieren bis 3 x 10 6 Zellen / ml in komplettem RPMI - Medium und der Kultur in dreifacher Ausfertigung mit 3 x 10 5 Zellen / Vertiefung in 96-well - Flachbodenplatten für 72 Stunden.
- Für CFSE-markierten T - Zellen, resuspendieren zu 0,5-3 x 10 6 Zellen / ml in komplettem RPMI - Medium und der Kultur in dreifacher Ausführung mit 0,5-3 x 10 5 Zellen / Well in 96-Well - Rundbodenplatten für 48 oder 72 Std .
6. In - vivo - Stimulation
- Für in vivo Stimulation, adoptiv Übertragungs 4 x 10 6 CFSE-markierten T - Zellen pro Maus (intravenös (iv) in 200 & mgr; l PBS) in jedes MHC-angepaßten Empfängermaus.
HINWEIS: In diesem Protokoll CFSE-markierten T-Zellen adoptiv übertragen werden können Schwanzvene oder retroorbitale Injektions da diese Zellen verwendet werden Hause Organe wie die Milz und Lymphknoten lymphoiden. - Fordern Sie die Empfängermäuse 1 Tag später mit dem Antigen.
HINWEIS:In diesem Beispiel verwenden wir Ovalbumin (OVA-Protein, 50 & mgr; g / Maus) als Antigen weil OVA-spezifischen T-Zell-Rezeptor (TCR) -transgene T-Zellen adoptiv in Empfängermäuse transferiert. Bereiten Sie OVA Protein in sterilem PBS und injizieren 100 ul OVA Protein / PBS oder PBS - Kontrolle wird über eine subkutane Injektion (si), in jede Empfängermaus 5. - Ernte und Einzelzellsuspensionen aus lymphatischen Organen (Lymphknoten und Milz) erzeugen von Empfängermäuse 3 Tage nach der Immunisierung mit OVA-Protein oder PBS. Separate Lymphknoten in proximal-Lymphknoten (PLN), die Achsel umfasst, brachialis und oberflächlicher Lymphknoten) und distale Lymphknoten (dLN), die mesenterischen umfasst, popliteal, inguinal, Lenden- und caudal Lymphknoten. Stain Zellen die entsprechenden FACS unter Verwendung von Antikörpern für T-Zellproliferation zu überprüfen.
HINWEIS: In diesem CFSE Zelle Tracking-Experiment, CFSE-markierten T-Zellen von PBS-injizierten Kontrollmäusen eine Fluoreszenzbasis für Nicht-di etablierenViding Zellen. Zellteilungen von proliferierenden, Antigen-stimulierten, CFSE-markierten Zellen werden durch Messen Fluoreszenzpeaks 12,13 visualisiert. Mit der PBS - Kontrolle, die Anzahl der Zellteilungen von proliferierenden, CFSE-markierten T - Zellen können 12,13 bestimmt werden. - Analyse der CFSE-markierten Zellproliferationsdaten durch die Anzahl der Zellteilungen zu vergleichen oder Spitzen zwischen den Proben (1 und 2).
HINWEIS: Zum Beispiel CFSE-markierte, OVA-spezifischen T - Zellen adoptiv Empfängermäuse übertragen in das OVA - Antigen empfangen wird aktiv proliferieren im Vergleich zu den PBS-injizierten Kontrollmäusen 5,12. Darüber hinaus ist es bemerkenswert , darauf hinweisen , dass es viele Wege gibt CFSE Zellproliferationsdaten zu analysieren, wie 14 von Hawkins und Kollegen gezeigt.
Ergebnisse
Magnetzellreinigung von Lymphozyten erlaubt Benutzern, eine Zielzellpopulation in einer relativ kurzen Zeit zu reinigen. Mit unserem Verarmungs Protokoll konnten wir den Prozentsatz der CD8-T-Zellen (OT-I in Rekombinations-aktivierendes Gen-1 (RAG-1) -defiziente Mäuse) von 72,8% (vor Reinigung) auf 94,2% (nach der Reinigung zu erhöhen; 1A) 4,5. Diese gereinigten Lymphozyten können dann für die nachfolgende funktionelle Assays verwendet werden , um die Lymphozytenproliferation und Signaltransduktion 4,5 bestimmen. Zum Beispiel können wir die in vivo T - Zell - Stimulation Kapazität von APCs studieren durch die Übertragung von CFSE-markierten, antigenspezifischen T - Zellen in Wildtyp (WT) und mutierten (MT) Mäuse mit geeigneten Antigen immunisiert 5.
In unserem repräsentativen Experiment, übertragen wir gereinigt, CFSE-markierte, Ovalbumin (OVA) spezifische OT-I CD8 T cells in Kontrolle (WT) und mutierten (MT) Mäuse und immunisiert diese Mäuse einen Tag mehr mit OVA-Protein. Drei Tage nach der Immunisierung geerntet wir Lymphknoten (proximal und distal) und Milzen und analysiert, um die T-Zellen mittels Durchflusszytometrie. CD45 kann allelen Formen verwendet werden, um besser auf die Trenn trennen, CFSE-markierten, Spender OT-I CD8-Zellen von nicht-markierten, Empfänger CD8-T-Zellen. In diesem Beispiel Spender- und Empfängerzellen werden aus CD45.1 und CD45.2 Mäusen, bzw. (1B). Die CFSE Ebenen überlebenden, nicht - stimulierten OT-I T - Zellen zu diesem Zeitpunkt verwendet werden , der Peak für nicht-proliferierenden Zellen (1C, gepunktete Linie) zu definieren. Nach Stimulation wird die Intensität der CFSE Ebenen in OT-I T-Zellen auf die Hälfte bei jeder Teilung verringern. T - Zellproliferation kann dabei durch Zählen der Anzahl von CFSE 6,12 Peaks bestimmt werden. In unserer repräsentativen Ergebnissen, sehen wir nicht Unterschiede in der Kreuzpräsentation Kapazitäten von WT und MT APCs (1C, durchgezogene Linien), da die T - Zellen mit ähnlichen Raten in beiden Mäuse vermehren.
In einem separaten Experiment, führten wir eine [3 H] -Thymidin - Einbau - Assay die Zellproliferation von aktivierten Steuerung und MT T - Zellen zu studieren. Gereinigtes WT und MT T - Zellen wurden mit verschiedenen Stimuli für 48 Stunden stimuliert und gepulst mit [3 H] -Thymidin für die letzten 8 Stunden. Zellen in der S-Phase des Zellzyklus wird proliferierenden inkorporieren kann das radioaktiv markierte Nukleotid, [3 H] -Thymidin in neu synthetisierte Desoxyribonukleinsäure (DNA), also unter Verwendung von Flüssig - Scintillationszählung, Zellproliferation durch [3 H] gemessen werden , -Thymidin-Aufnahme. Die Anzahl der Counts pro Minute (cpm) korreliert direkt mit der Menge an [3 H] -Thymidin - Aufnahme in T - Zellen proliferieren. In unserer repräsentativen Ergebnissen, verglichen die reduzierte Anzahl von cpm aus MT-T-Zellen nach Stimulation erhalten counts von WT - T - Zellen zeigt eine kompromittiert proliferative Kapazität von MT - T - Zellen (Abbildung 1D).
Zur B-Zell-proliferative Kapazität, wir gereinigt Milz-B-Zellen unter Verwendung der beschriebenen Verarmungsstrategie bestimmen. Nach Aufreinigung konnten wir den Prozentsatz der B220 - B - Zellen (WT - Mäuse) von 63,9% (vor Reinigung) auf 98,4% erhöht werden (nach der Reinigung; 2A) 4. Ähnliche T - Zellen, gereinigte Milz - B - Zellen an gereinigtes können auch für nachgeschaltete funktionelle Assays verwendet werden , um die Lymphozytenproliferation und Signaltransduktion 4 bewerten. Anschließend wir markierte gereinigte WT Milz - B - Zellen mit CFSE und stimuliert diese Zellen in vitro - Platten mit Anti-CD40 mit dem Cytokin IL-4 supplementiert beschichtet werden. Drei Tage nach der Stimulation, analysierten wir tragfähige, aktivierten B-Zellen mittels Durchflusszytometrie. Die CFSE Ebenen überlebenden, nicht-stimulierten B-Zellen zu diesem Zeitpunkt verwendet werden, umdefinieren die Spitze für nicht wuchernden Zellen (2B, gestrichelte Linie). Ähnlich wie T - Zellen, verringert sich die Intensität der CFSE Ebenen in B - Zellen auf die Hälfte mit jeder Teilung 6,12.
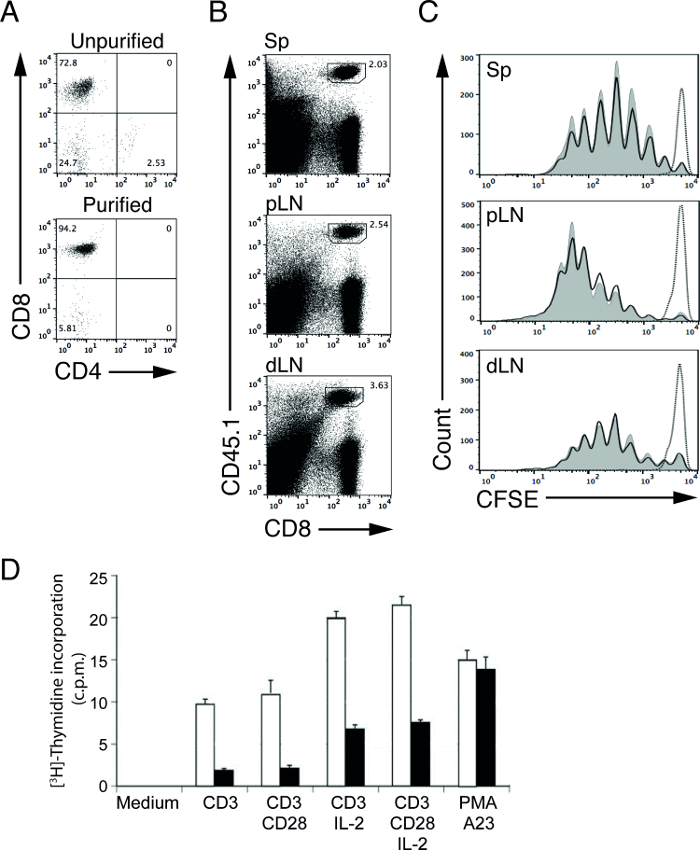
Abbildung 1: CFSE Profile von adoptiv übertragen gereinigt OT-I T - Zellen nach Immunisierung (A) CD4- und CD8 - Färbung von OT-I isolierten Zellen;. RAG-1-defiziente Mäuse vor (oberes Feld) und nach (unteres Feld) nicht-T-Zell-Depletion. (B) Repräsentative FACS Plots von T - Zellen aus der Milz (Sp), proximalen Lymphknoten (ZL) und distalen Lymphknoten (dLN). Donor OT-I CD8-T-Zellen sind CD45.1 positiv. (C) Repräsentative CFSE Profile übertragen, CFSE-markierte OT-I Spender - T - Zellen aus der Milz (Sp), proximalen Lymphknoten (ZL) und distalen Lymphknoten (dLN) von WT (schraffierte Kurven) undMT (durchgezogene Linien) Empfängermäuse 3 Tage nach der Immunisierung mit OVA-Protein und LPS. Die gestrichelte Linie zeigt OT-I T-Zellen von WT Empfängermäuse ohne Immunisierung (PBS injiziert). (D) Cell Proliferation aktivierter Kontrolle oder MT T - Zellen, gemessen durch [3 H] -Thymidin - Aufnahme - Assay. Die Ergebnisse sind in Counts pro Minute (cpm) angegeben. Gereinigtes Kontrolle (offene Balken) oder MT (geschlossene Balken) T-Zellen für 48 Stunden in Medium allein inkubiert wurden (mittel) oder in Gegenwart von plattengebundenen anti-CD3 oder anti-CD3 und anti-CD28 mit oder ohne rekombinantes IL- 2. Polyklonale Zell - Aktivierung durch PMA (Phorbolester) und A23 (Calciumionophor) ausgelöst wurde. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 2: CFSE ProfilB - Zellen nach in vitro Stimulation. (A) B220 und CD3 - Färbung von Milzzellen isoliert von WT - Mäusen vor (oberes Feld) und nach (unteres Feld) nicht-B - Zell - Depletion. (B) Repräsentative CFSE Profil von CFSE-markierten WT (schraffierte Kurve) Milz - B - Zellen nach 3 Tagen in vitro Stimulation mit Platten , beschichtet mit Anti-CD40 und IL - 4. Die gestrichelte Linie zeigt an CFSE-markierten WT - B - Zellen ohne Stimulation. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Diskussion
In diesem Protokoll zeigen wir ein Verfahren für die Lymphozyten aus lymphoiden Organen zu reinigen. Zellreinigung magnetischen Kügelchen Sortieranlage verwendet, ist eine schnelle und einfache Methode, die lebensfähige, hochgereinigten Zielzellen ergibt.
Kritische Schritte im Rahmen des Protokolls
Die Lebensfähigkeit der Zellen und Zellausbeute
Die Aufrechterhaltung Lebensfähigkeit von hämatopoetischen Linie Zellen in vitro ist von entscheidender Bedeutung für eine erfolgreiche und reproduzierbare Experimente zu gewährleisten. Chemische und biologische Reagenzien, suboptimalen Versuchsbedingungen oder unsachgemäße Lagerung Bedingungen herausgeschnitten Organe können alle beeinflussen die Lebensfähigkeit der Zellen. Nach Exzision von Mäusen, müssen lymphoiden Organen auf Eis und Einzelzellsuspensionen hergestellt, so schnell wie möglich gespeichert werden. Hochgeschwindigkeits-Zentrifugation von Zellsuspensionen auch vermieden werden sollte. Weiterhin Zellpellets sollten durch Ausklopfen Rohre mit den Fingern nach dem Entfernen der Überstand gelöst werden. Es ist nichtzu resuspendieren Pellets direkt mit großen Mengen an Medium durch Pipettieren empfohlen.
Ungefähr 2-4 x 10 7 Milz - B - Zellen und 2 x 10 7 T - Zellen aus allen wichtigen Lymphknoten können von einer 8-10 Wochen alte WT - Maus isoliert werden. Reduzierte Anzahl von gereinigtem B und T-Zellen (unter dem erwarteten Wert) zeigt, suboptimale Bedingungen, wie bereits erwähnt.
Zell Reinheit
Die durchschnittliche Reinheit der isolierten Zellen unter Verwendung dieses Protokolls liegt im Bereich von 90 bis 95%, was für die nachfolgende in vitro oder in vivo - Versuche (1A) , die ausreichend rein ist. Es ist ratsam, nicht die Trennsäule mit einem übermäßigen Anzahl von Zellen während des Prozesses der Trennung zu überlasten, da dies Zelle Reinheit aufgrund der begrenzten Bindungskapazität der Säule beeinträchtigen können.
Die Qualität der FBS
DasQualität FBS verwendete Kulturmedium ist von entscheidender Bedeutung für die in vitro das Überleben von Lymphozyten zu ergänzen. FBS aus verschiedenen Quellen und Chargen können in ihrer Fähigkeit variieren in vitro - Lymphozytenantworten zu unterstützen. Daher ist es wichtig, verschiedene Typen von FBS zu testen, zu finden, die hochspezifische Reaktion mit niedrigen Hintergrund gibt. Eine erhebliche Anzahl von Flaschen sollten dann als Lager reserviert werden.
Technische Änderungen und Fehlerbehebung
CFSE Markierungsbedingungen
Obwohl CFSE Markierung in Klar RPMI arbeitet, haben wir festgestellt, dass ein geringer Prozentsatz von FBS in PBS unter Verwendung von Zelltod während des Ladevorgangs verringert, ohne die Effizienz der Markierung zu beeinträchtigen. Außerdem minimiert die Anwesenheit von FBS Zellverlust während der Zentrifugation.
Ein wichtiger Aspekt der CFSE Kennzeichnung ist auch die Kennzeichnung der Zellen, um zu gewährleisten, die ausgeprägte Spitze zu visualisierens, die darstellen, Zellteilung. Eine Überlastung von CFSE könnte zu einer erhöhten Zelltod in vitro oder schlechte Wiederherstellung der markierten Zellen in vivo führen. Auf der anderen Seite eine unzureichende CFSE Etikettieren oder Heterogenität in der Zielzellsuspension während des Prozesses der Etikettierung führen kann schlecht aufgelösten CFSE 12 Spitzen. Daher ist es wichtig, die CFSE Markierungsbedingungen zu optimieren. Die Menge an CFSE zur Etikettierung verwendet wird, sollte so gering wie möglich zu reduzieren potentiellen toxischen Wirkungen von Überlastung, gehalten werden, aber immer noch eine ausreichende Markierung erzielt gut aufgelöste Peaks bei Stimulierung innerhalb des Versuchszeitrahmens zu erfassen. Zusätzlich zu schlecht aufgelöste Peaks, Zellklumpen zu vermeiden sollten von Einzelzellsuspensionen vor der CFSE Laden entfernt werden.
Zellklumpen und Zellverlust
Es ist von entscheidender Bedeutung, um sicherzustellen, dass die Zellen wieder vollständig ausgesetzt werden, bevor sie wegen der ewigen remova zu dem nächsten Schritt fortfahrenl der Zellklumpen während des Versuchs drastisch reduziert Zellzahlen. Zellklumpen werden in der Regel mit verringerter Lebensfähigkeit der Zellen oder unzureichende Resuspension des Zellpellets in Verbindung gebracht.
Überlappungs CFSE und Emissionsspektren
CFSE-markierten Zellen können weiter mit Fluorophor-konjugierten Antikörper nach einem Tag in Kultur jedoch definiert werden, wobei diese CFSE-markierten Zellen verbleiben immer noch hell fluoreszierende nach einem Tag in Kultur. Verwendung von Kombinationen von Fluorophoren zu hell mit minimalen Mengen von Emissionsspektren überlappen konjugierte Antikörper mit CFSE wie Phycoerythrin (PE) und Phycoerythrin-Cyanin 7 (PeCy7) liefert optimale Färbeergebnisse. Allerdings Kompensation Emissionsspektren Überlappung zu reduzieren ist weiterhin erforderlich. Darüber hinaus aufgrund der hohen Intensität des CFSE Signal (FL-1 Kanal), die in den FL-2-Kanal schwappt, hat der FL-2-Kanal durch Abzug des hohen Anteils von FL-2-Wert kompensiert werden, um eine Opt zu erreichenimal CFSE Profil. Man kann sich auf das Papier beziehen , veröffentlicht von Quah et al., Die 12 Lösungen für die Fehlersuche CFSE Kennzeichnung und Analyse der Ergebnisse liefert.
Alternativen zu CFSE
Das Emissionsspektrum von CFSE schränkt die Verwendung von Kombinationen von CFSE mit Fluorescein-Derivate, wie grün fluoreszierendes Protein (GFP) und Fluorescein-Isothiocyanat (FITC) -konjugierten Antikörpern. Es gibt jedoch auch andere im Handel erhältliche Zell Farbstoffe mit gleich hoher Fluoreszenzintensität und niedrige Zelltoxizität in violett (CTV, Anregung / Emission: 405/450 nm), Gelb (CTY, 555/580 nm), weit rot (CTFR, 630 / 661 nm oder CPD670, 647/670 nm) und rot (PKH26, 551/567 nm). Mit Zellmarkierungsfarbstoffe mit unterschiedlichen Emissionsspektren bietet Flexibilität bei der Versuchsplanung. Auf der anderen Seite, die nicht alle der oben beschriebenen Zellmarkierungsfarbstoffe können verschiedene Zellteilung Peaks erzeugen. Eine vergleichende Studie durchgeführt, unter Verwendung vonverschiedene Zellmarkierungsfarbstoffe festgestellt , dass eine bessere CTV Ersatz für CFSE ist , weil CTV die Erfassung einer höheren Anzahl von klar definierten Zellteilung Spitzen 13 ermöglicht.
Einschränkungen
Die Hauptbeschränkung der magnetischen Zellsortierung ist, dass sie nur für den einfachen Zellsortierung ist. In unserem Beispiel könnten wir CD43 zu verarmen, alle nicht-B-Zellen aus der Milz verwenden; Allerdings würden wir nicht in der Lage sein, follikulärem B-Zellen aus Randzone B-Zellen zu trennen. Diese Teilpopulationen können nur mit mehreren Oberflächenmarker definiert werden. Während es möglich ist, positiv Zellen unter Verwendung von magnetischen Zelle auswählen Sortieren mehrerer Oberflächenmarker auf Basis ist es abhängig von speziell präparierten, im Handel erhältlichen Reagenzien, die die Freisetzung von Mikrokügelchen von Zielzellen nach der ersten Runde der Sortierung, bevor Sie mit dem zweiten Marker ermöglichen. Somit würde der Benutzer auf den im Handel erhältlichen Kits vollständig abhängig sein. In einem solchen Fall FACS iist viel vorteilhafter, in verfeinerte Zellpopulationen zu trennen.
Bedeutung der Technik
Antikörper-basierte Zellsortierung Ansätze, wie beispielsweise magnetische Zellsortierung und FACS, sind die zuverlässigsten Zelltechniken Sortier 15 zu datieren. Andere Methoden der Zellseparation existieren, einschließlich Dichte Basis und Einhaltung Gestützte Techniken jedoch Lymphozyten sind schlecht anhaftenden Zellen und deren Subpopulationen sind relativ ähnlich in der Dichte, wodurch adherence- und Dichte basierenden Techniken sind entweder nicht anwendbar oder sind sehr ineffizient 15 .
Wie in der Einleitung erwähnt, eine schnelle, einfache, hohe Lebensfähigkeit der Zellen, und unabhängig von hoch entwickelten Geräten sind die ausgezeichneten Eigenschaften der magnetischen Zelle über FACS-Sortierung. Insbesondere negative Depletion mit Hilfe von Magnetzell Etiketten und verarmt unerwünschte Zellen Sortieren einer magnetischen Trennsäule, während die Zielzellen mit minimalen modificatio Isolierungns an die Zelloberfläche und den naiven Zustand beibehalten wird.
Zukünftige Anwendungen
Die hoch angereichert ist , lebensfähige und naiven Lymphozyten unter Verwendung dieses magnetischen basierten Reinigungstechnik gereinigt an verschiedene funktionelle Tests der Lymphozytenverhalten und Signalisierungsmechanismen in vitro und in vivo unterzogen werden. In diesem Protokoll haben wir gezeigt , zwei verschiedene Zellproliferationsassays unter Verwendung von - [3 H] -Thymidin - Einbau - Assay und CFSE Zellproliferationsassay - Die Zelle proliferative Kapazität von aktivierten Lymphozyten zu untersuchen.
Die Wahl zwischen [3 H] -Thymidin - Einbau - Assay und CFSE - Zellproliferationstest hängt weitgehend von Probengröße und Versuchsbedingungen. Verwendung des [3 H] -Thymidin - Einbau - Assay in Experimenten mit großen Probengrößen erzeugt Hochdurchsatz - Zellproliferationsdaten. Um eine optimale, um sicherzustellen, [ 3 H] -Thymidin - Aufnahme und die Reproduzierbarkeit der Ergebnisse, [3 H] -Thymidin sollte zu der Kultur hinzugefügt werden , wenn eine Mehrheit der Zellen aktiv sind , dividiert wird . Optimierung der Markierungsprotokoll wird für verschiedene Zelltypen und Stimuli erforderlich. Außerdem ist es aufgrund der radioaktiven Art von [3 H] -Thymidin, diese Inkorporationstest kann nur in vitro durchgeführt werden, im Gegensatz zu CFSE Markierung von Zellen, die in vitro (2B) oder adoptiv übertragen in Empfängermäuse (1B aktiviert werden kann , und 1C).
Die CFSE - Zellproliferationstest, andererseits bietet mehr Informationen über die Zellproliferation als [3 H] -Thymidin - Inkorporation. Da die Intensität des CFSE in CFSE-markierten Zellen um die Hälfte bei jeder Zellteilung verringert, kann man die Anzahl der Zellteilungen und den Anteil der Zellen bei jeder Teilung durch Zählen der Anzahl und der Größe von Spitzen festzustellen, 12,13. Weiterhin kann CFSE-markierten Zellen weiter in verschiedene Untergruppen definiert werden, entsprechend ihrer Oberflächenmolekül-Expression mittels Durchflusszytometrie die entsprechenden Fluorophor-konjugierte Antikörper verwendet. Am wichtigsten ist , im Gegensatz zu den [3 H] -Thymidin - Einbau - Assay die Zellproliferation in der letzten Zeitpunkt misst, erlaubt die CFSE - Zellproliferationstest für die Verfolgung der Zellteilung, weitere Informationen über die Kinetik der Zellproliferationskapazität. Jedoch kann die CFSE-Zellproliferationstest nicht geeignet sein für Experimente mit großen Stichprobengrößen.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
Die Studie wird durch das Ministerium für Bildung, Singapur (ACRF Tier1-RG40 / 13 und Tier2-MOE2013-T2-2-038) unterstützt. Das Manuskript wurde von Amy Sullivan aus Obrizus Kommunikation bearbeitet.
Materialien
| Name | Company | Catalog Number | Comments |
| Materials | |||
| RPMI 1640 (without L-Glutamine) | Gibco | 31870025 | |
| Fetal Bovine Serum | Heat inactivated | ||
| L-glutamine | Gibco | 25030024 | |
| Penicillin/Streptomycin | Gibco | 15140114 | |
| 2-mercaptoethanol | Gibco | 21985023 | |
| Anti-CD43 magnetic microbeads | Miltenyi Biotec | 130-049-801 | Mix well prior use |
| Streptavidin microbeads | Miltenyi Biotec | 130-048-101 | Mix well prior use |
| Anti-Annexin V magnetic beads | Miltenyi Biotec | 130-090-201 | Mix well prior use |
| MACS LD | Miltenyi Biotec | 130-042-901 | |
| 96-well U-bottom sterile culture plate | Greiner Bio-one | 650180 | |
| 96-well F-bottom sterile culture plate | Greiner Bio-one | 655180 | |
| 100 μm cell strainer mesh | To sterilize using UV radiation prior use | ||
| 0.2 μm sterile disposable filter units | Nalgene | 567-0020 | Can be substituted with any sterile filter device |
| CellTrace Violet | Invitrogen | C34557 | CTV for short; alternative to CFSE |
| CellTrace Yellow | Invitrogen | C34567 | CTY for short; alternative to CFSE |
| CellTrace Far Red | Invitrogen | C34564 | CTFR for short; alternative to CFSE |
| Cell Proliferation Dye eFluor 670 | eBioscience | 65-0840 | CPD670 for short; alternative to CFSE |
| PKH26 | Sigma Aldrich | PKH26GL | PKH26, alternative to CFSE |
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Dextrose | Sigma Aldrich | G7021 | |
| Potassium phosphate monobasic | Sigma Aldrich | P5655 | |
| Sodium phosphate dibasic | Sigma Aldrich | S5136 | |
| Phenol Red | Sigma Aldrich | P0290 | |
| Calcium chloride dihydrate | Sigma Aldrich | C7902 | |
| Potassium chloride | Sigma Aldrich | P5405 | |
| Sodium chloride | Merck Millipore | S7653 | Can use from other sources |
| Magnesium chloride hexahydrate | Sigma Aldrich | M2393 | |
| Magnesium sulfate | Sigma Aldrich | M2643 | |
| Ammonium chloride | Sigma Aldrich | A9434 | |
| Tris-base | |||
| Dimethyl Sulfoxide | Sigma Aldrich | D8418 | |
| (5-(and 6-) carboxyfluorescein diacetate succinimidyl ester (CFSE) | Molecular Probes | C-1157 | Reconstitute in DMSO |
| Phorbol 12,13-dibutyrate (PBDU, Phorbol ester) | Sigma Aldrich | P1269 | |
| A23187 (Calcium ionophore) | Sigma Aldrich | C7522 | |
| Name | Company | Catalog Number | Comments |
| Antibodies and recombinant protein | |||
| CD11b biotin (clone m1/70) | Biolegend | 101204 | T cell depletion cocktail |
| CD11c biotin (clone N418) | Biolegend | 117304 | T cell depletion cocktail |
| Gr-1 biotin (clone RB6-8C5) | Biolegend | 108404 | T cell depletion cocktail |
| Ter119 biotin (clone Ter119) | Biolegend | 116204 | T cell depletion cocktail |
| TCR-γδ biotin (clone GL-3) | Biolegend | 118103 | T cell depletion cocktail |
| CD19 biotin (clone 6D5) | Biolegend | 115504 | T cell depletion cocktail |
| B220 biotin (clone RA3-6B2) | Biolegend | 103204 | T cell depletion cocktail |
| CD49b biotin (clone DX5) | Biolegend | 108904 | T cell depletion cocktail |
| CD4 biotin (clone GK1.5) | Biolegend | 100404 | T cell depletion cocktail |
| CD8 biotin (clone 53-6.7) | Biolegend | 100704 | T cell depletion cocktail |
| F(ab’)2 goat anti-mouse IgM (plate coated) | Jackson ImmunoResearch | 115-006-075 | 50 µl/well for coating (96-well) |
| Anti-mouse CD40 mAb (plate coated) | Pharmingen | 553722 | 50 µl/well for coating (96-well) |
| Recombinant IL-4 | ProSpec | Cyt-282 | |
| LPS from E. coli Serotype 055:B5 | Sigma Aldrich | L-4005 | |
| Anti-CD3 (clone clone OKT3) (plate coated) | eBioscience | 16-0037-85 | 50 µl/well for coating (96-well) |
| Anti-CD28 (clone clone 37.51) (plate coated) | eBioscience | 16-0281-85 | 50 µl/well for coating (96-well) |
| Recombinant IL-2 | ProSpec | Cyt-370 | |
| Albumin from chicken egg white, Ovalbumin | Sigma Aldrich | A7641 |
Referenzen
- Nikolich-Žugich, J., Slifka, M. K., Messaoudi, I. The many important facets of T-cell repertoire diversity. Nat. Rev. Immunol. 4 (2), 123-132 (2004).
- LeBien, T. W., Tedder, T. F. B lymphocytes: how they develop and function. Blood. 112 (5), 1570-1580 (2008).
- Brownlie, R., Zamoyska, R. T cell receptor signaling networks: branched, diversified and bound. Nat. Rev. Immunol. 13 (4), 257-269 (2013).
- Neo, W. H., Lim, J. F., Grumont, R., Gerondakis, S., Su, I. C-rel regulates ezh2 expression in activated lymphocytes and malignant lymphoid cells. J. Biol. Chem. 289 (46), 31693-31707 (2014).
- Gunawan, M., et al. The methyltransferase Ezh2 controls cell adhesion and migration through direct methylation of the extranuclear regulatory protein talin. Nat Immunol. 16 (5), 505-516 (2015).
- Lyons, A. B., Parish, C. R. Determination of lymphocyte division by flow cytometry. J. Immunol. Methods. 171 (1), 131-137 (1994).
- Cabatingan, M. S., Schmidt, M. R., Sen, R., Woodland, R. T. Naïve B lymphocytes undergo homeostatic proliferation in response to B cell deficit. J. Immunol. 169 (12), 6795-6805 (2002).
- Bedoya, S. K., Wilson, T. D., Collins, E. L., Lau, K., Larkin, J. Isolation and Th17 differentiation of naïve CD4 lymphocytes. J. Vis. Exp. (79), e50765(2013).
- Su, I., et al. Ezh2 controls B cell development through histone h3 methylation and Igh rearrangement. Nat. Immunol. 4 (2), 124-131 (2003).
- Mecklenbräuker, I., Saijo, K., Zheng, N., Leitges, M., Tarakhovsky, A. Protein kinase Cδ controls self-antigen-induced B-cell tolerance. Nature. 416 (6883), 860-865 (2002).
- Rush, J. S., Hodgkin, P. D. B cells activated via CD40 and IL-4 undergo a division burst but require continued stimulation to maintain division, survival and differentiation. Eur. J. Immunol. 31 (4), 1150-1159 (2001).
- Quah, B. J. C., Warren, H. S., Parish, C. R. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester. Nat. Protoc. 2 (9), 2049-2056 (2007).
- Quah, B. J. C., Parish, C. R. New and improved methods for measuring lymphocyte proliferation in vitro and in vivo using CFSE-like fluorescent dyes. J. Immunol. Methods. 379 (1-2), 1-14 (2012).
- Hawkins, E. D., Hommel, M., Turner, M. L., Battye, F. L., Markham, J. F., Hodgkin, P. D. Measuring lymphocyte proliferation, survival and differentiation using CFSE time-series data. Nat. Protoc. 2 (9), 2057-2067 (2007).
- Tomlinson, M. J., Tomlinson, S., Yang, X. B., Kirkham, J. Cell separation: Terminology and practical considerations. J. Tissue Eng. 4 (1), 1-14 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten