Method Article
Aislamiento y activación de los linfocitos murinos
En este artículo
Resumen
Lymphocytes are the major players in adaptive immune responses. Here, we present a lymphocyte purification protocol to determine the physiological functions of the desired molecules in lymphocyte activation in vitro and in vivo. The described experimental procedures are suitable for comparing functional capacities between control and genetically modified lymphocytes.
Resumen
B and T cells, with their extremely diverse antigen-receptor repertoires, have the ability to mount specific immune responses against almost any invading pathogen1,2. Understandably, such intricate abilities are controlled by a large number of molecules involved in various cellular processes to ensure timely and spatially regulated immune responses3. Here, we describe experimental procedures that allow rapid isolation of highly purified murine lymphocytes using magnetic cell sorting technology. The resulting purified lymphocytes can then be subjected to various in vitro or in vivo functional assays, such as the determination of lymphocyte signaling capacity upon stimulation by immunoblotting4 and the investigation of proliferative abilities by 3H-thymidine incorporation or carboxyfluorescein diacetate succinimidyl ester (CFSE) labeling5-7. In addition to comparing the functional capacities of control and genetically modified lymphocytes, we can also determine the T cell stimulatory capacity of antigen-presenting cells (APCs) in vivo, as shown in our representative results using transplanted CFSE-labeled OT-I T cells.
Introducción
Mature lymphocytes generally exist in the resting state if there is no pre-existing infection or inflammation in the individual. Therefore, it is important to retain the naïve status of lymphocytes during the isolation process before performing in vitro or in vivo functional assays. The key to ensuring consistent and reproducible results is to limit any unnecessary manipulation of the cells.
Magnetic cell sorting utilizes antibodies and microbeads to label cells so as to enrich the cell population of interest. With this approach, there are two purification strategies: positive enrichment and negative depletion. Positive enrichment enriches the cell population of interest using an antibody that binds to the target cells. Negative depletion, on the other hand, depletes non-target cells, leaving the cell population of interest. In our lab, we prefer negative depletion to positive enrichment because the binding of antibodies to the target cells could potentially alter cell features and behavior. In fact, many established cell surface markers suitable for the isolation of a particular cell population are also functional receptors.
Magnetic cell sorting not only yields highly pure populations of viable target cells, it is also less time-consuming and avoids the cellular stress induced by high-pressure flow used in fluorescence-activated cell sorting (FACS). By labeling the unwanted cell populations and depleting them using a magnetic separation column, we are able to perform rapid cell isolation without compromising the viability of the target cell population. In this protocol, we demonstrate the use of negative depletion strategies to purify naïve B cells or T cells.
Protocolo
Todos los ratones son criados y mantenidos en condiciones libres de patógenos específicos y todos los protocolos de ratón se llevan a cabo de acuerdo con las directrices del Comité para el Cuidado y Uso de Animales institucional.
1. Preparación de tampones y reactivos
- Preparar Memorial Institute completa Roswell Park (RPMI) medio (10% de suero inactivado por calor bovino fetal (FBS), 2 mM L-glutamina, penicilina (100 UI / ml) / estreptomicina (100 mg / ml), 55 mM 2-mercaptoetanol ).
- Preparar 20x solución salina equilibrada (BSS) Lote 1 y 2, por separado.
- Preparar 20x BSS stock 1 (111 mM dextrosa, fosfato de potasio 8,8 mM, 26,7 mM de fosfato dibásico de sodio en 1 L de agua estéril) y añadir 40 ml de 0,5% de rojo fenol 20x BSS stock 1 antes del ajuste del volumen final. Filtro estéril utilizando 0,2 micras filtro antes de guardar a 4 ° C.
- Preparar 20x BSS madre 2 (25,8 mM de cloruro de calcio dihidrato, 107 mM de cloruro de potasio, cap 2,73 M de sodioLoride, 19,6 mM de cloruro de magnesio hexahidratado, 16,6 mM de sulfato de magnesio en 1 L de agua estéril). Filtro estéril utilizando 0,2 micras filtro antes de guardar a 4 ° C.
- Para preparar 1x BSS para uso experimental, diluir 50 ml de BSS stock 1 y 50 ml de BSS madre 2, por separado, en 400 ml de agua estéril cada uno. Combinar ambas soluciones diluidas, se ajusta a pH 7, y se añaden 20 ml de FBS (2%). Completar hasta 1 litro con agua esterilizada y el filtro estéril usando 0,2 micras filtro.
NOTA: las soluciones madre del SRS se deben preparar por separado porque la mezcla de poblaciones concentradas directamente SRS podría dar lugar a la precipitación.
- De glóbulos rojos (RBC) Tampón de lisis
- Para preparar tampón de lisis RBC, la mezcla 9 partes de cloruro de stock de amonio (cloruro de amonio 155 mM en agua estéril) a 1 parte de la base Tris (Tris mM (hidroximetil) aminometano 130 en agua estéril, pH 7,65) antes de su uso.
NOTA: las tiendas de soluciones madre estériles de cloruro de amonio y Tris-base a 4 ° C. Preparar lisis bUffer fresco para asegurar la lisis eficiente de los glóbulos rojos.
- Para preparar tampón de lisis RBC, la mezcla 9 partes de cloruro de stock de amonio (cloruro de amonio 155 mM en agua estéril) a 1 parte de la base Tris (Tris mM (hidroximetil) aminometano 130 en agua estéril, pH 7,65) antes de su uso.
2. Generación de linfocitos Suspensión de bazo o los ganglios linfáticos
NOTA: Es importante preparar todos los reactivos y equipos necesarios para el experimento antes de la eutanasia y del ratón para generar suspensiones de células individuales de linfocitos tan pronto como sea posible para mantener la viabilidad celular por alto.
- La eutanasia experimental de ratón por dislocación cervical o asfixia con CO2.
NOTA: A partir de este paso en adelante, todos los procedimientos experimentales deben llevarse a cabo de forma aséptica. - Sumergir todo el ratón en etanol al 70% antes de hacer ninguna incisión. Extirpar el bazo y los ganglios linfáticos de manera aséptica 8, y colocarlos en distintos tubos de 15 ml que contienen 5 ml de RPMI / FBS enfriado con hielo (RPMI con FBS al 2%) o BSS / FBS (del paso 1.2.3).
NOTA: Como BSS impide eficiente lisis RBC, utilice RPMI para la preparación de la suspensión de células del bazo y cambiar a BSS faetlisis r RBC. - Para generar una suspensión de células de bazo o los ganglios linfáticos, coloque el órgano (s) entre dos piezas de malla de filtro de micras de células estéril 100 en una placa de Petri que contiene 2 ml enfriado en hielo RPMI / FBS o BSS / FBS. Usando el émbolo de una jeringa de 1 ml, triturar el órgano (s) hasta que se haya rasgado en partes muy finas.
- Transferir la suspensión celular a un tubo de 15 ml y lavar la malla del filtro de células con helado de RPMI / FBS o BSS / FBS. Recoger la suspensión celular restante, añadirlo al mismo tubo de 15 ml y centrifugar a 453 g durante 5 min a 4 ° C. Eliminar el sobrenadante.
NOTA: Vuelva a suspender las células sedimentadas colocando el tubo con los dedos antes de la adición de tampón de lisis de glóbulos rojos o medio en los pasos posteriores. - Preparar temperatura ambiente tampón de lisis (RT) RBC durante la centrifugación de la suspensión celular (véase la etapa 1.3.). Después de la granulación de las células y eliminar el sobrenadante, volver a suspender las células con 1 ml de tampón de lisis de glóbulos rojos por cada 10 8 células. Incubate la reacción de lisis a temperatura ambiente durante 3-4 min.
- Deja de lisis de glóbulos rojos con 14 ml de helado de BSS / FBS y centrifugar a 453 g durante 5 min a 4 ° C.
3. Purificación de células B y T
- La purificación de las células B
- Contar las células utilizando un hemocitómetro. Vuelva a suspender hasta 10 8 células esplénicas en 300 l BSS / FBS y se añaden 50 l anti-CD43 microbolas magnéticas 9,10. Para eliminar las células muertas, añadir 30 l perlas magnéticas Anexina V. Incubar la suspensión de células en un refrigerador 4 ° C durante 30 min.
- La purificación de las células T
- Contar las células utilizando un hemocitómetro. Vuelva a suspender hasta 10 8 células en no-T cóctel de anticuerpos agotamiento de las células (anticuerpos biotinilados contra CD19, B220, Gr-1, TCR-γδ, CD49b, CD11c, CD11b, Ter119 y CD4 o CD8 en función de la población de células diana a ser purificado), diluido 1: 200 en 200 BSS l / FBS 4,5. Incubar la suspensión de células en una4 ° C refrigerador durante 15 min.
- Después de la incubación, añadir 10 ml BSS / FBS para lavar las células y centrifugar a 453 xg durante 5 min a 4 ° C. Eliminar el sobrenadante y resuspender las células en 165 l BSS / FBS con 30 microperlas de estreptavidina l y 15 l perlas magnéticas Anexina V. Incubar la suspensión de células en un refrigerador 4 ° C durante 30 min.
NOTA: Para asegurar incluso el etiquetado con las microperlas magnéticas, incubar las células con microperlas de 15 min, a continuación, mezclar la suspensión de células suavemente tocando el tubo de 15 ml y se incuba otros 15 minutos durante la etapa 3.1.1. o 3.2.2.
- Preparación de la columna de separación para la purificación de la célula
- Preparar una columna de separación no utilizado durante el etiquetado de microperlas de las células (paso 3.1.1. O 3.2.2.). Pre-caliente BSS (sin FBS) a TA y utilizar 2 ml de lavar y equilibrar la columna de forma aséptica. Después de equilibrar con BSS, la columna se lava no se debe permitir que se seque.
NOTA: Utilizamos el LS cOLUMNA lugar de la columna LD recomendada debido a su aptitud para la reutilización (véase el paso 3.4.). - Después del marcaje con las perlas magnéticas, añadir 14 ml BSS / FBS para lavar las células y centrifugar a 453 xg durante 5 min a 4 ° C. Eliminar el sobrenadante y resuspender las células en 1-3 ml de BSS RT.
- Adjuntar una aguja estéril 21 G a la punta de la columna para reducir la velocidad de flujo durante el proceso de purificación. Cargar la suspensión celular en la columna equilibrada y se recoge el flujo a través que contiene las células diana purificadas.
NOTA: Evitar la introducción de burbujas dentro de la columna durante la carga. - Lavar la columna una vez con 1 ml de BSS / FBS y se recoge el flujo a través que contiene las células diana purificadas. Actualizar la columna con el flujo a través una vez más. Recoger el flujo a través de después de la segunda carga en el mismo tubo de 15 ml.
- Lavar la columna 3 veces con 1 ml de BSS / FBS y se recoge el flujo a través que contiene las células diana purificadas. A partir de entonces, se añaden 5 ml de BSS / FBS a thcolumna de dirección y, con un émbolo, a eliminar las células marcadas magnéticamente fuera de la columna en un nuevo tubo de 15 ml.
- Comprobar la pureza de las células recogidas por citometría de flujo utilizando anticuerpos que se unen a antígenos de B purificada o células T 4,5 superficie.
- Preparar una columna de separación no utilizado durante el etiquetado de microperlas de las células (paso 3.1.1. O 3.2.2.). Pre-caliente BSS (sin FBS) a TA y utilizar 2 ml de lavar y equilibrar la columna de forma aséptica. Después de equilibrar con BSS, la columna se lava no se debe permitir que se seque.
- La reutilización de la columna de separación
NOTA: La columna LS se puede reutilizar hasta 4 veces sin afectar a la eficiencia de purificación.- Lavar la columna 3 veces con 5 ml de tampón fosfato salino (PBS) y 3 veces con 5 ml de agua destilada por la parte superior mediante el émbolo.
- Lavar la columna con 5 ml de etanol 70% y se seca la columna extensivamente usando un grifo de aire para evitar la acumulación de óxido en la columna.
- Para preparar una columna LS usado para un experimento de purificación por separado, lavar la columna de abajo hacia arriba con etanol 5 ml de 70% utilizando el adaptador de la jeringa. A continuación, lavar la columna de abajo hacia arriba dos veces con 5 ml de PBS estéril, seguido por 5 ml de PBS una vez desde la parte superior de la columna. Añadir 2RT ml de BSS para equilibrar la columna y luego proceder a la carga de la columna con células marcadas.
4. CFSE etiquetado y Estimulación
NOTA: Purificado células se pueden someter a una variedad de in vitro y en ensayos funcionales in vivo. Aquí, nosotros usamos las células T purificadas para determinar la capacidad de estimulación de células T de APC 5.
- solución de pre-calentamiento de etiquetado (0,1% de FBS en PBS) a 37 ° C antes de la CFSE de carga.
NOTA: El uso de un bajo porcentaje de FBS en PBS reduce la muerte celular durante la CFSE carga y reduce al mínimo la pérdida de células durante la centrifugación. Sin embargo, demasiado FBS pueden interferir con la carga CFSE. - Lavar las células purificadas dos veces con solución de etiquetado, a continuación, se resuspendieron a 2 x 10 7 células / ml en solución de etiquetado pre-calentado en un tubo de 15 ml.
- Preparar 10 solución CFSE mu M (1: 500 dilución de CFSE mM solución madre 5) en solución de etiquetado pre-calentado. CFSE solución debedebe prepararse cada vez para conseguir el marcaje óptimo.
- Para cargar las células con CFSE, añadir la suspensión de células de 1 parte a 1 M solución CFSE parte 10 en un tubo de 15 ml y se incuban en la oscuridad durante 10 min a 37 ° C. Una concentración final de 5 mM CFSE se utiliza para etiquetar 1 x 10 7 células / ml.
- Invertir el tubo cada 2 minutos para asegurar una mezcla homogénea de las células durante la CFSE de carga.
- Para detener la reacción, añade varios volúmenes de medio RPMI completo enfriado con hielo y centrifugar a 453 g durante 5 min a 4 ° C. Al éxito CFSE de carga, el sedimento celular aparecerá amarillento.
- Wash CFSE cargado células una vez más con medio RPMI completo enfriado con hielo y girar hacia abajo a 453 xg durante 5 min a 4 ° C antes de usar para el cultivo in vitro o la estimulación in vivo.
5. estimulación in vitro
- Preparar una solución 2x social de estímulos (2x estímulos solución madre) inmediatamente antes de su uso para que 100 l de solución de los estímulos de la 2x se puede añadir a 100 l de células a un volumen final de 200 l por pocillo en una placa de 96 pocillos.
- Si se requiere una placa recubierta con estímulos (IgM o CD40 para células B o CD3 y CD28 para las células T), diluir los estímulos en PBS y pre-capa de la placa de cultivo a 4 ° C durante la noche. Alternativamente, la placa de cultivo se puede recubrir a 37 ° C durante 1 hr en el día del experimento. Lavar la placa recubierta dos veces con PBS (No permita que la placa se seque en cualquier momento).
| Para las células B | |
| Los estímulos | La concentración final |
| F (ab ') 2 de cabra anti-IgM de ratón | 0,6 a 2,4 g / ml |
| Anti-ratón CD40 | 0,5-2 mg / ml |
| recombinanteratón IL-4 | 25 U / ml |
| lipopolisacárido | 0,1 a 10 mg / ml |
| (LPS) de E. coli serotipo 055: B5 | |
| Para las células T | |
| Los estímulos | La concentración final |
| Anti-CD3 (placa recubierta) | 2-10 g / ml |
| (50 l / pocillo para el recubrimiento) | |
| Anti-CD28 (placa recubierta) | 2 g / ml |
| Recombinante IL-2 | 40 U / ml |
| PDBu (éster de forbol) | 5-50 ng / ml |
| A23187 (ionóforo de calcio) | 250 ng / ml |
Tabla 1: Concentraciones de estímulos que se utilizan para estimular los linfocitos en cultivo in vitro.
- Para las células B marcadas con CFSE, vuelva a suspender a 3 x 10 6 células / ml en medio RPMI completo y la cultura, por triplicado, con 3 x 10 5 células / pocillo en placas de 96 pocillos de fondo plano de 72 horas.
- Para las células T marcadas con CFSE, volver a suspender a 0,5-3 x 10 6 células / ml en medio RPMI completo y la cultura por triplicado con 0,5-3 x 10 5 células / pocillo en placas de 96 pocillos de fondo redondo de 48 o 72 horas .
6. En Vivo Estimulación
- Para la estimulación in vivo, la transferencia adoptiva de 4 x 10 6 células T marcadas con CFSE por ratón (por vía intravenosa (iv) en 200 l de PBS) en cada ratón receptor emparejado-MHC.
NOTA: En este protocolo, las células T marcadas con CFSE se pueden transferir de manera adoptiva utilizando vena de la cola o inyección retro-orbital que estas células se alberga órganos linfoides como el bazo y los ganglios. - Desafiar a los ratones receptores un día después con el antígeno.
NOTA:En este ejemplo, se utiliza la ovoalbúmina (proteína OVA, 50 g / ratón) como el antígeno porque específica de OVA, receptor de células T (TCR) las células T -transgenic se transfirieron adoptivamente en ratones receptores. Preparar la proteína OVA en PBS estéril e inyectar 100 l de proteína OVA / PBS o PBS control, a través de inyección subcutánea (IS), en cada ratón receptor 5. - Cosecha y generar suspensiones individuales de células de los órganos linfoides (ganglios linfáticos y el bazo) de los ratones receptores de 3 días después de la inmunización con la proteína OVA o PBS. ganglios linfáticos separadas en los ganglios linfáticos proximales (PLN), que incluye axilar, braquial y de los ganglios linfáticos cervicales superficiales) y los ganglios linfáticos distales (DLN), que incluye mesentérica, poplítea, inguinal, lumbar, y los ganglios linfáticos caudal. células de tinción de FACS utilizando los anticuerpos adecuados para detectar la proliferación de células T.
NOTA: En este experimento de seguimiento de células CFSE, CFSE marcado con las células T de ratones de control inyectados con PBS establecer una fluorescencia de línea de base para los no-diViding células. Divisiones celulares de proliferación, las células, marcadas con CFSE estimulados por antígenos se visualizaron mediante la medición de los picos de fluorescencia 12,13. Con el control de PBS, el número de divisiones celulares de la proliferación, las células T marcadas con CFSE se puede determinar 12,13. - Analizar los datos de proliferación de células CFSE marcado mediante la comparación del número de divisiones celulares o picos entre las muestras (Figuras 1 y 2).
NOTA: Por ejemplo, marcado con CFSE, las células T específicos de OVA adoptivamente transferidas en ratones receptores que recibieron el antígeno OVA se someterán a la proliferación activa en comparación con los ratones de control inyectados con PBS 5,12. Además, es digno de mención destacar que hay muchas maneras de analizar los datos de proliferación de células CFSE, como se demuestra por Hawkins y colegas 14.
Resultados
purificación celular magnética de linfocitos permite a los usuarios para purificar una población de células diana en un período relativamente corto de tiempo. Utilizando el protocolo de agotamiento, hemos sido capaces de aumentar el porcentaje de células T CD8 (OT-I en la recombinación de activación de gen-1 (RAG-1) ratones deficientes) de 72,8% (antes de la purificación) a 94,2% (después de la purificación; Figura 1 A) 4,5. Estos linfocitos purificados se pueden utilizar para ensayos funcionales aguas abajo para determinar la proliferación de linfocitos y la señal de transducción de 4,5. Por ejemplo, podemos estudiar in vivo la capacidad de estimulación de células T en las APC mediante la transferencia de células T marcadas con CFSE, específicas de antígeno en wildtype (WT) y ratones mutantes (MT) inmunizados con antígeno adecuado 5.
En nuestro experimento representativo, transferimos purificado, marcado con CFSE, ovoalbúmina (OVA) específica OT-I c T CD8ells en control (WT) y ratones mutantes (MT) y se inmunizaron los ratones un día después con la proteína OVA. Tres días después de la inmunización, cosechamos ganglios linfáticos (proximal y distal) y los bazos y se analizaron las células T por citometría de flujo. formas alélicas CD45 se pueden utilizar para separar mejor la divisoria, CFSE marcado, donantes células OT-I de las células CD8 no marcados, receptores T CD8. En este ejemplo, las células del donante y el receptor son de ratones CD45.1 y CD45.2, respectivamente (Figura 1B). Los niveles CFSE de sobrevivir, las células OT-I T no estimuladas en este punto de tiempo se utilizan para definir el pico de células no proliferativas (Figura 1C, la línea de puntos). Tras la estimulación, la intensidad de los niveles de CFSE en las células OT-I T reducirá a la mitad con cada división. La proliferación de células T de ese modo se puede determinar contando el número de picos de CFSE 6,12. En nuestros resultados representativos, no vemos diferencias en las capacidades de presentación cruzada de WT y MT (APCFigura 1C, líneas continuas), ya que las células T proliferan a tasas similares tanto en ratones.
En un experimento separado, se realizó un [3 H] -timidina ensayo para estudiar la proliferación de las células de control de activado y células MT T. Las células purificadas WT y MT T se estimularon con diversos estímulos durante 48 horas y se pulsaron con timidina [3 H] para la final 8 hr. La proliferación de células en la fase S del ciclo celular incorporará el nucleótido radiomarcado, [3 H] -timidina, en ácido desoxirribonucleico recién sintetizado (DNA), por lo tanto, con el recuento de centelleo líquido, la proliferación celular se puede medir por [3 H] la captación de timidina. El número de cuentas por minuto (cpm) se correlaciona directamente con la cantidad de [3H] -timidina absorción en la proliferación de células T. En nuestros resultados representativos, el reducido número de cpm obtenido de células MT T a la estimulación en comparación con counts de células T WT indica una capacidad proliferativa de las células MT comprometida T (Figura 1D).
Para determinar la capacidad proliferativa de las células B, purificamos células B del bazo utilizando la estrategia descrita agotamiento. Tras la purificación, hemos sido capaces de aumentar el porcentaje de células B220 B (ratones WT) de 63,9% (antes de la purificación) a 98,4% (después de la purificación; Figura 2A) 4. Similar a purificado las células T, las células B esplénicas purificadas también se pueden utilizar para ensayos funcionales aguas abajo para evaluar la proliferación de linfocitos y la transducción de señales 4. Posteriormente, se etiquetados células B esplénicas purificadas WT con CFSE y se estimularon estas células in vitro usando placas recubiertas con anti-CD40 suplementado con la citocina IL-4. Tres días después de la estimulación, se analizaron, células B activadas viables por citometría de flujo. Los niveles de CFSE de sobrevivir, las células B no estimuladas en este punto de tiempo se utilizan paradefinir el pico para las células no proliferativas (Figura 2B, línea de puntos). De manera similar a las células T, la intensidad de los niveles de CFSE en las células B se reducirá a la mitad con cada división 6,12.
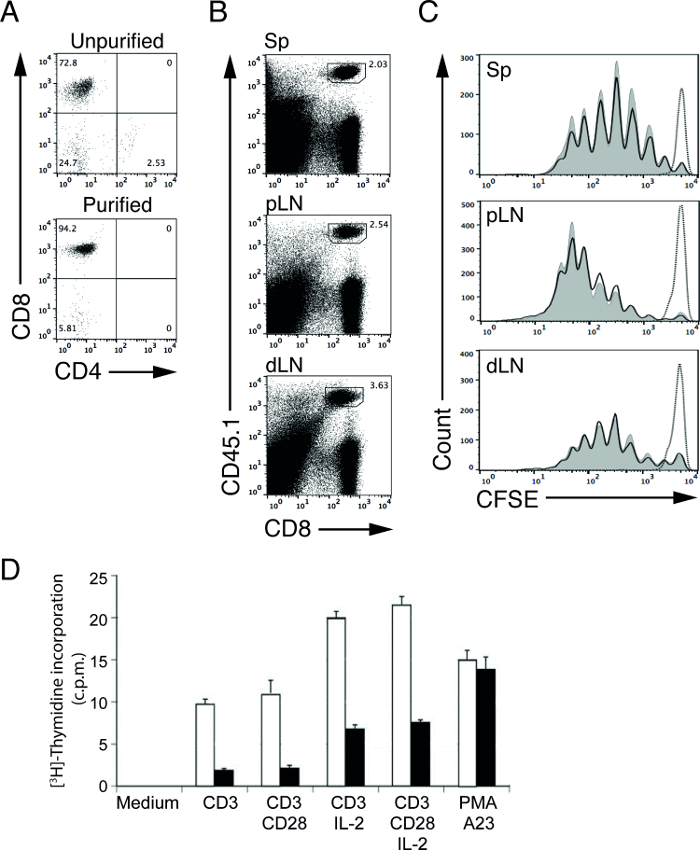
Figura 1: Perfiles de CFSE de adoptivamente células OT-I T purificadas transferidos después de la inmunización (A) CD4 y CD8 tinción de las células aisladas a partir de OT-I;. ratones RAG-1-deficiente antes (panel superior) y después (panel inferior) el agotamiento de células no-T. (B) parcelas de FACS representativos de las células T de bazo (Sp), los ganglios linfáticos proximales (PLN) y los ganglios linfáticos distales (DLN). Donantes células OT-I T CD8 se CD45.1 positivo. Perfiles (C) Representante CFSE de células transferidas, CFSE marcado donantes OT-I T de bazo (Sp), los ganglios linfáticos proximales (PLN) y los ganglios linfáticos distales (DLN) de WT (curvas sombreadas) yratones receptores MT (líneas continuas) 3 días después de la inmunización con la proteína y LPS OVA. La línea punteada indica células OT-I T de los ratones receptores WT sin inmunización (PBS inyectado). (D) la proliferación celular de las células MT T de control activado o medida por ensayo de absorción de timidina [3 H]. Los resultados se presentan en cuentas por minuto (cpm). de control purificada (barra abierta) o MT (bar cerrado) se incubaron las células T durante 48 horas en un solo medio (medio) o en presencia de unido a la placa anti-CD3 o anti-CD3 más anti-CD28 con o sin IL-recombinante 2. La activación policlonal de células fue provocada por la PMA (éster de forbol) y A23 (ionóforo de calcio). Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Perfil de CFSELas células B tras la estimulación in vitro. (A) B220 y CD3 de tinción de las células esplénicas aisladas de ratones WT antes (panel superior) y después (panel inferior) el agotamiento de células no B. (B) el perfil Representante CFSE de WT marcado con CFSE (curva sombreada) células B esplénicas después de 3 días de estimulación in vitro con placas recubiertas con anti-CD40 y IL4. La línea punteada indica WT células B marcadas con CFSE sin estimulación. Por favor, haga clic aquí para ver una versión más grande de esta figura.
Discusión
En este protocolo, se demuestra un procedimiento para la purificación de los linfocitos de los órganos linfoides. la purificación de células utilizando la clasificación perla magnética es un método rápido y simple que produce células diana viables, altamente purificados.
Los pasos críticos dentro del Protocolo
La viabilidad celular y el rendimiento celular
El mantenimiento de la viabilidad de las células del linaje hematopoyético in vitro es fundamental para garantizar experimentos exitosos y reproducibles. Químicos y reactivos biológicos, condiciones experimentales sub-óptimas condiciones de almacenamiento inadecuadas o de los órganos extirpados pueden afectar la viabilidad celular. Tras la escisión de los ratones, los órganos linfoides necesitan ser almacenados en hielo y suspensiones de células individuales preparadas tan pronto como sea posible. centrifugación de alta velocidad de las suspensiones celulares también debe ser evitado. Por otra parte, los sedimentos celulares se deben aflojar los tubos con un movimiento rápido con los dedos después de la eliminación del sobrenadante. No lo esrecomendada para volver a suspender gránulos directamente con grandes cantidades de medio de pipeteo.
Aproximadamente 2-4 x 10 7 células B esplénicas y 2 x 10 7 células T de todos los principales ganglios linfáticos se pueden aislar de un 8-10 semanas de edad de ratón WT. reducción del número de B purificado y células T (por debajo del valor esperado) indica que las condiciones subóptimas, como se mencionó anteriormente.
la pureza de la célula
La pureza media de las células aisladas utilizando este protocolo está dentro del intervalo de 90 a 95%, que es suficientemente puro para su posterior in vitro o en experimentos in vivo (Figura 1A). Es aconsejable no sobrecargar la columna de separación con un número excesivo de las células durante el proceso de separación, ya que hacerlo puede poner en peligro la pureza celular debido a la limitada capacidad de unión de la columna.
Calidad de FBS
loscalidad de FBS utiliza para complementar el medio de cultivo es crítico para la supervivencia in vitro de linfocitos. FBS de diferentes fuentes y los lotes puede variar en su capacidad para apoyar en las respuestas de linfocitos in vitro. Por lo tanto, es importante probar diferentes tipos de FBS para encontrar uno que da respuesta a alta específico con bajo fondo. Un número considerable de botellas continuación, debe reservarse como una acción.
Modificaciones y solución de problemas
Condiciones de etiquetado CFSE
A pesar de que el etiquetado CFSE trabaja en llano RPMI, hemos encontrado que el uso de un bajo porcentaje de FBS en PBS reduce la muerte celular durante el proceso de carga, sin comprometer la eficiencia del etiquetado. Por otra parte, la presencia de FBS minimiza la pérdida de células durante la centrifugación.
Un aspecto importante de etiquetado CFSE es asegurar incluso el etiquetado de las células con el fin de visualizar el pico distintos que representan la división celular. La sobrecarga de CFSE podría resultar en un aumento de la muerte celular in vitro o mala recuperación de células marcadas en vivo. Por otro lado, la insuficiente etiquetado CFSE o heterogeneidad en la suspensión de células diana durante el proceso de etiquetado pueden dar lugar a mal resuelto CFSE picos 12. Por lo tanto, es importante optimizar las condiciones de etiquetado CFSE. La cantidad de CFSE utilizado para el etiquetado debe mantenerse lo más bajo posible para reducir los posibles efectos tóxicos de la sobrecarga, pero aún así lograr suficiente etiquetado para detectar picos bien resueltos tras la estimulación dentro del marco de tiempo experimental. Además, para evitar picos de mal resueltas, grupos de células deben ser retirados de suspensiones de células individuales antes de CFSE de carga.
Grupos de células y la pérdida de células
Es crucial para asegurar que las baterías están completamente re-suspendido antes de proceder al siguiente paso, porque el remova perpetual de grupos de células durante el experimento reduce drásticamente el número de células. grupos de células se asocian generalmente con una viabilidad celular reducida o inadecuada resuspensión del sedimento celular.
CFSE y espectros de emisión solapamiento
células CFSE marcado con pueden definirse con mayor precisión con anticuerpos fluoróforo conjugado después de un día de la cultura, sin embargo, estas células CFSE marcado con fluorescencia brillante aún permanecen después de un día en la cultura. El uso de combinaciones de anticuerpos conjugados con fluoróforos brillantes con cantidades mínimas de solapamiento espectros de emisión con CFSE, tales como ficoeritrina (PE) y ficoeritrina-cianina 7 (PeCy7), proporciona resultados óptimos de tinción. Sin embargo, la compensación para reducir aún se requiere solapamiento espectros de emisión. Además, debido a la alta intensidad de la señal de CFSE (FL-1 canal) que se derrama en el canal FL-2, el canal FL-2 tiene que ser compensado mediante la deducción del alto porcentaje de valor FL-2 para lograr un optperfil tremo CFSE. Uno puede referirse al documento publicado por Quah et al., Que ofrece soluciones para el etiquetado y el análisis de los resultados de la solución de problemas 12 CFSE.
Alternativas a la CFSE
El espectro de emisión de CFSE restringe el uso de combinaciones de CFSE con derivados de fluoresceína tales como la proteína verde fluorescente (GFP) y isotiocianato de fluoresceína (FITC) y conjugado con anticuerpos. Hay, sin embargo, otros colorantes celulares disponibles en el mercado con la intensidad de fluorescencia igualmente alta y baja toxicidad celular en violeta (CTV, excitación / emisión: 405/450 nm), amarillo (CTY, 555/580 nm), rojo lejano (CTFR, 630 / 661 nm o CPD670, 647/670 nm) y roja (PKH26, 551/567 nm). El uso de tintes de etiquetado celular con diferentes espectros de emisión ofrece flexibilidad en el diseño experimental. Por otra parte, no todos los colorantes de etiquetado celular descritos anteriormente pueden generar picos de división celular distintas. Un estudio comparativo realizado utilizandodiversos colorantes de etiquetado celular concluyeron que CTV es un mejor reemplazo para CFSE porque CTV permite la detección de un mayor número de picos de división celular claramente definidos 13.
limitaciones
La principal limitación de la clasificación de células magnética es que sólo es adecuado para la clasificación de células simples. En nuestro ejemplo, podríamos usar CD43 para agotar todas las células no-B de bazo; Sin embargo, no sería capaz de separar las células B foliculares de células de la zona marginal B. Estas subpoblaciones sólo se pueden definir con múltiples marcadores de superficie. Si bien es posible seleccionar positivamente células usando clasificación celular magnética basan en múltiples marcadores de superficie, que depende de los reactivos especialmente preparados, disponibles comercialmente que permiten la liberación de las microperlas de las células diana después de la primera ronda de clasificación antes de proceder a la segunda marcador. Así, el usuario sería completamente dependiente de los kits disponibles en el mercado. En tal caso, FACS iEs mucho más ventajoso en la separación de poblaciones de células refinados.
Importancia de la Técnica
De clasificación de células enfoques basados en anticuerpos, tales como la clasificación de células magnético y FACS, son la célula más fiable técnicas de clasificación hasta la fecha 15. Existen otros métodos de separación de células, incluyendo técnicas basadas en la densidad y a base de adherencia, sin embargo, los linfocitos son células pobremente adheridas y sus subpoblaciones son relativamente similares en la densidad, por lo tanto adherence- y técnicas son o bien no aplicable a base de densidad o son muy ineficientes 15 .
Como se ha mencionado en la introducción, rápido, simple viabilidad, celda de alta, e independiente de cualquier equipo sofisticado son las características ganadoras de clasificación celular magnética sobre FACS. En particular, el agotamiento, negativa usando clasificación celular magnética etiquetas y reduce las células no deseadas utilizando una columna de separación magnética, mientras que el aislamiento de células diana con un mínimo modifications a la superficie celular y el mantenimiento del estado ingenuo.
Las aplicaciones futuras
Los linfocitos altamente enriquecido, viable, y no tratados previamente purificado utilizando esta técnica de purificación basada en magnética pueden ser sometidos a diversos ensayos funcionales de comportamiento de los linfocitos y los mecanismos de señalización in vitro e in vivo. En este protocolo, hemos demostrado el uso de dos diferentes ensayos de proliferación celular - [3 H] -timidina y ensayo de incorporación de ensayo de proliferación celular CFSE - para investigar las células capacidades proliferativas de los linfocitos activados.
La elección entre [3 H] -timidina y ensayo de incorporación de ensayo de proliferación celular CFSE depende en gran medida de tamaño de la muestra y las condiciones experimentales. Utilizando el [3H] timidina incorporación de ensayo en los experimentos con muestras de gran tamaño genera datos de proliferación celular de alto rendimiento. A fin de asegurar una óptima [ 3 H] -timidina absorción y la reproducibilidad de los resultados, [3 H] -timidina, debe añadirse a la cultura cuando una mayoría de las células se están dividiendo activamente. Se requiere Optimización del protocolo de marcaje para diferentes tipos de células y estímulos. Además, debido a la naturaleza radiactiva de [3 H] -timidina, este ensayo de incorporación sólo se puede realizar in vitro, a diferencia de etiquetado CFSE de células, que puede ser activado in vitro (Figura 2B) o adoptivamente transferida en ratones receptores (Figura 1B y 1C).
El ensayo de proliferación de células CFSE, por otra parte, ofrece más información sobre la proliferación celular de [3H] -timidina. Dado que la intensidad de CFSE en las células CFSE marcado reduce a la mitad con cada división celular, se puede determinar el número de divisiones celulares y la proporción de células en cada división contando el número y el tamaño de los picos 12,13. Además, las células marcadas con CFSE se pueden definir más en diferentes subconjuntos de acuerdo con su superficie de la expresión de moléculas mediante citometría de flujo usando los anticuerpos fluoróforo conjugado correspondientes. Lo más importante, a diferencia del ensayo de incorporación de timidina [3 H] que mide la proliferación celular en el punto de tiempo final, el ensayo de proliferación de células CFSE permite el seguimiento de la división celular, proporcionando más información sobre la cinética de la capacidad de proliferación de las células. Sin embargo, el ensayo de proliferación de células CFSE puede no ser adecuado para los experimentos con muestras de gran tamaño.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
El estudio es apoyado por el Ministerio de Educación, Singapur (ACRF Tier1-RG40 / 13 y Tier2-MOE2013-T2-2-038). El manuscrito fue editado por Amy Sullivan de Obrizus Comunicaciones.
Materiales
| Name | Company | Catalog Number | Comments |
| Materials | |||
| RPMI 1640 (without L-Glutamine) | Gibco | 31870025 | |
| Fetal Bovine Serum | Heat inactivated | ||
| L-glutamine | Gibco | 25030024 | |
| Penicillin/Streptomycin | Gibco | 15140114 | |
| 2-mercaptoethanol | Gibco | 21985023 | |
| Anti-CD43 magnetic microbeads | Miltenyi Biotec | 130-049-801 | Mix well prior use |
| Streptavidin microbeads | Miltenyi Biotec | 130-048-101 | Mix well prior use |
| Anti-Annexin V magnetic beads | Miltenyi Biotec | 130-090-201 | Mix well prior use |
| MACS LD | Miltenyi Biotec | 130-042-901 | |
| 96-well U-bottom sterile culture plate | Greiner Bio-one | 650180 | |
| 96-well F-bottom sterile culture plate | Greiner Bio-one | 655180 | |
| 100 μm cell strainer mesh | To sterilize using UV radiation prior use | ||
| 0.2 μm sterile disposable filter units | Nalgene | 567-0020 | Can be substituted with any sterile filter device |
| CellTrace Violet | Invitrogen | C34557 | CTV for short; alternative to CFSE |
| CellTrace Yellow | Invitrogen | C34567 | CTY for short; alternative to CFSE |
| CellTrace Far Red | Invitrogen | C34564 | CTFR for short; alternative to CFSE |
| Cell Proliferation Dye eFluor 670 | eBioscience | 65-0840 | CPD670 for short; alternative to CFSE |
| PKH26 | Sigma Aldrich | PKH26GL | PKH26, alternative to CFSE |
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Dextrose | Sigma Aldrich | G7021 | |
| Potassium phosphate monobasic | Sigma Aldrich | P5655 | |
| Sodium phosphate dibasic | Sigma Aldrich | S5136 | |
| Phenol Red | Sigma Aldrich | P0290 | |
| Calcium chloride dihydrate | Sigma Aldrich | C7902 | |
| Potassium chloride | Sigma Aldrich | P5405 | |
| Sodium chloride | Merck Millipore | S7653 | Can use from other sources |
| Magnesium chloride hexahydrate | Sigma Aldrich | M2393 | |
| Magnesium sulfate | Sigma Aldrich | M2643 | |
| Ammonium chloride | Sigma Aldrich | A9434 | |
| Tris-base | |||
| Dimethyl Sulfoxide | Sigma Aldrich | D8418 | |
| (5-(and 6-) carboxyfluorescein diacetate succinimidyl ester (CFSE) | Molecular Probes | C-1157 | Reconstitute in DMSO |
| Phorbol 12,13-dibutyrate (PBDU, Phorbol ester) | Sigma Aldrich | P1269 | |
| A23187 (Calcium ionophore) | Sigma Aldrich | C7522 | |
| Name | Company | Catalog Number | Comments |
| Antibodies and recombinant protein | |||
| CD11b biotin (clone m1/70) | Biolegend | 101204 | T cell depletion cocktail |
| CD11c biotin (clone N418) | Biolegend | 117304 | T cell depletion cocktail |
| Gr-1 biotin (clone RB6-8C5) | Biolegend | 108404 | T cell depletion cocktail |
| Ter119 biotin (clone Ter119) | Biolegend | 116204 | T cell depletion cocktail |
| TCR-γδ biotin (clone GL-3) | Biolegend | 118103 | T cell depletion cocktail |
| CD19 biotin (clone 6D5) | Biolegend | 115504 | T cell depletion cocktail |
| B220 biotin (clone RA3-6B2) | Biolegend | 103204 | T cell depletion cocktail |
| CD49b biotin (clone DX5) | Biolegend | 108904 | T cell depletion cocktail |
| CD4 biotin (clone GK1.5) | Biolegend | 100404 | T cell depletion cocktail |
| CD8 biotin (clone 53-6.7) | Biolegend | 100704 | T cell depletion cocktail |
| F(ab’)2 goat anti-mouse IgM (plate coated) | Jackson ImmunoResearch | 115-006-075 | 50 µl/well for coating (96-well) |
| Anti-mouse CD40 mAb (plate coated) | Pharmingen | 553722 | 50 µl/well for coating (96-well) |
| Recombinant IL-4 | ProSpec | Cyt-282 | |
| LPS from E. coli Serotype 055:B5 | Sigma Aldrich | L-4005 | |
| Anti-CD3 (clone clone OKT3) (plate coated) | eBioscience | 16-0037-85 | 50 µl/well for coating (96-well) |
| Anti-CD28 (clone clone 37.51) (plate coated) | eBioscience | 16-0281-85 | 50 µl/well for coating (96-well) |
| Recombinant IL-2 | ProSpec | Cyt-370 | |
| Albumin from chicken egg white, Ovalbumin | Sigma Aldrich | A7641 |
Referencias
- Nikolich-Žugich, J., Slifka, M. K., Messaoudi, I. The many important facets of T-cell repertoire diversity. Nat. Rev. Immunol. 4 (2), 123-132 (2004).
- LeBien, T. W., Tedder, T. F. B lymphocytes: how they develop and function. Blood. 112 (5), 1570-1580 (2008).
- Brownlie, R., Zamoyska, R. T cell receptor signaling networks: branched, diversified and bound. Nat. Rev. Immunol. 13 (4), 257-269 (2013).
- Neo, W. H., Lim, J. F., Grumont, R., Gerondakis, S., Su, I. C-rel regulates ezh2 expression in activated lymphocytes and malignant lymphoid cells. J. Biol. Chem. 289 (46), 31693-31707 (2014).
- Gunawan, M., et al. The methyltransferase Ezh2 controls cell adhesion and migration through direct methylation of the extranuclear regulatory protein talin. Nat Immunol. 16 (5), 505-516 (2015).
- Lyons, A. B., Parish, C. R. Determination of lymphocyte division by flow cytometry. J. Immunol. Methods. 171 (1), 131-137 (1994).
- Cabatingan, M. S., Schmidt, M. R., Sen, R., Woodland, R. T. Naïve B lymphocytes undergo homeostatic proliferation in response to B cell deficit. J. Immunol. 169 (12), 6795-6805 (2002).
- Bedoya, S. K., Wilson, T. D., Collins, E. L., Lau, K., Larkin, J. Isolation and Th17 differentiation of naïve CD4 lymphocytes. J. Vis. Exp. (79), e50765(2013).
- Su, I., et al. Ezh2 controls B cell development through histone h3 methylation and Igh rearrangement. Nat. Immunol. 4 (2), 124-131 (2003).
- Mecklenbräuker, I., Saijo, K., Zheng, N., Leitges, M., Tarakhovsky, A. Protein kinase Cδ controls self-antigen-induced B-cell tolerance. Nature. 416 (6883), 860-865 (2002).
- Rush, J. S., Hodgkin, P. D. B cells activated via CD40 and IL-4 undergo a division burst but require continued stimulation to maintain division, survival and differentiation. Eur. J. Immunol. 31 (4), 1150-1159 (2001).
- Quah, B. J. C., Warren, H. S., Parish, C. R. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester. Nat. Protoc. 2 (9), 2049-2056 (2007).
- Quah, B. J. C., Parish, C. R. New and improved methods for measuring lymphocyte proliferation in vitro and in vivo using CFSE-like fluorescent dyes. J. Immunol. Methods. 379 (1-2), 1-14 (2012).
- Hawkins, E. D., Hommel, M., Turner, M. L., Battye, F. L., Markham, J. F., Hodgkin, P. D. Measuring lymphocyte proliferation, survival and differentiation using CFSE time-series data. Nat. Protoc. 2 (9), 2057-2067 (2007).
- Tomlinson, M. J., Tomlinson, S., Yang, X. B., Kirkham, J. Cell separation: Terminology and practical considerations. J. Tissue Eng. 4 (1), 1-14 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados