Method Article
分离及小鼠淋巴细胞的激活
摘要
Lymphocytes are the major players in adaptive immune responses. Here, we present a lymphocyte purification protocol to determine the physiological functions of the desired molecules in lymphocyte activation in vitro and in vivo. The described experimental procedures are suitable for comparing functional capacities between control and genetically modified lymphocytes.
摘要
B and T cells, with their extremely diverse antigen-receptor repertoires, have the ability to mount specific immune responses against almost any invading pathogen1,2. Understandably, such intricate abilities are controlled by a large number of molecules involved in various cellular processes to ensure timely and spatially regulated immune responses3. Here, we describe experimental procedures that allow rapid isolation of highly purified murine lymphocytes using magnetic cell sorting technology. The resulting purified lymphocytes can then be subjected to various in vitro or in vivo functional assays, such as the determination of lymphocyte signaling capacity upon stimulation by immunoblotting4 and the investigation of proliferative abilities by 3H-thymidine incorporation or carboxyfluorescein diacetate succinimidyl ester (CFSE) labeling5-7. In addition to comparing the functional capacities of control and genetically modified lymphocytes, we can also determine the T cell stimulatory capacity of antigen-presenting cells (APCs) in vivo, as shown in our representative results using transplanted CFSE-labeled OT-I T cells.
引言
Mature lymphocytes generally exist in the resting state if there is no pre-existing infection or inflammation in the individual. Therefore, it is important to retain the naïve status of lymphocytes during the isolation process before performing in vitro or in vivo functional assays. The key to ensuring consistent and reproducible results is to limit any unnecessary manipulation of the cells.
Magnetic cell sorting utilizes antibodies and microbeads to label cells so as to enrich the cell population of interest. With this approach, there are two purification strategies: positive enrichment and negative depletion. Positive enrichment enriches the cell population of interest using an antibody that binds to the target cells. Negative depletion, on the other hand, depletes non-target cells, leaving the cell population of interest. In our lab, we prefer negative depletion to positive enrichment because the binding of antibodies to the target cells could potentially alter cell features and behavior. In fact, many established cell surface markers suitable for the isolation of a particular cell population are also functional receptors.
Magnetic cell sorting not only yields highly pure populations of viable target cells, it is also less time-consuming and avoids the cellular stress induced by high-pressure flow used in fluorescence-activated cell sorting (FACS). By labeling the unwanted cell populations and depleting them using a magnetic separation column, we are able to perform rapid cell isolation without compromising the viability of the target cell population. In this protocol, we demonstrate the use of negative depletion strategies to purify naïve B cells or T cells.
研究方案
所有小鼠饲养和无特定病原体的条件下维持和所有小鼠协议按照机构动物护理和使用委员会的指导方针进行。
1.缓冲液和试剂的制备
- 制备完整罗斯韦尔园区纪念研究所(RPMI)培养基(10%热灭活胎牛血清(FBS),2mM的L-谷氨酰胺,青霉素(100国际单位/毫升)/链霉素(100微克/毫升),55μM2-巯基乙醇)。
- 准备20X平衡盐溶液(BSS)股票1和库存2,分别。
- 准备20X BSS股票1(111毫米葡萄糖,8.8毫米磷酸钾,26.7磷酸钠1升无菌水二元)和最终音量调整前加40毫升中含0.5%酚红20倍BSS股票1。无菌过滤器采用0.2微米的过滤器,在4℃下储存之前。
- 制备20倍的BSS库存2(25.8毫氯化钙二水合物,107毫氯化钾,2.73酸钠沟道loride,19.6毫氯化镁六水合物,于1升无菌水16.6毫硫酸镁)。无菌过滤器采用0.2微米的过滤器,在4℃下储存之前。
- 要准备1X BSS的实验使用,稀释50毫升BSS股票1和50毫升BSS股票2,另外,400毫升无菌水各。结合这两个稀释溶液,调整至pH 7,并添加20毫升FBS(2%)。顶起来使用无菌水和无菌过滤器使用0.2微米的过滤器1升。
注:BSS储液应单独准备,因为集中的BSS股票的混合,直接会导致沉淀。
- 红细胞(RBC)裂解液
- 为了制备RBC裂解缓冲液,混合9份氯乙烯库存铵(155毫氯化物在无菌水中铵)在使用前1份股票Tris碱(在无菌水中130毫摩尔Tris(羟甲基)氨基甲烷,pH值7.65)。
注意:在4℃的氯化铵和Tris碱商店无菌原液。准备裂解buffer新鲜确保红细胞裂解效率。
- 为了制备RBC裂解缓冲液,混合9份氯乙烯库存铵(155毫氯化物在无菌水中铵)在使用前1份股票Tris碱(在无菌水中130毫摩尔Tris(羟甲基)氨基甲烷,pH值7.65)。
2.代脾或淋巴结淋巴细胞悬液的
注:以制备用于小鼠安乐死之前实验所需的所有试剂和设备,并尽快产生淋巴细胞的单细胞悬浮液,以维持高的细胞存活率是重要的。
- 颈椎脱位或CO 2窒息安乐死实验老鼠。
注意:这一步起,所有实验程序应无菌条件下进行。 - 做任何切口之前浸整个鼠标放到70%的乙醇。取出脾和淋巴结无菌8,并将它们置于含5毫升的冰冷RPMI / FBS(RPMI用2%FBS)或BSS / FBS(从步骤1.2.3)独立15ml试管。
注:由于BSS防止高效RBC裂解,使用RPMI的脾细胞悬浮液的制备,并切换到BSS AFTE- [R RBC裂解。 - 以产生从脾脏或淋巴结单细胞悬浮液,将器官(多个)在无菌100微米的细胞滤网目的两片在含有2毫升冰冷的RPMI / FBS或BSS / FBS的培养皿。使用1毫升注射器的柱塞,捣烂器官(S),直到它已被撕裂成很细的部分。
- 细胞悬液转移到15毫升管中并洗涤细胞过滤用冰冷的RPMI / FBS或BSS / FBS的啮合。收集剩余的细胞悬浮液,将其添加到相同的15毫升管中,并在4℃下降速在453×g离心5分钟。去除上清。
注:加入RBC裂解缓冲液或培养基中的后续步骤之前轻弹用手指管重悬浮沉淀的细胞。 - 将细胞悬浮液的离心分离过程中制备室温(RT)RBC裂解缓冲液(见步骤1.3)。制粒细胞并除去上清液后,再停止与每10 8个细胞1毫升RBC裂解缓冲液中的细胞。 INCU软化在RT裂解反应3-4分钟。
- 停止RBC裂解14毫升冰冷的BSS / FBS和在4℃降速在453×g离心5分钟。
3. B和T细胞的分离纯化
- B细胞的纯化
- 算使用血球细胞。重悬在300微升BSS / FBS高达10 8脾细胞,并加入50微升抗CD43磁珠9,10。要去除死细胞,加入30微升Annexin V的磁珠。孵育在4℃冰箱内的细胞悬浮液30分钟。
- 性T细胞的分离纯化
- 算使用血球细胞。重悬至10 8个细胞的非T细胞耗竭抗体混合物(抗CD19,B220,GR-1的生物素化抗体,TCR-γδ,CD49b,CD11c的,细胞CD11b,TER119和CD4或CD8根据目标细胞群体在200μlBSS / FBS -4,5- 200:被纯化),稀释。孵育在所述细胞悬浮液4℃冰箱中15分钟。
- 孵育后,加入10 mL的BSS / FBS洗涤细胞,并在4℃下降速在453×g离心5分钟。去除上清,再暂停165微升BSS / FBS细胞与30微升链霉亲和微珠15微升Annexin V的磁珠。孵育在4℃冰箱内的细胞悬浮液30分钟。
注:为了确保即使在磁微珠标记,用微珠孵育细胞15分钟,然后通过轻敲15毫升管轻轻混合细胞悬液和步骤3.1.1期间孵育另外15分钟。 3.2.2或。
- 分离柱的制备细胞纯化
- 细胞的微珠标记中制备的未使用分离柱(步骤3.1.1。或3.2.2。)。预暖的BSS(无FBS)至RT,并用2毫升给洗并无菌平衡色谱柱。用BSS平衡后,将洗涤塔不应该被允许干燥。
注:我们使用LSÇolumn代替推荐的LD柱的,由于其重复使用性(参见步骤3.4)。 - 用磁珠标记后,添加14毫升BSS / FBS洗涤细胞,并在4℃下降速在453×g离心5分钟。除去上清液并重新悬浮在1-3毫升RT BSS细胞。
- 附加的无菌21g的针列的前端纯化的过程中,以降低流速。加载细胞悬液到平衡柱,并通过含有纯化靶细胞收集的流动。
注意:避免引入气泡进入而载入列。 - 用1毫升BSS / FBS冲洗柱子一次,并通过包含纯化的靶细胞采集流程。通过再次刷新同流列。通过在相同的15ml试管第二装载后收集的流动。
- 用1ml BSS / FBS洗涤柱3次,并通过含有纯化靶细胞收集的流动。此后,加5毫升BSS / FBS为thÈ柱,有柱塞,冲洗磁性标记的细胞出列到一个新的15ml试管中。
- 检查由流收集仪使用结合到表面纯化的B细胞或T细胞4,5抗原的抗体的细胞的纯度。
- 细胞的微珠标记中制备的未使用分离柱(步骤3.1.1。或3.2.2。)。预暖的BSS(无FBS)至RT,并用2毫升给洗并无菌平衡色谱柱。用BSS平衡后,将洗涤塔不应该被允许干燥。
- 重新使用分离柱
注:LS柱可以在不影响净化效率被重用高达4倍。- 用5ml磷酸盐缓冲盐水(PBS)中,用从使用柱塞顶端蒸馏水洗5×3次洗涤柱3次。
- 洗用5毫升70%的乙醇柱和广泛使用空气抽头防止生锈的该列中的积聚干燥塔。
- 以制备用于单独的纯化实验中使用的LS柱,从下向上洗柱,使用注射器接合件5 1ml 70%乙醇。接着,用5毫升无菌PBS,从塔的顶部,随后用5毫升的PBS洗一次从底部向上的柱两次。添加2RT毫升BSS平衡柱,然后进行与标记细胞装入列。
4. CFSE标记和刺激
注:纯化的细胞可以经受多种在体外和体内功能性测定法。在这里,我们使用纯净的T细胞,以确定装甲运兵车5的T细胞的刺激能力。
- 预暖标签解决方案(PBS中0.1%FBS)至37°CFSEÇ之前加载。
注意:使用的FBS的PBS中的低百分比的CFSE装载期间减少细胞死亡和在离心分离期间最大限度地减少细胞的损失。然而,过多的FBS可以用CFSE载荷干扰。 - 用标记溶液洗涤纯化的细胞两次,然后在15毫升管预热的标记溶液再悬浮为2×10 7个细胞/ ml。
- 制备10μM的CFSE溶液(1:500稀释的5mM CFSE原液)的预热的标记溶液。 CFSE解决方案应每次实现最佳标记新鲜配制。
- 加载细胞用CFSE,在37℃下添加1份细胞悬液至1份10微米的CFSE溶液在一个15毫升管中并孵育在黑暗中10分钟。为5μMCFSE的最终浓度用于标记1×10 7个细胞/ ml。
- 倒置该管每隔2分钟,以确保CFSE装载期间细胞的均匀的混合物。
- 停止反应,加入冰冷的完全RPMI介质的多个卷,且在4℃降速在453 XG 5分钟。在成功CFSE加载,将细胞沉淀将出现淡黄色。
- 洗涤CFSE装载的细胞再一次用冰冷的完全RPMI培养基中,并使用用于体外培养或体内刺激前在4℃降速在453×g离心5分钟。
5. 体外刺激
- 临用前准备刺激的2倍原液(2X刺激原液),使100微升2×刺激原液可以加入到100μl的细胞对每孔200微升的在一个96孔板的最终体积。
- 如果需要涂覆有刺激(IgM抗体或CD40对B细胞或CD3和CD28对于T细胞)的板,稀释在PBS中的刺激和预涂层的培养板在4℃下过夜。可替代地,将培养板可在37℃被涂布于在实验当天1小时。用PBS(不要让盘在任何时间干)洗涂板的两倍。
| 对于B细胞 | |
| 刺激 | 最终浓度 |
| 的F(ab')2山羊抗小鼠IgM | 0.6-2.4微克/毫升 |
| 抗小鼠CD40单克隆抗体 | 0.5-2微克/毫升 |
| 重组小鼠IL-4 | 25单位/毫升 |
| 脂多糖 | 0.1-10微克/毫升 |
| (LPS)的来自大肠杆菌大肠杆菌血清型055:B5 | |
| 对于T细胞 | |
| 刺激 | 最终浓度 |
| 抗CD3(板涂层) | 2-10微克/毫升 |
| (50μl/孔涂覆) | |
| 抗CD28(板涂层) | 2微克/毫升 |
| 重组IL-2 | 40单位/毫升 |
| PDBu组(佛波酯) | 5-50纳克/毫升 |
| A23187(钙离子载体) | 250纳克/毫升 |
表1:用于刺激在体外培养的淋巴细胞的刺激的浓度。
- 对于CFSE标记的B细胞,重新悬浮在一式三份的完全RPMI培养基和培养至3×10 6个细胞/ ml用3×10 5细胞中/孔72小时的96孔平底板。
- 对于CFSE标记的T细胞,再悬浮于完全RPMI培养基和培养,一式三份用0.5-3×10 5个细胞0.5-3×10 6个细胞/ ml /孔在96孔48或72小时圆底平板。
6. 在体刺激
- 用于体内刺激,过继转移4×10 6每只小鼠CFSE标记的T细胞(静脉内(IV)在200μlPBS中)到每个MHC匹配的受体小鼠。
注:在这个协议中,CFSE标记的T细胞可以使用继尾静脉或眼眶注射,因为这些细胞将家里淋巴器官如脾和淋巴结转移。 - 挑战受体小鼠一天后的抗原。
注意:在这个例子中,使用卵白蛋白(OVA蛋白,50微克/小鼠)作为抗原,因为OVA特异性T细胞受体(TCR)-transgenic T细胞过继转移到受者小鼠。准备OVA蛋白无菌PBS并注入100微升OVA蛋白/ PBS或PBS控制,通过皮下注射(SI),为每个收件人鼠标5。 - 收获并用OVA蛋白或PBS免疫接种后3天生成从淋巴器官受体小鼠的单细胞悬浮液(淋巴结和脾)。单独的淋巴结到近端淋巴结(PLN),其中包括腋窝,臂和颈浅淋巴结)和远端淋巴结(DLN),它包括肠系膜,腘,腹股沟,腰椎,和尾部淋巴结。使用适当的FACS抗体染色的细胞以检查T细胞增殖。
注:在此CFSE细胞跟踪实验,CFSE标记的T细胞PBS注射的对照小鼠建立一个基线荧光非二viding细胞。增殖的细胞分裂,抗原刺激,CFSE标记的细胞通过测量荧光峰12,13可视化。与PBS对照,增殖的细胞分裂的次数,CFSE标记的T细胞可以被确定12,13。 - 通过比较细胞分裂或峰的样本之间的数字分析CFSE标记的细胞增殖数据( 图1和2)。
注意:例如,CFSE标记,继转移到接收到的OVA抗原受体小鼠OVA特异性T细胞将较之PBS注射的对照小鼠5,12经历活跃增殖。此外,值得注意的是要指出,有很多方法来分析CFSE细胞增殖数据,由Hawkins和同事14所证明。
结果
淋巴细胞的磁性细胞纯化允许用户在一段相对短的量纯化的靶细胞群。使用我们的耗尽协议中,我们能够从72.8%(前纯化)增加的CD8 T细胞的百分比(OT-I在重组活化基因-1(RAG-1)缺陷小鼠)到94.2%(纯化后; 图1A)4,5。然后将这些纯化的淋巴细胞可用于下游功能测定来确定的淋巴细胞增殖和信号转导4,5。例如,我们可以研究的装甲运兵车体内 T细胞的刺激能力 通过CFSE标记,抗原特异性T细胞转移入野生型(WT)和与合适的抗原5免疫的突变体(MT)的小鼠。
在我们的代表实验中,我们转移纯化,CFSE标记,卵清蛋白(OVA)特异性OT-I CD8 T C厄尔分为对照(WT)和突变型(MT)小鼠和OVA蛋白的一天后免疫这些老鼠。免疫后3天里,我们收获淋巴结(近端和远端)和脾和术分析由流T细胞。 CD45等位基因形式可被用于更好的分割,CFSE标记,供体的OT-I CD8细胞从非标记,受体CD8 T细胞中分离出来。在这个例子中,供体和受体细胞来自CD45.1和CD45.2小鼠,分别为( 图1B)。尚存的CFSE水平,未刺激OT-I的T细胞在这个时间点被用于定义非增殖细胞( 图1C,虚线)的峰。在刺激时,在OT-I的T细胞的CFSE水平的强度将降低一半,每个分部。 T细胞的增殖可以由此通过计数数目的CFSE峰6,12来确定。在我们的代表性的结果,我们没有看到WT和MT装甲运兵车的交叉呈递能力(差异图1C中,实线),由于T细胞增殖在两小鼠率相似。
在一个单独的实验中,我们进行了[3 H] -胸苷掺入法学习激活控制和MT T细胞的细胞增殖。纯化的WT和MT T细胞与各种刺激刺激48小时,并用[3 H] -胸苷的最终8小时脉冲。在细胞周期的S期增殖细胞将结合的放射性标记的核苷酸,[3 H] -胸苷,到新合成脱氧核糖核酸(DNA),因此,使用液体闪烁计数,细胞增殖可通过测量[3 H]胸苷摄取。每分钟计数(CPM)的数量与[3 H] -胸苷摄取在增殖T细胞的量直接相关。在我们的代表性的结果,相对于C刺激后,从MT T细胞获得CPM的数量减少来自WT T细胞ounts表示MT的T细胞( 图1D)的损害的增殖能力。
以确定B细胞的增殖能力,我们纯化使用所述消耗策略脾B细胞。经纯化,我们能够从63.9%(精制前)增加B220 B细胞(WT小鼠)的百分比为98.4%(纯化后; 图2A)4。类似于纯化的T细胞,纯化的脾B细胞也可用于下游功能测定来评估淋巴细胞增殖和信号转导4。随后,我们标记纯化的WT脾B细胞用CFSE并用涂有补充有细胞因子IL-4的抗CD40板刺激这些细胞在体外 。刺激后三天,我们分析通过流式细胞术上可行,活化的B细胞。尚存的CFSE水平,未刺激的B细胞在这个时间点被用来定义非增殖细胞( 图2B,虚线)的峰值。类似的T细胞,B细胞的CFSE水平的强度将降低一半,每个分部6,12。
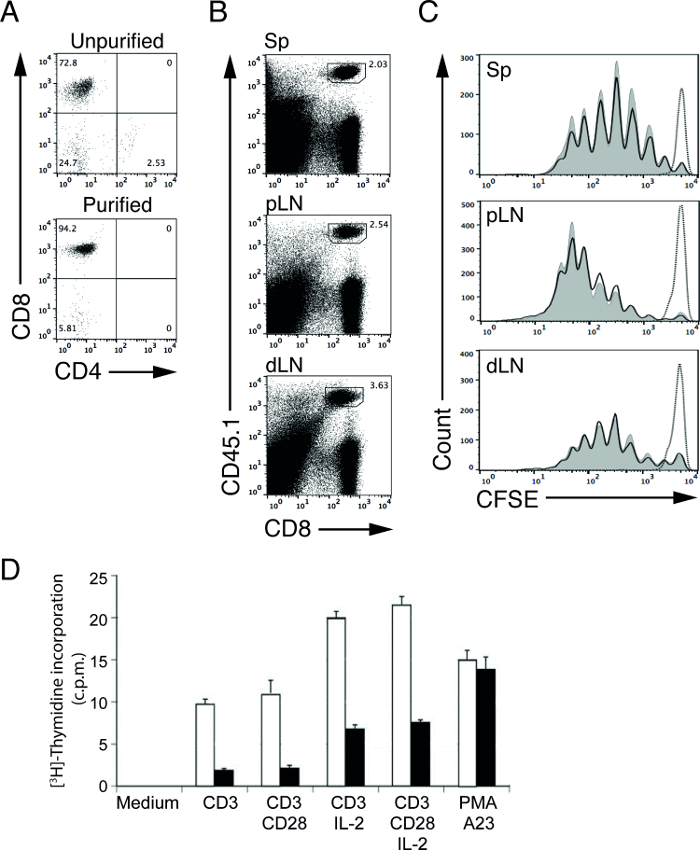
图1: 免疫后继转移纯化的OT-I的T细胞的CFSE型材从OT-I分离的细胞(A)的CD4和CD8染色。 RAG-1缺陷小鼠之前(上图)和后(下图)的非T细胞耗竭。 (B)从脾脏(SP)T细胞的代表性FACS图,近端淋巴结(PLN)和远端淋巴结(DLN)。捐助OT-I CD8 T细胞CD45.1阳性。从脾转移,CFSE标记的OT-I供体的T细胞(C)的代表性的CFSE型材(SP),近端淋巴结(PLN)和远端淋巴结WT的(DLN)(阴影曲线)和MT(实线)的受体小鼠以OVA蛋白和LPS免疫后3天。虚线表示,从WT受体小鼠OT-I T细胞免疫无(注射PBS)。激活控制或MT T细胞通过[3 H] -胸苷摄取测定法测量(D)的细胞增殖。结果以每分钟的计数(CPM)提出。纯化的对照(空心条)或MT(闭合巴)T细胞孵育在仅培养基(培养基)48小时或在板结合的抗CD3或抗CD3加抗CD28的存在下有或没有重组IL- 2。多克隆活化细胞被PMA(佛波酯)和A23(钙离子载体)触发。 请点击此处查看该图的放大版本。

图2:CFSE轮廓B细胞在体外 刺激。(A)的B220和(上面板)之前和之后(下图)非B细胞耗竭来自WT小鼠分离的脾细胞的CD3染色。 (B)后体外刺激的3天用抗CD40和IL-4板CFSE标记的WT(阴影曲线)脾B细胞的代表性CFSE轮廓。虚线表示CFSE标记的WT B细胞无刺激。 请点击此处查看该图的放大版本。
讨论
在这个协议中,我们展示了从淋巴器官淋巴细胞净化的过程。使用磁珠分选的细胞纯化是产生可行的,高度纯化的靶细胞快速和简单的方法。
该议定书中的关键步骤
细胞活力和细胞产量
体外造血保持系细胞的活力,是确保成功的和可重复的实验,是至关重要的。化学和生物试剂,次优实验条件或切除器官的不适当的储存条件都可以影响细胞活力。在从小鼠切除,淋巴器官需要储存在冰上,并尽快制备可能的单细胞悬浮液。也应避免细胞悬液的高速离心。此外,细胞沉淀应该由除去上清液后的手指弹管松开。不是这样建议重新暂停与大量介质,通过移液直接粒料。
大约有来自所有主要淋巴结2-4×10 7脾B细胞和2×10 7的T细胞可以从一个8-10周龄WT鼠标隔离。纯化的B细胞和T细胞(下面的预期值)的数量减少表示亚最佳条件下,如前面提到的。
细胞纯度
使用该协议分离的细胞的平均纯度为90%至95%,这是在体外或体内实验( 图1A)随后足够纯的范围内。这是最好不要分离,因为这样做可能会损害细胞纯度的过程中,用超载的细胞数目过多分离柱,由于列的有限结合能力。
FBS质量
该FBS的质量用于补充培养基为淋巴细胞的体外存活是至关重要的。 FBS的不同来源和批处理可以在其在体外淋巴细胞反应,以支持能力而变化。因此,为了测试不同类型的FBS找到一个给出具有低背景高特异性反应是很重要的。然后瓶的大量应保留作为储备。
修改和故障排除
CFSE标记条件
即使CFSE标记以纯RPMI工作的,我们已经发现,使用的FBS的PBS中的低百分比,在加载过程减少了细胞死亡,而不会影响标记的效率。此外,FBS的存在下离心期间最大限度地减少细胞的损失。
CFSE标记的一个重要方面是要确保为了形象化明显的峰,即使细胞的标记S中的代表细胞分裂。 CFSE超载可能导致在体外或体内标记细胞的恢复差增加的细胞死亡。另一方面,标签的过程中CFSE标记或异质性的靶细胞悬浮液不足可导致分辨不良CFSE峰12。因此,为了优化CFSE标记的条件是很重要的。 CFSE的用于标记的量应保持尽可能低,以降低过载潜在的毒性作用,但仍实现充分的标记的实验时间范围内刺激后检测很好分辨的峰。此外,为避免解决较差的峰,细胞团块应从之前CFSE装载单细胞悬浮液中除去。
细胞团块和细胞损失
关键的是要确保在继续,因为永久remova下一步骤之前使细胞完全重悬在实验过程中的细胞团块l的大大减少的细胞数。细胞团块通常具有降低细胞活力或细胞沉淀重新悬浮不足有关。
CFSE和发射光谱重叠
CFSE标记的细胞可进一步被一个一天中培养后的荧光团标记的抗体所定义,但是,这些CFSE标记的细胞仍然是一个天培养后明亮的荧光。使用缀合到明亮的荧光团具有最小量的发射光谱重叠的用CFSE,如藻红蛋白(PE)和藻红蛋白菁7(PeCy7)的抗体的组合,提供了最佳的染色结果。然而,补偿减少的发射光谱重叠仍然需要。此外,这是因为泄漏到FL-2声道信号CFSE(FL-1通道)的高强度,在FL-2通道已被扣除FL-2值的高比例,以达到选择进行补偿进制CFSE轮廓。可以参考由Quah 等人的 ,它提供了用于故障诊断CFSE标记和结果12的分析解决方案发表的论文。
替代CFSE
CFSE的发射光谱限制使用具有荧光素衍生物的CFSE的组合,如绿色荧光蛋白(GFP)和异硫氰酸荧光素(FITC)共轭的抗体。有,但是,在紫同样高的荧光强度和低毒性细胞(CTV,激发/发射:四百五十零分之四百零五纳米)其它市售细胞染料,黄色(CTY,580分之555纳米),远红(CTFR,630 / 661纳米或CPD670,670分之647纳米)和红色(PKH26,五百六十七分之五百五十一纳米)。使用细胞标记的染料具有不同的发射光谱提供实验设计的灵活性。另一方面,并非所有上述细胞标记染料可以产生不同的细胞分裂的峰。通过比较研究完成各种细胞标记染料的结论是,CTV为CFSE一个更好的替换,因为视使更多数量的明确定义的细胞分裂的峰13的检测。
限制
磁性细胞分选的主要限制是它仅适用于简单细胞分选。在我们的例子中,我们可以使用CD43耗尽脾所有非B细胞;然而,我们将不能够滤泡的B细胞从边缘区B细胞中分离出来。这些亚群只能与多个表面标记限定。虽然可以使用磁性细胞的细胞分选基于多个表面标记积极选择,它是依赖于专门准备,市售试剂,使微珠从靶细胞首轮在进行到第二标记前排序后的释放。因此,用户将完全依赖于市售的试剂盒。在这样的情况下,流式细胞仪我■在分离精制的细胞群体更为有利。
技术意义
基于抗体的细胞分选方法,例如磁性细胞分选和FACS,是最可靠的细胞分选技术迄今15。细胞分离的其它方法存在,包括密度为基础的和粘附的基础的技术,但是,淋巴细胞是贴壁不良细胞及其亚群是在密度比较类似,因此adherence-和技术要么不适用基于密度的或非常低效15 。
由于在引进,快速,简便,高细胞活力提及,并且独立于任何精良的设备具有磁性细胞分选FACS以上的获奖功能。特别是,负耗尽用磁性细胞分选标签和耗尽使用磁性分离柱不良细胞,同时隔离以最小的改性中的靶细胞ns到细胞表面和保持幼稚状态。
未来应用
使用这种基于磁的纯化技术纯化高度富集,可行,和幼稚淋巴细胞可经受的淋巴细胞的行为的各种功能测定法和在体外和体内信令机制。在这个协议中,我们证明了使用两种不同的细胞增殖测定- [3 H] -胸苷掺入法和CFSE细胞增殖试验-研究活化的淋巴细胞的细胞增殖的能力。
之间的选择的[3 H] -胸苷掺入法和CFSE细胞增殖测定在很大程度上取决于样品尺寸和实验条件。利用[3 H] -胸苷掺入实验检测与大样本产生高通量细胞增殖数据。为了确保最佳的[ 3 H] -胸苷摄取和结果的可重复性,[3 H] -胸苷应添加到培养时大部分细胞正在积极分裂。标记协议的优化需要不同的细胞类型和刺激。此外,由于[3 H] -胸苷,这种掺入法只能在体外进行,不同于细胞CFSE标记,其可以在体外 ( 图2B)被激活或继转移到受体小鼠( 图1B的放射性性质和1C)。
的CFSE细胞增殖测定,在另一方面,提供比的[3 H] -胸苷掺入细胞增殖的更多信息。自的CFSE的CFSE标记的细胞的强度一半与每个细胞分裂降低,可以确定细胞分裂的数目和细胞的各分割通过计数峰的数目和大小的比例 12,13。此外,CFSE标记的细胞可进一步根据通过流式细胞术使用相应的荧光团共轭抗体在它们的表面分子表达为不同的子集。最重要的是,不同于在最后时间点测定细胞增殖的[3 H] -胸苷掺入测定中,CFSE细胞增殖试验允许细胞分裂的跟踪,提供有关的细胞增殖能力的动力学详细信息。然而,CFSE细胞增殖试验可能不适合用于大量样品的大小的实验。
披露声明
The authors have nothing to disclose.
致谢
这项研究是由教育部,新加坡教育部(ACRF Tier1-RG40 / 13层2-MOE2013-T2-2-038)的支持。这份手稿是由来自Obrizus通信艾米沙利文编辑。
材料
| Name | Company | Catalog Number | Comments |
| Materials | |||
| RPMI 1640 (without L-Glutamine) | Gibco | 31870025 | |
| Fetal Bovine Serum | Heat inactivated | ||
| L-glutamine | Gibco | 25030024 | |
| Penicillin/Streptomycin | Gibco | 15140114 | |
| 2-mercaptoethanol | Gibco | 21985023 | |
| Anti-CD43 magnetic microbeads | Miltenyi Biotec | 130-049-801 | Mix well prior use |
| Streptavidin microbeads | Miltenyi Biotec | 130-048-101 | Mix well prior use |
| Anti-Annexin V magnetic beads | Miltenyi Biotec | 130-090-201 | Mix well prior use |
| MACS LD | Miltenyi Biotec | 130-042-901 | |
| 96-well U-bottom sterile culture plate | Greiner Bio-one | 650180 | |
| 96-well F-bottom sterile culture plate | Greiner Bio-one | 655180 | |
| 100 μm cell strainer mesh | To sterilize using UV radiation prior use | ||
| 0.2 μm sterile disposable filter units | Nalgene | 567-0020 | Can be substituted with any sterile filter device |
| CellTrace Violet | Invitrogen | C34557 | CTV for short; alternative to CFSE |
| CellTrace Yellow | Invitrogen | C34567 | CTY for short; alternative to CFSE |
| CellTrace Far Red | Invitrogen | C34564 | CTFR for short; alternative to CFSE |
| Cell Proliferation Dye eFluor 670 | eBioscience | 65-0840 | CPD670 for short; alternative to CFSE |
| PKH26 | Sigma Aldrich | PKH26GL | PKH26, alternative to CFSE |
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Dextrose | Sigma Aldrich | G7021 | |
| Potassium phosphate monobasic | Sigma Aldrich | P5655 | |
| Sodium phosphate dibasic | Sigma Aldrich | S5136 | |
| Phenol Red | Sigma Aldrich | P0290 | |
| Calcium chloride dihydrate | Sigma Aldrich | C7902 | |
| Potassium chloride | Sigma Aldrich | P5405 | |
| Sodium chloride | Merck Millipore | S7653 | Can use from other sources |
| Magnesium chloride hexahydrate | Sigma Aldrich | M2393 | |
| Magnesium sulfate | Sigma Aldrich | M2643 | |
| Ammonium chloride | Sigma Aldrich | A9434 | |
| Tris-base | |||
| Dimethyl Sulfoxide | Sigma Aldrich | D8418 | |
| (5-(and 6-) carboxyfluorescein diacetate succinimidyl ester (CFSE) | Molecular Probes | C-1157 | Reconstitute in DMSO |
| Phorbol 12,13-dibutyrate (PBDU, Phorbol ester) | Sigma Aldrich | P1269 | |
| A23187 (Calcium ionophore) | Sigma Aldrich | C7522 | |
| Name | Company | Catalog Number | Comments |
| Antibodies and recombinant protein | |||
| CD11b biotin (clone m1/70) | Biolegend | 101204 | T cell depletion cocktail |
| CD11c biotin (clone N418) | Biolegend | 117304 | T cell depletion cocktail |
| Gr-1 biotin (clone RB6-8C5) | Biolegend | 108404 | T cell depletion cocktail |
| Ter119 biotin (clone Ter119) | Biolegend | 116204 | T cell depletion cocktail |
| TCR-γδ biotin (clone GL-3) | Biolegend | 118103 | T cell depletion cocktail |
| CD19 biotin (clone 6D5) | Biolegend | 115504 | T cell depletion cocktail |
| B220 biotin (clone RA3-6B2) | Biolegend | 103204 | T cell depletion cocktail |
| CD49b biotin (clone DX5) | Biolegend | 108904 | T cell depletion cocktail |
| CD4 biotin (clone GK1.5) | Biolegend | 100404 | T cell depletion cocktail |
| CD8 biotin (clone 53-6.7) | Biolegend | 100704 | T cell depletion cocktail |
| F(ab’)2 goat anti-mouse IgM (plate coated) | Jackson ImmunoResearch | 115-006-075 | 50 µl/well for coating (96-well) |
| Anti-mouse CD40 mAb (plate coated) | Pharmingen | 553722 | 50 µl/well for coating (96-well) |
| Recombinant IL-4 | ProSpec | Cyt-282 | |
| LPS from E. coli Serotype 055:B5 | Sigma Aldrich | L-4005 | |
| Anti-CD3 (clone clone OKT3) (plate coated) | eBioscience | 16-0037-85 | 50 µl/well for coating (96-well) |
| Anti-CD28 (clone clone 37.51) (plate coated) | eBioscience | 16-0281-85 | 50 µl/well for coating (96-well) |
| Recombinant IL-2 | ProSpec | Cyt-370 | |
| Albumin from chicken egg white, Ovalbumin | Sigma Aldrich | A7641 |
参考文献
- Nikolich-Žugich, J., Slifka, M. K., Messaoudi, I. The many important facets of T-cell repertoire diversity. Nat. Rev. Immunol. 4 (2), 123-132 (2004).
- LeBien, T. W., Tedder, T. F. B lymphocytes: how they develop and function. Blood. 112 (5), 1570-1580 (2008).
- Brownlie, R., Zamoyska, R. T cell receptor signaling networks: branched, diversified and bound. Nat. Rev. Immunol. 13 (4), 257-269 (2013).
- Neo, W. H., Lim, J. F., Grumont, R., Gerondakis, S., Su, I. C-rel regulates ezh2 expression in activated lymphocytes and malignant lymphoid cells. J. Biol. Chem. 289 (46), 31693-31707 (2014).
- Gunawan, M., et al. The methyltransferase Ezh2 controls cell adhesion and migration through direct methylation of the extranuclear regulatory protein talin. Nat Immunol. 16 (5), 505-516 (2015).
- Lyons, A. B., Parish, C. R. Determination of lymphocyte division by flow cytometry. J. Immunol. Methods. 171 (1), 131-137 (1994).
- Cabatingan, M. S., Schmidt, M. R., Sen, R., Woodland, R. T. Naïve B lymphocytes undergo homeostatic proliferation in response to B cell deficit. J. Immunol. 169 (12), 6795-6805 (2002).
- Bedoya, S. K., Wilson, T. D., Collins, E. L., Lau, K., Larkin, J. Isolation and Th17 differentiation of naïve CD4 lymphocytes. J. Vis. Exp. (79), e50765 (2013).
- Su, I., et al. Ezh2 controls B cell development through histone h3 methylation and Igh rearrangement. Nat. Immunol. 4 (2), 124-131 (2003).
- Mecklenbräuker, I., Saijo, K., Zheng, N., Leitges, M., Tarakhovsky, A. Protein kinase Cδ controls self-antigen-induced B-cell tolerance. Nature. 416 (6883), 860-865 (2002).
- Rush, J. S., Hodgkin, P. D. B cells activated via CD40 and IL-4 undergo a division burst but require continued stimulation to maintain division, survival and differentiation. Eur. J. Immunol. 31 (4), 1150-1159 (2001).
- Quah, B. J. C., Warren, H. S., Parish, C. R. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester. Nat. Protoc. 2 (9), 2049-2056 (2007).
- Quah, B. J. C., Parish, C. R. New and improved methods for measuring lymphocyte proliferation in vitro and in vivo using CFSE-like fluorescent dyes. J. Immunol. Methods. 379 (1-2), 1-14 (2012).
- Hawkins, E. D., Hommel, M., Turner, M. L., Battye, F. L., Markham, J. F., Hodgkin, P. D. Measuring lymphocyte proliferation, survival and differentiation using CFSE time-series data. Nat. Protoc. 2 (9), 2057-2067 (2007).
- Tomlinson, M. J., Tomlinson, S., Yang, X. B., Kirkham, J. Cell separation: Terminology and practical considerations. J. Tissue Eng. 4 (1), 1-14 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。