Method Article
Выделение и активация мышиных лимфоцитах
В этой статье
Резюме
Lymphocytes are the major players in adaptive immune responses. Here, we present a lymphocyte purification protocol to determine the physiological functions of the desired molecules in lymphocyte activation in vitro and in vivo. The described experimental procedures are suitable for comparing functional capacities between control and genetically modified lymphocytes.
Аннотация
B and T cells, with their extremely diverse antigen-receptor repertoires, have the ability to mount specific immune responses against almost any invading pathogen1,2. Understandably, such intricate abilities are controlled by a large number of molecules involved in various cellular processes to ensure timely and spatially regulated immune responses3. Here, we describe experimental procedures that allow rapid isolation of highly purified murine lymphocytes using magnetic cell sorting technology. The resulting purified lymphocytes can then be subjected to various in vitro or in vivo functional assays, such as the determination of lymphocyte signaling capacity upon stimulation by immunoblotting4 and the investigation of proliferative abilities by 3H-thymidine incorporation or carboxyfluorescein diacetate succinimidyl ester (CFSE) labeling5-7. In addition to comparing the functional capacities of control and genetically modified lymphocytes, we can also determine the T cell stimulatory capacity of antigen-presenting cells (APCs) in vivo, as shown in our representative results using transplanted CFSE-labeled OT-I T cells.
Введение
Mature lymphocytes generally exist in the resting state if there is no pre-existing infection or inflammation in the individual. Therefore, it is important to retain the naïve status of lymphocytes during the isolation process before performing in vitro or in vivo functional assays. The key to ensuring consistent and reproducible results is to limit any unnecessary manipulation of the cells.
Magnetic cell sorting utilizes antibodies and microbeads to label cells so as to enrich the cell population of interest. With this approach, there are two purification strategies: positive enrichment and negative depletion. Positive enrichment enriches the cell population of interest using an antibody that binds to the target cells. Negative depletion, on the other hand, depletes non-target cells, leaving the cell population of interest. In our lab, we prefer negative depletion to positive enrichment because the binding of antibodies to the target cells could potentially alter cell features and behavior. In fact, many established cell surface markers suitable for the isolation of a particular cell population are also functional receptors.
Magnetic cell sorting not only yields highly pure populations of viable target cells, it is also less time-consuming and avoids the cellular stress induced by high-pressure flow used in fluorescence-activated cell sorting (FACS). By labeling the unwanted cell populations and depleting them using a magnetic separation column, we are able to perform rapid cell isolation without compromising the viability of the target cell population. In this protocol, we demonstrate the use of negative depletion strategies to purify naïve B cells or T cells.
протокол
У всех мышей разводят и поддерживается при определенных патогена условиях и все протоколы мыши проводятся в соответствии с руководящими указаниями по уходу и использованию комитета Institutional животных.
1. Приготовление буферами и реагентов
- Готовят институт Мемориальный полный Roswell Park (RPMI) среды (10% инактивированной нагреванием фетальной бычьей сыворотки (FBS), 2 мМ L-глутамина, пенициллина (100 МЕ / мл) / стрептомицин (100 мкг / мл), 55 мкМ 2-меркаптоэтанола ).
- Подготовить 20x сбалансированный солевой раствор (BSS) Фото 1 и 2 Наличие на складе, отдельно.
- Подготовка 20x ПБС запас 1 (111 мМ декстроза, 8,8 мМ фосфата калия, 26,7 мМ двухосновного фосфата натрия в 1 л стерильной воды) и добавляют 40 мл 0,5% фенолового красного до 20x ПБС складе 1 до окончательной регулировки громкости. Стерильный фильтр с использованием фильтра 0,2 мкм перед хранением при 4 ° С.
- Подготовка 20x ПБС запас 2 (25,8 мМ дигидрат хлорида кальция, 107 мМ хлорид калия, ч 2,73 М натрияloride, 19,6 мМ хлорид магния гексагидрат, 16,6 мМ сульфата магния в 1 л стерильной воды). Стерильный фильтр с использованием фильтра 0,2 мкм перед хранением при 4 ° С.
- Для подготовки 1x BSS для экспериментального использования, развести 50 мл ПБС запас 1 и 50 мл ПБС запас 2, отдельно, в 400 мл стерильной воды каждый. Объединить оба разбавленные растворы, доведения рН до 7, и добавляют 20 мл FBS (2%). Долить до 1 л, используя стерильную воду и стерильный фильтр с использованием фильтра 0,2 мкм.
Примечание: BSS исходные растворы должны быть приготовлены отдельно, поскольку смешивание концентрированных запасов РвСС непосредственно может привести к осаждению.
- ЭРИТРОЦИТОВ (РБК) лизирующего буфера
- Для подготовки RBC буфер для лизиса, смешайте 9 частей хлорида аммония (сток 155 мм хлорида аммония в стерильной воде) на 1 часть акций Трис-основание (130 мМ трис (гидроксиметил) в стерильной воде, рН 7,65) перед использованием.
Примечание: Храните стерильные исходные растворы хлорида аммония и Трис-основания при 4 ° С. Подготовить лизис бuffer свежей для обеспечения эффективного лизис эритроцитах.
- Для подготовки RBC буфер для лизиса, смешайте 9 частей хлорида аммония (сток 155 мм хлорида аммония в стерильной воде) на 1 часть акций Трис-основание (130 мМ трис (гидроксиметил) в стерильной воде, рН 7,65) перед использованием.
2. Формирование суспензии лимфоцитов из селезенки или лимфатических узлов
Примечание: Важно, чтобы подготовить все реагенты и оборудование, необходимые для проведения эксперимента до эвтаназии мыши и генерировать одиночные клеточные суспензии лимфоцитов как можно скорее для поддержания высоких viabilities клеток.
- Эвтаназии экспериментальная мышь путем смещения шейных позвонков или CO 2 удушья.
Примечание: Начиная с этого этапа и далее, все экспериментальные процедуры должны выполняться в асептических. - Dip всю мышь в 70% этанола, прежде чем принимать какие-либо надрезы. Удалите селезенки и лимфатических узлов асептических 8, и поместить их в отдельные 15 мл пробирки , содержащие 5 мл ледяной RPMI / FBS (RPMI с 2% FBS) или BSS / FBS (со стадии 1.2.3).
Примечание: Так как ПБС не позволяет создать эффективную RBC лизис, используют RPMI для приготовления селезеночной клеточной суспензии и переключения на ПБС Afteг РБК лизиса. - Для создания суспензии отдельных клеток из селезенки или лимфатических узлов, поместите орган (ы) между двумя кусками стерильной фильтрующей сетки 100 мкм клеток в чашке Петри, содержащую 2 мл ледяной RPMI / FBS или BSS / FBS. Используя поршень шприца емкостью 1 мл, разомните орган (ы), пока она не была разорвана на очень мелкие части.
- Передачи клеточной суспензии в 15 мл пробирку и промыть сетчатый фильтр сетка ячейка с охлажденным льдом RPMI / FBS или ПБС / FBS. Собрать оставшуюся клеточную суспензию, добавить его в том же 15-мл пробирку, и спином вниз на 453 мкг в течение 5 мин при 4 ° С. Удалить супернатант.
Примечание: Повторное приостановить осажденные клетки слегка ударяя по пробирке с пальцами перед добавлением буфера для лизиса эритроцитов или среду на последующих стадиях. - Готовят при комнатной температуре (RT) RBC буфер для лизиса во время центрифугирования суспензии клеток (этап 1.3.). После того, как гранулирование клетки и удаления надосадочной жидкости, повторно приостанавливать клетки с 1 мл буфера для лизиса эритроцитов за каждые 10 8 клеток. INCUBATE реакция лизиса при комнатной температуре в течение 3-4 мин.
- Прекратить RBC лизис с 14 мл охлажденного льдом BSS / FBS и спином вниз на 453 мкг в течение 5 мин при 4 ° С.
3. Очистка В- и Т-клеток
- Очистка В-клеток
- Граф клеток с использованием гемоцитометра. Повторное приостановить до 10 8 клеток селезенки в 300 мкл BSS / FBS и добавить 50 мкл анти-CD43 магнитные микрогранулы 9,10. Для того, чтобы удалить мертвые клетки, добавьте 30 мкл аннексина V магнитных шариков. Инкубируйте клеточной суспензии в холодильнике C 4 ° С в течение 30 мин.
- После очистки Т-клеток
- Граф клеток с использованием гемоцитометра. Повторное приостановить до 10 8 клеток в не-T коктейль истощение клеток антител (биотинилированных антител против CD19, B220, Gr-1, ТКС-γδ, CD49b, CD11c, CD11b, Ter119 и CD4 или CD8 в зависимости от популяции клеток - мишеней к очищаться), разведенной 1: 200 в 200 мкл ПБС / FBS 4,5. Выдержите суспензии клеток у4 ° С холодильником в течение 15 мин.
- После инкубации добавляют 10 мл раствора ПБС / FBS, чтобы промыть клетки и спином вниз на 453 х г в течение 5 мин при температуре 4 ° С. Удалить супернатант и вновь приостановить клетки в 165 мкл ПБС / FBS с 30 мкл стрептавидин микрошариков и 15 мкл аннексина V магнитных шариков. Инкубируйте клеточной суспензии в холодильнике C 4 ° С в течение 30 мин.
Примечание: Для того, чтобы обеспечить даже маркировка с магнитными микрогранул, инкубировать клетки с микрогранул в течение 15 мин, затем смешать клеточную суспензию осторожно коснувшись 15 мл трубки и инкубировать еще 15 минут в течение стадии 3.1.1. или 3.2.2.
- Получение разделения колонок для очистки клеток
- Подготовьте неиспользуемый разделительную колонну во время микрогранулами мечения клеток (шаг 3.1.1. Или 3.2.2.). Предварительно теплая ПБС (без FBS) до комнатной температуры и используют 2 мл, чтобы вымыть и уравновешивают колонку асептически. После уравновешивания с ПБС, промытый столбец не следует допускать, чтобы высохнуть.
Примечание: Мы используем LS Column вместо рекомендованного столбца LD из-за его повторного использования (см шаг 3.4.). - После того, как маркировка с использованием магнитных шариков, добавьте 14 мл ПБС / FBS, чтобы промыть клетки и спином вниз на 453 х г в течение 5 мин при температуре 4 ° С. Удалить супернатант и повторно приостанавливать клетки в 1-3 мл RT ПБС.
- Приложить стерильный 21 G иглу на кончик колонны, чтобы уменьшить скорость потока в процессе очистки. Нагрузка клеточной суспензии на уравновешенную колонку и собирают поток через содержащие очищенные клетки-мишени.
ПРИМЕЧАНИЕ: Избегайте введения пузырьков в колонке во время загрузки. - Промывают колонку один раз с 1 мл ПБС / FBS и собрать поток через содержащие очищенные клетки-мишени. Обновить колонку с потоком через еще раз. Собирают поток через после второй загрузки в той же 15 мл трубки.
- Промыть колонку 3 раза с 1 мл BSS / FBS и собрать поток через содержащий очищенные клетки-мишени. Затем добавляют 5 мл BSS / FBS к йе столбец и, с помощью ударника, промойте магнитно меченых клеток из колонны в новый 15 мл пробирку.
- Проверьте чистоту клеток , собранных с помощью проточной цитометрии с использованием антител , которые связываются с поверхностным антигенам очищенного В или Т - клеток 4,5.
- Подготовьте неиспользуемый разделительную колонну во время микрогранулами мечения клеток (шаг 3.1.1. Или 3.2.2.). Предварительно теплая ПБС (без FBS) до комнатной температуры и используют 2 мл, чтобы вымыть и уравновешивают колонку асептически. После уравновешивания с ПБС, промытый столбец не следует допускать, чтобы высохнуть.
- Повторное использование разделения колонок
Примечание: В столбце LS могут быть повторно использованы до 4-х раз, не затрагивая эффективность очистки.- Промывают колонку 3 раза с 5 мл фосфатно-буферным раствором (PBS) и 3 раза с 5 мл дистиллированной воды с вершины, используя поршень.
- Промывают колонку 5 мл 70% -ного этанола и высушивают колонку интенсивно используя воздушный кран, чтобы предотвратить накопление ржавчины в колонне.
- Для того, чтобы подготовить используемый столбец LS для отдельного эксперимента очистки, промывки колонки снизу вверх с 5 мл 70% этанола с помощью адаптера шприца. Затем промойте колонку снизу вверх дважды 5 мл стерильной PBS, а затем 5 мл PBS, как только из верхней части колонны. Добавить 2мл RT ПБС для уравновешивания колонки, а затем перейти к загрузке колонки меченых клеток.
4. CFSE Этикетировочное и стимулирование
Примечание: Очищенная клетки могут быть подвергнуты различным в пробирке и в естественных функциональных анализов. Здесь мы используем очищенные Т - клетки для определения Т клеточной стимуляции способности АРС 5.
- Предварительно теплый раствор мечение (0,1% FBS в PBS) до 37 ° С перед CFSE нагрузки.
Примечание: Используя низкий процент FBS в PBS снижает гибель клеток во время CFSE нагрузки и сводит к минимуму потерю клеток во время центрифугирования. Тем не менее, слишком много ФБС может помешать CFSE нагрузки. - Вымойте очищенные клетки дважды раствором маркировки, а затем ресуспендировали в 2 х 10 7 клеток / мл в подогретого раствора маркировки в 15 мл трубки.
- Приготовьте 10 мкМ раствор CFSE (1: 500 разбавление 5 мМ CFSE исходного раствора) в подогретого раствора маркировки. Решение CFSE должнобыть свежеприготовленной каждый раз, когда для достижения оптимальной маркировки.
- Для загрузки клеток с CFSE, добавить приостановку 1 часть клеток к 1 части 10 мкМ раствора CFSE в 15-мл пробирку и инкубировать в темноте в течение 10 мин при 37 ° С. В конечной концентрации 5 мкМ CFSE используется для обозначения 1 х 10 7 клеток / мл.
- Переверните пробирку каждые 2 мин, чтобы обеспечить однородную смесь клеток во время CFSE нагрузки.
- Для того, чтобы остановить реакцию, добавить несколько томов ледяной полной среде RPMI и спином вниз на 453 мкг в течение 5 мин при 4 ° С. При успешной загрузке CFSE, клеточный осадок появляется желтоватый.
- Мытье CFSE загружены ячеек еще один раз с ледяной полной среде RPMI и спином вниз на 453 мкг в течение 5 мин при 4 ° С перед использованием для культивирования в пробирке или в естественных условиях стимуляции.
5. In Vitro Стимуляция
- Подготовить 2х маточный раствор стимулов (2x раздражители основной раствор) непосредственно перед употреблением, так что 100 мкл 2х раздражители маточного раствора может быть добавлено к 100 мкл клеток до конечного объема 200 мкл на лунку в 96-луночный планшет.
- Если пластина покрыта раздражители (IgM или CD40 для В-клеток или CD3 и CD28 для Т-клеток) требуется, разбавить стимулы в PBS и предварительно пальто культуры пластины при 4 ° С в течение ночи. В качестве альтернативы, культура пластины может быть нанесено покрытие при температуре 37 ° С в течение 1 часа в день эксперимента. Промыть пластины с нанесенным покрытием дважды PBS (Не допускайте пластины высохнуть в любое время).
| Для В - клеток | |
| Стимулы | Конечная концентрация |
| F (аb ') 2 козьего анти-мышиных IgM | 0.6-2.4 мкг / мл |
| Анти-CD40 мыши мАт | 0.5-2 мкг / мл |
| рекомбинантмыши IL-4 | 25 ед / мл |
| липополисахарид | 0,1-10 мкг / мл |
| (LPS) из E. палочки серотипа 055: B5 | |
| Для Т - клеток | |
| Стимулы | Конечная концентрация |
| Анти-CD3 (пластина с покрытием) | 2-10 мкг / мл |
| (50 мкл / лунку для покрытия) | |
| Анти-CD28 (пластина с покрытием) | 2 мкг / мл |
| Рекомбинантный IL-2 | 40 ед / мл |
| PDBu (форболовыми эфир) | 5-50 нг / мл |
| А23187 (Ионофор кальция) | 250 нг / мл |
Таблица 1: Концентрации раздражителей , используемых для стимуляции лимфоцитов в культуре в пробирке.
- Для CFSE-меченых В - клеток, вновь приостановить до 3 х 10 6 клеток / мл в полной среде RPMI , и культуры в трех экземплярах с 3 х 10 5 клеток / лунку в 96-луночных плоскодонных пластины в течение 72 ч.
- Для CFSE-меченных Т - клеток, повторно приостанавливать до 0,5-3 × 10 6 клеток / мл в полной среде RPMI , и культуры в трех экземплярах с 0,5-3 × 10 5 клеток / лунку в 96-луночные планшеты круглые нижние 48 или 72 ч ,
6. В Vivo Стимуляция
- Для стимуляции в естественных условиях, адаптивно передачи 4 × 10 6 CFSE меченных Т - клеток на мышь (внутривенно (IV) в 200 мкл PBS) в каждую MHC подобранная мыши - реципиента.
Примечание: В этом протоколе CFSE-меченных Т-клетки могут быть перенесены с помощью адаптивно хвостовую вену или ретро-орбитальной инъекции, так как эти клетки будут домой лимфоидных органов, таких как селезенка и лимфатические узлы. - Призовите мышей-реципиентов один день позже с антигеном.
ЗАМЕТКА:В этом примере мы используем овальбумина (OVA белок, 50 мкг / мышь) в качестве антигена, так как OVA-специфический, Т-клеточного рецептора (TCR) -transgenic Т-клетки адаптивно переносили в организм мышей-реципиентов. Подготовьте OVA белок в стерильной PBS и вводят 100 мкл OVA белка / PBS или PBS контроля, с помощью подкожной инъекции (SI), в каждой мыши - реципиента 5. - Урожай и генерировать одиночные клеточные суспензии из лимфоидных органов (лимфатических узлов и селезенки) мышей-реципиентов через 3 дня после иммунизации белком OVA или PBS. Отдельные лимфатические узлы в проксимальных лимфатические узлы (злотый), которая включает в себя подмышечные, плечевой и поверхностные шейные лимфатические узлы) и дистальные лимфатические узлы (дина), которая включает в себя брыжеечных, подколенные, паховые, поясничного отдела позвоночника, и хвостовые лимфатических узлов. Пятно клетки с использованием соответствующих антител FACS для проверки пролиферации Т-клеток.
Примечание: В этом CFSE клеток эксперимента слежения, CFSE-меченных Т-клетки из PBS-инъекции у контрольных мышей установить базовые флуоресценции для не-диviding клетки. Деление клеток пролиферирующих, стимулированных антигеном, CFSE-меченые клетки визуализируют путем измерения флуоресценции пиков 12,13. С помощью контрольной среде ФБР, количество клеточных делений пролиферирующих, CFSE меченных Т - клетки могут быть определены 12,13. - Анализировать данные пролиферации клеток с CFSE меченных путем сравнения количества клеточных делений или пиков между образцами (рисунки 1 и 2).
Примечание: Например, CFSE-меченого, OVA-специфические Т - клетки , перенесенные в организм адоптивно мышей - реципиентов , получавших антиген OVA претерпит активной пролиферации по сравнению с PBS , вводили мышам 5,12 управления. Кроме того, следует отметить , указать на то , что существует множество способов анализа данных клеточной пролиферации CFSE, как показали Хокинс и его коллегами 14.
Результаты
Очистка магнитной ячейки лимфоцитов позволяет очистить популяцию клеток-мишеней в относительно короткий промежуток времени. Используя наш протокол истощения, мы смогли увеличить процент CD8 Т-клеток (OT-I в рекомбинацией активации гена-1 (КГР-1) дефицитных мышей) от 72,8% (до очистки) до 94,2% (после очистки; Рисунок 1А) 4,5. Эти очищенные лимфоциты затем могут быть использованы для последующих функциональных анализов для определения пролиферации лимфоцитов и трансдукции сигнала 4,5. Например, мы можем изучать в естественных условиях Т - клеточной стимуляции способности АРС путем переноса CFSE-маркированный антиген-специфических Т - клеток в дикого типа (WT) и мутантного (МТ) у мышей , иммунизированных с подходящим антигеном 5.
В нашем репрезентативного эксперимента, мы передали очищенный, CFSE-меченый, овальбумин (OVA) конкретных OT-I CD8 T Cгезов в систему управления (WT) и мутантных мышей (МТ) и иммунизацию этих мышей на день позже с белком OVA. Через три дня после иммунизации, мы собирали лимфатические узлы (проксимальный и дистальный) и селезенку и анализировали Т-клеток с помощью проточной цитометрии. CD45 аллельные формы могут быть использованы, чтобы лучше отделить Разделительная, CFSE-меченый, донорские ОТ-я CD8 клетки от немеченого, получателе CD8-Т-клеток. В этом примере, доноров и получателей клетки из CD45.1 и CD45.2 мышей, соответственно (рис 1b). Уровни CFSE на выживание, нестимулированных OT-I Т - клетки в этот момент времени используются для определения пика для Непролиферирующие клеток (рис 1C, пунктирная линия). При стимуляции, интенсивность уровней CFSE в OT-I Т-клеток будет сократить вдвое с каждым делением. Пролиферацию Т - клеток , таким образом , может быть определена путем подсчета количества CFSE пиков 6,12. В наших репрезентативных результатов, мы не видим различия в кросс-презентации возможностей WT и MT (АРСНа фиг.1С, сплошные линии), так как Т - клетки пролиферируют с одинаковой скоростью в обоих мышей.
В отдельном эксперименте, мы провели [3 H] -тимидина анализа для изучения пролиферации клеток активированного контроля и МТ Т - клетками. Очищенная WT и МТ Т - клетки стимулировали различными стимулами в течение 48 ч и в импульсном режиме с [3 Н] -тимидина для окончательного 8 часов. Пролиферирующих клеток в S-фазе клеточного цикла , будет включать радиоактивно меченого нуклеотида, [3 Н] -тимидина, во вновь синтезированную дезоксирибонуклеиновой кислоты (ДНК), поэтому, используя жидкий сцинтилляционный счетчик, пролиферации клеток может быть измерена с помощью [3H] -thymidine поглощение. Количество импульсов в минуту (СРМ) напрямую коррелирует с количеством [3 H] -тимидина поглощение в пролиферирующих Т - клеток. В наших представительных результатов, сокращение числа имп, полученного из МТ Т-клеток при стимуляции по сравнению с Counts из WT Т - клеток указывает на скомпрометированной пролиферативную способность МТ Т - клеток (рис 1D).
Для определения В-клеточной пролиферативной способности, мы очистили селезеночной В-клетки, используя описанную стратегию истощения. После очистки, мы смогли увеличить процент B220 В - клеток (WT) мышей с 63,9% (до очистки) до 98,4% (после очистки; Рисунок 2A) 4. Аналогично очищают Т - клетки, очищенные селезеночных В - клетки также могут быть использованы для последующих функциональных анализов для оценки пролиферации лимфоцитов и трансдукции сигнала 4. Впоследствии мы пометили очищенные WT селезеночной В - клеток с CFSE и стимулировали эти клетки в пробирке с использованием пластин , покрытых анти-CD40 , дополненной цитокина IL-4. Через три дня после стимуляции, мы проанализировали жизнеспособные, активированные В-клетки с помощью проточной цитометрии. Уровни CFSE на выживание, нестимулированных В-клетки в этот момент времени используются дляопределяют пик для Непролиферирующие клеток (Фигура 2В, пунктирная линия). Подобно Т - клеток, интенсивность уровней CFSE в В - клетках будет сократить вдвое с каждым делением 6,12.
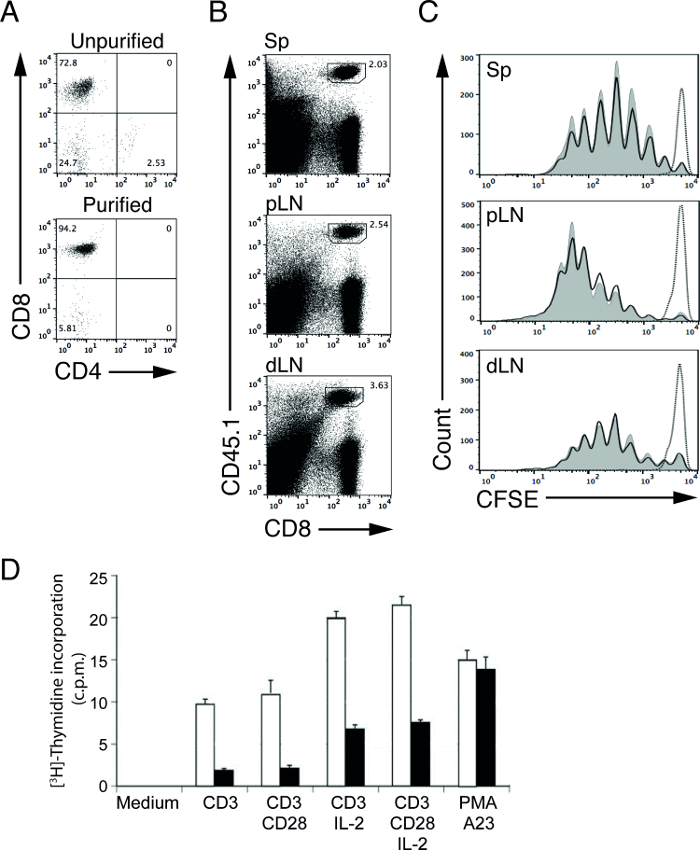
Рисунок 1: CFSE профили восприимчиво переданных очищенных OT-I Т - клеток после иммунизации (А) CD4 и CD8 окрашивание клеток , выделенных из OT-I;. КГР-1-дефицитных мышей, прежде чем (верхняя панель) и после (нижняя панель) истощением клеток не-Т. (Б) Представитель FACS участков Т - клеток из селезенки (Sp), ближние лимфатические узлы (злотый) и дистальные лимфатические узлы (дина). Донорские OT-I CD8 Т-клетки CD45.1 положительными. (C) представитель CFSE профили, переданных CFSE-меченых OT-I донорских Т - клеток из селезенки (Sp), ближние лимфатические узлы (злотый) и дистальные лимфатические узлы (дина) из WT (заштрихованы кривые) иМТ (сплошные линии) мышей-реципиентов через 3 дня после иммунизации с помощью белка и LPS OVA. Пунктирная линия указывает OT-I Т-клетки мышей-реципиентов WT без иммунизации (PBS вводили). (D) , Пролиферация клеток активированного контроля или МТ Т - клеток , как измерено с помощью [3 H] -тимидина анализа поглощения. Результаты представлены в импульсах в минуту (СРМ). Очищенная контроль (открытый бар) или МТ (закрытый бар) Т-клетки инкубировали в течение 48 ч в только (среды), либо в присутствии пластинчатого переплете анти-CD3 или анти-CD3 плюс анти-CD28 с добавлением или без рекомбинантного ИЛ 2. Поликлональные активации клеток была вызвана РМА (форбол эфира) и А23 (ионофором кальция). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 2: CFSE профильВ - клетки , при стимуляции в пробирке. (A) В220 и CD3 - окрашивании клеток селезенки , выделенных из WT мышей до того (верхняя панель) и после (нижняя панель) истощением клеток не-B. (Б) представитель CFSE профиля CFSE меченного WT (заштрихованная кривая) селезеночных В - клеток после 3 дней стимуляции в пробирке с пластин , покрытых анти-CD40 и IL - 4. Пунктирная линия указывает CFSE-меченых клеток WT B без стимуляции. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
В этом протоколе, мы демонстрируем процедуру очистки лимфоцитов из лимфоидных органов. очистка клеток с помощью магнитной сортировки шарик представляет собой быстрый и простой метод, который дает жизнеспособные, высоко очищенные клетки-мишени.
Критические шаги в рамках Протокола
Жизнеспособность клеток и выход клеток
Поддержание жизнеспособности кроветворных клеток линии дифференцировки в пробирке имеет решающее значение для обеспечения успешных и воспроизводимых экспериментов. Химические и биологические реагенты, субоптимальные экспериментальные условия или ненадлежащее условий хранения вырезанных органов могут влиять на жизнеспособность клеток. После иссечения от мышей, лимфоидные органы должны храниться на льду и одноклеточных суспензий, приготовленных как можно скорее. Высокоскоростной центрифугирование клеточной суспензии, также следует избегать. Кроме того, клеточные гранулы должны быть ослаблены Смахивающее трубки с пальцами после удаления супернатанта. Это неРекомендуется ресуспендируйте гранулы непосредственно большими объемами среды пипеткой.
Примерно 2-4 х 10 7 селезеночной клетки и 2 х 10 7 Т - клетки из всех основных лимфатических узлов , могут быть выделены из одной 8-10-недельных WT мыши. Сокращение числа очищенного В- и Т-клеток (ниже ожидаемого значения) указывает на суб-оптимальные условия, как уже упоминалось ранее.
чистота клеток
Средняя чистота выделенных клеток с использованием этого протокола находится в диапазоне от 90 до 95%, что является достаточно чистым для последующего в пробирке или в естественных условиях экспериментов (Фигура 1А). Желательно, чтобы не перегружать разделительную колонну с избыточным количеством клеток в процессе разделения, так как это может поставить под угрозу чистоту клеток из-за ограниченной связывающей способности колонны.
Качество FBS
Качество FBS используется в дополнение к культуральной среды имеет решающее значение для выживания в пробирке лимфоцитов. ФБС из различных источников и партий могут варьироваться в их способности поддерживать в пробирке реакций лимфоцитов. Поэтому, важно, чтобы проверить различные типы ФБС, чтобы найти тот, который дает высокую-специфический ответ с низким фоном. Значительное количество бутылок должны затем быть зарезервирован в качестве запаса.
Модификации и устранение неисправностей
Условия маркировки CFSE
Даже если CFSE маркировка работает в простом RPMI, мы обнаружили, что использование низкий процент FBS в PBS уменьшает гибель клеток в процессе загрузки, не ставя под угрозу эффективность маркировки. К тому же, наличие FBS минимизирует потерю клеток во время центрифугирования.
Важным аспектом маркировки CFSE является обеспечение даже мечение клеток для того, чтобы представить себе четкий пикs, которые представляют собой деление клеток. Перегрузка CFSE может привести к увеличению гибели клеток в пробирке или плохое восстановление меченых клеток в естественных условиях. С другой стороны, недостаточная маркировка CFSE или гетерогенность в целевой клеточной суспензии в процессе маркировки может привести к плохо разрешены CFSE пики 12. Поэтому, важно, чтобы оптимизировать условия CFSE маркировки. Количество CFSE используется для маркировки должна быть настолько низкой, насколько это возможно, чтобы уменьшить потенциальные токсические эффекты от перегрузки, но до сих пор достичь достаточной маркировки для обнаружения хорошо разрешенных пиков при стимуляции в экспериментальной сроки. Кроме того, чтобы избежать плохо разрешенных пиков, скопления клеток должны быть удалены из одноклеточных суспензий клеток перед CFSE нагрузки.
Клеточные сгустки и гибель клеток
Крайне важно, чтобы гарантировать, что клетки полностью ресуспендировали, прежде чем перейти к следующему шагу, потому что вечный removaл клеточных сгустков во время эксперимента резко снижает количество клеток. Клеточные сгустки, как правило, связаны со снижением жизнеспособности клеток или неадекватного ресуспендирования клеточного осадка.
CFSE и спектры излучения перекрываются
CFSE-меченых клеток могут быть дополнительно определены с флуорофором-конъюгированные антитела через один день в культуре, тем не менее, эти CFSE-меченых клеток все еще остаются ярко флуоресцентный после дня в культуре. Используя комбинации антител, конъюгированных с яркими флуорофоров с минимальным количеством спектров излучения перекрываются с CFSE, таких как фикоэритрин (РЕ) и фикоэритрин-цианина 7 (PeCy7), обеспечивает оптимальные результаты окрашивания. Однако компенсация, чтобы уменьшить спектры излучения перекрытия по-прежнему требуется. Кроме того, в связи с высокой интенсивностью сигнала CFSE (FL-1 канал), который разливает в канал FL-2, канал FL-2 должен быть компенсирован путем вычитания высокий процент стоимости FL-2 для получения неавтоматическогоIMAL CFSE профиль. Можно обратиться к статье , опубликованной Quah и др., Которая обеспечивает решения для маркировки и анализа результатов 12 поиска неисправностей CFSE.
Альтернативы CFSE
Спектр излучения CFSE ограничивает использование комбинаций CFSE с производными флуоресцеина, такие как зеленый флуоресцентный белок (GFP) и изотиоцианат флуоресцеина (FITC) -conjugated антител. Существуют, однако, и другие коммерчески доступные красители кювета с одинаково высокой интенсивности флуоресценции и низкой токсичности клеток в фиолетовой (КТВ, возбуждение / излучения: 405/450 нм), желтый (CTY, 555/580 нм) до красного (CTFR, 630 / 661 нм или CPD670, 647/670 нм) и красный (PKH26, 551/567 нм). Использование маркировки клеток красителей с различными спектрами излучения обеспечивает гибкость в опытно-конструкторских. С другой стороны, не все из описанных выше мечения клеток красители могут генерировать различные пики клеточного деления. Проведено сравнительное исследование, проведенное с использованиемразличные маркировки клеток красители к выводу , что CTV является лучшей заменой для CFSE , поскольку CTV обеспечивает обнаружение большего числа четко определенных пиков 13 деления клеток.
Ограничения
Основным недостатком магнитной сортировки клеток является то, что он подходит только для простой сортировки клеток. В нашем примере, мы могли бы использовать CD43 исчерпать все не-В-клеток из селезенки; Тем не менее, мы не смогли бы отделить фолликулярных В-клеток из маргинальной зоны В-клеток. Эти субпопуляции можно определить только с несколькими поверхностными маркерами. В то время как можно положительно выбирать клетки с использованием магнитной сортировки клеток на основе нескольких поверхностных маркеров, она зависит от специально подготовленных, коммерчески доступных реагентов, которые позволяют высвобождение микрошариков из клеток-мишеней после первого раунда сортировки, прежде чем перейти ко второму маркеру. Таким образом, пользователь будет полностью зависит от коммерчески доступных наборов. В таком случае, FACS-яS гораздо выгоднее в разделении популяции рафинированных клеток.
Значение Техника
Антител на основе сортировки клеток подходы, такие как магнитно - сортировкой клеток и FACS, являются наиболее надежными методы сортировки клеток на сегодняшний день 15. Другие методы разделения клеток существуют, в том числе методов плотности на основе и приверженности на основе, однако, лимфоциты плохо прилипшие клетки и их субпопуляции относительно сходны по плотности, таким образом , adherence- и плотности на основе технологии либо не применимы или очень неэффективны 15 ,
Как уже упоминалось во введении, быстрый, простой, высокой жизнеспособности клеток, и не зависит от любого другого сложного оборудования являются выигрышные особенности магнитной сортировки клеток над FACS. В частности, отрицательное истощение с использованием магнитной сортировки клеток метки и истощает нежелательных клеток с использованием магнитного разделительной колонны, в то время выделения клеток-мишеней с минимальным modificatioнс до поверхности клеток и поддержание наивную состояния.
Будущие приложения
Высококвалифицированные обогащается, жизнеспособные, и наивные лимфоциты очищали с использованием этого магнитного методика на основе очистки может быть подвергнуто различным функциональных анализов поведения лимфоцитов и сигнальных механизмов в пробирке и в естественных условиях. В этом протоколе, мы показали , с использованием двух различных анализах пролиферации клеток - [3 Н] -тимидина анализа и включение CFSE анализа клеточной пролиферации - исследовать клеточные пролиферативные способности активированных лимфоцитов.
Выбор между [3 H] -тимидина анализ и включение CFSE анализ пролиферации клеток в значительной степени зависит от размера выборки и условий эксперимента. Используя [3 H] -тимидина анализа включения в экспериментах с большими размерами выборки генерирует данные пролиферации клеток с высокой пропускной способностью . Для того, чтобы обеспечить оптимальное [ 3 Н] -тимидина поглощение и воспроизводимость результатов, [3 Н] -тимидина следует добавить к культуре , когда большинство клеток активно делятся. Оптимизация протокола маркировки требуется для различных типов клеток и стимулов. Кроме того, в связи с радиоактивной природы [3 Н] -тимидина, это включение анализ может выполняться только в лабораторных условиях , в отличие от CFSE мечения клеток, которые могут быть активированы в пробирке (фиг.2В) или адаптивно переносили в мышей - реципиентов (фиг.1В и 1С).
Анализ пролиферации клеток CFSE, с другой стороны, дает больше информации на пролиферацию клеток , чем [3 Н] -тимидина. Поскольку интенсивность CFSE в CFSE-меченых клеток снижается наполовину с каждым делением клетки, можно определить число клеточных делений и доли клеток при каждом делении путем подсчета количества и размера пиков 12,13. Кроме того, CFSE-меченые клетки могут быть дополнительно определены в различные подмножества в соответствии с их экспрессии молекулы поверхности с помощью проточной цитометрии с использованием соответствующих флуорофора-конъюгированные антитела. Самое главное, что в отличие от [3 H] -тимидина анализа , который измеряет пролиферацию клеток в конечной точке времени, анализ пролиферации клеток CFSE позволяет для отслеживания клеточного деления, предоставляя больше информации о кинетике способности клеточной пролиферации. Тем не менее, анализ пролиферации клеток CFSE не могут быть пригодны для экспериментов с большими размерами выборки.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
Работа выполнена при поддержке Министерства образования, Сингапур (ACRF Tier1-RG40 / 13 и Tier2-MOE2013-T2-2-038). Рукопись была отредактирована Эми Салливан из Obrizus Communications.
Материалы
| Name | Company | Catalog Number | Comments |
| Materials | |||
| RPMI 1640 (without L-Glutamine) | Gibco | 31870025 | |
| Fetal Bovine Serum | Heat inactivated | ||
| L-glutamine | Gibco | 25030024 | |
| Penicillin/Streptomycin | Gibco | 15140114 | |
| 2-mercaptoethanol | Gibco | 21985023 | |
| Anti-CD43 magnetic microbeads | Miltenyi Biotec | 130-049-801 | Mix well prior use |
| Streptavidin microbeads | Miltenyi Biotec | 130-048-101 | Mix well prior use |
| Anti-Annexin V magnetic beads | Miltenyi Biotec | 130-090-201 | Mix well prior use |
| MACS LD | Miltenyi Biotec | 130-042-901 | |
| 96-well U-bottom sterile culture plate | Greiner Bio-one | 650180 | |
| 96-well F-bottom sterile culture plate | Greiner Bio-one | 655180 | |
| 100 μm cell strainer mesh | To sterilize using UV radiation prior use | ||
| 0.2 μm sterile disposable filter units | Nalgene | 567-0020 | Can be substituted with any sterile filter device |
| CellTrace Violet | Invitrogen | C34557 | CTV for short; alternative to CFSE |
| CellTrace Yellow | Invitrogen | C34567 | CTY for short; alternative to CFSE |
| CellTrace Far Red | Invitrogen | C34564 | CTFR for short; alternative to CFSE |
| Cell Proliferation Dye eFluor 670 | eBioscience | 65-0840 | CPD670 for short; alternative to CFSE |
| PKH26 | Sigma Aldrich | PKH26GL | PKH26, alternative to CFSE |
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Dextrose | Sigma Aldrich | G7021 | |
| Potassium phosphate monobasic | Sigma Aldrich | P5655 | |
| Sodium phosphate dibasic | Sigma Aldrich | S5136 | |
| Phenol Red | Sigma Aldrich | P0290 | |
| Calcium chloride dihydrate | Sigma Aldrich | C7902 | |
| Potassium chloride | Sigma Aldrich | P5405 | |
| Sodium chloride | Merck Millipore | S7653 | Can use from other sources |
| Magnesium chloride hexahydrate | Sigma Aldrich | M2393 | |
| Magnesium sulfate | Sigma Aldrich | M2643 | |
| Ammonium chloride | Sigma Aldrich | A9434 | |
| Tris-base | |||
| Dimethyl Sulfoxide | Sigma Aldrich | D8418 | |
| (5-(and 6-) carboxyfluorescein diacetate succinimidyl ester (CFSE) | Molecular Probes | C-1157 | Reconstitute in DMSO |
| Phorbol 12,13-dibutyrate (PBDU, Phorbol ester) | Sigma Aldrich | P1269 | |
| A23187 (Calcium ionophore) | Sigma Aldrich | C7522 | |
| Name | Company | Catalog Number | Comments |
| Antibodies and recombinant protein | |||
| CD11b biotin (clone m1/70) | Biolegend | 101204 | T cell depletion cocktail |
| CD11c biotin (clone N418) | Biolegend | 117304 | T cell depletion cocktail |
| Gr-1 biotin (clone RB6-8C5) | Biolegend | 108404 | T cell depletion cocktail |
| Ter119 biotin (clone Ter119) | Biolegend | 116204 | T cell depletion cocktail |
| TCR-γδ biotin (clone GL-3) | Biolegend | 118103 | T cell depletion cocktail |
| CD19 biotin (clone 6D5) | Biolegend | 115504 | T cell depletion cocktail |
| B220 biotin (clone RA3-6B2) | Biolegend | 103204 | T cell depletion cocktail |
| CD49b biotin (clone DX5) | Biolegend | 108904 | T cell depletion cocktail |
| CD4 biotin (clone GK1.5) | Biolegend | 100404 | T cell depletion cocktail |
| CD8 biotin (clone 53-6.7) | Biolegend | 100704 | T cell depletion cocktail |
| F(ab’)2 goat anti-mouse IgM (plate coated) | Jackson ImmunoResearch | 115-006-075 | 50 µl/well for coating (96-well) |
| Anti-mouse CD40 mAb (plate coated) | Pharmingen | 553722 | 50 µl/well for coating (96-well) |
| Recombinant IL-4 | ProSpec | Cyt-282 | |
| LPS from E. coli Serotype 055:B5 | Sigma Aldrich | L-4005 | |
| Anti-CD3 (clone clone OKT3) (plate coated) | eBioscience | 16-0037-85 | 50 µl/well for coating (96-well) |
| Anti-CD28 (clone clone 37.51) (plate coated) | eBioscience | 16-0281-85 | 50 µl/well for coating (96-well) |
| Recombinant IL-2 | ProSpec | Cyt-370 | |
| Albumin from chicken egg white, Ovalbumin | Sigma Aldrich | A7641 |
Ссылки
- Nikolich-Žugich, J., Slifka, M. K., Messaoudi, I. The many important facets of T-cell repertoire diversity. Nat. Rev. Immunol. 4 (2), 123-132 (2004).
- LeBien, T. W., Tedder, T. F. B lymphocytes: how they develop and function. Blood. 112 (5), 1570-1580 (2008).
- Brownlie, R., Zamoyska, R. T cell receptor signaling networks: branched, diversified and bound. Nat. Rev. Immunol. 13 (4), 257-269 (2013).
- Neo, W. H., Lim, J. F., Grumont, R., Gerondakis, S., Su, I. C-rel regulates ezh2 expression in activated lymphocytes and malignant lymphoid cells. J. Biol. Chem. 289 (46), 31693-31707 (2014).
- Gunawan, M., et al. The methyltransferase Ezh2 controls cell adhesion and migration through direct methylation of the extranuclear regulatory protein talin. Nat Immunol. 16 (5), 505-516 (2015).
- Lyons, A. B., Parish, C. R. Determination of lymphocyte division by flow cytometry. J. Immunol. Methods. 171 (1), 131-137 (1994).
- Cabatingan, M. S., Schmidt, M. R., Sen, R., Woodland, R. T. Naïve B lymphocytes undergo homeostatic proliferation in response to B cell deficit. J. Immunol. 169 (12), 6795-6805 (2002).
- Bedoya, S. K., Wilson, T. D., Collins, E. L., Lau, K., Larkin, J. Isolation and Th17 differentiation of naïve CD4 lymphocytes. J. Vis. Exp. (79), e50765 (2013).
- Su, I., et al. Ezh2 controls B cell development through histone h3 methylation and Igh rearrangement. Nat. Immunol. 4 (2), 124-131 (2003).
- Mecklenbräuker, I., Saijo, K., Zheng, N., Leitges, M., Tarakhovsky, A. Protein kinase Cδ controls self-antigen-induced B-cell tolerance. Nature. 416 (6883), 860-865 (2002).
- Rush, J. S., Hodgkin, P. D. B cells activated via CD40 and IL-4 undergo a division burst but require continued stimulation to maintain division, survival and differentiation. Eur. J. Immunol. 31 (4), 1150-1159 (2001).
- Quah, B. J. C., Warren, H. S., Parish, C. R. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester. Nat. Protoc. 2 (9), 2049-2056 (2007).
- Quah, B. J. C., Parish, C. R. New and improved methods for measuring lymphocyte proliferation in vitro and in vivo using CFSE-like fluorescent dyes. J. Immunol. Methods. 379 (1-2), 1-14 (2012).
- Hawkins, E. D., Hommel, M., Turner, M. L., Battye, F. L., Markham, J. F., Hodgkin, P. D. Measuring lymphocyte proliferation, survival and differentiation using CFSE time-series data. Nat. Protoc. 2 (9), 2057-2067 (2007).
- Tomlinson, M. J., Tomlinson, S., Yang, X. B., Kirkham, J. Cell separation: Terminology and practical considerations. J. Tissue Eng. 4 (1), 1-14 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены