Method Article
Budding Maya endositozun kantitatif, kinetik ve Yüksek verim Analizi pHluorin Uygulamaları
Bu Makalede
Özet
Accurate quantification of vesicular trafficking events often provides key insights into roles for specific proteins and the effects of mutations. This paper presents methods for using superecliptic pHluorin, a pH-sensitive GFP variant, as a tool for quantification of endocytic events in living cells using quantitative fluorescence microscopy and flow cytometry.
Özet
Yeşil floresan proteini (GFP) ve türevleri yaygın protein lokalizasyonu ve hücre iskeleti yeniden ve canlı hücrelerin veziküler kaçakçılığı gibi olaylar dinamiklerini incelemek için kullanılan araçlardır. Kimerik GFP füzyonu kullanılarak niceliksel yöntemler birçok uygulama için geliştirilmiştir; Ancak, GFP, proteoliz biraz dayanıklıdır böylece floresan endositik yolunda kargo ticareti ölçümü engelleyebilir lizozom / vakuol, devam etmektedir. endositoz sonrası endositik trafik olayları ölçülmesi için alternatif bir yöntem, superecliptic pHluorin, asidik ortamlarda söndürülür GFP bir pH-duyarlı bir varyantın kullanır. multiveziküler organları (MVBs) ve lizozom / vakuol lümene sunumuna kargo dahil edildikten sonra floresan nemlendirme transmembran Yük proteinleri sonuçlar sitoplazmik kuyruk pHluorin kimerik füzyon. Bu nedenle, vakuolar floresans söndürme quantifi kolaylaştırırendositoz ve endositik yolunda erken olayların katyon. Bu çalışma, floresan mikroskobu ile endositoz miktarının pHluorin etiketli yükleri yöntemler kullanılarak, hem de akış sitometrisi kullanılarak popülasyon bazlı tahliller açıklanmaktadır.
Giriş
Veziküler trafik ökaryotik hücrelerde organel kimliği ve işlevini muhafaza edilmesinde önemli bir rol oynar ve tek tek hücre bölümlerinde protein ve zar bileşimi düzenlemek için önemli bir mekanizmadır. endositoz yoluyla üretilen keseler daha sonra geri dönüşüm veya lizozoma hedefleme için yüzeyinden zar ve proteinleri uzaklaştırmak ise plazma membranında, ekzositik veziküllerin füzyon, hücrenin yüzeyine yeni proteinler ve membranlar sağlar. Bu nedenle, endositoz besin alımı ve hücre dışı ortama yanıtları için önemlidir. Ekzositoz ve endositoz plazma zarı yüzey alanı düzenleyen ve hasarlı proteinlerin ciro izin dengelenir.
maya ve memeli hücrelerinde yapılan çalışmalar en çeşitli yanıt olarak bir endositoz katılan proteinlerin büyük sayıda, hem de belirli bir yükün içselleşmesini çerçevesinde çok endositik yollar ya da hareket belirledikvironmental koşullar. en iyi çalışılmış yol klatrin ve sitosolik yardımcı proteinleri oluşmakta endositik vezikül stabilize etmek için bir kaplama yapısına monte edildiği klatrin aracılı endositoz (STE) vardır. Tomurcuklanan maya Saccharomyces cerevisiae yapılan deneyler dinamikleri ve birçok endositik proteinler 1-3 için işe alım düzenine temel anlayışlar vermiştir. Özellikle, CME makine yüksek evrim boyunca muhafaza edilir maya STE ile ilişkili proteinlerin çoğunluğu, insan ortologlarını olduğu; böylece, maya tomurcuklanan yüksek ökaryotlarda korunmuş olan endositoz mekanizmalarını anlamak için önemli bir araç olmuştur. Örneğin, tomurcuklanan maya kullanılarak çalışmalar ek endositik aksesuar işe ardından CME yapılarının bu oluşumunu ve olgunlaşmasını (maya olarak kortikal aktin yamalar anılacaktır) Klatrin ve kargo bağlayıcı adaptör proteinleri ile başlayan, pek çok protein sıralı akınıdır tespit proteinler,ARP2 / 3-aracılı aktin polimerizasyonu aktivasyonu ve vezikül kesme 1,2 katılan proteinlerin işe. aktin yamaları kortikal için CME makine proteinlerinin İşe çok sipariş edilen ve basmakalıp bir süreçtir ve birçok protein için işe kesin sipariş CME makine diğer bileşenleri ile ilgili olarak kurulmuştur. Daha da önemlisi, son çalışmalar memeli hücrelerinde 4 Klatrin kaplı çukurlar CME proteinler için işe benzer bir düzen doğruladı.
CME ek olarak, çok sayıda hücre tipleri, plazma zarının 5-7 vezikül oluşumu ve içselleşmesini teşvik etmek için alternatif mekanizmalar kullanan bir veya daha fazla klatrin bağımsız endositik (CIE) yollarına sahiptirler. Maya, biz son zamanlarda küçük GTPaz Rho1 ve aktive guanin nükleotid değişim faktörü (GEF), ROM1 8,9 kullanan bir CIE yolu belirledi. Rho1 aktin polimerizasyonu 1 teşvik formin Bni1 aktiveMaya 12 klatrin bağımsız endositoz bu formu için gerekli olan 0,11. Ayrıca, proteinlerin α-arrestin ailesi ubikitin ligaz Rsp5 CME 13-17 yoluyla kargo yayılmasını ve daha sonra içselleşmesini teşvik etmek ve aynı zamanda CIE 18 yer alan proteinlerle muhtemelen doğrudan etkileşim yoluyla, CIE yolu ile kargo içselleştirme teşvik işe. CIE yollarının çeşitli da Rho1 ortologunun, RhoA 9,19 kullanan klatrin bağımsız ve fagositik yollar dahil, memeli hücrelerinde mevcuttur. Memeli CIE RhoA rolü tam olarak anlaşılamamıştır; böylece, tomurcuklanan maya çalışmalar memeli CIE için geçerli olan ek mekanistik bakış açıları sağlayabilir.
endositik olayların doğru ölçümü endositoz düzenleyen spesifik proteinlerin rolleri hakkında önemli bilgiler sağlayabilir ve kargo içselleştirme veya progressio mutasyonların etkilerini ortaya çıkarabilirendositik yolu ile n. Bu amaç için, biyokimyasal yöntemler ligand alımını izlemek ve endositik kargo proteinlerin degradasyon oranları ölçmek için kullanılabilir. canlı hücrelerinde, yeşil floresan proteininin (GFP) ve ilgi kargolara türevleri füzyon kargo taşımacılığı doğrudan görselleştirme izin verir. GFP (maya veya vakuol) lizozom bozulmaya dirençli olduğu Ancak, GFP etiketli yükler endositoz miktarının sınırlı kullanıma sahiptir. Ayrıca, GFP flöresanmm, pH değişiklikleri kısmen duyarlıdır ve 20,21 lümen vakuol içerisinde tespit olmaya devam etmektedir. Sonuç olarak, GFP etiketi floresan kargo kalan bozulmuş olup, kargo yoğunluğuna tüm hücre tabanlı miktar nedeniyle vakuol uzun vadeli GFP floresan yanlış olabilir süre sonra vakuol devam etmektedir.
vakuolar GFP floresans sakıncaların üstesinden gelmek için, daha önce superecliptic pH kullandıluorin, nötr pH'ta parlak bir floresant, ancak bu 20,22,23 Lizozom vakuol / lümeni gibi asidik ortamlarda flüoresans kaybeder GFP bir pH-duyarlı varyantı. Endositik kargolar sitoplazmik kuyruk bir pHluorin etiketi yerleştirme plazma membranında ve pHluorin etiket sitoplazmaya (Şekil 1A) maruz kalır erken endozomlardan üzerinde kargoların görselleştirme izin verir. Erken endozomlar, endozomun lümenine tomurcuk veziküller içine taşıma (ESCRT) makine paketleri yüzey lokalize kargolar için gerekli endozomal ayırma kompleksleri, üreten multiveziküler cisim (MVBs) 24 olgun olarak. İç MVB veziküller içine dahil edilmiştir kargolar için, pHluorin etiket vezikül lümenine doğru dönüktür. İç MVB veziküller asitlendirilirler; Onlar MVBs 20 içine olgun olarak böylece pHluorin-etiketli kargolar erken endozomlardan üzerinde floresan kaybedersiniz. vakuol ile MVB daha sonraki füzyon MVB lümen içeriğini teslimindirgenmesi için ve pHluorin etiketler vakuol lümeninin asidik ortamda söndürüldü kalır.
Bu yazıda maya sitoplazmik pHluorin etiketleri ile kargoları kullanarak kantitatif endositik testlerin ayrıntılı açıklamalar sağlar. pHluorin etiketli yükleri sentezleyen cinsler, belirli yük özellikleri ve trafik davranışa bağlı olarak, kinetik ve / veya son nokta deneylerinde kullanılabilir. Buna ek olarak, bazı pHluorin-etiketli yüklerin akış sitometrisi içeren yüksek verimli analiz yöntemleri, elverişlidir. Önemli olarak, pHluorin etiketi, canlı hücrelerde endositik olayları incelemek endositoz ve vahşi tip ve mutant suşları endositik fonksiyonunun karşılaştırılması sayılmasına olanak tanıyan bir çok yönlü bir araçtır.
Protokol
1. Çözüm ve Medya
- Aşağıdaki Stoklar, Medya ve Tabaklar hazırlayın:
- 10x YNB hazırlamak için, suyun 1 L amino asitleri eksik maya azot baz 67 g çözülür. 0.22 mikron nitroselüloz filtre ile süzme ile sterilize edin.
- 2 (h stokunun w / steril% 50),% dekstroz ve 1 x amino asit / besleyici karışımı (10x stok) 1x YNB kullanılarak YNB orta hazırlayın (100X'lik bir stok, Aşama 1.1.4 bakınız). gerektiği gibi plazmid seçimi için, bireysel amino asitler ya da besin ihmal. Mup1 ekspresyon indüksiyonu için, ilave olarak, amino asit / besleyici karışımından metiyonin sayın.
- (H stokunun w / steril% 50) (10x stok) 1x YNB kullanılarak YNB plakaları,% 2 dekstroz hazırlayın, 0.7 g / L amino asit / besleyici karışımı (adım 1.1.5) ve% 2.5 agar. ağar, 25 g su ve 860 ml başına amino asit / besin karışımı 0.7 g otoklav tarafından plaka ortamı hazırlayın. mi O karışım 100 10x YNB üzerine ilave edildi ve 40, daha sonra, 55 ° C'ye kadar soğumaya eklemesine izin verinF% 50 glükoz. , Plakalar (10 cm tabak başına ortamın yaklaşık 30 mi) dökün ortamı oda sıcaklığında katılaşmaya izin ve mağaza plakalar 4 ° C 'de.
- iyonu giderilmiş su, 100 ml aşağıdaki çözündürülmesiyle (sıvı ortam için) 100 x amino asit / besleyici stok çözelti hazırlayın: 0.1 g L-Metionin, 0.3 g L-lösin ve L-lizin, ve 0.2 g L-histidin, her her biri L-triptofan, adenin ve urasil (spesifik suşları için gerektiği şekilde başka amino asitler ve besin dahil edilebilir). çözünmesi için gerekirse hafif ısı kullanın ve 0.45 mikron nitroselüloz filtre ile sterilize edin. ışıktan korunarak oda sıcaklığında saklayınız. Plazmid seçimi için, gerektiği gibi, belirli bileşenlerin bulunmadığı stok çözelti hazırlayın.
- birleştirerek amino asit / (plakaları için) besin karışımının hazırlanması Aşağıdaki: adenin 0.5 g, L-lösin 4 g, 2 g L-histidin, L-lizin, L-metiyonin, L-triptofan, her, L- tirosin ve urasil. Bir havanda eziyet ve pro ile saklamakışıktan koruması. Plazmid seçimi için, gerektiği gibi, belirli bileşenlerin bulunmadığı karışımlarını hazırlamak ve plaka ortamında (adım 1.1.3 bakınız) her bir litresi için, amino asit karışımı ve 0.7 g kullanın.
- konkanavalin A (ConA) ile slayt yüzeyini kaplayarak mikroskopi için 8-iyi odasının slaytlar hazırlayın. slaytı, her sıra için, su içinde çözülmüş, 2 mg / ml ConA 25 ul ekle. Bir pipet kullanarak, kuyunun alt yüzeyi boyunca CnA yayılmış, sonra en az 4-8 saat oda sıcaklığında hava içinde kurumasına slayt sağlar. İdeal olarak, ConA kaplama 24 saat içinde odasının slaytlar kullanın.
- Polimeraz zincir reaksiyonu (PCR) Longtine et al merkezli entegrasyon metodu kullanılarak söz endositik kargo GFP veya pHluorin çerçeve içi füzyon maya suşları oluşturur. ve Goldstein ve McCusker 25,26.
Not: pHluorin direnci kanamisin genleri (KANMX6) ve nourseothricin kasetler etiketleme ihtiva eden plasmidler ( NATMX4) daha önce 20 tarif edilmiştir.- Genomik entegrasyon 20,25 site özel ek sekanslar ihtiva eden primerler ile seçilebilir işaretleyiciler içeren GFP ya pHluorin kasetleri yükseltin.
- Lityum asetat yöntemi 27 kullanarak istenen maya suşu içine çıkan PCR ürünü Transform.
- Uygun ilaç içeren YPD plakalar üzerinde büyüyen hücreleri tarafından kasetin entegrasyonu için seçin. tabak, otoklav 10 g maya özü, 20 g pepton, 0.1 gr triptofan ve 960 ml su içinde 25 g agar hazırlamak. Plakaları, dökme önce, karışım daha sonra kan şekeri ve KANMX6 seçimi için, 200 ug / ml bir son konsantrasyona kadar G418 ya da ya da nourseothricin 100 ug / ml'lik bir son konsantrasyon için, 40 ml% 50 eklemek 55 ° C'ye kadar soğuması NATMX4 seçimi.
- PCR ile tek tek koloniler GFP ya pHluorin etiketinin entegrasyonu teyit ve / veya anti-GFP antikorları kullanılarak Western lekeleme,yanı sıra floresan mikroskobu 20 tarafından etiketlenen proteinin tespiti ile.
Not: Belirli maya kökleri ve bu çalışmada kullanılan plazmidler, sırasıyla Tablolar 1 ve 2'de sıralanmıştır.
Konstitütif İçselleştirilmiş Endositik Cargo kararlı durum Floresans 2. Endpoint Testi
- (Varsa) plazmid bakımı için gerekli olan amino asitler ya da besin eksik YNB ortamın 5 ml hücreler (~ 3 küçük koloni) inoküle. 250 rpm çalkalanarak, 30 ° C'de yörüngesel çalkalamalı bir enkübatörde 16-24 saat boyunca hücrelerin büyütün. Alternatif olarak, amino asitler ya da plazmid seçimi için besin eksik YNB plaka üzerine hücre çizgi bir p, 1-2 mm kolonisi ile 30 ° C 'de bir gece boyunca hücreler büyür.
- Bir spektrofotometre kullanılarak, her bir gece boyunca kültür yoğunluk (OD 600) ölçülür. Pla için amino asitleri veya besin eksik YNB ortamında 0,35-0,4 OD 600 / ml 5 ml seyreltme hazırlayınSmid bakımı ve çalkalanarak 30 ° C'de yaklaşık 3 saat büyür. kullanarak hücrelerin bir tabakta çizgili, bu adımı atlayın ve adım 2.4 (aşağıya bakınız) ile devam edin.
- Şimdi 0,6-1,0 OD 600 / ml arasında olmalıdır hücrelerin yoğunluk (OD 600), ölçün. 2 dakika boyunca 8.000 rpm'de (6,800 xg) 1.5 kadar bir mikrofüj tüpüne kültür ml ve pelet hücreleri aktarın. süpernatant 1475 ul çıkarın.
- bir floresan mikroskobu hücreleri getirin. Her bir örnek görüntüleme önce, geri kalan ortam içinde yeniden süspansiyona alınmasıyla, bir slayt hazırlayın ve bir kapak slip altında hücre süspansiyonu 3 ul monte edin. Plazmid seçimi için uygun bir şekilde YNB ortamı kullanılarak, protokol 3'te aşağıda tarif edildiği gibi alternatif olarak, 8 oyuklu odası preparatların hazırlanması. İdeal olarak, bir 100X, 1.4 veya daha yüksek sayısal açıklık (NA) yağ daldırma objektif lens, 12 veya 16-bit kamera ve uyarma / emisyon filtreleri ile görüntü hücreleri GFP floresan için optimize edilmiş.
NOT: kullanan hücreler o çizgiler büyüdüğü takdirdena plaka, bir kapak kayma taze YNB orta 3 ul koyarak slayt hazırlamak. Bir pipet kullanarak, plakadan hücrelerin küçük koloni toplama YNB ortama hücreleri dağıtmak ve görüntüleme hemen önce bir cam lam üzerine elde edilen süspansiyon monte edin. - Görüntü bir deney içindeki tüm görüntüler için aynı satın alma parametreleri (örneğin, filtre setleri ve maruz kalma süresi) ile her bir durum için hücrelerin 4-6 rastgele alanlar.
NOT: her alan için bir aydınlık ya da DIC görüntü Toplama pHluorin sinyali MVB ve vakuoler bölümlerinde söndürülür hücreleri için yararlı olabilir. - her bir durum için, en az 30-50 hücrelerin floresans yoğunluğunu ölçülmesi (protokol 5).
Ayarlı endositoza uğrayabilmektedir kargoların endositozun Niceleme 3. Kinetik Testi
- metionin yoksun YNB ortamın 5 ml maya hücreleri (koloni başına çap olarak yaklaşık 2 mm) 2-3 koloniler inoküle ekleyinPlazmid seçimi muhafaza etmek için itional amino asitler ya da besin. çalkalanarak 30 ° C'de 16-24 saat boyunca kültürler büyütün.
NOT: Bu yazıda, düzenlenmiş endositik kargo proteinleri çalışmak için protokoller metiyonin permease, Mup1 kullanımı yapacak. düzenlenmiş endositoza uğrayabilmektedir diğer yükler de pHluorin ile etiketleme için uygundur (örneğin, urasil yokluğunda plazma membranında birikir ve Fur4 permeaz urasil, harici urasil uygulanan tepki olarak içselleştiren); Bu kargolar için, medya koşulların bu yükler için özel anlatım, indüksiyon ve içselleştirme koşullarını yansıtacak şekilde modifiye edilmelidir. - Yaklaşık 3 saat görüntüleme önce her gecede kültür yoğunluk (OD 600) ölçün. Plazmid bakım metiyonin ve ilave amino asitler ya da besin eksik YNB ortamında 0,35-0,4 OD 600 / ml'de 5 ml'lik bir seyreltme hazırlayın ve çalkalanarak 30 ° C'de büyütülmüştür.
- Mikrolara önceden dengeyeAdım 3.2 3 saat inkübasyon sırasında 30 ° C çevre odasını veya ısıtmalı sahne (varsa) baş.
- Transferi 2 dakika boyunca 8.000 rpm'de (6,800 xg) 1 kadar bir mikrofüj tüpüne hücre kültürünün mi, ve pelet hücreleri. süpernatan 975 ul çıkarın.
- görüntüleme (protokol 1.2) için bir ConA ile tedavi edilen, 8-iyi cam tabanlı bölme slayt hazırlayın.
- her bir plazmid seçimi için metiyonin ve ilave amino asitler ya da besin eksik YNB ortamı 200 ul ekle. Kalan süpernatant adım 3.4 den hücre pelletini ve her bir merkezi haline hücre süspansiyonu 2.5 ul bırakın. aşağı yukarı pipetleme kuyu yüzeyinde hücreleri dağıtmak ve hücreler 5-10 dakika yerleşmek için izin verir.
- 30 ° C (adım 3.3) dengelenmiş bir ters floresan mikroskop odası slayt yerleştirin. aydınlık aydınlatma kullanarak hücrelerin bir alan bulun.
- 100 ug / ml metionin ihtiva eden YNB ortamı 50 ul ekle20 ug / ml'lik bir son konsantrasyon elde etmek için metionin kuyudaki ortam 200 ul (30 ° C'ye kadar önceden ısıtılmış). alt yüzer hücreler önlemek amacıyla kuyudaki ortam bozmamak.
- Hücreler görüntüleme başlamadan önce 2 dakika süreyle dengelenmeye bırakın. Hemen ilk fotoğraf çekiminden önce, istenen odak düzlemine mikroskop ayarlamak (genellikle, bir ekvatoral odak düzlemi en iyi şekilde çalışır).
- GFP filtre kullanarak (örneğin bir zaman serisi içindeki tüm görüntüler için, 100X 1.4 NA immersiyon yağı hedefi ve 500 msn edinme zamanı aynı edinme parametreleri kullanılarak, 45-60 dakika süreyle 100 5 dakika aralıklarla GFP ve aydınlık (veya DIC) görüntüler elde msn alma süresi DIC filtre kullanarak).
NOT: mikroskop sahne ve görüntüleme yazılımı odak düzlemi sürüklenme otomatik olarak düzeltilmesi için izin vermezseniz, elle her bir görüntüleme zaman noktası öncesinde odağı yeniden ayarlanması gerekebilir. Ayrıca, satın alma süreleri olacaknedeniyle aydınlatma ve filtreler farklılıklara mikroskoplar arasında değişir ve en iyi şartlar deney başlamadan önce manuel olarak belirlenmelidir. Mup1 dışında bir endositik kargo kullanılırsa, yükün içselleştirme kinetiklerini yansıtmak için, elde etme süresi ve görüntüleme aralıkları, hem de deney süresini değiştirmek için gerekli olabilir. - Her bir zaman noktasında tek tek hücrelerin floresans yoğunluğunu ölçülmesi (protokol 5) ve birinci görüntünün ilk yoğunluğu yüzdesi olarak değerleri ifade eder.
Ayarlı endositoz GeçecekANKARA Endositik Cargos Niceleme 4. Endpoint Testi
- protokol 3'te tarif edildiği gibi görüntüleme için hücrelerin hazırlanması (3.6 ile 3.1 adım).
- Görüntü hemen aydınlık ve GFP filtre setleri kullanılarak, metionin eklemeden önce her bir durum için hücrelerin 4-5 rastgele alanlar.
- 100 ug / ml metionin ihtiva eden YNB ortamı 50 ul ekle (savaş öncesikuyudaki ortam 200 ul), 30 ° C'ye kadar Med 20 ug / ml'lik bir son konsantrasyon elde etmek için metionin. alt yüzer hücreler önlemek amacıyla kuyudaki ortam bozmamak.
- 0 dakika zaman noktası (aşama 4.2) aynı edinim koşulları kullanıldığında metiyonin ilave edildikten sonra hücreler resmi 4-5 rastgele alanları 30 dakika.
- Her bir zaman noktası için, en az 30-50 hücrelerin floresans yoğunluğunu ölçülmesi (protokol 5). formülü kullanarak 30 dakika sonra içselleştirilmiş Mup1-pHluorin yüzdesi olarak ifade değerler: - x% 100 [0 dak ortalama yoğunluğu] / [30 dk yoğunluğunu ortalama 0 dk yoğunluğunu ortalama].
NOT:. Aynı anda her testin başlangıç zamanını şaşırtıcı sekiz uç noktaları deneyleri kadar gerçekleştirmek mümkündür Tablo 3 sekiz eşzamanlı deneyleri için örnek iş akışı sağlar.
5. Post-satın alma Analizi
- 1 olarak satın alma yazılımı ihracat görüntüleri6-bit etiketli görüntü dosyası biçimi (.tif veya .tiff formatında).
Not: Diğer dosya formatları da uygun olabilir ve ideal kayıpsız sıkıştırma algoritmaları kullanmak gerekir. 8-bit görüntüler, genel olarak ölçümü için uygun değildir. - varsa ( 'Dosya' menüsünden 'Aç' seçeneği serbestçe kullanılabilir ImageJ yazılımı (kullanarak açık dosyaları. ölçümü için floresan görüntü kullanın ve bir referans olarak aydınlık / DIC görüntü hücrelerinin yerini belirlemek ve ölü hücreleri hariç ), DIC tarafından görüntülenen ve GFP uyarma / emisyon filtreleri ile bakıldığında autofluorescent olan canlı hücreler daha koyu görünür hangi.
- floresan görüntü bir arka plan çıkarma gerçekleştirin. dengesiz bir arka plan sinyali ile görüntüler için, 'İşlem menüsünden' bulundu 'Arka Plan Çıkarma' algoritmasını kullanır. Miktar belirleme amaçları için genellikle yeterli olmaktadır varsayılan ayarı (50 piksel top yarıçapı haddeleme) kullanın.
Not: Alternatif bir backgroüniforma arka plan ile görüntüler için und çıkarma yöntemi adım 5.3.1.-5.3.2 anlatılmıştır; Bununla birlikte, yukarıdaki yöntem, homojen bir arka plan için de kullanılabilir.- Üniforma kökenli görüntülerde (yani, arka plan yoğunluğu tüm kenarlarda ve görüntünün merkezine yaklaşık sabittir), manuel arka plan çıkarma işlemleri. Ana ImageJ penceresinde bulunan 'serbest Seçmeler' butonuna tıklayın, ve hücreleri içermeyen görüntü içinde 3-5 rastgele bölgeleri seçin.
- 'Analiz' menüsünde bulunan 'Set Ölçümler' işlevini açın 'Mean Gray Değer' parametreyi seçin ve (aynı zamanda 'Analiz' menüsünde bulunur) 'Tedbir' fonksiyonunu kullanarak yoğunluk değerlerini ölçmek. 3-5 ölçülen bölgelerden ortalama değerini hesaplayın ve bu görüntüdeki sonraki tüm ölçümlerden çıkarılır.
- Kinetik deneyler ölçümü için (protokol 3), Tim için tek bir yığın görüntü oluşturmakE serisi. kronolojik sırayla her zaman noktasından floresan görüntüleri açın ve (Yığınlar alt menüsü altındaki 'Resim' menüsünde bulunan,) işlevini 'Stack Görüntüler' kullanarak bir yığın oluşturur.
- mümkün olduğunca hücre dışında tüm hücre ama küçük alanı da kapsayacak şekilde emin, serbest seçim aracını kullanarak bir hücreyi Anahat.
- Aşağıdaki parametreleri ölçün: 'Alan, Entegre Yoğunluk' ve 'Mean Gri Değeri'. 'Analiz' menüsünde bulunan 'Set Ölçümler' fonksiyonunu kullanarak seçiniz parametreleri.
NOT: Entegre Yoğunluk seçilmiş bölge içindeki tüm piksel yoğunluğunun toplamına karşılık gelir ve ortalama Gri Değer hücre boyutu yoğunluk değerlerini düzeltir [Entegre Yoğunluk / Alan], karşılık gelir. - 'Araçlar' alt menüsü altındaki 'Analiz' menüsünde bulunan YG Yöneticisi 'açın. ROI Manager penceresinde vurgulanır regio girmek için 'Ekle' butonuna tıklayınn faiz (ROI) yeni bir bölge olarak.
- Tekrarlayın görüntüde kalan hücreler için 5.6 ile 5.4 arasındaki adımları. Ve görüntünün kenarına dokunacak herhangi bir hücre; aydınlık / DIC ve floresan (Şekil 2F bkz ölü hücreler DIC görüntülerde koyu görünür ve GFP uyarma / emisyon ile inceledi autofluorescent sitoplazmik sinyal var) tarafından değerlendirilen herhangi bir ölü hücreleri hariç. YG Yöneticisi 'penceresinde' Diğer 'düğmesini tıklayarak .zip dosyası olarak seçilen ROI'ları kaydedin ve bir elektronik tablo veya istatistiksel analiz yazılımı tüm ölçümleri ihracat.
- Kinetik tahliller miktarının (protokol 3) için, anahat ve adımları 5.4 ve 5.5 açıklandığı gibi ilk zaman noktasından bir hücreyi ölçün. Deneyde sonraki tüm zaman noktalarında ölçülmesi için aynı ROI kullanın.
- Son nokta tahlilleri (protokolleri 2 ve 4), her bir durum için 30-50 hücre ölçüldüğünde en az. En az 2-3 görüntüler için ölçümü gerçekleştirin ve her tüm hücreleri dahilanalizinde adım 5.8 belirtilen kriterlere uygun görüntüsü.
- Post hoc analiz için Tukey çoklu karşılaştırma testi ile takip tek yönlü ANOVA kullanılarak numuneler arasındaki istatistiksel anlamlılık değerlendirin.
Akış Sitometrisi ile Mup1-pHluorin endositozun 6. Nüfus Analizi
- metionin ve plazmid seçimi muhafaza etmek için ilave amino asitler ya da besin eksik YNB 0.5 ml ortamda maya hücrelerinin (koloni başına çap olarak yaklaşık 2 mm) 2-3 koloniler inoküle. bir silindir tamburu üzerinde, 30 ° C'de 16-24 saat boyunca 5 ml yuvarlak tabanlı tüplerde hücreleri büyütün.
- Plazmid bakım metiyonin ve ilave amino asitler ya da besin eksik YNB ortamın 1.5 ml ilave edilir, ve bir silindir tambur üzerinde, fazladan bir 3 saat boyunca 30 ° C'de büyütülmüştür.
- Aktarım iki adet 5 ml'lik yuvarlak dipli tübe hücre 1 mi. İlk tüp (Met koşul) için YNB Met orta 0.25 ml ekleyin ve YNB ortamı 0.25 ml 100 ug içeren/ Ml ikinci tüpe metionin 20 ug / ml (+ Met durum) bir son metionin konsantrasyonu elde edildi. bir silindir tamburu üzerine, 45 dakika boyunca 30 ° C'de inkübe hücreleri.
- Yük içselleştirme bir ölçüsü olarak, floresanlı bir izotiyosiyanat (FITC) filtresi bir hücre boyutu ölçümü ve Mup1-pHluorin floresan yoğunluğu olarak ortaya dağılım (FS) seçerek, akış sitometrisi ile analiz hücreleri.
- Kullanılan maya hücrelerinin boyut aralığı ve floresan yoğunluğu için algılama optimize etmek için FS ve FITC kanallarının voltajını ayarlamak için kaydırıcı düğmelerini kullanın (Bu deneyler için kullanılan ayarlar FS 50 V ve FITC için 400 V idi).
Not: her iki kanal için gerilim kullanılan akış sitometresi bağlı olarak değişecektir. Bu adım, daha önce ya da metionin (adım 6.3) ile 45 dakika işlemi sırasında yapılmalıdır. - yüksek akış hızı ayarı kullanarak, her bir durumda 10.000 hücreleri için FS ve floresan yoğunluğu ölçmek. fluo karşı FS bir dağılım grafiği oluşturmakyoğunluğu rescence: 'grafiği eklemek tıklayın FITC (x-ekseni) ve FS (y-ekseni) seçin ve grafik 1.000 puan (yazılım 10,000 hücre ölçüldü olsa bile, 1000 hücreleri değerlerini gösterecektir).
NOT: maksimal tutarlılık için, hücreler metiyonin ilave edildikten sonra 45-50 dakika analiz; örneklerin çok sayıda içeren deneyler için, akış sitometri analizi için gerekli zamanı karşılamak için metionin ilave yalpalayarak. - Bir kontrol olarak, vahşi tip (WT) hücreler için Met ile + Met koşulları içerir. kapı fonksiyonunu kullanarak, parlak hücrelerin yaklaşık% 5'i kapısının sağında düşmek öyle ki, WT + Met koşulunu kullanarak dikey bir kapı atayın. deneyde tüm diğer koşullar için bu yolluk kullanın.
Sonuçlar
Yapısal içselleştirilmiş endositik kargo protein ste3 kararlı hal lokalizasyonu ve miktar
canlı hücreler, ste3, maya a-faktör feromon alıcısının sitoplazmik bir C-terminal kuyruğu kimerik GFP ve pHluorin füzyonları lokalizasyonunda pHluorin-etiketli yükler endositoz ölçümü için kullanılabileceğini göstermek için, karşılaştırıldı. Ste3 kurucu bozulması 28 için vaküole, plazma zarına taşınmaktadır içselleştirilir ve hedeflenen bir G-protein kenetli reseptör (GPCR) 'dir. Ste3-GFP (Şekil 2A) ifade eden vahşi tip (WT) hücrelerinde görüldüğü gibi Böylece kararlı durum koşulları altında, ste3 çoğunluğu, koful lümene lokalize eder. Bunun aksine, dört klatrin bağlayıcı adaptör proteinler Ent1, Ent2, Yap1801 ve Yap1802 (şifreleyen genleri eksik olan hücreler ent1 Δbundan sonra 4Δ olarak anılacaktır ent2 Δ yap1801 Δ yap1802 Δ) endositoz 29 bölgelerinde Klatrin stabilize başarısız ve CME 30 ciddi bozuk. 4Δ hücreleri canlılığı 30,31 için epsin Ent1 ya Ent2 ya N-terminali homolojisi (coşkuyuŞhşarı) etki ekspresyonunu gerektirir. Ent1 (Şekil 2A) 8,30 arasında coşkuyuŞhşarı alan ifade 4Δ + ENTH1 hücrelerinde plazma membranında ste3-GFP tutma ile gösterildiği gibi coşkuyuŞhşarı alan, 4Δ hücrelerinde endositoz için yeterli değildir; 4Δ + ENTH1 hücreleri içindeki plazma zarı sabitleme Ste2-GFP (α-faktörü feromon alıcısı) ile Mup1-GFP veya Mup1-pHluorin (bir metionin permeaz) 8,18 dahil olmak üzere diğer endositik yükler için gözlenmiştir. Bunun aksine, 4Δ hücrelerinde, bir plazmid (4Δ + Ent1) için tam uzunlukta bir Ent1 ekspresyonu vaküole endositoz ve ste3-GFP lokalizasyonunu yükler. 4Δ + ENTH1 hücreleri geçenlerde i kullanıldına genetik ekran kullanır mayada CIE yolu belirlemek için, aktin-modüle GTPaz Rho1 ve GEF, ROM 1, hem de formin Bni1 ve kargo 8,18 sıralama içinde yer alan proteinlerin α-arrestin ailesinin üyeleri. Ste3-GFP (Şekil 2A) içselleşmesini geliştirilmiş 4Δ + ENTH1 hücrelerde yüksek kopya plazmid bir CIE rolü, ifade ROM 1 ya da α-arrestin LDB19 tutarlı.
Ste3-GFP veya diğer GFP etiketli endositik yüklerin ifade Hücreler birikimi ve GFP etiketi proteolitik direnç nedeniyle parlak vakuoller var. Bunun aksine, ste3-pHluorin ifade eden hücreler, asidik ortamlarda 20 nedeniyle pHluorin etiketin soğutulması için vakuolar floresan çok düşük seviyelerde mevcuttur. Daha önce gördüğümüz gibi, VT ve 4Δ + Ent1 hücrelerinin floresan mikroskobu (Şekil 2B) ile çok az algılanabilir ste3-pHluorin gösterdi. Bunun aksine, ste3-pHluorinvakuolar ste3-pHluorin her durumda neredeyse bulgulanamaz kalırken, 4Δ + ENTH1 hücrelerin plazma membranında hali hazırda bulgulanabilir olmuştur. Vakuolar ste3-pHluorin tüm olgularda neredeyse belirlenemeyen kalmasına rağmen ROM1 veya LDB19 yüksek kopya ifadesi ste3-GFP ile sonuçlarına benzer hücre yüzeyinde en saptanabilir ste3-pHluorin miktarı azalır.
GFP- ve etkinliğini karşılaştırmak hücre endositik kapasitesindeki değişiklik ölçülmesi için bir araç olarak yüklerin pHluorin-etiketli, ste3-GFP ve ste3-pHluorin tüm hücre floresan WT ve 4Δ hücrelerinde ölçülmüştür. Ste3-GFP lokalizasyonunu değişiklikler mikroskobu (Şekil 2A) ile kolayca tespit edilebilir olmasına rağmen, genel olarak floresan yoğunluğundaki farklılıklar WT, 4Δ + Ent1 ve boş vektör (Şekil 2C), 20 ile transforme 4Δ + ENTH1 hücreleri arasındaki istatistiksel olarak anlamlı değildir. LikewisE, Vector, ROM 1 ve LDB19 ile transforme 4Δ + ENTH1 hücreleri içindeki tam-hücre floresan yoğunlukları vardı. Özellikle, ROM 1 ya LDB19 ile transforme 4Δ + ENTH1 hücreleri WT hücreleri (Şekil 2C) 8,18 önemli ölçüde daha sönük edildi; immunoblotting (Şekil 2E) ile değerlendirildiği gibi, ancak ste3-GFP protein seviyeleri benzerdi. Yoğunluğundaki farklılık vakuol boyutu veya morfolojik değişimler kısmen veya vakuol GFP etiketin tutma farklılıklara bağlı olsa da, ste3-GFP floresan ölçümü (Şekil floresan mikroskobu altında gözlemlenebilir lokalizasyon değişiklikleri yansıtmıyor Şekil 2A). Bunun aksine, ste3-pHluorin yoğunluğunun ölçümü vektörü ile transforme 4Δ + ENTH1 hücreleri wt ya da 4Δ + Ent1 hücrelere göre önemli ölçüde daha parlak olduğunu göstermiştir ve ROM 1 ya 4Δ + ENTH1 hücrelerinde LDB19 yüksek kopyalama ekspresyonu ste3-pHluorin yoğunluğu azaltılmışWT ve 4Δ + Ent1 (Şekil 2B) benzerdi seviyeleri. Böylece, kararlı hal ste3-pHluorin yoğunluğu ölçümü doğru floresan mikroskobu ile gözlenen lokalizasyon farklılıkları yansıtmaktadır.
Düzenlenmiş endositik kargo, Mup1 kullanarak Kinetik içselleştirilmesi deneyleri
Kararlı durumda yapısal içselleştirilmiş kargolar için floresan yoğunluğu Niceleme WT hücrelere kıyasla mutant hücrelerin endositik kapasitesi farklılıkları ortaya çıkarabilir. Ancak, bazı kargolar mutant hücreler kargo içselleştirilmesi için endositoz veya daha yavaş kinetik bir gecikme olsa bile, WT ve endositik mutant hücreler aynı kararlı durum dağılım ve yoğunluk ulaşmak mümkündür. Belirli bir uyarıcı ya da liganda yanıt olarak ayarlanır endositoza uğrayabilmektedir Bunun yerine, pHluorin-etiketli yüklerin izlemek için kullanılabilirendositoz kinetiği. Bu amaçla, yüksek afiniteli metionin permeaz, Mup1, bir içselleştirme 32 izlenmiştir. hücre-dışı metionin yokluğunda, Mup1 sentezleme yukarı regüle edilir ve permeaz plazma membranında tutulur; ortama metionin eklenmesi üzerine, Mup1 hızlı internalizasyonundan ve vakuol 13 hedefleme maruz kalır.
Mup1 içselleştirme kinetiğini takip etmek için, genomik lokus Mup1-GFP veya Mup1-pHluorin ifade WT suşları plazma membranında (Şekil 3A, 0 dakika zaman noktası) flüoresan Mup1 biriktirmek için metionin yokluğu içinde büyütülmüştür. Hücrelerin Time-lapse görüntüleme sonra kargo içselleştirme ve floresan değişiklikleri izlemek için yokluğunda veya metionin varlığında 5 dakika aralıklarla yapıldı. Beklendiği gibi, metionin olmadan görüntülenmiş GFP- ve pHluorin etiketli Mup1 plazma zarı f kalmıştırya da tüm 45 dk gözlem süresi 20. Bunun aksine, metionin varlığında görüntülü hücreler kargo içselleştirme tutarlı hücre yüzeyinden floresans sinyalinin gittikçe azalmasına gösterdi. Özellikle, Mup1-GFP floresan Mup1-pHluorin olasılıkla erken endozomlardan karşılık iç punctae lokalize, ancak vakuol görülmedi ise iç yapılarının (yani, endozomlar ve vakuol) birikmiş.
Floresan tek tek hücrelerin seyahati zaman noktalarındaki miktarı zaman, Mup1-GFP ve Mup1-pHluorin yoğunluğu stabil olarak, plazma zarında lokalize olmuş kalan protein ile tutarlı 45 dakika deney sırasında dıştan uygulanan metionin olmadan çok az değişiklik gösterdi (Şekil 3B). Buna karşılık, bütün hücre Mup1-pHluorin yoğunluğu hızla metionin varlığında azalmış bu fluorescenc% 50 azalma olduğue yoğunluğu yaklaşık 20-25 dakika sonra gözlendi ve% 80 azalma sonra yaklaşık 40 dakika 20 gözlendi. Mup1-GFP hücreleri de metioninin eklenmesi üzerine flüoresans yoğunluğunda bir azalma olduğunu gösterdi; Bununla birlikte, floresans kaybı kinetiği yoğunluğunda% 50 azalma, sadece 40 dakika sonra gözlemlenmiştir şekilde Mup1-pHluorin kişilerce göre gecikmeli. Şekil 3A'da görüldüğü gibi, Mup1-GFP Kalıcı vakuolar GFP floresans hücre yüzeyinde endositik olayların doğru kantifikasyon önlediğini gösteren bu zamanda plazma membranında sonrasında ancak dedekte edilebilmiştir.
Düzenlenmiş endositik kargo, Mup1 kullanarak uç nokta deneyleri
yukarıda tarif edildiği gibi endositoz kantitatif kinetik tahlillerine ek olarak, örneğin Mup1 olarak düzenlenmiş endositik yükler de miktar benzer uç nokta tahlilleri için kullanılabilirkararlı durum ste3-pHluorin yoğunluk. Bu amaçla, Mup1-pHluorin içselleştirme ölçümü için deney metionin 8,18 ilave edildikten sonra 30 dakika ya da hemen önce görüntülü hücre popülasyonlarından ortalama floresan yoğunluklarının karşılaştırma yapmak için modifiye edilmiştir. Bu yaklaşım WT ve endositik mutant hücreler arasında içselleştirilmiş Mup1 yüzdesi karşılaştırılmasına olanak sağlar.
Kinetik tahlilin sonuçları ile uyum (Şekil 3) 'de, Mup1-pHluorin hızlı Mup1-pHluorin yaklaşık% 60 metionin ilave edildikten sonra 30 dakika özümsendiğini şekilde WT hücreleri (Şekil 4A), plazma zarı (arasında tükenmiş Şekil 4B). Beklendiği gibi içselleştirme anlamlı endositoz ciddi bir kusuru ile tutarlı 4Δ + ENTH1 hücrelerinde azalmış iken, Mup1-pHluorin internalizasyonunu 4 + Ent1 hücrelerinde benzer şekilde etkili oldu. Yüksek kopya ifadeROM 1 ya da spesifik olarak, her iki CME ile Mup1 içselleştirme için gerekli olan α-arrestin LDB19 ve CIE'nin 4Δ + ENTH1 hücreleri 18 endositoz teşvik etme kabiliyetleri ile tutarlıdır Mup1-pHluorin bölgesinin 13,18, gelişmiş içselleştirme, geçiş yolu. 4Δ + ENTH1 hücrelerinde kararlı hal ste3-pHluorin yoğunluğu yüksek kopya ROM 1 ifade eden ya da LDB19 wt ya da 4Δ + Ent1 hücrelerinden ayırt olmasına rağmen Özellikle, Mup1-pHluorin bölgesinin içselleştirme kısmen yüksek kopya ifade 4Δ + ENTH1 hücrelerde gelişmiş olduğu ROM 1 ya LDB19 (Şekil 4C). Böylece, bu veriler kinetik ve / veya bitiş noktası analizleri diğer kargolara benzer kararlı durum dağılım aynı suşlar elde edilebilmesine rağmen, bazı kargolar için WT ve mutant suşlar arasındaki endositik oranlarındaki farklılıkları ortaya çıkarabilir göstermektedir.
Mup1-PHL Nüfus tabanlı analiziçselleştirilmesi uorin akış sitometri kullanılarak
mikroskopi ile kargo içselleştirilmesi için kinetik ve uç nokta deneyleri gerçekleştirmek için bir alternatif sağlayabilir akış sitometri kullanarak hücrelerin büyük nüfus yüksek verimlilik analizi. Bu amaçla, Mup1-pHluorin floresans yoğunluğu ( "parlak" olmalıdır WT MET) metionin olmadan büyütülmüş bir kültür ya da 45 dakika boyunca metiyonin mevcudiyetinde (WT + Met WT hücrelerde karşılaştırılmıştır, bu olarak Şekil 3B'de görülen floresan% 80 azalma) göre muamele edilmemiş hücreler ile karşılaştırıldığında "dim" olmalıdır. Sitometrisi dikey kapı hücrelerinin ~% 5 kapısının sağ tarafında yer alan ve nüfusun (Şekil 5A ve 5B içinde parlak hücrelerin karşılık edildi WT + Met durumda, tatbik edildi akışı ile analizi sonucunda kırmızı nüfus). Aynı kapısı uygulandığındaWT Met şart, hücrelerin yaklaşık% 65 olduğu akış sitometrisi hali hazırda daha önce ve metiyonin ilave edildikten sonra hücre popülasyonları arasında Mup1-pHluorin floresan farklılıkları dikkate için kullanılabilir gösteren parlak kategori içine düştü. Buna karşılık, loş hücrelerin karşı parlak dağılımı bozuk endositoz ile tutarlı WT + Met nüfus uygulanan aynı kapısı kullanılarak 4Δ + ENTH1 Met ve + Met koşullarında farksızdı. Böylece, hücrelerin endositik kapasite değişiklikleri algılayabilir flow sitometri ve hücre geniş popülasyonların hızlı analiz izin verir. Önemlisi, sitometri de sıralama ve kusurlu endositoz mutant hücrelerin seçimi için bir araç olarak genetik ekranlarında kullanılabilir akış (K. Wrasman ve B. Wendland, lığa) 33.
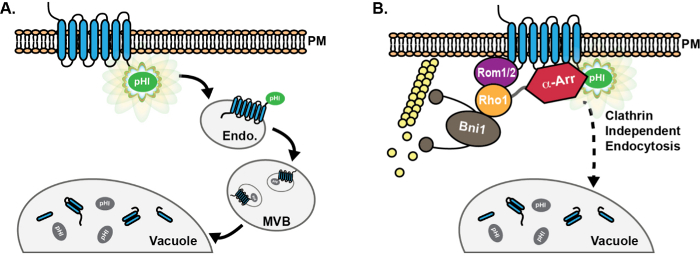
Şekil 1: endositik yolu aracılığıyla pHluorin etiketli kargo ilerlemesi şematik. (A) pHluorin (PHL) kimerik füzyon plazma membranında kargo saptanabilir floresan (yeşil) endositik kargo proteinleri sonuçlarının sitoplazmik kuyruk etiketi (PM ). endositoz sonra, Yük proteinleri pHluorin etiketi sitoplazmaya maruz bırakılır ve bu şekilde floresan kalır erken endozoma (Endo), teslim edilir. Daha sonra, ESCRT makineleri multiveziküler organları (MVB) luminal veziküller içine kargo sıralama ve katılmasını teşvik eder. MVBs sonra bozulması için proteinler ve membran bileşenleri sunmak için vakuol ile sigorta. MVBs içine dahil edildikten sonra, pHluorin etiketi asitlenme nedeniyle (gri) söndürüldü olur. PHluorin etiketli kargoların (B) kullanın mayada bir Klatrin bağımsız endositik (CIE) yolunda yer alan proteinlerin keşif ve karakterizasyonu kolaylaştırmıştır. Arızalı klatrin aracılı endocytos olan hücrelerdeYüksek kopya GTPaz Rho1 ekspresyonu yanı sıra aktive GEF ROM 1, bir CIE 8 yoluyla kargo içselleştirme teşvik eder. Proteinlerin α-arrestin aile (α-Varış) CME 13-17 yoluyla kargo ubikitinasyona ve içselleştirilmesi teşvik roller bilinen olmasına rağmen üstelik, CIE içinde α-arrestins rolleri son zamanlarda nedeniyle CIE proteinleri ziyade ile etkileşimi, büyük olasılıkla tespit edilmiştir ubikitin işe 18 ligaz yoluyla. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
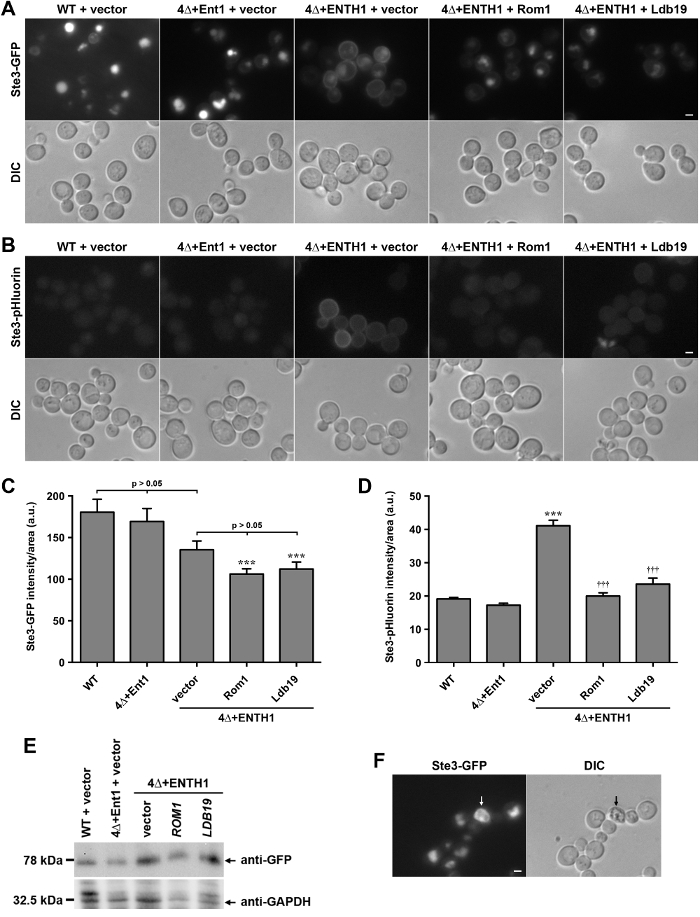
Şekil 2:. Yabani tip ve endositik mutan hücrelerde ste3-GFP ve ste3-pHluorin lokalizasyonu ve miktar tayini (A) WT 4Δ + Ent1 ve 4Δ + ENTH1 hücreleri genetik olarak ste3-G şifrelenmiş tanımlayıcıAP ve floresan mikroskobu (üst sıra) veya DIC (alt sıra) ile görselleştirilmiştir gösterildiği gibi, vektör, bir yüksek kopya ROM 1 veya yüksek kopya LDB19 ile transforme. Ste3-GFP görüntüleri ste3 lokalizasyonu doğrudan karşılaştırılmasına izin aynı maksimum ve minimum yoğunluklarının ayarlandı. Genomik kodlanan ste3-pHluorin eksprese (B), WT, 4Δ + Ent1 ve 4Δ + ENTH1 hücreleri transforme ve panel A'da açıklandığı gibi görüntülenmiştir. Ölçek çubuğu = 2 mikron. (C, D) ste3-GFP (C) ve ste3-pHluorin (D) floresan yoğunluğu ölçümü her bir durum için, paneller A ve B'de kullanılan suşlar, bütün hücre floresan 40 hücrelerinin en az nicelleştirilmiştir. Değerler, hücre boyutu için düzeltildi ve ortalama ± SEM olarak rasgele birimi (AU) olarak ifade edildi (*** p <0.001 ila göre, ††† p <0.001 4Δ + ENTH1 + vektörüne göre). (E) Relativbelirtildiği gibi WT, 4Δ + Ent1 ve 4Δ + ENTH1 hücrelerinde değerlendirildi ste3-GFP e ifade vektörü, yüksek kopya ROM 1 veya yüksek kopya LDB19 ile transforme. Daha önce tarif edildiği gibi, 20 hücre özleri hazırlandı ve her bir numune eşit miktarlarda, SDS-PAGE ile çözüldü. Ste3-GFP tanımı anti-GFP antikorlar ile immunoblotting ile değerlendirilmiştir, ve protein yükleme anti GAPDH kullanılarak değerlendirildi. (F) ste3-GFP oklarla gösterilen ölü hücre ile, floresan mikroskobu (ste3 GFP panel) ve DIC optik tarafından izlendi genomik kodlanan ifade Yabani tip hücreleri. Ölü hücreler GFP filtresi autofluorescent görünür ve DIC tarafından bakıldığında koyu vardır. Ölçek çubuğu = 2 mikron. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Şekil 3:. Mup1-GFP ve Mup1-pHluorin içselleştirme kinetik deney (A), yabani tip hücrelerin genetik olarak orta logaritmik faza büyütülmüştür Mup1-GFP (Üst iki panel) ya da Mup1-pHluorin (alt iki panel) şifrelenmiş tanımlayıcı plazma membranında Mup1 ifade ve tutma ikna etmek metionin eksik YNB orta. (- Met) ya da varlığında (+ Met), 20 ug / ml Metionin Daha sonra hücreler flüoresans mikroskopisi ile yokluğunda her bir 5 dakika görüntülendi. bir durumun her bir zaman noktası için, denk maksimum ve minimum yoğunluk değerleri floresan yoğunluğu ve yerelleştirme karşılaştırma yapmak için uygulanmıştır. Tüm koşullar için belirtildiği gibi 0, 5, 10, 20 ve 40 dakika zaman noktalarında gösterilmiştir. Ölçek çubuğu = 2 mikron. Panel A doğal tipte hücrelerde Mup1-GFP (B) Niceleme ve Mup1-pHluorin içselleştirme. ya Mup1-pHluo - (+ Met mavi elmas Met, mor kareler) Mup1-GFP Tüm hücre floresan yoğunluğurin (- Met, yeşil üçgen + Met, kırmızı daireler) 5 dakika aralıklarla görüntülü tek tek hücreler için ölçülen ve başlangıç floresans yoğunluğu yüzdesi olarak ifade edilmiştir (ortalama ± SEM, n = koşul başına 6 hücre). Prosser et al yayımlanmaktadır. Yayıncının izni ile (2010) 20. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
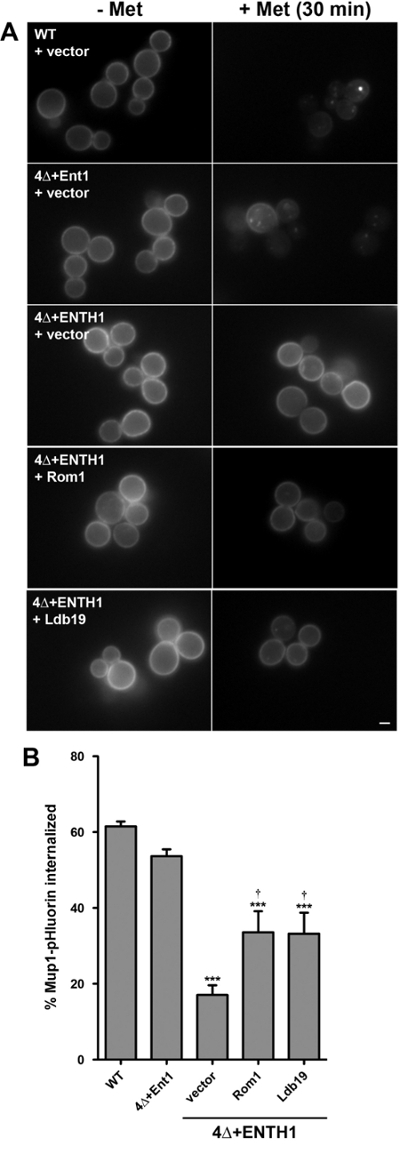
Şekil 4:. Mup1-pHluorin içselleştirme uç nokta deneyi (A) WT 4Δ + Ent1 ve 4Δ + ENTH1 hücreleri genetik olarak Mup1-pHluorin kodlanan ve orta büyütülmüştür gösterildiği gibi, vektör, bir yüksek kopya ROM 1 veya yüksek kopya LDB19 ile transforme eksprese YNB ortamı yoksun metiyonin -logarithmic aşaması. hücrelerin rastgele alanları fluorescenc ile görüntülendi (- Met) e hemen önce mikroskopi ya da 20 ug / ml metionin (± Met) ilave edildikten sonra 30 dakika. Tüm görüntüler aynı maksimum ve minimum yoğunluk değerlerine ayarlandı. Ölçek çubuğu = 2 mikron. Panel A hücrelerde Mup1-pHluorin içselleştirme (B) belirlenmesi. Her durum için, bütün hücre floresan yoğunluğu 40 hücrelerinin en az ölçülmüş ve hücre boyutu için düzeltildi. içsel Mup1-pHluorin yüzdesi önce ve metiyonin ile 30 dakika işlemden sonra yoğunluğu ortalama değerleri karşılaştırılarak hesaplandı. (*** P <0.001 ila göre, 4, n = 4Δ + ENTH1 + vektörüne göre † p <0.05) değerleri, ortalama ± SEM olarak gösterilmiştir. Bu rakam, Prosser ve ark modifiye edilmiştir. Yayıncının izni ile (2015) 18. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
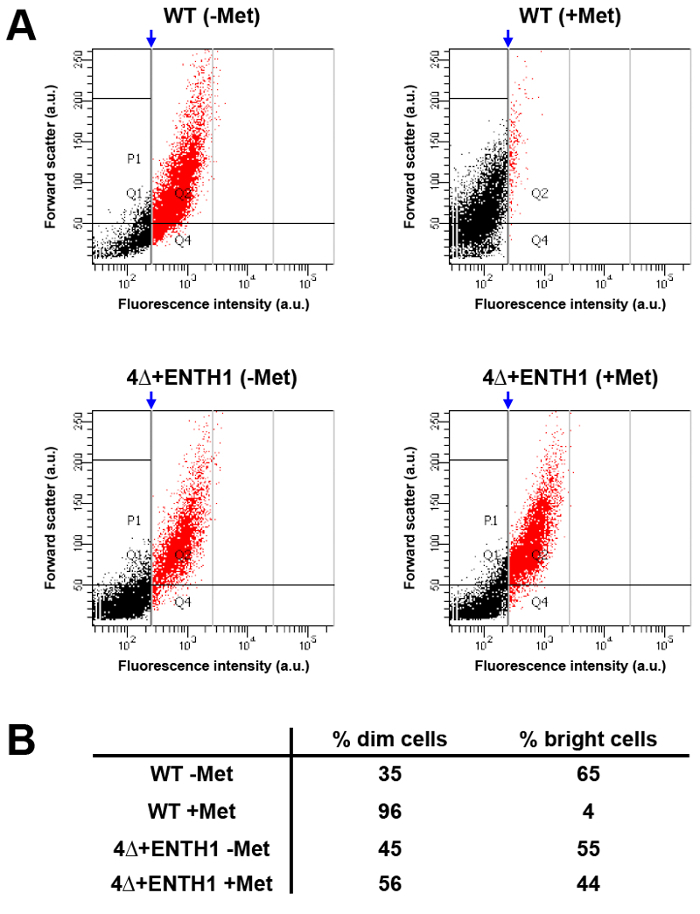
Şekil 5:. Akış sitometrisi ile Mup1-pHuorin içselleştirme nüfus analizi (A) VT ve 4Δ + ENTH1 hücreleri bir kez metioninin yoksun YNB ortamında orta logaritmik faza büyütülmüştür. akış sitometrisi ile analizden önce 45 dakika boyunca 20 ug / ml metionin ya da varlığında (+ Met) - (Met) sonra hücreler yokluğunda inkübe edildi. Her durum için, (keyfi birim, au) öne dağılım ölçülen 10,000 hücre toplam üzerinden 1000 hücreleri için (bir FITC filtresi kullanılarak, AU) floresan yoğunluğu karşı çizilmiştir. Popülasyonları daha (kırmızı ile gösterilen) parlak hücrelerin yaklaşık% 5'i kapısının sağ tarafında düştü WT + Met durumuna, dikey bir kapı (mavi ok) uygulanarak analiz edilmiştir. WT + Met durum için oluşturulan yolluk sonra karşılaştırma yapılmasına olanak kalan koşullara uygulandıörnek dağılımları. (B) WT ve 4Δ + ENTH1 için (kapısının sağında kırmızı nokta) (Kapının solundaki siyah noktalar) loş hücreler ve parlak hücrelerin yüzdesi Özeti paneli A'da gösterilen Met denemeler ±. Lütfen Bu rakamın büyük halini görmek için buraya tıklayın.
| Gerilme | Genotip | Kaynak |
| SEY6210 bir | MAT α his3-Δ200 trp 1-Δ901 leu2-3,112 ura3-52 lys2-801 SUC2-Δ9 | Laboratuvar plazmid |
| BWY2858 | Ste3-GFP :: KANMX6 | Prosser ve ark. (2010) 16 |
| BWY2995 | Ste3-pHluorin :: KANMX6 | Prosser ve ark. (2010) 16 |
| BWY3036 | ent1Δ :: LEU2 ent2Δ :: HIS3 yap1801Δ :: HIS3 yap1802Δ :: LEU2 ste3-pHluorin :: KANMX6 + pEnt1 [CEN TRP1] | Prosser ve ark. (2010) 16 |
| BWY3037 | ent1Δ :: LEU2 ent2Δ :: HIS3 yap1801Δ :: HIS3 yap1802Δ :: LEU2 ste3-pHluorin :: KANMX6 + pENTH1 [CEN TRP1] | Prosser ve ark. (2010) 16 |
| BWY3399 | ent1Δ :: LEU2 ent2Δ :: HIS3 yap1801Δ :: HIS3 yap1802Δ :: LEU2 ste3 GFP :: KANMX6 + pEnt1 [CEN TRP1] | Prosser ve ark. (2010) 16 |
| BWY3400 | ent1Δ :: LEU2 ent2Δ :: HIS3 yap1801Δ :: HIS3 yap1802Δ :: LEU2 ste3 GFP :: KANMX6 + pEnt1 [CEN TRP1] | Prosser ve ark. (2010) 16 |
| BWY3817 | MUP1-GFP :: KANMX6 | PrOsser ve ark. (2010) 16 |
| BWY3818 | MUP1-pHluorin :: KANMX6 | Prosser ve ark. (2010) 16 |
| BWY4153 | ent1Δ :: LEU2 ent2Δ :: HIS3 yap1801Δ :: HIS3 yap1802Δ :: LEU2 MUP1-pHluorin :: KANMX6 + pEnt1 [CEN TRP1] | Prosser ve ark. (2011) 7 |
| BWY4154 | ent1Δ :: LEU2 ent2Δ :: HIS3 yap1801Δ :: HIS3 yap1802Δ :: LEU2 MUP1-pHluorin :: KANMX6 + pENTH1 [CEN TRP1] | Prosser ve ark. (2011) 7 |
| Bir Bu çalışmada kullanılan tüm suşlar, belirtilen loci haricinde SEY6210 için izogenik bulunmaktadır. | ||
Tablo 1: Bu çalışmada kullanılan maya türleri.
| plazmid | Açıklama | Kaynak |
| pRS426 | 2μ URA3 | Sikorski ve Hieter, 1989 |
| pBW0768 | pRS414 :: ENT1 [CEN TRP1] | pEnt1, Laboratuvar plasmidi |
| pBW0778 | pRS414 :: ent1 (aa1-151) [CEN TRP1] | pENTH1, Laboratuvar plasmidi |
| pBW1571 | pFA6a-pHluorin-KANMX6 | Prosser ve ark. (2010) 16 |
| pBW2053 | YEP24 :: ROM1 [2μ URA3] | pROM1 (Prosser ve ark., 2011) 7 |
| pRS426-Ldb19 | LDB19prom-LDB19 [2μ URA3] | Prosser ve ark. (2015) 15 |
| pFA6a-GFP (S65T) -kanMX6 | maya GFP-etiketleme için pFA6a-GFP-KANMX6, PCR tabanlı entegre plazmid | Longtineve ark., (1998) 21 |
Tablo 2: Bu çalışmada kullanılan Plazmidler.
| Süresi (dak) | Eylem (ler) |
| -5 | Resim örnek 1 (Met) |
| 0 | Örnek 1 ile metionin ekleme |
| Resim örnek 2 (Met) | |
| 5 | 2 örnek metionin ekle |
| Resim Örnek 3 (Met) | |
| 10 | 3 örnek metionin ekle |
| Görüntü örnek 4 (Met) | |
| 15 | 4 örnek metionin ekle |
| Görüntü numune 5 (Met) | |
| 20 | Eklemek5 örnek metiyonin |
| Görüntü örneği 6 (Met) | |
| 25 | 6 örnek metionin ekle |
| Görüntü örneği 7 (Met) | |
| 30 | 7 örnek metionin ekle |
| Görüntü örnek 8 (Met) | |
| Resim örnek 1 (+ Met) | |
| 35 | 8 örnek metionin ekle |
| Resim örnek 2 (+ Met) | |
| 40 | Resim örnek 3 (+ Met) |
| 45 | Görüntü örnek 4 (+ Met) |
| 50 | Görüntü numune 5 (+ Met) |
| 55 | Görüntü örneği 6 (+ Met) |
| 60 | Görüntü örneği 7 (+ Met) |
| 65 | Görüntü örnek 8 (+ Met) |
Tablo 3: Şaşırtıcı 8 Mup1-pHluorin uç nokta tahlilleri için örnek akışı.
Tartışmalar
Maya hücrelerinde endositik olaylar miktarının pHluorin uygulamaları floresan etiketi proteini (Şekil 1A) sitoplazmik kuyruğuna kaynaşık olduğu transmembran yüklerinin kullanır. pHluorin etiketi nötr ortamlara maruz kalan, ama pHluorin etiketi asidik koşullar karşılaştığında söndürülür haline olduğunda burada tarif edilen deneyler için, kargolar parlak floresan vardır. Böylece, pHluorin-etiketli endositik kargo kolayca plazma zarının sitoplazmik yüzüne ve erken endozomlardan tespit edilirse, ancak lümen MVB veziküller içine veya vakuol lümen teslim üzerine dahil edildiğinde "dim" olur. Genel olarak, yeni sentezlenmiş endositik kargoların olasılıkla endoplazmik retikulum (ER) bırakın ve GFP ve türevleri birçok tam olgunlaşmadan önce plazma zarı ulaşmak; böylece, ER veya Golgi çıkış i sürece saptanamayan kalması henüz tahmin edilmektedir hücre yüzeyine ulaşmış değil kargoları pHluorin-etiketlimpaired.
Bu ste3 ve Mup1 olarak pHluorin etiketli endositik yüklerin kullanımı maya CIE yolunun (Şekil 1B) 8,18 katılan bir dizi protein karakterizasyonu kolaylaştırmıştır. Özellikle, bu yazıda anlatılan yöntemler bu üretiminde artış göstermek için kullanılmıştır aktin modüle CME 8 hatalarına maya mutant çeşitli GTPaz Rho1 ve GEF ROM 1 teşvik endositoz. Buna ek olarak, pHluorin-etiketli kargolar son zamanlarda nicel, CME 13-15,34-36 rol köklü olduğunu α-arrestins, göstermek CME ve CIE hem de kargo-selektif roller oynamak için kullanılan ve mekanik olarak farklı işlevlere sahiptir edildi iki yolun 18.
Bu yazıda tarif protokoller için, birçok önemli faktörlerdir tutarlı niceliksel sonuçlar elde etmek için dikkate alınmalıdır. İlk olarak, Mup1-GFP veya Mup1-pHluorin ekspresyonu ve Floresanmaya hücreleri yaklaşım ya da durağan büyüme fazı (yayınlanmamış sonuçlar) girerken artmasına neden olmuştur azaltabilir; Bu durumda, bir gecelik kültürden yetiştirilen hücreler seyreltilmelidir ve (adım 3.1-3.2 ve 6,1-6,2 bakınız), fazladan bir 3 saat boyunca yeniden büyütülür. Son nokta tahlilleri ya da akış sitometrisi ile analiz için birden fazla deneysel koşullar gerginlikten şaşırtıcı Buna ek olarak, tek tek koşullara arasında karşılaştırma sağlamak için metionin, aynı tedavi süresi sonunda, bütün numuneler için veri toplamak için önemlidir. 8-bit formatına dönüştürme floresan yoğunluğu değerlerini etkileyebilir veri kaybına neden olduğu için alım sonrası analizi için, ölçme, 16-bit resimler kullanılarak yapılmalıdır. Arka sinyal belirgin örnekler arasında yoğunluk farklılıkları tıkamaktadır Dahası, arka plan çıkarma, miktar (aşama 5.3) önce yapılmalıdır.
pHluorin-etiketli Oysa ste3 ve Mup1, ölçümü uygun olmayan kanıtlanmıştırTüm kargolar pHluorin etiketleme için çok uygundur olacaktır. tandem pHluorin etiketler geliştirmek mümkündür, ancak, örneğin, muhtemelen ste3 ya Mup1 (yayınlanmamış sonuçlar) kıyasla Ste2-pHluorin alt floresans yoğunluğu, tutarsız niceliksel sonuçlar vermiştir α-faktör reseptörü Ste2 etiketlemek için çalışır sinyal yoğunluğu. Buna ek olarak, ligand bağlı endositoz çok yavaş oranları ile yükler içselleştirme yarı-zamanı maya hücre döngüsünün (yaklaşık 90 dakika) daha uzun, özellikle pHluorin ölçümü için etiketleme için uygun olmayabilir. Bu tür kargolar için, floresan bir azalma endositoz ve / veya bölünmesi sırasında anne ve kızı hücreleri arasındaki kargo bölümleme ortaya çıkabilecek. Böylece, faiz bireysel yüklerin test kendi ifadesi ve kinetik pHluorin-tagging ve ölçümü için uygun olup olmadığını belirlemek amacıyla tavsiye edilir.
PHL kullanarak son çalışmalar olmasına rağmenuorin plazma membranında endositik olaylar üzerinde duruldu var, pHluorin-etiketli kargolar endositik yolunda ilerleyen kaçakçılık olayları incelemek için kullanılabilir. PHluorin etiketi MVB lümen veziküller 20 içine dahil edildikten sonra söndürüldü hale geldiğinden, Örneğin, Mup1-pHluorin başarıyla akışında MVBs 37 içine sıralama ESCRT aracılı kargo sitometri tabanlı tahlilleri kullanılmıştır. Bu yaklaşım, luciferase 38,39 mevcudiyetinde bir biyolojik olarak ışık veren bir sinyal üretmek için bir sitoplazmik lusiferaz etiketli yüklerin kullanan lümen içi yerleştirme (LUCID) tahlilin son zamanlarda tarif edilen lusiferaz raportör, benzer. MVB lümen vezikülleri içine dahil edildikten sonra pHluorin flüoresanının söndürülmesi benzer LUCID deneyde biyolüminesans MVB vezikülleri içine lusiferaz etiketin dahil edildikten sonra azaltılır. pHluorin ve LUCID tahliller kavramsal benzer olmakla birlikte, pHluorin-etiketli kargolar endositoz ve MVB olgunlaşma incelemek için kullanılabilir iN sağlam hücreler.
Alternatif yöntemler endositoz ölçümü için var, ve yabani tip ve endositik mutant hücreler kargo içselleştirme oranları hakkında değerli bilgiler sağlamıştır. Örnekleri gibi ste3 olarak 40,41 veya endositik kargolar için bozulma oranını izleme (permease Fur4 tarafından içselleştirilmiş) ve urasil (feromon reseptörü Ste2 bağlanır) α-faktör olarak radyoetiketli ligandların izleme alımını içeren onlar içselleştirilmiş ve vakuol 42 taşınmaktadır. Bu biyokimyasal yaklaşımlar hücre lizizi gerektiren ve bu nedenle, canlı hücreler doğrudan ölçümü için uygun değildir. Alternatif olarak, floresan α-faktörü, sıvı-faz boya Lucifer Sarı veya FM4-64 canlı hücrelerin endositoz görselleştirmek için kullanılabilir stiril boya etiketli, ancak endojen ifade kargo proteinlerin 40,43,44 doğrudan izlenmesine olanak yoktur. va floresan bu yaklaşımların, kalıcılık içinGFP ile görüldüğü gibi cuole lümen, kantifikasyonunu komplike edebilir. Bütün-hücre floresan ölçümü ve sitoplazmik ve endozomal / vakuolar bölmelerden sinyal çıkarılarak endositoz ölçümü için GFP etiketli yükleri kullanmak da mümkündür; Bununla birlikte, endozomlar ve vakuollerin plazma zarına yakın genellikle. Bunun aksine, pHluorin-etiketli endositik yükler daha yaygın olarak kullanılan GFP etiketine göre trafik etkinlikleri ölçümü için ayrı bir avantaj olabilir MVB / vakuol bölmeleri söndürülür. Gelecekteki çalışmalar STE ve CIE katkıda ek faktörleri belirlemek için, yük ve sıralama kararları düzenleyen mekanizmaları anlamak için maya endositik yollar ve kargo sıralama mevcut bilgi üzerine genişleyecektir.
Açıklamalar
The authors declare no competing interests.
Teşekkürler
We would like to thank Gero Miesenböck and Tim Ryan for sharing pHluorin cDNA used to generate reagents in this study, Nathan Wright, Joanna Poprawski and Lydia Nyasae for excellent technical assistance, members of the Wendland lab for helpful discussions, and Michael McCaffery and Erin Pryce at the Integrated Imaging Center (Johns Hopkins) for advice and assistance with microscopy and flow cytometry. This work was supported by grants from the National Institutes of Health (to B.W., GM60979) and the National Science Foundation (to B.W., MCB 1024818). K.W. was supported in part by a training grant from the National Institutes of Health (T32-GM007231). A.F.O. was supported by developmental funds from the Department of Biological Sciences at Duquesne University and National Science Foundation CAREER grant 553143.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Adenine | Sigma | A8626-25G | Use for preparation of amino acid mixture and stock solution |
| Bacto-agar | Fisher | BP1423-2 | Use for preparation of plate media |
| BD Difco Yeast Nitrogen Base (without amino acids) | BD | 291920 | Use for preparation of liquid and plate media |
| Concanavalin A | Sigma | C5275-5MG | Use for coating of chamber slides |
| Dextrose | Fisher | BP350-1 | Use for preparation of liquid and plate media |
| L-Histidine | Fisher | BP382-100 | Use for preparation of amino acid mixture and stock solution |
| L-Leucine | Acros | 125121000 | Use for preparation of amino acid mixture and stock solution |
| L-Lysine | Fisher | BP386-100 | Use for preparation of amino acid mixture and stock solution |
| L-Methionine | Fisher | BP388-100 | Use for preparation of amino acid mixture and stock solution |
| L-Tryptophan | Fisher | BP395-100 | Use for preparation of amino acid mixture and stock solution |
| L-Tyrosine | Acros | 140641000 | Use for preparation of amino acid mixture |
| Nunc Lab-Tek Chambered Coverglass (8-well) | Thermo Scientific | 155411 | Use for kinetic and endpoint assays of Mup1-pHluorin internalization |
| Uracil | Sigma | U0750-100G | Use for preparation of amino acid mixture and stock solution |
| Axiovert 200 inverted microscope | Carl Zeiss | Custom Build | |
| 100X/1.4 Plan-Apochromat Oil Immersion Objective Lens | Carl Zeiss | Objective should be 100X, 1.4NA or higher | |
| Sensicam | Cooke Corporation | Camera should have 12-bit or higher dynamic range | |
| X-Cite 120PC Q Illumination Source | Excelitas Technologies | ||
| Slidebook 5 software | Intelligent Imaging Innovations | ||
| ImageJ software | National Institutes of Health | http://imagej.nih.gov/ij/ |
Referanslar
- Kaksonen, M., Sun, Y., Drubin, D. G. A pathway for association of receptors, adaptors, and actin during endocytic internalization. Cell. 115 (4), 475-487 (2003).
- Kaksonen, M., Toret, C. P., Drubin, D. G. A modular design for the clathrin- and actin-mediated endocytosis machinery. Cell. 123 (2), 305-320 (2005).
- Boettner, D. R., Chi, R. J., Lemmon, S. K. Lessons from yeast for clathrin-mediated endocytosis. Nat Cell Biol. 14 (1), 2-10 (2012).
- Taylor, M. J., Perrais, D., Merrifield, C. J. A High Precision Survey of the Molecular Dynamics of Mammalian Clathrin-Mediated Endocytosis. PLoS Biol. 9 (3), e1000604 (2011).
- Hansen, C. G., Nichols, B. J. Molecular mechanisms of clathrin-independent endocytosis. J Cell Sci. 122 (11), 1713-1721 (2009).
- Sabharanjak, S., Sharma, P., Parton, R. G., Mayor, S. GPI-anchored proteins are delivered to recycling endosomes via a distinct cdc42-regulated, clathrin-independent pinocytic pathway. Dev Cell. 2 (4), 411-423 (2002).
- Radhakrishna, H., Klausner, R. D., Donaldson, J. G. Aluminum fluoride stimulates surface protrusions in cells overexpressing the ARF6 GTPase. J Cell Biol. 134 (4), 935-947 (1996).
- Prosser, D. C., Drivas, T. G., Maldonado-Báez, L., Wendland, B. Existence of a novel clathrin-independent endocytic pathway in yeast that depends on Rho1 and formin. J Cell Biol. 195 (4), 657-671 (2011).
- Prosser, D. C., Wendland, B. Conserved roles for yeast Rho1 and mammalian RhoA GTPases in clathrin-independent endocytosis. Small GTPases. 3 (4), 229-235 (2012).
- Kohno, H., et al. Bni1p implicated in cytoskeletal control is a putative target of Rho1p small GTP binding protein in Saccharomyces cerevisiae. EMBO J. 15 (22), 6060-6068 (1996).
- Evangelista, M., et al. a Yeast Formin Linking Cdc42p and the Actin Cytoskeleton During Polarized Morphogenesis. Science. 276 (5309), 118-122 (1997).
- Kübler, E., Riezman, H. Actin and fimbrin are required for the internalization step of endocytosis in yeast. EMBO J. 12 (7), 2855-2862 (1993).
- Lin, C. H., MacGurn, J. A., Chu, T., Stefan, C. J., Emr, S. D. Arrestin-Related Ubiquitin-Ligase Adaptors Regulate Endocytosis and Protein Turnover at the Cell Surface. Cell. 135 (4), 714-725 (2008).
- Nikko, E., Sullivan, J. A., Pelham, H. R. B. Arrestin-like proteins mediate ubiquitination and endocytosis of the yeast metal transporter Smf1. EMBO Rep. 9 (12), 1216-1221 (2008).
- Nikko, E., Pelham, H. R. B. Arrestin-Mediated Endocytosis of Yeast Plasma Membrane Transporters. Traffic. 10 (12), 1856-1867 (2009).
- O'Donnell, A. F., McCartney, R. R., Chandrashekarappa, D. G., Zhang, B. B., Thorner, J., Schmidt, M. C. 2-Deoxyglucose impairs Saccharomyces cerevisiae growth by stimulating Snf1-regulated and α-arrestin-mediated trafficking of hexose transporters 1 and 3. Mol Cell Biol. 35 (6), 939-955 (2015).
- O'Donnell, A. F., Huang, L., Thorner, J., Cyert, M. S. A calcineurin-dependent switch controls the trafficking function of α-arrestin Aly1/Art6. J Biol Chem. 288 (33), 24063-24080 (2013).
- Prosser, D. C., Pannunzio, A. E., Brodsky, J. L., Thorner, J., Wendland, B., O'Donnell, A. F. α-Arrestins participate in cargo selection for both clathrin-independent and clathrin-mediated endocytosis. J Cell Sci. 128 (22), 4220-4234 (2015).
- Lamaze, C., Dujeancourt, A., Baba, T., Lo, C. G., Benmerah, A., Dautry-Varsat, A. Interleukin 2 receptors and detergent-resistant membrane domains define a clathrin-independent endocytic pathway. Mol Cell. 7 (3), 661-671 (2001).
- Prosser, D. C., Whitworth, K., Wendland, B. Quantitative analysis of endocytosis with cytoplasmic pHluorin chimeras. Traffic. 11 (9), 1141-1150 (2010).
- Bokman, S. H., Ward, W. W. Renaturation of green-fluorescent protein. Biochem Biophys Res Commun. 101 (4), 1372-1380 (1981).
- Miesenböck, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Sankaranarayanan, S., De Angelis, D., Rothman, J. E., Ryan, T. A. The Use of pHluorins for Optical Measurements of Presynaptic Activity. Biophys J. 79 (4), 2199-2208 (2000).
- Katzmann, D. J., Babst, M., Emr, S. D. Ubiquitin-dependent sorting into the multivesicular body pathway requires the function of a conserved endosomal protein sorting complex. ESCRT-I. Cell. 106 (2), 145-155 (2001).
- Longtine, M. S., et al. Additional modules for versatile and economical PCR-based gene deletion and modification in Saccharomyces cerevisiae. Yeast. 14 (10), 953-961 (1998).
- Goldstein, A. L., McCusker, J. H. Three new dominant drug resistance cassettes for gene disruption in Saccharomyces cerevisiae. Yeast. 15 (14), 1541-1553 (1999).
- Ausubel, F. M. . Curr Prot Mol Biol. , (1991).
- Urbanowski, J. L., Piper, R. C. Ubiquitin sorts proteins into the intralumenal degradative compartment of the late-endosome/vacuole. Traffic. 2 (9), 622-630 (2001).
- Newpher, T. M., Smith, R. P., Lemmon, V., Lemmon, S. K. In Vivo Dynamics of Clathrin and Its Adaptor-Dependent Recruitment to the Actin-Based Endocytic Machinery in Yeast. Dev Cell. 9 (1), 87-98 (2005).
- Maldonado-Báez, L., Dores, M. R., Perkins, E. M., Drivas, T. G., Hicke, L., Wendland, B. Interaction between Epsin/Yap180 adaptors and the scaffolds Ede1/Pan1 is required for endocytosis. Mol Biol Cell. 19 (7), 2936-2948 (2008).
- Aguilar, R. C., et al. Epsin N-terminal homology domains perform an essential function regulating Cdc42 through binding Cdc42 GTPase-activating proteins. Proc Natl Acad Sci U.S.A. 103 (11), 4116-4121 (2006).
- Isnard, A. D., Thomas, D., Surdin-Kerjan, Y. The study of methionine uptake in Saccharomyces cerevisiae reveals a new family of amino acid permeases. J Mol Biol. 262 (4), 473-484 (1996).
- Wendland, B., McCaffery, J. M., Xiao, Q., Emr, S. D. A novel fluorescence-activated cell sorter-based screen for yeast endocytosis mutants identifies a yeast homologue of mammalian eps15. J Cell Biol. 135 (6), 1485-1500 (1996).
- Alvaro, C. G., et al. Specific Alpha-Arrestins Negatively Regulate Saccharomyces cerevisiae Pheromone Response by Down-Modulating the G-Protein-Coupled Receptor Ste2. Mol Cell Biol. 34 (14), 2660-2681 (2014).
- Ghaddar, K., Merhi, A., Saliba, E., Krammer, E. M., Prevost, M., Andre, B. Substrate-Induced Ubiquitylation and Endocytosis of Yeast Amino Acid Permeases. Mol Cell Biol. 34 (24), 4447-4463 (2014).
- Becuwe, M., Léon, S. Integrated control of transporter endocytosis and recycling by the arrestin-related protein Rod1 and the ubiquitin ligase Rsp5. eLife. 3, (2014).
- Henne, W. M., Buchkovich, N. J., Zhao, Y., Emr, S. D. The Endosomal Sorting Complex ESCRT-II Mediates the Assembly and Architecture of ESCRT-III Helices. Cell. 151 (2), 356-371 (2012).
- Nickerson, D. P., Russell, M. R. G., Lo, S. -. Y., Chapin, H. C., Milnes, J. M., Merz, A. J. Termination of Isoform-Selective Vps21/Rab5 Signaling at Endolysosomal Organelles by Msb3/Gyp3. Traffic. 13 (10), 1411-1428 (2012).
- Nickerson, D. P., Merz, A. J. LUCID: A Quantitative Assay of ESCRT-Mediated Cargo Sorting into Multivesicular Bodies. Traffic. 16 (12), 1318-1329 (2015).
- Dulic, V., Egerton, M., Elguindi, I., Raths, S., Singer, B., Riezman, H. Yeast endocytosis assays. Methods Enzymol. 194, 697-710 (1991).
- Silve, S., Volland, C., Garnier, C., Jund, R., Chevallier, M. R., Haguenauer-Tsapis, R. Membrane insertion of uracil permease, a polytopic yeast plasma membrane protein. Mol Cell Biol. 11 (2), 1114-1124 (1991).
- Miliaras, N. B., Park, J. -. H., Wendland, B. The Function of the Endocytic Scaffold Protein Pan1p Depends on Multiple Domains. Traffic. 5 (12), 963-978 (2004).
- Vida, T. A., Emr, S. D. A new vital stain for visualizing vacuolar membrane dynamics and endocytosis in yeast. J Cell Biol. 128 (5), 779-792 (1995).
- Toshima, J. Y., Toshima, J., Kaksonen, M., Martin, A. C., King, D. S., Drubin, D. G. Spatial dynamics of receptor-mediated endocytic trafficking in budding yeast revealed by using fluorescent alpha-factor derivatives. Proc Natl Acad Sci U.S.A. 103 (15), 5793-5798 (2006).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır