Method Article
Le domande di pHluorin per quantitativa, Cinetica e high-throughput analisi di endocitosi in germogliamento lievito
In questo articolo
Riepilogo
Accurate quantification of vesicular trafficking events often provides key insights into roles for specific proteins and the effects of mutations. This paper presents methods for using superecliptic pHluorin, a pH-sensitive GFP variant, as a tool for quantification of endocytic events in living cells using quantitative fluorescence microscopy and flow cytometry.
Abstract
proteina fluorescente verde (GFP) e le sue varianti sono ampiamente utilizzati strumenti per studiare la localizzazione delle proteine e la dinamica di eventi come il rimodellamento del citoscheletro e il traffico vescicolare nelle cellule viventi. metodologie quantitative che utilizzano fusioni GFP chimerici sono stati sviluppati per molte applicazioni; tuttavia, GFP è un po 'resistente alla proteolisi, così la sua fluorescenza persiste nel lisosoma / vacuolo, che può ostacolare la quantificazione del traffico merci nella via endocitico. Un metodo alternativo per quantificare endocitosi e post-endocitosi eventi traffico fa uso di superecliptic pHluorin, una variante pH-sensibile GFP che viene raffreddato in ambienti acidi. la fusione chimerica del pHluorin alla coda citoplasmatica di transmembrana carico proteine risultati in una attenuazione della fluorescenza al momento della costituzione del carico in corpi multivesicular (MVB) e la consegna al lume lisosomi / vacuolo. Così, tempra di fluorescenza vacuolare facilita quantificazione di endocitosi ed eventi precoci nella via endocitico. Questo documento descrive i metodi che utilizzano carichi pHluorin-tag per la quantificazione di endocitosi tramite microscopia a fluorescenza, così come saggi basati sulla popolazione citometria a flusso.
Introduzione
traffico vescicolare svolge un ruolo importante nel mantenimento dell'identità organello e funzione in cellule eucariotiche, ed è un meccanismo fondamentale di regolazione composizione proteica e la membrana dei singoli compartimenti cellulari. Alla membrana plasmatica, fusione delle vescicole esocitosi offre nuove proteine e membrane alla superficie della cellula, mentre vescicole generati tramite endocitosi rimuovere la membrana e proteine dalla superficie per il successivo riciclaggio o destinata al lisosoma. Così, endocitosi è importante per l'assorbimento dei nutrienti e risposte all'ambiente extracellulare. Esocitosi e endocitosi sono equilibrati per regolare la superficie della membrana plasmatica, e per consentire un fatturato di proteine danneggiate.
Studi in lievito e cellule di mammifero hanno identificato un gran numero di proteine coinvolte nella endocitosi, così come molteplici percorsi endocitosi che promuovono internalizzazione dei carichi specifici o che agiscono in risposta ad una varietà di encondizioni am-. Il percorso più studiato è clatrina mediata endocitosi (CME), in cui clathrin e accessori citosolico proteine assemblano in una struttura cappotto per stabilizzare la vescicola endocitico nascente. Gli esperimenti in erba lievito Saccharomyces cerevisiae hanno prodotto conoscenze fondamentali nei confronti delle dinamiche e l'ordine di assunzione per molte proteine endocytic 1-3. In particolare, la macchina CME è altamente conservata attraverso l'evoluzione tale che la maggior parte delle proteine CME-relativi a lievito ha ortologhi umani; in tal modo, il lievito è stato uno strumento importante per la comprensione dei meccanismi di endocitosi che sono conservati in eucarioti superiori. Ad esempio, gli studi che utilizzano il lievito in erba hanno determinato che la formazione e la maturazione delle strutture ECM (denominato patch actina come corticali nel lievito) coinvolge il reclutamento sequenziale di molte proteine, a cominciare da clatrina e proteine adattatrici cargo-binding, seguita da assunzione di accessorio endocytic supplementari proteine,attivazione di polimerizzazione actina Arp2 / 3-mediata, e l'assunzione di proteine coinvolte nella scissione delle vescicole 1,2. Assunzione di proteine macchine ECM per corticale patch di actina è un processo altamente ordinato e stereotipata, e l'ordine preciso di reclutamento per molte proteine è stato stabilito rispetto ad altri componenti del macchinario CME. È importante sottolineare che recenti studi hanno confermato un ordine simile di reclutamento per le proteine ECM ai box clathrin rivestite in cellule di mammifero 4.
Oltre al CME, molti tipi di cellule in possesso di uno o più endocitico (CIE) percorsi clatrina-indipendenti che si basano su meccanismi alternativi per promuovere la formazione di vescicole e interiorizzazione dalla membrana plasmatica 5-7. In lievito, abbiamo recentemente identificato un percorso CIE che utilizza la piccola GTPasi Rho1 e il suo fattore di attivazione guanina scambio nucleotide (GEF), Rom1 8,9. Rho1 attiva il Formin Bni1 di promuovere la polimerizzazione 10,11, che è richiesto per questa forma di endocitosi clatrina-indipendenti in lievito 12. Inoltre, la famiglia α-arrestina di proteine reclutare l'ubiquitina ligasi Rsp5 per promuovere carico ubiquitinazione e successiva interiorizzazione attraverso CME 13-17, e anche promuovere carico interiorizzazione attraverso la via CIE, possibilmente attraverso l'interazione diretta con le proteine coinvolte nel CIE 18. Una varietà di percorsi CIE esistono anche nelle cellule dei mammiferi, inclusi i percorsi clatrina-indipendenti e fagocitarie che si basano sul ortologo Rho1, RhoA 9,19. Il ruolo di RhoA in mammiferi CIE è poco conosciuta; in tal modo, gli studi in lievito in erba possono fornire approfondimenti meccanicistici aggiuntive che sono applicabili a CIE mammiferi.
quantificazione accurata di eventi endocitici può fornire informazioni importanti circa i ruoli di proteine specifiche nella regolazione endocitosi, e può rivelare gli effetti delle mutazioni sul carico internalizzazione o progression attraverso la via endocitico. A tale scopo, metodi biochimici possono essere utilizzati per monitorare ligando assorbimento o misurare tassi di degradazione delle proteine cargo endocitosi. Nelle cellule viventi, fusione di proteina fluorescente verde (GFP) e le sue varianti per carichi di interesse permette la visualizzazione diretta del trasporto merci. Tuttavia, carichi GFP-tagged sono di uso limitato per la quantificazione di endocitosi perché GFP è resistente alla degradazione in lisosomi (o vacuolo nel lievito). Inoltre, GFP fluorescenza è solo parzialmente sensibile alle variazioni di pH, e rimane rilevabile all'interno del vacuolo lume 20,21. Di conseguenza, la fluorescenza del tag GFP persiste nel vacuolo molto tempo dopo il resto del carico è stato degradato, e tutta la quantificazione delle cellule a base di intensità di carico può essere impreciso a causa di fluorescenza GFP-lungo termine nel vacuolo.
Al fine di superare gli inconvenienti della vacuolare GFP fluorescenza, abbiamo in precedenza fatto uso di pH supereclipticluorin, una variante pH-sensibile GFP che brilla fluorescente a pH neutro, ma perde fluorescence in ambienti acidi, come il lume del vacuolo / lisosoma 20,22,23. Posizionamento di un tag pHluorin sulla coda citoplasmatica dei carichi endocitici consente di visualizzare i carichi a livello della membrana plasmatica e su endosomi precoci, in cui il tag pHluorin rimane esposta al citoplasma (Figura 1A). Come endosomi precoci maturano, il endosomal di ordinamento complessi necessari per i pacchetti di trasporto (ESCRT) macchine carichi superficie localizzata in vescicole che germogliano nel lume del endosome, generando corpi multivesicular (MVB) 24. Per carichi che sono stati incorporati in vescicole MVB interne, il tag pHluorin rivolta verso il lume vescicole. vescicole MVB interne sono acidificati; in tal modo, carichi pHluorin-taggate perdono fluorescenza su endosomi precoci man mano che maturano in MVB 20. la fusione successiva della MVB con vacuolo fornisce i contenuti MVB luminaleper la degradazione, tag e pHluorin rimangono spente nell'ambiente acido del lume vacuolo.
Questo documento fornisce descrizioni dettagliate di analisi quantitativa, utilizzando endocitici carichi con tag pHluorin citoplasmatici nel lievito. I ceppi esprimenti carichi pHluorin-marcati possono essere utilizzati in saggi cinetici e / o del computer, a seconda delle proprietà e traffico comportamento del carico specifico. Inoltre, alcuni carichi pHluorin-tag sono suscettibili di metodi di analisi high-throughput, tra cui citometria a flusso. È importante sottolineare che il tag pHluorin è uno strumento versatile per studiare eventi endocytic nelle cellule viventi, permettendo la quantificazione di endocitosi e confronto della funzione endocitico nel wild-type e mutanti.
Protocollo
1. Soluzioni e supporti
- Preparare i seguenti stock, Media e piastre:
- Per preparare 10x YNB, sciogliere 67 g di base azotata di lievito priva aminoacidi in 1 L di acqua. Sterilizzare per filtrazione attraverso un filtro di 0,22 micron nitrocellulosa.
- Preparare medio YNB usando 1x YNB (da 10x magazzino) con il 2% di destrosio (da una sterile 50% w / v magazzino) e miscela di aminoacidi 1x / nutrienti (da 100x magazzino, vedere il punto 1.1.4). Per la selezione plasmide, omettere singoli aminoacidi o nutrienti, se necessario. Per l'induzione di espressione Mup1, inoltre omettere metionina dalla miscela di aminoacidi / nutrienti.
- Preparare piatti YNB utilizzando 1x YNB (da 10x magazzino), il 2% di destrosio (da una sterile 50% w / v magazzino), 0,7 g / L amino miscela di acidi / nutrienti (vedi punto 1.1.5) e il 2,5% di agar. Preparare medio plate in autoclave 25 g di agar e 0,7 g di ammino miscela acida / nutrienti per 860 ml di acqua. Lasciare raffreddare il composto a 55 ° C, quindi aggiungere 100 ml di 10x YNB e 40 ml of 50% di glucosio. Versare in piastre (circa 30 ml di terreno per 10 cm piatto), permettono il supporto per solidificare a temperatura ambiente, e le piastre Conservare a 4 ° C.
- Preparare 100x soluzione aminoacido / nutrienti magazzino (per mezzo liquido) sciogliendo i seguenti in 100 ml di acqua deionizzata: 0.1 g L-metionina, 0,3 g ciascuno di L-leucina e L-lisina, e 0,2 g ciascuno di L-istidina , L-triptofano, adenina e uracile (altri aminoacidi e nutrienti possono essere inclusi come necessario per i ceppi specifici). Usare il calore delicato, se necessario per sciogliere, e sterilizzare attraverso un filtro da 0,45 micron di nitrocellulosa. Conservare a temperatura ambiente con protezione dalla luce. Per la selezione plasmide, preparare le soluzioni madre privi di componenti specifici in base alle esigenze.
- Preparare aminoacido / miscela di nutrienti (per le piastre) combinando il seguente: 0,5 g di adenina, 4 g di L-leucina, e 2 g ciascuno di L-istidina, L-lisina, L-metionina, L-triptofano, L- tirosina e uracile. Macinare con un mortaio e pestello, e memorizzare con proprotezione dalla luce. Per la selezione plasmide, preparare miscele privi di componenti specifici come necessario, e utilizzare 0,7 g di miscela di aminoacidi per litro di mezzo di targa (vedi punto 1.1.3).
- Preparare vetrini camera 8 pozzetti per la microscopia rivestendo la superficie del vetrino con concanavalina A (ConA). Per ogni pozzetto del vetrino camera, aggiungere 25 ml di 2 mg / ml ConA disciolti in acqua. Usando una pipetta, diffondere la ConA attraverso la superficie inferiore del pozzetto, quindi consentire la diapositiva asciugare a temperatura ambiente per almeno 4-8 ore. Idealmente, usare diapositive da camera entro 24 ore di rivestimento ConA.
- Generare ceppi di lievito con fusioni in-frame di GFP o pHluorin al carico endocitico di interesse utilizzando la reazione a catena della polimerasi (PCR) metodo di integrazione basata su descritto Longtine et al. e Goldstein e McCusker 25,26.
NOTA: I plasmidi contenenti pHluorin codifica cassette con geni di resistenza per kanamicina (KANMX6) e nourseothricin ( NATMX4) sono state descritte in precedenza 20.- Amplificare GFP o pHluorin cassette contenenti marcatori selezionabili con primer contenenti sequenze aggiuntive specifiche per il sito di integrazione genomica 20,25.
- Trasformare il prodotto di PCR risultante nel ceppo di lievito desiderato utilizzando il metodo di acetato di litio 27.
- Selezionare per l'integrazione della cassetta coltivando cellule su piastre YPD contenenti il farmaco appropriato. Per preparare lastre, autoclave 10 g estratto di lievito, 20 g peptone, 0,1 g di triptofano e 25 g di agar in 960 ml di acqua. Prima di versare piastre, lasciare raffreddare il composto a 55 ° C, quindi aggiungere 40 ml di 50% di glucosio e sia G418 ad una concentrazione finale di 200 mg / ml per la selezione KANMX6 o nourseothricin ad una concentrazione finale di 100 mg / ml selezione NATMX4.
- Confermare l'integrazione della GFP o tag pHluorin in singole colonie mediante PCR e / o Western blotting utilizzando anticorpi anti-GFP,nonché dalla rilevazione della proteina marcata mediante microscopia in fluorescenza 20.
NOTA: ceppi di lievito specifici e plasmidi utilizzati in questo studio sono elencati nelle tabelle 1 e 2, rispettivamente.
2. Endpoint Assay per fluorescenza a regime di Constitutively interiorizzato endocitici Cargo
- Seminare cellule (~ 3 piccole colonie) in 5 ml di terreno YNB privi di amminoacidi o di sostanze nutritive come richiesto per la manutenzione plasmide (se applicabile). Crescere le cellule per 16-24 ore in un incubatore agitazione orbitale a 30 ° C, con 250 rpm agitazione. In alternativa, si depositano su una ~ 1-2 mm colonia di cellule su una piastra YNB privo amminoacidi o nutrienti per la selezione plasmide, e crescere cellule notte a 30 ° C.
- Misurare la densità (OD 600) di ogni cultura durante la notte utilizzando uno spettrofotometro. Preparare una diluizione 5 ml a 0.35-0.4 OD 600 / ml in mezzo YNB privo di aminoacidi o sostanze nutritive per plaSmid manutenzione, e crescere per circa 3 ore a 30 ° C con agitazione. Se si utilizzano le cellule striati su un piatto, saltare questo passaggio e procedere con passo 2.4 (vedi sotto).
- Misurare la densità (OD 600) di cellule, che ora dovrebbe essere compreso tra 0.6-1.0 OD 600 / ml. Trasferire 1,5 ml di coltura in una provetta da microcentrifuga, e le cellule pellet a 8.000 giri (6.800 xg) per 2 minuti. Rimuovere 1.475 ml di surnatante.
- Portare cellule ad un microscopio a fluorescenza. Prima di imaging ogni campione, preparare una diapositiva risospendere le cellule in medium rimanente e montare 3 ml di sospensione cellulare in un vetrino. In alternativa, preparare diapositive camera 8-così come descritto di seguito nel protocollo 3, utilizzando media YNB come appropriato per la selezione del plasmide. Idealmente, celle di immagine con un 100X, 1.4 o superiore apertura numerica (NA) immersione in olio lente dell'obiettivo, una fotocamera a 12 o 16 bit, e filtri di eccitazione / emissione ottimizzate per GFP fluorescenza.
NOTA: Se si utilizzano le cellule coltivate strisciando ona piatto, preparare la slitta mettendo 3 ml di media YNB fresca su un vetrino. Usando una pipetta, raccogliere una piccola colonia di cellule dalla piastra, disperdere le cellule nel mezzo YNB e montare la sospensione risultante su un vetrino immediatamente prima di imaging. - Immagine 4-6 campi aleatori di cellule per ogni condizione, utilizzando gli stessi parametri di acquisizione (ad esempio, set di filtri e tempo di esposizione) per tutte le immagini all'interno di un esperimento.
NOTA: Raccolta un'immagine DIC campo chiaro che per ogni campo può essere utile per le cellule in cui il segnale pHluorin si spegne in MVB e scomparti vacuolari. - Quantificare l'intensità di fluorescenza di almeno 30-50 cellule per ogni condizione (vedi protocollo 5).
3. Kinetic Assay per la quantificazione di endocitosi di carichi che subiscono Endocitosi regolamentato
- Seminare 2-3 colonie di cellule di lievito (circa 2 mm di diametro per colonia) in 5 ml di mezzo privo YNB metionina e aggiungereaminoacidi transitorie, o sostanze nutritive per il mantenimento di selezione plasmide. Grow culture per 16-24 ore a 30 ° C con agitazione.
NOTA: In questo documento, i protocolli per lo studio delle proteine regolate da carico endocytic faranno uso della permeasi metionina, Mup1. Altri carichi che subiscono endocitosi regolamentato sono anche adatti per tagging con pHluorin (per esempio, l'uracile permeasi Fur4, che si accumula a livello della membrana plasmatica in assenza di uracile, e interiorizza in risposta applicata esternamente uracile); per questi carichi, condizioni media dovrebbero essere modificati per riflettere le condizioni specifiche di espressione, di induzione e l'interiorizzazione di quel carico. - Misurare la densità (OD 600) di ogni cultura durante la notte circa 3 ore prima di imaging. Preparare una diluizione 5 ml a 0.35-0.4 OD 600 / ml in mezzo YNB privi di acidi metionina e aminoacidi aggiuntivi o sostanze nutritive per la manutenzione plasmide, e crescere a 30 ° C con agitazione.
- Pre-equilibrare il microsfronte di camera ambientale o stadio riscaldato (se disponibile) a 30 ° C durante l'incubazione 3 ore di step 3.2.
- Trasferire 1 ml di coltura cellulare in una provetta da microcentrifuga, e le cellule pellet a 8.000 giri (6.800 xg) per 2 minuti. Togliere 975 ml di surnatante.
- Preparare a Cona-trattati, scivolo camera 8-ben fondo di vetro per l'imaging (protocollo 1.2).
- Aggiungere 200 ml di media YNB privi di acidi metionina e aminoacidi aggiuntivi o sostanze nutritive per la selezione plasmide in ogni pozzetto. Risospendere il pellet di cellule dal punto 3.4 nel surnatante rimanente e goccia 2,5 ml di sospensione cellulare al centro di ciascun pozzetto. Disperse cellule attraverso la superficie del pozzetto pipettando su e giù, e permettono fissare le cellule per 5-10 min.
- Posizionare il vetrino da camera su un microscopio a fluorescenza invertito equilibrati a 30 ° C (vedi punto 3.3). Individuare un campo di celle che utilizzano illuminazione campo chiaro.
- Aggiungere 50 ml di media YNB contenenti 100 ug / ml metionina(Pre-riscaldato a 30 ° C) per 200 ml di mezzo nel pozzo per ottenere una concentrazione finale di 20 metionina mg / ml. Evitare di interrompere il mezzo nel pozzo per impedire alle cellule di galleggianti dal fondo.
- Permettono alle cellule equilibrare per 2 minuti prima di iniziare imaging. Immediatamente prima di catturare la prima immagine, regolare il microscopio al piano focale desiderata (tipicamente, un piano focale equatoriale funziona meglio).
- Acquisire le immagini GFP e campo chiaro (o DIC) a 5 min intervalli di 45-60 minuti, utilizzando parametri di acquisizione identici per tutte le immagini all'interno di una serie di tempo (ad esempio, 100X 1.4 NA obiettivo ad immersione e 500 msec tempo di acquisizione utilizzando il filtro GFP, 100 tempo di acquisizione msec utilizzando il filtro DIC).
NOTA: Se fase del microscopio e software di imaging non consentono la correzione automatica del piano focale deriva, può essere necessario regolare nuovamente il fuoco manualmente prima di ogni punto di tempo di imaging. Inoltre, i tempi di acquisizionevariano tra microscopi a causa di differenze di illuminazione e filtri e condizioni ottimali devono essere determinati manualmente prima di iniziare l'esperimento. Se si utilizza un carico endocytic diverso Mup1, può essere necessario modificare il tempo di acquisizione e di imaging intervalli, nonché la durata dell'esperimento, per riflettere la cinetica di internalizzazione di tali merci. - Quantificare intensità di fluorescenza delle cellule individuali in ogni momento (vedi protocollo 5), ed esprimere i valori in percentuale l'intensità iniziale della prima immagine.
4. Endpoint Assay per la quantificazione della endocitico Cargos che subiscono Endocitosi regolamentato
- Preparare le cellule per l'imaging, come descritto nel protocollo 3 (punti 3.1 tramite 3.6).
- Immagine 4-5 campi aleatori di cellule per ogni condizione immediatamente prima di aggiungere metionina, con campo chiaro e filtro GFP set.
- Aggiungere 50 ml di media YNB contenenti 100 mg / ml di metionina (prima della guerramed a 30 ° C) per 200 ml di mezzo nel pozzo per ottenere una concentrazione finale di 20 metionina mg / ml. Evitare di interrompere il mezzo nel pozzo per impedire alle cellule di galleggianti dal fondo.
- Immagine 4-5 campi casuali di celle 30 min dopo l'aggiunta di metionina, utilizzando gli stessi parametri di acquisizione come per il punto di tempo 0 min (fase 4.2).
- Quantificare l'intensità di fluorescenza di almeno 30-50 cellule per ogni momento (vedi protocollo 5). valori espressi come percentuale di Mup1-pHluorin internalizzato dopo 30 min utilizzando la formula: [intensità media a 0 min - media intensità a 30 min] / [media intensità a 0 min] x 100%.
NOTA:. E 'possibile eseguire contemporaneamente fino a otto saggi endpoint scaglionando l'orario di inizio di ogni test tabella 3 offre un flusso di lavoro ad esempio per otto test simultanei.
5. Analisi post-acquisizione
- esportare immagini da software di acquisizione come 16-bit formato di file-immagine con tag (tif o in formato .tiff).
NOTA: Altri formati di file possono anche essere adatto, e dovrebbero idealmente utilizzare algoritmi di compressione senza perdita di dati. immagini a 8 bit non sono generalmente adatti per scopi di quantificazione. - Aprire i file utilizzando il software ImageJ (liberamente disponibile l'opzione 'Open' in nel menu 'File'. Utilizzare l'immagine di fluorescenza per la quantificazione, e l'immagine brightfield / DIC come riferimento per identificare la posizione delle cellule e di escludere le cellule morte (se presente ), che appaiono più scuro di cellule vive se visti da DIC e sono autofluorescenti se visti con filtri GFP di eccitazione / emissione.
- Eseguire una sottrazione di sfondo l'immagine di fluorescenza su. Per le immagini con un segnale di fondo irregolare, usare l'algoritmo di 'sottrazione del fondo' trovato nel 'menu Processo'. Utilizzare l'impostazione di default (raggio di rotolamento palla di 50 pixel), che è generalmente sufficiente ai fini di quantificazione.
NOTA: un backgro alternativametodo di sottrazione und per le immagini con sfondo uniforme è descritto al punto 5.3.1.-5.3.2; tuttavia, il metodo di cui sopra funziona anche per sfondo uniforme.- Per le immagini con sfondo uniforme (cioè intensità bassa è approssimativamente costante a tutti i bordi e nel centro dell'immagine), eseguire una sottrazione dello sfondo manuale. Fare clic sul pulsante 'selezioni a mano libera' trovato nella finestra ImageJ principale e selezionare 3-5 regioni casuali all'interno dell'immagine che non contengono cellule.
- Aprire la funzione 'Impostazione misurazioni indipendenti situato nel menu' Analizza ', selezionare il parametro' medio grigio Valore ', e misurare i valori di intensità con la funzione' Misura '(che si trova anche nel menu' Analizza '). Calcolare il valore medio delle regioni 3-5 misurati, e sottrarre da tutte le successive misurazioni in quell'immagine.
- Per la quantificazione dei test cinetici (protocollo 3), generare una singola immagine, impilati per la time serie. Aprire le immagini a fluorescenza da ogni punto di volta in ordine cronologico, e generare uno stack utilizzando le "Immagini di Stack 'la funzione (che si trova nel menu' Immagine ', sotto il sottomenu Stack).
- Delineare una cella utilizzando lo strumento di selezione a mano libera, avendo cura di includere l'intera cella, ma come piccola area al di fuori della cellula possibile.
- Misurare i seguenti parametri: 'Area, Densità integrata' e 'medio grigio Valore'. Selezionare i parametri utilizzando la funzione 'Impostazione Misure', che si trova nel menu 'Analizza'.
NOTA: Integrato densità corrisponde alla somma di tutte le intensità dei pixel all'interno della regione selezionata, e il valore medio grigio corrisponde [Integrated Densità / Area], che corregge valori di intensità per dimensione della cella. - Aprire il situato nel menu 'Analizza' 'ROI Manager', sotto sotto-menu 'Strumenti'. Nella finestra ROI Manager, fare clic sul pulsante 'Aggiungi' per entrare nel regio evidenziatan come nuova regione di interesse (ROI).
- Ripetere i passaggi 5.4 tramite 5.6 per i restanti celle nell'immagine. Escludere eventuali cellule morte, come valutato dal campo chiaro / DIC e fluorescenza (cellule morte appaiono più scuri nelle immagini DIC, e hanno autofluorescenti segnale citoplasmatica se visti con GFP di eccitazione / emissione; vedi Figura 2F), e tutte le cellule che toccano il bordo dell'immagine. Salvare le ROI selezionate come un file .zip facendo clic sul pulsante 'Altro' nella finestra 'ROI Manager', ed esportare tutte le misure ad un foglio di calcolo o software di analisi statistica.
- Per la quantificazione di saggi cinetici (protocollo 3), tracciare e misurare una cella dal punto di tempo iniziale come descritto ai punti 5.4 e 5.5. Utilizzare lo stesso ROI per la misurazione di tutti i punti temporali successive dell'esperimento.
- Per i saggi endpoint (protocolli 2 e 4), misurare un minimo di 30-50 cellule per ogni condizione. Eseguire la quantificazione per almeno 2-3 immagini e includere tutte le cellule in ogniimmagine che soddisfano i criteri di cui al punto 5.8 per l'analisi.
- Valutare la significatività statistica tra i campioni utilizzando ANOVA, seguito dal test di confronto multiplo di Tukey per l'analisi post hoc.
6. Analisi della Popolazione Mup1-pHluorin Endocitosi mediante citometria di flusso
- Seminare 2-3 colonie di cellule di lievito (circa 2 mm di diametro per colonia) in 0,5 ml di mezzo di YNB privo di metionina e aminoacidi addizionali o nutrienti per mantenere la selezione plasmide. Crescere le cellule in 5 ml provette a fondo rotondo per 16-24 ore a 30 ° C su un tamburo a rulli.
- Aggiungere 1,5 ml di terreno YNB privi acidi metionina e aminoacidi supplementari o nutrienti per la manutenzione plasmide, e crescere a 30 ° C per altri 3 ore su un tamburo a rulli.
- Trasferire 1 ml di cellule in ciascuna delle due provette da 5 ml a fondo rotondo. Aggiungere 0,25 ml di terreno YNB -Met al primo tubo (condizione -Met), e 0,25 ml di mezzo YNB contenente 100 mg/ Ml metionina al secondo tubo per ottenere una concentrazione finale di 20 metionina pg / ml (condizione + Met). Incubare le cellule a 30 ° C per 45 minuti su un tamburo a rulli.
- Analizzare cellule mediante citometria a flusso, selezionando forward scatter (FS) come misura della dimensione cellulare, e l'intensità di fluorescenza Mup1-pHluorin da un filtro isotiocianato di fluoresceina (FITC) come misura del carico internalizzazione.
- Con i tasti cursore per regolare la tensione dei FS e canali FITC per ottimizzare il rilevamento per l'intensità gamma di dimensioni e fluorescenza delle cellule di lievito in uso (per questi esperimenti, impostazioni usate erano 50 V per FS e 400 V per FITC).
NOTA: tensione per entrambi i canali varierà a seconda del citometro a flusso utilizzato. Questa operazione deve essere effettuata prima o durante il trattamento 45 min con metionina (passo 6.3). - Misurare FS e l'intensità della fluorescenza per 10.000 cellule da ogni condizione, utilizzando l'impostazione di portata elevata. Genera un grafico a dispersione di FS contro fluorescence intensità: fare clic su 'aggiungi grafico', selezionare FITC (asse x) e FS (asse y), e grafico 1.000 punti (il software visualizza i valori per 1.000 celle, anche se 10.000 cellule sono state misurate).
NOTA: Per coerenza massimale, analizzare le cellule 45-50 minuti dopo l'aggiunta di metionina; per esperimenti coinvolgono un gran numero di campioni, sfalsare aggiunta di metionina per accogliere il tempo richiesto per citometria a flusso. - Includere condizioni -MET e + Met per wild-type cellule (WT) come controllo. Utilizzando la funzione di gate, assegnare un cancello verticale utilizzando la condizione WT + Met, tale che circa il 5% delle cellule brillanti cadere a destra del cancello. Utilizzare questa gating per tutte le altre condizioni durante l'esperimento.
Risultati
Localizzazione steady-state e la quantificazione del costitutivamente interiorizzato endocitico proteine cargo STE3
Per dimostrare che carichi pHluorin-tag possono essere utilizzati per la quantificazione di endocitosi in cellule viventi, localizzazione di GFP chimerico e fusioni pHluorin con la coda citoplasmatica C-terminale STE3, il recettore feromone un fattore in lievito, sono stati confrontati. STE3 è un recettore accoppiato alla proteina G (GPCR) che è costitutivamente trasportato alla membrana plasmatica, interiorizzato, e mirato a vacuolo per la degradazione 28. Così, in condizioni stazionarie, la maggior parte dei STE3 localizza al lume vacuolo, come si è visto nelle cellule wild-type (WT) che esprimono STE3-GFP (Figura 2A). Al contrario, le cellule prive dei geni che codificano le proteine quattro adattatori clatrina-binding Ent1, Ent2, Yap1801 e Yap1802 (ent1 Δent2 Δ Δ yap1801 yap1802 Δ, di seguito denominato 4Δ) non riescono a stabilizzarsi clathrin nei siti di endocitosi 29, e sono gravemente difettosi in CME 30. Cellule 4Δ richiedono espressione della epsin omologia N-terminale (ENTH) dominio di uno o Ent1 Ent2 per la vitalità 30,31. Il dominio ENTH non è sufficiente per endocitosi in 4Δ cellule, come mostrato da ritenzione di STE3-GFP a livello della membrana plasmatica delle cellule 4Δ + ENTH1 esprimono il dominio ENTH di Ent1 (Figura 2A) 8,30; ritenzione membrana plasmatica simile nelle cellule 4Δ + ENTH1 è stata osservata per altri carichi endocitici, tra cui Ste2-GFP (il recettore feromone α-factor) e Mup1-GFP o Mup1-pHluorin (un permeasi metionina) 8,18. Al contrario, l'espressione di full-length Ent1 da un plasmide in cellule 4Δ (4Δ + Ent1) ripristina endocitosi e la localizzazione di STE3-GFP al vacuolo. cellule 4Δ + ENTH1 sono stati recentemente utilizzati ina screening genetico per identificare un percorso CIE di lievito che si basa sulla actina-modulante GTPasi Rho1 e la sua GEF, Rom1, così come il Formin Bni1 e membri della famiglia α-arrestina di proteine coinvolte nella carico di smistamento 8,18. In linea con un ruolo nel CIE, espressione di ROM1 o LDB19 α-arrestina da plasmidi alta copia nelle cellule 4Δ + ENTH1 interiorizzazione di STE3-GFP (Figura 2A) migliorate.
Le cellule che esprimono STE3-GFP o altri carichi endocitici GFP-tagged hanno vacuoli brillanti a causa di accumulo e la resistenza proteolitici del tag GFP. Al contrario, le cellule che esprimono STE3-pHluorin hanno livelli molto bassi di vacuolare di fluorescenza a causa di quenching del tag pHluorin in ambienti acidi 20. Come visto in precedenza, le cellule WT e 4Δ + Ent1 mostrato molto poco rilevabile STE3-pHluorin da microscopia a fluorescenza (Figura 2B). Al contrario, STE3-pHluorinera facilmente rilevabile a livello della membrana plasmatica delle cellule 4Δ + ENTH1, mentre vacuolare STE3-pHluorin è rimasto quasi non rilevabile in tutti i casi. -Alta copia espressione di ROM1 o LDB19 ridotto la quantità di rilevabile STE3-pHluorin sulla superficie cellulare, simile a risultati con STE3-GFP, anche se vacuolare STE3-pHluorin è rimasto quasi non rilevabile in tutti i casi.
Per confrontare l'efficacia di GFP e carichi come strumenti pHluorin-tag per quantificare i cambiamenti nella capacità endocitico delle cellule, la fluorescenza a cellule di STE3-GFP e STE3-pHluorin è stata misurata in WT e 4Δ cellule. Anche se i cambiamenti nella localizzazione STE3-GFP erano facilmente rilevabili al microscopio (Figura 2A), le differenze di intensità complessiva di fluorescenza non erano statisticamente significative tra il WT, 4Δ + Ent1 e cellule 4Δ + ENTH1 trasformate con vettore vuoto (Figura 2C) 20. Likewise, cellule 4Δ + ENTH1 trasformate con il vettore, ROM1 e LDB19 avevano simili intensità di fluorescenza di cellule intere. In particolare, le cellule 4Δ + ENTH1 trasformate con ROM1 o LDB19 erano significativamente dimmer rispetto alle cellule WT (Figura 2C) 8,18; tuttavia, i livelli di proteina STE3-GFP sono stati simili come valutato mediante immunoblotting (Figura 2E). Mentre la differenza di intensità può essere dovuto in parte alle variazioni di dimensioni vacuolo o morfologia, o differenze di ritenzione del tag GFP nel vacuolo, quantificazione di STE3-GFP fluorescenza non riflette i cambiamenti nella localizzazione osservati al microscopio a fluorescenza (Figura 2A). Al contrario, la quantificazione dell'intensità STE3-pHluorin dimostrato che le cellule 4Δ + ENTH1 trasformate con vettore erano significativamente più luminoso rispetto alle cellule WT o 4Δ + Ent1, e ad alta copia espressione di ROM1 o LDB19 nelle cellule 4Δ + ENTH1 ridotta intensità STE3-pHluorin perlivelli che erano simili a WT e 4Δ + Ent1 (Figura 2D). Così, la quantificazione dello stato stazionario intensità STE3-pHluorin riflette con precisione le differenze nella localizzazione osservato al microscopio a fluorescenza.
Saggi di internalizzazione Kinetic utilizzando il carico endocitico regolata, Mup1
La quantificazione di intensità di fluorescenza per carichi costitutivamente internalizzate allo stato stazionario può rivelare differenze nella capacità di endocitico di cellule mutanti rispetto alle cellule WT. Tuttavia, è possibile che alcuni carichi possono raggiungere la stessa distribuzione allo stato stazionario e l'intensità nelle cellule mutanti WT e endocitiche, anche se le cellule mutanti hanno un ritardo nella endocitosi o inferiori cinetica per il carico internalizzazione. carichi Invece, pHluorin-tag che subiscono endocitosi regolata in risposta ad uno stimolo o ligando specifico può essere utilizzato per monitorare lacinetica di endocitosi. A questo scopo, l'interiorizzazione della metionina permeasi ad alta affinità, Mup1, è stato monitorato 32. In mancanza di metionina extracellulare, espressione Mup1 è upregulated e il permeasi viene mantenuta a livello della membrana plasmatica; l 'aggiunta di metionina al mezzo, Mup1 subisce una rapida internalizzazione e mira al vacuolo 13.
Per monitorare la cinetica di internalizzazione Mup1, ceppi WT esprimono Mup1-GFP o Mup1-pHluorin dal locus genomico sono state coltivate in assenza di metionina per accumulare Mup1 fluorescente sulla membrana plasmatica (punto di tempo Figura 3A, 0 min). time-lapse imaging di cellule è stata poi eseguita a 5 min intervalli in assenza o presenza di metionina per monitorare il carico internalizzazione e variazioni nella fluorescenza. Come previsto, GFP e pHluorin-tagged Mup1 ripreso in assenza di metionina è rimasto a livello della membrana plasmatica Fo l'intero periodo di osservazione di 45 min 20. In contrasto, cellule impressi in presenza di metionina mostrato progressivo esaurimento del segnale di fluorescenza dalla superficie cellulare, coerente con carico internalizzazione. In particolare, Mup1-fluorescenza GFP accumulata in strutture interne (cioè, endosomi e vacuolo), mentre Mup1-pHluorin localizzato a punctae interna che probabilmente corrispondono a endosomi precoci, ma non è stato visto nel vacuolo.
Quando la fluorescenza è stata quantificata in tutti i punti temporali per singole celle, Mup1-GFP e Mup1-pHluorin intensità mostrato piccolo cambiamento in mancanza di metionina applicato esternamente nel corso della 45 min esperimento, coerente con la proteina rimanendo stabilmente localizzato sulla membrana plasmatica (Figura 3B). Al contrario, whole-cell intensità Mup1-pHluorin rapidamente diminuita in presenza di metionina, tale che una riduzione del 50% fluorescence intensità è stata osservata dopo circa 20-25 min, ed una riduzione dell'80% è stata osservata dopo circa 40 min 20. cellule Mup1-GFP anche mostrato una diminuzione della intensità di fluorescenza l 'aggiunta di metionina; tuttavia, la cinetica di perdita di fluorescenza sono stati ritardati rispetto a quelle di Mup1-pHluorin, tale che una diminuzione del 50% dell'intensità è stata osservata solo dopo 40 min. Come si vede nella figura 3A, Mup1-GFP era appena rilevabile a livello della membrana plasmatica in questo momento, indicando che la persistente vacuolare fluorescenza GFP impedito quantificazione accurata di eventi endocitici sulla superficie cellulare.
Dosaggi endpoint che utilizzano il carico endocitico regolata, Mup1
Oltre ai quantitativi, saggi cinetici di endocitosi come sopra descritto, regolamentati carichi endocitici come Mup1 possono essere utilizzati anche per saggi endpoint, simile a quantificazionedello stato stazionario intensità STE3-pHluorin. A questo scopo, il dosaggio per la quantificazione della Mup1-pHluorin internalizzazione è stato modificato per permettere il confronto delle intensità di fluorescenza media da popolazioni di cellule impressi immediatamente prima o 30 minuti dopo l'aggiunta di metionina 8,18. Questo approccio consente il confronto della percentuale di Mup1 interiorizzato tra le cellule mutanti WT e endocytic.
In accordo con i risultati del saggio cinetica (figura 3), Mup1-pHluorin stato rapidamente esaurita dalla membrana plasmatica in cellule WT (Figura 4A), in modo tale che circa il 60% di Mup1-pHluorin stata internalizzata 30 min dopo l'aggiunta di metionina ( Figura 4B). Come previsto, Mup1-pHluorin internalizzazione era ugualmente efficiente in 4 + Ent1 cellule, mentre l'internalizzazione è stata significativamente ridotta nelle cellule 4Δ + ENTH1, in linea con un grave difetto di endocitosi. espressione-alta copiadi ROM1 o LDB19 α-arrestina, che è specificamente necessario per Mup1 internalizzazione via sia CME e CIE vie di diffusione Le 13,18, una migliore internalizzazione dei Mup1-pHluorin, in linea con la loro capacità di promuovere endocitosi nelle cellule 4Δ + ENTH1 18. In particolare, anche se allo stato stazionario intensità STE3-pHluorin nelle cellule 4Δ + ENTH1 esprimendo ad alta copia ROM1 o LDB19 era indistinguibile da cellule WT o 4Δ + Ent1, interiorizzazione di Mup1-pHluorin è stato solo parzialmente migliorato nelle cellule 4Δ + ENTH1 esprimendo ad alta copia ROM1 o LDB19 (Figura 4C). Così, questi dati indicano che i test cinetici e / o endpoint può rivelare differenze nei tassi di endocitici tra WT e mutanti per alcuni carichi, anche se simile distribuzione allo stato stazionario di altri carichi può essere ottenuto negli stessi ceppi.
Analisi basato sulla popolazione di Mup1-PHLuorin internalizzazione usando citometria a flusso
analisi high-throughput di grandi popolazioni di cellule con citometria di flusso in grado di fornire un'alternativa a eseguire test cinetici e endpoint per le merci internalizzazione al microscopio. A questo scopo, l'intensità di fluorescenza di Mup1-pHluorin stata confrontata in cellule WT da una coltura cresciuta in mancanza di metionina (WT -Met, che dovrebbe essere "brillante") o in presenza di metionina per 45 minuti (WT + Met, che deve essere "dim" rispetto alle cellule non trattate basati sulla riduzione dell'80% di intensità di fluorescenza visibile nella figura 3B). Dopo analisi mediante citometria a flusso, un cancello verticale è stata applicata alla condizione WT + Met, dove ~ 5% di cellule erano contenute sul lato destro della porta, e corrispondeva alle cellule brillanti all'interno della popolazione (Figura 5A e 5B , frazione rosso). Quando è stata applicata la stessa portaalla condizione WT -Met, circa il 65% delle cellule caduto nella categoria luminoso, dimostrando che citometria di flusso può essere usato per osservare facilmente differenze di intensità di fluorescenza Mup1-pHluorin tra le popolazioni di cellule prima e dopo l'aggiunta di metionina. Al contrario, la distribuzione di brillante contro cellule dim indistinguibile in condizioni 4Δ + ENTH1 -MET e + Met utilizzando la stessa porta applicata alla popolazione WT + Met, coerente con endocitosi difettoso. Così, citometria a flusso in grado di rilevare i cambiamenti nella capacità endocitico delle cellule, e consente l'analisi rapida di grandi popolazioni di cellule. È importante sottolineare che, citofluorimetria può essere utilizzato anche in schermi genetici come strumento per l'ordinamento e la selezione delle cellule mutanti con endocitosi difettoso (K. Wrasman e B. Wendland, manoscritto in preparazione) 33.
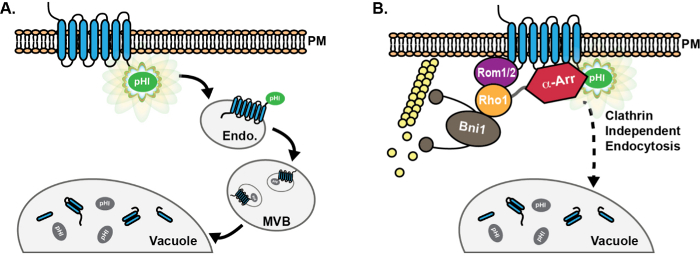
Figura 1: Schema di progressione carico pHluorin-tag attraverso la via endocitico. (A) la fusione chimerico di un pHluorin (PHL) tag sulla coda citoplasmatica di endocitici proteine cargo risultati in fluorescenza rilevabile (verde) del carico a livello della membrana plasmatica (PM ). A seguito di endocitosi, proteine cargo vengono consegnati ai primi endosome (Endo), in cui il tag pHluorin rimane esposta al citoplasma, ed è quindi fluorescente. Successivamente, il macchinario ESCRT promuove carico di smistamento e l'incorporazione in vescicole luminale dei corpi multivesicular (MVB). MVB poi si fondono con il vacuolo per fornire proteine e componenti della membrana per la degradazione. Al momento della costituzione in MVB, il tag pHluorin viene spenta (grigio) a causa di acidificazione. (B) L'utilizzo di carichi pHluorin-targhette ha facilitato la scoperta e la caratterizzazione di proteine coinvolte in un endocitico (CIE) via clatrina-indipendenti nel lievito. Nelle cellule con difetti endocytos clatrina mediataè, ad alta copia espressione della GTPasi Rho1, così come la sua attivazione GEF Rom1, promuovere l'internalizzazione del carico tramite CIE 8. Inoltre, anche se la famiglia α-arrestina (α-Arr) delle proteine ha conosciuto un ruolo nella promozione del carico ubiquitinazione e interiorizzazione via CME 13-17, ruoli per alfa-arrestine in CIE sono stati recentemente identificati, probabilmente a causa di interazione con le proteine CIE, piuttosto che attraverso il reclutamento di ubiquitina ligasi 18. cliccate qui per vedere una versione più grande di questa figura.
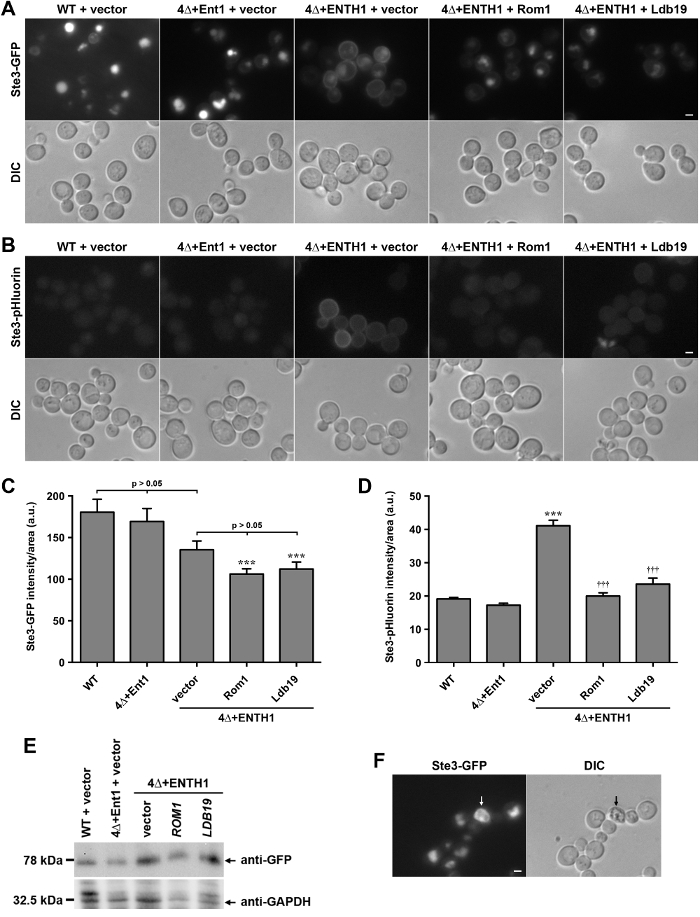
Figura 2:. Localizzazione e quantificazione dei STE3-GFP e STE3-pHluorin in wild-type e cellule mutanti endocitico cellule (A) WT, 4Δ + Ent1 e 4Δ + ENTH1 esprimendo genomicamente codificati STE3-GFP e trasformato con il vettore, ad alta copia ROM1 o ad alta copia LDB19 come indicato sono state visualizzate mediante microscopia a fluorescenza (riga superiore) o DIC (fila in basso). immagini STE3-GFP sono stati adeguati alle stesse intensità massime e minime per permettere il confronto diretto dei STE3 localizzazione. Cellule (B) WT, 4Δ + Ent1 e 4Δ + ENTH1 esprimono genomicamente codificato STE3-pHluorin sono stati trasformati e ripreso come descritto nel pannello A. Barra di scala = 2 micron. (C, D) Quantificazione di intensità di fluorescenza per STE3-GFP (C) e STE3-pHluorin (D) ceppi utilizzati in pannelli A e B. Per ciascuna condizione, fluorescenza a cellula intera è stato quantificato per un minimo di 40 celle. I valori sono stati corretti per le dimensioni delle cellule, ed espressi in unità arbitrarie (AU) come media ± SEM (*** p <0,001 rispetto al WT; ††† p <0,001 rispetto al 4Δ + ENTH1 + vettore). (E) Relative l'espressione di STE3-GFP valutata in WT, 4Δ + Ent1 e cellule 4Δ + ENTH1 trasformato con il vettore, ROM1 alta copia o ad alta copia LDB19 come indicato. Gli estratti cellulari sono state preparate come descritto in precedenza 20, e la stessa quantità di ciascun campione sono stati risolti mediante SDS-PAGE. espressione STE3-GFP è stata valutata mediante immunoblotting con anticorpi anti-GFP e proteine di carico è stata valutata utilizzando anti-GAPDH. (F) cellule wild-type che esprimono genomicamente codificato STE3-GFP visto al microscopio a fluorescenza (pannello STE3-GFP) e ottica DIC, con una cellula morta indicato dalle frecce. Le cellule morte appaiono autofluorescenti nel filtro GFP, e sono più scuri se visti da DIC. Scala bar = 2 micron. Clicca qui per vedere una versione più grande di questa figura.

Figura 3:. Saggio cinetico di Mup1-GFP e Mup1-pHluorin internalizzazione (A) cellule wild-type che esprimono genomicamente codificati Mup1-GFP (superiore due pannelli) o Mup1-pHluorin (inferiori due pannelli) sono stati coltivati a fase di mid-logaritmica in medio YNB privo di metionina per indurre l'espressione Mup1 e la ritenzione a livello della membrana plasmatica. Le cellule sono state poi ripreso al microscopio a fluorescenza ogni 5 minuti in assenza (- Met) o presenza (+ Met) di 20 mg / ml di metionina. Per ogni punto di tempo all'interno di una condizione, sono stati applicati valori di intensità massimo e minimo identici per permettere il confronto dell'intensità di fluorescenza e localizzazione. 0, 5, 10, 20 e 40 punti di tempo minimo sono mostrati come indicato per tutte le condizioni. Barra di scala = 2 micron. (B) Quantificazione dei Mup1-GFP e Mup1-pHluorin internalizzazione nelle cellule wild-type da pannello A. intensità di fluorescenza a cellule di Mup1-GFP (- Met, piazze viola; + Met, diamanti blu) o Mup1-pHluorin (- Met, triangoli verdi; + Met, cerchi rossi) è stato misurato per le singole celle imaged a 5 min intervalli, ed espressi come percentuale del intensità iniziale di fluorescenza (media ± SEM, n = 6 celle per condizione). Ristampato da Prosser et al. (2010) 20 con il permesso dell'editore. Clicca qui per vedere una versione più grande di questa figura.
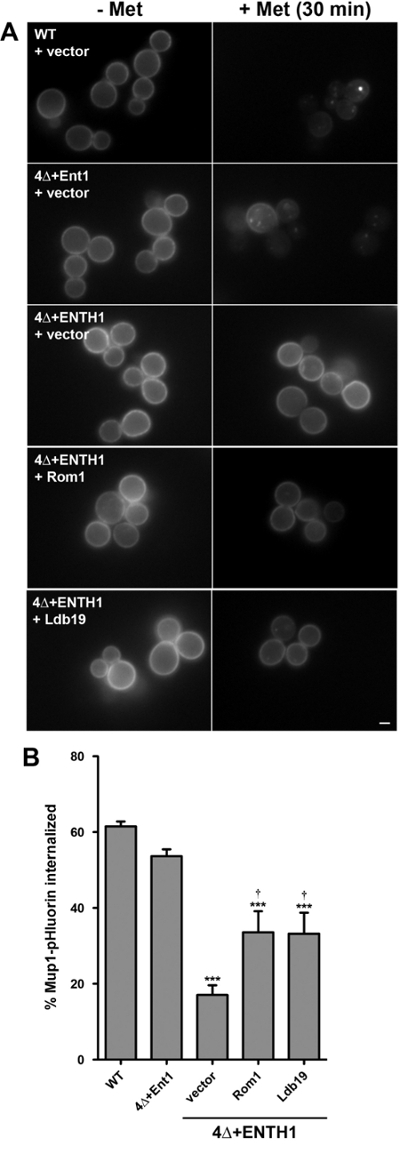
Figura 4:. Celle di test endpoint di Mup1-pHluorin internalizzazione (A) WT, 4Δ + Ent1 e 4Δ + ENTH1 esprimendo genomicamente codificati Mup1-pHluorin e trasformati con il vettore, ad alta copia ROM1 o ad alta copia LDB19 come indicato sono stati coltivati a metà fase -logarithmic in media YNB privo di metionina. campi aleatori di cellule sono stati ripresi da fluorescenc e microscopia immediatamente prima (- Met) o 30 minuti dopo (+ Met) aggiunta di 20 ug / ml di metionina. Tutte le immagini sono stati adeguati agli stessi valori massimi e minimi di intensità. Barra di scala = 2 micron. (B) Quantificazione dei Mup1-pHluorin internalizzazione nelle cellule da pannello A. Per ciascuna condizione, intensità di fluorescenza a cellula intera è stato misurato per un minimo di 40 celle e corretta per dimensione della cella. La percentuale di Mup1-pHluorin internalizzata stato calcolato confrontando significa valori di intensità prima e dopo 30 min trattamento con metionina. I valori sono mostrati come media ± SEM (n = 4; *** p <0,001 rispetto al WT; † p <0,05 rispetto al 4Δ + ENTH1 + vettore). Questa cifra è stata modificata da Prosser et al. (2015) 18 con il permesso dell'editore. Clicca qui per vedere una versione più grande di questa figura.
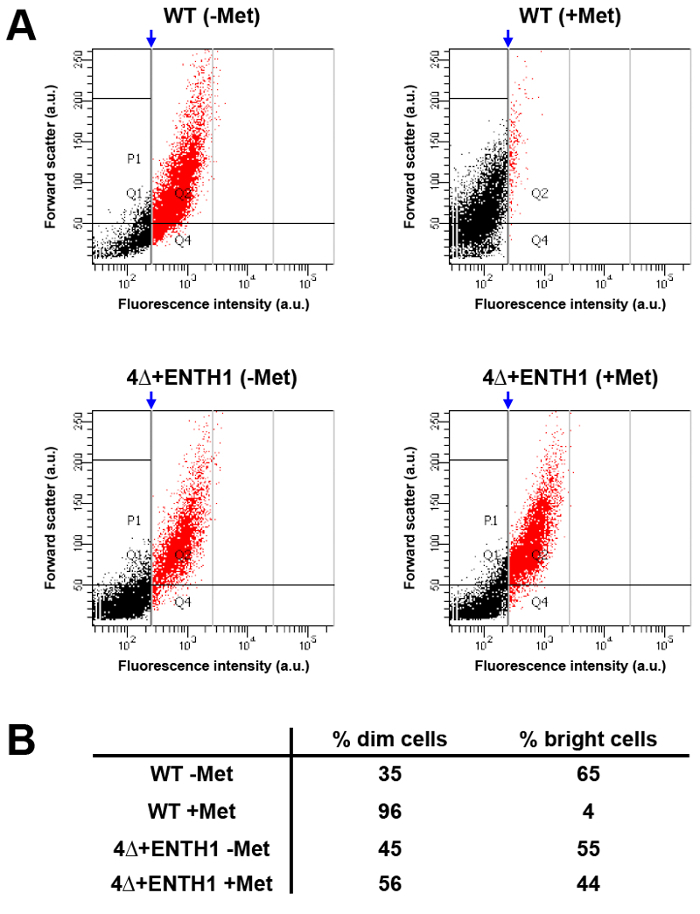
Figura 5:. Analisi Popolazione Mup1-pHuorin internalizzazione mediante citometria di flusso cellule WT e 4Δ + ENTH1 (A) sono state coltivate per fase metà logaritmica in media YNB privo di metionina. Le cellule sono state poi incubate in assenza (- Met) o presenza (+ Met) di 20 mg / ml di metionina per 45 minuti prima dell'analisi mediante citometria a flusso. Per ciascuna condizione, forward scatter (in unità arbitrarie AU) è stata rilevata in intensità di fluorescenza (au, utilizzando un filtro FITC) per 1.000 celle su un totale di 10.000 cellule misurata. Popolazioni sono stati ulteriormente analizzati applicando un cancello verticale (freccia blu) alla condizione WT + Met, dove circa il 5% delle cellule brillanti (mostrati in rosso) caduta sul lato destro della porta. Il gating generato per la condizione WT + Met è stata poi applicata alle restanti condizioni per permettere il confrontodi distribuzioni del campione. (B) Sintesi della percentuale di cellule dim (punti neri, a sinistra della porta) e le cellule luminosi (punti rossi, alla destra della porta) per WT e 4Δ + ENTH1 ± prove Met come da tabella A. Si prega clicca qui per vedere una versione più grande di questa figura.
| Sforzo | Genotipo | fonte |
| SEY6210 un | MAT α-his3 Δ200 TRP1-Δ901 leu2-3,112 ura3-52 lys2-801 SUC2-Δ9 | plasmide Laboratorio |
| BWY2858 | STE3-GFP :: KANMX6 | Prosser et al. (2010) 16 |
| BWY2995 | STE3-pHluorin :: KANMX6 | PRosser et al. (2010) 16 |
| BWY3036 | ent1Δ :: LEU2 ent2Δ :: HIS3 yap1801Δ :: HIS3 yap1802Δ :: LEU2 STE3-pHluorin :: KANMX6 + pEnt1 [CEN TRP1] | Prosser et al. (2010) 16 |
| BWY3037 | ent1Δ :: LEU2 ent2Δ :: HIS3 yap1801Δ :: HIS3 yap1802Δ :: LEU2 STE3-pHluorin :: KANMX6 + pENTH1 [CEN TRP1] | Prosser et al. (2010) 16 |
| BWY3399 | ent1Δ :: LEU2 ent2Δ :: HIS3 yap1801Δ :: HIS3 yap1802Δ :: LEU2 STE3-GFP :: KANMX6 + pEnt1 [CEN TRP1] | Prosser et al. (2010) 16 |
| BWY3400 | ent1Δ :: LEU2 ent2Δ :: HIS3 yap1801Δ :: HIS3 yap1802Δ :: LEU2 STE3-GFP :: KANMX6 + pEnt1 [CEN TRP1] | Prosser et al. (2010) 16 |
| BWY3817 | MUP1-GFP :: KANMX6 | PrOsser et al. (2010) 16 |
| BWY3818 | MUP1-pHluorin :: KANMX6 | Prosser et al. (2010) 16 |
| BWY4153 | ent1Δ :: LEU2 ent2Δ :: HIS3 yap1801Δ :: HIS3 yap1802Δ :: LEU2 MUP1-pHluorin :: KANMX6 + pEnt1 [CEN TRP1] | Prosser et al. (2011) 7 |
| BWY4154 | ent1Δ :: LEU2 ent2Δ :: HIS3 yap1801Δ :: HIS3 yap1802Δ :: LEU2 MUP1-pHluorin :: KANMX6 + pENTH1 [CEN TRP1] | Prosser et al. (2011) 7 |
| un Tutti i ceppi utilizzati in questo studio sono isogenico per SEY6210 tranne al loci indicata. | ||
Tabella 1: ceppi di lievito utilizzati in questo studio.
| plasmidi | Descrizione | fonte |
| pRS426 | 2μ URA3 | Sikorski e Hieter 1989 |
| pBW0768 | pRS414 :: Ent1 [CEN TRP1] | pEnt1, plasmide Laboratorio |
| pBW0778 | pRS414 :: ent1 (aa1-151) [CEN TRP1] | pENTH1, plasmide Laboratorio |
| pBW1571 | pFA6a-pHluorin-KANMX6 | Prosser et al. (2010) 16 |
| pBW2053 | YEp24 :: ROM1 [2μ URA3] | PROM1 (Prosser et al., 2011) 7 |
| pRS426-Ldb19 | LDB19prom-LDB19 [2μ URA3] | Prosser et al. (2015) 15 |
| pFA6a-GFP (S65T) -kanMX6 | plasmide integrando pFA6a-GFP-KANMX6, PCR-based per GFP-tagging in lievito | Longtineet al. (1998) 21 |
Tabella 2: Plasmidi utilizzati in questo studio.
| Tempo (min) | Azioni) |
| -5 | campione Immagine 1 (-Met) |
| 0 | Aggiungere metionina al campione 1 |
| campione Immagine 2 (-Met) | |
| 5 | Aggiungere metionina a campione 2 |
| campione Immagine 3 (-Met) | |
| 10 | Aggiungere metionina a campione 3 |
| campione Immagine 4 (-Met) | |
| 15 | Aggiungere metionina a campione 4 |
| campione Immagine 5 (-Met) | |
| 20 | Aggiungeremetionina a campione 5 |
| campione Immagine 6 (-Met) | |
| 25 | Aggiungere metionina per assaggiare 6 |
| campione Immagine 7 (-Met) | |
| 30 | Aggiungere metionina a campione 7 |
| campione Immagine 8 (-Met) | |
| campione Immagine 1 (+ Met) | |
| 35 | Aggiungere metionina a campione 8 |
| campione Immagine 2 (+ Met) | |
| 40 | campione Immagine 3 (+ Met) |
| 45 | campione Immagine 4 (+ Met) |
| 50 | campione Immagine 5 (+ Met) |
| 55 | campione Immagine 6 (+ Met) |
| 60 | campione Immagine 7 (+ Met) |
| 65 | campione Immagine 8 (+ Met) |
Tabella 3: Flusso di lavoro Esempio di vacillamento 8 dosaggi endpoint Mup1-pHluorin.
Discussione
Applicazioni di pHluorin per la quantificazione degli eventi endocitosi in cellule di lievito fa uso di carichi transmembrana in cui il tag fluorescente viene fusa alla coda citoplasmatica della proteina (Figura 1A). Per i saggi qui descritte, carichi sono fluorescenti vivacemente quando il tag pHluorin è esposto ad ambienti neutri, ma diventano spenta quando il tag pHluorin incontra condizioni di acidità. Così, un carico endocitico pHluorin-tag è prontamente rilevata la faccia citoplasmatica della membrana plasmatica e endosomi precoci, ma diventa "dim" incorporati in luminali vescicole MVB o al momento della consegna al lume vacuolo. In generale, carichi endocitici nuova sintesi probabilmente lasciano il reticolo endoplasmatico (ER) e raggiungono la membrana plasmatica prima GFP e molte delle sue varianti hanno pienamente maturato; in tal modo, carichi che non hanno ancora raggiunto la superficie cellulare sono previsti pHluorin-tagged per rimanere rilevabile a meno che l'uscita dal pronto soccorso o di Golgi è impaired.
Uso di carichi endocitici pHluorin-tag come STE3 e Mup1 ha facilitato la caratterizzazione di un certo numero di proteine coinvolte nel pathway di lievito CIE (Figura 1B) 8,18. In particolare, i metodi descritti in questo documento sono stati utilizzati per dimostrare che l'aumentata produzione di actina-modulante GTPasi Rho1 e la sua GEF Rom1 promuovere endocitosi in una varietà di mutanti di lievito con difetti di CME 8. Inoltre, carichi pHluorin-tag sono stati recentemente utilizzati per dimostrare quantitativamente che alfa-arrestine, che hanno ruoli ben consolidata nel CME 13-15,34-36, giocano un ruolo di carico-selettivo sia CME e CIE, e hanno funzioni distinte meccanicamente nei due percorsi 18.
Per i protocolli descritti in questo documento, diversi fattori importanti devono essere considerati per ottenere risultati costanti e quantitativi. In primo luogo, Mup1-GFP o Mup1-pHluorin espressione e FLUORESscenza può diminuire come cellule di lievito si avvicinano o entrano nella fase di crescita stazionaria (risultati non pubblicati); in tal modo, le cellule cresciute da una cultura durante la notte devono essere diluiti e ri-coltivati per un ulteriore 3 ore (vedere i passaggi 3.1-3.2 e 6.1-6.2). Inoltre, quando sfalsando più condizioni sperimentali o ceppi in saggi endpoint o per l'analisi mediante citometria di flusso, è importante raccogliere i dati per tutti i campioni dopo la stessa durata del trattamento metionina per consentire il confronto tra singole condizioni. Per l'analisi post-acquisizione, quantificazione deve essere effettuata utilizzando immagini a 16 bit, dato che la conversione in formato a 8 bit provoca la perdita di dati che può influenzare i valori di intensità di fluorescenza. Inoltre, sottrazione del background deve essere eseguita prima della quantificazione (passo 5.3), in quanto il segnale di fondo può occludere significativamente differenze di intensità tra i campioni.
Mentre pHluorin-tag STE3 e Mup1 hanno dimostrato suscettibile di quantificazione, nontutti i carichi saranno ben si adatta a pHluorin tagging. Ad esempio, i tentativi di contrassegnare l'α-factor receptor Ste2 hanno dato risultati quantitativi incoerenti, probabilmente a causa della minore intensità di fluorescenza Ste2-pHluorin rispetto a quella dei STE3 o Mup1 (risultati non pubblicati), anche se è possibile che i tag tandem pHluorin potrebbero migliorare l'intensità del segnale. Inoltre, carichi con tassi molto lente dell'endocitosi ligando-indotta non possono essere suscettibili di pHluorin codifica per la quantificazione, specialmente se il primo tempo di internalizzazione è più lungo del ciclo cellulare di lievito (circa 90 min). Per tali carichi, una diminuzione della fluorescenza potrebbe derivare da endocitosi e / o dalla ripartizione del carico tra le cellule madre e figlia durante la divisione. Così, il test singoli carichi di interesse si raccomanda, al fine di determinare se la loro espressione e cinetica sono adatti per pHluorin-tagging e la quantificazione.
Sebbene studi recenti che utilizzano PHLuorin si sono concentrati principalmente su eventi endocitici a livello della membrana plasmatica, carichi pHluorin-tag possono essere utilizzati per studiare gli eventi di traffico più tardi nella via endocitico. Ad esempio, Mup1-pHluorin è stato utilizzato con successo nel flusso saggi citometria a base di carico ESCRT-mediata di smistamento in MVB 37, dal momento che il tag pHluorin viene spenta al momento della costituzione in MVB vescicole luminali 20. Questo approccio è simile alla luciferasi più recentemente descritto di deposizione intraluminale dosaggio (LUCID), che fa uso di carichi con un tag luciferasi citoplasmatica per generare un segnale bioluminescente in presenza di luciferina 38,39. Simile a quenching di fluorescenza pHluorin al momento della costituzione in MVB vescicole luminali, bioluminescenza nel saggio lucido è attenuato al momento della costituzione del tag luciferasi in vescicole MVB. Mentre pHluorin e analisi lucida sono concettualmente simili, carichi pHluorin-tag possono essere utilizzati per studiare endocitosi e MVB maturazione icellule n intatte.
Esistono metodi alternativi per la quantificazione di endocitosi, e hanno fornito preziose informazioni sui tassi di carico internalizzazione a wild-type e cellule mutanti endocytic. Gli esempi includono il monitoraggio assorbimento di ligandi radioattivi come l'α-factor (che si lega al recettore feromone Ste2) e uracile (che viene interiorizzato dal permeasi Fur4) 40,41, o il monitoraggio della velocità di degradazione per carichi endocitici come STE3 come sono internalizzati e trasportati al vacuolo 42. Questi approcci biochimici richiedono la lisi cellulare, e non sono quindi adatti per quantificazione diretta nelle cellule viventi. In alternativa, fluorescente α-factor, la fase fluida colorante Lucifer giallo, o il colorante styryl FM4-64 può essere utilizzato per visualizzare endocitosi nelle cellule viventi, ma non consentono il monitoraggio diretto di proteine cargo endogeno espresse 40,43,44. Per questi approcci, la persistenza di fluorescenza a VAlumen cuole possono complicare la quantificazione, come si è visto con GFP. È anche possibile utilizzare carichi GFP-tagged per la quantificazione di endocitosi misurando intensità di fluorescenza whole-cell e sottraendo il segnale da compartimenti citoplasma e endosomiali / vacuolari; tuttavia, endosomi e vacuoli sono spesso in prossimità della membrana plasmatica. Al contrario, carichi endocitici pHluorin-tag sono state spente in MVB / compartimenti vacuolo, che può essere un vantaggio per la quantificazione degli eventi di traffico rispetto al tag GFP più largamente usato. I nostri studi futuri potranno estendere le attuali conoscenze dei percorsi endocitici e merci di smistamento in lievito per identificare ulteriori fattori che contribuiscono al CME e CIE, e per comprendere i meccanismi che regolano le decisioni carico ordinamento.
Divulgazioni
The authors declare no competing interests.
Riconoscimenti
We would like to thank Gero Miesenböck and Tim Ryan for sharing pHluorin cDNA used to generate reagents in this study, Nathan Wright, Joanna Poprawski and Lydia Nyasae for excellent technical assistance, members of the Wendland lab for helpful discussions, and Michael McCaffery and Erin Pryce at the Integrated Imaging Center (Johns Hopkins) for advice and assistance with microscopy and flow cytometry. This work was supported by grants from the National Institutes of Health (to B.W., GM60979) and the National Science Foundation (to B.W., MCB 1024818). K.W. was supported in part by a training grant from the National Institutes of Health (T32-GM007231). A.F.O. was supported by developmental funds from the Department of Biological Sciences at Duquesne University and National Science Foundation CAREER grant 553143.
Materiali
| Name | Company | Catalog Number | Comments |
| Adenine | Sigma | A8626-25G | Use for preparation of amino acid mixture and stock solution |
| Bacto-agar | Fisher | BP1423-2 | Use for preparation of plate media |
| BD Difco Yeast Nitrogen Base (without amino acids) | BD | 291920 | Use for preparation of liquid and plate media |
| Concanavalin A | Sigma | C5275-5MG | Use for coating of chamber slides |
| Dextrose | Fisher | BP350-1 | Use for preparation of liquid and plate media |
| L-Histidine | Fisher | BP382-100 | Use for preparation of amino acid mixture and stock solution |
| L-Leucine | Acros | 125121000 | Use for preparation of amino acid mixture and stock solution |
| L-Lysine | Fisher | BP386-100 | Use for preparation of amino acid mixture and stock solution |
| L-Methionine | Fisher | BP388-100 | Use for preparation of amino acid mixture and stock solution |
| L-Tryptophan | Fisher | BP395-100 | Use for preparation of amino acid mixture and stock solution |
| L-Tyrosine | Acros | 140641000 | Use for preparation of amino acid mixture |
| Nunc Lab-Tek Chambered Coverglass (8-well) | Thermo Scientific | 155411 | Use for kinetic and endpoint assays of Mup1-pHluorin internalization |
| Uracil | Sigma | U0750-100G | Use for preparation of amino acid mixture and stock solution |
| Axiovert 200 inverted microscope | Carl Zeiss | Custom Build | |
| 100X/1.4 Plan-Apochromat Oil Immersion Objective Lens | Carl Zeiss | Objective should be 100X, 1.4NA or higher | |
| Sensicam | Cooke Corporation | Camera should have 12-bit or higher dynamic range | |
| X-Cite 120PC Q Illumination Source | Excelitas Technologies | ||
| Slidebook 5 software | Intelligent Imaging Innovations | ||
| ImageJ software | National Institutes of Health | http://imagej.nih.gov/ij/ |
Riferimenti
- Kaksonen, M., Sun, Y., Drubin, D. G. A pathway for association of receptors, adaptors, and actin during endocytic internalization. Cell. 115 (4), 475-487 (2003).
- Kaksonen, M., Toret, C. P., Drubin, D. G. A modular design for the clathrin- and actin-mediated endocytosis machinery. Cell. 123 (2), 305-320 (2005).
- Boettner, D. R., Chi, R. J., Lemmon, S. K. Lessons from yeast for clathrin-mediated endocytosis. Nat Cell Biol. 14 (1), 2-10 (2012).
- Taylor, M. J., Perrais, D., Merrifield, C. J. A High Precision Survey of the Molecular Dynamics of Mammalian Clathrin-Mediated Endocytosis. PLoS Biol. 9 (3), e1000604 (2011).
- Hansen, C. G., Nichols, B. J. Molecular mechanisms of clathrin-independent endocytosis. J Cell Sci. 122 (11), 1713-1721 (2009).
- Sabharanjak, S., Sharma, P., Parton, R. G., Mayor, S. GPI-anchored proteins are delivered to recycling endosomes via a distinct cdc42-regulated, clathrin-independent pinocytic pathway. Dev Cell. 2 (4), 411-423 (2002).
- Radhakrishna, H., Klausner, R. D., Donaldson, J. G. Aluminum fluoride stimulates surface protrusions in cells overexpressing the ARF6 GTPase. J Cell Biol. 134 (4), 935-947 (1996).
- Prosser, D. C., Drivas, T. G., Maldonado-Báez, L., Wendland, B. Existence of a novel clathrin-independent endocytic pathway in yeast that depends on Rho1 and formin. J Cell Biol. 195 (4), 657-671 (2011).
- Prosser, D. C., Wendland, B. Conserved roles for yeast Rho1 and mammalian RhoA GTPases in clathrin-independent endocytosis. Small GTPases. 3 (4), 229-235 (2012).
- Kohno, H., et al. Bni1p implicated in cytoskeletal control is a putative target of Rho1p small GTP binding protein in Saccharomyces cerevisiae. EMBO J. 15 (22), 6060-6068 (1996).
- Evangelista, M., et al. a Yeast Formin Linking Cdc42p and the Actin Cytoskeleton During Polarized Morphogenesis. Science. 276 (5309), 118-122 (1997).
- Kübler, E., Riezman, H. Actin and fimbrin are required for the internalization step of endocytosis in yeast. EMBO J. 12 (7), 2855-2862 (1993).
- Lin, C. H., MacGurn, J. A., Chu, T., Stefan, C. J., Emr, S. D. Arrestin-Related Ubiquitin-Ligase Adaptors Regulate Endocytosis and Protein Turnover at the Cell Surface. Cell. 135 (4), 714-725 (2008).
- Nikko, E., Sullivan, J. A., Pelham, H. R. B. Arrestin-like proteins mediate ubiquitination and endocytosis of the yeast metal transporter Smf1. EMBO Rep. 9 (12), 1216-1221 (2008).
- Nikko, E., Pelham, H. R. B. Arrestin-Mediated Endocytosis of Yeast Plasma Membrane Transporters. Traffic. 10 (12), 1856-1867 (2009).
- O'Donnell, A. F., McCartney, R. R., Chandrashekarappa, D. G., Zhang, B. B., Thorner, J., Schmidt, M. C. 2-Deoxyglucose impairs Saccharomyces cerevisiae growth by stimulating Snf1-regulated and α-arrestin-mediated trafficking of hexose transporters 1 and 3. Mol Cell Biol. 35 (6), 939-955 (2015).
- O'Donnell, A. F., Huang, L., Thorner, J., Cyert, M. S. A calcineurin-dependent switch controls the trafficking function of α-arrestin Aly1/Art6. J Biol Chem. 288 (33), 24063-24080 (2013).
- Prosser, D. C., Pannunzio, A. E., Brodsky, J. L., Thorner, J., Wendland, B., O'Donnell, A. F. α-Arrestins participate in cargo selection for both clathrin-independent and clathrin-mediated endocytosis. J Cell Sci. 128 (22), 4220-4234 (2015).
- Lamaze, C., Dujeancourt, A., Baba, T., Lo, C. G., Benmerah, A., Dautry-Varsat, A. Interleukin 2 receptors and detergent-resistant membrane domains define a clathrin-independent endocytic pathway. Mol Cell. 7 (3), 661-671 (2001).
- Prosser, D. C., Whitworth, K., Wendland, B. Quantitative analysis of endocytosis with cytoplasmic pHluorin chimeras. Traffic. 11 (9), 1141-1150 (2010).
- Bokman, S. H., Ward, W. W. Renaturation of green-fluorescent protein. Biochem Biophys Res Commun. 101 (4), 1372-1380 (1981).
- Miesenböck, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Sankaranarayanan, S., De Angelis, D., Rothman, J. E., Ryan, T. A. The Use of pHluorins for Optical Measurements of Presynaptic Activity. Biophys J. 79 (4), 2199-2208 (2000).
- Katzmann, D. J., Babst, M., Emr, S. D. Ubiquitin-dependent sorting into the multivesicular body pathway requires the function of a conserved endosomal protein sorting complex. ESCRT-I. Cell. 106 (2), 145-155 (2001).
- Longtine, M. S., et al. Additional modules for versatile and economical PCR-based gene deletion and modification in Saccharomyces cerevisiae. Yeast. 14 (10), 953-961 (1998).
- Goldstein, A. L., McCusker, J. H. Three new dominant drug resistance cassettes for gene disruption in Saccharomyces cerevisiae. Yeast. 15 (14), 1541-1553 (1999).
- Ausubel, F. M. . Curr Prot Mol Biol. , (1991).
- Urbanowski, J. L., Piper, R. C. Ubiquitin sorts proteins into the intralumenal degradative compartment of the late-endosome/vacuole. Traffic. 2 (9), 622-630 (2001).
- Newpher, T. M., Smith, R. P., Lemmon, V., Lemmon, S. K. In Vivo Dynamics of Clathrin and Its Adaptor-Dependent Recruitment to the Actin-Based Endocytic Machinery in Yeast. Dev Cell. 9 (1), 87-98 (2005).
- Maldonado-Báez, L., Dores, M. R., Perkins, E. M., Drivas, T. G., Hicke, L., Wendland, B. Interaction between Epsin/Yap180 adaptors and the scaffolds Ede1/Pan1 is required for endocytosis. Mol Biol Cell. 19 (7), 2936-2948 (2008).
- Aguilar, R. C., et al. Epsin N-terminal homology domains perform an essential function regulating Cdc42 through binding Cdc42 GTPase-activating proteins. Proc Natl Acad Sci U.S.A. 103 (11), 4116-4121 (2006).
- Isnard, A. D., Thomas, D., Surdin-Kerjan, Y. The study of methionine uptake in Saccharomyces cerevisiae reveals a new family of amino acid permeases. J Mol Biol. 262 (4), 473-484 (1996).
- Wendland, B., McCaffery, J. M., Xiao, Q., Emr, S. D. A novel fluorescence-activated cell sorter-based screen for yeast endocytosis mutants identifies a yeast homologue of mammalian eps15. J Cell Biol. 135 (6), 1485-1500 (1996).
- Alvaro, C. G., et al. Specific Alpha-Arrestins Negatively Regulate Saccharomyces cerevisiae Pheromone Response by Down-Modulating the G-Protein-Coupled Receptor Ste2. Mol Cell Biol. 34 (14), 2660-2681 (2014).
- Ghaddar, K., Merhi, A., Saliba, E., Krammer, E. M., Prevost, M., Andre, B. Substrate-Induced Ubiquitylation and Endocytosis of Yeast Amino Acid Permeases. Mol Cell Biol. 34 (24), 4447-4463 (2014).
- Becuwe, M., Léon, S. Integrated control of transporter endocytosis and recycling by the arrestin-related protein Rod1 and the ubiquitin ligase Rsp5. eLife. 3, (2014).
- Henne, W. M., Buchkovich, N. J., Zhao, Y., Emr, S. D. The Endosomal Sorting Complex ESCRT-II Mediates the Assembly and Architecture of ESCRT-III Helices. Cell. 151 (2), 356-371 (2012).
- Nickerson, D. P., Russell, M. R. G., Lo, S. -. Y., Chapin, H. C., Milnes, J. M., Merz, A. J. Termination of Isoform-Selective Vps21/Rab5 Signaling at Endolysosomal Organelles by Msb3/Gyp3. Traffic. 13 (10), 1411-1428 (2012).
- Nickerson, D. P., Merz, A. J. LUCID: A Quantitative Assay of ESCRT-Mediated Cargo Sorting into Multivesicular Bodies. Traffic. 16 (12), 1318-1329 (2015).
- Dulic, V., Egerton, M., Elguindi, I., Raths, S., Singer, B., Riezman, H. Yeast endocytosis assays. Methods Enzymol. 194, 697-710 (1991).
- Silve, S., Volland, C., Garnier, C., Jund, R., Chevallier, M. R., Haguenauer-Tsapis, R. Membrane insertion of uracil permease, a polytopic yeast plasma membrane protein. Mol Cell Biol. 11 (2), 1114-1124 (1991).
- Miliaras, N. B., Park, J. -. H., Wendland, B. The Function of the Endocytic Scaffold Protein Pan1p Depends on Multiple Domains. Traffic. 5 (12), 963-978 (2004).
- Vida, T. A., Emr, S. D. A new vital stain for visualizing vacuolar membrane dynamics and endocytosis in yeast. J Cell Biol. 128 (5), 779-792 (1995).
- Toshima, J. Y., Toshima, J., Kaksonen, M., Martin, A. C., King, D. S., Drubin, D. G. Spatial dynamics of receptor-mediated endocytic trafficking in budding yeast revealed by using fluorescent alpha-factor derivatives. Proc Natl Acad Sci U.S.A. 103 (15), 5793-5798 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon