Method Article
出芽酵母におけるエンドサイトーシスの定量的、動力学的およびハイスループット分析のためのpHluorinの応用
要約
Accurate quantification of vesicular trafficking events often provides key insights into roles for specific proteins and the effects of mutations. This paper presents methods for using superecliptic pHluorin, a pH-sensitive GFP variant, as a tool for quantification of endocytic events in living cells using quantitative fluorescence microscopy and flow cytometry.
要約
緑色蛍光タンパク質(GFP)およびその変異体は、広くタンパク質の局在や、細胞骨格の再構築と生きた細胞内小胞輸送などのイベントのダイナミクスを研究するためのツールを使用しています。キメラGFP融合物を用いた定量方法は、多くの用途のために開発されています。しかし、GFPは、タンパク質分解に対して多少耐性があるので、その蛍光は、エンドサイトーシス経路に貨物輸送の定量化を妨げる可能性がリソソーム/液胞に持続します。エンドサイトーシスとエンドサイトーシス後の人身売買のイベントを定量化するための別の方法はsuperecliptic pHluorin、酸性環境中で急冷されるGFPのpH感受性の変異体を使用しています。多胞体(MVBs)およびリソソーム/液胞の内腔への配信への貨物の取り込み時に蛍光の減衰における膜貫通貨物タンパク質結果の細胞質尾部にpHluorinのキメラ融合。このように、液胞蛍光の消光はquantifiを容易にエンドサイトーシスとエンドサイトーシス経路における初期の事象のカチオン。本稿では、フローサイトメトリーを用いて、蛍光顕微鏡を介したエンドサイトーシスの定量化のためのpHluorinタグ付き貨物だけでなく、集団ベースのアッセイを使用する方法について説明します。
概要
小胞輸送は、真核細胞内小器官の同一性および機能を維持する上で重要な役割を果たし、個々の細胞区画のタンパク質および膜組成を調節するための重要なメカニズムです。エンドサイトーシスを介して生成された小胞は、その後のリサイクルまたはリソソームに標的化するための表面から膜およびタンパク質を除去に対し、原形質膜で、エキソサイトーシス小胞の融合は、細胞の表面に新たなタンパク質や膜を実現します。このように、エンドサイトーシスは、栄養摂取のためおよび細胞外環境への応答のために重要です。エキソサイトーシスおよびエンドサイトーシスは、形質膜の表面積を調節するため、および損傷を受けたタンパク質の代謝回転を可能にするようにバランスされています。
酵母および哺乳動物細胞での研究には、専用の様々なことに応答して、エンドサイトーシスに関与するタンパク質の大規模な数、ならびに特定の貨物の内在化を促進する複数のエンドサイトーシス経路またはその行為を同定していますvironmental条件。最もよく研究経路は、クラスリンおよびサイトゾルアクセサリータンパク質は、発生期のエンドサイトーシス小胞を安定化させるためにコート構造に集合したクラスリン依存性エンドサイトーシス(CME)、です。出芽酵母サッカロマイセス・セレビシエにおける実験は、力学と多くのエンドサイトーシスタンパク質1-3のための募集のために重要な洞察が得られています。特に、CMEの機械は非常に進化の過程で保存されているような酵母におけるCME関連タンパク質の大部分は人間のオルソログを持っていること。このように、出芽酵母は、高等真核生物に保存されているエンドサイトーシスのメカニズムを理解するための重要なツールとなっています。例えば、出芽酵母を用いた研究では、追加のエンドサイトーシスのアクセサリーの動員に続いて、CME構造(酵母における皮質アクチンパッチと呼ばれる)の形成と成熟がクラスリンと貨物結合アダプタータンパク質で始まる、多くのタンパク質の順次募集を伴う決定しましたタンパク質、ARP2 / 3媒介アクチン重合の活性化、および小胞の切断の1,2に関与するタンパク質の動員。皮質アクチンパッチにCME機械タンパク質の募集は、高度に秩序とステレオタイプのプロセスであり、多くのタンパク質のための募集の正確な順序は、CMEの機械の他の構成要素に関して確立されています。重要なことは、最近の研究では、哺乳動物細胞4でクラスリン被覆ピットでのCMEのタンパク質のための募集の同様の順序を確認しています。
CMEに加えて、多くの細胞型は、原形質膜5-7の小胞形成および内在化を促進するための代替メカニズムに頼る一つ以上のクラスリン非依存性エンドサイトーシス(CIE)の経路を有します。酵母では、我々は最近、低分子量GTPase Rho1とその活性化グアニンヌクレオチド交換因子(GEF)、ROM1 8,9を利用CIE経路を同定しました。 Rho1は、アクチン重合1を促進するためにformin Bni1を活性化させます酵母12でクラスリン非依存性エンドサイトーシスは、このフォームに必要とされる0,11、。また、タンパク質のα-アレスチンファミリーは、CME 13-17を通じて貨物のユビキチン化およびその後の内在化を促進し、またおそらくCIE 18に関与するタンパク質との直接的な相互作用を介して、CIE経路を介して貨物の内在化を促進するために、ユビキチンリガーゼRSP5を募集します。 CIE経路の様々なもRho1オルソログ、RhoAの9,19に依存しているクラスリン依存せず、食作用経路を含めた哺乳動物細胞、中に存在します。哺乳類CIEにおけるRhoAの役割は十分に理解されていません。従って、出芽酵母での研究は、哺乳類のCIEに適用可能な追加の機械的な洞察を提供してもよいです。
エンドサイトーシス事象の正確な定量は、エンドサイトーシスを調節する特定のタンパク質の役割に関する重要な情報を提供することができ、および貨物の内在またはprogressio上の変異の影響を明らかにすることができますエンドサイトーシス経路を介して、n個。この目的のために、生化学的方法は、リガンドの取り込みを監視するために、またはエンドサイトーシス積荷タンパク質の分解の速度を測定するために利用することができます。生細胞において、関心対象の貨物に緑色蛍光タンパク質(GFP)及びその変異体の融合は、貨物輸送の直接可視化を可能にします。 GFPは、(酵母または液胞)リソソームでの分解に耐性があるのでしかし、GFPタグ貨物は、エンドサイトーシスの定量化のための使用が制限されています。また、GFP蛍光は、pHの変化に部分的にのみ敏感であり、液胞ルーメン20,21内で検出可能なままです。その結果、GFPタグの蛍光は、貨物の残りの部分が劣化したずっと後に液胞に固執し、貨物の強度の全細胞ベースの定量化が原因液胞の長期的なGFP蛍光に不正確になることがあります。
液胞GFP蛍光の欠点を克服するために、我々は、以前にsuperecliptic pHを使用しましたluorin、中性pHで明るく蛍光を発するが、そのようなリソソーム液胞/ 20,22,23の内腔などの酸性環境下で蛍光を失うGFPのpH感受性変異体です。エンドサイトーシス貨物の細胞質尾部にpHluorinタグを配置することは、原形質膜でとpHluorinタグが細胞質( 図1A)に露出したまま初期エンドソーム、上の荷物の可視化を可能にします。初期エンドソームが成熟するにつれ、エンドソームは、多胞体(MVBs)24を生成し 、エンドソームの内腔に出芽小胞への輸送のために必要な複雑な(ESCRT)機械パッケージ表面局在貨物を仕分け。内部MVB小胞に組み込まれている貨物については、pHluorinタグは小胞内腔に向いています。内部MVB小胞が酸性化されています。彼らはMVBs 20に成熟としてこのように、pHluorinタグ付きカーゴは、初期エンドソームの蛍光を失います。液胞とMVBのその後の融合は、MVB腔の内容を提供します分解のために、とpHluorinタグは液胞内腔の酸性環境中で急冷したまま。
本稿では、酵母における細胞質pHluorinタグで貨物を用いた定量的エンドサイトーシスアッセイの詳細な説明を提供します。 pHluorinタグ貨物を発現する株は、特定の貨物の性質および輸送の挙動に応じて、運動及び/又はエンドポイントアッセイに使用することができます。さらに、いくつかのpHluorinタグ貨物は、フローサイトメトリーなどのハイスループット分析法に適しています。重要なことは、pHluorinタグは、野生型と変異株におけるエンドサイトーシス機能のエンドサイトーシスとの比較の定量化を可能にする、生きた細胞内のエンドサイトーシス事象を研究するための汎用性の高いツールです。
プロトコル
1.ソリューションとメディア
- 続いて株式、メディアやプレートを準備します。
- 10×YNBを調製するために、水1Lにアミノ酸を欠く酵母窒素塩基、67 gで溶解します。 0.22μmのニトロセルロースフィルターを通して濾過することにより滅菌します。
- (無菌の50%のw / vのストックから)2%デキストロースで(10×ストックから)1×YNBを使用して、YNB培地を準備し、1×アミノ酸/栄養混合物(100×ストックからは、ステップ1.1.4を参照してください)。必要に応じて、プラスミド選択のために、個々のアミノ酸や栄養分を省略します。 Mup1発現の誘導のために、追加的なアミノ酸/栄養混合物からメチオニンを省略します。
- 1×YNB(10×ストックから)、(無菌の50%のw / vのストックから)2%デキストロース、0.7グラム/ Lのアミノ酸/栄養混合物(ステップ1.1.5を参照)、および2.5%寒天を使用したYNBプレートを準備します。寒天の25グラム、水の860ミリリットルあたりのアミノ酸/栄養混合物の0.7グラムをオートクレーブで平板培地を準備します。その後、100 10×YNBのミリリットルと40ミリリットルOを追加し、混合物を55℃に冷却させます50%グルコースF。 4℃でプレート(約30ミリリットル10cmディッシュあたり媒体の)、媒体が室温で固化することを可能にする、と店のプレートを注ぎます。
- 脱イオン水100mlに、以下溶解することにより(液体培地の場合)100Xアミノ酸/栄養ストック溶液を調製:0.1グラムのL-メチオニン、0.3 gのL-ロイシンおよびL-リジン、および0.2 gのL-ヒスチジンのそれぞれの各、L-トリプトファン、アデニンおよびウラシル(特定の株について、必要に応じて他のアミノ酸および栄養素が含まれていてもよいです)。必要に応じて溶解し、そして0.45μmのニトロセルロースフィルターを通して滅菌するために穏やかな熱を使用してください。光から保護して室温で保管してください。プラスミド選択のために、必要に応じて特定のコンポーネントを欠くストック溶液を準備します。
- 以下を組み合わせることによって(プレート用)アミノ酸/栄養混合物を準備し、アデニンを0.5g、L-ロイシンを4g、2 G〜Lヒスチジン、L-リジン、L-メチオニン、L-トリプトファン、L-各チロシンとウラシル。乳鉢と乳棒で挽く、そしてプロで保存光からtection。プラスミド選択のために、必要に応じて特定のコンポーネントを欠いた混合物を製造し、(ステップ1.1.3を参照)平板培地1リットル当たりのアミノ酸混合物の0.7グラムを使用します。
- コンカナバリンA(ConAを)とスライドの表面をコーティングすることにより、顕微鏡検査のための8ウェルチャンバースライドを準備します。チャンバースライドの各ウェルに、水に溶解した2 mg / mlでのConAの25μlを添加します。ピペットチップを使用して、その後、少なくとも4-8時間室温で空気乾燥さスライドを可能にする、井戸の底表面を横切ってのConAを広げます。理想的には、ConAをコーティングの24時間以内にチャンバースライドを使用しています。
- ポリメラーゼ連鎖反応(PCR)Longtine らベース積分法を用いて、関心のエンドサイトーシス貨物にGFPまたはpHluorinのインフレーム融合物を有する酵母株を生成します。そして、ゴールドスタインとマッカスカー25,26。
注:pHluorinを含むプラスミドは、カナマイシン(KANMX6)とヌーセオスリシンのための抵抗性遺伝子とのカセットをタグ付け( NATMX4)は、以前に20に説明されました。- ゲノム組み込み20,25のサイトに固有の付加的な配列を含むプライマーを用いて選択マーカーを含むGFPまたはpHluorinカセットを増幅します。
- 酢酸リチウム法27を用いて、所望の酵母株に得られたPCR産物を形質転換します。
- 適切な薬物を含有するYPDプレート上で細胞を増殖させることによって、カセットの組み込みのために選択します。プレートを、オートクレーブ10gの酵母エキス、20gのペプトン0.1グラムのトリプトファン960 mlの水における25gの寒天を調製しました。プレートを注ぐ前に、混合物は、次いで、グルコースとKANMX6選択のために200μg/ mlの最終濃度のG418か、ヌーセオスリシンを100μg/ mlの最終濃度のために、40 mlの50%追加し、55℃に冷却しますNATMX4選択 。
- 抗GFP抗体を用いたPCRおよび/またはウェスタンブロッティングにより個々のコロニーでGFPまたはpHluorinタグの統合を確認し、同様に、蛍光顕微鏡20によりタグ付けされたタンパク質の検出によって。
注:この研究で使用される特定の酵母株およびプラスミドを、それぞれ、 表1および2に記載されています。
構成的に内在化エンドサイトーシス貨物の定常状態蛍光2.エンドポイントアッセイ
- (該当する場合)プラスミド維持のために必要とされるアミノ酸または栄養素を欠くYNB培地5mlで細胞(〜3小コロニー)を接種します。 250 rpmで振盪しながら、30℃で軌道振盪インキュベーター中で16-24時間細胞を増殖させます。また、アミノ酸またはプラスミド選択のための栄養素を欠くYNBプレート上に細胞のストリークA〜1〜2ミリメートルのコロニーと30℃で一晩細胞を増殖させます。
- 分光光度計を使用して各一晩培養物の密度(OD 600)を測定します 。 PLAのためのアミノ酸または栄養素を欠いたYNB培地中で0.35から0.4 OD 600 / mlで5mLの希釈物を調製しSMIDメンテナンス、そして振盪しながら30℃で約3時間成長します。使用した細胞は、プレート上にストリークした場合、このステップをスキップし、ステップ2.4(下記参照)に進みます。
- 今0.6から1.0 OD 600 / mlの間であるべきである細胞の密度(OD 600)を 、測定します。 2分間8,000rpmで(6800 XG)で1.5マイクロチューブに培養物1ml、ペレット細胞を転送します。上清の1475μLを削除します。
- 蛍光顕微鏡に細胞を持参してください。各サンプルを画像化する前に、残りの培地中で細胞を再懸濁することにより、スライドを準備し、カバースリップの下で細胞懸濁液の3μLをマウントします。プラスミドの選択のための適切なYNB培地を用いて、手順3に下記のように代替的に、8ウェルチャンバースライドを準備します。 100X、1.4以上の開口数(NA)の油浸対物レンズ、12または16ビットのカメラ、およびGFP蛍光のために最適化された励起/発光フィルターを有する理想的には、画像セル。
注:使用して、細胞がoストリーキングによって成長させた場合ナプレートは、カバースリップ上で新鮮なYNB培地の3μLを配置することによって、スライドを準備します。ピペットチップを使用して、プレートから細胞の小コロニーを収集YNB培地に細胞を分散し、撮影直前にスライドガラス上に得られた懸濁液をマウントします。 - 画像実験内のすべての画像に対して同じ取得パラメータ( すなわち 、フィルタセット、および露出時間)を使用して、各条件についての細胞の4-6ランダムフィールド。
注:各フィールドの明視野またはDICの画像を収集することpHluorin信号がMVBと液胞のコンパートメント中で急冷された細胞のために役立つことができます。 - 各条件について、少なくとも30-50細胞の蛍光強度を定量化(プロトコル5参照)。
規制エンドサイトーシスを受けるようにして貨物のエンドサイトーシスの定量化のための3キネティックアッセイ
- メチオニンを欠くYNB培地5ml中の酵母細胞(コロニーあたり直径約2mm)の2~3コロニーを接種し、追加プラスミドの選択を維持するためitionalアミノ酸または栄養。振盪しながら30℃で16〜24時間培養を成長させます。
注:この論文では、規制のエンドサイトーシス貨物タンパク質を研究するためのプロトコルは、メチオニン透過酵素、Mup1を利用します。規制エンドサイトーシスを受ける他の貨物もpHluorin(例えば、ウラシルは、ウラシルの非存在下で細胞膜に蓄積FUR4を、パーミ、外部ウラシル印加に応答して内在)でタグ付けするのに適しています。これらの貨物のために、培地条件は、その貨物のための特異的な発現、誘導および内在化の条件を反映するように変更する必要があります。 - 約3時間イメージング前に各一晩培養物の密度(OD 600)を測定します 。プラスミドの維持のためにメチオニンおよび追加のアミノ酸や栄養分を欠くYNB培地で0.35から0.4 OD 600 / mlで5ミリリットル希釈を準備し、そして振盪しながら30℃で成長します。
- マイクロを事前に平衡化ステップ3.2の3時間のインキュベーションの間に30℃までの環境室や加熱されたステージを(使用可能な場合)も対応。
- 2分間8,000rpmで(6800 XG)で微量遠心管に移し、細胞培養物の1ミリリットルを、ペレット細胞。上清の975μLを削除します。
- イメージングのためのConAで処理し、8ウェルのガラス底のチャンバースライド(プロトコル1.2)を準備します。
- 各ウェルにプラスミド選択のためのメチオニンおよび追加のアミノ酸や栄養分を欠くYNB培地200μlのを追加します。残りの上清のステップ3.4から細胞ペレットを再懸濁し、そして各ウェルの中央に細胞懸濁液の2.5μLをドロップします。上下にピペッティングによりウェルの表面を横切って細胞を分散し、細胞は5〜10分間沈降することを可能にします。
- 30°C(ステップ3.3参照)に平衡化した倒立蛍光顕微鏡上のチャンバースライドを置きます。明視野照明を用いた細胞のフィールドを探します。
- 100μg/ mlのメチオニンを含むYNB培地50μlのを追加20μg/ mlの最終メチオニン濃度を得るために、ウェル中の培地200μlに(30℃に予め温めておきました)。底から浮いから細胞を防止するために、ウェル中の培地を中断することは避けてください。
- 細胞は撮影を開始する前に2分間平衡化することができます。すぐに最初の画像をキャプチャする前に、所望の焦点面に顕微鏡を調整します(一般的に、赤道焦点面が最適です)。
- 45〜60分間、5分間隔でGFP及び明視野(またはDIC)画像を取得し、GFPフィルターを用いた時系列内のすべての画像に対して同一の取得パラメータを用いて(例えば、100×1.4 NA油浸対物レンズおよび500ミリ秒の取得時間、100ミリ秒の取得時間DICフィルタを使用して)。
注:顕微鏡のステージとイメージングソフトウェアは、焦点面のずれの自動補正を可能にしない場合は、手動で各撮像時点の前に焦点を再調整する必要があるかもしれません。また、取得時間はなります照明やフィルタの違いに顕微鏡の間で変動し、最適な条件は、実験を開始する前に手動で決定されるべきです。 Mup1以外のエンドサイトーシス貨物が使用される場合、その貨物の内在化動態を反映するように、取得時間と撮影間隔、ならびに実験の持続時間を変更する必要があるかもしれません。 - 各時点における個々の細胞の蛍光強度を定量化(プロトコル5参照)、第1の画像の最初の強度の割合として値を表します。
規制エンドサイトーシスを受けるようにしてエンドサイトーシス貨物の定量4.エンドポイントアッセイ
- プロトコル3で説明したようにイメージングのための細胞を調製(3.6を通じて3.1ステップ)。
- 画像直ちに明視野およびGFPフィルターセットを使用して、メチオニンを添加する前に、各条件のための細胞の4-5ランダムフィールド。
- 100μg/ mlのメチオニン(戦前を含むYNB培地50μlのを追加20μg/ mlの最終メチオニン濃度を得るために、ウェル中の培地200μlに、30°C)に対してMED。底から浮いから細胞を防止するために、ウェル中の培地を中断することは避けてください。
- 0分の時点(ステップ4.2)と同じ取得パラメータを用いて、メチオニンの添加後の細胞の画像4-5ランダムフィールドは、30分、。
- 各時点で少なくとも30〜50細胞の蛍光強度を定量化(プロトコル5参照)。式を使用して30分後に内在Mup1-pHluorinの割合としてエクスプレス値は: - X 100%[0分で平均強度] / [30分で強度を平均0分で強度の平均します]。
注:それは同時に各アッセイの開始時間をずらすことにより、8エンドポイントアッセイまで行うことが可能である。表3は、8つの同時アッセイのためのワークフロー例を提供します。
5.買収後の分析
- 1として収集ソフトからエクスポート画像6ビットのタグ付きイメージファイル形式(.tifまたは.tiffの形式)。
注:他のファイル形式も好適であり、理想的には可逆圧縮アルゴリズムを使用する必要があります。 8ビット画像は、一般的に定量化目的には適していません。 - 存在する場合「ファイル」メニューの「開く」オプションで自由に利用可能なImageJソフトウェアを使用して、開いているファイルには、(。(細胞の位置を同定し、死細胞を排除するための基準として定量化のために蛍光画像を使用し、明視野/ DICイメージ)、DICが表示およびGFPの励起/発光フィルターを見たときに自家蛍光されている生きた細胞よりも暗く表示されます。
- 蛍光画像の背景減算を実行します。不均一なバックグラウンド信号の画像については、「Processメニュー」に見られる「背景差分」アルゴリズムを使用します。一般的に定量化の目的のために十分である、デフォルトの設定(50ピクセルのボール半径をローリング)を使用します。
注:代替backgro均一な背景を持つ画像のためウントサブトラクション法は、ステップ5.3.1.-5.3.2に記載されています。しかし、上記の方法はまた、均一なバックグラウンドで動作します。- 均一な背景を持つイメージの場合( すなわち 、バックグラウンド強度は、すべてのエッジで、画像の中心にほぼ一定である)、手動バックグラウンド減算を行います。メインImageJのウィンドウで見つかった「フリーハンドの選択」ボタンをクリックして、細胞を含まない画像内3-5ランダムな領域を選択します。
- 「分析」メニューにある「設定測定」機能を開き、「平均グレー値」パラメータを選択し、(また、「分析」メニューにある)「メジャー」機能を使用して強度値を測定します。 3-5測定領域からの平均値を計算し、そのイメージ内のすべての後続の測定値から減算します。
- 動的アッセイ(プロトコル3)の定量化のために、ティムのための単一の、積み重ねられた画像を生成Eシリーズ。時系列順に各時点から蛍光画像を開き、(スタックのサブメニューの下で、「イメージ」メニューにあります)機能 'をスタックにイメージ'を使用してスタックを生成します。
- 可能性として細胞の外側細胞全体が、わずか面積を含まれていることを確認し、フリーハンド選択ツールを使用してセルの輪郭を描きます。
- 次のパラメータを測定します: 'エリア、統合密度」と「平均グレイ値'。 「分析」メニューにある「設定測定」機能を、使用してパラメータを選択します。
注:統合密度は、選択された領域内のすべての画素強度の和に相当し、平均グレー値[集積密度/エリア]に対応し、セルサイズの輝度値を補正します。 - 「ツール」サブメニューの下で、「分析」メニューにある「ROI Manager」を開きます。 ROIマネージャウィンドウで、ハイライトされレジオを入力して「追加」ボタンをクリックしてください関心領域(ROI)の新しい領域としてのn。
- 繰り返しは、画像内の残りのセルのために5.6を介して5.4を繰り返します。明/ DICおよび蛍光(死んだ細胞はDIC画像では暗く表示され、GFPの励起/発光で見たときの自家蛍光細胞質シグナルを持っている; 図2Fを参照)によって評価されるように任意の死細胞を除外し、画像のエッジに触れる任意の細胞。 「ROIマネージャ」ウィンドウの「詳細」ボタンをクリックすることで、.zipファイルとして選択されたROIを保存し、スプレッドシートや統計解析ソフトウェアにすべての測定値をエクスポートします。
- 動的アッセイ(プロトコル3)の定量のために、概要と手順5.4と5.5で説明したように最初の時点からセルを測定します。実験では、後続のすべての時点の測定に同じROIを使用してください。
- エンドポイントアッセイ(プロトコル2および4)については、各条件について30-50細胞の最小値を測定します。少なくとも2-3の画像について定量化を行い、各内のすべてのセルが含まれます分析のステップ5.8に概説された基準を満たすイメージ。
- 事後解析のためのTukeyの多重比較検定に続く一方向ANOVAを使用して、サンプル間の統計的有意性を評価します。
フローサイトメトリーによるMup1-pHluorinエンドサイトーシスの6人口分析
- メチオニンおよびプラスミドの選択を維持するための付加的なアミノ酸または栄養素を欠いたYNB培地0.5mlに、酵母細胞(コロニーあたり直径約2mm)の2~3コロニーを接種します。ローラードラム上で30℃で16〜24時間、5 mLの丸底チューブに細胞を増殖させます。
- プラスミドの維持のためのメチオニンおよび追加のアミノ酸や栄養分を欠くYNB培地の1.5ミリリットルを追加し、ローラードラム上でさらに3時間、30℃で成長します。
- 転送2 5ミリリットル丸底チューブの各々への細胞の1ミリリットル。第1のチューブ(-Met状態)にYNB -Met媒体の0.25ミリリットルを加え、および100μgを含むYNB培地の0.25ミリリットル第二の管/ mlのメチオニンを20μg/ mlの(+ Metの条件)の最終メチオニン濃度を得ました。ローラードラム上で45分間、30℃で細胞をインキュベートします。
- 貨物の内在性の尺度として、フルオレセインイソチオシアネート(FITC)フィルターから細胞の大きさの尺度、およびMup1-pHluorin蛍光強度として前方散乱(FS)を選択、フローサイトメトリーにより細胞を分析します。
- 使用されている酵母細胞の大きさの範囲と蛍光強度を検出を最適化するためにFSとFITCチャンネルの電圧を調整するスライダボタンを使用します(これらの実験のために、使用される設定は、FS用の50 VおよびFITC用400 Vでした)。
注:両方のチャネルの電圧が使用されているフローサイトメーターによって異なります。このステップは、メチオニン(ステップ6.3)で45分処理の前または中に行われるべきです。 - 高流量設定を使用して、各条件から10,000個の細胞のためFS及び蛍光強度を測定します。 FLUOに対するFSの散布図を生成しますrescence強度:(ソフトウェアは10,000個の細胞を測定したにも関わらず、1,000個の細胞のための値が表示されます)1,000ポイントを、「グラフの追加」をクリックし、FITC(x軸)およびFS(y軸)を選択し、グラフ。
注:最大の一貫性を保つために、メチオニンを添加した後、細胞を45から50分を分析します。多数のサンプルを伴う実験のために、フローサイトメトリー分析のために必要な時間に対応するために、メチオニンの付加をずらします。 - 対照として、野生型(WT)細胞について-Metと+ Metの条件を含みます。ゲート機能を使用して、最も明るい細胞の約5%は、ゲートの右に落ちるように、WT + Metの条件を用いた縦型ゲートを割り当てます。実験では、他のすべての条件については、このゲーティングを使用してください。
結果
構成的に内在化エンドサイトーシス貨物タンパク質STE3の定常状態の局在化および定量化
生きている細胞、STE3、酵母におけるA因子フェロモン受容体の細胞質C末端テイルを有するキメラGFPとpHluorin融合の局在化pHluorinタグ貨物はエンドサイトーシスの定量化のために利用できることを実証するために、比較しました。 STE3は、構成的分解28液胞に、原形質膜に輸送内在化、および標的化されるGタンパク質共役受容体(GPCR)です。 STE3-GFP( 図2A)を発現する野生型(WT)細胞に見られるようにこのように、定常状態の条件下で、STE3の大部分は、液胞の内腔に局在します。これとは対照的に、4クラスリン結合アダプタータンパク質ENT1、ENT2、Yap1801とYap1802をコードする遺伝子を欠く細胞(ENT1Δ以下、4Δと呼ばENT2Δyap1801Δyap1802Δは、)エンドサイトーシス29のサイトでクラスリンを安定させるために失敗し、CME 30で深刻な欠陥があります。 4Δ細胞は生存率30,31のためのepsin ENT1またはENT2のいずれかのN末端相同性(ENTH)ドメインの発現を必要とします。 ENT1( 図2A)8,30のENTHのドメインを発現4Δ+ ENTH1細胞に形質膜でSTE3-GFPの保持によって示されるようにENTHドメインは、4Δ細胞におけるエンドサイトーシスのために十分ではありません。 4Δ+ ENTH1細胞で同様の形質膜の保持がSTE2-GFP(α因子フェロモン受容体)とMup1-GFPまたはMup1-pHluorin(メチオニン透過酵素)8,18を含む他のエンドサイトーシス貨物のために観察されています。これとは対照的に、4Δ細胞中のプラスミド(4Δ+ ENT1)から完全長ENT1の発現は、液胞へのエンドサイトーシスおよびSTE3-GFPの局在を復元します。 4Δ+ ENTH1細胞は、最近私が使用されましたアクチン調節GTPアーゼRho1とそのGEF、ROM1、ならびにformin Bni1と8,18の並べ替え貨物に関与するタンパク質のαアレスチンファミリーのメンバーに依存している酵母におけるCIE経路を特定するための遺伝子スクリーニングナ。 CIE、ROM1の発現またはSTE3-GFP( 図2A)の内在化を改善し4Δ+ ENTH1細胞において高コピープラスミドからのα-アレスチンLDB19における役割と一致します。
STE3-GFPまたは他のGFPタグ付きエンドサイトーシス貨物を発現する細胞が蓄積し、GFPタグのタンパク質分解抵抗による明るい空胞を持っています。これとは対照的に、STE3-pHluorinを発現している細胞は、酸性環境20でpHluorinタグの消光に液胞蛍光の非常に低いレベルを持っています。以前に見られるように、WT及び4Δ+ ENT1細胞は、蛍光顕微鏡( 図2B)によってはほとんど検出STE3-pHluorinを示しました。これとは対照的に、STE3-pHluorin液胞STE3-pHluorinは、すべてのケースではほぼ検出不可能なままで、4Δ+ ENTH1細胞の形質膜で容易に検出可能でした。 ROM1またはLDB19の高コピー発現液胞STE3-pHluorinは、すべてのケースではほぼ検出不可能なままであったが、STE3-GFPを用いた結果と同様に、細胞表面で検出STE3-pHluorinの量を減少させました。
GFP-との効果を比較するために、細胞のエンドサイトーシス容量の変化を定量化するためのツールとしての貨物をpHluorinをタグ付き、STE3-GFPおよびSTE3-pHluorinの全細胞の蛍光は、WTと4Δ細胞で測定しました。 STE3-GFPの局在の変化は顕微鏡( 図2A)によって容易に検出可能であったものの、全体的な蛍光強度の違いは、WT、4Δ+ ENT1および空ベクター( 図2C)20で形質転換4Δ+ ENTH1細胞間の統計的に有意ではなかったです。 Likewis4Δ+ ENTH1細胞をベクターで形質転換された電子は、ROM1及びLDB19は、同様の全細胞の蛍光強度を有していました。特に、ROM1またはLDB19で形質転換4Δ+ ENTH1細胞はWT細胞( 図2C)8,18よりも有意に調光器でした。イムノブロット( 図2E)によって評価されるが、STE3-GFPタンパク質レベルは同様でした。強度の差は、液胞の大きさや形態の変化に部分的に、または液胞におけるGFPタグの保持の違いによるかもしれないが、STE3-GFP蛍光の定量化は、( 図蛍光顕微鏡で観察局在の変化を反映していません図2(a))。これとは対照的に、STE3-pHluorin強度の定量化は、ベクターで形質転換4Δ+ ENTH1細胞はWTまたは4Δ+ ENT1細胞よりも有意に明るくすることが実証された、およびROM1または4Δ+ ENTH1細胞におけるLDB19の高コピー発現は、STE3-pHluorin強度にを縮小しますWTと4Δ+ ENT1( 図2D)に類似していたレベル。したがって、定常状態STE3-pHluorin強度の定量化は、正確に蛍光顕微鏡で観察局在の違いを反映しています。
規制エンドサイトーシス貨物、Mup1を使用して、動力学的内在化アッセイ
定常状態での構成的内在貨物用の蛍光強度の定量化は、WT細胞と比較した変異細胞のエンドサイトーシス能の違いを明らかにすることができます。しかし、変異細胞はエンドサイトーシスまたは貨物内在化のために遅い速度の遅れを持っているにもかかわらず、いくつかの貨物は、WTとエンドサイトーシス変異細胞において同じ定常状態分布と強度に達する可能性があります。代わりに、特定の刺激またはリガンドに応答して調節され、エンドサイトーシスを受けるpHluorinタグ貨物を監視するために使用することができますエンドサイトーシスの動態。この目的のために、高親和性メチオニンパーミアーゼ、Mup1の内在化は、32を監視しました。細胞外のメチオニンの不在下で、Mup1発現がアップレギュレートされ、パーミアーゼは、原形質膜に保持されます。培地へのメチオニンの添加時に、Mup1は急速な内在化および液胞13へのターゲティングを受けます。
Mup1内在化の動態をモニターするために、ゲノム遺伝子座からMup1-GFPまたはMup1-pHluorinを発現するWT株は、原形質膜で( 図3A、0分の時点の)蛍光Mup1を蓄積するためにメチオニンの不在下で増殖させました。細胞のタイムラプスイメージングは、その後、貨物内在化および蛍光の変化をモニターするためにメチオニンの不在下または存在下で、5分間隔で行いました。予想されるように、メチオニンの非存在下で撮像されたGFP-とpHluorinタグMup1は、原形質膜Fにとどまっ全体で45分の観察期間20。対照的に、メチオニンの存在下で撮像された細胞は、カーゴ内在化と一致して、細胞表面からの蛍光信号の進行枯渇を示しました。特に、Mup1-GFPの蛍光がMup1-pHluorinは、おそらく初期エンドソームに対応した内部punctaeに局在するが、液胞には見られなかったのに対し、内部構造( すなわち 、エンドソームおよび液胞)に蓄積されました。
蛍光は個々のセルのために全ての時点渡って定量化した場合には、Mup1-GFPとMup1-pHluorin強度が安定的に形質膜に局在化したままのタンパク質と一致して45分間の実験の過程で外部から印加されるメチオニンの不在下でほとんど変化を示しました( 図3B)。対照的に、全細胞Mup1-pHluorin強度が急激にメチオニンの存在下で減少し、そのようなfluorescenc 50%減少そのE強度は後に約20〜25分で観察され、80%の減少が約40〜20分後に観察されました。 Mup1-GFP細胞はまた、メチオニンを添加すると蛍光強度の減少を示しました。しかし、蛍光損失の動態は、強度の50%の減少はわずか40分後に観察されたことなどMup1-pHluorinのものに比べて遅れました。 図3Aに見られるように、Mup1-GFPは、永続的な液胞GFP蛍光は細胞表面でのエンドサイトーシスイベントの正確な定量化を妨げていることを示し、この時点では原形質膜でかろうじて検出可能でした。
規制エンドサイトーシス貨物、Mup1を使用して、エンドポイントアッセイ
前述のようにエンドサイトーシスの定量的、速度論的アッセイに加えて、Mup1として規制エンドサイトーシス貨物はまた、定量化と同様の終点アッセイのために使用することができます定常状態STE3-pHluorin強度の。この目的のために、Mup1-pHluorinの内在化の定量化のためのアッセイは、メチオニン8,18の添加後30分または直前に撮像された細胞の集団からの平均蛍光強度の比較をできるように変更されました。このアプローチは、WTおよびエンドサイトーシス変異細胞の間に内在Mup1の割合の比較を可能にします。
動態アッセイ( 図3)の結果と一致して、Mup1-pHluorin急速(Mup1-pHluorinの約60%は、メチオニンの添加の30分後に内在化されたように、WT細胞( 図4A)に形質膜から除去されました図4B)。予想されるように内在化が著しく4Δ+ ENTH1細胞において減少した一方で、Mup1-pHluorinの内在は、4 + ENT1細胞にエンドサイトーシスに深刻な欠陥と一致し、同様に効率的でした。高コピー発現ROM1または特異的に両方のCMEを介しMup1内在するために必要とされるα-アレスチンLDB19、およびCIEの4Δ+ ENTH1セル18にエンドサイトーシスを促進する能力と一致してMup1-pHluorinの13,18、改善された内在化を、経路。高コピーROM1またはLDB19を表現4Δ+ ENTH1細胞における定常状態STE3-pHluorin強度がWTまたは4Δ+ ENT1細胞と区別できなかったが、注目すべきは、Mup1-pHluorinの内在化は、部分的にしか高コピーを発現している4Δ+ ENTH1細胞に改善しましたROM1またはLDB19( 図4C)。したがって、これらのデータは、運動および/またはエンドポイントアッセイは、他の貨物の同様の定常状態分布は、同じ株で達成することができるにもかかわらず、いくつかの貨物用WTと変異株の間のエンドサイトーシス率の違いを明らかにすることができることを示しています。
Mup1-PHLの人口ベースの分析フローサイトメトリーを使用して、内在uorin
フローサイトメトリーを用いて細胞の大きな集団のハイスループット分析は、顕微鏡によって貨物内在化動態およびエンドポイントアッセイを実行する代替手段を提供することができます。この目的のために、Mup1-pHluorinの蛍光強度は、メチオニンの不在( "明るい"であるべきWT -Met、)または45分(WT +メット、のためのメチオニンの存在下で増殖させた培養物からWT細胞において比較しましたこれは図3Bに見られる蛍光強度)で80%の減少に基づいて、未処理細胞と比較して、「暗く」する必要があります。 図5Aおよび5B(フローサイトメトリーにより分析した後、縦型ゲートを、細胞の約5%が、ゲートの右側に含まれていたWT + Metの条件に適用し、そして集団内の最も明るい細胞に対応しました、赤人口)。同じゲートを適用した場合にはWT -Met状態に、細胞の約65%は、フローサイトメトリーは、容易にメチオニンを添加する前と後の細胞集団間Mup1-pHluorin蛍光強度の差を観察するために使用することができる実証、明るいカテゴリに落ちました。これとは対照的に、薄暗い細胞に対する明るいの分布が同じゲートを使用して、条件に欠陥がエンドサイトーシスと一致して、WT + Metの人口に適用4Δ+ ENTH1 -Metと+メットに区別できませんでした。このように、フローサイトメトリーは、細胞のエンドサイトーシスの能力の変化を検出し、細胞の大集団の迅速な分析を可能にすることができます。重要なことは、フローサイトメトリーは、不良エンドサイトーシス(K. WrasmanとBベントラント、原稿準備中)33で選別および変異細胞の選択のためのツールとしての遺伝子スクリーニングにも使用することができます。
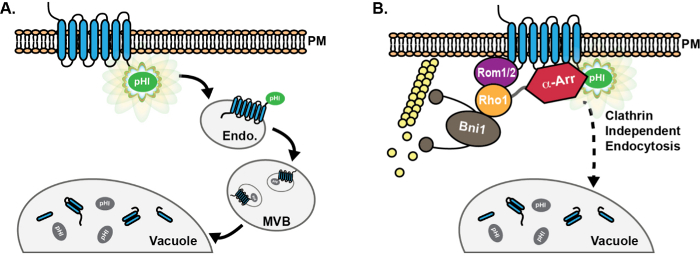
図1: エンドサイトーシス経路を介して、pHluorinタグ付き貨物の進行の模式図。(A)pHluorin(PHL)のキメラ融合、原形質膜での貨物の検出可能な蛍光(緑)におけるエンドサイトーシス貨物タンパク質結果の細胞質尾部上のタグ(PM )。エンドサイトーシスに続いて、積荷タンパク質はpHluorinタグが細胞質に露出し、従って、蛍光性であるまま初期エンドソーム(遠藤)に配信されます。その後、ESCRT機械は、多胞体(MVB)の管腔小胞への貨物の仕分けと取り込みを促進します。 MVBsその後、分解のためにタンパク質や膜成分を提供するために液胞と融合します。 MVBsへの組み込みの際に、pHluorinタグは、酸性化のために(灰色)でクエンチしてしまいます。 pHluorinタグ付き貨物の(B)の使用は、酵母におけるクラスリン非依存性エンドサイトーシス(CIE)経路に関与するタンパク質の発見および特徴付けを容易にしました。不良クラスリン媒介endocytosを有する細胞で、高コピーGTPアーゼRho1の発現、並びにその活性化GEF ROM1、あるは、CIE 8を介して貨物の内在化を促進します。また、タンパク質のαアレスチンファミリー(α-編曲)は、CIEでαアレスチンのための役割が最近同定された、CME 13-17を経由して貨物のユビキチン化および内在化を促進する上で役割を知られている可能性が高い原因CIEタンパク質との相互作用ではなく、たがユビキチンの募集を通じて18をリガーゼ。 この図の拡大版をご覧になるにはこちらをクリックしてください。
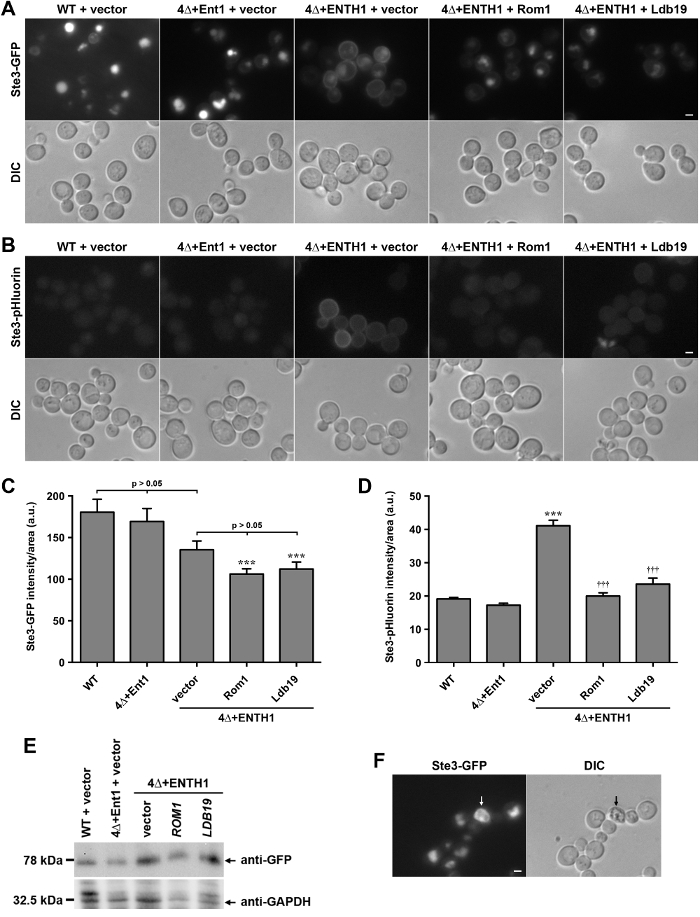
図2: 野生型およびエンドサイトーシス変異細胞でSTE3-GFPおよびSTE3-pHluorinの局在化および定量 (A)WT、4Δ+ ENT1と4Δ+ ENTH1細胞がゲノムエンコードさSTE3-Gを発現していますFPおよび蛍光顕微鏡(一番上の行)またはDIC(下段)により可視化した示されるように、ベクター、高コピーROM1または高コピーLDB19で形質転換しました。 STE3-GFP画像はSTE3局在の直接比較を可能にするために同一の最大値と最小強度に調整しました。ゲノムエンコードされたSTE3-pHluorinを発現している(B)WT、4Δ+ ENT1と4Δ+ ENTH1細胞が形質転換され、パネルAに記載されているように画像化しました。スケールバー=2μmです。 (C、D)STE3-GFP(C)及びSTE3-pHluorin(D)用の蛍光強度の定量化は、各条件についてパネルAおよびBで使用した株、全細胞の蛍光は、40セルの最低定量しました。値は、セルサイズについて補正し、平均±SEMとして任意の単位(AU)で発現させた(*** P <0.001 WTに比べ、†††てp <0.001は4Δ+ ENTH1 +ベクトルと比較します)。 (E)する相対的示されているように、WT、4Δ+ ENT1と4Δ+ ENTH1細胞で評価STE3-GFPのE発現は、ベクター、高コピーROM1または高コピーLDB19で形質転換しました。以前20に記載のように細胞抽出物を調製し、各試料の等量をSDS-PAGEにより分離しました。 STE3-GFPの発現は、抗GFP抗体を用いたイムノブロッティングにより評価し、タンパク質負荷は、抗GAPDHを用いて評価しました。 (F)野生型細胞は、矢印で示す死細胞と、蛍光顕微鏡(STE3-GFPのパネル)およびDIC光学系によって見ゲノムコードされるSTE3-GFPを発現します。死んだ細胞はGFPフィルターで自己蛍光を表示され、DICによって見たときに暗いです。スケールバー=2μmである。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図3:Mup1-GFPとMup1-pHluorin内在化の速度論的アッセイ (A)野生型細胞は、ゲノム中に中期対数期に成長させたMup1-GFP(上位二つのパネル)またはMup1-pHluorin(下の二つのパネル)をコードし発現しますYNB培地は、原形質膜でMup1発現および保持を誘導するために、メチオニンを欠きます。 ( - メット)または存在(+メット)を20μg/ mlのメチオニンの細胞は、その後、蛍光顕微鏡によって不存在下で5分ごとに画像化しました。状態内の各時点については、同一の最大値と最小輝度値は、蛍光強度及び局在化の比較を可能にするために適用しました。すべての条件を示すように0、5、10、20及び40分の時点が示されています。スケールバー=2μmです。パネルAからの野生型細胞におけるMup1-GFPの(B)定量及びMup1-pHluorin内在。またはMup1-pHluo; - (+メット、ブルーダイヤモンドのMet、紫色の四角)Mup1-GFPの全細胞の蛍光強度RIN( - メット、緑の三角形; +メット、赤丸)は5分間隔で撮像された個々の細胞について測定し、初期の蛍光強度のパーセンテージとして表した(平均±SEM、nは=条件当たり6細胞)。プロッサーらより転載。 (2010年)20出版社の許可を受けて。 この図の拡大版をご覧になるにはこちらをクリックしてください。
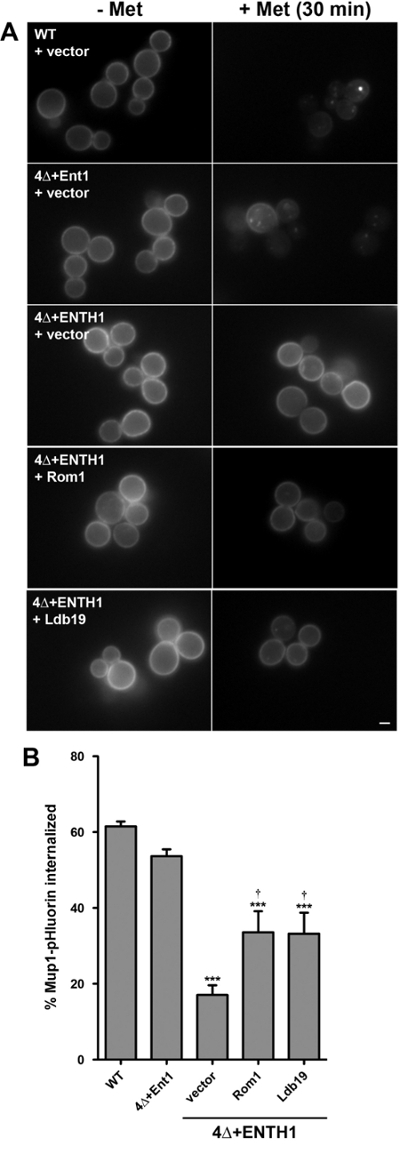
図4:Mup1-pHluorin内在のエンドポイントアッセイ (A)WT、4Δ+ ENT1と4Δ+ ENTH1細胞がゲノムMup1-pHluorinをエンコードされ、ベクターで形質転換発現する、高コピーROM1または高コピーLDB19示さ半ばまで成長させたとして、メチオニンを欠くYNB培地中で-logarithmic相。細胞のランダムフィールドはfluorescencによって画像化しました 20 / mlのメチオニンの(+ MET)を添加した後または30分 - (メット)直前の電子顕微鏡。すべての画像は同一の最大値と最小輝度値に調整しました。スケールバー=2μmです。 (B)パネルAからの細胞内Mup1-pHluorin内在の定量。各条件について、全細胞の蛍光強度は、40セルの最小を測定し、細胞の大きさのために修正しました。 Mup1-pHluorinの割合がメチオニンで30分間の処理前後の平均強度値を比較することにより計算された内在化。 (; *** P <0.001 WTと比較して、4のn =4Δ+ ENTH1 +ベクターに比べて†pを <0.05)の値は、平均±SEMとして示されています。この図は、プロッサーらから変更されています。 (2015年)18出版社の許可を受けて。 この図の拡大版をご覧になるにはこちらをクリックしてください。
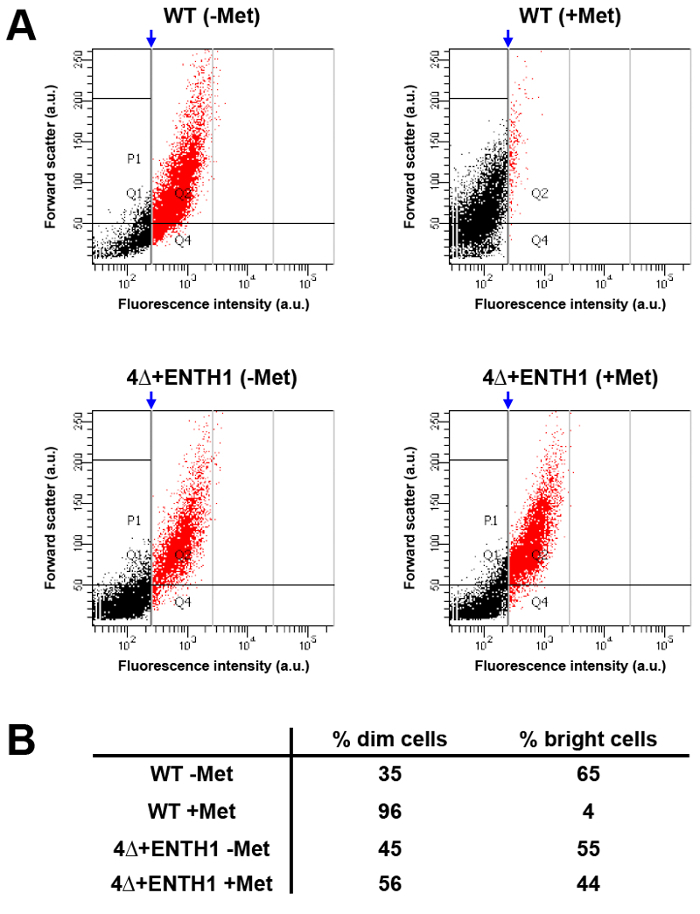
図5: フローサイトメトリーによるMup1-pHuorin内在の人口分析 (A)WTと4Δ+ ENTH1細胞は、メチオニンを欠くYNB培地中で中期対数期まで増殖させました。フローサイトメトリーによる分析の前に45分間に20μg/ mlのメチオニンまたは存在(+ MET) - (MET)の細胞は、次いで非存在下でインキュベートしました。各条件については、(任意の単位、AU内)前方散乱が測定された10,000個の細胞の合計のうち1,000個の細胞のための(FITCフィルターを使用して、AU)蛍光強度に対してプロットしました。集団は、さらに、(赤で表示)最も明るい細胞の約5%は、ゲートの右側に落ちWT + Metの条件に垂直ゲート(青い矢印)を適用することによって分析しました。 WT + Metの条件の発生のゲートは、比較を可能にするために、残りの条件に適用されましたサンプル分布。 (B)WTと4Δ+ ENTH1用(ゲートの右側に赤い点、)(ゲートの左側の黒い点)薄暗い細胞と明るい細胞の割合の概要は、パネルAに示す会った試練を±。 してくださいこの図の拡大版をご覧になるにはこちらをクリックしてください。
| 歪み | 遺伝子型 | ソース |
| SEY6210のA | MATαHIS3-Δ200TRP1-Δ901leu2-3,112 ura3-52 lys2-801 SUC2-Δ9 | 実験室でのプラスミド |
| BWY2858 | STE3-GFP :: KANMX6 | プロッサーら (2010年)16 |
| BWY2995 | STE3-pHluorin :: KANMX6 | Pロッサーら (2010年)16 |
| BWY3036 | ent1Δ:: LEU2ent2Δ:: HIS3yap1801Δ:: HIS3yap1802Δ:: LEU2 STE3-pHluorin :: KANMX6 + pEnt1 [CEN TRP1] | プロッサーら (2010年)16 |
| BWY3037 | ent1Δ:: LEU2ent2Δ:: HIS3yap1801Δ:: HIS3yap1802Δ:: LEU2 STE3-pHluorin :: KANMX6 + pENTH1 [CEN TRP1] | プロッサーら (2010年)16 |
| BWY3399 | ent1Δ:: LEU2ent2Δ:: HIS3yap1801Δ:: HIS3yap1802Δ:: LEU2 STE3-GFP :: KANMX6 + pEnt1 [CEN TRP1] | プロッサーら (2010年)16 |
| BWY3400 | ent1Δ:: LEU2ent2Δ:: HIS3yap1801Δ:: HIS3yap1802Δ:: LEU2 STE3-GFP :: KANMX6 + pEnt1 [CEN TRP1] | プロッサーら (2010年)16 |
| BWY3817 | MUP1-GFP :: KANMX6 | 広報osser ら (2010年)16 |
| BWY3818 | MUP1-pHluorin :: KANMX6 | プロッサーら (2010年)16 |
| BWY4153 | ent1Δ:: LEU2ent2Δ:: HIS3yap1801Δ:: HIS3yap1802Δ:: LEU2 MUP1-pHluorin :: KANMX6 + pEnt1 [CEN TRP1] | プロッサーら (2011年)7 |
| BWY4154 | ent1Δ:: LEU2ent2Δ:: HIS3yap1801Δ:: HIS3yap1802Δ:: LEU2 MUP1-pHluorin :: KANMX6 + pENTH1 [CEN TRP1] | プロッサーら (2011年)7 |
| 本研究で用いた全ての株は、指示された遺伝子座を除いてSEY6210に同質遺伝子です。 | ||
表1:本研究で使用した酵母株。
| プラスミド | 説明 | ソース |
| pRS426 | 2μ、URA3 | シコルスキとHieter、1989 |
| pBW0768 | pRS414 :: ENT1 [CEN TRP1] | pEnt1、研究所プラスミド |
| pBW0778 | pRS414 :: ENT1(aa1-151)[CEN TRP1] | pENTH1、研究所プラスミド |
| pBW1571 | pFA6a-pHluorin-KANMX6 | プロッサーら (2010年)16 |
| pBW2053 | YEp24 :: ROM1 [2μのURA3] | PROM1(プロッサーら 、2011年)7 |
| pRS426-Ldb19 | LDB19prom-LDB19 [2μのURA3] | プロッサーら (2015年)15 |
| pFA6a-GFP(S65T)-kanMX6 | pFA6a-GFP-KANMX6、酵母におけるGFP-タグ付けのためのPCRベースの組み込みプラスミド | Longtineら。(1998)21 |
表2:本研究で使用したプラスミド。
| 時間(分) | 行動) |
| -5 | 画像サンプル1(-Met) |
| 0 | 1をサンプリングするためにメチオニンを加えます |
| 画像サンプル2(-Met) | |
| 5 | 2をサンプリングするためにメチオニンを加えます |
| 画像サンプル3(-Met) | |
| 10 | 3をサンプリングするためにメチオニンを加えます |
| 画像サンプル4(-Met) | |
| 15 | 4をサンプリングするためにメチオニンを加えます |
| 画像サンプル5(-Met) | |
| 20 | 加えますサンプル5のメチオニン |
| 画像サンプル6(-Met) | |
| 25 | 6をサンプリングするためにメチオニンを加えます |
| 画像サンプル7(-Met) | |
| 30 | 7をサンプリングするためにメチオニンを加えます |
| 画像サンプル8(-Met) | |
| 画像サンプル1(+メット) | |
| 35 | 8をサンプリングするためにメチオニンを加えます |
| 画像サンプル2(+ MET) | |
| 40 | 画像サンプル3(+メット) |
| 45 | 画像サンプル4(+メット) |
| 50 | 画像サンプル5(+メット) |
| 55 | 画像サンプル6(+ MET) |
| 60 | 画像サンプル7(+ MET) |
| 65 | 画像サンプル8(+ MET) |
表3:驚異8 Mup1-pHluorinエンドポイントアッセイのためのワークフロー例。
ディスカッション
酵母細胞におけるエンドサイトーシスイベントの定量化のためのpHluorinのアプリケーションは、蛍光タグは、タンパク質( 図1A)の細胞質尾部に融合された貫通貨物を利用します。ここに記載のアッセイのために、貨物はpHluorinタグがニュートラルな環境にさらされたときに明るく蛍光であるが、pHluorinタグは酸性条件に遭遇したときに急冷になります。したがって、pHluorinタグ付きエンドサイトーシス貨物は容易に形質膜の細胞質面で、早期エンドソーム上で検出されたが、管腔MVB小胞または液胞の内腔への配送時に組み込まれた場合、「暗く」となります。一般的には、新たに合成されたエンドサイトーシス貨物は、おそらく、小胞体(ER)のままとGFPとその変異体の多くは完全に成熟する前に、原形質膜に達します。 ERまたはゴルジからの出口が私でない限り、このように、まだ細胞表面に達していないpHluorinタグ付き貨物は検出不可能なままであると予測されますmpaired。
このようなSTE3とMup1などpHluorinタグ付きエンドサイトーシス貨物の使用は、酵母CIE経路( 図1B)8,18に関与するタンパク質の数の特徴付けを容易にしました。具体的には、この論文に記載された方法は、アクチン調節GTPアーゼRho1とそのGEF ROM1の産生の増加は、CME 8の欠陥を持つ酵母変異体の様々なエンドサイトーシスを促進することを実証するために使用されています。また、pHluorinタグ付き貨物は、最近、定量的CME 13-15,34-36で十分に確立の役割を持っているα-アレスチンを、実証するために使用CMEとCIEの両方における貨物選択的役割を果たし、機構的に異なる機能を持っていました二つの経路18インチ
本稿で概説したプロトコルのために、いくつかの重要な要因は、一貫性、定量的な結果を得るために考慮すべきです。まず、Mup1-GFPまたはMup1-pHluorin発現と蛍光物質cenceは、酵母細胞が近づくにつれて減少または定常増殖期(未発表の結果)を入力することができます。このように、一晩培養物から増殖させた細胞を希釈しなければならないと(ステップ3.1から3.2および6.1から6.2を参照)、さらに3時間再増殖させました。エンドポイントアッセイまたはフローサイトメトリーによる分析のために、複数の実験条件または株をずらす場合に加えて、個々の条件間の比較を可能にするためにメチオニン処理の同じ期間の後、すべてのサンプルについてのデータを収集することが重要です。 8ビットのフォーマットへの変換は、蛍光強度値に影響を与えることができるデータの損失を引き起こすため、取得後の分析のために、定量化は、16ビットの画像を用いて行われるべきです。バックグラウンドシグナルが大幅にサンプル間の強度の違いを閉塞することができるので、バックグラウンド減算は、定量化(ステップ5.3)に先立って行われるべきです。
pHluorinタグ付きSTE3とMup1は、定量化に適していないことが証明されているのに対しすべての貨物は、pHluorinタギングに適してになります。例えば、タンデムpHluorinタグが改善できることが可能であるが、おそらくSTE3またはMup1(未発表の結果)に比べSTE2-pHluorinの低い蛍光強度に、一貫性のない定量的な結果が得られているα因子受容体STE2をタグ付けしようとします信号強度。また、リガンド誘導性エンドサイトーシスの非常に遅い速度での貨物は、内在化のハーフタイムは、酵母の細胞周期(約90分)よりも長い場合は特に、pHluorinは、定量化のためにタグ付けに適していない可能性があります。そのような貨物については、蛍光の減少は、エンドサイトーシスからおよび/または分裂の間、母と娘細胞間の貨物の分割から発生する可能性があります。このように、興味のある個々の貨物を検査すると、それらの発現および動態がpHluorinタグ付けおよび定量化するのに適しているかどうかを判断するために推奨されます。
PHLを使用して、最近の研究が、原形質膜に主にエンドサイトーシスイベントに焦点を当てているuorin、pHluorinタグ貨物は、エンドサイトーシス経路の後の売買イベントを研究するために使用することができます。 pHluorinタグがMVB管腔小胞20への組み込み時に急冷してしまうので、例えば、Mup1-pHluorinは成功し、MVBs 37に仕分けESCRT媒介貨物のフローサイトメトリーベースのアッセイにおいて使用されています。このアプローチは、ルシフェリン38,39の存在下で生物発光シグナルを生成するために、細胞質ルシフェラーゼタグで貨物を利用した腔内堆積(LUCID)アッセイのより最近記載されたルシフェラーゼレポーターに似ています。 MVB管腔小胞への取り込み時にpHluorin蛍光の消光と同様に、LUCIDアッセイにおける生物発光は、MVB小胞のルシフェラーゼタグの取り込み時に減衰されます。 pHluorinとLUCIDアッセイが概念的に似ていますが、pHluorinタグ付き貨物は、エンドサイトーシスとMVB成熟を研究するために使用することができます私nは無傷の細胞。
別の方法は、エンドサイトーシスの定量化のために存在し、野生型およびエンドサイトーシス変異細胞における貨物内在化率に関する貴重な情報を提供してきました。例としては、などSTE3として40,41、またはエンドサイトーシス貨物のための分解速度を監視する(パーFUR4によって内在化された)およびウラシル(フェロモン受容体STE2に結合する)α因子などの放射性標識リガンドの監視の取り込みを含み、それら内在化および液胞42に搬送されます。これらの生化学的アプローチは、細胞溶解を必要とし、従って、生細胞中で直接定量化には適していません。また、蛍光α因子、流体相色素ルシファーイエロー、またはスチリル色素標識されたFM4-64は、生細胞にエンドサイトーシスを可視化するために使用することができますが、内因的に発現貨物タンパク質40,43,44の直接監視することはできません。 VAにおける蛍光のこれらのアプローチのために、持続性GFPで見られるようにcuoleルーメンは、定量化を複雑にする可能性があります。全細胞の蛍光強度を測定し、細胞質とエンドソーム/液胞コンパートメントからの信号を減算することによりエンドサイトーシスの定量化のためのGFPタグ付き貨物を使用することも可能です。しかし、エンドソームおよび液胞は、原形質膜に近接してあることが多いです。これとは対照的に、pHluorinタグ付きエンドサイトーシス貨物をより広く使用されているGFPタグに比べて人身売買イベントの定量化のための明確な利点することができますMVB /液胞コンパートメント、で急冷されています。当社の将来の研究では、CMEとCIEに貢献する追加の因子を同定するために、貨物仕分け決定を調節機構を理解するために、酵母におけるエンドサイトーシス経路および貨物の仕分けの現在の知識に展開されます。
開示事項
The authors declare no competing interests.
謝辞
We would like to thank Gero Miesenböck and Tim Ryan for sharing pHluorin cDNA used to generate reagents in this study, Nathan Wright, Joanna Poprawski and Lydia Nyasae for excellent technical assistance, members of the Wendland lab for helpful discussions, and Michael McCaffery and Erin Pryce at the Integrated Imaging Center (Johns Hopkins) for advice and assistance with microscopy and flow cytometry. This work was supported by grants from the National Institutes of Health (to B.W., GM60979) and the National Science Foundation (to B.W., MCB 1024818). K.W. was supported in part by a training grant from the National Institutes of Health (T32-GM007231). A.F.O. was supported by developmental funds from the Department of Biological Sciences at Duquesne University and National Science Foundation CAREER grant 553143.
資料
| Name | Company | Catalog Number | Comments |
| Adenine | Sigma | A8626-25G | Use for preparation of amino acid mixture and stock solution |
| Bacto-agar | Fisher | BP1423-2 | Use for preparation of plate media |
| BD Difco Yeast Nitrogen Base (without amino acids) | BD | 291920 | Use for preparation of liquid and plate media |
| Concanavalin A | Sigma | C5275-5MG | Use for coating of chamber slides |
| Dextrose | Fisher | BP350-1 | Use for preparation of liquid and plate media |
| L-Histidine | Fisher | BP382-100 | Use for preparation of amino acid mixture and stock solution |
| L-Leucine | Acros | 125121000 | Use for preparation of amino acid mixture and stock solution |
| L-Lysine | Fisher | BP386-100 | Use for preparation of amino acid mixture and stock solution |
| L-Methionine | Fisher | BP388-100 | Use for preparation of amino acid mixture and stock solution |
| L-Tryptophan | Fisher | BP395-100 | Use for preparation of amino acid mixture and stock solution |
| L-Tyrosine | Acros | 140641000 | Use for preparation of amino acid mixture |
| Nunc Lab-Tek Chambered Coverglass (8-well) | Thermo Scientific | 155411 | Use for kinetic and endpoint assays of Mup1-pHluorin internalization |
| Uracil | Sigma | U0750-100G | Use for preparation of amino acid mixture and stock solution |
| Axiovert 200 inverted microscope | Carl Zeiss | Custom Build | |
| 100X/1.4 Plan-Apochromat Oil Immersion Objective Lens | Carl Zeiss | Objective should be 100X, 1.4NA or higher | |
| Sensicam | Cooke Corporation | Camera should have 12-bit or higher dynamic range | |
| X-Cite 120PC Q Illumination Source | Excelitas Technologies | ||
| Slidebook 5 software | Intelligent Imaging Innovations | ||
| ImageJ software | National Institutes of Health | http://imagej.nih.gov/ij/ |
参考文献
- Kaksonen, M., Sun, Y., Drubin, D. G. A pathway for association of receptors, adaptors, and actin during endocytic internalization. Cell. 115 (4), 475-487 (2003).
- Kaksonen, M., Toret, C. P., Drubin, D. G. A modular design for the clathrin- and actin-mediated endocytosis machinery. Cell. 123 (2), 305-320 (2005).
- Boettner, D. R., Chi, R. J., Lemmon, S. K. Lessons from yeast for clathrin-mediated endocytosis. Nat Cell Biol. 14 (1), 2-10 (2012).
- Taylor, M. J., Perrais, D., Merrifield, C. J. A High Precision Survey of the Molecular Dynamics of Mammalian Clathrin-Mediated Endocytosis. PLoS Biol. 9 (3), e1000604 (2011).
- Hansen, C. G., Nichols, B. J. Molecular mechanisms of clathrin-independent endocytosis. J Cell Sci. 122 (11), 1713-1721 (2009).
- Sabharanjak, S., Sharma, P., Parton, R. G., Mayor, S. GPI-anchored proteins are delivered to recycling endosomes via a distinct cdc42-regulated, clathrin-independent pinocytic pathway. Dev Cell. 2 (4), 411-423 (2002).
- Radhakrishna, H., Klausner, R. D., Donaldson, J. G. Aluminum fluoride stimulates surface protrusions in cells overexpressing the ARF6 GTPase. J Cell Biol. 134 (4), 935-947 (1996).
- Prosser, D. C., Drivas, T. G., Maldonado-Báez, L., Wendland, B. Existence of a novel clathrin-independent endocytic pathway in yeast that depends on Rho1 and formin. J Cell Biol. 195 (4), 657-671 (2011).
- Prosser, D. C., Wendland, B. Conserved roles for yeast Rho1 and mammalian RhoA GTPases in clathrin-independent endocytosis. Small GTPases. 3 (4), 229-235 (2012).
- Kohno, H., et al. Bni1p implicated in cytoskeletal control is a putative target of Rho1p small GTP binding protein in Saccharomyces cerevisiae. EMBO J. 15 (22), 6060-6068 (1996).
- Evangelista, M., et al. a Yeast Formin Linking Cdc42p and the Actin Cytoskeleton During Polarized Morphogenesis. Science. 276 (5309), 118-122 (1997).
- Kübler, E., Riezman, H. Actin and fimbrin are required for the internalization step of endocytosis in yeast. EMBO J. 12 (7), 2855-2862 (1993).
- Lin, C. H., MacGurn, J. A., Chu, T., Stefan, C. J., Emr, S. D. Arrestin-Related Ubiquitin-Ligase Adaptors Regulate Endocytosis and Protein Turnover at the Cell Surface. Cell. 135 (4), 714-725 (2008).
- Nikko, E., Sullivan, J. A., Pelham, H. R. B. Arrestin-like proteins mediate ubiquitination and endocytosis of the yeast metal transporter Smf1. EMBO Rep. 9 (12), 1216-1221 (2008).
- Nikko, E., Pelham, H. R. B. Arrestin-Mediated Endocytosis of Yeast Plasma Membrane Transporters. Traffic. 10 (12), 1856-1867 (2009).
- O'Donnell, A. F., McCartney, R. R., Chandrashekarappa, D. G., Zhang, B. B., Thorner, J., Schmidt, M. C. 2-Deoxyglucose impairs Saccharomyces cerevisiae growth by stimulating Snf1-regulated and α-arrestin-mediated trafficking of hexose transporters 1 and 3. Mol Cell Biol. 35 (6), 939-955 (2015).
- O'Donnell, A. F., Huang, L., Thorner, J., Cyert, M. S. A calcineurin-dependent switch controls the trafficking function of α-arrestin Aly1/Art6. J Biol Chem. 288 (33), 24063-24080 (2013).
- Prosser, D. C., Pannunzio, A. E., Brodsky, J. L., Thorner, J., Wendland, B., O'Donnell, A. F. α-Arrestins participate in cargo selection for both clathrin-independent and clathrin-mediated endocytosis. J Cell Sci. 128 (22), 4220-4234 (2015).
- Lamaze, C., Dujeancourt, A., Baba, T., Lo, C. G., Benmerah, A., Dautry-Varsat, A. Interleukin 2 receptors and detergent-resistant membrane domains define a clathrin-independent endocytic pathway. Mol Cell. 7 (3), 661-671 (2001).
- Prosser, D. C., Whitworth, K., Wendland, B. Quantitative analysis of endocytosis with cytoplasmic pHluorin chimeras. Traffic. 11 (9), 1141-1150 (2010).
- Bokman, S. H., Ward, W. W. Renaturation of green-fluorescent protein. Biochem Biophys Res Commun. 101 (4), 1372-1380 (1981).
- Miesenböck, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Sankaranarayanan, S., De Angelis, D., Rothman, J. E., Ryan, T. A. The Use of pHluorins for Optical Measurements of Presynaptic Activity. Biophys J. 79 (4), 2199-2208 (2000).
- Katzmann, D. J., Babst, M., Emr, S. D. Ubiquitin-dependent sorting into the multivesicular body pathway requires the function of a conserved endosomal protein sorting complex. ESCRT-I. Cell. 106 (2), 145-155 (2001).
- Longtine, M. S., et al. Additional modules for versatile and economical PCR-based gene deletion and modification in Saccharomyces cerevisiae. Yeast. 14 (10), 953-961 (1998).
- Goldstein, A. L., McCusker, J. H. Three new dominant drug resistance cassettes for gene disruption in Saccharomyces cerevisiae. Yeast. 15 (14), 1541-1553 (1999).
- Ausubel, F. M. . Curr Prot Mol Biol. , (1991).
- Urbanowski, J. L., Piper, R. C. Ubiquitin sorts proteins into the intralumenal degradative compartment of the late-endosome/vacuole. Traffic. 2 (9), 622-630 (2001).
- Newpher, T. M., Smith, R. P., Lemmon, V., Lemmon, S. K. In Vivo Dynamics of Clathrin and Its Adaptor-Dependent Recruitment to the Actin-Based Endocytic Machinery in Yeast. Dev Cell. 9 (1), 87-98 (2005).
- Maldonado-Báez, L., Dores, M. R., Perkins, E. M., Drivas, T. G., Hicke, L., Wendland, B. Interaction between Epsin/Yap180 adaptors and the scaffolds Ede1/Pan1 is required for endocytosis. Mol Biol Cell. 19 (7), 2936-2948 (2008).
- Aguilar, R. C., et al. Epsin N-terminal homology domains perform an essential function regulating Cdc42 through binding Cdc42 GTPase-activating proteins. Proc Natl Acad Sci U.S.A. 103 (11), 4116-4121 (2006).
- Isnard, A. D., Thomas, D., Surdin-Kerjan, Y. The study of methionine uptake in Saccharomyces cerevisiae reveals a new family of amino acid permeases. J Mol Biol. 262 (4), 473-484 (1996).
- Wendland, B., McCaffery, J. M., Xiao, Q., Emr, S. D. A novel fluorescence-activated cell sorter-based screen for yeast endocytosis mutants identifies a yeast homologue of mammalian eps15. J Cell Biol. 135 (6), 1485-1500 (1996).
- Alvaro, C. G., et al. Specific Alpha-Arrestins Negatively Regulate Saccharomyces cerevisiae Pheromone Response by Down-Modulating the G-Protein-Coupled Receptor Ste2. Mol Cell Biol. 34 (14), 2660-2681 (2014).
- Ghaddar, K., Merhi, A., Saliba, E., Krammer, E. M., Prevost, M., Andre, B. Substrate-Induced Ubiquitylation and Endocytosis of Yeast Amino Acid Permeases. Mol Cell Biol. 34 (24), 4447-4463 (2014).
- Becuwe, M., Léon, S. Integrated control of transporter endocytosis and recycling by the arrestin-related protein Rod1 and the ubiquitin ligase Rsp5. eLife. 3, (2014).
- Henne, W. M., Buchkovich, N. J., Zhao, Y., Emr, S. D. The Endosomal Sorting Complex ESCRT-II Mediates the Assembly and Architecture of ESCRT-III Helices. Cell. 151 (2), 356-371 (2012).
- Nickerson, D. P., Russell, M. R. G., Lo, S. -. Y., Chapin, H. C., Milnes, J. M., Merz, A. J. Termination of Isoform-Selective Vps21/Rab5 Signaling at Endolysosomal Organelles by Msb3/Gyp3. Traffic. 13 (10), 1411-1428 (2012).
- Nickerson, D. P., Merz, A. J. LUCID: A Quantitative Assay of ESCRT-Mediated Cargo Sorting into Multivesicular Bodies. Traffic. 16 (12), 1318-1329 (2015).
- Dulic, V., Egerton, M., Elguindi, I., Raths, S., Singer, B., Riezman, H. Yeast endocytosis assays. Methods Enzymol. 194, 697-710 (1991).
- Silve, S., Volland, C., Garnier, C., Jund, R., Chevallier, M. R., Haguenauer-Tsapis, R. Membrane insertion of uracil permease, a polytopic yeast plasma membrane protein. Mol Cell Biol. 11 (2), 1114-1124 (1991).
- Miliaras, N. B., Park, J. -. H., Wendland, B. The Function of the Endocytic Scaffold Protein Pan1p Depends on Multiple Domains. Traffic. 5 (12), 963-978 (2004).
- Vida, T. A., Emr, S. D. A new vital stain for visualizing vacuolar membrane dynamics and endocytosis in yeast. J Cell Biol. 128 (5), 779-792 (1995).
- Toshima, J. Y., Toshima, J., Kaksonen, M., Martin, A. C., King, D. S., Drubin, D. G. Spatial dynamics of receptor-mediated endocytic trafficking in budding yeast revealed by using fluorescent alpha-factor derivatives. Proc Natl Acad Sci U.S.A. 103 (15), 5793-5798 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved