Method Article
신진 효모의 세포 내 이입의 양적, 운동 및 높은 처리량 분석을위한 pHluorin의 응용 프로그램
요약
Accurate quantification of vesicular trafficking events often provides key insights into roles for specific proteins and the effects of mutations. This paper presents methods for using superecliptic pHluorin, a pH-sensitive GFP variant, as a tool for quantification of endocytic events in living cells using quantitative fluorescence microscopy and flow cytometry.
초록
녹색 형광 단백질 (GFP) 및 그 변종 널리 단백질 현지화 및 세포 골격 리모델링 및 살아있는 세포에서 소포 인신 매매 등의 이벤트의 역학을 공부하는 도구를 사용합니다. 키메라 GFP 융합을 사용하여 정량 방법은 많은 응용을 위해 개발되었다; 그러나, GFP는 단백질 분해에 어느 정도 내성 때문에 그 형광은 세포 내 이입 경로에화물 인신 매매의 정량을 방해 할 수있는 리소좀 / 공포에 계속. 이입 및 사후 이입 피킹 이벤트를 정량화하기위한 다른 방법은 superecliptic pHluorin 산성 환경에서 켄칭 GFP의 pH 민감성 변이체를 사용한다. multivesicular 기관 (MVBs)와 리소좀 / 공포 루멘에 전달하기로화물 통합에 따라 형광의 감쇠에 횡단화물 단백질 결과의 세포질 꼬리에 pHluorin의 키메라 융합. 따라서, 액포 형광의 담금질은 quantifi을 용이하게엔도 시토 시스와 세포 내 이입 경로에 이른 사건의 양이온. 이 논문은 형광 현미경을 통해 세포 내 이입의 정량 pHluorin 태그가화물을 사용하는 방법뿐만 아니라 유동 세포 계측법 사용 인구 기반의 분석에 대해 설명합니다.
서문
소포 피킹은 진핵 세포 내의 소기관 신원 및 기능을 유지하는 데 중요한 역할을하고, 각각의 세포 구획 막 단백질 및 조성물을 조절하기위한 중요한 메커니즘이다. 이입을 통해 생성 소체 후속 재활용 또는 리소좀 타겟팅에 대한 표면으로부터 막 단백질을 제거하는 반면 세포막에서 exocytic 소포 융합은 세포 표면 단백질 및 새로운 막을 제공한다. 따라서, 엔도 시토 시스는 영양 흡수 및 세포 외 환경에 대한 응답 중요하다. 세포 외 유출 및 엔도 시토 시스는 세포막 표면적을 조절하기 위해, 손상된 단백질의 회전율을 균형있게된다.
효모 및 포유 동물 세포의 연구는 다양한 EN에 응답하여 세포 내 이입에 관련된 단백질의 대량뿐만 아니라 특정화물의 내재화를 촉진 여러 세포 내 이입 경로 또는 행위를 식별 한vironmental 조건. 가장 공부 경로는 클라과 세포질 액세서리 단백질이 초기 세포 내 이입 소포를 안정화 코트 구조로 조립하는 클라 매개 엔도 시토 시스 (CME)입니다. 신진 효모 사카로 마이 세스 세레 비지에의 실험 역학 및 많은 세포 내 이입 단백질 1-3 모집의 순서로 키 통찰력을 굴복했다. 특히, CME 기계가 매우 진화를 통해 보존되는 효모에서 CME 관련 단백질의 대부분은 인간 orthologs을 가지고; 따라서, 효모 신진 높은 진핵 생물에 보존되어 엔도 시토 시스의 메커니즘을 이해하기위한 중요한 도구가되고있다. 예를 들어, 출아 효모를 사용하는 연구가 추가로 세포 내 이입 액세서리 채용 하였다 CME 구조의 형성과 성숙 (효모 등 피질 액틴 패치 라 함) 클라화물 결합 어댑터 단백질부터 시작하여, 많은 단백질의 연속 채용 관련 결정 단백질,Arp2 / 3 매개 액틴의 중합의 활성화 및 소포 절단 1,2에 관여하는 단백질의 모집. 굴지 패치를 대뇌 피질하기 CME 기계 단백질의 모집은 높은 주문하고 진부한 과정, 많은 단백질 모집의 정확한 순서는 CME 기계의 다른 구성 요소에 대한 설립되었습니다. 중요한 것은, 최근의 연구는 포유 동물 세포 4 클라 코팅 된 구덩이에서 CME의 단백질을 모집 비슷한 순서를 확인했다.
CME 외에도 여러 종류의 세포는 세포막 5-7에서 소포 형성 및 내재화를 촉진하는 다른 메커니즘에 의존하는 하나 이상의 독립적 인 클라 세포 내 이입 (CIE) 경로를 갖는다. 효모, 우리는 최근에 작은는 GTPase Rho1 및 활성화 구아닌 염기 교환 계수 (GEF), ROM1 8,9을 활용하는 CIE 경로를 확인했다. Rho1은 액틴의 중합 (1)를 홍보하기 위해 formin Bni1를 활성화효모 12 클라 독립적 인 세포 내 이입이 양식에 필요한 0,11. 또한, 단백질의 α-아레스 가족은 유비퀴틴 리가 Rsp5은 CME 13-17을 통해화물 유비퀴틴 이후의 국제화를 촉진하고, 또한 CIE (18)에 관여하는 단백질과 가능성 직접적인 상호 작용을 통해 CIE 경로를 통해화물의 국제화를 촉진하기 위해 모집. CIE의 다양한 경로는 또한 Rho1의 ortholog, 9,19-에서 RhoA 의존 클라 독립적 식세포 경로를 포함한 포유 동물 세포에 존재한다. 포유 동물 CIE에서에서 RhoA의 역할은 제대로 이해된다; 따라서, 신진 효모의 연구는 포유류 CIE에 적용 할 수있는 추가 기계적인 통찰력을 제공 할 수있다.
세포 내 이입 사건의 정확한 정량화는 엔도 시토 시스를 조절하는 특정 단백질의 역할에 대한 중요한 정보를 제공 할 수 있으며,화물 내재화 또는 progressio에 돌연변이의 효과를 밝힐 수세포 내 이입 경로를 통해 N. 이를 위하여, 생화학 적 방법은 리간드 흡수를 모니터링하거나 세포 내 이입화물 단백질의 분해 속도를 측정하기 위해 이용 될 수있다. 살아있는 세포에서 녹색 형광 단백질 (GFP)과이자의화물에 그 변종의 융합은화물 운송의 직접 시각화 할 수 있습니다. GFP는 (효모 또는 공포) 리소좀에서 분해에 내성이 있기 때문에, GFP - 태그화물은 엔도 시토 시스의 정량 사용이 제한됩니다. 또한, GFP의 형광은 pH의 변화에 부분적으로 만 구분하며 20, 21 루멘 액포 내에서 검출 남아있다. 그 결과, GFP 태그 형광화물의 나머지가 저하되었으며,화물 강도 전체 셀 기반 정량 인해 액포 장기 GFP 형광에 부정확 할 수 오랜 후에 액포에 계속.
액포의 GFP 형광의 단점을 극복하기 위해, 우리는 이전 superecliptic pH를 사용했다luorin, 중성 pH에서 밝은 형광 있지만, 이러한 20,22,23 리소좀 액포 /의 루멘으로 산성 환경에서 형광을 상실 GFP의 pH에 민감한 변형. 세포 내 이입화물의 세포질 꼬리에 pHluorin 태그를 배치하면 세포막에와 pHluorin 태그가 세포질 (그림 1A)에 노출 된 상태로 유지 초기 엔도 좀,에화물의 시각화를 허용합니다. 초기 엔도 좀은 엔도 좀의 루멘에 꽃 봉오리 소포로 전송 (ESCRT) 기계 패키지 표면 지역화 된화물에 필요한 엔도 좀 정렬 복잡하고, 생성 multivesicular 기관 (MVBs) (24)를 성숙. 내부 MVB 소체에 포함 된화물의 경우, pHluorin 태그 소포 루멘을 향. 내부 MVB 소체는 산성화; 그들은 MVBs (20)에 성숙하여, pHluorin 태그가화물 초기 엔도 좀의 형광을 잃게됩니다. 액포와 MVB의 후속 융합은 MVB의 내강 내용을 제공합니다열화 및 pHluorin 태그는 액포 루멘의 산성 환경에서 급냉 유지.
이 논문은 효모의 세포질 pHluorin 태그로화물을 이용하여 정량적 인 세포 내 이입 분석에 대한 자세한 설명을 제공합니다. pHluorin 태깅화물을 발현 균주 특정화물의 특성 및 피킹 동작에 따라, 운동 및 / 또는 엔드 포인트 분석에 사용될 수있다. 또한, 일부 pHluorin 태그가화물은 유동 세포 계측법을 포함하여 높은 처리량 분석 방법, 의무가 있습니다. 중요한 것은, pHluorin 태그는, 살아있는 세포에서 세포 내 이입 이벤트 공부 이입 및 야생형 및 돌연변이 균주에서 세포 내 이입 함수의 비교의 정량을 허용하는 다용도 공구이다.
프로토콜
1. 솔루션 및 미디어
- 뒤에 오는 주식, 미디어 및 플레이트를 준비합니다 :
- 배 YNB을 준비하기 위해 물 1 L의 아미노산이 부족한 효모 질소 염기 67g을 용해. 0.22 ㎛의 니트로 셀룰로오스 필터를 통해 여과하여 멸균.
- 2 (V의 재고 / w 멸균 50 %)에서 % 덱 스트로스와 1X 아미노산 / 영양 혼합물 (10 배 재고에서) 1 배 YNB를 사용하여 YNB 매체를 준비합니다 (100 × 재고에서, 단계 1.1.4 참조). 필요한 플라스미드 선택 개별 아미노산 또는 영양분을 생략합니다. Mup1 발현 유도 추가적으로 아미노산 / 영양 혼합물로부터 메티오닌 생략.
- (V의 재고 / w 멸균 50 %에서) (10 배 재고에서) 1 배 YNB를 사용하여 YNB 판, 2 % 덱 스트로스를 준비, 0.7 g / L의 아미노산 / 영양 혼합물 (단계 1.1.5 참조)와 2.5 % 한천. 한천 25 g 및 물 860 ml의 당 아미노산 / 영양 혼합물의 0.7 g을 고온 가압 멸균하여 평판 배지를 준비합니다. ml의 오 혼합물을 100 배 YNB ml의 40을 한 후, 55 ° C로 냉각 추가 할 수 있습니다F 50 % 포도당. 플레이트 (10cm 접시 당 매체의 30 ml)에 붓고 매체가 실온에서 고화하는 것을 허용하고, 가기 판 4 ℃에서.
- 탈 이온수 100ml에 다음 용해 (액체 매체 용) 100X 아미노산 / 영양 스톡 용액을 제조 하였다 : 0.1 g의 L-메티오닌 0.3 g L 류신 및 L- 리신 0.2 g L 히스티딘 각각마다 , L- 트립토판, 아데닌 및 우라실이 (특정 균주에 필요한 다른 아미노산 및 영양소가 포함될 수도있다). 용해 필요한 경우 부드러운 열을 사용하여 0.45 μm의 니트로 셀룰로오스 필터를 통해 살균. 빛으로부터 보호 실온에서 보관하십시오. 플라스미드의 선택을 위해 필요에 따라 특정 구성 요소가 결여 원액을 준비한다.
- 조합함으로써 아미노산 / (플레이트) 영양 혼합물을 제조 다음 아데닌 0.5 g, L- 루신 4 g, 2 g L 히스티딘, L- 라이신, L- 메티오닌, L- 트립토판 각각 L- 티로신 및 우라실. 박격포와 유 봉으로 갈기, 그리고 프로로 저장빛에서 tection. 플라스미드의 선택을 위해 필요에 따라 특정 구성 요소가없는 이들의 혼합물을 제조하고, 평판 배지 (단계 1.1.3 참조) 리터당 아미노산 혼합물 0.7 g을 사용한다.
- 콘 카나 발린의 A (ConA에)와 슬라이드의 표면을 코팅하여 현미경 8 웰 챔버 슬라이드를 준비한다. 챔버 슬라이드의 각 웰에, 물에 용해 2 ㎎ / ㎖ ConA에 25 μl를 추가합니다. 피펫 팁을 사용하여, 웰의 바닥면에 걸쳐 ConA에 확산하고, 적어도 4-8 시간 동안 실온에서 공기 건조에 슬라이드 가능. 이상적으로, ConA에 코팅의 24 시간 내에 챔버 슬라이드를 사용합니다.
- 중합 효소 연쇄 반응 (PCR) 등 Longtine에 기술 기반 통합 방법을 사용하여 관심의 세포 내 이입화물에 GFP 또는 pHluorin의 프레임 내 융합체와 효모 균주를 생성한다. 그리고 골드 스타와 McCusker 25, 26.
참고 : pHluorin는 저항 카나마이신에 대한 유전자 (KANMX6) 및 nourseothricin와 카세트 태그를 포함하는 플라스미드 ( NATMX4)는 이전 20 설명했다.- 게놈 통합 20,25의 사이트에 고유의 추가 서열을 포함하는 프라이머와 선택 마커를 포함하는 GFP 또는 pHluorin 카세트를 증폭.
- 리튬 아세테이트 방법 (27)를 사용하여 원하는 효모 균주에 생성 된 PCR 생성물을 변형.
- 적절한 약물을 함유 YPD 접시에 세포를 성장시켜 카세트의 통합을 선택합니다. 플레이트, 오토 클레이브 10g 효모 추출물 20 g 펩톤 0.1 g 트립토판 및 960 ml의 물에 25g의 한천을 준비합니다. 플레이트 쏟아지는 전에 혼합 후 글루코스 KANMX6 선택 200 ㎍ / ml의 최종 농도 G418하거나, nourseothricin 100 ㎍ / ml의 최종 농도로 40 ml의 50 %를 넣고 55 ℃로 냉각되도록 NATMX4를 선택합니다.
- PCR에 의해 개별 식민지에서 GFP 또는 pHluorin 태그의 통합을 확인 및 / 또는 방지 GFP 항체를 사용하여 웨스턴 블로 팅,뿐만 아니라, 형광 현미경 (20)에 의해 태그 된 단백질의 검출에 의해.
주 : 특정 효모 균주를 본 연구에 사용 된 플라스미드를 각각 표 1 및 표 2에 열거되어있다.
구조적으로 내면화 세포 내 이입화물의 정상 상태 형광 2. 엔드 포인트 분석
- (해당하는 경우) 플라스미드 유지 보수에 필요한 아미노산이나 영양소를 부족 YNB 배지 5 ml의 세포 (~ 3 작은 식민지를) 접종. 250 rpm으로는 진탕, 30 ° C에서 궤도 진탕 배양기에서 16 ~ 24 시간 동안 세포를 성장. 또한, 아미노산 또는 플라스미드 선택을위한 영양분을, 부족한 YNB 판 상 세포의 행진 a를 ~ 1-2mm 식민지 30 ° C에서 하룻밤 세포를 성장.
- 분광 광도계를 이용하여 각각의 하룻밤 배양 밀도 (OD 600)를 측정한다. 놀이터 용 아미노산 또는 영양분을 부족 YNB 배지에서 0.35-0.4 OD 600 / ㎖에서 5 ml의 희석을 준비합니다SMID의 유지 보수 및 진탕 30 ° C에서 약 3 시간 동안 성장한다. 사용하는 세포가 접시에 줄무늬가있는 경우,이 단계를 건너 뛰고 단계 2.4 (아래 참조)를 진행합니다.
- 지금 0.6-1.0 OD 600 / ㎖ 사이 여야 세포의 밀도 (OD 600)를 측정한다. 2 분 동안 8,000 RPM (6,800 XG)에서 1.5의 microfuge 튜브에 문화 ml의, 그리고 펠렛 세포를 전송합니다. 상층 액 1,475 μl를 제거합니다.
- 형광 현미경으로 세포를 가져와. 각 샘플을 묘화 전에 남은 배지에서 세포를 재현 탁하여 슬라이드를 제조하고, 커버 슬립에 따라 세포 현탁액 3 μL 마운트. 플라스미드의 선택에 따라 적절하게 YNB 배지를 사용하여 프로토콜 3에서 후술하는 바와 같이 다른 방법으로, 8 웰 챔버 슬라이드를 준비한다. 이상적으로, 100 배, 1.4 이상의 개구 수 (NA) 오일 액침 대물 렌즈, 12 또는 16 비트의 카메라 및 여기 / 발광 필터 화상 세포 GFP 형광에 최적화.
참고 : 사용하여 셀 (을)를 줄무늬로 성장하는 경우NA 플레이트는 커버 슬립에 신선한 YNB 배지 3 μl를 배치하여 슬라이드를 준비한다. 피펫 팁을 사용하여, 상기 플레이트로부터 세포의 작은 콜로니를 수집 YNB 배지로 세포를 분산하고, 촬상 직전에 유리 슬라이드에 생성 된 현탁액을 탑재. - 화상 실험 내의 모든 화상에 대해 동일한 파라미터 획득 (즉, 필터 세트와 노출 시간)을 이용하여 각각의 조건에 대한 세포의 4-6 랜덤 필드.
참고 : 각 필드의 시야 또는 DIC 이미지를 수집하는 것은 pHluorin 신호가 MVB와 액포 구획에서 급냉 세포에 대한 도움이 될 수 있습니다. - 각 조건에 대해 적어도 30-50 세포의 형광 강도를 정량화 (프로토콜 5 참조).
규제 엔도 시토 시스를 받아야화물의 엔도 시토 시스의 정량 3. 운동 분석
- 메티오닌이 부족 YNB 배지 5ml에 효모 세포 (식민지 당 직경 약 2mm)의 2 ~ 3 콜로니를 접종 및 추가플라스미드 선택을 유지하기위한 itional 아미노산 또는 영양소. 진탕 30 ° C에서 16 ~ 24 시간 동안 문화를 성장.
참고 :이 논문에서는 규제 세포 내 이입화물 단백질을 연구 프로토콜은 메티오닌 퍼 미아, Mup1의 사용을 만들 것입니다. 조절 된 세포 내 이입을 겪는 다른화물도 pHluorin로 태깅에 적합하다 (예를 들면 우라실의 부재 세포막에 축적하고 Fur4 미아 우라실은 외부 우라실인가에 응답 내면화); 이화물에 대한 미디어 조건은화물에 대한 특정 식, 유도 및 국제화 조건을 반영하기 위해 수정해야합니다. - 약 3 시간 이미징 전에 각 하룻밤 문화의 밀도 (OD 600)를 측정한다. 플라스미드 유지를위한 추가적인 메티오닌 아미노산 또는 영양 결핍 YNB 배지 0.35-0.4 OD 600 / ㎖에서 5 ㎖ 희석액을 제조하고, 진탕하면서 30 ℃에서 성장한다.
- 마이크로 사전 평형단계 3.2의 3 시간 배양 동안 30 ° C까지의 환경 챔버 또는 가열 단계 (있는 경우)에 대응.
- 전송 2 분 동안 8,000 rpm으로 (6,800 XG)에서 1의 microfuge 튜브에 세포 배양 ml의, 그리고 펠렛 세포. 상층 액 975 μl를 제거합니다.
- 영상 (프로토콜 1.2)에 대한 ConA에 처리, 8 잘 유리 바닥 챔버 슬라이드를 준비합니다.
- 물론 각 플라스미드 선택에 메티오닌 및 추가 아미노산 또는 영양분을 부족 YNB 배지 200 μl를 추가합니다. 나머지 상층 액을 단계 3.4에서 세포 펠렛을 재현 탁하고, 각 웰의 중앙에 세포 현탁액 250 μl를 드롭. 아래로 피펫 팅에 의해 우물의 표면에서 세포를 분산하고, 세포가 5 ~ 10 분 동안 정착 할 수 있습니다.
- 30 ° C (단계 3.3 참조) 평형 거꾸로 형광 현미경에 챔버 슬라이드를 놓습니다. 시야 조명을 사용하여 세포의 필드를 찾습니다.
- 100 μg의 / ㎖의 메티오닌을 포함 YNB 배지 50 μl를 추가20 μg의 / ㎖의 최종 메티오닌 농도를 획득하기 위해 상기 웰에 배지 200 μL로 (30 ° C로 미리는 예열). 바닥으로부터 떠로부터 세포를 방지하기 위해, 웰의 배지를 방해하지 마세요.
- 세포 이미징을 시작하기 전에 2 분 동안 평형을 허용합니다. 바로 첫 번째 이미지를 캡처하기 전에 원하는 초점면에 현미경을 조정 (일반적으로 적도 초점면이 가장 잘 작동합니다).
- , GFP 필터를 사용하여 (예를 들면 시계열 내의 모든 이미지, 100X 1.4 NA 오일 침지 대물 500 밀리 획득 시간을 동일 획득 파라미터를 이용하여, 45 ~ 60 분 동안 100을 5 분 간격으로 GFP 및 브라이트 (또는 DIC) 화상을 취득 밀리 획득 시간 DIC 필터를 사용하여).
주 : 현미경의 스테이지 및 이미징 소프트웨어 초점 평면 드리프트를 자동 보정을 허용하지 않는 경우, 수동 각 촬상 시각 이전에 포커스를 재조정 할 필요가있다. 또한, 획득 시간은 것때문에 조명 및 필터의 차이에 현미경 사이에서 변화하고, 최적의 조건은 실험을 시작하기 전에 수동으로 결정되어야한다. Mup1 이외 이입화물을 사용하는 경우, 그화물의 내재화 동역학을 반영하기 위해, 획득 시간 및 촬상 간격뿐만 아니라 실험 기간을 수정할 필요가있다. - 각 시점에서 각 셀의 형광 강도를 정량화 (프로토콜 5 참조), 제 1 화상의 초기 강도의 백분율 값을 표현한다.
규제 엔도 시토 시스를 받아야 세포 내 이입화물의 정량 4. 엔드 포인트 분석
- 프로토콜 3에 설명 된대로 이미징을위한 세포를 준비 (3.6 통해 3.1 단계).
- 이미지 즉시 시야와 GFP 필터 세트를 사용하여, 메티오닌을 추가하기 전에 각 조건에 대한 세포의 4-5 임의의 필드.
- 100 μg의 / ㎖의 메티오닌을 포함 YNB 배지 50 μl를 추가 (전쟁 전웰에서 배지 200 μL로) 30 ° C로 20 μg의 메드 / ㎖의 최종 메티오닌 농도를 얻었다. 바닥으로부터 떠로부터 세포를 방지하기 위해, 웰의 배지를 방해하지 마세요.
- 0 분 시점 (스텝 4.2)과 동일한 인수 변수를 이용하여 메티오닌을 첨가 한 후 세포의 이미지 4-5 랜덤 필드, 30 분.
- 각 시점에 대해 적어도 30-50 세포의 형광 강도를 정량화 (프로토콜 5 참조). 수식을 사용하여 30 분 후 내면화 Mup1-pHluorin의 비율로 명시 적 값 : - X 100 % [0 분에서 평균 강도] / [30 분에서 강도를 평균 0 분에서 강도를 평균].
주 :. 또한 동시에 각각의 분석의 개시 시각을 엇갈리게하여 여덟 종점 분석법까지 수행 할 수있다 표 3은 여덟 동시 분석을위한 예시적인 흐름을 제공한다.
5. 후 수집 분석
- 1 등 수집 소프트웨어에서 이미지 내보내기6 비트 태그 이미지 파일 포맷 (이 .tif 또는 .TIFF 포맷).
참고 : 다른 파일 형식도 적합 할 수있다, 이상적 무손실 압축 알고리즘을 사용한다. 8 비트 이미지는 일반적으로 정량 목적에 적합하지 않다. - 존재하는 경우 ( '파일'메뉴에서 '열기'옵션에서 자유롭게 사용할 수 ImageJ에 소프트웨어를 (사용하여 파일 열기가. 정량의 형광 이미지를 사용하고, 참고로 시야 / DIC 이미지는 세포의 위치를 확인하고 죽은 세포를 제외 ), DIC가보고 GFP 여기 / 방출 필터로 볼 때 autofluorescent하는 살아있는 세포보다 어둡게 표시되는.
- 형광 이미지의 배경 빼기를 수행합니다. 고르지 배경 신호 이미지의 경우, '프로세스 메뉴'에있는 '배경 빼기'알고리즘을 사용합니다. 정량 목적을 위해 일반적으로 충분 기본 설정 (50 픽셀의 볼 반경 롤링)를 사용합니다.
참고 : 대안 backgro에균일 한 배경 이미지 싶게 감산 방법은 단계 5.3.1.-5.3.2에 설명되어 있습니다; 그러나, 상기 방법은 또한, 균일 한 배경에 대해 작동한다.- 균일 한 배경 이미지 (즉, 배경 강도의 모든 에지에서 상기 이미지의 중심에서 대략 일정하다), 수동 배경 차감을 수행한다. 주 ImageJ에 창에있는 '자유 선택'버튼을 클릭하고, 세포를 포함하지 않는 이미지에서 3-5 임의의 영역을 선택합니다.
- 의 '분석'메뉴에있는 '설정 측정'기능을 열고 '평균 회색 값'매개 변수를 선택하고 (또한 '분석'메뉴에 있음) '측정'기능을 사용하여 강도 값을 측정한다. 3-5 측정 지역의 평균 값을 계산하고, 그 이미지의 모든 후속 측정에서 뺍니다.
- 운동 분석의 정량 (프로토콜 3)는 TIM을위한 단일 이미지를 생성 누적전자 시리즈. 시간 순서대로 각 시점에서 형광 이미지를 열고 (스택의 하위 메뉴에서 '이미지'메뉴에서 발견) 함수를 '스택 이미지'를를 사용하여 스택을 생성합니다.
- 가능한 전지의 외부 전체 셀뿐만 아니라 작은 영역을 포함해야 만드는 자유 선택 도구를 사용하여 셀을 설명합니다.
- 다음 매개 변수를 측정 : '지역 통합 밀도'와 '평균 회색 값'. '분석'메뉴에있는 '설정 측정'기능을 사용하여 파라미터를 선택.
주 : 집적도 선택된 영역 내의 모든 픽셀 세기들의 합에 대응하고, 평균 그레이 값이 셀 크기에 대한 강도 값들을 보정 [집적 밀도 / 영역]에 대응한다. - '도구'하위 메뉴 아래에있는 '분석'메뉴에있는 '투자 수익 (ROI) 관리자'를 엽니 다. 투자 수익 (ROI) 관리자 창에서 강조 레지오를 입력하려면 '추가'버튼을 클릭n은 관심 (ROI)의 새로운 영역으로.
- 반복 이미지의 나머지 셀 5.6을 통해 5.4 단계를 반복합니다. 및 이미지의 가장자리에 닿을 모든 세포, 시야 / DIC 및 형광 (그림 2 층을 볼 죽은 세포는 DIC 이미지에서 어두운 표시하고, GFP 여기 / 방출로 볼 autofluorescent 세포질 신호가)에 의해 평가로 죽은 세포를 제외합니다. 의 투자 수익 (ROI) 관리자 '창에서'추가 '버튼을 클릭하여 .zip 파일로 선택한 로아을 저장하고 스프레드 시트 또는 통계 분석 소프트웨어로 모든 측정을 내보낼 수 있습니다.
- 운동 분석 정량화 (프로토콜 3)의 경우, 윤곽 및 단계 5.4 및 5.5에 기술 된 바와 같이 초기의 시점에서 전지를 측정한다. 실험의 모든 후속 시점의 측정에 대해 동일한 투자 수익 (ROI)을 사용합니다.
- 종점 분석법 (프로토콜 2, 4)은 각 조건에 대해 30 ~ 50 셀의 최소 측정한다. 적어도 2 ~ 3 이미지에 대한 정량화를 수행하고, 각의 모든 셀을 포함분석의 단계 5.8에 설명 된 기준을 충족하는 이미지입니다.
- 사후 분석을 위해 Tukey에의 다중 비교 시험 다음 편도 ANOVA를 사용하여 샘플 간의 통계적 유의성을 평가합니다.
유동 세포 계측법에 의해 Mup1 - pHluorin 엔도 시토 시스 6. 인구 분석
- 메티오닌 플라스미드의 선택을 유지하는 추가적인 아미노산 또는 영양 결핍 YNB 배지 0.5 ㎖의 효모 세포 (콜로니 당 직경 약 2 ㎜) 2-3 콜로니를 접종한다. 롤러 드럼에 30 ° C에서 16 ~ 24 시간 동안 5 ml의 둥근 바닥 튜브에 세포를 성장.
- 플라스미드 유지를위한 추가적인 메티오닌 아미노산 또는 영양 결핍 YNB 배지 1.5 mL를 넣어 롤러 드럼에서 추가 3 시간 동안 30 ℃에서 성장한다.
- 이전 두 5 ㎖ 둥근 바닥 튜브의 각 셀에 1 ㎖. 제 1 튜브 (-Met 조건)에 YNB -Met 매체의 0.25 ML을 추가하고, YNB 배지 0.25 ㎖를 100 μg의를 포함/ ㎖의 제 2 튜브에 메티오닌 20 μg의 / ㎖ (+ 만난 조건) 메티오닌의 최종 농도를 얻었다. 롤러 드럼 상을 45 분 동안 30 ℃에서 세포를 인큐베이션.
- 화물 국제화의 척도로 형광 이소 티오 시아 네이트 (FITC) 필터에서 셀 크기의 측정 및 Mup1-pHluorin 형광 강도로 앞으로 분산 형 (FS)를 선택, 유동 세포 계측법에 의해 세포를 분석 할 수 있습니다.
- 사용되는 효모 세포의 크기 범위의 형광 강도에 대한 검출을 최적화 FS 및 FITC 채널의 전압을 조정하기 위해 슬라이더 버튼을 사용하여 (이 실험에 사용되는 설정은 FS 50 V 및 FITC 400 V이었다).
참고 : 두 채널의 전압이 사용되는 사이토 흐름에 따라 달라집니다. 이 단계는 이전 또는 메티오닌 (단계 6.3)로 45 분 처리시 수행해야합니다. - 높은 유량 설정을 사용하여, 각 조건에서 10,000 세포 FS 및 형광 강도를 측정한다. FLUO에 대한 FS의 산포도를 생성강도를 rescence : '그래프를 추가'를 클릭 FITC (x 축)와 FS (y 축)을 선택하고 그래프 1,000 점 (소프트웨어 만 세포를 측정 하였다에도 불구하고, 1000 셀의 값을 표시합니다).
주 : 최대 일관성을 위해, 세포에게 메티오닌의 첨가 후 45 ~ 50 분을 분석; 샘플의 다수를 포함하는 실험을 위해, 유동 세포 계측법 분석에 필요한 시간을 수용하기 메티오닌 첨가 비틀. - 제어로 야생형 (WT) 세포 -Met과 + 메트로 조건을 포함합니다. 게이트 함수를 사용하여, 밝은 세포의 약 5 %, 게이트의 우측에 낙하되도록 상기 WT + 메트 조건을 사용하여, 수직 게이트를 할당한다. 실험의 다른 모든 조건이 게이팅을 사용합니다.
결과
구조적으로 내면화 세포 내 이입화물 단백질 STE3의 정상 상태 파악 및 정량화
살아있는 세포, STE3, 효모의 A-요인 페로몬 수용체의 세포질 C 말단 꼬리 키메라 GFP 및 pHluorin 융합의 현지화에 pHluorin 태그가화물은 엔도 시토 시스의 정량에 이용 될 수 있다는 것을 보여주기 위해 비교 하였다. STE3는 구성 적 열화 28 액포로 원형질막으로 수송 내면화 및 타겟팅 된 G 단백질 - 결합 수용체 (GPCR)이다. STE3-GFP (도 2A)를 발현하는 야생형 (WT) 세포에서 본 따라서, 정상 상태 조건 하에서 STE3 대다수는 액포 루멘에 편재. 한편, 네 클라 결합 어댑터 단백질 ENT1, Ent2, Yap1801 및 Yap1802을 (암호화하는 유전자를 결핍 세포 ENT1 Δ이하 4Δ라고 ent2 Δ yap1801 Δ yap1802 Δ는) 엔도 시토 시스 (29)의 사이트에서 클라을 안정화하는 데 실패하고, CME (30)에 심각한 결함이 있습니다. 4Δ 세포 생존 능력의 30, 31에 대한 epsin ENT1 또는 Ent2 하나의 N 말단 동성 (ENTH) 도메인의 표현을 필요로한다. ENT1 (도 2A) 8,30의 ENTH 도메인 표현 4Δ ENTH1 + 세포의 세포막에 STE3-GFP의 보존에 의해 도시 된 바와 같이 ENTH 도메인, 4Δ 세포 내 이입에 충분하지 않다; 4Δ + ENTH1 세포에서 유사한 세포막 유지는 STE2-GFP합니다 (α-요인 페로몬 수용체) 및 Mup1-GFP 또는 Mup1-pHluorin (메티오닌 퍼 미아) (8, 18)를 포함하여 다른 세포 내 이입화물에 대한 관찰되었다. 반면, 4Δ 세포에서 플라스미드 (4Δ + ENT1)에서 전체 길이 ENT1의 표현은 공포에 엔도 시토 시스와 STE3-GFP의 현지화를 복원합니다. 4Δ ENTH1 + 세포는 최근에 사용 된NA 유전자 스크린에 의존하는 효모의 CIE 경로를 식별 할 액틴 변조는 GTPase Rho1 및 GEF, ROM1뿐만 아니라 formin Bni1화물은 8, 18 분류에 관련된 단백질의 α-아레스 가족 구성원. STE3-GFP (그림 2A)의 내재화를 개선 4Δ + ENTH1 세포에서 높은 복사 플라스미드에서 CIE 역할, 표현 ROM1의 또는 α-아레스의 LDB19과 일치.
STE3-GFP 또는 다른 GFP 태그가 세포 내 이입화물을 발현하는 세포가 축적 및 GFP 태그의 단백질 분해 저항으로 인해 밝은 액포가있다. 반대로-STE3 pHluorin을 발현하는 세포는 산성 환경 (20)으로 인해 pHluorin 태그 담금질 액포 형광 매우 낮은 레벨을 갖는다. 앞서 본 바와 같이, WT와 4Δ ENT1 + 세포는 형광 현미경 (도 2B)에 의해 거의 검출-STE3 pHluorin 나타났다. 한편, STE3-pHluorin액포-STE3 pHluorin이 모든 경우에 거의 탐지 유지하면서, 4Δ ENTH1 + 세포의 세포막에서 용이하게 검출되었다. 액포-STE3 pHluorin이 모든 경우에 거의 탐지 남아 있지만 ROM1 또는 LDB19 높은 - 카피 발현은 GFP-STE3 결과와 유사한 세포 표면에서 검출-STE3 pHluorin의 양을 감소시켰다.
GFP-과의 효과를 비교하기 위해 세포의 세포 내 이입 능력의 변화를 정량화하기위한 도구로화물을 pHluorin을-태그, STE3-GFP 및 STE3-pHluorin의 전체 세포 형광 WT 및 4Δ 세포에서 측정 하였다. STE3-GFP 지역화의 변화가 현미경 (그림 2A)에 의해 쉽게 감지했지만, 전반적으로 형광 강도의 차이는 WT, 4Δ + ENT1와 빈 벡터 (그림 2C) (20)로 형질 전환 된 4Δ + ENTH1 세포 사이에 통계적으로 유의하지 않았다. Likewis즉, 벡터, 및 ROM1 LDB19 형질 4Δ + ENTH1 세포 유사 전체 세포의 형광 강도를 가지고 있었다. 특히 ROM1 또는 LDB19 형질 4Δ + ENTH1 세포 WT 세포 (도 2c) (8, 18)보다 상당히 어둡게 하였다 면역 (도 2E)에 의해 평가 그러나 STE3-GFP 단백질 수치는 유사 하였다. 강도의 차이는 공포의 크기 나 형태의 변화에 부분적으로, 또는 공포의 GFP 태그의 보존의 차이에 기인 할 수 있지만, STE3-GFP의 형광의 정량 (그림 형광 현미경으로 관찰 현지화의 변화를 반영하지 않습니다 2A). 반면, STE3 - pHluorin 강도의 정량화는 벡터로 형질 전환 4Δ + ENTH1 세포는 WT 또는 4Δ + ENT1 세포보다 훨씬 밝게했다 시연 및 ROM1 또는 4Δ + ENTH1 세포에서 LDB19의 높은 복사 식 STE3-pHluorin의 강도를 감소WT 및 4Δ + ENT1 (그림 2D)과 유사 하였다 수준. 따라서, 정상 상태 STE3 - pHluorin 강도의 정량을 정확하게 형광 현미경으로 관찰 현지화의 차이를 반영한다.
조절 된 세포 내 이입화물, Mup1를 사용하여 운동 내재화 분석
정상 상태에서 구조적으로 내면화화물에 대한 형광 강도의 정량화는 WT 세포에 비해 돌연변이 세포의 세포 내 이입 능력의 차이를 공개 할 수 있습니다. 그러나, 일부화물은화물 돌연변이 세포가 내재화에 대한 세포 내 이입 또는 느린 반응 속도가 지연에도 불구하고 세포 내 이입 WT 돌연변이 세포에서 동일한 정상 분포 및 강도에 도달 할 수있다. 특정 자극 또는 리간드에 대한 응답으로 조정 된 엔도 사이토 시스를 받아야 대신 pHluorin이 태깅 된화물은 모니터링하는데 사용될 수있다엔도 시토 시스의 반응 속도. 이를 위해, 높은 친 메티오닌 미아, Mup1의 내재화는 32 모니터링 하였다. 세포 메티오닌이없는 경우, Mup1 발현은 상향 조절되고, 퍼 미아는 세포막에 유지된다; 매체에 메티오닌의 첨가시, Mup1 빠른 국제화 및 공포 (13)에 대상을 겪는다.
Mup1 내재화의 동력학을 모니터링하기 위해 게놈 궤적 Mup1-GFP 또는 Mup1-pHluorin 표현 WT 균주는 세포막에서 (도 3a, 0 분의 시점)을 형광 Mup1를 축적하기 위하여 메티오닌의 부재 하에서 성장시켰다. 세포의 시간 경과 후 영상화물 내재화를 형광의 변화를 모니터링 할 수없는 또는 메티오닌의 존재하에 5 분 간격으로 수행 하였다. 예상 한 바와 같이, 메티오닌의 부재시에 이미징 및 GFP- pHluorin 태그가 Mup1는 세포막 F에서 남아또는 전체 45 분의 관찰 기간 20. 대조적으로 메티오닌의 존재 묘화 셀화물 내재화와 일치 세포 표면에서 형광 신호의 점진적인 고갈을 나타내었다. 특히, Mup1-GFP의 형광 Mup1-pHluorin 가능성이 초기 엔도 좀에 해당하는 내부 punctae에 지역화하지만 공포에서 볼되지 않은 반면, 내부 구조 (즉, 엔도 좀과 공포)에 축적.
형광 개별 셀에 대한 모든 시점에 걸쳐 정량했을 때 Mup1-GFP 및 Mup1-pHluorin 강도 안정적 세포막에 국부적 잔류 단백질과 부합하는 45 분 실험 과정 중에 외부에서 가해 메티오닌이없는 작은 변화를 보여 (그림 3B). 대조적으로, 전체 셀 Mup1-pHluorin 강도가 급격히 메티오닌의 존재하에 감소 등 fluorescenc 50 % 감소하는즉 강도가 대략 20 내지 25 분 후에 관찰되었으며, 80 % 환원 후 약 40 분 (20)이 관찰되었다. Mup1-GFP 세포는 메티오닌의 첨가시의 형광 강도의 감소를 보였다; 그러나, 형광 손실의 역학 강도가 50 % 감소는 단지 40 분 후에 관찰되었다되도록 Mup1-pHluorin들에 비해 지연되었다. 도 3a에 도시 된 바와 같이, GFP-Mup1 영구 액포의 GFP 형광은 세포 표면에서 세포 내 이입 이벤트의 정확한 정량을 방지되었음을 나타내는 이때 세포막에서 거의 검출되었다.
조절 된 세포 내 이입화물, Mup1를 사용하여 엔드 포인트 분석
전술 한 바와 같이 세포 내 이입의 양적 분석 운동 외에도 예 Mup1로 규제 이입화물도 정량화 유사한 종점 분석법에 사용할 수있는의 정상 상태 STE3 - pHluorin 강도. 이를 위해 Mup1-pHluorin 내재화의 정량 분석은 메티오닌 (8, 18)을 첨가 한 후 30 분 또는 직전에 묘화 세포 집단의 평균 형광 강도의 비교를 위하여 변형 하였다. 이 방법은 WT 및 세포 내 이입 돌연변이 세포 사이에 내면화 Mup1의 비율의 비교를 할 수 있습니다.
운동 분석 결과와 일치 (도 3)에서, Mup1-pHluorin 신속 Mup1-pHluorin의 약 60 %의 메티오닌을 첨가 한 후 30 분 내재화가되도록 WT 세포 (도 4a)에서 원형질막 (120408시켰다 그림 4B). 예상대로 국제화가 크게 엔도 시토 시스에 심각한 결함과 일치 4Δ + ENTH1 세포 감소하는 동안, Mup1 - pHluorin의 국제화는 4 + ENT1 세포에서 유사 효율적이었다. 높은 복사 식ROM1 또는 구체적 모두 CME를 통해 Mup1의 국제화에 필요한 α-아레스 LDB19 및 CIE의 4Δ + ENTH1 셀 (18)의 엔도 시토 시스를 촉진 할 수있는 능력과 일치 Mup1-pHluorin의 13,18 개선 국제화를, 경로. 4Δ + ENTH1 세포에서 정상 상태 STE3 - pHluorin 강도 높은 복사 ROM1을 표현하거나 LDB19이 WT 또는 4Δ + ENT1 세포를 구별 있었지만 특히, Mup1 - pHluorin의 국제화는 부분적으로 만 높은 사본을 표현 4Δ + ENTH1 세포에서 개선되었다 ROM1 또는 LDB19 (그림 4C). 따라서, 이들 데이터는 운동 및 / 또는 엔드 포인트 분석 다른화물 유사 정상 상태 분포는 동일한 균주에서 달성 될 수있다하더라도, 어떤화물에 대한 WT 및 변이주 사이 이입 속도의 차이를 밝힐 수있는 것을 나타낸다.
Mup1-PHL의 인구 기반 분석내재화 uorin 유동 세포 계측법을 사용하여
현미경화물 내재화를위한 운동과 종점 분석법을 수행하는 대안을 제공 할 수있는 유동 세포 계측법을 사용하여 세포의 큰 개체군의 높은 처리량 분석. 이를 위해 Mup1-pHluorin의 형광 강도 ( "밝은"이어야 WT -Met) 메티오닌의 부재 하에서 성장 된 배양에서 45 분 동안 메티오닌의 존재 (WT + 메트에서 WT 세포와 비교하여, 어떤 수도 3B에서 보이는 형광 강도의 80 % 감소)에 기초한 처리되지 않은 세포에 비해 "어둡게"한다. 계측법 수직 게이트 셀 ~ 5 %, 게이트의 오른쪽에 함유 인구 (도 5a 및도 5b에서 가장 밝은 셀에 대응 한 WT + 메트 조건에 적용 하였다 흐름에 의해 분석 한 후 빨강, 인구). 동일한 게이트 걸면WT는 -Met 상태로, 세포의 약 65 %는 유동 세포 계측법 용이 전에 메티오닌을 첨가 한 후 세포의 집단 사이 Mup1-pHluorin 형광 강도의 차이를 관찰하는데 사용될 수 보여주는 밝은 카테고리에 빠졌다. 반대로, 어두운 세포에 비해 밝은 분포 결함 이입과 부합하는 WT + 메트 인구인가 같은 게이트를 사용 4Δ + ENTH1 -Met 및 + 메트 조건 구별 하였다. 따라서, 세포 내 이입 능력의 변화를 검출 할 수있는 유세포 분석기, 세포의 큰 개체군의 신속한 분석을 허용한다. 중요한 것은, 세포 계측법 또한 정렬 및 결함 엔도 시토 시스와 돌연변이 세포의 선택을위한 도구로 유전 화면에서 사용할 수있는 흐름 (K. Wrasman와 B Wendland, 준비 원고) 33.
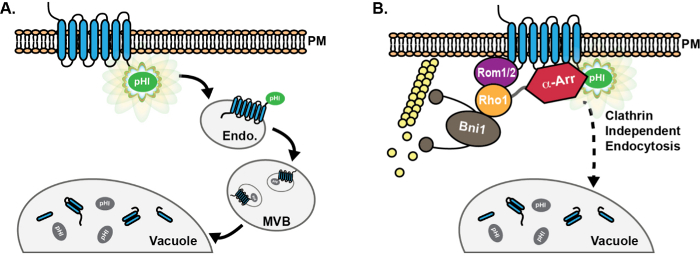
그림 1 : 은 세포 내 이입 경로를 통해 pHluorin 태그가화물 진행의 도식. (A)는 pHluorin (PHL)의 키메라 융합 플라즈마 막에서화물의 검출 형광 (녹색)의 세포 내 이입화물 단백질 결과의 세포질 꼬리에 태그 (PM ). 엔도 시토 시스 후에,화물 단백질은 pHluorin 태그 세포질에 노출되므로 형광 유지 초기 엔도 좀 (엔도)로 전달된다. 그 후, ESCRT 기계는 multivesicular 바디 (MVB)의 내강 소포로화물 분류 및 혼합을 촉진합니다. MVBs는 열화 단백질, 막 성분을 제공하는 액포와 융합. MVBs에 통합하면, pHluorin 태그는 산성화로 인해 (회색) 급냉된다. pHluorin 태그가화물의 (B) 사용은 효모에서 클라 독립적 인 세포 내 이입 (CIE) 경로에 관여하는 단백질의 발견과 특성화를 촉진했다. 결함이있는 클라 매개 endocytos와 세포에서고 복사 상기는 GTPase Rho1의 발현뿐만 아니라 그 활성화 GEF ROM1이다는 CIE 8 통해화물 내재화를 촉진한다. 단백질의 α-아레스 가족 (α-도착지가) CME 13-17를 통해화물 유비퀴틴 화 및 국제화를 촉진하는 역할을 공지했지만 또한, CIE에서 α-arrestins의 역할은 최근에 의한 CIE 단백질보다는과의 상호 작용에, 가능성이 확인되었다 유비퀴틴 모집 18 리가 통해. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
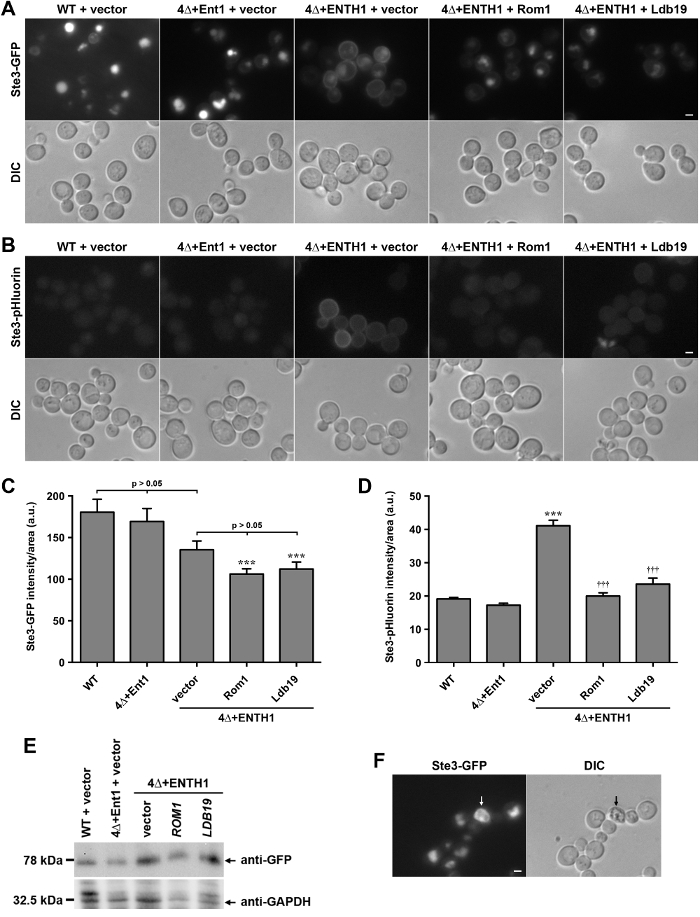
그림 2 :. 야생형 및 세포 내 이입 돌연변이 세포에서 STE3-GFP 및 STE3-pHluorin의 현지화 및 정량화 (A) WT, 4Δ + ENT1 및 4Δ + ENTH1 세포는 genomically STE3-G 코드를 발현FP 및 형광 현미경 (맨 윗줄) 또는 DIC (하단 행)에 의해 가시화 된 바와 같이 벡터, 높은 복사 ROM1 또는 높은 복사 LDB19로 형질 전환. STE3-GFP 이미지는 STE3 지역화 직접 비교할 수 있도록 동일한 최대 및 최소 세기로 조정 하였다. genomically 인코딩 STE3-pHluorin을 표현하는 (B) WT, 4Δ + ENT1 및 4Δ + ENTH1 세포 변형 및 패널 (A)에 설명 된대로 몇 군데 있었다. 스케일 바 = 2 μm의. (C, D) STE3-GFP (C) 및 STE3-pHluorin (D)에 대한 형광 강도의 정량화가 각각의 조건에 대해 패널 (A)와 (B)에 사용되는 균주 전체 셀 형광 40 셀 최소 정량 하였다. 값은 셀 크기에 대한 수정 및 SEM ± 평균로 임의 단위 (AU)으로 표현 하였다 (*** p <0.001 WT에 비해, ††† p <0.001 4Δ + ENTH1 + 벡터에 비해). (E) 상대 금지나타낸 바와 같이 WT, 4Δ + ENT1 및 4Δ + ENTH1 세포에서 평가 STE3-GFP의 E 발현 벡터, 고 복사 ROM1 또는 고 복사 LDB19 형질. 앞서 설명한 바와 같이 20 세포 추출물을 제조하고, 각 샘플의 동량을 SDS-PAGE에 의해 해결되었다. STE3-GFP 발현 항 GFP 항체로 면역 블에 의해 평가하고, 단백질 로딩 방지 GAPDH를 사용하여 평가 하였다. (F) STE3-GFP는 화살표에 의해 지시 된 죽은 세포와 형광 현미경 (STE3-GFP 패널) 및 DIC 광학 볼 genomically 인코딩 표현 야생형 세포. 죽은 세포는 GFP 필터에 autofluorescent을 표시하고, DIC 볼 때 어두운이다. 스케일 바 = 2 μm의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3 :. Mup1-GFP 및 Mup1-pHluorin 국제화의 운동 분석 (A) 야생 형 세포는 genomically에서 중반 로그 단계로 성장시켰다 Mup1-GFP (상단 두 개의 패널) 또는 Mup1-pHluorin (아래 두 패널) 코드를 발현 원형질막에 Mup1 발현 및 유지를 유도하는 메티오닌 결여 YNB 배지. (- 메트로) 또는 존재 (+ 메트로) 20 μg의 / ㎖ 메티오닌의 세포는 형광 현미경에 의해 부재에서 매 5 분 군데 있었다. 조건 내의 각 시점의 경우, 동일한 최대 및 최소 세기 값은 형광 강도 및 지역화의 비교를 적용 하였다. 모든 조건에 대해 나타낸 바와 같이, 0, 5, 10, 20 및 40 분의 시점을 나타낸다. 스케일 바 = 2 μm의. 패널 (A)로부터 야생형 세포 Mup1-GFP의 (B) 정량 Mup1-pHluorin 내재화. 또는 Mup1 - pHluo - (+ 메트로, 블루 다이아몬드 메트로, 보라색 사각형) Mup1-GFP의 전체 세포의 형광 강도린 (- 만난 녹색 삼각형] + 만난 적색 원)는 5 분 간격으로 묘화 각 셀에 대해 측정하고, 초기의 형광 강도의 비율로 나타내었다 (± SEM 평균, N = 조건 당 106 세포). 프로 서 등의 알에서 재판. 발행인의 허가와 함께 (2010) 20. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
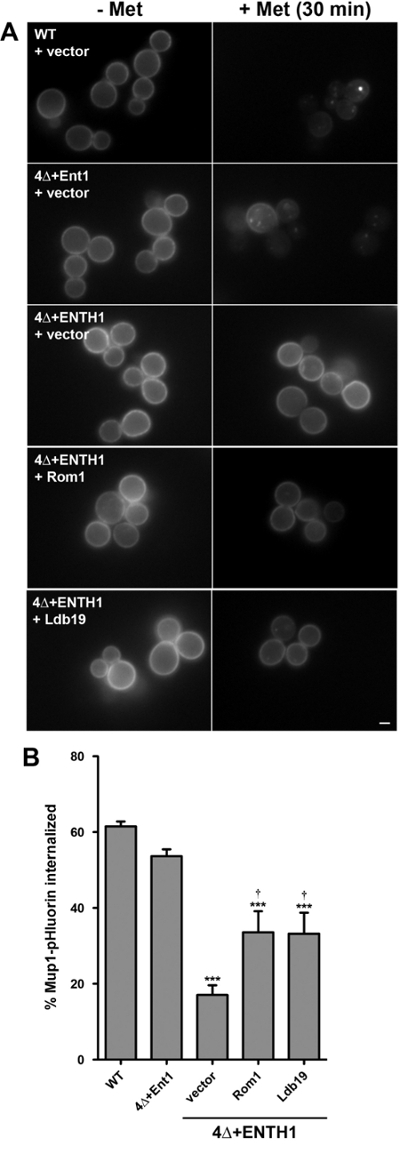
그림 4 :. Mup1-pHluorin의 국제화의 엔드 포인트 분석 (A) WT, 4Δ + ENT1 및 4Δ + ENTH1 세포는 genomically Mup1-pHluorin을 인코딩 중간에 성장 된 바와 같이 벡터, 높은 복사 ROM1 또는 높은 복사 LDB19로 형질을 발현 YNB 매체 부족한 메티오닌에서 -logarithmic 단계입니다. 세포의 랜덤 필드 fluorescenc에 의해 촬영되었다 (- 메트로) 전자 직전 현미경 또는 20 μg의 / ㎖ 메티오닌 (+ 메트로) 첨가 후 30 분. 모든 이미지는 동일한 최대 및 최소 세기 값으로 조정 하였다. 스케일 바 = 2 μm의. 패널 (A)에서 세포 Mup1-pHluorin의 국제화의 (B) 정량. 각 조건에 대해, 전체 셀 형광 강도는 셀 (40)의 최소 측정하고, 셀 크기에 대해 보정. 내재화 Mup1-pHluorin의 비율은 이전에 메티오닌 30 분 처리 후의 강도 값을 비교하여 평균을 산출 하였다. (; *** p <0.001 WT에 비해 4 N = 4Δ + ENTH1 + 벡터에 비해 †의 P <0.05) 값은 SEM ± 평균으로 표시됩니다. 이 수치는 프로 서 등의 알에서 수정되었습니다. 발행인의 허가와 함께 (2015) 18. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
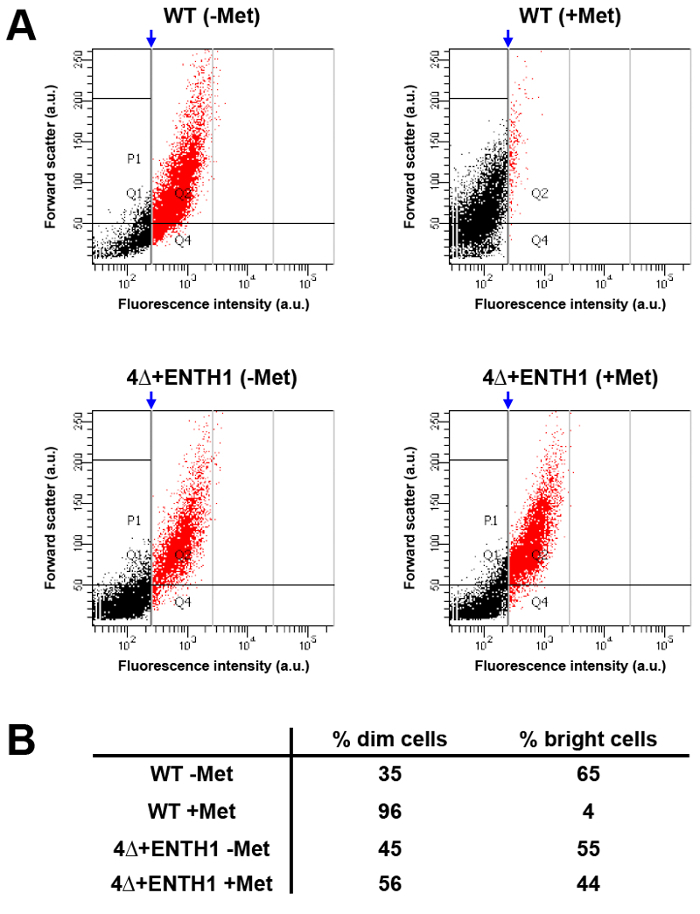
그림 5 :. 유동 세포 계측법에 의해 Mup1-pHuorin의 국제화의 인구 분석 (A) WT 및 4Δ + ENTH1 세포를 메티오닌이 부족 YNB 배지에서 중반 로그 단계로 성장시켰다. 유세포 분석 전에 45 분 동안 20 μg의 / ㎖의 메티오닌 또는 존재 (+ 메트) - (메트) 세포는 부재하에 배양 하였다. 각 조건을 위해, (임의 단위), 금 (Au)에 전방 산란 측정 만의 전체 셀 중에서 1,000 셀 (a FITC 필터를 사용하여), 금 (Au) 형광 강도에 대해 도시 하였다. 인구 상기 (적색 도시) 밝은 세포의 약 5 %, 게이트의 우측에 떨어진 WT + 메트 조건에 수직 게이트 (청색 화살표)을 적용하여 분석 하였다. WT는 + 메트 조건에 대해 생성 된 게이트는 비교를 위해 나머지 조건에 도포샘플 분포. (B) WT 및 4Δ + ENTH1 대 (게이트 오른쪽 빨간 점) (게이트의 좌측에 검은 점) 희미 세포 밝은 세포의 비율 요약 패널 (A)에 도시 만난 재판 ±. 주세요 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 변형 | 유전자형 | 출처 |
| SEY6210 a를 | 매트 α의 HIS3 - Δ200 TRP1 - Δ901 leu2-3,112 ura3-52 lys2-801 suc2-Δ9 | 실험실 플라스미드 |
| BWY2858 | STE3-GFP :: KANMX6 | 프로 서 등. (2010 년) (16) |
| BWY2995 | STE3-pHluorin :: KANMX6 | 피rosser 등. (2010 년) (16) |
| BWY3036 | ent1Δ ::는 Leu2 ent2Δ :: HIS3 yap1801Δ :: HIS3 yap1802Δ ::는 Leu2 STE3-pHluorin :: KANMX6 + pEnt1 [CEN TRP1] | 프로 서 등. (2010 년) (16) |
| BWY3037 | ent1Δ ::는 Leu2 ent2Δ :: HIS3 yap1801Δ :: HIS3 yap1802Δ ::는 Leu2 STE3-pHluorin :: KANMX6 + pENTH1 [CEN TRP1] | 프로 서 등. (2010 년) (16) |
| BWY3399 | ent1Δ ::는 Leu2 ent2Δ :: HIS3 yap1801Δ :: HIS3 yap1802Δ ::는 Leu2 STE3-GFP :: KANMX6 + pEnt1 [CEN TRP1] | 프로 서 등. (2010 년) (16) |
| BWY3400 | ent1Δ ::는 Leu2 ent2Δ :: HIS3 yap1801Δ :: HIS3 yap1802Δ ::는 Leu2 STE3-GFP :: KANMX6 + pEnt1 [CEN TRP1] | 프로 서 등. (2010 년) (16) |
| BWY3817 | MUP1-GFP :: KANMX6 | 홍보osser 등. (2010 년) (16) |
| BWY3818 | MUP1-pHluorin :: KANMX6 | 프로 서 등. (2010 년) (16) |
| BWY4153 | ent1Δ ::는 Leu2 ent2Δ :: HIS3 yap1801Δ :: HIS3 yap1802Δ ::는 Leu2 MUP1-pHluorin :: KANMX6 + pEnt1 [CEN TRP1] | 프로 서 등. (2011) 7 |
| BWY4154 | ent1Δ ::는 Leu2 ent2Δ :: HIS3 yap1801Δ :: HIS3 yap1802Δ ::는 Leu2 MUP1-pHluorin :: KANMX6 + pENTH1 [CEN TRP1] | 프로 서 등. (2011) 7 |
| A 본 연구에 사용 된 모든 균주가 표시된 궤적을 제외하고 SEY6210에 동종이다. | ||
표 1 : 본 연구에 사용 된 효모 균주.
| 플라스미드 | 기술 | 출처 |
| pRS426 | 2μ URA3 | 시코 르 스키와 Hieter 1989 |
| pBW0768 | pRS414 :: ENT1 [CEN TRP1] | pEnt1, 실험실 플라스미드 |
| pBW0778 | pRS414 :: ENT1 (aa1-151) CEN TRP1] | pENTH1, 실험실 플라스미드 |
| pBW1571 | pFA6a-pHluorin - KANMX6 | 프로 서 등. (2010 년) (16) |
| pBW2053 | YEp24 :: ROM1 [2μ의 URA3] | pROM1 (프로 서 등의 알., 2011) (7) |
| pRS426-Ldb19 | LDB19prom-LDB19 [2μ의 URA3] | 프로 서 등. (2015) 15 |
| pFA6a-GFP (S65T) -kanMX6 | 효모에서 GFP 태그에 대한 pFA6a-GFP-KANMX6, PCR 기반의 통합 플라스미드 | Longtine등. (1998) (21) |
표 2 : 본 연구에 사용 된 플라스미드.
| 시간 (분) | 행위) |
| -5 | 이미지 샘플 1 (-Met) |
| 0 | 1 샘플 메티오닌 추가 |
| 이미지 샘플 2 (-Met) | |
| (5) | 2 샘플 메티오닌 추가 |
| 이미지 샘플 3 (-Met) | |
| (10) | 3 샘플 메티오닌 추가 |
| 이미지 샘플 4 (-Met) | |
| (15) | 4 샘플 메티오닌 추가 |
| 이미지 샘플 5 (-Met) | |
| (20) | 더하다5 맛볼 수 메티오닌 |
| 이미지 샘플 6 (-Met) | |
| (25) | 6 샘플 메티오닌 추가 |
| 이미지 샘플 7 (-Met) | |
| (30) | 7 샘플 메티오닌 추가 |
| 이미지 샘플 8 (-Met) | |
| 이미지 샘플 1 (+ 메트로) | |
| (35) | 8 샘플 메티오닌 추가 |
| 이미지 샘플 2 (+ 메트로) | |
| (40) | 이미지 샘플 3 (+ 메트로) |
| (45) | 이미지 샘플 4 (+ 메트로) |
| (50) | 이미지 샘플 5 (+ 메트로) |
| (55) | 이미지 샘플 6 (+ 메트로) |
| (60) | 이미지 샘플 7 (+ 메트로) |
| (65) | 이미지 샘플 8 (+ 메트로) |
표 3: 엄청난 8 Mup1-pHluorin 엔드 포인트 분석의 예 워크 플로우.
토론
효모 세포에서의 세포 내 이입 이벤트 정량 pHluorin의 적용은 태그 형광 단백질 (도 1a)의 세포질 테일에 융합 된 트랜스화물을 사용한다. pHluorin 태그가 중립적 인 환경에 노출되지는 않지만 pHluorin 태그가 산성 조건을 발견 한 경우 급냉 될 때 여기에 설명 된 분석의 경우,화물 밝은 형광이다. 따라서, 태그가 이입 pHluorin화물 용이 세포막의 세포질 표면에 초기 엔도 좀에서 검출되지만 내강 MVB 소체로 액포 또는 루멘의 배송에 혼입 될 때 "어둡게"된다. 일반적으로, 새로 합성 된 세포 내 이입화물 가능성 소포체 (ER)을 남겨 GFP 및 그의 변이체의 대부분은 충분히 성숙되기 전에 세포막에 도달; 따라서, ER 또는 골지 종료가 나는 경우를 제외하고 탐지 남아 아직 예측 세포 표면에 도달하지 않은화물을 pHluorin는-태그mpaired.
이러한 STE3 및 Mup1 같은 pHluorin 태그가 세포 내 이입화물의 사용은 효모 CIE 경로 (그림 1B) (8, 18)에 관여하는 단백질의 숫자의 특성화를 촉진했다. 특히,이 논문에 기술 된 방법의 생산 증가를 입증하는 데 사용 된 굴지 변조 CME 8 결함 효모 돌연변이 체의 다양한는 GTPase Rho1와 GEF ROM1 홍보 엔도 시토 시스를. 또한, pHluorin 태그가화물은 최근 양적, CME 13-15,34-36에서 역할을 잘 설립하는 α-arrestins을 보여 CME와 CIE 모두화물 선택적 역할을하는 데 사용하고, 기계적으로 고유 한 기능을 가지고 있었다 두 경로 십팔인치
이 문서에 설명 된 프로토콜에 대한 몇 가지 중요한 요소는 일관성, 정량적 결과를 얻기 위해 고려되어야한다. 첫째, Mup1-GFP 또는 Mup1-pHluorin 표현과 fluores효모 세포가 접근 또는 고정 성장 단계 (게시되지 않은 결과)를 입력으로 cence이 저하 될 수 있습니다; 따라서, 하룻밤 문화에서 자란 세포를 희석되어야하고 (단계 3.1-3.2 및 6.1-6.2 참조) 추가로 3 시간 동안 재 - 성장. 종점 분석법 또는 유세포 분석을 위해 여러 실험 조건 또는 균주 엇갈리게 때, 이는 각각의 상태 사이의 비교를 허용하기 위해 메티오닌 처리 동일한 기간 이후의 모든 샘플에 대한 데이터를 수집하는 것이 중요하다. 8 비트의 포맷으로 변환 형광 강도 값에 영향을 미칠 수있는 데이터 손실의 원인 때문에 취득 이후 분석을 위해 정량은 16 비트의 이미지를 사용하여 수행되어야한다. 백그라운드 신호는 크게 샘플 사이의 강도 차이를 흡장 할 수 있기 때문에, 또한, 배경 차감은 정량화한다 (단계 5.3)에 앞서 수행되어야한다.
pHluorin 태그가있는 반면 STE3 및 Mup1은 정량 의무가 없습니다 입증모든화물은 pHluorin 태그에 적합 할 것이다. 이 탠덤 pHluorin 태그를 향상시킬 수있는 가능성이 있지만, 예를 들어, 아마도 때문에 STE3 또는 Mup1 (게시되지 않은 결과)에 비해 STE2 - pHluorin 낮은 형광 강도에 일관성 정량적 결과를 산출 한 α-인자 수용체 STE2에 태그를 시도 신호 강도. 또한, 리간드에 의한 세포 내 이입의 매우 느린 속도로화물은 국제화의 하프 타임이 효모 세포주기 (약 90 분) 이상이며, 특히 pHluorin는 정량 태그에 순종하지 않을 수 있습니다. 이러한화물의 경우, 형광의 감소는 세포 내 이입에서 및 / 또는 분할하는 동안 어머니와 딸 세포 사이의화물의 파티션에서 발생할 수 있습니다. 따라서, 관심의 개별화물을 테스트하는 자신의 표현과 반응 속도가 pHluorin 태그 및 정량에 적합 여부를 확인하기 위해 권장합니다.
PHL를 사용하여 최근의 연구 있지만uorin는 세포막에서 세포 내 이입 이벤트에 주로 초점을 맞추고있다, pHluorin 태그가화물은 세포 내 이입 경로에 이상 인신 매매 사건을 연구하는 데 사용할 수 있습니다. pHluorin 태그 MVB 소체 내강 (20) 내로 혼입에 급냉되기 때문에 예를 들어, Mup1-pHluorin 성공적 흐름 MVBs 37으로 정렬 ESCRT 매개화물 계측법 기반 분석법을 이용되었다. 이 접근법은 루시페린 (38, 39)의 존재 하에서 생체 발광 신호를 생성하는 세포질 루시퍼 태그화물 이용한다 관내 증착 (LUCID) 분석의 최근 기술 된 루시퍼 라제 리포터와 유사하다. MVB 내강 소포로 혼입시 pHluorin 형광 소광 마찬가지로, LUCID 분석에서 생물 발광은 MVB 소체로 루시퍼 태그의 혼입에 감쇠된다. pHluorin와 LUCID 분석은 개념적으로 유사하지만, pHluorin 태그가화물은 엔도 시토 시스와 MVB 성숙을 연구하는 데 사용할 수있는 전n은 그대로 세포.
다른 방법은 엔도 시토 시스의 정량화를 위해 존재하고, 야생형 및 세포 내 이입 돌연변이 세포에서화물 국제화의 속도에 가치있는 정보를 제공하고 있습니다. 예를 들면 다음과 같은 STE3로 40, 41, 또는 세포 내 이입화물에 대한 분해 속도를 모니터링합니다 (퍼 미아 Fur4에 의해 내면화한다) 및 우라실 (페로몬 수용체 STE2 결합) α-요소로 방사성 리간드의 모니터링 흡수를 포함 그들은 내면화하고 공포 (42)로 이송된다. 이 생화학 적 접근법은 세포 용해를 필요로하고, 따라서 살아있는 세포에 직접 정량화에 적합하지 않다. 대안 적으로, 형광 α 인자, 유체 상 염료 루시퍼 옐로우 또는 FM4-64 살아있는 세포 내 이입을 가시화하는 데 사용될 수있는 스티 릴 색소 표지 있지만 내생 발현화물 단백질 40,43,44 직접 모니터링을 허용하지 않는다. 버지니아에서 형광의 이러한 접근, 지속성GFP와 본 cuole 루멘은 정량을 복잡하게 할 수있다. 이는 전체 셀 형광 강도를 측정하여 세포질과 엔도 좀 / 액포 격실로부터의 신호를 감산하여 세포 내 이입의 정량 GFP 표지 된화물을 사용하는 것이 가능하다; 그러나, 엔도 좀과 공포는 세포막에 근접 종종 있습니다. 반면, pHluorin 태그가 세포 내 이입화물은 더 널리 사용 GFP 태그에 비해 인신 매매 사건의 정량 뚜렷한 장점이 될 수 MVB / 공포 구획, 급냉된다. 우리의 미래 연구는 CME와 CIE에 기여하는 추가 요인을 파악하고,화물 분류 결정을 조절하는 메커니즘을 이해하는 효모의 세포 내 이입 경로 및화물 분류의 현재의 지식에 확장됩니다.
공개
The authors declare no competing interests.
감사의 말
We would like to thank Gero Miesenböck and Tim Ryan for sharing pHluorin cDNA used to generate reagents in this study, Nathan Wright, Joanna Poprawski and Lydia Nyasae for excellent technical assistance, members of the Wendland lab for helpful discussions, and Michael McCaffery and Erin Pryce at the Integrated Imaging Center (Johns Hopkins) for advice and assistance with microscopy and flow cytometry. This work was supported by grants from the National Institutes of Health (to B.W., GM60979) and the National Science Foundation (to B.W., MCB 1024818). K.W. was supported in part by a training grant from the National Institutes of Health (T32-GM007231). A.F.O. was supported by developmental funds from the Department of Biological Sciences at Duquesne University and National Science Foundation CAREER grant 553143.
자료
| Name | Company | Catalog Number | Comments |
| Adenine | Sigma | A8626-25G | Use for preparation of amino acid mixture and stock solution |
| Bacto-agar | Fisher | BP1423-2 | Use for preparation of plate media |
| BD Difco Yeast Nitrogen Base (without amino acids) | BD | 291920 | Use for preparation of liquid and plate media |
| Concanavalin A | Sigma | C5275-5MG | Use for coating of chamber slides |
| Dextrose | Fisher | BP350-1 | Use for preparation of liquid and plate media |
| L-Histidine | Fisher | BP382-100 | Use for preparation of amino acid mixture and stock solution |
| L-Leucine | Acros | 125121000 | Use for preparation of amino acid mixture and stock solution |
| L-Lysine | Fisher | BP386-100 | Use for preparation of amino acid mixture and stock solution |
| L-Methionine | Fisher | BP388-100 | Use for preparation of amino acid mixture and stock solution |
| L-Tryptophan | Fisher | BP395-100 | Use for preparation of amino acid mixture and stock solution |
| L-Tyrosine | Acros | 140641000 | Use for preparation of amino acid mixture |
| Nunc Lab-Tek Chambered Coverglass (8-well) | Thermo Scientific | 155411 | Use for kinetic and endpoint assays of Mup1-pHluorin internalization |
| Uracil | Sigma | U0750-100G | Use for preparation of amino acid mixture and stock solution |
| Axiovert 200 inverted microscope | Carl Zeiss | Custom Build | |
| 100X/1.4 Plan-Apochromat Oil Immersion Objective Lens | Carl Zeiss | Objective should be 100X, 1.4NA or higher | |
| Sensicam | Cooke Corporation | Camera should have 12-bit or higher dynamic range | |
| X-Cite 120PC Q Illumination Source | Excelitas Technologies | ||
| Slidebook 5 software | Intelligent Imaging Innovations | ||
| ImageJ software | National Institutes of Health | http://imagej.nih.gov/ij/ |
참고문헌
- Kaksonen, M., Sun, Y., Drubin, D. G. A pathway for association of receptors, adaptors, and actin during endocytic internalization. Cell. 115 (4), 475-487 (2003).
- Kaksonen, M., Toret, C. P., Drubin, D. G. A modular design for the clathrin- and actin-mediated endocytosis machinery. Cell. 123 (2), 305-320 (2005).
- Boettner, D. R., Chi, R. J., Lemmon, S. K. Lessons from yeast for clathrin-mediated endocytosis. Nat Cell Biol. 14 (1), 2-10 (2012).
- Taylor, M. J., Perrais, D., Merrifield, C. J. A High Precision Survey of the Molecular Dynamics of Mammalian Clathrin-Mediated Endocytosis. PLoS Biol. 9 (3), e1000604 (2011).
- Hansen, C. G., Nichols, B. J. Molecular mechanisms of clathrin-independent endocytosis. J Cell Sci. 122 (11), 1713-1721 (2009).
- Sabharanjak, S., Sharma, P., Parton, R. G., Mayor, S. GPI-anchored proteins are delivered to recycling endosomes via a distinct cdc42-regulated, clathrin-independent pinocytic pathway. Dev Cell. 2 (4), 411-423 (2002).
- Radhakrishna, H., Klausner, R. D., Donaldson, J. G. Aluminum fluoride stimulates surface protrusions in cells overexpressing the ARF6 GTPase. J Cell Biol. 134 (4), 935-947 (1996).
- Prosser, D. C., Drivas, T. G., Maldonado-Báez, L., Wendland, B. Existence of a novel clathrin-independent endocytic pathway in yeast that depends on Rho1 and formin. J Cell Biol. 195 (4), 657-671 (2011).
- Prosser, D. C., Wendland, B. Conserved roles for yeast Rho1 and mammalian RhoA GTPases in clathrin-independent endocytosis. Small GTPases. 3 (4), 229-235 (2012).
- Kohno, H., et al. Bni1p implicated in cytoskeletal control is a putative target of Rho1p small GTP binding protein in Saccharomyces cerevisiae. EMBO J. 15 (22), 6060-6068 (1996).
- Evangelista, M., et al. a Yeast Formin Linking Cdc42p and the Actin Cytoskeleton During Polarized Morphogenesis. Science. 276 (5309), 118-122 (1997).
- Kübler, E., Riezman, H. Actin and fimbrin are required for the internalization step of endocytosis in yeast. EMBO J. 12 (7), 2855-2862 (1993).
- Lin, C. H., MacGurn, J. A., Chu, T., Stefan, C. J., Emr, S. D. Arrestin-Related Ubiquitin-Ligase Adaptors Regulate Endocytosis and Protein Turnover at the Cell Surface. Cell. 135 (4), 714-725 (2008).
- Nikko, E., Sullivan, J. A., Pelham, H. R. B. Arrestin-like proteins mediate ubiquitination and endocytosis of the yeast metal transporter Smf1. EMBO Rep. 9 (12), 1216-1221 (2008).
- Nikko, E., Pelham, H. R. B. Arrestin-Mediated Endocytosis of Yeast Plasma Membrane Transporters. Traffic. 10 (12), 1856-1867 (2009).
- O'Donnell, A. F., McCartney, R. R., Chandrashekarappa, D. G., Zhang, B. B., Thorner, J., Schmidt, M. C. 2-Deoxyglucose impairs Saccharomyces cerevisiae growth by stimulating Snf1-regulated and α-arrestin-mediated trafficking of hexose transporters 1 and 3. Mol Cell Biol. 35 (6), 939-955 (2015).
- O'Donnell, A. F., Huang, L., Thorner, J., Cyert, M. S. A calcineurin-dependent switch controls the trafficking function of α-arrestin Aly1/Art6. J Biol Chem. 288 (33), 24063-24080 (2013).
- Prosser, D. C., Pannunzio, A. E., Brodsky, J. L., Thorner, J., Wendland, B., O'Donnell, A. F. α-Arrestins participate in cargo selection for both clathrin-independent and clathrin-mediated endocytosis. J Cell Sci. 128 (22), 4220-4234 (2015).
- Lamaze, C., Dujeancourt, A., Baba, T., Lo, C. G., Benmerah, A., Dautry-Varsat, A. Interleukin 2 receptors and detergent-resistant membrane domains define a clathrin-independent endocytic pathway. Mol Cell. 7 (3), 661-671 (2001).
- Prosser, D. C., Whitworth, K., Wendland, B. Quantitative analysis of endocytosis with cytoplasmic pHluorin chimeras. Traffic. 11 (9), 1141-1150 (2010).
- Bokman, S. H., Ward, W. W. Renaturation of green-fluorescent protein. Biochem Biophys Res Commun. 101 (4), 1372-1380 (1981).
- Miesenböck, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Sankaranarayanan, S., De Angelis, D., Rothman, J. E., Ryan, T. A. The Use of pHluorins for Optical Measurements of Presynaptic Activity. Biophys J. 79 (4), 2199-2208 (2000).
- Katzmann, D. J., Babst, M., Emr, S. D. Ubiquitin-dependent sorting into the multivesicular body pathway requires the function of a conserved endosomal protein sorting complex. ESCRT-I. Cell. 106 (2), 145-155 (2001).
- Longtine, M. S., et al. Additional modules for versatile and economical PCR-based gene deletion and modification in Saccharomyces cerevisiae. Yeast. 14 (10), 953-961 (1998).
- Goldstein, A. L., McCusker, J. H. Three new dominant drug resistance cassettes for gene disruption in Saccharomyces cerevisiae. Yeast. 15 (14), 1541-1553 (1999).
- Ausubel, F. M. . Curr Prot Mol Biol. , (1991).
- Urbanowski, J. L., Piper, R. C. Ubiquitin sorts proteins into the intralumenal degradative compartment of the late-endosome/vacuole. Traffic. 2 (9), 622-630 (2001).
- Newpher, T. M., Smith, R. P., Lemmon, V., Lemmon, S. K. In Vivo Dynamics of Clathrin and Its Adaptor-Dependent Recruitment to the Actin-Based Endocytic Machinery in Yeast. Dev Cell. 9 (1), 87-98 (2005).
- Maldonado-Báez, L., Dores, M. R., Perkins, E. M., Drivas, T. G., Hicke, L., Wendland, B. Interaction between Epsin/Yap180 adaptors and the scaffolds Ede1/Pan1 is required for endocytosis. Mol Biol Cell. 19 (7), 2936-2948 (2008).
- Aguilar, R. C., et al. Epsin N-terminal homology domains perform an essential function regulating Cdc42 through binding Cdc42 GTPase-activating proteins. Proc Natl Acad Sci U.S.A. 103 (11), 4116-4121 (2006).
- Isnard, A. D., Thomas, D., Surdin-Kerjan, Y. The study of methionine uptake in Saccharomyces cerevisiae reveals a new family of amino acid permeases. J Mol Biol. 262 (4), 473-484 (1996).
- Wendland, B., McCaffery, J. M., Xiao, Q., Emr, S. D. A novel fluorescence-activated cell sorter-based screen for yeast endocytosis mutants identifies a yeast homologue of mammalian eps15. J Cell Biol. 135 (6), 1485-1500 (1996).
- Alvaro, C. G., et al. Specific Alpha-Arrestins Negatively Regulate Saccharomyces cerevisiae Pheromone Response by Down-Modulating the G-Protein-Coupled Receptor Ste2. Mol Cell Biol. 34 (14), 2660-2681 (2014).
- Ghaddar, K., Merhi, A., Saliba, E., Krammer, E. M., Prevost, M., Andre, B. Substrate-Induced Ubiquitylation and Endocytosis of Yeast Amino Acid Permeases. Mol Cell Biol. 34 (24), 4447-4463 (2014).
- Becuwe, M., Léon, S. Integrated control of transporter endocytosis and recycling by the arrestin-related protein Rod1 and the ubiquitin ligase Rsp5. eLife. 3, (2014).
- Henne, W. M., Buchkovich, N. J., Zhao, Y., Emr, S. D. The Endosomal Sorting Complex ESCRT-II Mediates the Assembly and Architecture of ESCRT-III Helices. Cell. 151 (2), 356-371 (2012).
- Nickerson, D. P., Russell, M. R. G., Lo, S. -. Y., Chapin, H. C., Milnes, J. M., Merz, A. J. Termination of Isoform-Selective Vps21/Rab5 Signaling at Endolysosomal Organelles by Msb3/Gyp3. Traffic. 13 (10), 1411-1428 (2012).
- Nickerson, D. P., Merz, A. J. LUCID: A Quantitative Assay of ESCRT-Mediated Cargo Sorting into Multivesicular Bodies. Traffic. 16 (12), 1318-1329 (2015).
- Dulic, V., Egerton, M., Elguindi, I., Raths, S., Singer, B., Riezman, H. Yeast endocytosis assays. Methods Enzymol. 194, 697-710 (1991).
- Silve, S., Volland, C., Garnier, C., Jund, R., Chevallier, M. R., Haguenauer-Tsapis, R. Membrane insertion of uracil permease, a polytopic yeast plasma membrane protein. Mol Cell Biol. 11 (2), 1114-1124 (1991).
- Miliaras, N. B., Park, J. -. H., Wendland, B. The Function of the Endocytic Scaffold Protein Pan1p Depends on Multiple Domains. Traffic. 5 (12), 963-978 (2004).
- Vida, T. A., Emr, S. D. A new vital stain for visualizing vacuolar membrane dynamics and endocytosis in yeast. J Cell Biol. 128 (5), 779-792 (1995).
- Toshima, J. Y., Toshima, J., Kaksonen, M., Martin, A. C., King, D. S., Drubin, D. G. Spatial dynamics of receptor-mediated endocytic trafficking in budding yeast revealed by using fluorescent alpha-factor derivatives. Proc Natl Acad Sci U.S.A. 103 (15), 5793-5798 (2006).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유