Method Article
Применение pHluorin для количественного, Kinetic и высокой пропускной способностью анализа эндоцитоза у почкующихся дрожжей
В этой статье
Резюме
Accurate quantification of vesicular trafficking events often provides key insights into roles for specific proteins and the effects of mutations. This paper presents methods for using superecliptic pHluorin, a pH-sensitive GFP variant, as a tool for quantification of endocytic events in living cells using quantitative fluorescence microscopy and flow cytometry.
Аннотация
Зеленый флуоресцентный белок (GFP) и его варианты широко используются инструменты для изучения локализации белка и динамики событий, таких как цитоскелета ремоделирования и везикулярного торговли в живых клетках. Количественные методики с использованием химерных GFP слитых были разработаны для многих приложений; однако, GFP несколько устойчив к протеолизу, таким образом, его флуоресценция сохраняется в лизосом / вакуоли, которые могут препятствовать квантификацию торговли грузов в эндоцитотического пути. Альтернативный метод количественной оценки событий торговли людьми эндоцитоза и пост-эндоцитических использует superecliptic pHluorin, рН-чувствительный вариант GFP, который гасится в кислой среде. Химерический слияние pHluorin к цитоплазматическим хвостом трансмембранный грузовых белков приводит в демпфирование флуоресценции при включении груза в мультивезикулярных тел (MVBs) и доставки в лизосомы / вакуоли просвет. Таким образом, тушение флуоресценции вакуолярной облегчает quantifiкатион эндоцитоза и ранних событий в эндоцитотического пути. В данной статье описаны методы, использующие pHluorin-маркированные грузы для количественной оценки эндоцитоза с помощью флуоресцентной микроскопии, а также анализы населения на основе с использованием проточной цитометрии.
Введение
Везикулярный торговля играет важную роль в поддержании идентичности органелл и функцию в эукариотических клетках, и является ключевым механизмом для регулирования белков и мембран состава отдельных клеточных отсеков. На плазматической мембране, слияние exocytic везикул содержит новые белки и мембраны на поверхности клетки, в то время как пузырьки, генерируемые посредством эндоцитоза удалить мембрану и белки с поверхности для последующей переработки или нацеливание в лизосомы. Таким образом, эндоцитоз имеет важное значение для поглощения питательных веществ и для ответов на внеклеточную среду. Экзоцитоз и эндоцитоз сбалансированы регулировать площадь поверхности плазматической мембраны, и обеспечить оборот поврежденных белков.
Исследования, проведенные в дрожжах и клетках млекопитающих выявили большое количество белков, участвующих в эндоцитоза, а также несколько эндоцитических путей, которые способствуют интернализации конкретных грузов или этот акт в ответ на различные анжающей среды условия. Наиболее изученный путь является клатрин-опосредованный эндоцитоз (CME), в котором клатрина и цитозольная вспомогательные белки собираются в структуру покрытия, чтобы стабилизировать зарождающееся эндоцитических пузырек. Эксперименты в почкующихся дрожжей Saccharomyces CEREVISIAE дали глубокие знания о динамике и порядок набора для многих белков эндоцитических 1-3. Следует отметить, что техника СМЕ высоко консервативен в ходе эволюции таким образом, что большинство СМЕ-родственных белков в дрожжах имеют человеческие ортологи; Таким образом, почкующихся дрожжей стала важным инструментом для понимания механизмов эндоцитоза, которые являются консервативными в высших эукариот. Например, исследования с использованием многообещающий дрожжей определяют, что формирование и созревание CME структур (называемых корковых пластырей актина у дрожжей) включает в себя последовательный набор многих белков, начиная с клатрина и грузовыми-связывающим адаптерных белков, а затем набор дополнительного эндоцитотического принадлежности белки,активация Arp2 / 3-опосредованной полимеризации актина, и набор белков , участвующих в пузырек 1,2 разрыва. Набор машинных белков CME кортикальных актиновых заплатки является весьма упорядоченные и стереотипное процесс, и точный порядок набора для многих белков было установлено по отношению к другим компонентам оборудования CME. Важно отметить, что недавние исследования подтвердили , аналогичный порядок набора для CME белков на клатриновых ямах в клетках млекопитающих 4.
В дополнение к КВМ, многие типы клеток , обладающие одной или несколькими клатриновых-независимый эндоцитотический (CIE) пути , которые полагаются на альтернативные механизмы для содействия формированию везикул и интернализации из плазматической мембраны 5-7. У дрожжей, недавно мы определили CIE путь , который использует небольшой GTPase Rho1 и его активации гуанин фактор нуклеотид обмена (ГЭФ), Rom1 8,9. Rho1 активирует Formin Bni1 для содействия актина полимеризации 10,11, который необходим для этой формы клатрин-независимого эндоцитоза у дрожжей 12. Кроме того, α-arrestin семейство белков Набирать убиквитинлигаза Rsp5 для содействия убиквитинирование грузов и последующей интернализации через НМО 13-17, а также содействовать интернализации грузов через МКО пути, возможно , за счет прямого взаимодействия с белками , участвующими в CIE 18. Разнообразие путей CIE существуют также в клетках млекопитающих, в том числе клатриновых независимый и фагоцитирующих путей , которые полагаются на ортолога Rho1, RhoA 9,19. Роль RhoA в CIE млекопитающих изучена слабо; Таким образом, исследования в почкующихся дрожжей может обеспечить дополнительные механистические идеи, которые применимы к CIE млекопитающих.
Точная количественная оценка эндоцитических событий может предоставить важную информацию о роли специфических белков в регуляции эндоцитоза, и может выявить влияние мутаций на грузовом интернализации или Progressioп через эндоцитотического пути. Для этой цели, биохимические методы могут быть использованы для мониторинга поглощения лиганда или для измерения скорости деградации эндоцитических грузовых белков. В живых клетках, слияние зеленого флуоресцентного белка (GFP) и его вариантов для грузов, представляющих интерес позволяет осуществлять прямую визуализацию грузового транспорта. Тем не менее, GFP-меченый грузов, имеют ограниченное применение для количественной оценки эндоцитоза, так как GFP, устойчив к деградации в лизосомах (или вакуоли в дрожжах). Кроме того, GFP флуоресценции только частично чувствительна к изменению рН, и остается обнаружить в течение вакуоли люмена 20,21. Следовательно, флуоресценция GFP тега сохраняется в вакуоль долго после того, как остальная часть груза деградирует, и вся клетка на основе количественной оценки интенсивности груза может быть неточным из-за долговременной GFP флуоресценции в вакуоль.
Для того, чтобы преодолеть недостатки вакуолярная флуоресценции GFP, ранее мы использовали superecliptic рНluorin, рН-чувствительный вариант GFP , который флуоресцирует ярко при нейтральном значении рН, но теряет флуоресценцию в кислой среде , такой как просвет вакуоли / лизосомы 20,22,23. Размещение тега pHluorin на цитоплазматической хвост эндоцитических грузов позволяет визуализировать грузов на плазматической мембране и на ранних эндосом, где метка pHluorin остается открытой в цитоплазму (рис 1А). В ранние эндосомы созревают, эндосомный сортировочный комплекс необходим для транспорта (ESCRT) машины пакеты поверхностно-локализованные грузов в пузырьки , которые BUD в просвет эндосом, генерируя мультивезикулярные тел (MVBs) 24. Для грузов, которые были включены во внутренние MVB везикул, тег pHluorin обращен к везикулы просвет. Внутренние MVB везикулы подкисляют; Таким образом, pHluorin-меченый грузов теряют флуоресценцию на ранних эндосом , поскольку они созревают в MVBs 20. Последующее слияние MVB с вакуоли обеспечивает содержание MVB просветадеградации и pHluorin метки остаются гас в кислой среде вакуоли просвет.
В настоящем документе приводится подробное описание количественных анализов с использованием эндоцитических с цитоплазматическими грузов pHluorin тегов в дрожжах. Штаммы, экспрессирующие pHluorin-маркированные грузы могут быть использованы в кинетических и / или конечных точек анализов, в зависимости от свойств и торговли поведения конкретного груза. Кроме того, некоторые pHluorin-меченый грузов поддаются методам анализа с высокой пропускной способностью, в том числе проточной цитометрии. Важно отметить, что тег pHluorin является универсальным инструментом для изучения эндоцитических событий в живых клетках, что позволяет количественно оценить эндоцитоза и сравнения функции эндоцитотического в дикого типа и мутантных штаммов.
протокол
1. Решения и средства массовой информации
- Подготовьте следующие запасы, медиа и планшеты:
- Для приготовления 10x YNB, растворите 67 г азотистого основания дрожжей не хватает аминокислот в 1 л воды. Стерилизуют путем фильтрации через 0,22 мкм нитроцеллюлозный фильтр.
- Подготовка среды YNB с использованием 1x YNB (с 10-кратным акций) с 2% раствором декстрозы (из стерильного 50% вес / объем запаса) и смеси 1x аминокислота / питательных веществ (от 100х запаса см шаг 1.1.4). Для отбора плазмиды, опустить отдельные аминокислоты или питательные вещества, по мере необходимости. Для индукции экспрессии Mup1, дополнительно опустить метионин из аминокислоты / питательной смеси.
- Подготовка YNB пластины, используя 1x YNB (с 10-кратным наличии), 2% раствор декстрозы (из стерильного 50% вес / объем запаса), 0,7 г / л аминокислоты / питательной смеси (этап 1.1.5) и 2,5% агара. Подготовьте пластины среду автоклавированием 25 г агара и 0,7 г аминокислот / питательной смеси на 860 мл воды. Дайте смеси остыть до 55 ° С, затем добавляют 100 мл 10х YNB и 40 мл OF 50% глюкозы. Налейте пластин (приблизительно 30 мл среды на 10 см чашку), позволяют среда затвердевать при комнатной температуре, и хранить пластины при температуре 4 ° С.
- Готовят 100x аминокислоты / питательное вещество маточного раствора (для жидкой среды) путем растворения следующих в 100 мл деионизированной воды: 0,1 г L-метионин, 0,3 г каждого из L-лейцина и L-лизин, и 0,2 г каждого из L-гистидина , L-триптофана, аденина и урацила (другие аминокислоты и питательные вещества, могут быть включены по мере необходимости для конкретных штаммов). Используйте мягкое тепло, если это необходимо для растворения, и стерилизуют через 0,45 мкм нитроцеллюлозный фильтр. Хранить при комнатной температуре с защитой от света. Для отбора плазмиды, готовят растворы специфические компоненты, лишенные по мере необходимости.
- Готовят аминокислоты / смесь питательных веществ (для пластин) путем объединения следующих: 0,5 г аденина, 4 г L-лейцина и 2 г каждого из L-гистидин, L-лизин, L-метионин, L-триптофан, L- тирозин и урацил. Измельчите с помощью ступки и пестика, и магазин с проСРЕДЫ от света. Для отбора плазмиды, готовят смеси компонентов, в которых отсутствует специальное по мере необходимости, и используют 0,7 г смеси аминокислот на литр пластинчатой среды (этап 1.1.3).
- Подготовка 8-луночных слайды камера для микроскопии путем нанесения на поверхность предметного стекла с конканавалина А (ConA). В каждую лунку камеры горкой, добавить 25 мкл 2 мг / мл ConA, растворенную в воде. С помощью пипетки, распространять ConA всей нижней поверхности скважины, а затем позволить слайд высохнуть на воздухе при комнатной температуре в течение по крайней мере 4-8 часов. В идеале, использование камеры слайды в течение 24 ч с ConA покрытия.
- Сформировать штаммов дрожжей с в рамке слитых GFP или pHluorin к эндоцитотического груза интереса с использованием полимеразной цепной реакции (ПЦР) метод интегрирования основанное описано в Longtine и др. Гольдштейн и Маккаскер 25,26.
Примечание: Плазмиды , содержащие pHluorin мечения кассеты с генами устойчивости к канамицину (KANMX6) и nourseothricin ( NATMX4) были описаны ранее 20.- Amplify GFP или pHluorin кассеты , содержащие селективные маркеры , с использованием праймеров , содержащих дополнительные последовательности , специфичные для сайта геномной интеграции 20,25.
- Преобразование полученного продукта ПЦР в желаемый штамм дрожжей с помощью метода 27 ацетата лития.
- Выберите для интеграции кассеты путем выращивания клеток на пластинах, содержащих YPD соответствующий препарат. Для приготовления пластины, автоклав 10 г дрожжевого экстракта, 20 г пептона, 0,1 г триптофана и 25 г агара в 960 мл воды. Перед заливкой плиты, дайте смеси остыть до 55 ° С, затем добавляют 40 мл 50% глюкозы и либо G418 , до конечной концентрации 200 мкг / мл для отбора KANMX6 или nourseothricin до конечной концентрации 100 мкг / мл для выбор NATMX4.
- Подтвердить интеграцию GFP или pHluorin тега в отдельных колоний с помощью ПЦР и / или Вестерн-блоттинга с использованием анти-GFP антител,а также путем обнаружения меченого белка с помощью флуоресцентной микроскопии 20.
Примечание: Конкретные дрожжевые штаммы и плазмиды , используемые в этом исследовании, приведены в таблицах 1 и 2, соответственно.
2. Анализ конечных точек для установившегося состояния флуоресценцию конститутивно Интернализованная эндоцитических Cargo
- Привить клетки (~ 3 небольших колоний) в 5 мл YNB среду, лишенную аминокислоты или питательные вещества, как это требуется для поддержания плазмиды (если применимо). Рост клеток в течение 16-24 ч, в орбитальное инкубаторе при температуре 30 ° C, при 250 оборотов в минуту встряхивая. В качестве альтернативы, полоса а ~ 1-2 мм колонии клеток на пластину YNB хватает аминокислот или питательных веществ для отбора плазмиды и клетки растут в течение ночи при 30 ° С.
- Измерения плотности (OD 600) для каждой ночной культуры с использованием спектрофотометра. Подготовьте 5 мл раствор при 0.35-0.4 OD 600 / мл в YNB среду , лишенную аминокислоты или питательные вещества для PLAсодержание Шмид, и расти в течение приблизительно 3 ч при 30 ° C при встряхивании. Если используются клетки штрихом на тарелку, пропустите этот шаг и перейдите к шагу 2.4 (смотри ниже).
- Измерьте плотность (OD 600) клеток, которые в настоящее время должен находиться в пределах 0,6-1,0 OD 600 / мл. Передача 1,5 мл культуры в микроцентрифуге трубки и гранул клеток при 8000 оборотов в минуту (6,800 XG) в течение 2 мин. Удалить 1475 мкл супернатанта.
- Доведите клетки к флуоресцентным микроскопом. Перед тем, визуализации каждого образца, подготовить слайд путем ресуспендирования клеток в оставшейся среде, и смонтировать 3 мкл клеточной суспензии под покровным стеклом. В качестве альтернативы, подготовить 8-луночных слайды в камере, как это описано ниже, в протоколе 3, используя YNB среду по мере необходимости для отбора плазмиды. В идеале, изображения клетки с 100х, 1.4 или выше числовой апертуры (NA) иммерсионным объективом, 12- или 16-разрядной камерой, а также фильтров возбуждения / эмиссии оптимизированы для GFP флуоресценции.
Примечание: При использовании клетки, выращенные штриховой разводкой Oна пластину, подготовить слайд путем размещения 3 мкл свежей среды YNB на покровным. С помощью кончика пипетки, собрать небольшую колонию клеток от пластины, разгонять клетки в среду YNB, и смонтировать полученную суспензию на предметном стекле непосредственно перед изображениями. - Изображение 4-6 случайных полей ячеек для каждого условия, используя те же параметры сбора данных (то есть, наборы фильтров и времени экспозиции) для всех изображений в рамках эксперимента.
ПРИМЕЧАНИЕ: Собирая или DIC светлого изображения для каждого поля может быть полезно для клеток, где сигнал pHluorin гасится в MVB и вакуолярных отсеков. - Количественно интенсивность флуоресценции по меньшей мере 30-50 клеток для каждого условия (см протокол 5).
3. Кинетическая Анализ для количественного определения эндоцитоза, которые претерпевают Грузы эндоцитоза Регулируемый
- Инокулируйте 2-3 колоний клеток дрожжей (около 2 мм в диаметре на колонии) в 5 мл YNB среде, не содержащей метионин и добавитьitional аминокислоты или питательные вещества для поддержания выбора плазмиды. Grow культур в течение 16-24 ч при 30 ° C при встряхивании.
Примечание: В данной работе протоколы для изучения регулируемых эндоцитических грузовых белков будет использовать метионин пермеазы, Mup1. Другие грузы, которые претерпевают регулируемую эндоцитоз также пригодны для мечения с pHluorin (например, урацил пермеазы Fur4, которая накапливается в плазматической мембране в отсутствие урацила, и усваивает в ответ на прилагаемое извне урацил); для этих грузов, условия СМИ должны быть изменены, чтобы отразить конкретное выражение, индукция и интернализации условий для этого груза. - Измерения плотности (OD 600) для каждой ночной культуры приблизительно 3 ч до того визуализации. Приготовьте 5 мл раствор при 0.35-0.4 OD 600 / мл в среде , не содержащей YNB метионин и дополнительные аминокислоты или питательные вещества для поддержания плазмид, и расти при температуре 30 ° C при встряхивании.
- Предварительно уравновешивания микролимитахКоуп климатическую камеру или подогретой стадию (если таковая имеется) до 30 ° С в течение 3 ч инкубации стадии 3.2.
- Передача 1 мл клеточной культуры в микроцентрифуге трубки и гранул клеток при 8000 оборотах в минуту (6,800 XG) в течение 2 мин. Удалить 975 мкл супернатанта.
- Приготовьте КонА обработанную, 8-хорошо со стеклянным дном камеры слайд для работы с изображениями (протокол 1.2).
- Добавить 200 мкл YNB среду, лишенную метионин и дополнительные аминокислоты или питательные вещества для селекции плазмиды в каждую лунку. Ресуспендируют осадок клеток, полученной на стадии 3.4, в оставшейся надосадочной жидкости, и падение 2,5 мкл клеточной суспензии в центр каждой лунки. Дисперсные клетки по всей поверхности лунки с помощью пипетки вверх и вниз, и позволяют клеткам урегулировать в течение 5-10 мин.
- Поместите камеру слайд на перевернутой флуоресцентного микроскопа, уравновешенной до 30 ° C (см шаг 3.3). Найдите поле ячеек с помощью светлого освещения.
- Добавляют 50 мкл YNB среды, содержащей 100 мкг / мл метионина(Предварительно нагретый до 30 ° С) до 200 мкл среды в скважине для получения конечной концентрации метионина 20 мкг / мл. Во избежание разрушения среды в скважине, чтобы предотвратить клетки от плавающей снизу.
- Дайте клеткам уравновешиваться в течение 2 мин до начала обработки изображений. Непосредственно перед съемкой первого изображения, настроить микроскоп к нужному фокальной плоскости (как правило, экваториальный фокальной плоскости лучше всего работает).
- Получение изображений GFP и (или светлого DIC) 5-минутными интервалами в течение 45-60 мин, при использовании одинаковых параметров приобретения для всех изображений в пределах временного ряда (например, 100X 1.4 NA цели масло погружения и 500 мс времени обнаружения с использованием фильтра GFP, 100 мс время обнаружения с использованием DIC фильтра).
Примечание: Если этап микроскопа и программное обеспечение визуализации не позволяют автоматической коррекции дрейфа фокальной плоскости, это может быть необходимо, чтобы вручную настроить фокус перед каждым времени изображений точки. Кроме того, приобретение будет разварьируются от микроскопов из-за различий в освещении и фильтров, а также оптимальные условия должны быть определены вручную до начала эксперимента. Если эндоцитотический груз кроме Mup1 используется, может возникнуть необходимость изменить время сбора и обработки изображений интервалов, а также продолжительность эксперимента, чтобы отразить кинетики интернализации этого груза. - Количественно интенсивность флуоресценции отдельных клеток в каждой временной точке (см протокол 5), и выражают значения в процентах от начальной интенсивности первого изображения.
4. Анализ конечных точек для Количественное эндоцитических, претерпевающих Грузы Регулируемый эндоцитоза
- Подготовка клеток для визуализации, как описано в протоколе 3 (шаги 3.1 через 3.6).
- Изображение 4-5 случайных полей ячеек для каждого состояния непосредственно перед добавлением метионин, используя Светлое и GFP наборы фильтров.
- Добавляют 50 мкл YNB среды, содержащей 100 мкг / мл метионина (довоеннаяMed до 30 ° С) до 200 мкл среды в скважине для получения конечной концентрации метионина 20 мкг / мл. Во избежание разрушения среды в скважине, чтобы предотвратить клетки от плавающей снизу.
- Изображение 4-5 случайных полей клеток через 30 мин после добавления метионина, используя те же параметры, что и для приобретения в момент времени 0 мин (шаг 4.2).
- Количественно величина интенсивности флуоресценции по крайней мере, 30-50 клеток для каждой временной точки (см протокол 5). Экспресс значения как процент от Mup1-pHluorin интернализированной через 30 мин с использованием формулы: [Средняя интенсивность при 0 мин - средняя интенсивность на 30 мин] / [средняя интенсивность при 0 мин] х 100%.
Примечание:. Можно одновременно выполнять до восьми конечных точек анализов ошеломляющим времени начала каждого теста В таблице 3 приведен пример рабочего процесса для восьми одновременных анализов.
5. после приобретения Анализ
- Экспорт изображений из программного обеспечения сбора в качестве 16-битный формат файла меченых изображения (.tif или .tiff формат).
Примечание: Другие форматы файлов могут также быть пригодны, и в идеале должны использовать алгоритмы сжатия без потерь. 8-битные изображения, как правило, не пригодны для целей количественного определения. - Открытие файлов с помощью программного обеспечения ImageJ (в свободном доступе в опции "Открыть" в меню "Файл". С помощью флуоресцентного изображения для количественной оценки, а светлое / DIC изображения в качестве эталона для определения местоположения клеток и исключить мертвые клетки (если они присутствуют ), которые выглядят более темными, чем живых клеток при просмотре DIC и autofluorescent при просмотре с помощью фильтров GFP возбуждения / излучения.
- Выполните вычитание фона на флуоресцентного изображения. Для получения изображений с нечетным фонового сигнала, используйте '' вычитание фона алгоритм, найденный в меню 'Process'. Используйте настройки по умолчанию (радиус качения шарика 50 пикселей), который, как правило, достаточно для целей количественной оценки.
Примечание: альтернативный backgroунд метод вычитания для изображений с однородным фоном описан на этапе 5.3.1.-5.3.2; Тем не менее, описанный выше способ также работает для равномерного фона.- Для получения изображений с равномерным фоном (т.е. интенсивность фона примерно постоянна на всех кромках и в центре изображения), вручную выполнить вычитание фона. Нажмите на кнопку "Freehand опциям пункта, найденного в главном окне ImageJ и выберите 3-5 случайных областей внутри изображения, которые не содержат клеток.
- Откройте функцию "Set измерений", расположенную в меню "Анализировать", выберите параметр 'Mean Gray Value', и измерения значений интенсивности с помощью функции "Измерение" (также находится в меню "Анализировать"). Вычислить среднее значение из измеренных 3-5 регионов, и вычесть из всех последующих измерений в этом изображении.
- Для количественного определения кинетических анализов (протокол 3), генерируют одну, многоярусные изображение для тимE-серии. Откройте флуоресцентные изображения от каждой точки времени в хронологическом порядке, а также генерировать стек с помощью "изображений в стек 'функцию (находится в меню" Изображение ", в соответствии с подменю Стеки).
- Наметит ячейку с помощью инструмента выделения областей произвольной формы, убедившись в том, чтобы включить всю клетку, но как мало площади вне клетки, как это возможно.
- Измерьте следующие параметры: 'Area, интегральная плотность "и" Среднее значение серого ". Выбор параметров с помощью функции "Set измерений", расположенный в меню "Analyze".
Примечание: интегральная плотность соответствует сумме всех интенсивностей пикселей в выбранной области, а среднее значение серого соответствует [интегральной плотности / Area], которая корректирует значения интенсивности для размера ячейки. - Откройте "ROI Менеджер", расположенный в меню "Анализ", в соответствии с подменю "Инструменты". В окне ROI Manager, нажмите кнопку "Добавить", чтобы ввести выделенную Regioп как новую область интереса (ROI).
- Повторите шаги 5.4 через 5.6 для остальных ячеек в изображении. Исключить любые мертвые клетки , как оцениваемые светлопольному / DIC и флуоресценции (мертвые клетки кажутся более темными в DIC изображений, и имеют autofluorescent цитоплазматический сигнал при наблюдении с GFP возбуждения / излучения, см рис 2F), а также любые клетки , которые касаются края изображения. Сохранение выбранных трансформирования в виде файла .zip, нажав на кнопку "More" в окне "ROI Менеджер", а также экспортировать все измерения в электронную таблицу или программного обеспечения статистического анализа.
- Для количественного определения кинетических анализов (протокол 3), обрисовать и измерить ячейку из начального момента времени, как описано в пунктах 5.4 и 5.5. Используйте один и тот же ROI для измерения всех последующих моментов времени в эксперименте.
- Для конечных точек анализа (протоколы 2 и 4), измеряют как минимум 30-50 клеток для каждого условия. Выполнение количественной оценки в течение по крайней мере 2-3 изображений, и включают в себя все клетки в каждойизображения, которые отвечают критериям, изложенным в пункте 5.8 в анализе.
- Оценка статистической значимости между образцами с использованием односторонней ANOVA с последующим тестом множественного сравнения Тьюки для постфактум анализа.
6. Анализ Население Mup1-pHluorin эндоцитоза с помощью проточной цитометрии
- Инокулируйте 2-3 колоний клеток дрожжей (около 2 мм в диаметре на колонии) в 0,5 мл YNB среду, лишенную метионин и дополнительные аминокислоты или питательные вещества для поддержания выбора плазмиды. Рост клеток в 5 мл круглодонную пробирки в течение 16-24 ч при 30 ° С на роликовом барабане.
- Добавить 1,5 мл YNB среду, лишенную метионин и дополнительные аминокислоты или питательные вещества для поддержания плазмид, и расти при температуре 30 ° С в течение еще 3 ч на роликовом барабане.
- Передача 1 мл клеток, в каждую из двух 5 мл с круглым дном пробирки. Добавить 0,25 мл YNB -Met среды к первой трубе (-Met состояние), и 0,25 мл YNB среды, содержащей 100 мкг/ Мл метионин ко второй трубе, чтобы получить конечную концентрацию метионин 20 мкг / мл (+ Met состояние). Инкубируйте клетки при 30 ° С в течение 45 мин на роликовом барабане.
- Анализ клеток с помощью проточной цитометрии, выбирая рассеяния вперед (FS) в качестве меры размера ячейки и интенсивности флуоресценции Mup1-pHluorin из фильтра флуоресцеинизотиоцианата (FITC) в качестве меры груза интернализации.
- С помощью кнопок ползунок для регулировки напряжения ФС и каналов FITC для оптимизации обнаружения для диапазона размеров и интенсивности флуоресценции дрожжевых клеток используется (для этих экспериментов, настройки были использованы 50 V для FS и 400 V для FITC).
Примечание: Напряжение для обоих каналов будет изменяться в зависимости от потока цитометрии используется. Этот шаг должен быть сделан до или в течение 45 мин обработки с метионином (шаг 6.3). - Мера FS и интенсивность флуоресценции для 10000 клеток из каждого состояния, используя параметр высокой скоростью потока. Сформировать график рассеяния ФС против флуоценция интенсивности: нажмите на ссылку "добавить график ', выберите FITC (ось х) и FS (ось у), и график 1000 пунктов (программное обеспечение будет отображать значения на 1000 ячеек, хотя 10000 клеток были измерены).
ПРИМЕЧАНИЕ: Для получения максимальной согласованности, анализа ячеек 45-50 мин после добавления метионина; для экспериментов с участием большого количества проб, шатаются добавление метионин, чтобы приспособить время, необходимое для анализа потока цитометрии. - Включить -Met и + Met условия для дикого типа (WT) клеток в качестве контроля. С помощью функции затвора, назначить вертикальную ворота, используя условие WT + Met, таким образом, что примерно 5% из самых ярких клеток попадают справа от ворот. Используйте эту селекцию для всех других условий эксперимента.
Результаты
Стационарное локализация и количественное конститутивно интернализованной эндоцитотического груза белка STE3
Для того, чтобы продемонстрировать, что pHluorin-меченый грузы могут быть использованы для количественного определения эндоцитоза в живых клетках, локализации химерного GFP и pHluorin слитых с цитоплазматическим С-концевого хвоста STE3, А-фактора феромонов рецептора у дрожжей, сравнивались. STE3 является G-белком рецептор (GPCR) , которые конститутивно транспортируется к плазматической мембране, интернализации, и нацелен на вакуоли для деградации 28. Таким образом, в стационарных условиях, большинство STE3 локализуется в вакуоли просвет, как видно из дикого типа (WT) клеток , экспрессирующих STE3-GFP (рис 2A). В противоположность этому , клетки , лишенные генов , кодирующих четыре клатриновых-связывающим адаптерных белков Ent1, ent2, Yap1801 и Yap1802 (ent1 Δent2 Δ yap1801 Δ Δ yap1802, далее именуемые как 4Δ) не в состоянии стабилизировать клатрин на участках эндоцитоза 29, и серьезно дефектным в CME 30. 4Δ клетки требуют экспрессии epsin N-концевой гомологии (ENTH) домена либо Ent1 или ent2 для жизнеспособности 30,31. Домен ENTH не является достаточным для эндоцитоза в клетках 4Δ, как показано путем удержания STE3-GFP в плазматической мембране в клетках 4Δ + ENTH1 , экспрессирующих домен выбывание из Ent1 (фиг.2А) 8,30; подобное удержание плазмы мембраны в клетках 4Δ + ENTH1 наблюдается для других эндоцитических грузов, в том числе Ste2-GFP (феромон рецептора α-фактора) и Mup1-GFP или Mup1-pHluorin (метионин пермеазы) 8,18. В противоположность этому, экспрессия полноразмерного Ent1 из плазмиды в клетках 4Δ (4Δ + ent1) восстанавливает эндоцитоз и локализацию STE3-GFP в вакуоль. 4Δ + ENTH1 клетки недавно использовали Iна генетический экран для идентификации CIE пути у дрожжей , которая опирается на актин-модулирующий GTPase Rho1 и его ГЭФ, Rom1, а также Formin Bni1 и члены альфа-arrestin семейства белков , участвующих в сортировке грузов 8,18. В соответствии с ролью в CIE, экспрессия Rom1 или α-arrestin LDB19 из высококачественной копии плазмид в клетках 4Δ + ENTH1 улучшенных интернализации STE3-GFP (рис 2А).
Клетки, экспрессирующие STE3-GFP или другие GFP-меченый эндоцитических грузов имеют яркие вакуоли из-за накопления и протеолитической сопротивления GFP тега. В противоположность этому , клетки , экспрессирующие STE3-pHluorin имеют очень низкий уровень вакуолярной флуоресценции из - за резкого охлаждения тега pHluorin в кислой среде 20. Как было замечено ранее, WT и 4Δ + ent1 клетки показали очень мало обнаруживаемого STE3-pHluorin с помощью флуоресцентной микроскопии (рис 2В). В противоположность этому, STE3-pHluorinбыло легко обнаружить на плазматической мембране клеток 4Δ + ENTH1, в то время как вакуоли STE3-pHluorin оставалась почти невозможно обнаружить во всех случаях. Высокая копию выражение Rom1 или LDB19 уменьшил количество обнаруживаемого STE3-pHluorin на поверхности клетки, аналогичные результатам с STE3-GFP, хотя вакуольная STE3-pHluorin остается почти невозможно обнаружить во всех случаях.
Для сравнения эффективности GFP- и pHluorin-меченый грузов в качестве инструментов для количественной оценки изменений в эндоцитотического способности клеток, цельноклеточная флуоресценция STE3-GFP и STE3-pHluorin измеряли в WT и 4Δ клеток. Хотя изменения в локализации STE3-GFP были легко обнаружить с помощью микроскопа (рис 2А), различия в общей интенсивности флуоресценции не были статистически значимыми между WT, 4Δ + Ent1 и клеток 4Δ + ENTH1 , трансформированных пустым вектором (рис 2С) 20. Likewisе, 4Δ + ENTH1 клетки , трансформированные вектором, Rom1 и LDB19 имели сходные интенсивности флуоресценции целых клеток. Следует отметить, что 4Δ + ENTH1 клетки , трансформированные Rom1 или LDB19 были значительно слабее , чем клетки WT (рис 2в) 8,18; Тем не менее, уровень белка STE3-GFP были похожи , как оценивали с помощью иммуноблоттинга (рис 2E). В то время как разница в интенсивности может быть обусловлено отчасти изменением размера вакуоли или морфологии, или различий в сохранении GFP тега в вакуоль, количественное определение STE3-GFP флуоресценции не отражает изменения в локализации , наблюдаемые с помощью флуоресцентной микроскопии (рис 2А). В противоположность этому , количественное определение интенсивности STE3-pHluorin показали , что 4Δ + ENTH1 клетки , трансформированные вектором были значительно ярче , чем WT или 4Δ + ent1 клеток и высокого копия выражение Rom1 или LDB19 в клетках 4Δ + ENTH1 снижается интенсивность STE3-pHluorin куровни , которые были похожи на WT и 4Δ + Ent1 (рис 2D). Таким образом, количественное определение стационарной интенсивности STE3-pHluorin точно отражает различия в локализации, наблюдаемой с помощью флуоресцентной микроскопии.
Кинетические анализы интернализации с использованием регулируемых эндоцитических груза, Mup1
Количественное интенсивности флуоресценции для конститутивно интернализированных грузов в стационарном состоянии может выявить различия в эндоцитотического способности мутантных клеток по сравнению с клетками WT. Тем не менее, вполне возможно, что некоторые грузы могут достичь того же стационарное распределение и интенсивность в WT и эндоцитических мутантных клеток, хотя мутантные клетки имеют задержку в эндоцитоза или более медленной кинетикой для груза интернализации. Вместо этого, pHluorin-меченый грузов, которые подвергаются регулируемой эндоцитоз в ответ на специфический стимул или лиганд может быть использован для мониторингакинетика эндоцитоза. Для этого, интернализация высоким сродством метионин пермеазы, Mup1, контролировали 32. В отсутствие внеклеточного метионин, экспрессия Mup1 позитивно регулируется, и пермеазы удерживается на плазматической мембране; при добавлении метионина к среде, Mup1 подвергается быстрому интернализации и нацеливание на вакуоли 13.
Для контроля кинетики Mup1 интернализации, WT штаммы , экспрессирующие Mup1-GFP или Mup1-pHluorin из геномного локуса были выращены в отсутствие метионина для того , чтобы аккумулировать флуоресцентного Mup1 на плазматической мембране (фиг 3А, 0 мин момент времени). Покадровый изображений клеток затем проводили через каждые 5 мин в отсутствии или в присутствии метионин для мониторинга грузов интернализации и изменений флюоресценции. Как и следовало ожидать, GFP- и pHluorin-меченый Mup1 изображаются в отсутствие метионина осталась на плазматической мембраны Fили всего 45 мин периода наблюдения 20. В противоположность этому, клетки, изображаемой в присутствии метионин показали прогрессирующее истощение флуоресцентного сигнала с клеточной поверхности, в соответствии с грузовой интернализации. Следует отметить, что Mup1-GFP флуоресценции накапливается во внутренних структурах (например, эндосомы и вакуоли), в то время как Mup1-pHluorin локализован на внутренней punctae , которые , вероятно , соответствуют ранних эндосом, но не был замечен в вакуоли.
Когда флуоресценции количественно во всех временных точках для отдельных ячеек, Mup1-GFP и Mup1-pHluorin интенсивность показала небольшое изменение в отсутствии приложенного извне метионином в течение 45 мин эксперимента, в соответствии с белком оставаясь устойчиво локализованы в плазматической мембране (фигура 3В). В противоположность этому, поклеточного интенсивность Mup1-pHluorin быстро снижается в присутствии метионин, таким образом, что сокращение fluorescenc 50%Интенсивность е наблюдалось приблизительно через 20-25 мин, и уменьшение на 80% наблюдалось приблизительно через 40 мин 20. Mup1-GFP клетки также показали снижение интенсивности флуоресценции при добавлении метионин; Однако кинетика потери флуоресцентной задерживались по сравнению с теми Mup1-pHluorin, таким образом, что уменьшение интенсивности 50% наблюдалась только через 40 минут. Как видно на фигуре 3А, Mup1-GFP , был едва обнаружим в плазматической мембране в это время, что свидетельствует о том , что стойкие вакуолярная флуоресценции GFP предотвращено точное определение количества эндоцитических событий на поверхности клетки.
Конечных точек анализы с использованием регулируемых эндоцитических груза, Mup1
Помимо количественных, кинетических анализов эндоцитоза, как описано выше, регулируемые эндоцитических грузов, таких как Mup1 также могут быть использованы для конечных точек анализов, подобных квантификацииустановившихся интенсивность STE3-pHluorin. Для этой цели, анализ для количественного определения Mup1-pHluorin интернализации была изменена , чтобы позволить сравнение средних значений интенсивности флуоресценции из популяций клеток отображенных непосредственно до или через 30 минут после добавления метионина 8,18. Такой подход позволяет сравнивать процент Mup1 интернализованной между WT и эндоцитических мутантных клеток.
В соответствии с результатами кинетического анализа (рисунок 3), Mup1-pHluorin быстро истощаются из плазматической мембраны в клетках WT (рис 4а), таким образом, что примерно 60% Mup1-pHluorin было интернализированных 30 мин после добавления метионина ( Рисунок 4B). Как и следовало ожидать, Mup1-pHluorin интернализации был так же эффективен в 4 + Ent1 клеток, в то время как интернализация была значительно снижена в клетках 4Δ + ENTH1, в соответствии с серьезным дефектом эндоцитоза. Выражение высокого копияиз Rom1 или альфа-arrestin LDB19, который специально требуемой для Mup1 интернализации как через CME и CIE дорожками 13,18, улучшенную интернализации Mup1-pHluorin, в соответствии с их способностью содействовать эндоцитоза в клетках 4Δ + ENTH1 18. Следует отметить, что хотя Стационарная интенсивность STE3-pHluorin в клетках 4Δ + ENTH1 экспрессии высокого копирования Rom1 или LDB19 был неотличим от WT или 4Δ + ent1 клеток, интернализация Mup1-pHluorin лишь частично улучшилась в клетках 4Δ + ENTH1 выражая высокую копию ROM1 или LDB19 (рис 4C). Таким образом, эти данные указывают на то, что кинетические и / или конечных точек анализы могут выявить различия в эндоцитических ставок между WT и мутантных штаммов для некоторых грузов, несмотря на то, подобное стационарное распределение других грузов может быть достигнуто в одних и тех же штаммов.
Население на основе анализа Mup1-PHLuorin интернализации с помощью проточной цитометрии
Высокая пропускная способность анализа больших популяций клеток с использованием проточной цитометрии может обеспечить альтернативу проведения кинетических и конечных точек анализов для грузов интернализации с помощью микроскопии. Для этой цели, интенсивность флуоресценции Mup1-pHluorin сравнивали в WT клетках из культуры, выращенной в отсутствие метионина (WT -Met, который должен быть "ярким"), либо в присутствии метионина в течение 45 мин (WT + Met, которая должна быть "тусклым" по сравнению с необработанными клетками , основанных на сокращении на 80% интенсивности флуоресценции видно на рисунке 3 , б). После анализа с помощью проточной цитометрии, вертикальный затвор был применен к условию WT + Met, где ~ 5% клеток содержались на правой стороне ворот, и соответствует ярких клеток в популяции (рис 5А и 5В , красное население). Когда тот же затвор был примененусловию WT -Met, примерно 65% клеток попали в светлую категорию, демонстрируя, что цитометрии потока может быть использован, чтобы легко наблюдать различия в Mup1-pHluorin интенсивности флуоресценции между популяциями клеток до и после добавления метионина. В противоположность этому, распределение ярко по сравнению с тусклой клеток было неразличимы 4Δ + ENTH1 -Met и + Met условиях с использованием тех же ворот, приложенное к населению WT + Met, в соответствии с дефектной эндоцитоза. Таким образом, проточная цитометрия может обнаружить изменения в эндоцитотического способности клеток, а также позволяет проводить быстрый анализ больших популяций клеток. Важно отметить, проточной цитометрии могут также быть использованы в генетических экранах в качестве инструмента для сортировки и отбора мутантных клеток с дефектным эндоцитоза (К. Wrasman и Б. Wendland, рукопись в процессе подготовки) 33.
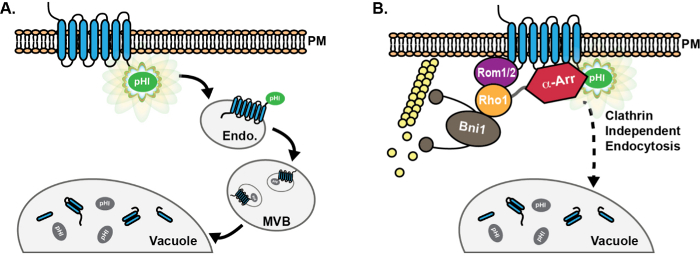
Рисунок 1: Схема прогрессии pHluorin-меченой груза через эндоцитотического пути. (А) химерных слияние с pHluorin (PHL) метки на цитоплазматической хвост эндоцитических грузовых белков приводит к детектируемой флуоресценции (зеленый) груза на плазматической мембране (ПМ ). После эндоцитоза, грузовые белки доставляются в начале эндосомы (Endo), где тег pHluorin остается открытой в цитоплазму, и, таким образом, флуоресцентный. Впоследствии ESCRT техника способствует сортировки грузов и включение в просвете везикул мультивезикулярных органов (MVB). MVBs затем сливаются с вакуоли поставлять белки и мембранные компоненты для деградации. После включения в MVBs, тег pHluorin становится гас (серый) из-за подкисления. (B) Использование pHluorin-меченых грузов способствовало открытие и характеристика белков , участвующих в клатрин независимый эндоцитотический (CIE) пути у дрожжей. В клетках с дефектными клатриновых-опосредованной endocytosявляется, высокого копия выражение ГТФ Rho1, а также его активации ГЭФ Rom1, содействовать грузовую интернализации через CIE 8. Кроме того, хотя семейство α-arrestin (α-ARR) белков знает роль в продвижении грузов убиквитинирование и интернализации через CME 13-17, роли для альфа-arrestins в CIE недавно были выявлены, вероятно , из - за взаимодействия с CIE белков , а не через набор убиквитинлигаза 18. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
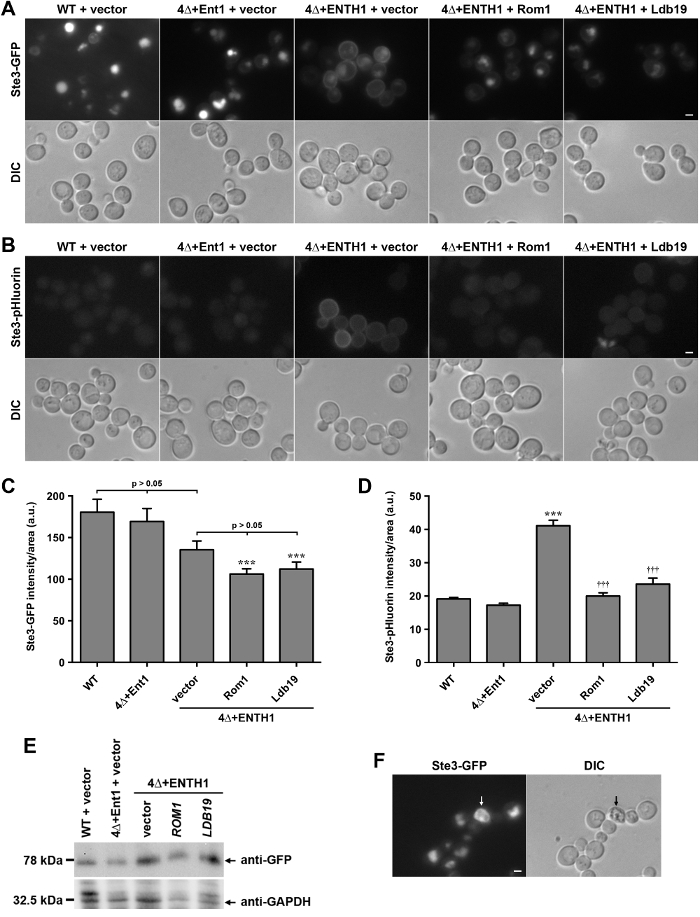
Рисунок 2:. Локализация и количественное STE3-GFP и STE3-pHluorin в дикого типа и мутантных клеток эндоцитических (А) WT, 4Δ + ent1 и 4Δ + ENTH1 клетки , экспрессирующие genomically закодирован STE3-GFP и трансформируют вектором, высокого копирования Rom1 или высокой копии LDB19 как указано визуализировали с помощью флуоресцентной микроскопии (верхний ряд) или DIC (нижний ряд). STE3-GFP изображения были скорректированы в одних и тех же максимальных и минимальных интенсивностей, чтобы обеспечить прямое сравнение локализации STE3. (B) WT, 4Δ + ent1 и 4Δ + ENTH1 клетки , экспрессирующие genomically закодированный STE3-pHluorin были преобразованы и отображены , как описано в панели A. Шкала бар = 2 мкм. (С, D) Количественное определение интенсивности флуоресценции для STE3-GFP (C) и STE3-pHluorin (D) штаммов , используемых в Панели А и В. Для каждого состояния, поклеточного флуоресценции количественно определяли в течение как минимум 40 клеток. Значения были скорректированы для размера ячейки, и выражается в условных единицах (AU) в виде среднего значения ± SEM (*** р <0,001 по сравнению с WT; ††† р <0,001 по сравнению с 4Δ + ENTH1 + вектор). (Е) Relativе выражение STE3-GFP оценивается в WT, 4Δ + Ent1 и клеток 4Δ + ENTH1 трансформируют вектором, высокой копией Rom1 или высокой копией LDB19 , как указано. Клеточные экстракты были получены , как описано выше 20, и равное количество каждого образца были решены с помощью SDS-PAGE. Выражение STE3-GFP, оценивали с помощью иммуноблоттинга с анти-GFP антител, а загрузка белка оценивали с помощью анти-GAPDH. (F) , дикого типа клетки , экспрессирующие genomically закодирован STE3-GFP , рассматривается с помощью флуоресцентной микроскопии (STE3-GFP , панель) и DIC оптики, с мертвой ячейки , обозначенном стрелками. Мертвые клетки появляются autofluorescent в GFP фильтре, и темнее при просмотре DIC. Шкала бар = 2 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рис . 3: Кинетический анализ из Mup1-GFP и Mup1-pHluorin интернализации (A) клетки дикого типа , выражающие genomically кодируются Mup1-GFP (две верхние панели) или Mup1-pHluorin (нижние две панели) выращивали до середины логарифмической фазы в YNB среду, не содержащую метионин, чтобы индуцировать экспрессию и сохранение Mup1 на плазматической мембране. Затем клетки изображается с помощью флуоресцентной микроскопии через каждые 5 мин в отсутствии (- Met) или в присутствии (+ Met) 20 мкг / мл метионина. Для каждой точки времени в состоянии, одинаковые значения максимальной и минимальной интенсивности были применены, чтобы позволить сравнение интенсивности флуоресценции и локализации. 0, 5, 10, 20 и 40 мин временные точки показаны как указано для всех условий. Шкала бар = 2 мкм. (B) Количественная Mup1-GFP и Mup1-pHluorin интернализации в клетках дикого типа из панели А. Цельноклеточная интенсивность флуоресценции Mup1-GFP (- Met, фиолетовых квадратах + Met, голубые бриллианты) или Mup1-pHluoRin (- Met, зеленые треугольники + Met, красные кружки) измеряли для отдельных клеток изображаемых 5-минутными интервалами, и выражали в процентах от исходной интенсивности флуоресценции (среднее значение ± SEM, n = 6 ячеек на каждый вариант). Перепечатано из Проссер и др. (2010) 20 с разрешения издателя. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
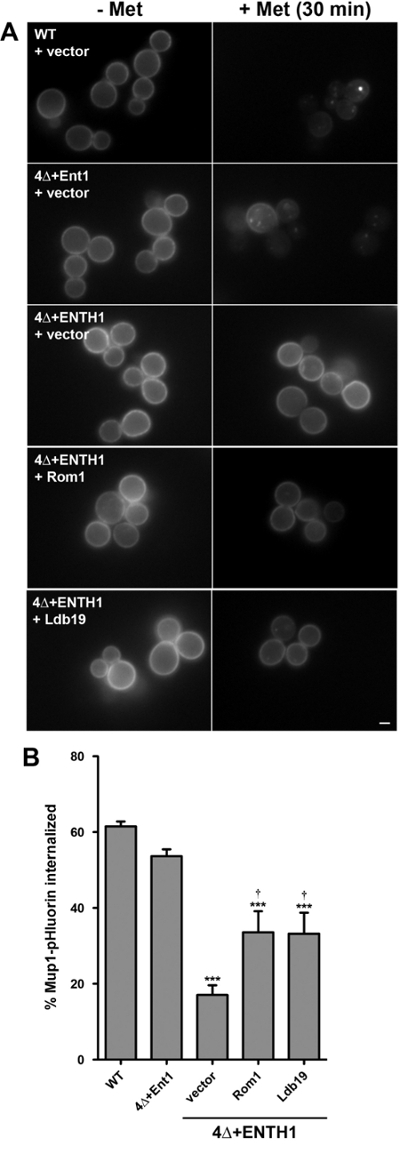
Рис . 4: конечная точка анализа из Mup1-pHluorin интернализации (A) WT, 4Δ + ent1 и 4Δ + ENTH1 клетки , экспрессирующие genomically кодируются Mup1-pHluorin и трансформируют вектором, высокой копией Rom1 или высокой копией LDB19 , как указано выращивали до середины -logarithmic фаза в YNB среде, не содержащей метионин. Случайные поля клеток были обследованы с помощью fluorescenc электронной микроскопии непосредственно перед (- Met) или 30 мин после того, как (+ Met) добавлением 20 мкг / мл метионина. Все изображения были скорректированы в одних и тех же максимальных и минимальных значений интенсивности. Шкала бар = 2 мкм. (B) Количественная Mup1-pHluorin интернализации в клетках из панели А. Для каждого состояния, интенсивность флуоресценции поклеточного измеряли в течение как минимум 40 клеток и с поправкой на размер ячейки. Процент Mup1-pHluorin усвоены рассчитывалась путем сравнения средних значений интенсивности до и после 30 мин обработки метионин. Значения представлены как средние значения ± SEM (n = 4; *** р <0,001 по сравнению с WT; † р <0,05 по сравнению с 4Δ + ENTH1 + вектор). Эта цифра была изменена из Проссер и др. (2015) 18 с разрешения издателя. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
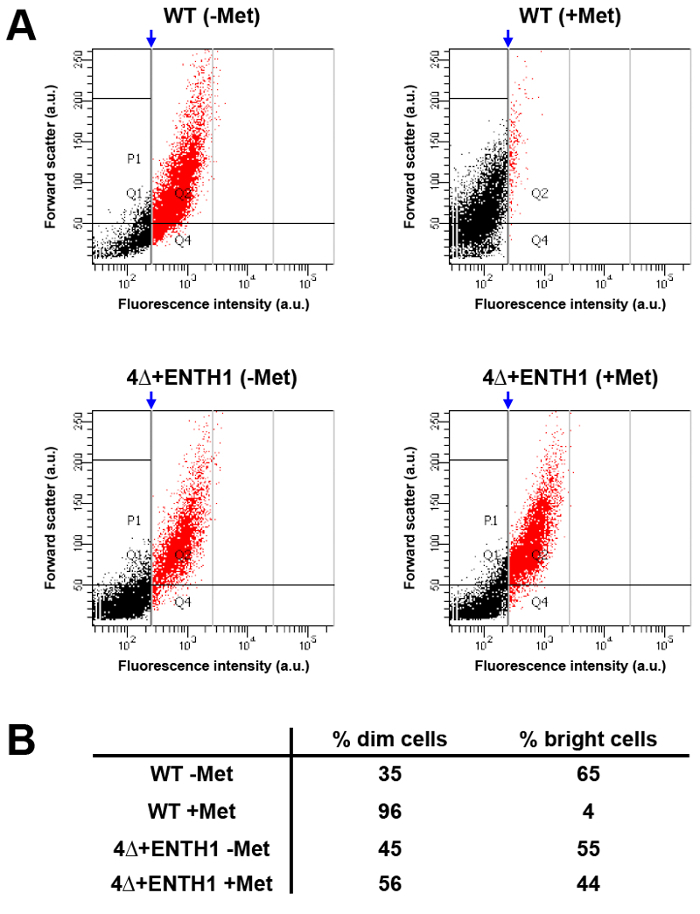
Рисунок 5:. Анализ Популяция Mup1-pHuorin интернализации с помощью проточной цитометрии (А) WT и 4Δ + ENTH1 клетки выращивали до середины логарифмической фазы роста в YNB среде , не содержащей метионин. Затем клетки инкубировали в отсутствие (- Met) или в присутствии (+ Met) 20 мкг / мл метионина в течение 45 мин перед проведением анализа с помощью проточной цитометрии. Для каждого условия, вперед разброс (в условных единицах, Au) наносили на график против интенсивности флуоресценции (а.е., используя FITC фильтр) для 1000 клеток из общего количества 10000 клеток измеряется. Популяции далее анализировали путем применения вертикального затвора (синяя стрелка) к условию WT + Met, где примерно 5% наиболее ярких клеток (показано красным) упал на правой стороне ворот. Стробирования генерируется для условия WT + Met затем применяются к оставшимся условий для возможности сравнениявыборочных распределений. (B) Резюме процент тусклых клеток (черных точек, слева от ворот) и светлых клеток (красные точки, справа от ворот) для WT и 4Δ + ENTH1 ± Met испытания , показанные на панели A. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
| Напряжение | Генотип | Источник |
| SEY6210 | MAT α his3-Δ200 trp1-Δ901 leu2-3,112 ura3-52 lys2-801 SUC2-Δ9 | Лаборатория плазмида |
| BWY2858 | STE3-GFP :: KANMX6 | Проссер и др. (2010) 16 |
| BWY2995 | STE3-pHluorin :: KANMX6 | пРоссер и др. (2010) 16 |
| BWY3036 | ent1Δ :: LEU2 ent2Δ :: HIS3 yap1801Δ :: HIS3 yap1802Δ :: LEU2 STE3-pHluorin :: KANMX6 + pEnt1 [ЕКС TRP1] | Проссер и др. (2010) 16 |
| BWY3037 | ent1Δ :: LEU2 ent2Δ :: HIS3 yap1801Δ :: HIS3 yap1802Δ :: LEU2 STE3-pHluorin :: KANMX6 + pENTH1 [ЕКС TRP1] | Проссер и др. (2010) 16 |
| BWY3399 | ent1Δ :: LEU2 ent2Δ :: HIS3 yap1801Δ :: HIS3 yap1802Δ :: LEU2 STE3-GFP :: KANMX6 + pEnt1 [ЕКС TRP1] | Проссер и др. (2010) 16 |
| BWY3400 | ent1Δ :: LEU2 ent2Δ :: HIS3 yap1801Δ :: HIS3 yap1802Δ :: LEU2 STE3-GFP :: KANMX6 + pEnt1 [ЕКС TRP1] | Проссер и др. (2010) 16 |
| BWY3817 | MUP1-GFP :: KANMX6 | Prosser и др. (2010) 16 |
| BWY3818 | MUP1-pHluorin :: KANMX6 | Проссер и др. (2010) 16 |
| BWY4153 | ent1Δ :: LEU2 ent2Δ :: HIS3 yap1801Δ :: HIS3 yap1802Δ :: LEU2 MUP1-pHluorin :: KANMX6 + pEnt1 [ЕКС TRP1] | Проссер и др. (2011) 7 |
| BWY4154 | ent1Δ :: LEU2 ent2Δ :: HIS3 yap1801Δ :: HIS3 yap1802Δ :: LEU2 MUP1-pHluorin :: KANMX6 + pENTH1 [ЕКС TRP1] | Проссер и др. (2011) 7 |
| A Все штаммы , используемые в данном исследовании, изогенно SEY6210 за исключением указанного локусов. | ||
Таблица 1: Штаммы дрожжей , используемые в данном исследовании.
| плазмида | Описание | Источник |
| pRS426 | 2μ URA3 | Сикорский и Hieter, 1989 |
| pBW0768 | pRS414 :: ent1 [ЕКС TRP1] | pEnt1, Лаборатория плазмида |
| pBW0778 | pRS414 :: ent1 (aa1-151) [ЕКС TRP1] | pENTH1, Лаборатория плазмида |
| pBW1571 | pFA6a-pHluorin-KANMX6 | Проссер и др. (2010) 16 |
| pBW2053 | YEp24 :: ROM1 [2μ URA3] | pROM1 (Проссер и др., 2011) 7 |
| pRS426-Ldb19 | LDB19prom-LDB19 [2μ URA3] | Проссер и др. (2015) 15 |
| pFA6a-GFP (S65T) -kanMX6 | pFA6a-GFP-KANMX6, ПЦР на основе интеграции плазмиду для GFP-тегов в дрожжах | Longtineи др. (1998) 21 |
Таблица 2: Плазмиды , используемые в данном исследовании.
| Время (мин) | Действие (ы) |
| -5 | Пример изображения 1 (-Met) |
| 0 | Добавить метионин в образец 1 |
| Изображение образец 2 (-Met) | |
| 5 | Добавить метионин к образцу 2 |
| Пример изображения 3 (-Met) | |
| 10 | Добавить метионин в образец 3 |
| Пример изображения 4 (-Met) | |
| 15 | Добавить метионин к образцу 4 |
| Пример изображения 5 (-Met) | |
| 20 | Добавитьметионин для образца 5 |
| Пример изображения 6 (-Met) | |
| 25 | Добавить метионин к образцу 6 |
| Пример изображения 7 (-Met) | |
| 30 | Добавить метионин к образцу 7 |
| Пример изображения 8 (-Met) | |
| Пример изображения 1 (+ Met) | |
| 35 | Добавить метионин к образцу 8 |
| Изображение образец 2 (+ Met) | |
| 40 | Пример изображения 3 (+ Met) |
| 45 | Пример изображения 4 (+ Met) |
| 50 | Пример изображения 5 (+ Met) |
| 55 | Пример изображения 6 (+ Met) |
| 60 | Пример изображения 7 (+ Met) |
| 65 | Пример изображения 8 (+ Met) |
Таблица 3Пример рабочего процесса для ошеломляющие 8 Mup1-pHluorin конечных точек анализов.
Обсуждение
Применение pHluorin количественно оценить эндоцитических событий в клетках дрожжей использует трансмембранных грузов , в котором флуоресцентная метка слита с цитоплазматическим хвостом белка (Рис . 1А) Для анализов, описанных здесь, ярко грузы флуоресцентные, когда тег pHluorin подвергается нейтральной среде, но становятся гас, когда тег pHluorin встречает кислотные условия. Таким образом, pHluorin-меченый эндоцитотический груз легко обнаруживается на цитоплазматической стороне мембраны плазмы, и на ранних эндосом, но становится при введении в просвете MVB везикул или после доставки в вакуоль просвет "тусклым". В общем, вновь синтезированные эндоцитических грузов скорее всего оставить эндоплазматической сети (ER) и достигают плазматической мембраны, прежде чем GFP и многие из его вариантов полностью созрели; Таким образом, pHluorin-меченый грузов, которые еще не достигли поверхности клеток, по прогнозам, останутся незаметного, если выход из ER или Гольджи пока яmpaired.
Использование pHluorin-меченых эндоцитических грузов , таких как STE3 и Mup1 облегчило характеристику ряда белков , участвующих в дрожжевой CIE пути (рис 1B) 8,18. В частности, способы , описанные в данной работе, были использованы для демонстрации того, что увеличение производства актин-модулирующий GTPase Rho1 и его ГЭФ Rom1 содействовать эндоцитоза в различных мутантах дрожжей с дефектами в CME 8. Кроме того, pHluorin-меченый грузов были недавно использованы для количественного продемонстрировать , что а-arrestins, которые хорошо зарекомендовавшие себя роли в CME 13-15,34-36, играют грузовые селективные роли в обоих CME и CIE, и имеют различные функции механистически в двух путей 18.
Для протоколов, описанных в этой статье, несколько важных факторов следует учитывать для того, чтобы получить последовательные, количественные результаты. Во-первых, Mup1-GFP или Mup1-pHluorin выражение и fluoresценция может уменьшаться по мере приближения дрожжевые клетки или войти в стационарной фазе роста (неопубликованные результаты); Таким образом, клетки, выращенные из ночной культуры должны быть разбавлены и повторно выращивают в течение еще 3 ч (см шаги 3.1-3.2 и 6.1-6.2). Кроме того, когда шатаясь несколько экспериментальных условиях или деформации в оконечных анализов или для анализа с помощью проточной цитометрии, важно, чтобы собрать данные для всех образцов после той же продолжительности лечения метионин, с тем чтобы сравнений между отдельными условиями. Для анализа после приобретения, количественная оценка должна быть выполнена с использованием 16-битных изображений, так как преобразование в 8-битном формате приводит к потере данных, которые могут повлиять на значения интенсивности флуоресценции. Более того, вычитание фона должны быть выполнены до количественной оценки (этап 5.3), так как фоновый сигнал может значительно закупоривать различия в интенсивности между образцами.
В то время как pHluorin-меченый STE3 и Mup1 доказали поддаются количественной оценке, невсе грузы будут хорошо подходит для pHluorin мечения. Например, попытки пометить α-рецептор фактора Ste2 дали противоречивые количественные результаты, возможно, из-за снижения интенсивности флуоресценции Ste2-pHluorin по сравнению с STE3 или Mup1 (неопубликованные результаты), хотя вполне возможно, что тандем pHluorin теги могли бы улучшить интенсивность сигнала. Кроме того, с очень грузов медленными темпами, индуцированной лигандом эндоцитоза не могут быть пригодны для pHluorin тегах для количественной оценки, особенно, если полупериод интернализации длиннее, чем дрожжи клеточного цикла (примерно 90 мин). Для таких грузов, снижение флуоресценции может возникнуть в результате эндоцитоза и / или разделения груза между матерью и дочерью клеток в процессе деления. Таким образом, тестирование отдельных грузов, представляющих интерес рекомендуется для того, чтобы определить, пригодны ли для pHluorin-мечения и количественной оценки их экспрессия и кинетика.
Хотя недавние исследования с использованием PHLuorin были сосредоточены в основном на эндоцитических событий на плазменной мембране, pHluorin-меченый грузов могут быть использованы для изучения дальнейших событий торговли людьми в эндоцитотического пути. Например, Mup1-pHluorin был успешно использован в потоке анализов цитометрии на основе ESCRT из-опосредованной грузов сортировочного в MVBs 37, так как тег pHluorin становится гасили при регистрации в MVB просветными пузырьках 20. Этот подход аналогичен недавно описанного люциферазы внутрикишечной осаждения (LUCID) анализа, что делает использование с грузами цитоплазматической люциферазы тег для генерации биолюминесцентного сигнала в присутствии люциферин 38,39. Подобно тушение флуоресценции при pHluorin включения в MVB просветными везикул, биолюминесценции в LUCID анализе ослабляется при включении люциферазы тега в MVB пузырьки. В то время как pHluorin и Lucid анализы концептуально похожи, pHluorin-меченый грузов могут быть использованы для изучения эндоцитоза и MVB созреванию яп целые клетки.
Существуют альтернативные методы для количественного определения эндоцитоза и предоставили ценную информацию о показателях груза интернализации в дикого типа и эндоцитических мутантных клеток. Примеры включают в себя поглощение мониторинга радиоактивно меченных лигандов , таких как альфа-фактора (который связывается с рецептором феромонов Ste2) и урацил (который усвоены пермеазы Fur4) 40,41, или контролируя скорость деградации для эндоцитических грузов , таких , как STE3 , как они усваиваются и транспортируются в вакуоль 42. Эти биохимические подходы требуют лизиса клеток, и, таким образом, не пригодны для прямого количественного определения в живых клетках. В качестве альтернативы, флуоресцентно меченных альфа-фактора, флюид-фазовую краситель Lucifer Yellow, или стирильную краситель FM4-64 может быть использован для визуализации эндоцитоза в живых клетках, но не обеспечивают прямой контроль эндогенно экспрессированного грузовых белков 40,43,44. Для этих подходов, настойчивости флуоресценции в ваcuole Просвет может осложнить квантификацию, как видно с GFP. Кроме того, можно использовать GFP-меченый грузов для количественного определения эндоцитоза путем измерения интенсивности флуоресценции целой клетки и вычитания сигнала от цитоплазмы и эндосомальных / вакуолярных отсеков; Тем не менее, эндосомы и вакуоли часто находятся в непосредственной близости к плазматической мембране. В противоположность этому, pHluorin-меченый эндоцитических грузов будут закалены в MVB / вакуоли отсеков, которые могут быть явное преимущество для количественной оценки событий торговли людьми по сравнению с более широко используемой GFP тега. Наши будущие исследования будут расширяться при текущих знаний эндоцитических путей и сортировки грузов в дрожжах, чтобы выявить дополнительные факторы, которые способствуют CME и CIE, и понять механизмы, регулирующие грузовые сортировки решений.
Раскрытие информации
The authors declare no competing interests.
Благодарности
We would like to thank Gero Miesenböck and Tim Ryan for sharing pHluorin cDNA used to generate reagents in this study, Nathan Wright, Joanna Poprawski and Lydia Nyasae for excellent technical assistance, members of the Wendland lab for helpful discussions, and Michael McCaffery and Erin Pryce at the Integrated Imaging Center (Johns Hopkins) for advice and assistance with microscopy and flow cytometry. This work was supported by grants from the National Institutes of Health (to B.W., GM60979) and the National Science Foundation (to B.W., MCB 1024818). K.W. was supported in part by a training grant from the National Institutes of Health (T32-GM007231). A.F.O. was supported by developmental funds from the Department of Biological Sciences at Duquesne University and National Science Foundation CAREER grant 553143.
Материалы
| Name | Company | Catalog Number | Comments |
| Adenine | Sigma | A8626-25G | Use for preparation of amino acid mixture and stock solution |
| Bacto-agar | Fisher | BP1423-2 | Use for preparation of plate media |
| BD Difco Yeast Nitrogen Base (without amino acids) | BD | 291920 | Use for preparation of liquid and plate media |
| Concanavalin A | Sigma | C5275-5MG | Use for coating of chamber slides |
| Dextrose | Fisher | BP350-1 | Use for preparation of liquid and plate media |
| L-Histidine | Fisher | BP382-100 | Use for preparation of amino acid mixture and stock solution |
| L-Leucine | Acros | 125121000 | Use for preparation of amino acid mixture and stock solution |
| L-Lysine | Fisher | BP386-100 | Use for preparation of amino acid mixture and stock solution |
| L-Methionine | Fisher | BP388-100 | Use for preparation of amino acid mixture and stock solution |
| L-Tryptophan | Fisher | BP395-100 | Use for preparation of amino acid mixture and stock solution |
| L-Tyrosine | Acros | 140641000 | Use for preparation of amino acid mixture |
| Nunc Lab-Tek Chambered Coverglass (8-well) | Thermo Scientific | 155411 | Use for kinetic and endpoint assays of Mup1-pHluorin internalization |
| Uracil | Sigma | U0750-100G | Use for preparation of amino acid mixture and stock solution |
| Axiovert 200 inverted microscope | Carl Zeiss | Custom Build | |
| 100X/1.4 Plan-Apochromat Oil Immersion Objective Lens | Carl Zeiss | Objective should be 100X, 1.4NA or higher | |
| Sensicam | Cooke Corporation | Camera should have 12-bit or higher dynamic range | |
| X-Cite 120PC Q Illumination Source | Excelitas Technologies | ||
| Slidebook 5 software | Intelligent Imaging Innovations | ||
| ImageJ software | National Institutes of Health | http://imagej.nih.gov/ij/ |
Ссылки
- Kaksonen, M., Sun, Y., Drubin, D. G. A pathway for association of receptors, adaptors, and actin during endocytic internalization. Cell. 115 (4), 475-487 (2003).
- Kaksonen, M., Toret, C. P., Drubin, D. G. A modular design for the clathrin- and actin-mediated endocytosis machinery. Cell. 123 (2), 305-320 (2005).
- Boettner, D. R., Chi, R. J., Lemmon, S. K. Lessons from yeast for clathrin-mediated endocytosis. Nat Cell Biol. 14 (1), 2-10 (2012).
- Taylor, M. J., Perrais, D., Merrifield, C. J. A High Precision Survey of the Molecular Dynamics of Mammalian Clathrin-Mediated Endocytosis. PLoS Biol. 9 (3), e1000604 (2011).
- Hansen, C. G., Nichols, B. J. Molecular mechanisms of clathrin-independent endocytosis. J Cell Sci. 122 (11), 1713-1721 (2009).
- Sabharanjak, S., Sharma, P., Parton, R. G., Mayor, S. GPI-anchored proteins are delivered to recycling endosomes via a distinct cdc42-regulated, clathrin-independent pinocytic pathway. Dev Cell. 2 (4), 411-423 (2002).
- Radhakrishna, H., Klausner, R. D., Donaldson, J. G. Aluminum fluoride stimulates surface protrusions in cells overexpressing the ARF6 GTPase. J Cell Biol. 134 (4), 935-947 (1996).
- Prosser, D. C., Drivas, T. G., Maldonado-Báez, L., Wendland, B. Existence of a novel clathrin-independent endocytic pathway in yeast that depends on Rho1 and formin. J Cell Biol. 195 (4), 657-671 (2011).
- Prosser, D. C., Wendland, B. Conserved roles for yeast Rho1 and mammalian RhoA GTPases in clathrin-independent endocytosis. Small GTPases. 3 (4), 229-235 (2012).
- Kohno, H., et al. Bni1p implicated in cytoskeletal control is a putative target of Rho1p small GTP binding protein in Saccharomyces cerevisiae. EMBO J. 15 (22), 6060-6068 (1996).
- Evangelista, M., et al. a Yeast Formin Linking Cdc42p and the Actin Cytoskeleton During Polarized Morphogenesis. Science. 276 (5309), 118-122 (1997).
- Kübler, E., Riezman, H. Actin and fimbrin are required for the internalization step of endocytosis in yeast. EMBO J. 12 (7), 2855-2862 (1993).
- Lin, C. H., MacGurn, J. A., Chu, T., Stefan, C. J., Emr, S. D. Arrestin-Related Ubiquitin-Ligase Adaptors Regulate Endocytosis and Protein Turnover at the Cell Surface. Cell. 135 (4), 714-725 (2008).
- Nikko, E., Sullivan, J. A., Pelham, H. R. B. Arrestin-like proteins mediate ubiquitination and endocytosis of the yeast metal transporter Smf1. EMBO Rep. 9 (12), 1216-1221 (2008).
- Nikko, E., Pelham, H. R. B. Arrestin-Mediated Endocytosis of Yeast Plasma Membrane Transporters. Traffic. 10 (12), 1856-1867 (2009).
- O'Donnell, A. F., McCartney, R. R., Chandrashekarappa, D. G., Zhang, B. B., Thorner, J., Schmidt, M. C. 2-Deoxyglucose impairs Saccharomyces cerevisiae growth by stimulating Snf1-regulated and α-arrestin-mediated trafficking of hexose transporters 1 and 3. Mol Cell Biol. 35 (6), 939-955 (2015).
- O'Donnell, A. F., Huang, L., Thorner, J., Cyert, M. S. A calcineurin-dependent switch controls the trafficking function of α-arrestin Aly1/Art6. J Biol Chem. 288 (33), 24063-24080 (2013).
- Prosser, D. C., Pannunzio, A. E., Brodsky, J. L., Thorner, J., Wendland, B., O'Donnell, A. F. α-Arrestins participate in cargo selection for both clathrin-independent and clathrin-mediated endocytosis. J Cell Sci. 128 (22), 4220-4234 (2015).
- Lamaze, C., Dujeancourt, A., Baba, T., Lo, C. G., Benmerah, A., Dautry-Varsat, A. Interleukin 2 receptors and detergent-resistant membrane domains define a clathrin-independent endocytic pathway. Mol Cell. 7 (3), 661-671 (2001).
- Prosser, D. C., Whitworth, K., Wendland, B. Quantitative analysis of endocytosis with cytoplasmic pHluorin chimeras. Traffic. 11 (9), 1141-1150 (2010).
- Bokman, S. H., Ward, W. W. Renaturation of green-fluorescent protein. Biochem Biophys Res Commun. 101 (4), 1372-1380 (1981).
- Miesenböck, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Sankaranarayanan, S., De Angelis, D., Rothman, J. E., Ryan, T. A. The Use of pHluorins for Optical Measurements of Presynaptic Activity. Biophys J. 79 (4), 2199-2208 (2000).
- Katzmann, D. J., Babst, M., Emr, S. D. Ubiquitin-dependent sorting into the multivesicular body pathway requires the function of a conserved endosomal protein sorting complex. ESCRT-I. Cell. 106 (2), 145-155 (2001).
- Longtine, M. S., et al. Additional modules for versatile and economical PCR-based gene deletion and modification in Saccharomyces cerevisiae. Yeast. 14 (10), 953-961 (1998).
- Goldstein, A. L., McCusker, J. H. Three new dominant drug resistance cassettes for gene disruption in Saccharomyces cerevisiae. Yeast. 15 (14), 1541-1553 (1999).
- Ausubel, F. M. . Curr Prot Mol Biol. , (1991).
- Urbanowski, J. L., Piper, R. C. Ubiquitin sorts proteins into the intralumenal degradative compartment of the late-endosome/vacuole. Traffic. 2 (9), 622-630 (2001).
- Newpher, T. M., Smith, R. P., Lemmon, V., Lemmon, S. K. In Vivo Dynamics of Clathrin and Its Adaptor-Dependent Recruitment to the Actin-Based Endocytic Machinery in Yeast. Dev Cell. 9 (1), 87-98 (2005).
- Maldonado-Báez, L., Dores, M. R., Perkins, E. M., Drivas, T. G., Hicke, L., Wendland, B. Interaction between Epsin/Yap180 adaptors and the scaffolds Ede1/Pan1 is required for endocytosis. Mol Biol Cell. 19 (7), 2936-2948 (2008).
- Aguilar, R. C., et al. Epsin N-terminal homology domains perform an essential function regulating Cdc42 through binding Cdc42 GTPase-activating proteins. Proc Natl Acad Sci U.S.A. 103 (11), 4116-4121 (2006).
- Isnard, A. D., Thomas, D., Surdin-Kerjan, Y. The study of methionine uptake in Saccharomyces cerevisiae reveals a new family of amino acid permeases. J Mol Biol. 262 (4), 473-484 (1996).
- Wendland, B., McCaffery, J. M., Xiao, Q., Emr, S. D. A novel fluorescence-activated cell sorter-based screen for yeast endocytosis mutants identifies a yeast homologue of mammalian eps15. J Cell Biol. 135 (6), 1485-1500 (1996).
- Alvaro, C. G., et al. Specific Alpha-Arrestins Negatively Regulate Saccharomyces cerevisiae Pheromone Response by Down-Modulating the G-Protein-Coupled Receptor Ste2. Mol Cell Biol. 34 (14), 2660-2681 (2014).
- Ghaddar, K., Merhi, A., Saliba, E., Krammer, E. M., Prevost, M., Andre, B. Substrate-Induced Ubiquitylation and Endocytosis of Yeast Amino Acid Permeases. Mol Cell Biol. 34 (24), 4447-4463 (2014).
- Becuwe, M., Léon, S. Integrated control of transporter endocytosis and recycling by the arrestin-related protein Rod1 and the ubiquitin ligase Rsp5. eLife. 3, (2014).
- Henne, W. M., Buchkovich, N. J., Zhao, Y., Emr, S. D. The Endosomal Sorting Complex ESCRT-II Mediates the Assembly and Architecture of ESCRT-III Helices. Cell. 151 (2), 356-371 (2012).
- Nickerson, D. P., Russell, M. R. G., Lo, S. -. Y., Chapin, H. C., Milnes, J. M., Merz, A. J. Termination of Isoform-Selective Vps21/Rab5 Signaling at Endolysosomal Organelles by Msb3/Gyp3. Traffic. 13 (10), 1411-1428 (2012).
- Nickerson, D. P., Merz, A. J. LUCID: A Quantitative Assay of ESCRT-Mediated Cargo Sorting into Multivesicular Bodies. Traffic. 16 (12), 1318-1329 (2015).
- Dulic, V., Egerton, M., Elguindi, I., Raths, S., Singer, B., Riezman, H. Yeast endocytosis assays. Methods Enzymol. 194, 697-710 (1991).
- Silve, S., Volland, C., Garnier, C., Jund, R., Chevallier, M. R., Haguenauer-Tsapis, R. Membrane insertion of uracil permease, a polytopic yeast plasma membrane protein. Mol Cell Biol. 11 (2), 1114-1124 (1991).
- Miliaras, N. B., Park, J. -. H., Wendland, B. The Function of the Endocytic Scaffold Protein Pan1p Depends on Multiple Domains. Traffic. 5 (12), 963-978 (2004).
- Vida, T. A., Emr, S. D. A new vital stain for visualizing vacuolar membrane dynamics and endocytosis in yeast. J Cell Biol. 128 (5), 779-792 (1995).
- Toshima, J. Y., Toshima, J., Kaksonen, M., Martin, A. C., King, D. S., Drubin, D. G. Spatial dynamics of receptor-mediated endocytic trafficking in budding yeast revealed by using fluorescent alpha-factor derivatives. Proc Natl Acad Sci U.S.A. 103 (15), 5793-5798 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены