Method Article
יישומים של pHluorin עבור כמותי, קינטי וניתוח תפוקה גבוהה של אנדוציטוזה שמרים הנצה
In This Article
Summary
Accurate quantification of vesicular trafficking events often provides key insights into roles for specific proteins and the effects of mutations. This paper presents methods for using superecliptic pHluorin, a pH-sensitive GFP variant, as a tool for quantification of endocytic events in living cells using quantitative fluorescence microscopy and flow cytometry.
Abstract
חלבון פלואורסצנטי ירוק (GFP) על גירסאותיה משמשים כלים נרחב ללימוד לוקליזציה חלבון ודינמיקה של אירועים כגון שיפוץ cytoskeletal וסחר שלפוחי בתאים חיים. מתודולוגיות כמותיות באמצעות התכת GFP כימרי פותחו עבור יישומים רבים; עם זאת, GFP הוא מעט עמיד proteolysis, ובכך הקרינה שלה נמשכת ליזוזום / vacuole, אשר יכול לעכב כימות של סחר המטען במסלול endocytic. שיטה חלופית לכימות אנדוציטוזה ופוסט endocytic אירועים סחר עושה שימוש superecliptic pHluorin, וריאנט pH רגיש של GFP כי הוא הרווה בסביבה חומצית. היתוך Chimeric של pHluorin לזנב cytoplasmic של תוצאות חלבונים מטען הטרנסממברני בתוך ריסון של הקרינה על ההתאגדות של המטען לתוך הגוף multivesicular (MVBs) והסעה לבית לומן ליזוזום / vacuole. לכן, מרווה הקרינה vacuolar מקלה quantifiקטיון של אנדוציטוזה ואירועים מוקדם מסלול endocytic. מאמר זה מתאר שיטות באמצעות מטענים מתויגים pHluorin כימות של אנדוציטוזה באמצעות מיקרוסקופ פלואורסצנטי, כמו גם מבחנים מבוססי אוכלוסייה באמצעות cytometry זרימה.
Introduction
סחר שלפוחי ממלא תפקיד חשוב בשמירה על הזהות אברון ותפקוד בתאים איקריוטיים, והוא מכשיר מרכזי להסדרת הרכב חלבונים בממברנה של תאים סלולריים הפרט. על הממברנה הפלזמה, שילוב של שלפוחית exocytic מספק חלבונים וממברנות חדשים אל פני השטח של התא, ואילו שלפוחית שנוצרה באמצעות אנדוציטוזה להסיר קרום וחלבונים מפני השטח למחזור עקב או מיקוד אל ליזוזום. לפיכך, אנדוציטוזה חשוב ספיגת חומרים מזינה ועל תגובות הסביבה התאית. Exocytosis ו אנדוציטוזה מאוזנים להסדיר שטח הממברנה, וכדי לאפשר מחזור של חלבונים פגומים.
עיונים שמרים בתאי יונקים זיהו מספר רב של חלבונים המעורבים אנדוציטוזה, כמו גם מסלולים endocytic מרובים שמקדמים הפנמה של מטענים ספציפיים או מעשה שיש בהם בתגובה במגוון enתנאים סביבתיים. מסלול-למד הכי טוב הוא אנדוציטוזה מתווכת clathrin (CME), שבו clathrin אביזר cytosolic חלבונים להרכיב למבנה מעיל לייצב את שלפוחית endocytic המתהווה. הניסויים cerevisiae Saccharomyces שמרים ניצני הניבו תובנות חשובות על הדינמיקה והסדר של גיוס חלבונים endocytic רבים 1-3. יש לציין, כי מכונה CME הוא שמור ביותר בתהליך האבולוציה כזה שרוב החלבונים הקשורים CME בשמרים יש orthologs אדם; וכך, נבגי שמרים כבר כלי חשוב להבנת המנגנונים של אנדוציטוזה כי הם משומר אאוקריוטים גבוה. לדוגמא, מחקרים באמצעות שמרי ניצנים נקבעו כי היווצרות והתבגרות של מבני CME (המכונה טלאים יקטינו קליפת מוח כמו שמרים) כרוך הגיוס הרציף של חלבונים רבים, החל clathrin וחלבוני מתאם מחייב למשא ואחריו גיוס של אבזר endocytic נוסף חלבונים,הפעלת Arp2 / פילמור אקטין 3 בתיווך, וגיוס של חלבונים המעורבים 1,2 scission שלפוחית. גיוס של חלבונים מכונים CME כדי קליפת מוח טלאים יקטינו הוא תהליך הורה מאוד וסטריאוטיפי, ואת הסדר המדויק של גיוס חלבונים רבים כבר נקבע ביחס לרכיבים אחרים של מכונות CME. חשוב לציין, מחקרים שנעשו לאחרונה אישרו צו דומה של גיוס חלבונים CME בבורות מצופה clathrin בתאי יונקים 4.
בנוסף CME, סוגי תאים רבים להחזיק אחד או יותר מסלולי endocytic עצמאי-clathrin (CIE) המסתמכים על מנגנונים חלופיים לקדם היווצרות שלפוחית והפנמה מן קרום הפלזמה 5-7. בשמרים, אנו לאחרונה זיהינו מסלול CIE אשר מנצל את Rho1 GTPase הקטן גורם חליפי נוקלאוטיד גואנין ההפעלה שלה (GEF), Rom1 8,9. Rho1 מפעיל את formin Bni1 לקדם פילמור אקטין 10,11, אשר נדרש עבור סוג זה של אנדוציטוזה עצמאית-clathrin בשמרים 12. יתר על כן, המשפחה-arrestin α של חלבונים לגייס את האנזים היוביקוויטין Rsp5 לקדם ubiquitination מטען והפנמה עוקבות דרך CME 13-17, וגם לקדם הפנמה מטענים דרך מסלול CIE, ואולי באמצעות אינטראקציה ישירה עם חלבונים המעורבים CIE 18. מגוון מסלולי CIE קיים גם בתאי יונקים, כוללים מסלולי clathrin-עצמאי phagocytic המסתמכים על ortholog Rho1, RhoA 9,19. תפקידו של RhoA ב יונקים CIE הוא הבין היטב; לכן, מחקרים בשמרי ניצנים עשויים לספק תובנות מכניסטית נוספים החלימו על CIE היונק.
כימות מדויק של אירועי endocytic יכול לספק מידע חשוב על התפקידים של חלבונים ספציפיים בויסות אנדוציטוזה, והוא יכול לחשוף את ההשפעות של מוטציות על הפנמת מטען או progression דרך מסלול endocytic. לשם כך, בשיטות ביוכימיות יכולות להיות מנוצלות כדי לפקח ספיג ליגנד או כדי למדוד את שיעורים של פירוק של חלבוני מטען endocytic. בתאים חיים, שילוב של חלבון פלואורסצנטי ירוק (GFP) על גרסותיה כדי מטעני עניין מאפשר הדמיה ישירה של כלי רכב כבדים. עם זאת, מטענים מתויג GFP הם של שימוש מוגבל כימות של אנדוציטוזה כי GFP הוא עמיד בפני פירוק בתוך ליזוזום (או vacuole בשמרים). יתר על כן, GFP הקרינה היא רק רגיש באופן חלקי לשינויים ב- pH, ונשאר לזיהוי בתוך vacuole לומן 20,21. כתוצאה מכך, הקרינה של תג ה- GFP נמשכת vacuole הרבה אחרי שאר המטען כבר מושפלת, ושלמי כימותים מבוססי תאים של עוצמת מטען עשויים להיות לא מדויקים בשל קרינת GFP לטווח ארוכה של vacuole.
על מנת להתגבר על החסרונות של GFP הקרינה vacuolar, אנחנו קודם לכן עשו שימוש pH supereclipticluorin, וריאנט רגיש-pH של GFP כי מאיר במאור ב- pH נייטרלי, אבל מאבד הקרינה בסביבה חומצית כגון לומן של vacuole / ליזוזום 20,22,23. הצבת תג pHluorin על הזנב cytoplasmic של מטענים endocytic היתרי להדמיה של מטענים על קרום פלזמה על endosomes מוקדם, שבו תג pHluorin נשאר חשוף אל הציטופלסמה (איור 1 א). כפי endosomes מוקדם להתבגר, במתחם מיון endosomal הנדרש להובלה (ESCRT) מטענים משטח-מקומי חבילות מכונות לתוך שלפוחית כי ניצן לתוך לומן של אנדוזום, יצירת גופים multivesicular (MVBs) 24. עבור מטענים כי שולבו שלפוחית MVB פנימית, תג pHluorin פונה כלפי לומן השלפוחית. שלפוחית MVB הפנימית acidified; וכך, מטענים מתויגים pHluorin לאבד קרינה על endosomes מוקדם כשהם מתבגרים לתוך MVBs 20. ההיתוך הבא של MVB עם vacuole מספק את תוכן luminal MVBהשפלה, ותגיות pHluorin נשארים הרווה בסביבה החומצית של לומן vacuole.
מאמר זה מספק תיאורים מפורטים של מבחני endocytic כמותית באמצעות מטענים עם תגי pHluorin ציטופלסמית בשמרים. זנים להביע מטענים מתויג pHluorin יכול לשמש מבחני קינטית ו / או נקודות קצה, בהתאם להתנהגות נכסים וסחר של מטענים ספציפיים. בנוסף, כמה מטענים מתויג pHluorin ניתנים שיטות ניתוח תפוקה גבוהה, כולל זרימת cytometry. חשוב לציין כי תג pHluorin הוא כלי תכליתי עבור חוקר ענייני endocytic בתאים חיים, המאפשר כימות של אנדוציטוזה והשוואה של פונקציה endocytic ב wild-type ו זנים מוטנטים.
Protocol
1. פתרונות ומדיה
- הכן את המניות, מדיה צלחות הבאות:
- כדי להכין 10x YNB, לפזר 67 גרם של בסיס שמרים חנקן חסר חומצות אמינו ב 1 ליטר של מים. לעקר על ידי סינון דרך פילטר nitrocellulose 0.22 מיקרומטר.
- כן בינוני YNB באמצעות YNB 1x (מ 10x מלאה) עם 2 דקסטרוז% (מתוך 50% סטרילי w / מניית v) תערובת חומצות אמינו 1x / מזין (מ 100x מניות, ראה שלב 1.1.4). לקבלת מבחר פלסמיד, להשמיט חומצות אמינו בודדות או חומרים מזינים לפי הצורך. לזירוז הביטוי Mup1, גם להשמיט מתיונין מתערובת חומצות אמינו / מזין.
- כן צלחות YNB באמצעות YNB 1x (מ 10x מלאה), 2% דקסטרוז (מתוך 50% סטרילי w / מניית v), 0.7 גר '/ ל אמינו תערובת חומצות / מזין (ראה שלב 1.1.5) ו -2.5% אגר. הכן בינוני הצלחת על ידי מעוקר 25 גרם של אגר ו -0.7 גרם של תערובת חומצות אמיניות / מזין לכל 860 מ"ל מים. אפשר לתערובת להתקרר עד 55 מעלות צלזיוס, ולאחר מכן להוסיף 100 מ"ל של 10x YNB ו -40 מ"ל oגלוקוז ו 50%. יוצקים צלחות (כ 30 מ"ל של מדיום לכל 10 צלחת ס"מ), לאפשר את המדיום כדי לחזק בטמפרטורת החדר, וצלחות ולאחסן ב 4 מעלות צלזיוס.
- כן פתרון מניות חומצה / מזין אמינו 100x (עבור במדיום נוזלי) על ידי המס את הדברים הבאים 100 מ"ל מים ללא יונים: 0.1 גרם L-מתיונין, 0.3 גרם כל אחד L-לאוצין ו- L ליזין, ו -0.2 גרם כל אחד L-היסטידין , L- טריפטופן, אדנין ו אורציל (חומצות אמינו וחומרים מזינים אחרים עשויים להיכלל כנדרש עבור זנים ספציפיים). השתמש חום עדין במידת הצורך לפזר, לעקר דרך פילטר nitrocellulose 0.45 מיקרומטר. אחסן בטמפרטורת חדר עם הגנה מפני אור. לקבלת מבחר פלסמיד, להכין פתרונות מניות חסרי רכיבים ספציפיים לפי צורך.
- הכן חומצה אמינו / תערובת מזין (עבור צלחות) על ידי שילוב של הבאים: 0.5 גר 'אדנין, 4 גרם של-לאוצין L, ו -2 גרם כל אחד היסטידין L, L ליזין, L- מתיונין, L- טריפטופן, L- טירוזין אורציל. טוחנים עם ובמכתש, ולאחסן עם פרוtection מן האור. לקבלת מבחר פלסמיד, להכין תערובות חסרות רכיבים ספציפיים לפי צורך, ולהשתמש 0.7 גרם של תערובת חומצות אמינו לליטר בינוני צלחת (ראה שלב 1.1.3).
- כן שקופיות קאמריות 8 היטב במיקרוסקופ על ידי ציפוי פני השטח של שקופית עם concanavalin (ConA). זה טוב של השקופית קאמרית, להוסיף 25 μl של 2 מ"ג / מ"ל ConA מומס במים. בעזרת קצה פיפטה, להפיץ את ConA על פני השטח התחתון של הבאר, ואז לאפשר את השקופית אוויר יבש בטמפרטורת החדר למשך לפחות 4-8 שעות. באופן אידיאלי, להשתמש שקופיות קאמריות תוך 24 שעות של ציפוי ConA.
- צור זני שמרים עם התכה בתוך המסגרת של GFP או pHluorin למטען endocytic עניין באמצעות תגובת שרשרת פולימרז (PCR) שיטת אינטגרציה מבוססת מתואר Longtine et al. ו גולדשטיין McCusker 25,26.
הערה: פלסמידים המכילים pHluorin תיוג קלטות עם גנים התנגדות עבור kanamycin (KANMX6) ו nourseothricin ( NATMX4) תוארו בעבר 20.- להגביר קלטות GFP או pHluorin המכילות סמנים לבחירה עם פריימרים המכילים רצפים נוספים ספציפיים לאתר של אינטגרציה הגנומי 20,25.
- להפוך את מוצר PCR שנוצר לתוך זן שמרים הרצוי בשיטה תצטט ליתיום 27.
- בחר לשילוב של הקלטת על ידי גידול תאים על צלחות YPD המכילות את התרופה המתאימה. כדי להכין צלחות, תמצית שמרים החיטוי 10 גרם, 20 גרם peptone, טריפטופן 0.1 גרם ו 25 אגר גרם 960 מ"ל מים. לפני לשפוך צלחות, לאפשר לתערובת להתקרר עד 55 מעלות צלזיוס, ולאחר מכן להוסיף 40 מ"ל של 50% גלוקוז או G418 לריכוז סופי של 200 מיקרוגרם / מ"ל לבחירה KANMX6, או nourseothricin לריכוז סופי של 100 מיקרוגרם / מ"ל עבור מבחר NATMX4.
- אשר שילוב של GFP או תג pHluorin במושבות הפרט על ידי PCR ו / או המערבי סופג באמצעות נוגדנים אנטי GFP,כמו גם על ידי זיהוי של חלבון מתויג על ידי מיקרוסקופ פלואורסצנטי 20.
הערה: זני שמרים ספציפיים פלסמידים השתמשו במחקר זה מפורטים בלוחות 1 ו -2, בהתאמה.
2. Assay Endpoint של קרינה יציבה של מטעני constitutively הפנים endocytic
- לחסן תאים (~ 3 מושבות קטנות) ב 5 מיליליטר של מדיום YNB חסר חומצות או חומרים מזינים האמין כנדרש לצורך תחזוקת פלסמיד (אם זה אפשרי). לגדל תאים במשך 16-24 שעות באינקובטור רועד מסלולית ב 30 מעלות צלזיוס, עם 250 סל"ד רועד. לחלופין, פס ~ 1-2 מושבת מ"מ של תאים על גבי צלחת YNB חסר חומצות אמינו או חומרי הזנה עבור מבחר פלסמיד, ולגדול תאי הלילה ב 30 מעלות צלזיוס.
- מדוד את הצפיפות (OD 600) של כל תרבות הלילה באמצעות ספקטרופוטומטר. הכן דילול 5 מ"ל ב 0.35-0.4 OD 600 מ"ל / במדיום YNB חסר חומצות אמינו או חומרי הזנה עבור PLAתחזוקת סמיד, ולגדול במשך כ 3 שעות ב 30 מעלות צלזיוס עם רעד. אם תאים באמצעות מפוספסים על צלחת, לדלג על שלב זה ולהמשיך עם שלב 2.4 (ראה להלן).
- מדוד את צפיפות (OD 600) של תאים, אשר אמור להיות עכשיו בין 0.6-1.0 OD 600 / מ"ל. העבר 1.5 מ"ל של התרבות לצינור microfuge, ותאי גלולה ב 8000 סל"ד (6,800 XG) במשך 2 דקות. הסר 1,475 μl של supernatant.
- תביא לתאים מיקרוסקופ פלואורסצנטי. לפני הדמית מדגם זה, להכין שקופיות על ידי resuspending התאים במדיום הנותר, ו הר 3 μl של השעית תא תחת להחליק את מכסה. לחלופין, להכין שקופיות קאמריות 8-גם כמתואר להלן פרוטוקול 3, באמצעות מדיום YNB בהתאם מבחר פלסמיד. באופן אידיאלי, תאי תמונה עם 100X, 1.4 או צמצם מספרי גבוהה (NA) עדשה אובייקטיבית טבילה שמנה, מצלמת 12 או 16 סיבית, ומסנני עירור / פליטה מותאם במיוחד GFP קרינה.
הערה: אם תאים באמצעות גדלת פסי oצלחת נה, להכין את השקופית על ידי הנחת 3 μl של המדיום YNB טרי על להחליק את המכסה. בעזרת קצה פיפטה, לאסוף מושבה קטנה של תאים מהצלחת, לפזר את התאים לתוך מדיום YNB, ולעגן את ההשעיה וכתוצאה בשקופית זכוכית מייד לפני ההדמיה. - תמונה 4-6 שדות אקראיים של תאים עבור כל תנאי, באמצעות אותם פרמטרי הרכישה (כלומר, מערכות סינון וזמן חשיפה) עבור כל התמונות במסגרת ניסוי.
הערה: גביית brightfield או תמונה DIC עבור כל שדה יכול להיות מועיל עבור תאים שבהם האות pHluorin הוא הרווה ב MVB ותאים vacuolar. - לכמת עוצמת קרינה של לפחות 30-50 תאים עבור כל תנאי (ראה פרוטוקול 5).
3. Assay קינטי עבור כימות של אנדוציטוזה של מטענים העוברים אנדוציטוזה מווסת
- לחסן 2-3 מושבות של תאים שמרים (כ -2 מ"מ קוטר לכל מושבה) ב 5 מ"ל של מדיום YNB חסר מתיונין ולהוסיףחומצות אמינו או חומרים מזינים itional לשמירת מבחר פלסמיד. לגדול תרבויות במשך 16-24 שעות ב 30 מעלות צלזיוס עם רעד.
הערה: במאמר זה, פרוטוקולים ללימוד חלבוני מטען endocytic מוסדרים יעשו שימוש של מתיונין permease, Mup1. מטענים אחרים אשר עוברים אנדוציטוזה מוסדרת מתאימים גם עבור תיוג עם pHluorin (למשל, אורציל permease Fur4 אשר נערם על הממברנה הפלזמה בהעדר אורציל, ומפנה בתגובה לשימוש חיצוני אורציל); עבור מטענים אלה, צריכים להיות שונים תנאי תקשורת על מנת לשקף את הביטוי המבוקש, תנאי אינדוקציה והפנמה עבור מטען. - מדוד את הצפיפות (OD 600) של כל תרבות הלילה כ 3 שעות לפני ההדמיה. הכן דילול 5 מ"ל ב 0.35-0.4 OD 600 / מ"ל במדיום YNB חסר מתיונין אמינו נוספות חומצות או חומרים מזינים עבור תחזוקה פלסמיד, ולצמוח בקצב של 30 ° C עם רעד.
- טרום לאזן את microsלהתמודד קאמרי או שלב מחומם סביבתיים (אם קיימים) עד 30 מעלות צלזיוס במהלך דגירת 3 השעות של שלב 3.2.
- העברת 1 מ"ל של תרבית תאים לצינור microfuge, ותאי גלולה ב 8000 סל"ד (6,800 XG) במשך 2 דקות. הסר 975 μl של supernatant.
- כן שקופית קאמרית ConA שטופלה, 8-גם עם רצפת זכוכית הדמיה (פרוטוקול 1.2).
- הוסף 200 μl של מדיום YNB חסר מתיונין אמינו נוסף חומצות או חומרים מזינים לבחירה פלסמיד זה טוב. Resuspend התא גלולה משלב 3.4 ב supernatant הנותרים, ושחרר 2.5 μl של השעיה התא לתוך במרכז כל טוב. לפזר תאים על פני השטח של הבאר ידי pipetting למעלה ולמטה, ולאפשר לתאים להסתפק 5-10 דקות.
- מניח את השקף הקאמרי על מיקרוסקופ פלואורסצנטי ההפוך equilibrated עד 30 ° C (ראה שלב 3.3). אתר בתחום של תאים באמצעות תאורה brightfield.
- הוסף 50 μl של המדיום YNB המכיל מתיונין 100 מיקרוגרם / מ"ל(מחומם מראש ל 30 מעלות צלזיוס) עד 200 μl של בינוניים הבאר כדי להשיג ריכוז מתיונין סופי של 20 מיקרוגרם / מ"ל. למנוע שיבוש בינוני הבאר על מנת למנוע את התאים מפני צף מלמטה.
- אפשר התאים לאזן במשך 2 דקות לפני תחילת הדמיה. מייד לפני צילום התמונה הראשונה, להתאים את מיקרוסקופ כדי במישור המוקד הרצוי (בדרך כלל, מטוס מוקדים משווני עובד הכי טוב).
- רוכשת GFP ו brightfield (או DIC) תמונות ב 5 מרווחי דקות במשך 45-60 דקות, באמצעות פרמטרי רכישה זהים עבור כל התמונות בתוך סדרה עתית (למשל, טבילה אובייקטיבית שמן 100X 1.4 NA ו -500 זמן רכישת msec באמצעות מסנן GFP, 100 זמן רכישה msec באמצעות מסנן DIC).
הערה: אם של הבמה מיקרוסקופ ותוכנת הדמיה לא לאפשר תיקון אוטומטי של סחיפת מישור מוקד, ייתכן שיהיה צורך להתקין מחדש את הפוקוס באופן ידני לפני כל זמן הדמית נקודה. יתר על כן, פעמי רכישהלהשתנות בין מיקרוסקופים בשל הבדלי תאורה וכן מסננים, צריכים להיקבע תנאים אופטימליים לפני ידני תחילת הניסוי. אם מטען endocytic מלבד Mup1 משמש, זה עשוי להיות נחוץ כדי לשנות את מרווחי רכישת זמן הדמיה, כמו גם את משך הניסוי, על מנת לשקף את קינטיקה הפנים כי מטען. - לכמת עוצמת הקרינה של תאים בודדים בכל נקודת זמן (ראה פרוטוקול 5), ולהביע את הערכים כאחוז עוצמת הראשונית של התמונה הראשונה.
4. Assay Endpoint של כימות מטעני endocytic שעוברים אנדוציטוזה מווסת
- כן תאי הדמיה כמתואר בפרוטוקול 3 (שלבי 3.1 דרך 3.6).
- תמונה 4-5 שדות אקראיים של תאים עבור כל תנאים מייד לפני הוספת מתיונין, באמצעות ערכות brightfield ו- GFP מסננים.
- הוסף 50 μl של המדיום YNB המכיל מתיונין 100 מיקרוגרם / מ"ל (לפני המלחמהmed עד 30 מעלות צלזיוס) עד 200 μl של בינוניים הבאר כדי להשיג ריכוז מתיונין סופי של 20 מיקרוגרם / מ"ל. למנוע שיבוש בינוני הבאר על מנת למנוע את התאים מפני צף מלמטה.
- תמונת 4-5 שדות אקראיים של תאים 30 דקות אחרי תוספת של מתיונין, באמצעות אותם פרמטרי הרכישה עבור נקודת זמן 0 דקות (שלב 4.2).
- לכמת עוצמת קרינה של לפחות 30-50 תאים עבור כל נקודת זמן (ראה פרוטוקול 5). ערכים אקספרס כאחוז Mup1-pHluorin הפנימו לאחר 30 דקות באמצעות הנוסחה: [Mean עוצמת ב 0 דק '- Mean עוצמת ב 30 דק'] / [Mean עוצמת ב 0 דקות] x 100%.
הערה:. אפשר לבצע בו זמנית לשמונה מבחני נקודות קצה על ידי מזעזע את שעת ההתחלה של כל assay טבלה 3 מספק עבודה למשל במשך שמונה מבחני סימולטני.
5. לאחר רכישת ניתוח
- יצוא תמונות מתוכנת רכישה כהצגת 16 סיבי פורמט קובץ דימוי מתויג (.tif או .tiff).
הערה: פורמטים של קבצים אחרים עשויים גם להיות מתאימים, ורצוי להשתמש אלגוריתמי דחיסה lossless. תמונות 8 סיביות הן בדרך כלל אינן מתאימות למטרות כימות. - פתיחת קבצים באמצעות תוכנת ImageJ (זמינה באופן חופשי בהתאם לשיקול 'פתח' בתפריט 'הקובץ'. השתמשו תמונת קרינת כימות, ותמונת brightfield / דסק"ש כהתייחסות לזהות את המיקום של תאים שלא לכלול תאים מתים (אם קיים ), אשר מופיעים כהה יותר תאים חיים כאשר נצפים על ידי דסק"ש והם autofluorescent כאשר צפו עם מסנני עירור GFP / פליטה.
- בצע רקע חיסור על תמונת הקרינה. לקבלת תמונות עם אות רקע אחיד, להשתמש באלגוריתם "חיסור רקע 'נמצא' תפריט התהליך '. השתמש הגדרת ברירת המחדל (מתגלגל רדיוס כדור של 50 פיקסלים), וזה מספיק בדרך כלל למטרות כימות.
הערה: כרטיס backgro חלופישיטת חיסור und עבור תמונות עם רקע אחיד המתואר בשלב 5.3.1.-5.3.2; עם זאת, השיטה הנ"ל פועלת גם עבור רקע אחיד.- לקבלת תמונות עם רקע אחיד (כלומר, עוצמת רקע היא כ קבועה בכל בקצוות במרכז התמונה), לבצע חיסור רקע ידני. לחץ על הכפתור 'הבחירות חופשיות' נמצא בחלון ImageJ הראשי, ובחר 3-5 אזורים אקראיים בתוך התמונה שאינו מכיל תאים.
- פתח את הפונקציה 'מדידות הגדר' ממוקם בתפריט 'ניתוח', לבחור את הפרמטר "Mean גריי ערך ', ולמדוד ערכי העוצמה באמצעות הפונקציה' מדוד '(נמצא גם בתפריט' ניתוח '). חשב את הערך הממוצע 3-5 האזורים נמדד, ולחסר מכל המידות הבאות באותו דימוי.
- עבור כימות של מבחני הקינטית (פרוטוקול 3), ליצור תמונה אחת, מוערמים על timסדרת ה. פתח את התמונות הקרינה מן כל נקודת זמן בסדר כרונולוגי, וליצור ערימות באמצעות 'תמונות כדי סטאק' פונקציה (שנמצאת בתפריט 'תמונה', תחת תפריט המשנה סטאקס).
- מיתאר תא באמצעות כלי הבחירה ביד חופשית, והקפד לכלול את כל התא אך שטח קטן כמו החיצוני של התא ככל האפשר.
- מדוד את הפרמטרים הבאים: 'ישיבה, צפיפות משולבת' ו 'ערך הממוצע גריי ". פרמטרים בחרו באמצעות הפונקציה 'מדידות גדר ", הממוקמת בתפריט' ניתוח '.
הערה: הצפיפות משולבת תואמת את הסכום של כל עוצמות פיקסל בתוך האזור הנבחר, ולהתכוון גריי ערך מקביל [משולב צפיפות / Area], מתקנת ערכים עוצמים עבור גודל תא. - פתח את 'מנהל ROI' ממוקם בתפריט 'ניתוח', תחת תפריט המשנה 'כלים'. בחלון מנהל ROI, לחץ על הכפתור "הוסף" כדי להיכנס Regio המודגשתn כאזור חדש של (ROI) ריבית.
- חזור על שלבים 5.4 דרך 5.6 עבור התאים הנותרים בתמונה. אל תכלול את כל תאים מתים לפי הערכת brightfield / דסק"ש קרינה (תאים מתים להופיע כהים בתמונות DIC, ויש אות ציטופלסמית autofluorescent כאשר צפו עם / פליטת עירור GFP, ראו האיור 2F), וכל תאים לגעת בשולים של התמונה. שמור את ROIs נבחרים כקובץ .zip על ידי לחיצה על כפתור 'עוד' בחלון 'מנהל ROI', ולייצא כל המדידות לגיליון אלקטרוני או תוכנת ניתוח סטטיסטי.
- עבור כימות של מבחני הקינטית (פרוטוקול 3), מתאר ולמדוד תא מנקודת זמן הראשונית כמתואר בשלבים 5.4 ו -5.5. השתמש ROI אותו למדידה בכל נקודות הזמן שלאחר מכן בניסוי.
- עבור מבחני סיום (פרוטוקולים 2 ו -4), למדוד מינימום של 30-50 תאים עבור כל תנאי. בצע כימות במשך 2-3 תמונות לפחות, וכוללים את כל התאים בכלתמונה עומדת בקריטריונים המפורטים בשלב 5.8 בניתוח.
- הערכה מובהקת סטטיסטי בין דגימות באמצעות ANOVA חד-כיווני, ואחריו מבחן ההשוואה הנפוץ של Tukey לניתוח פוסט הוק.
ניתוח אוכלוסייה 6. Mup1-pHluorin אנדוציטוזה ידי cytometry זרימה
- לחסן 2-3 מושבות של תאי שמרים (כ -2 מ"מ קוטר לכל מושבה) ב 0.5 מיליליטר של מדיום YNB חסר מתיונין וחומצות אמינו נוספים או חומרים מזינים לשמירת מבחר פלסמיד. לגדל תאים 5 מ"ל צינורות מסביב לתחתית במשך 16-24 שעות ב 30 מעלות צלזיוס על תוף הרים.
- הוסף 1.5 מיליליטר של מדיום YNB חסר מתיונין אמינו נוסף חומצות או חומרים מזינים עבור תחזוקת פלסמיד, ולצמוח בקצב של 30 מעלות צלזיוס למשך שעה 3 נוספת על תוף הרים.
- העברת 1 מ"ל של תאים לתוך כל אחד משני 5 מ"ל מסביב לתחתית צינורות. להוסיף 0.25 מ"ל של מדיום YNB -Met אל הצינור הראשון (מצב -Met), ו -0.25 מ"ל של מדיום YNB המכיל 100 מיקרוגרם/ מ"ל מתיונין אל הצינור השני לתת הריכוז מתיונין סופי של 20 מיקרוגרם / מ"ל (+ מצב Met). דגירת תאים ב 30 מעלות צלזיוס למשך 45 דקות על תוף הרים.
- לנתח את התאים על ידי זרימה cytometry, בחירת קדימה פיזור (FS) כמדד גודל התא, ועוצמת הקרינה Mup1-pHluorin מתוך isothiocyanate והעמסת (FITC) מסנן כמדד הפנמה המטען.
- השתמש בלחצני המחוון כדי להתאים את המתח של FS וערוצי FITC לייעל גילוי עוצמת מגוון הקרינה גודל התאים שמרים בשימוש (לניסויים אלה, הגדרות השתמשו היו 50 V עבור FS ו -400 V עבור FITC).
הערה: מתח עבור שני הערוצים ישתנה בהתאם cytometer את הזרימה בשימוש. צעד זה צריך להיעשות לפני או במהלך הטיפול 45 דקות עם מתיונין (שלב 6.3). - מדוד FS ועוצמת קרינה עבור 10,000 תאים מכל מצב, באמצעות הגדרת קצב זרימה הגבוהה. צור עלילת פיזור של FS נגד fluorescence עוצמת: לחץ על 'להוסיף גרף', בחר FITC (ציר x) ו FS (ציר y), ונקודות גרף 1,000 (התוכנה תציג ערכים עבור 1,000 תאים, למרות 10,000 תאים נמדדו).
הערה: לקבלת עקביות מקסימלי, לאבחון תאים 45-50 דקות אחרי תוספת של מתיונין; עבור ניסויים מעורבים מספר רב של דגימות, להתנודד תוספת של מתיונין כדי להתאים את הזמן הנדרש לניתוח cytometry זרימה. - כלול תנאי -Met ו + Met עבור wild-type (WT) תאים כביקורת. שימוש בפונקציה השער, להקצות השער אנכי באמצעות התנאי Met WT +, כך כ 5% מכלל התאים הבהירים ליפול בצד ימין של השער. השתמש gating זה עבור כל יתר התנאים בניסוי.
תוצאות
לוקליזציה וכימות יציבים של חלבון מטען endocytic הפנים constitutively Ste3
על מנת להוכיח כי מטענים מתויג pHluorin יכול להיות מנוצל עבור כימות של אנדוציטוזה בתאים חיים, לוקליזציה של ה- GFP כימרי ו התכה pHluorin עם הזנב C- מסוף cytoplasmic של Ste3, הקולטן פרומון א-גורם בשמרים, הושוו. Ste3 הוא קולטן המצומד לחלבון G (GPCR) כי מועבר constitutively קרום הפלזמה, הפנים, וממוקד אל vacuole שפל 28. לכן, בתנאים יציבים, רוב Ste3 localizes לומן vacuole, כפי שניתן לראות wild-type (WT) תאי מבטאי Ste3-GFP (איור 2 א). לעומת זאת, תאים החסרים את הגנים המקודדים את ארבעת החלבונים מתאם מחייב clathrin Ent1, Ent2, Yap1801 ו Yap1802 (ent1 Δent2 Δ Δ yap1801 yap1802 Δ, להלן המכונה 4Δ) מצליחים לייצב clathrin באתרים של אנדוציטוזה 29, והם פגומים קשות CME 30. תאים 4Δ דורשים ביטוי epsin N-terminal הומולוגיה (enth) מושלם של כל אחד Ent1 או Ent2 עבור 30,31 הכדאיות. התחום enth אינו מספיק עבור אנדוציטוזה ב 4Δ תאים, כפי שמוצג על ידי שימור של Ste3-GFP על הממברנה פלזמה בתאים 4Δ + ENTH1 המבטא את תחום enth של Ent1 (איור 2 א) 8,30; שימור קרום הפלזמה דומה בתאים 4Δ + ENTH1 נצפתה עבור מטענים endocytic אחרים, כולל Ste2-GFP (הקולטן פרומון גורם α) ו Mup1-GFP או Mup1-pHluorin (א permease מתיונין) 8,18. לעומת זאת, הביטוי של באורך מלא Ent1 מתוך פלסמיד בתאי 4Δ (4Δ + Ent1) משחזר אנדוציטוזה ולוקליזציה של Ste3-GFP אל vacuole. תאים 4Δ + ENTH1 שימשו לאחרונה אנימסך גנטי נה לזהות מסלול CIE בשמרים המסתמכת על אקטין ויסות GTPase Rho1 שלה GEF, Rom1, כמו גם את formin Bni1 וחברי המשפחה α-arrestin של חלבונים המעורבים מטען מיון 8,18. עולה בקנה אחד עם תפקיד CIE, ביטוי ROM1 או LDB19 α-arrestin מן פלסמידים גבוה עותק 4Δ + ENTH1 תאים השתפרו הפנמת Ste3-GFP (איור 2 א).
תאים להביע Ste3-GFP או מטענים endocytic GFP-tagged אחרים יש vacuoles בהיר עקב הצטברות והתנגדות פרוטאוליטים של תג ה- GFP. לעומת זאת, תאים המבטאים Ste3-pHluorin יש רמות נמוכות מאוד של קרינת vacuolar בשל מרווה של תג pHluorin בסביבה חומצית 20. כפי שניתן לראות בעבר, WT ו 4Δ + Ent1 התאים הראה מעט מאוד לזיהוי Ste3-pHluorin ידי מיקרוסקופ פלואורסצנטי (איור 2 ב). לעומת זאת, Ste3-pHluorinלא הורגש בקלות על קרום הפלזמה של תאי 4Δ + ENTH1, בעוד vacuolar Ste3-pHluorin נשאר כמעט בלתי מורגש בכל המקרים. ביטוי גבוהה עותק של ROM1 או LDB19 הפחית את כמות Ste3-pHluorin לזיהוי על פני התא, תוצאות דומות עם Ste3-GFP, למרות vacuolar Ste3-pHluorin נשאר לגילוי כמעט בכל המקרים.
כדי להשוות את מידת היעילות של GFP- ו pHluorin מתויג מטענים ככלים לכימות שינויים קיבולת endocytic של תאים, הקרינה כל תא של Ste3-GFP ו Ste3-pHluorin נמדדה WT ו 4Δ תאים. למרות השינויים לוקליזציה Ste3-GFP היה ניתן להבחין בהן בקלות על ידי מיקרוסקופ (איור 2 א), ההבדלים בעוצמת הקרינה הכוללת לא היו משמעותיים סטטיסטית בין WT, 4Δ + Ent1 ו 4Δ + ENTH1 תאים הפך עם וקטור ריק (איור 2 ג) 20. Likewisדואר, תאי 4Δ + ENTH1 הפכו עם וקטור, ROM1 ו LDB19 היו עוצמות קרינה כל תא דומה. יש לציין, תאי 4Δ + ENTH1 הפכו עם ROM1 או LDB19 היו דימר משמעותי מאשר תאי WT (איור 2 ג) 8,18; עם זאת, רמות החלבון Ste3-GFP היו דומות כפי שהוערך על ידי immunoblotting (איור 2E). אמנם ההבדל בעוצמת עשויה לנבוע בחלקם משינויים בגודל vacuole או מורפולוגיה, או להבדלים בשייר של תג ה- GFP ב vacuole, כימות של הקרינה Ste3-GFP אינו משקף את השינויים לוקליזציה שנצפו על ידי מיקרוסקופ פלואורסצנטי (איור 2A). לעומת זאת, כימות של עוצמת Ste3-pHluorin הראתה כי תאי 4Δ + ENTH1 הפכו עם וקטור היו בהירים משמעותיים מאשר תאי WT או 4Δ + Ent1, וביטוי גבוה עותק של ROM1 או LDB19 בתאים 4Δ + ENTH1 מופחת Ste3-pHluorin אינטנסיביתלרמות שהיו דומים WT ו 4Δ + Ent1 (איור 2 ד). לכן, כימות של עוצמת היציבה Ste3-pHluorin משקפת נאמנה את הבדלי לוקליזציה שנצפתה על ידי מיקרוסקופ פלואורסצנטי.
מבחני הפנמה קינטי באמצעות מטען endocytic מוסדר, Mup1
כימות של עוצמת קרינה עבור מטענים הפנימו constitutively בבית יציב יכולה לחשוף הבדלים ביכולת endocytic של תאים מוטנטים לעומת תאי WT. עם זאת, יתכן כי מטענים מסוימים עשויים להגיע לאותה חלוקה יציבה ועצמת תאי מוטנטים WT ו endocytic, למרות תאי מוטנטים יש עיכוב אנדוציטוזה או איטית קינטיקה להפנמת מטען. במקום זאת, מטענים מתויג pHluorin שעוברים אנדוציטוזה מוסדר בתגובה לגירוי מסוים או ליגנד יכול לשמש כדי לפקח עלקינטיקה של אנדוציטוזה. לשם כך, הפנמה של permease מתיונין גבוהה זיקה, Mup1, היה פיקוח 32. בהעדר מתיונין התאי, ביטוי Mup1 הוא שהוגבר, ואת permease נשמרת על הממברנה הפלזמה; על תוספת של מתיונין למדיום, Mup1 עובר הפנמה מהירה ומיקוד אל vacuole 13.
כדי לפקח על קינטיקה של הפנמה Mup1, זנים WT להביע Mup1-GFP או Mup1-pHluorin מן מוקד גנומית גדלו בהעדר מתיונין כדי לצבור Mup1 ניאון על הממברנה פלזמה (איור 3 א, 0 דקות נקודת זמן). זמן לשגות הדמיה של תאים בוצעה אז ב 5 מרווחי דקות בהעדר או בנוכחות מתיונין לפקח הפנמת מטען ושינויי קרינה. כצפוי, GFP- ו pHluorin מתוייגים Mup1 צילמו בהעדר מתיונין נשאר בבית f קרום הפלזמהאו תקופת 45 דקות תצפית כולו 20. לעומת זאת, תאים צלמו בנוכחות מתיונין הראו דלדול הדרגתי של אות הקרינה מתא השטח, עולה בקנה אחד עם הפנמת מטען. יש לציין, הקרינה Mup1-GFP שהצטבר מבנים פנימיים (כלומר, endosomes ואת vacuole), ואילו Mup1-pHluorin מקומי punctae פנימי מתאימות עשוי endosomes מוקדם, אבל לא לראות vacuole.
כאשר הקרינה הייתה לכמת בכל נקודות הזמן עבור תאים בודדים, Mup1-GFP ו Mup1-pHluorin עוצם הראה שינוי קטן בהיעדר מתיונין לשימוש חיצוני במהלך ניסוי 45 דקות, עולה בקנה אחד עם חלבון נותרים מקומיים ביציבות אל קרום הפלזמה (איור 3 ב). לעומת זאת, כל תא Mup1-pHluorin עוצם ירד במהירות בנוכחות מתיונין, כך ירידה של 50% בשנת fluorescencעוצמת ה נצפתה לאחר כ 20-25 דקות, ולאחר הפחתה של 80% נצפתה לאחר כ 40 דקות 20. Mup1-GFP תאים הראו גם ירידה בעוצמת הקרינה על תוספת של מתיונין; עם זאת, קינטיקה של אובדן קרינה עוכבה בהשוואה לאלו של Mup1-pHluorin, כך ירידה של 50% בעוצמת נצפתה רק לאחר 40 דקות. כפי שניתן לראות באיור 3 א, Mup1-GFP לא הורגש בקושי על הממברנה הפלזמה בשלב זה, המציין כי קרינת GFP vacuolar מתמשכת מנעה כימות מדויק של אירועי endocytic על פני התא.
מבחני Endpoint באמצעות מטען endocytic מוסדר, Mup1
בנוסף כמותיים, מבחני הקינטית של אנדוציטוזה כמתואר לעיל, מטענים endocytic מוסדר כגון Mup1 יכול לשמש גם עבור מבחני הסיום, בדומה כימותשל מצב יציב עוצם Ste3-pHluorin. לשם כך, assay כימות של הפנמת Mup1-pHluorin שונה כדי לאפשר השוואה של עוצמות קרינה ממוצעות מתחיילים אוכלוסיות של תאים צלמו מייד לפני או 30 דקות אחרי תוספת של מתיונין 8,18. גישה זו מאפשרת השוואה של אחוז Mup1 הפנימו בין תאים מוטנטים WT ו endocytic.
בהסכם עם התוצאות של assay הקינטית (איור 3), Mup1-pHluorin היה מדולדל במהירות מן קרום הפלזמה בתאי WT (איור 4 א), כך כ -60% Mup1-pHluorin הופנמו 30 דקות אחרי תוספת של מתיונין ( איור 4B). כצפוי, הפנמת Mup1-pHluorin הייתה יעילה באופן דומה 4 + Ent1 תאים, בעוד הפנמה צומצמה משמעותית בתאי 4Δ + ENTH1, עולים בקנה אחד עם פגם חמור אנדוציטוזה. ביטוי גבוה עותקשל ROM1 או LDB19 α-arrestin, אשר נדרש במיוחד עבור הפנמה Mup1 באמצעות שני CME ו CIE מסלולים 13,18, הפנמה משופרת של Mup1-pHluorin, עולה בקנה אחד עם היכולת שלהם לקדם אנדוציטוזה בתאים 4Δ + ENTH1 18. יש לציין, כי עוצמת היציבה Ste3-pHluorin בתאים 4Δ + ENTH1 להביע ROM1 גבוה עותק או LDB19 היה נבדל תאי WT או 4Δ + Ent1, הפנמת Mup1-pHluorin הייתה רק השתפרה חלקית בתאים 4Δ + ENTH1 להביע עותק גבוה ROM1 או LDB19 (איור 4C). לפיכך, נתונים אלה מצביעים על כך מבחני קינטית ו / או נקודת סיום יכולים לחשוף הבדלים בשיעורי endocytic בין WT ו זנים מוטנטים עבור מטענים מסוימים, למרות הפצה יציבה דומה של מטענים אחרים עשויה להיות מושגות באותו זנים.
מבוסס אוכלוסיה ניתוח Mup1-PHLuorin הפנמה באמצעות cytometry זרימה
ניתוח תפוקה גבוהה של באוכלוסיות גדולות של תאים באמצעות cytometry זרימה יכולה לספק אלטרנטיבת ביצוע מבחני הקינטית נקודות קצה עבור הפנמת מטען על ידי מיקרוסקופ. לשם כך, עוצמת הקרינה של Mup1-pHluorin הושווה בתאים WT מתרבות גדל בהעדר מתיונין (WT -Met, שאמור להיות "מבריק") או בנוכחות מתיונין במשך 45 דקות (Met + WT, שאמור להיות "לעמעם" בהשוואה לתאים שלא טופלו על רקע הפחתת 80% בעוצמת קרינה שניתן לראות באיור 3 ב '). לאחר ניתוח על ידי cytometry זרימה, שער אנכי היה מוחל על המצב + Met WT, שם ~ 5% של תאים היו כלולים בצד הימני של השער, והיא תואמות את התאים הבהירים בתוך האוכלוסייה (איור 5 א ו 5 ב , אוכלוסייה אדומה). כשאותם השער יושםלמצב WT -Met, כ 65% מתאי נפל לתוך הקטגוריה בהיר, הוכחת cytometry זרימה שניתן להשתמש בהם כדי להבחין בשינויים בקלות בעוצמת הקרינה Mup1-pHluorin בין אוכלוסיות של תאים לפני ואחרי תוספת של מתיונין. לעומת זאת, החלוקה בהירה לעומת תאים עמומים הייתה מובחנת 4Δ + ENTH1 -Met ו + Met תנאי שימוש באותו השער להחיל אוכלוסיית Met WT +, עולה בקנה אחד עם אנדוציטוזה הפגום. לפיכך, cytometry זרימה יכול לזהות שינויים קיבולת endocytic של תאים, ומתיר ניתוח מהיר של אוכלוסיות גדולות של תאים. חשוב לציין, cytometry זרימה יכול לשמש גם מסכי גנטית ככלי למיון וגיוס כוח תאים מוטנטים עם אנדוציטוזה פגום (ק Wrasman ו- B. Wendland, כתב היד בהכנה) 33.
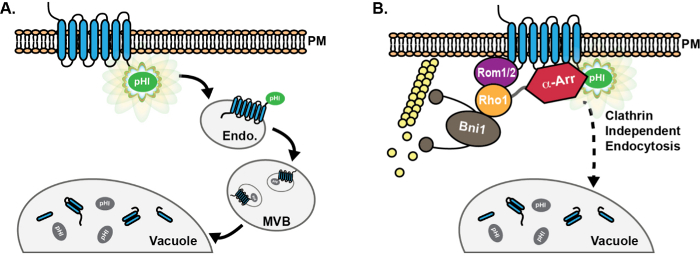
איור 1: סכמטי של התקדמות משא-tagged pHluorin דרך מסלול endocytic. (א) היתוך Chimeric של pHluorin (PHL) תג על הזנב cytoplasmic של תוצאות חלבונים מטען endocytic הקרינה לזיהוי (ירוק) של המטענים בנמל הממברנה (PM ). בעקבות אנדוציטוזה, חלבוני מטען מועברים אנדוזום מוקדם (Endo), שבו תג pHluorin נשאר חשוף אל הציטופלסמה, ולכן הוא ניאון. כתוצאה מכך, מכונית ESCRT מקדם מיון מטען ושילוב לתוך שלפוחית luminal של גופי multivesicular (MVB). MVBs אז פתיל עם vacuole לספק חלבונים ורכיבי קרום שפלים. עם הכללתו MVBs, תג pHluorin הופך רווה (אפור) בשל החמצה. (ב) שימוש של מטעני pHluorin מתויג יש להקל על הגילוי ואפיון של חלבונים מעורבים מסלול clathrin העצמאי endocytic (CIE) בשמרים. בתאים עם endocytos clathrin בתיווך פגוםהוא, ביטוי-עותק גבוה של GTPase Rho1, כמו גם Rom1 GEF ההפעלה שלה, לקדם הפנמת מטענים באמצעות CIE 8. יתר על כן, למרות שהמשפחה-arrestin α (α-"ששש) של חלבונים שידעה תפקידים בקידום משא ubiquitination והפנמה באמצעות CME 13-17, תפקידים α-arrestins ב CIE זוהו לאחרונה, כנראה עקב אינטראקציה עם חלבונים CIE ולא גיוס של היוביקוויטין באמצעות ליגאזות 18. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
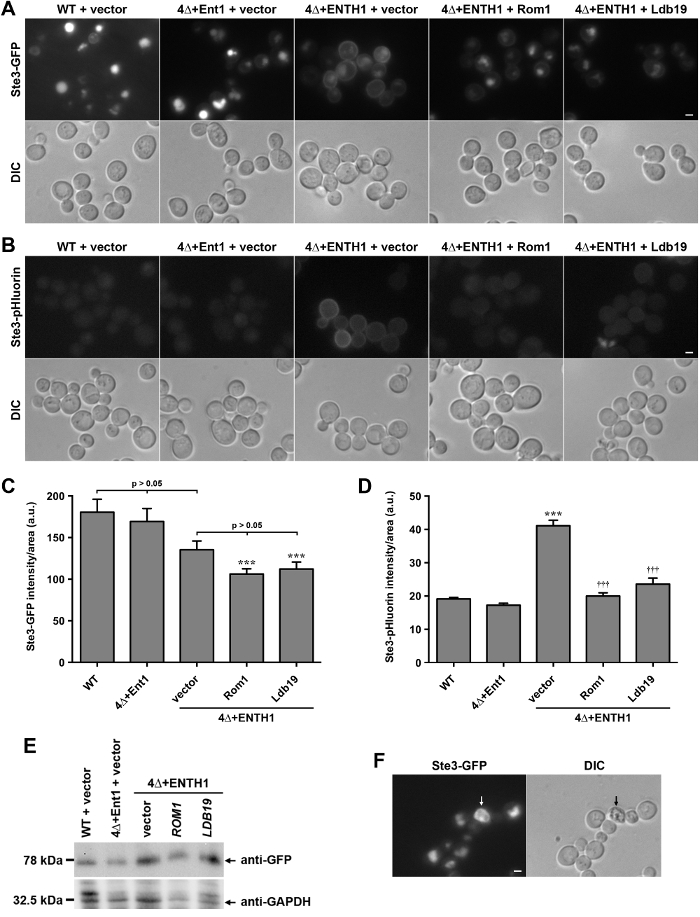
איור 2:. לוקליזציה וכימות Ste3-GFP ו Ste3-pHluorin ב wild-type ו תאים מוטנטים endocytic (א) WT, 4Δ + Ent1 ו 4Δ + ENTH1 תאים המבטאים מקודד genomically Ste3-GFP והפך עם הווקטור, גבוה עותק ROM1 או LDB19-עותק גבוה כמצוין היו דמיינו ידי מיקרוסקופ פלואורסצנטי (בשורה העליונה) או DIC (בשורה תחתונה). תמונות Ste3-GFP הותאמו בעוצמות המינימום והמקסימום אותו כדי לאפשר השוואה ישירה של לוקליזציה Ste3. (B) WT, 4Δ + Ent1 ו 4Δ + ENTH1 תאים המבטאים מקודד genomically Ste3-pHluorin שהוסבו צילמו כמתואר פאנל. סרגל קנה מידה = 2 מיקרומטר. (C, D) כימות של עוצמת הקרינה עבור Ste3-GFP (C) Ste3-pHluorin (D) זנים המשמשים לוחות A ו- B. עבור כל תנאי, הקרינה כל תא היה לכמת למשך תקופה מינימלית של 40 תאים. ערכים תוקנו עבור גודל התא, והביע ביחידות כלשהן (au) כממוצע ± SEM (*** p <0.001 לעומת WT; p ††† <0.001 לעומת 4Δ + ENTH1 + וקטור). (E) Relativביטוי דואר של Ste3-GFP העריך ב WT, 4Δ + Ent1 ו 4Δ + ENTH1 תאים הפך עם וקטור, ROM1 גבוה עותק או LDB19-עותק גבוה כפי שצוין. תמציות תא הוכנו כפי שתואר לעיל 20, ו כמויות שוות של כל דגימה נפתרו על ידי SDS-PAGE. Ste3-GFP ביטוי הוערך על ידי immunoblotting עם נוגדנים אנטי GFP, וטעינה חלבון הוערכה באמצעות אנטי GAPDH. (F) wild-type תאים המבטאים מקודד genomically Ste3-GFP שנצפו על ידי מיקרוסקופ פלואורסצנטי (פאנל Ste3-GFP) ואופטיקה דסק"ש, עם תא מת על ידי חצים. תאים מתים להופיע autofluorescent במסנן GFP, והם כהים כאשר נצפים על ידי דסק"ש. סרגל קנה מידה = 2 מיקרומטר. לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 3:. Assay קינטי של Mup1-GFP ו Mup1-pHluorin הפנמה (א) תאי wild-type להביע מקודד genomically Mup1-GFP (שני לוחות עליונים) או Mup1-pHluorin (נמוכים שני פנלים) גדלו לשלב אמצע לוגריתמים ב בינוני חסר מתיונין YNB להשרות ביטוי Mup1 ושימור על קרום התא. תאים הם צילמו אז על ידי מיקרוסקופ פלואורסצנטי כל 5 דקות בהעדר (- Met) או נוכחות (+ Met) של 20 מיקרוגרם / מ"ל מתיונין. עבור כל נקודת זמן בתוך מצב, ערכי עוצמת המינימום ומקסימום זהים יושמו על מנת לאפשר השוואה של עוצמת קרינה ולוקליזציה. 0, 5, 10, 20 ו -40 נקודות זמן דקות מוצגים כפי שצוינו לכל התנאי. סרגל קנה מידה = 2 מיקרומטר. (ב) כימות של Mup1-GFP ו Mup1-pHluorin הפנמה ב wild-type תאים מלוח. עוצמת קרינה כל תא של Mup1-GFP (- Met, ריבועים סגולים; Met +, יהלומים כחולים) או Mup1-pHluoרין (- Met, משולשים ירוקים; Met +, עיגולים אדומים) נמדדה עבור תאים בודדים צילמו בשעה 5 מרווחי דקות, ולאחר מבוטא באחוזים של עוצמת הקרינה הראשונית (ממוצע ± SEM, n = 6 תאים לכל מצב). נדפס מן פרוסר et al. (2010) 20 באישור המו"ל. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
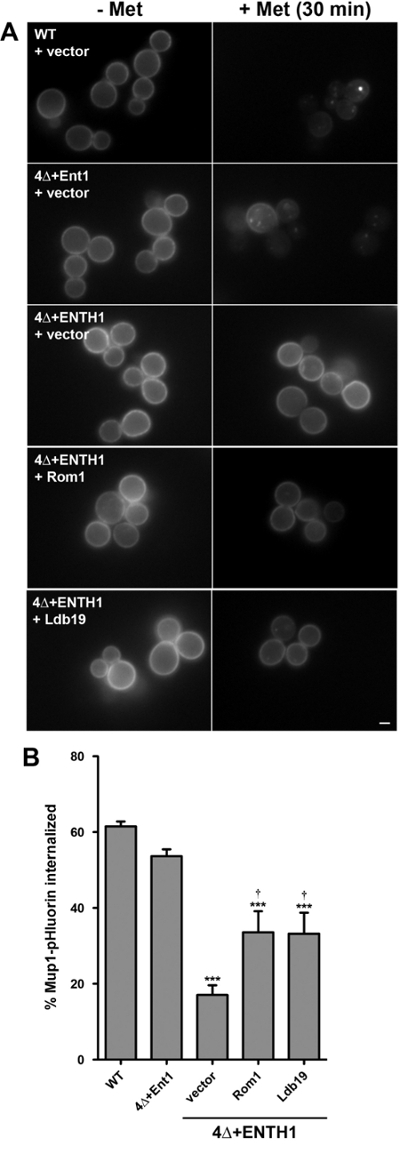
איור 4:. Assay Endpoint של הפנמה Mup1-pHluorin (א) WT, 4Δ + Ent1 ו 4Δ + ENTH1 תאים המבטאים מקודד genomically Mup1-pHluorin והפך עם וקטור, גבוהה עותק ROM1 או להעתיק גבוהה LDB19 כמצוין גדלו עד אמצע שלב -logarithmic ב מתיונין חסר בינוני YNB. שדות של תאים אקראיים הם צלמו ידי fluorescenc מיקרוסקופיה הדואר מיד לפני (- Met) או 30 דקות אחרי (+ Met) תוספת של מתיונין 20 מיקרוגרם / מ"ל. כל התמונות הותאמו לאותו ערך עוצמת מינימום ומקסימום. סרגל קנה מידה = 2 מיקרומטר. כימות (B) של הפנמה Mup1-pHluorin בתאים מתוך פאנל. עבור כל תנאי, עוצמת הקרינה כל תא נמדדה למשך תקופה מינימלית של 40 תאים ותיקן גודל התא. אחוז Mup1-pHluorin הפנים חושב על ידי השוואת מתכוון ערך עוצם לפני ואחרי 30 דק 'טיפול עם מתיונין. ערכים מוצגים כממוצע ± SEM (n = 4; *** p <0.001 לעומת WT; † p <0.05 לעומת 4Δ + ENTH1 + וקטור). נתון זה יש הבדל בין ואח פרוסר. (2015) 18 באישור המו"ל. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
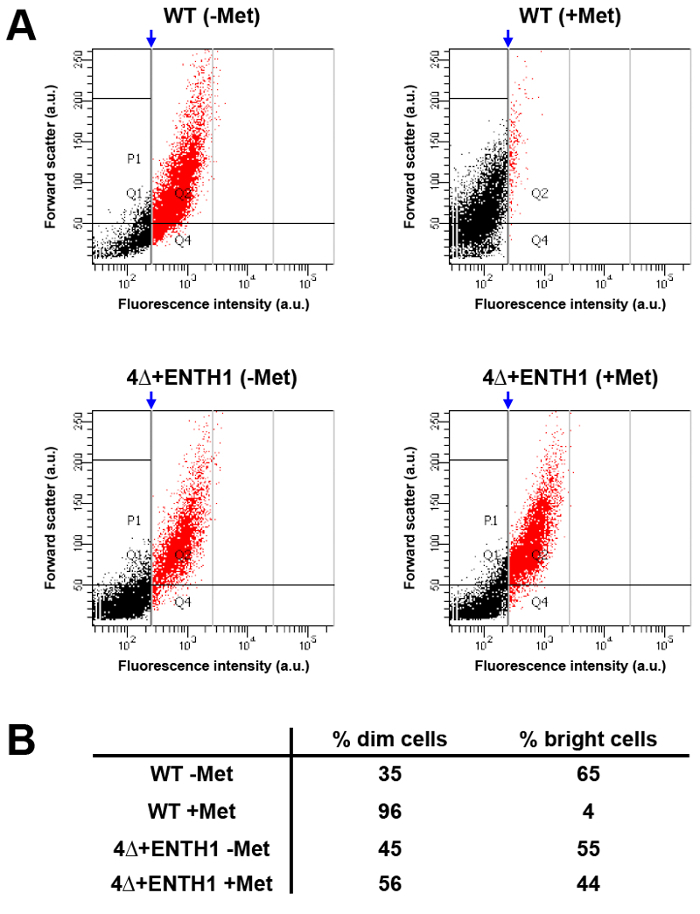
איור 5:. ניתוח האוכלוסין של הפנמה Mup1-pHuorin ידי cytometry הזרימה (א) WT ו 4Δ + ENTH1 התאים גדלו לשלב אמצע לוגריתמי במדיום YNB חסר מתיונין. התאים הודגרו אז בהעדר (- Met) או נוכחות (+ Met) של 20 מיקרוגרם / מ"ל מתיונין במשך 45 דקות לפני ניתוח על ידי cytometry הזרימה. עבור כל תנאי, פיזור קדימה (ביחידות כלשהן, au) היה להתוות נגד עוצמת קרינה (au, באמצעות מסנן FITC) עבור 1,000 תאים מתוך סך של 10,000 תאים הנמדדים. אוכלוסיות נותחו עוד יותר על ידי החלת שער אנכי (חץ כחול) למצב WT + Met, שבו כ 5% מכלל התאים הבהירים (באדום) נפלו בצד הימני של השער. Gating שנוצר על מצבו Met + WT אז היה מוחל על התנאים האחרים על מנת לאפשר השוואהשל הפצות מדגמות. סיכום (B) של אחוז התאים עמום (נקודות שחורות, בצד שמאל של השער) ותאי בהיר (נקודות אדומות, בצד ימין של השער) עבור WT ו 4Δ + ENTH1 ± ניסויים פגשתי לראות בפאנל. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
| מתח | גנוטיפ | מָקוֹר |
| SEY6210 | α MAT his3-Δ200 TRP1-Δ901 leu2-3,112 ura3-52 lys2-801 suc2-Δ9 | פלסמיד מעבדה |
| BWY2858 | STE3-GFP :: KANMX6 | פרוסר et al. (2010) 16 |
| BWY2995 | STE3-pHluorin :: KANMX6 | Pרוסר et al. (2010) 16 |
| BWY3036 | ent1Δ :: LEU2 ent2Δ :: HIS3 yap1801Δ :: HIS3 yap1802Δ :: LEU2 STE3-pHluorin :: KANMX6 + pEnt1 [CEN TRP1] | פרוסר et al. (2010) 16 |
| BWY3037 | ent1Δ :: LEU2 ent2Δ :: HIS3 yap1801Δ :: HIS3 yap1802Δ :: LEU2 STE3-pHluorin :: KANMX6 + pENTH1 [CEN TRP1] | פרוסר et al. (2010) 16 |
| BWY3399 | ent1Δ :: LEU2 ent2Δ :: HIS3 yap1801Δ :: HIS3 yap1802Δ :: LEU2 STE3-GFP :: KANMX6 + pEnt1 [CEN TRP1] | פרוסר et al. (2010) 16 |
| BWY3400 | ent1Δ :: LEU2 ent2Δ :: HIS3 yap1801Δ :: HIS3 yap1802Δ :: LEU2 STE3-GFP :: KANMX6 + pEnt1 [CEN TRP1] | פרוסר et al. (2010) 16 |
| BWY3817 | MUP1-GFP :: KANMX6 | יחסי ציבורosser et al. (2010) 16 |
| BWY3818 | MUP1-pHluorin :: KANMX6 | פרוסר et al. (2010) 16 |
| BWY4153 | ent1Δ :: LEU2 ent2Δ :: HIS3 yap1801Δ :: HIS3 yap1802Δ :: LEU2 MUP1-pHluorin :: KANMX6 + pEnt1 [CEN TRP1] | פרוסר et al. (2011) 7 |
| BWY4154 | ent1Δ :: LEU2 ent2Δ :: HIS3 yap1801Δ :: HIS3 yap1802Δ :: LEU2 MUP1-pHluorin :: KANMX6 + pENTH1 [CEN TRP1] | פרוסר et al. (2011) 7 |
| .א כל הזנים השתמשו במחקר זה הם isogenic כדי SEY6210 למעט בבית הלוקוסים המצוינים. | ||
טבלה 1: זני שמרים השתמשו במחקר זה.
| פלסמיד | תיאור | מָקוֹר |
| pRS426 | 2μ URA3 | שיקורסקי Hieter 1989 |
| pBW0768 | pRS414 :: ENT1 [CEN TRP1] | pEnt1, פלסמיד מעבדה |
| pBW0778 | pRS414 :: ent1 (aa1-151) [CEN TRP1] | pENTH1, פלסמיד מעבדה |
| pBW1571 | pFA6a-pHluorin-KANMX6 | פרוסר et al. (2010) 16 |
| pBW2053 | YEp24 :: ROM1 [2μ URA3] | pROM1 (ואח פרוסר., 2011) 7 |
| pRS426-Ldb19 | LDB19prom-LDB19 [2μ URA3] | פרוסר et al. (2015) 15 |
| pFA6a-GFP (S65T) -kanMX6 | pFA6a-GFP-KANMX6, פלסמיד שילוב מבוסס PCR עבור GFP תיוג בשמרים | Longtineet al. (1998) 21 |
טבלה 2: פלסמידים השתמשו במחקר זה.
| זמן (דקות) | פעולה (ים) |
| -5 | תמונת מדגם 1 (-Met) |
| 0 | הוספת מתיונין לדגום 1 |
| תמונת מדגם 2 (-Met) | |
| 5 | הוספת מתיונין לדגום 2 |
| תמונת מדגם 3 (-Met) | |
| 10 | הוספת מתיונין לדגום 3 |
| תמונת מדגם 4 (-Met) | |
| 15 | הוספת מתיונין לדגום 4 |
| תמונת מדגם 5 (-Met) | |
| 20 | לְהוֹסִיףמתיונין לדגום 5 |
| תמונת מדגם 6 (-Met) | |
| 25 | הוספת מתיונין לדגום 6 |
| תמונת מדגם 7 (-Met) | |
| 30 | הוספת מתיונין לדגום 7 |
| תמונת מדגם 8 (-Met) | |
| מדגם 1 תמונה (+ Met) | |
| 35 | הוספת מתיונין לדגום 8 |
| מדגם 2 תמונה (+ Met) | |
| 40 | מדגם 3 תמונה (+ Met) |
| 45 | מדגם 4 תמונה (+ Met) |
| 50 | מדגם 5 תמונה (+ Met) |
| 55 | מדגם 6 תמונה (+ Met) |
| 60 | מדגם 7 תמונה (+ Met) |
| 65 | מדגם 8 תמונה (+ Met) |
טבלה 3: עבודת דוגמא עבור מבחני סיום מזעזעים 8 Mup1-pHluorin.
Discussion
יישומים של pHluorin כימות של אירועי endocytic בתאי שמרים עושים שימוש מטענים הטרנסממברני שבו תג הניאון הוא קבע את זנב cytoplasmic של החלבון (איור 1 א). עבור המבחנים המתוארים כאן, מטענים הם פלורסנט במאור פנים כאשר תג pHluorin חשוף בסביבות ניטראליות, אבל להיות רווה כאשר תג pHluorin מפגשים בתנאים חומציים. לפיכך, מטען endocytic מתויג pHluorin מזוהה בקלות בפניו cytoplasmic של קרום פלזמה על endosomes מוקדם, אבל הופך "לעמעם" כאשר שולבו שלפוחית MVB לומינל או עם המסירה לומן vacuole. באופן כללי, מטעני endocytic מסונתזים חדש עשויים לעזוב את reticulum endoplasmic (ER) ולהגיע קרום הפלזמה לפני GFP ורבי גרסותיה הבשילו באופן מלא; וכך, pHluorin מתויג מטענים שטרם הגיעו פני התא הם חזו להישאר לגילוי אלא אם היציאה מן ER או Golgi הוא אניmpaired.
השימוש מטענים endocytic מתויג pHluorin כגון Ste3 ו Mup1 יש להקל אפיון של מספר חלבונים המעורבים מסלול שמרים CIE (איור 1B) 8,18. באופן ספציפי, בשיטות המתוארות במאמר זה נעשה שימוש על מנת להוכיח כי ייצור מוגבר של אקטין ויסות GTPase Rho1 ו אנדוציטוזה לקדם שלה GEF Rom1 במגוון מוטציות שמרים עם פגמים CME 8. בנוסף, מטענים מתויגים pHluorin שמשו לאחרונה להפגין כמותית כי α-arrestins, אשר תפקידים ומבוססים CME 13-15,34-36, ממלאי תפקידי סלקטיבי מטען בשני CME ו CIE, ויש מכניסטי פונקציות נפרדות ב בין שני המסלולים 18.
לקבלת הפרוטוקולים המפורטים במאמר זה, כמה גורמים חשובים צריכים להיחשב על מנת לקבל תוצאות עקביות, כמוני. ראשית, Mup1-GFP או Mup1-pHluorin הביטוי פלורסנטדעך עשוי לקטון בתאי שמרים להתקרב או להיכנס לשלב צמיחה הנייחת (תוצאות לא פורסמו); וכך, תאים שגודלו מתרבות לילה צריכים להיות מדוללים מחדש גדלו במשך שעה 3 נוספת (ראה צעדים 3.1-3.2 ו 6.1-6.2). בנוסף, כאשר מתנודדים תנאים או זנים ניסיוניים מרובים מבחני סיום או לניתוח על ידי cytometry זרימה, חשוב לאסוף נתונים עבור כל הדגימות לאחר אותו משך טיפול מתיונין כדי לאפשר השוואה בין תנאים בודדים. לניתוח שלאחר הרכישה, כימות צריכה להתבצע באמצעות תמונות 16-bit, מאז המרה לפורמט 8 סיביות גורמת לאובדן נתונים שיכולים להשפיע על ערכי עוצמת הקרינה. יתר על כן, חיסור רקע צריך להתבצע לפני כימות (שלב 5.3), מאז אות הרקע יכולה לחסום הבדלים משמעותיים בעצמה בין דגימות.
בעוד pHluorin מתויג Ste3 ו Mup1 הוכיחו מקובל כימות, לאכל המטענים יהיו מותאמים היטב כדי תיוג pHluorin. לדוגמה, מנסה לתייג את קולטן גורם α Ste2 הניבו תוצאות כמותיות עולה בקנה אחד, ככל הנראה בשל עוצמת הקרינה נמוכה יותר של Ste2-pHluorin בהשוואה לזו של Ste3 או Mup1 (תוצאות לא פורסם), אם כי יתכן כי תגי טנדם pHluorin יכול לשפר את עוצמת האות. בנוסף, מטענים עם שיעורי איטי מאוד של אנדוציטוזה הנגרמת ליגנד לא יכול להיות מקובל pHluorin תיוג כימות, במיוחד אם בחצי משרה של הפנמה ארוך יותר מחזור התא שמרים (כ 90 דק '). עבור מטענים כאלה, ירידת הקרינה יכולה לנבוע אנדוציטוזה ו / או החלוקה של המטענים בין תאים אם ובתה בעת החלוקה. לפיכך, בדיקת מטענים בודדים של עניין מומלץ כדי לקבוע אם הביטוי קינטיקה שלהם מתאימים pHluorin תיוג וכימות.
למרות מחקרים שנעשו לאחרונה באמצעות PHLuorin התמקד בעיקר על אירועי endocytic על הממברנה הפלזמה, מטענים מתויגים pHluorin יכולים לשמש כדי לחקור אירועי סחר בהמשך מסלול endocytic. לדוגמה, Mup1-pHluorin שימש בהצלחה בתזרים cytometry מבוססי מבחני מטענים בתיווך ESCRT מיון לתוך MVBs 37, מאז תג pHluorin הופך הרווה על ההתאגדות לתוך שלפוחית לומינל MVB 20. גישה זו דומה הכתב בלוציפראז ולאחרונה תיאר בתצהיר intraluminal assay (LUCID), מה שהופך את השימוש של מטענים עם תג בלוציפראז ציטופלסמית כדי ליצור אות bioluminescent בנוכחות luciferin 38,39. בדומה מרווה של הקרינה pHluorin על ההתאגדות לתוך שלפוחית לומינל MVB, פליטת אור ב assay LUCID מוחלש על ההתאגדות של תג בלוציפראז לתוך שלפוחית MVB. בעוד pHluorin מבחני LUCID דומים מושגית, מטענים מתויגים pHluorin יכולים לשמש כדי לחקור התבגרות אנדוציטוזה ו MVB iתאים שלמים n.
שיטות חלופיות להתקיים כימות של אנדוציטוזה, סיפקו מידע רב ערך על שיעורי הפנמה מטענים wild-type ו תאים מוטנטים endocytic. דוגמאות כוללות ספיגת ניטור של הליגנדים radiolabeled כגון גורם α (אשר נקשר לקולטן פרומון Ste2) ו אורציל (אשר הפנימו ידי permease Fur4) 40,41, או מעקב אחר קצב הפירוק למטענים endocytic כגון Ste3 כפי שהם הן הפנימו והובל לבית vacuole 42. גישות ביוכימיות אלה דורשים תמוגה תא, ועל כן הם אינם מתאימים כימותים ישירים בתאים חיים. לחלופין, שכותרתו fluorescently α-factor, לצבוע פאזיים נוזל לוציפר צהוב, או לצבוע styryl FM4-64 יכול לשמש כדי לחזות אנדוציטוזה בתאים חיים, אך אינם מאפשרים ניטור ישיר של חלבונים מטען הביע באופן אנדוגני 40,43,44. עבור גישות אלה, ההתמדה של קרינת vaלומן cuole עלול לסבך כימות, כפי שראינו עם GFP. כמו כן ניתן להשתמש מטענים מתויג GFP כימות של אנדוציטוזה ידי מדידת עוצמת הקרינה כל תא וחיסור האות מ תאים cytoplasmic ו endosomal / vacuolar; עם זאת, endosomes ו vacuoles הם בדרך כלל בסמיכות קרום הפלזמה. בניגוד לכך, מטעני endocytic מתויג pHluorin רווים בתאי MVB / vacuole, אשר יכול להיות יתרון ברור עבור כימות של אירועי סחר לעומת תג ה- GFP שימוש נרחב יותר. המחקרים העתידיים שלנו ירחיבו עליהן ידע הנוכחי של מסלולי endocytic ומיון מטענים בשמרים לזהות גורמים נוספים שתורמים CME ו CIE, וכדי להבין את המנגנונים מווסתים החלטות מיון מטען.
Disclosures
The authors declare no competing interests.
Acknowledgements
We would like to thank Gero Miesenböck and Tim Ryan for sharing pHluorin cDNA used to generate reagents in this study, Nathan Wright, Joanna Poprawski and Lydia Nyasae for excellent technical assistance, members of the Wendland lab for helpful discussions, and Michael McCaffery and Erin Pryce at the Integrated Imaging Center (Johns Hopkins) for advice and assistance with microscopy and flow cytometry. This work was supported by grants from the National Institutes of Health (to B.W., GM60979) and the National Science Foundation (to B.W., MCB 1024818). K.W. was supported in part by a training grant from the National Institutes of Health (T32-GM007231). A.F.O. was supported by developmental funds from the Department of Biological Sciences at Duquesne University and National Science Foundation CAREER grant 553143.
Materials
| Name | Company | Catalog Number | Comments |
| Adenine | Sigma | A8626-25G | Use for preparation of amino acid mixture and stock solution |
| Bacto-agar | Fisher | BP1423-2 | Use for preparation of plate media |
| BD Difco Yeast Nitrogen Base (without amino acids) | BD | 291920 | Use for preparation of liquid and plate media |
| Concanavalin A | Sigma | C5275-5MG | Use for coating of chamber slides |
| Dextrose | Fisher | BP350-1 | Use for preparation of liquid and plate media |
| L-Histidine | Fisher | BP382-100 | Use for preparation of amino acid mixture and stock solution |
| L-Leucine | Acros | 125121000 | Use for preparation of amino acid mixture and stock solution |
| L-Lysine | Fisher | BP386-100 | Use for preparation of amino acid mixture and stock solution |
| L-Methionine | Fisher | BP388-100 | Use for preparation of amino acid mixture and stock solution |
| L-Tryptophan | Fisher | BP395-100 | Use for preparation of amino acid mixture and stock solution |
| L-Tyrosine | Acros | 140641000 | Use for preparation of amino acid mixture |
| Nunc Lab-Tek Chambered Coverglass (8-well) | Thermo Scientific | 155411 | Use for kinetic and endpoint assays of Mup1-pHluorin internalization |
| Uracil | Sigma | U0750-100G | Use for preparation of amino acid mixture and stock solution |
| Axiovert 200 inverted microscope | Carl Zeiss | Custom Build | |
| 100X/1.4 Plan-Apochromat Oil Immersion Objective Lens | Carl Zeiss | Objective should be 100X, 1.4NA or higher | |
| Sensicam | Cooke Corporation | Camera should have 12-bit or higher dynamic range | |
| X-Cite 120PC Q Illumination Source | Excelitas Technologies | ||
| Slidebook 5 software | Intelligent Imaging Innovations | ||
| ImageJ software | National Institutes of Health | http://imagej.nih.gov/ij/ |
References
- Kaksonen, M., Sun, Y., Drubin, D. G. A pathway for association of receptors, adaptors, and actin during endocytic internalization. Cell. 115 (4), 475-487 (2003).
- Kaksonen, M., Toret, C. P., Drubin, D. G. A modular design for the clathrin- and actin-mediated endocytosis machinery. Cell. 123 (2), 305-320 (2005).
- Boettner, D. R., Chi, R. J., Lemmon, S. K. Lessons from yeast for clathrin-mediated endocytosis. Nat Cell Biol. 14 (1), 2-10 (2012).
- Taylor, M. J., Perrais, D., Merrifield, C. J. A High Precision Survey of the Molecular Dynamics of Mammalian Clathrin-Mediated Endocytosis. PLoS Biol. 9 (3), e1000604 (2011).
- Hansen, C. G., Nichols, B. J. Molecular mechanisms of clathrin-independent endocytosis. J Cell Sci. 122 (11), 1713-1721 (2009).
- Sabharanjak, S., Sharma, P., Parton, R. G., Mayor, S. GPI-anchored proteins are delivered to recycling endosomes via a distinct cdc42-regulated, clathrin-independent pinocytic pathway. Dev Cell. 2 (4), 411-423 (2002).
- Radhakrishna, H., Klausner, R. D., Donaldson, J. G. Aluminum fluoride stimulates surface protrusions in cells overexpressing the ARF6 GTPase. J Cell Biol. 134 (4), 935-947 (1996).
- Prosser, D. C., Drivas, T. G., Maldonado-Báez, L., Wendland, B. Existence of a novel clathrin-independent endocytic pathway in yeast that depends on Rho1 and formin. J Cell Biol. 195 (4), 657-671 (2011).
- Prosser, D. C., Wendland, B. Conserved roles for yeast Rho1 and mammalian RhoA GTPases in clathrin-independent endocytosis. Small GTPases. 3 (4), 229-235 (2012).
- Kohno, H., et al. Bni1p implicated in cytoskeletal control is a putative target of Rho1p small GTP binding protein in Saccharomyces cerevisiae. EMBO J. 15 (22), 6060-6068 (1996).
- Evangelista, M., et al. a Yeast Formin Linking Cdc42p and the Actin Cytoskeleton During Polarized Morphogenesis. Science. 276 (5309), 118-122 (1997).
- Kübler, E., Riezman, H. Actin and fimbrin are required for the internalization step of endocytosis in yeast. EMBO J. 12 (7), 2855-2862 (1993).
- Lin, C. H., MacGurn, J. A., Chu, T., Stefan, C. J., Emr, S. D. Arrestin-Related Ubiquitin-Ligase Adaptors Regulate Endocytosis and Protein Turnover at the Cell Surface. Cell. 135 (4), 714-725 (2008).
- Nikko, E., Sullivan, J. A., Pelham, H. R. B. Arrestin-like proteins mediate ubiquitination and endocytosis of the yeast metal transporter Smf1. EMBO Rep. 9 (12), 1216-1221 (2008).
- Nikko, E., Pelham, H. R. B. Arrestin-Mediated Endocytosis of Yeast Plasma Membrane Transporters. Traffic. 10 (12), 1856-1867 (2009).
- O'Donnell, A. F., McCartney, R. R., Chandrashekarappa, D. G., Zhang, B. B., Thorner, J., Schmidt, M. C. 2-Deoxyglucose impairs Saccharomyces cerevisiae growth by stimulating Snf1-regulated and α-arrestin-mediated trafficking of hexose transporters 1 and 3. Mol Cell Biol. 35 (6), 939-955 (2015).
- O'Donnell, A. F., Huang, L., Thorner, J., Cyert, M. S. A calcineurin-dependent switch controls the trafficking function of α-arrestin Aly1/Art6. J Biol Chem. 288 (33), 24063-24080 (2013).
- Prosser, D. C., Pannunzio, A. E., Brodsky, J. L., Thorner, J., Wendland, B., O'Donnell, A. F. α-Arrestins participate in cargo selection for both clathrin-independent and clathrin-mediated endocytosis. J Cell Sci. 128 (22), 4220-4234 (2015).
- Lamaze, C., Dujeancourt, A., Baba, T., Lo, C. G., Benmerah, A., Dautry-Varsat, A. Interleukin 2 receptors and detergent-resistant membrane domains define a clathrin-independent endocytic pathway. Mol Cell. 7 (3), 661-671 (2001).
- Prosser, D. C., Whitworth, K., Wendland, B. Quantitative analysis of endocytosis with cytoplasmic pHluorin chimeras. Traffic. 11 (9), 1141-1150 (2010).
- Bokman, S. H., Ward, W. W. Renaturation of green-fluorescent protein. Biochem Biophys Res Commun. 101 (4), 1372-1380 (1981).
- Miesenböck, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Sankaranarayanan, S., De Angelis, D., Rothman, J. E., Ryan, T. A. The Use of pHluorins for Optical Measurements of Presynaptic Activity. Biophys J. 79 (4), 2199-2208 (2000).
- Katzmann, D. J., Babst, M., Emr, S. D. Ubiquitin-dependent sorting into the multivesicular body pathway requires the function of a conserved endosomal protein sorting complex. ESCRT-I. Cell. 106 (2), 145-155 (2001).
- Longtine, M. S., et al. Additional modules for versatile and economical PCR-based gene deletion and modification in Saccharomyces cerevisiae. Yeast. 14 (10), 953-961 (1998).
- Goldstein, A. L., McCusker, J. H. Three new dominant drug resistance cassettes for gene disruption in Saccharomyces cerevisiae. Yeast. 15 (14), 1541-1553 (1999).
- Ausubel, F. M. . Curr Prot Mol Biol. , (1991).
- Urbanowski, J. L., Piper, R. C. Ubiquitin sorts proteins into the intralumenal degradative compartment of the late-endosome/vacuole. Traffic. 2 (9), 622-630 (2001).
- Newpher, T. M., Smith, R. P., Lemmon, V., Lemmon, S. K. In Vivo Dynamics of Clathrin and Its Adaptor-Dependent Recruitment to the Actin-Based Endocytic Machinery in Yeast. Dev Cell. 9 (1), 87-98 (2005).
- Maldonado-Báez, L., Dores, M. R., Perkins, E. M., Drivas, T. G., Hicke, L., Wendland, B. Interaction between Epsin/Yap180 adaptors and the scaffolds Ede1/Pan1 is required for endocytosis. Mol Biol Cell. 19 (7), 2936-2948 (2008).
- Aguilar, R. C., et al. Epsin N-terminal homology domains perform an essential function regulating Cdc42 through binding Cdc42 GTPase-activating proteins. Proc Natl Acad Sci U.S.A. 103 (11), 4116-4121 (2006).
- Isnard, A. D., Thomas, D., Surdin-Kerjan, Y. The study of methionine uptake in Saccharomyces cerevisiae reveals a new family of amino acid permeases. J Mol Biol. 262 (4), 473-484 (1996).
- Wendland, B., McCaffery, J. M., Xiao, Q., Emr, S. D. A novel fluorescence-activated cell sorter-based screen for yeast endocytosis mutants identifies a yeast homologue of mammalian eps15. J Cell Biol. 135 (6), 1485-1500 (1996).
- Alvaro, C. G., et al. Specific Alpha-Arrestins Negatively Regulate Saccharomyces cerevisiae Pheromone Response by Down-Modulating the G-Protein-Coupled Receptor Ste2. Mol Cell Biol. 34 (14), 2660-2681 (2014).
- Ghaddar, K., Merhi, A., Saliba, E., Krammer, E. M., Prevost, M., Andre, B. Substrate-Induced Ubiquitylation and Endocytosis of Yeast Amino Acid Permeases. Mol Cell Biol. 34 (24), 4447-4463 (2014).
- Becuwe, M., Léon, S. Integrated control of transporter endocytosis and recycling by the arrestin-related protein Rod1 and the ubiquitin ligase Rsp5. eLife. 3, (2014).
- Henne, W. M., Buchkovich, N. J., Zhao, Y., Emr, S. D. The Endosomal Sorting Complex ESCRT-II Mediates the Assembly and Architecture of ESCRT-III Helices. Cell. 151 (2), 356-371 (2012).
- Nickerson, D. P., Russell, M. R. G., Lo, S. -. Y., Chapin, H. C., Milnes, J. M., Merz, A. J. Termination of Isoform-Selective Vps21/Rab5 Signaling at Endolysosomal Organelles by Msb3/Gyp3. Traffic. 13 (10), 1411-1428 (2012).
- Nickerson, D. P., Merz, A. J. LUCID: A Quantitative Assay of ESCRT-Mediated Cargo Sorting into Multivesicular Bodies. Traffic. 16 (12), 1318-1329 (2015).
- Dulic, V., Egerton, M., Elguindi, I., Raths, S., Singer, B., Riezman, H. Yeast endocytosis assays. Methods Enzymol. 194, 697-710 (1991).
- Silve, S., Volland, C., Garnier, C., Jund, R., Chevallier, M. R., Haguenauer-Tsapis, R. Membrane insertion of uracil permease, a polytopic yeast plasma membrane protein. Mol Cell Biol. 11 (2), 1114-1124 (1991).
- Miliaras, N. B., Park, J. -. H., Wendland, B. The Function of the Endocytic Scaffold Protein Pan1p Depends on Multiple Domains. Traffic. 5 (12), 963-978 (2004).
- Vida, T. A., Emr, S. D. A new vital stain for visualizing vacuolar membrane dynamics and endocytosis in yeast. J Cell Biol. 128 (5), 779-792 (1995).
- Toshima, J. Y., Toshima, J., Kaksonen, M., Martin, A. C., King, D. S., Drubin, D. G. Spatial dynamics of receptor-mediated endocytic trafficking in budding yeast revealed by using fluorescent alpha-factor derivatives. Proc Natl Acad Sci U.S.A. 103 (15), 5793-5798 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved