Method Article
Koruyucu etkinliği ve Pulmoner Bağışıklık Tepkisi Fare Subkutan ve Burun BCG İdaresi ardından
Bu Makalede
Özet
We herein detail the methodology followed to compare protective efficacy and lung immune response induced by intranasal and subcutaneous immunization with BCG in mouse model. Our results show the benefits of pulmonary vaccination and suggest a role for IL17-mediated response in vaccine-induced protection.
Özet
Despite global coverage of intradermal BCG vaccination, tuberculosis remains one of the most prevalent infectious diseases in the world. Preclinical data have encouraged pulmonary tuberculosis vaccines as a promising strategy to prevent pulmonary disease, which is responsible for transmission. In this work, we describe the methodology used to demonstrate in the mouse model the benefits of intranasal BCG vaccination when compared to subcutaneous. Our data revealed greater protective efficacy following intranasal BCG administration. In addition, our results indicate that pulmonary vaccination triggers a higher immune response in lungs, including Th1 and Th17 responses, as well as an increase of immunoglobulin A (IgA) concentration in respiratory airways. Our data show correlation between protective efficacy and the presence of IL17-producing cells in lungs post-Mycobacterium tuberculosis challenge, suggesting a role for this cytokine in the protective response conferred by pulmonary vaccination. Finally, we detail the global workflow we have developed to study respiratory vaccination in the mouse model, which could be extrapolated to other tuberculosis vaccines, apart from BCG, targeting the mucosal response or other pulmonary routes of administration such as the intratracheal or aerosol.
Giriş
Tüberküloz (TB) TB endişe verici küresel bir sağlık sorunudur 1 yapan dünyada HIV fazla ilişkili ölümüne yol önde gelen bulaşıcı hastalıklardan biri olan ve çoklu ilaç dirençli suşlar yükselen artış ile birlikte olduğunu. Yeni tanı araçları, daha etkili ve daha az toksik ilaçlar ve yeni, güvenli ve etkili bir TB aşıları özellikle gelişmekte olan ülkelerde, acil ihtiyaç vardır.
zayıflatılmış Basil Calmette-Guerin (BCG) şu anda dünya çapında 1970'lerden beri doğumda intradermal tatbik edilmiştir TB, karşı tek lisanslı aşı edilir. BCG çocuklarda hastalık (menenjit ve miliyer TB) şiddetli formları önlemede etkili kabul edilir, ancak hastalık bulaşma 2 sorumlu akciğer TB karşı tutarsız etkinlik göstermiştir.
TB enfeksiyonunun doğal yolunu taklit Pulmoner aşılama, yerel ana bağışıklık yanıtını emişli için cazip bir yaklaşımı temsil etmektedirs. Deri altı veya deri içi yoldan 3-6 ile karşılaştırıldığında, bu bağlamda, farklı alakalı TBC hayvan modellerinde çeşitli klinik öncesi işleri pulmoner immünizasyondan sonra daha fazla aşı etkinliğini göstermiştir. Bununla birlikte, pulmoner aşılama aracılığı ile ortaya koruyucu mekanizmalar tam olarak anlaşılmış değildir. Son yıllarda, birçok eserler IL17 mukozal aşı kaynaklı koruyucu etkinliği için yoksun fare modellerinde olduğu gibi, TB-spesifik mukozal bağışıklık yanıtının önemli bir faktör olarak IL17 aracılı tepki doğru çekmişlerdir 7,8 bozulur.
Yakın zamanda BCG DBA / 2 fareleri, deri altından BCG aşısı sonra 9 koruma eksikliği ile karakterize edilen, bir fare türü korumalı intranazal ilk kez ortaya koymuştur. Bu sonuçlar solunum TB aşı intradermal BCG pulmon karşı etkisiz olarak kabul edilir endemik ülkelerde TB oranının azaltılmasında daha etkili olabileceğini öne sürdüli TB.
Protokol
Tüm fareler kontrol edilen koşullar altında tutulur ve hastalık belirtisi gözlendi. Deneysel çalışma Deney hayvanlarının korunması ve yetkili yerel etik kurul onayı ile Avrupa ve ulusal direktifleri ile anlaşma yapılmıştır.
BCG Danimarka ve Sayısallaştırılmış Gliserin Stoklar ve Mycobacterium tuberculosis H37Rv 1. hazırlanması
NOT: anlatılan tüm protokoller BSL3 koşulları altında gerçekleştirilmiştir.
- BCG Danimarka da H37Rv soylarının çözülme dondurulmuş gliserol stokları ve Tween-80% 0.05 (h / h) ve ADC (albümin, dekstroz, katalaz),% 10 (h / h) ile desteklenmiş 7H9 ortamı, 10, 10 ml 100 ul inokülasyon.
- Kültür log fazı büyümesinde kadar 37 ° C'de bir hafta süreyle statik koşullar altında inkübe edilir.
- taze ortam 200 ml 10 ml kültür aktararak bakteri kültürü büyütmek. 20 ek inkübestatik koşullar altında gün.
- x g, 2500, 15 dakika boyunca 50 ml'lik santrifüj tüplerine ve santrifüj aktarın.
- süpernatantlar atın ve artık hacmi bakteriyel pelletini. (- Tüp başına 15 10) her tüp steril 3 mm çaplı cam boncuklar ekle.
- Vortex şiddetle sırayla 1 dakika boyunca bakteri kümeleri ayırmak için. Tween-80% 0.05 ile 10 ml PBS, her pelletini (h / h).
- En büyük bakteriyel agrega ve cam boncuklar yerleşmek için izin 10 dakika tüpleri bırakın.
- Tek bir yeni bir 50 ml'lik santrifüj tüpüne (geri kazanılan son hacmi 38 mi), küçük kümeleri ve tek bir bakteri ve transfer birimleri ihtiva eden 4 tüplerinin her birinden süpernatan 9.5 ml yeniden elde. 400 x g'de 10 dakika boyunca santrifüj.
- % 15 bir son gliserol konsantrasyonunun elde edilmesi, tek bir taze 50-ml santrifüj tüpü içinde (esas olarak tek bir bakteri ihtiva eden) süpernatanın 35 ml yeniden elde etmek ve gliserol ile% 50 (h / h) 15 ml PBS ilave (h / h).
- yavaşça karıştırınve dondurma için uygun tüplerde 1 ml alikotlar içinde dağıtın. -80 ° C'de saklayın (bir çok yaklaşık 50 alikotları gliserol stok sağlar).
- gliserol stokları ölçmek için, dondurma işleminin, bir gliserol gün çözülmesi ve PBS 900 ul ihtiva eden ayrı bir 1.5 ml tüpler içinde yedi ila on kat seri dilüsyonları gerçekleştirmek.
- Levha 55 mm çapında Petri tabaklarına hazırlanan ADC,% 10 (h / h) ile desteklenmiş 7H10 katı agar ortamında 10, her seyreltme oranından 100 ul.
- Dikkatle 3 mm çaplı cam boncuk (plaka başına yakl. 10) ekleyin ve hafifçe eşit agar plaka üzerinde hacmini dağıtmak için plakayı sallayın. boncuk atın ve parafilm agar plaka mühür.
- 37 ° C'de 21 gün boyunca inkübe tek koloniler doğru bir şekilde ayırt edilebilir seyreltiler halinde koloni oluşturan birimler (CFU) sayımı için bakteriyel konsantrasyonunu belirlemek.
2. Fare Aşılama
- Önceden sayısal BCG gliserol çözülme ve hazırlık PBS içinde seyreltinİki süspansiyonlardır. Hayvan başına doz dikkate son hacim hesaplayın deri altı uygulama için 100 ul (subkutan aşılama için ml başına 10 7 cfu) ve burun (intranazal aşılama için 2.5 x 10 7 CFU) 40 ml.
- izofluran ve oksijen karışımı ile fareler anestezi kemirgenler için özel bir anestezi iş istasyonu kullanımı. Anestezi odasında fareler korumak için anestezi ve% 2 uyarmak için izofluran% 5 kullanın. (Diğer kabul anestezi yöntemi kullanılır).
- Deri altına uygulama için bir aşı bakteriyel süspansiyon (10 7 cfu / ml), 1 ml bir 26 G iğne ile bir 1 ml şırınga doldurun. hava kabarcıklarını çıkarın.
- Laminer akış kaput içinde yüzüstü pozisyonda düz bir yüzey üzerinde bir anestezi fare yerleştirin ve fare kanadını Deri altına aşı 100 ul (10 6 CFU / doz) geri aşılamak. kafes fare dönün ve prope sağlamak için monitörrly anestezi kurtarır.
- Her fare idaresi arasında şırınga iğnesi değiştirin. Yukarıda açıklandığı gibi hava kabarcıkları kaldırıldı.
- Burun içi uygulama için, kaput içinde yatar pozisyonda bir anestezi fare yerleştirin.
- Bir mikropipet ile 2.5 x 10 7 CFU / ml süspansiyon 20 ul alır. Fare hacim nefes izin damla arasındaki süreyi bırakarak, aşı damla-by-damla tüm hacim tevdi kadar iki burun delikleri arasında koyun Not:. fareler, bu işlem sırasında solunum sıkıntısı muzdarip olabilir onlar bırakılmalıdır böylece mümkün olduğunca önlemek için bir sonraki yönetmek için önce her damla asimile.
- Başka bir 20 ul mikropipet yeniden doldurmak ve işlemi tekrarlayın. Fare ilk aşılamadan sonra anestezi uyanmak başlarsa, önce ikinci bir anestezi odasına yerleştirin. kafes fare dönün ve düzgün kurtarır eminanesteziden.
H37Rv Gerinim 3. Fare intranazal meydan
- önceden miktarı H37Rv gliserol çözülme ve ml başına 2500 CFU bakteriyel süspansiyon hazırlamak için PBS içinde seyreltin. hayvan başına doz dikkate son hacim hesaplayın 40 ul.
- 2.5 açıklandığı gibi H37Rv intranazal inoküle - 2.7. Fare başına nihai meydan dozu 10 2 CFU / 40 ul.
Akciğerler uyarılmış bağışıklık tepkisinin 4. Analizi
- Akciğer hücresel süspansiyon
Not: akciğer aşıyla indüklenen adaptif bağışıklık tepkisinin değerlendirilmesi, tek bir hücre süspansiyonunun oluşturulmasını gerektirir. Bu amaç için, bu tür gentleMACS bir doku Dissociator kullanımı.- servikal dislokasyon (ya da diğer kabul insani metodoloji) ile fare Kurban ve fare göz kırpma refleksinin yok onaylamak için gözü dokunmadan ölü olduğundan emin olun.
- Laminer akış kaput içinde, l ayıklamakSteril makas ve forseps kullanarak ve temiz bir yüzeye koyun ungs. Temiz akciğerler trakea ve bağ dokusu çıkarılması ve (işleme kadar buz üzerinde muhafaza) PBS ile 1.5 ml tüp akciğerlere aktarın.
- PH 7.4, 150 mM NaCI, 5 mM KCI, 1 mM MgCI2 ve 1.8 mM CaCl2, 10 mM HEPES-NaOH 5 ml içeren organ dissosiyasyon (Cı-ayıracı tüp) için uygun bir tüp içinde akciğerlere yerleştirin hücresel bir süspansiyon oluşturmak üzere tampon.
- Kollajenaz D, 100 mg / ml 100 ul (2 mg / ml nihai konsantrasyon) ve DNase I 20,000 IU / ml, 40 ul (160 lU / ml nihai konsantrasyon ekleyin.
Not: Kollajenaz D veya DNasel stok çözeltileri, sırasıyla, 2, 1 mM (h / h), 20 mM Tris-HCI pH 7.5 Y MgC liyofilize PBS enzimler ya da gliserol% 50 eritilerek hazırlanır. - Doku dissociator tüpü yerleştirin ve akciğer parçalanması için önceden tanımlanmış bir program m_lung_01 kullanın. 30 dakika için bir su banyosu içinde 37 ° C 'de tüp inkübe edin.
- Yeri incie dissociator tüp ve tek hücre süspansiyonu içine tam akciğer homojenizasyon için önceden tanımlanmış bir program m_lung_02 kullanın.
- 50 ml santrifüj tüpüne yerleştirilmiş bir 70-mikron naylon hücre süzgecinden hücresel süspansiyon geçirin. RPMI 1640 ortamı 10 ml süzgeç yıkayın.
- Santrifüj hücreleri, 400 x g'de 5 dakika boyunca ve supernatant atın.
- , Tampon yokedici eritrositlerin 1 ml ilave edilir vorteks ile karıştırılır ve oda sıcaklığında 1 dakika boyunca inkübe edin.
- 400 x g, 5 dakika boyunca RPMI 1640 ortamı, santrifüj hücreleri 10 ml.
- tam RPMI 1640 ortamında 0.5 mL içinde süspanse hücreleri,% 10 ısı ile inaktive edilmiş fetal buzağı serumu (FCS), 2 mM L-Glutamın, 100 ug / mL streptomisin, 100 IU / ml penisilin ve 50 uM 2-merkaptoetanol desteklenmiştir.
Not: FCS 30 dakika 56 ° C'de inkübe edilerek inaktive edildi. - Hücrelerin sayısı ve 10 7 hücre / ml nihai hücre yoğunluğu ulaşmak için tam RPMI 1640 ortamı ilave edin.
NOT: hücre sayımı için, otomatik hücre sayacı kullanmak. - U tabanlı, 96-çukurlu, steril plaka hücre süspansiyonu 100 ul dağıtma (10 6 hücre / oyuk).
- Ticari H37Rv saflaştırılmış protein türevi 15 ug / ml (PPD) (5 ug / ml nihai konsantrasyon) ile desteklenmiş tam RPMI 1640 ortamı göz 50 ul / ekleyin.
- ELISA ile sitokin tespiti için supernatant toplanması
- 4.1.14 37 ° C'de 48 saat% 5 CO2 plaka inkübe edin.
- 5 400 x g'de dakika ve süpernatant 100 ul kurtarmak için santrifüj plaka.
- -80 ° C'de saklayın.
- sırasıyla IFNy için deney tamponu ve IL17A belirlenmesinde Üst fazlar, 1/10 ve 1/2 seyreltilir. üreticinin talimatlarına (ELISA Geliştirme kitleri) göre, ticari ELISA kitleri ile sitokin konsantrasyonları belirleyin.
- Sitokin tespiti için hücre içi boyamaAkış sitometrisi ile CD4 + üreten hücrelerde
- 4.1.14 37 ° C 'de, 18 saat ve% 5 CO2 plaka inkübe edin.
- her bir (10 ug / ml son konsantrasyon) Brefeldin 1 mg / ml (DMSO içinde çözülmüş stok), 1.5 ul ekleyin ve altı saat daha inkübe edilir.
- 3200 xg'de 1 dakika boyunca 4.3.2 plaka santrifüj ve supernatant atın.
- % 10 FCS (1/500) ile RPMI 1640 içinde seyreltilmiş anti-fare CD4-FITC, 50 ul ve yeniden süspanse hücreler 4 ° C'de 10 dakika inkübe edilir.
- , 3200 x g'de 1 dakika boyunca 4.3.4 plaka santrifüj süpernatan atılır ve 100 ul / göz sabitleme çözeltisi ilave edilir. 20 dakika boyunca 4 ° C'de inkübe edin.
- permeabilizasyon solüsyonundan 150 ul / yıkama ile hücreler iki kez yıkanır.
Not: 10x konsantre stok 1x çalışma çözeltisi hazırlamak için deiyonize su içinde seyreltilmiştir. - anti fare IFNy-APC, anti-fare IL17A-APC.Cy7 50 ul hücreleri tekrar permeabil içinde seyreltilmişleştirilmesi çözeltisi (1/250 hem antikorlar).
- Oda sıcaklığında 1 saat süreyle inkübe edin.
- permeabilizasyon solüsyonundan 150 ul / yıkama ile hücreler iki kez yıkanır.
- Akış sitometri edinimi için PBS 200 ul yeniden süspanse hücreleri.
Bronchoalveolar Lavage immünglobulinlerin 5. Analizi (BAL)
- BAL örnekleri elde edilmesi
- servikal dislokasyon (ya da diğer kabul insani metodoloji) ile fare Kurban ve fare göz kırpma refleksinin yok onaylamak için gözü dokunmadan ölü olduğundan emin olun.
- Emin tamamen çıkarılması için değil, yapım uygun hassas steril forseps ve makas kullanılarak trakea Açığa ve trakea küçük bir kesim yapmak. BAL örneği kontamine olabilir kanamaya neden özen gösterin.
- trakea içine buz soğukluğunda PBS 800 ul steril 1 ml şırınga bağlı bir kanül tanıtılması.
- PBS akciğer ve r yavaşça inoküleAkciğer çöküşü önlemek için çok yavaş şırınga en pistonu geri çekerek ecover BAL hacmi.
NOT: 500 600 ul Kurtarma tatmin edicidir. - 1.5 ml tüp içine BAL hacmi aktarın ve bu kanın (işleme kadar buz üzerinde muhafaza) ile kontamine değil belirten BAL renksiz kalır onaylayın.
- yeni bir tüpe 5 400 x g'de dakika ve Süpernatant santrifüjleyin BAL örnekleri.
- -80 ° C'de saklayın süpernatantlar.
- BAL süpernatanlarında IgA Belirlenmesi
Not: Kullanılan bütün ayıraçlar oda sıcaklığında yer almaktadır.- M. (10 ug / ml) PBS içinde seyreltilmiş PPD 100 ul kat yüksek protein bağlanması polistiren düz tabanlı 96 oyuklu plakalar Tüberküloz özel IgA belirlenmesi, ya da toplam IgA belirlenmesi için PBS içinde 10 kez seyreltildi BAL yüzer 100 ul.
- 4 ° C'de bir gece boyunca inkübe edilir.
- Süpernatantı atın ve d kağıt havlu üzerine plakayı dokununry. 200 ul / PBS kuyunun ile yıkayın.
- 200 ul / gözenek bir sığır serum albümini (BSA) PBS-Tween-80% 0.05 (h / h) (bloke edici tampon) (ağ / hac)% 1 ile bloklayın.
- Oda sıcaklığında 1 saat inkübe edin.
- 200 ul / PBS-Tween-80% 0.05 (h / h) (yıkama tampon maddesi) oyuk bir kez yıkayın.
- PPD kaplı oyuklara içinde seyreltilmemiş BAL yüzer 100 ul ekle. Oda sıcaklığında iki saat inkübe edilir.
NOT: Toplam IgA belirlenmesi PPD özgü IgA paralel olarak yapılır, Bu kuluçka sırasında 100 ul yıkama tamponu ile toplam IgA kuyu bırakın. - Yıkama buffer.0170004 200 ul / oyuk ile üç kez yıkayın
- yaban turpu peroksidazı (HRP), 100 ul ekle tamponu (1 / 10,000) engelleme seyreltilmiş anti-fare IgA konjüge edilmiş.
- 1 saat, oda sıcaklığı inkübe edin.
- Yıkama tamponu, 200 | il / oyuk ile beş kez yıkayın.
- 3,3, 100 ul / yuva ekleyin ', 5,5'-tetrametilbenzidin (TMB). t, oda sıcaklığında 20 dakika inkübeO karanlık.
- 100 ul / kuyucuk H2 SO 4 0.5 N ekleyin. 450 nm bir dalga boyunda bir spektrofotometre plaka okuyun.
akciğerlerde 6. Bakteriyel yük belirlenmesi
- Akciğer homojenizasyon ve kaplama
- Dört hafta mücadeleden sonra, servikal dislokasyon (ya da diğer kabul insani metodoloji) ile fare feda ve fare göz kırpma refleksinin yok onaylamak için gözü dokunmadan ölü olduğundan emin olun.
- Laminer akış kaput içinde düz ve dezenfekte yüzeyde sabit yatar pozisyonda fare yerleştirin.
- bir kesi yapmak ve göğüs alanı görünür bırakmak için göğüs bölgesinden deri kaldırmak.
- kaburga kesip ve steril makas ve forseps kullanarak akciğer ve kalp hasat. temiz bir yüzeye organları yerleştirin.
- Kalp, trakea ve bağ dokusu kaldırarak akciğerler temizleyin ve iyonu giderilmiş su, 1 ml ile 1.5 ml tüp akciğerlere aktarmak(Işleme kadar buz üzerinde muhafaza).
- iyonu giderilmiş su, 1 ml ihtiva eden, - (Ayıraç tüpü M), organ homojenizasyon için uygun bir tüp içine, her bir fare akciğerlerine aktarmak için steril forseps kullanın.
- Doku dissociator tüpü yerleştirin ve akciğerleri homojenleştirme önceden tanımlanmış bir program RNA_1 kullanın.
- 900 ul seyreltilmiş, akciğer homojenatı, 100 ul ile başlayarak, 1.5 ml tüpler içinde beş ila on kat seri dilüsyonları yapılır.
- Levha seyreltileri 1.11-1.14 tarif edildiği gibi.
- PCR ile BCG ve H37Rv arasındaki farklılaşma
NOT: burun içi yoldan BCG ile aşılanmış grubuna karşılık gelen 6.1.6 den plakalar, biz CFU aşı haiz koruyucu etkinliği geldi değerlendirmek için düşünülen sağlamak için BCG ve H37Rv arasında bir seçici PCR ile kolonilerin temsili bir dizi analiz benzersiz H37Rv için. RD9 Bu PCR hedefleri büyütme, BCG ve M. tu farklı bir genomik bölgetüberküloz, H37Rv için 2618 bp'lik ve BCG 11 465 bp'lik bir fragmanı verir.- PCR tüpleri (9 ul / numune) dağıtmak sonra belirtilen numune başına hacimleri ile tüm örnekler için bir master miks stok hazırlayın ve.
NOT: Tampon 5x: 2 ul. İleri primer 25 uM (GTGTAGGTCAGCCCCATCC): Taq polimeraz, ul 5 birimleri / 0.32 ul: 0.32 ul astar 25 mcM (GCCCAACAGCTCGACATC) Ters 0.04 ul, Deiyonize H 2 O: 6,32 ul. - steril bir kürdan ile bir koloni dokunun ve ana karışımı içeren bir PCR tüpünde numune ile kürdan batırın.
- Aşağıdaki programı ile PCR çalışması: 10 dak 95 ° C (bu adım bakteriyel bozulma tetiklemek için), 10 dakika 95 ° C, 1 dakika, 95 ° C 'de 35 döngü (30 saniye (bu adım bakteriyel bozulma tetiklemek için) 58 ° C ve 4 dakika 72 ° C'de).
- parçaları görselleştirmek için etidyum bromür ve çalışma örnekleri ile% 1 agaroz jel PCR örnekleri yükleyin.
- PCR tüpleri (9 ul / numune) dağıtmak sonra belirtilen numune başına hacimleri ile tüm örnekler için bir master miks stok hazırlayın ve.
Sonuçlar
deri altı ve burun içi: Bu çalışma, BCG iki uygulama yollarının karşılaştırmasını tarif eder. Subkutan rota dünya çapında BCG için geçerli klinik rota intradermal, karşılaştırılabilir. Aşının burun içinden yol M. enfeksiyonunun doğal yolunu taklit amaçlar amaç tüberküloz, akciğerlerde, doğrudan bu patojenin başlıca hedef organ immün tepkisini indüklemek için.
Şekil 1 takip iş akışını açıklar. On haftalık dişi DBA Sekiz / 2 fareler uygulamanın derialtı ya da burun içi yoldan 10 6 CFU BCG Danimarka ile aşılanmaktadır. Sekiz hafta sonra, fareler bir grup aşılama yoluyla uyarılan akciğer bağışıklık tepkisini analiz sakrifiye edildi. BAL örnekleri öncelikle elde edilir ve sonra akciğerleri hasat. aşı sağladığı koruyucu etkinliğini incelemek için, bir Ayırıcı inoküleM. düşük doz burun içi bulaştırma farelerin NT grup Tüberküloz H37Rv süzün. Bir ay sonra, biz hayvan ve hasat akciğerleri kurban. Bu durumda, her bir hayvan için bakteriyel yük ve aşı ile uyarılan bağışıklık tepkisi yüklemeden sonra değerlendirmek için doğru akciğer anlamak için sol akciğer kullanımı. Amaç koruma potansiyel bağıntılarını incelemek için her bir hayvan için akciğerlerdeki bakteri yükü ve bağışıklık tepkisi verileri oluşturmak için.
Şekil 2'de gösterildiği gibi, akciğerler bir organ Homojenat veya hücresel bir süspansiyon ya da elde edilmesi için ayrıştırılmıştır. Homojenize akciğerler Bakteriyel yük dört hafta sonrası meydan belirlemek için bir katı agar ortamı üzerine kaplanmıştır. aşıyla indüklenen immün tepkisi çalışma hücresel süspansiyon kolajenaz D ve DNasel akciğer enzimatik sindirimi ile elde edildi.
Bizim sonuçlar açıkça göstermektedir karşılaştırıldığında t osubkütan yoldan o aşılama burun rota meydan (Şekil 3A) sonra akciğerlerde dört hafta içinde çok daha büyük bir koruyucu etkinliğini bahşeder. Buna ek olarak, intranazal BCG aşısı gruptan akciğerlerde bakteri yükü H37Rv için olup BCG aşısı uygun doğruladı. Bu amaçla, BCG ve M. farklı uzunlukta parçalarını yükseltir RD9 genom bölgesi için spesifik PCR ile, bu gruptan koloni temsil eden bir miktarının analiz Tüberküloz (Şekil 3B). Şekil açıkça koloniler H37Rv karşılık 0.4 kbp'lik bir parça, Resim analiz göstermiştir.
Bizim verilerimiz intranazal BCG aşısı ve meydan öncesinde akciğerlerde aşı kaynaklı bağışıklık yanıtı sağladığı koruyucu etkinliği arasındaki ilişkiyi ortaya koymuştur. Burun içi BCG açıkça ELISA ile ölçülen yüksek IL17 ve akciğerlerde IFNy üretimini tetikledi (Şekil4A). Bu veriler, hücre içi boyama (ICS) ile onaylandı ve akış sitometresi (veriler gösterilmemiştir). Buna ek olarak, aynı zamanda, pulmoner BCG aşısı solunum yollarının IgA üretimini ve kaymasını indükler gösteren BAL örnekleri (Şekil 4B) hem toplam hem PPD özgü IgA konsantrasyonu daha yüksek bir konsantrasyon bulundu.
Son olarak, uygulama sonrasında akciğerlerinde BCG ile indüklenen immün tepkisi (Şekil 5) incelenmiştir. Bizim verilerimiz IL17 ve IFNy arasındaki farkları ortaya; IFNy-üreten hücreler bağımsız olarak aşılama H37Rv ile enfekte edilen tüm gruplarda bulunmuştur, oysa IL17A üreten CD4 + hücreleri sadece, burun BCG grubunda tespit edilmiştir. IL17 üreten hücreler ve bakteriyel yüke karşılık gelen her bir hayvanın veri temsili IFNy durumunda gözlenmedi IL17 varlığında ve akciğer bakteri yükü azalması arasında anlamlı bir korelasyon gösterdi.
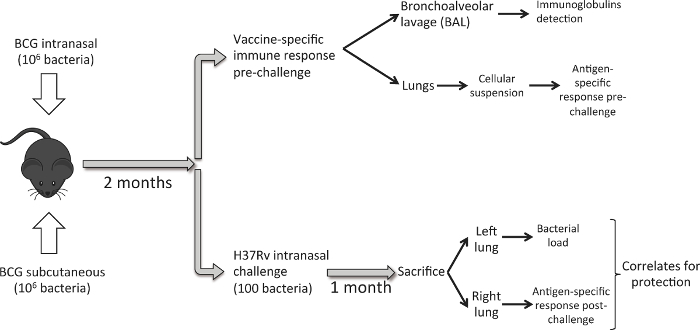
Şekil 1. İş Akışı BCG Aşı burun ve deri altı Rota Karşılaştırmak için. Sekiz hafta BCG aşılama, (deney grubu başına 6) farelerin bir dizi sonrası akciğerleri hasat ve BAL gerçekleştirmek ve aşılama ile oluşturulan akciğer bağışıklık tepkisini analiz etmek için kullanılır. Bir başka fare grubu (6 / grup), M., düşük doz burun içi bulaştırma ile aşılanır Tüberküloz H37Rv suşu (100 CFU). Bir ay sonra, hayvanlar kurban edilir ve bakteriyel yük sol akciğer ve sağ akciğer PPD-spesifik bağışıklık yanıtı analiz edilir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
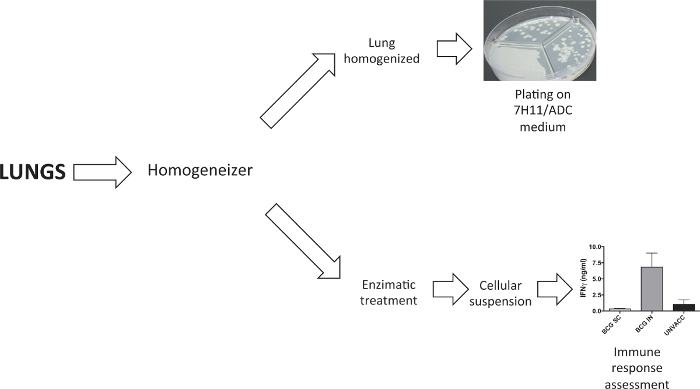
Akciğer Örnekleri Şekil 2. işlenmesi. Bir doku ayıracı akciğerleri işlemek için kullanıldı. Deneyler bakteri yükü belirlemek için, akciğerler katı agar ortamında bunları plaka önce homojenize edildi. Bir akciğer hücresel süspansiyon gerektiren deneylerde, bu kollajenaz D ve DNasel ile enzimatik sindirim aşağıdaki oluşturulmuştur. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Şekil 3. Koruyucu Etkinlik BCG Bağışıklama tarafından Doğan. 6 DBA kategorileri / 2 fareler BCG aşısı Danimarkalı 10 6 CFU ile deri altına (BCG sc), burun (BCG) rota, ya da aşılanmamış (Unvacc) tarafından aşılandı. iki ay aşılama sonrası, farelerden, düşük doz ile intranazal yoldan inoküle edildi (100akciğerlerde CFU) H37Rv zorluk, ve bir ay sonra, bakteriyel bir yük tespit edilmiştir. Iki bağımsız bir temsilî deney yapılmıştır. (A) Veri grafiklerinde ortalama ± SD olarak ifade edilmiştir. Bonferroni post analizi tek yönlü ANOVA testi istatistiksel anlamlılık hesaplamak için yapıldı. (B) (BCG ve H37Rv genomları farklı) PCR RD9 bölge için spesifik ile analiz edilmiştir BCG burun grubundan tek kolonilerin temsili bir sayısı BCG ayırt etmek ve H37Rv kolonileri. (Daha önce 9 yayınlanmıştır). Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Şekil 4. Aşı spesifik akciğer Bağışıklık Tepkisi H37Rv ile karşı karşıya getirilmeden önce analiz edilmiştir. 6 DBA / 2 fare grupları olduğuiki ay sonrası aşılama de deri altı (BCG sc) veya burun (BCG) rota, ya da aşılanmamış BCG aşısı Danimarka 10 6 CFU ile (Unvacc). (A) aşı, hasat akciğerlerden hücresel süspansiyon elde edildi. Yöntemleri bölümünde ve IL17A (sol panel) ve IFNy (sağ panel) üretimi ELISA ile analiz edilmiştir de tarif edildiği gibi hücreler PPD ile uyarıldı. (B) toplam IgA ve M. Tüberküloz (MTB) özel IgA ELISA ile BAL örnekleri analiz edildi. İki bağımsız deneyden elde edilen verileri gösterilmiştir. grafikler veriler ortalama ± SD olarak ifade edilmiştir. (Daha önce 9 yayınlanmıştır). Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
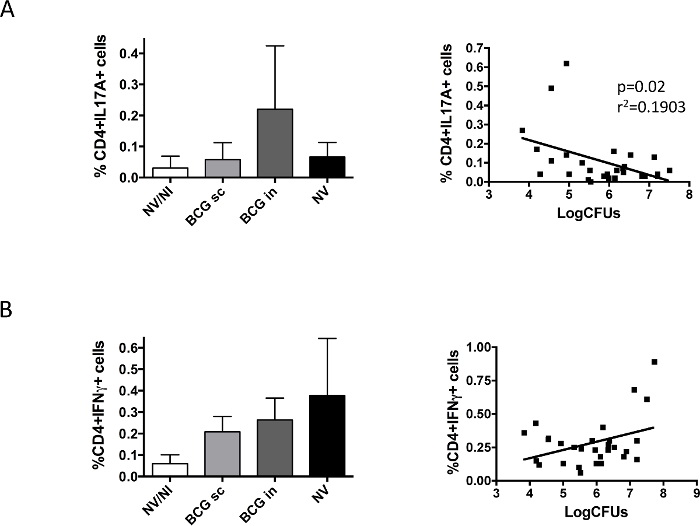
Şekil 5. Aşı özgüPulmoner Bağışıklık Tepki H37Rv ile meydan öncesinde Analiz. 6 DBA kategorileri / 2 fareler BCG aşısı Danimarkalı 10 6 CFU ile deri altına (BCG sc) veya burun (BCG) rota, ya da aşılanmamış (NV) tarafından aşılandı. aşılanmamış, enfekte olmayan farelerin bir kontrol grubu da (NV / NI) dahil edildi. iki ay aşılama sonrası, farelerden, düşük H37Rv doz (100 CFU) ile intranazal yoldan tehdit edildi ve bir ay sonra hayvanlar kurban edilmiştir. Sol ve aynı hayvan sağ akciğerleri sırasıyla CD4 + hücrelerinin üretilmesi bakteri yükü ve IL17A- (A) ya da IFNγ- (B) belirlenmesi için kullanılmıştır. Sol paneller veriler akış sitometresi ile ölçüldü sitokin üreten hücrelerin yüzdesi karşılık gelir ve ortalama ± SD olarak ifade edilmiştir. Sağ paneller bakteri yükten ve her fare için elde edilen CD4 + hücreleri üreten sitokin verileri temsil eder. Doğrusal regresyon hesaplandı ve her bir durumda elde edilen p-değeri IL17A halinde gösterilmiştir. Pooledİki bağımsız deneyden alınan veriler, Şekil gösterilmiştir. (Daha önce 9 yayınlanmıştır). Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Tartışmalar
Although current vaccine against tuberculosis, BCG, is the most widely administered vaccine in history, tuberculosis remains one of the leading causes of death and morbidity from infectious diseases worldwide. This paradox is explained by the lack of protection of this vaccine against pulmonary tuberculosis, the responsible form of transmission. New vaccination approaches effective against pulmonary forms of the disease are urgently needed, as they would have the greatest impact on disease transmission globally.
Our data clearly show that a change in the route of administration of BCG to mimic the natural route of infection could be a successful strategy to prevent pulmonary tuberculosis. Our results are in accordance with other authors showing equivalent data in different animal models, including guinea pigs and non-human primates (NHP) 6,9,12.
Remarkably, our unpublished data indicated that the volume of administration by the intranasal route is a critical step of the protocol. These results revealed that following intranasal delivery of 100 H37Rv bacteria resuspended in 10 μl (instead of 40 μl), we only recovered lung CFUs from around 20% of the animals (data not shown.
Importantly, one of the possible limitations of intranasal administration as a vaccine delivery route in clinic could be its proximity with the central nervous system13,14. In this regard, aerosol immunization might be safer as delivery route for pulmonary tuberculosis vaccines in humans.
This protocol describes a standardized methodology that can be adapted to other studies, as comparison of pulmonary vaccines, or different routes of pulmonary immunization, including aerosol.
Our data suggest that the analysis in parallel of protective efficacy and immune response, using lung samples from the same animal, could be a useful tool to identify biomarkers of protection. In this regard, our results reveal that lung IL17, but not IFNγ, seems to correlate with a better vaccine protective efficacy. These data highlight a possible role of IL17 in the protective response induced by intranasal BCG, which is in accordance with data reported by other authors using mucosal subunit TB vaccines 7,15. Our data also indicate that presence of IgA (both total and MTB-specific) in BAL samples correlates with protection conferred by intranasal BCG. Importantly, we described previously, in agreement with other works, that IL17 contributes to traslocation of IgA to respiratory airways and gut lumen.9,16,17
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
This work was supported by "Spanish Ministry of Economy and Competitiveness" [grant number BIO2014-5258P], "European Commission" by the H2020 programs [grant numbers TBVAC2020 643381].
Malzemeler
| Name | Company | Catalog Number | Comments |
| Middlebrook 7H9 broth | BD | 271310 | |
| Middlebrook ADC Enrichment | BD | 211887 | |
| Tween 80 | Scharlau | TW00800250 | |
| 3-mm diameter Glass Beads | Scharlau | 038-138003 | |
| Middlebrook 7H10 Agar | BD | 262710 | |
| 1-ml syringe 26GA 0.45 x 10 mm | BD | 301358 | |
| GentleMACS dissociator | Miltenyi Biotec | 130-093-235 | |
| C tubes | Miltenyi Biotec | 130-093-237 | |
| M tubes | Miltenyi Biotec | 130-093-236 | |
| Collagenase D | Roche | 11088882001 | |
| DNaseI | Applichem | A3778,0100 | |
| Falcon 70 µm Cell Strainer | Corning | 352350 | |
| RPMI 1640 | Sigma | R0883 | |
| Red Blood Cell Lysing Buffer | Sigma | R7757 | |
| GlutaMAX Supplement | Gibco | 35050-061 | 100x concentrated |
| Penicillin-Streptomycin Solution | Sigma | P4333 | 100x concentrated |
| Fetal Calf Serum | Biological Industries | 04-001-1A | |
| 2-Mercaptoethanol | Sigma | M3148-25ML | |
| Scepter 2.0 Handheld Automated Cell Counter | Millipore | PHCC20040 | |
| Scepter Cell Counter Sensors, 40 µm | Millipore | PHCC40050 | |
| Mycobacterium Tuberculosis - Tuberculin PPD | Statens Serum Institut (SSI) | 2390 | |
| Mouse IFN-γ ELISA development kit | Mabtech | 3321-1H | |
| Mouse IL17A ELISA development kit | Mabtech | 3521-1H | |
| Brefeldin A | Sigma | B7651 | |
| FITC Rat Anti-Mouse CD4 | BD | 553047 | |
| BD Cytofix/Cytoperm Kit | BD | 555028 | |
| APC-Cy7 Rat Anti-mouse IL-17A | BD | 560821 | |
| APC Mouse Anti-mouse IFNg | BD | 554413 | |
| LACHRYMAL OLIVE LUER LOCK 0.60 x 30 mm. 23G x 1 1/4” | UNIMED | 27.134 | Used as trachea cannula for BAL |
| high-protein binding polystyrene flat-bottom 96-well plates MAXISORP | NUNC | 430341 | |
| Albumin, from bovine serum | Sigma | A4503 | |
| Goat Anti-Mouse IgA (α-chain specific)−Peroxidase antibody | Sigma | A4789 | |
| 3,3′,5,5′-Tetramethylbenzidine (TMB) | Sigma | T0440 | |
| MyTaq DNA Polymerase | Bioline | BIO-21107 | The kit Includes Buffer 5x |
Referanslar
- Zumla, A., et al. The WHO 2014 global tuberculosis report--further to go. Lancet Glob Health. 3 (1), e10-e12 (2015).
- Mangtani, P., et al. Protection by BCG vaccine against tuberculosis: a systematic review of randomized controlled trials. Clin Infect Dis. 58 (4), 470-480 (2014).
- Aguilo, N., et al. Pulmonary Mycobacterium bovis BCG vaccination confers dose-dependent superior protection compared to that of subcutaneous vaccination. Clin Vaccine Immunol. 21 (4), 594-597 (2014).
- Chen, L., Wang, J., Zganiacz, A., Xing, Z. Single intranasal mucosal Mycobacterium bovis BCG vaccination confers improved protection compared to subcutaneous vaccination against pulmonary tuberculosis. Infect Immun. 72 (1), 238-246 (2004).
- Giri, P. K., Verma, I., Khuller, G. K. Protective efficacy of intranasal vaccination with Mycobacterium bovis BCG against airway Mycobacterium tuberculosis challenge in mice. J Infect. 53 (5), 350-356 (2006).
- Lagranderie, M., et al. BCG-induced protection in guinea pigs vaccinated and challenged via the respiratory route. Tuber Lung Dis. 74 (1), 38-46 (1993).
- Gopal, R., et al. Interleukin-17-dependent CXCL13 mediates mucosal vaccine-induced immunity against tuberculosis. Mucosal Immunol. 6 (5), 972-984 (2013).
- Khader, S. A., et al. IL-23 and IL-17 in the establishment of protective pulmonary CD4+ T cell responses after vaccination and during Mycobacterium tuberculosis challenge. Nat Immunol. 8 (4), 369-377 (2007).
- Aguilo, N., et al. Pulmonary but Not Subcutaneous Delivery of BCG Vaccine Confers Protection to Tuberculosis-Susceptible Mice by an Interleukin 17-Dependent Mechanism. J Infect Dis. , (2015).
- Middlebrook, G., Cohn, M. L. Bacteriology of tuberculosis: laboratory methods. Am J Public Health Nations Health. 48 (7), 844-853 (1958).
- Brosch, R., et al. A new evolutionary scenario for the Mycobacterium tuberculosis complex. Proc Natl Acad Sci U S A. 99 (6), 3684-3689 (2002).
- Kaushal, D., et al. Mucosal vaccination with attenuated Mycobacterium tuberculosis induces strong central memory responses and protects against tuberculosis. Nat Commun. 6, 8533 (2015).
- Lochhead, J. J., Thorne, R. G. Intranasal delivery of biologics to the central nervous system. Adv Drug Deliv Rev. 64 (7), 614-628 (2012).
- Lochhead, J. J., Wolak, D. J., Pizzo, M. E., Thorne, R. G. Rapid transport within cerebral perivascular spaces underlies widespread tracer distribution in the brain after intranasal administration. J Cereb Blood Flow Metab. 35 (3), 371-381 (2015).
- Griffiths, K. L., et al. Cholera toxin enhances vaccine-induced protection against Mycobacterium tuberculosis challenge in mice. PLoS One. 8 (10), e78312 (2013).
- Hirota, K., et al. Plasticity of Th17 cells in Peyer's patches is responsible for the induction of T cell-dependent IgA responses. Nat Immunol. 14 (4), 372-379 (2013).
- Jaffar, Z., Ferrini, M. E., Herritt, L. A., Roberts, K. Cutting edge: lung mucosal Th17-mediated responses induce polymeric Ig receptor expression by the airway epithelium and elevate secretory IgA levels. J Immunol. 182 (8), 4507-4511 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır