Method Article
Die protektive Wirksamkeit und pulmonale Immunantwort nach subkutaner und intranasale BCG Verabreichung an Mäuse
In diesem Artikel
Zusammenfassung
We herein detail the methodology followed to compare protective efficacy and lung immune response induced by intranasal and subcutaneous immunization with BCG in mouse model. Our results show the benefits of pulmonary vaccination and suggest a role for IL17-mediated response in vaccine-induced protection.
Zusammenfassung
Despite global coverage of intradermal BCG vaccination, tuberculosis remains one of the most prevalent infectious diseases in the world. Preclinical data have encouraged pulmonary tuberculosis vaccines as a promising strategy to prevent pulmonary disease, which is responsible for transmission. In this work, we describe the methodology used to demonstrate in the mouse model the benefits of intranasal BCG vaccination when compared to subcutaneous. Our data revealed greater protective efficacy following intranasal BCG administration. In addition, our results indicate that pulmonary vaccination triggers a higher immune response in lungs, including Th1 and Th17 responses, as well as an increase of immunoglobulin A (IgA) concentration in respiratory airways. Our data show correlation between protective efficacy and the presence of IL17-producing cells in lungs post-Mycobacterium tuberculosis challenge, suggesting a role for this cytokine in the protective response conferred by pulmonary vaccination. Finally, we detail the global workflow we have developed to study respiratory vaccination in the mouse model, which could be extrapolated to other tuberculosis vaccines, apart from BCG, targeting the mucosal response or other pulmonary routes of administration such as the intratracheal or aerosol.
Einleitung
Tuberkulose (TB) ist einer der führenden Infektionskrankheiten verursacht mehr Todesfälle assoziiert als HIV in der Welt und in Kombination mit steigenden Zunahme von multiresistenten Stämmen macht TB eine alarmierende globales Gesundheitsproblem dar 1. Neue Diagnose-Tools, effektiver und weniger toxische Medikamente und neue sichere und wirksame TB-Impfstoffe sind ein dringender Bedarf, vor allem in den Entwicklungsländern.
Lebendes attenuiertes Bazillus Calmette-Guerin (BCG) ist derzeit der einzige zugelassene Impfstoff gegen Tuberkulose, die seit den 1970er Jahren weltweit intradermal bei der Geburt verabreicht wurde. BCG als wirksam bei der Verhinderung von schweren Formen der Erkrankung (Meningitis und miliary TB) bei Kindern, hat aber inkonsistent Wirksamkeit gegen Lungentuberkulose verantwortlich für die Übertragung von Krankheiten 2 gezeigt.
Pulmonale Impfung, die natürliche Weg der TB-Infektion nachahmt, stellt ein attraktiver Ansatz für die lokale Immunantwort des Wirts Grundierens. Folgende Lungen Immunisierung In dieser Hinsicht wurden verschiedene präklinische Arbeiten in verschiedenen relevanten Tiermodellen TB größer Impfstoff Wirksamkeit gezeigt , wie 3-6 zur subkutanen oder intradermalen Weg verglichen. Dennoch werden die Schutzmechanismen ausgelöst durch Lungen Impfung nicht gut verstanden. In den letzten Jahren haben mehrere Werke IL17-vermittelte Reaktion als ein wichtiger Faktor der TB-spezifische Schleimhautimmunantwort, wie sie in Mausmodellen defizienten für IL17 Schleimhaut - Impfstoff-induzierte Schutzwirkung zeigte auf 7,8 wird beeinträchtigt.
Vor kurzem haben wir gezeigt , zum ersten Mal , die BCG - Administration intranasale DBA / 2 - Mäuse geschützt, eine Belastung der Maus durch den Mangel an Schutz nach subkutaner BCG Impfung 9 gekennzeichnet. Diese Ergebnisse legen nahe, dass der Atemwege TB-Impfung könnte effektiver sein Rate von TB in Endemiegebieten bei der Verringerung, wo intradermale BCG ist unwirksam gegen Pulmon betrachtetary TB.
Protokoll
Alle Mäuse wurden unter kontrollierten Bedingungen gehalten und auf Anzeichen von Krankheit beobachtet. Experimentelle Arbeiten wurde in Übereinstimmung mit den europäischen und nationalen Richtlinien für den Schutz von Versuchstieren und mit der Zustimmung der zuständigen lokalen Ethikausschüsse durchgeführt.
1. Herstellung von Quantifizierte Glycerol Stocks von BCG dänischen und Mycobacterium tuberculosis H37Rv
HINWEIS: Alle beschriebenen Protokolle wurden unter BSL3 Bedingungen durchgeführt.
- Auftau gefrorenen Glycerinstammkulturen von BCG Danish oder H37Rv Stämme und 100 & mgr; l in 10 ml 7H9 - Medium 10 mit Tween-80 0,05% (v / v) und ADC (Albumin, Dextrose, Catalase) 10% (v / v) ergänzt inokulieren.
- Inkubiere unter statischen Bedingungen für eine Woche bei 37 ° C, bis die Kultur in log-Phasenwachstum ist.
- Scale-up Bakterienkultur durch die Übertragung der 10-ml-Kultur zu 200 ml frischem Medium. Inkubieren für 20 weitereTagen unter statischen Bedingungen.
- Transfer in 50-ml-Zentrifugenröhrchen und zentrifugiere für 15 Minuten bei 2500 x g.
- Entsorgen Sie Stände und Bakterienpellet im Restvolumen resuspendieren. In jedes Röhrchen sterile 3 mm Durchmesser Glasperlen (10 bis 15 pro Röhrchen).
- Vortex kräftig während 1 min, um Bakterienklumpen zu distanzieren. Resuspendieren jedes Pellet in 10 ml PBS mit Tween-80 0,05% (v / v).
- Lassen Sie Rohre für 10 Minuten erlaubt die größten Bakterien Aggregate und Glasperlen zu beruhigen.
- Recover 9,5 ml Überstand aus jeder der vier Röhrchen, die kleine Klumpen und einzelne Bakterien und Transfervolumina zu einem einzigen frischen 50-ml-Zentrifugenröhrchen (endgültige gewonnen Volumen 38 ml). Zentrifuge für 10 min bei 400 x g.
- Recover 35 ml Überstand (die hauptsächlich einzelne Bakterien) in einem einzigen frischen 50-ml-Zentrifugenröhrchen und 15 ml PBS mit Glycerin 50% (v / v), eine endgültige Glycerinkonzentration von 15% zu erhalten (v / v).
- vorsichtig mischenund zum Einfrieren in 1-ml-Teilmengen in entsprechenden Röhrchen verteilen. Bei -80 ° C (ein Los liefert etwa 50 Aliquots Glycerolstammlösung).
- Um Glycerin-Stamm quantifizieren, tauen Sie den Tag mit einem Glycerin nach dem Einfrieren und führen sieben zehnfache serielle Verdünnungen in separaten 1,5-ml-Röhrchen, die 900 & mgr; l PBS.
- Platte 100 & mgr; l jeder Verdünnung in 7H10 Fest Agarmedium , ergänzt mit 10 ADC 10% (v / v) hergestellt , in 55-mm - Durchmesser - Petrischalen.
- Vorsichtig 3 mm Durchmesser Glasperlen (ca.. 10 pro Platte) und sanft Platte schütteln, um gleichermaßen Volumen über Agar-Platte verteilen. Entsorgen Sie Perlen und versiegeln Agar-Platte mit Parafilm.
- bei 37 ° C für 21 Tage inkubieren und koloniebildende Einheiten (CFU) in den Verdünnungen in denen Einzelkolonien genau unterschieden werden können durch Zählen von Bakterienkonzentration zu bestimmen.
2. Maus Impfung
- Tauen Sie eine vorher quantifiziert BCG Glycerin und verdünnen Sie es in PBS zu prepzwei Suspensionen. Endvolumen Berechnen Sie die Dosis pro Tier unter Berücksichtigung von 100 & mgr; l für die subkutane Verabreichung (10 7 KBE pro ml für die subkutane Impfung) und 40 & mgr; l für die intranasale Verabreichung (2,5 x 10 7 CFU für die intranasale Impfung).
- Verwenden Sie eine spezielle Anästhesiearbeitsplatz für Nager mit einer Mischung von Isofluran und Sauerstoff Mäuse zu betäuben. Verwenden Isofluran 5% Anästhesie zu induzieren und 2% der Mäuse in der Anästhesiekammer aufrechtzuerhalten. (Andere akzeptierte Anästhesie Methode kann verwendet werden).
- Zur subkutanen Verabreichung des Impfstoffes füllen eine 1-ml - Spritze mit einer 26 G - Nadel mit 1 ml Bakteriensuspension (10 7 KBE / ml). Luftblasen entfernen.
- Legen Sie eine narkotisierten Maus auf einer ebenen Fläche in Bauchlage in einer Laminar - Flow - Haube und impfen subkutan 100 & mgr; l (10 6 CFU / Dosis) des Impfstoffes in einer Flanke der Maus zurück. Bringen Sie die Maus an den Käfig und zu überwachen, um sicherzustellen, dass es Properly erholt sich von der Narkose.
- Ändern Sie die Spritzennadel zwischen jeder Maus Verwaltung. Luftblasen entfernt, wie oben beschrieben.
- Für die intranasale Verabreichung, im Inneren der Kapuze eine narkotisierten Maus in Rückenlage legen.
- Mit einer Mikropipette nehmen 20 ul der Suspension mit 2,5 x 10 7 CFU / ml. Legen Sie das Inokulum Drop-by-Drop zwischen den beiden Nüstern, bis das gesamte Volumen abgeschieden wurde, so dass Zeit zwischen Tropfen der Maus atmen die Lautstärke in zu ermöglichen. Hinweis: Mäuse, die von Atemnot während dieses Verfahrens leiden können, so sollten sie bleiben assimilieren jeden Tropfen, bevor der nächste administrieren es so weit wie möglich zu verhindern.
- Nachfüllung der Mikropipette mit einem weiteren 20 ul und den Vorgang wiederholen. Wenn die Maus aus der Narkose nach der ersten Impfung aufzuwachen beginnt, legen Sie sie in der Anästhesie Kammer vor dem zweiten. Bringen Sie die Maus an den Käfig und sicherzustellen, dass es richtig erholtaus der Narkose.
3. Maus intranasale Herausforderung mit Stamm H37Rv
- Tauen Sie eine vorher quantifiziert H37Rv Glycerin und verdünnen Sie es in PBS eine bakterielle Suspension von 2500 KBE pro ml herzustellen. Endvolumen Berechnen Sie die Dosis pro Tier unter Berücksichtigung beträgt 40 ul.
- H37Rv intranasal geimpft wie in 2.5 beschrieben - 2.7. Endgültige Herausforderung Dosis pro Maus ist 10 2 CFU / 40 & mgr; l.
4. Analyse der induzierten Immunantwort in Lungs
- Lung Zellsuspension
HINWEIS: Beurteilung der Impfstoff-induzierte adaptive Immunantwort in der Lunge erfordert die Erzeugung von Einzelzellsuspension. Zu diesem Zweck verwenden wir ein Gewebe Dissociator wie gentleMACS.- Opfere die Maus durch Genickbruch (oder andere anerkannte humane Methode) und gewährleisten Maus tot ist, den Augapfel zu berühren abwesend von Lidschlussreflexes zu bestätigen.
- Innerhalb einer Laminar-Flow-Haube, extrahieren Sie die lungs mit einer sterilen Schere und Pinzette und legen Sie sie auf eine saubere Oberfläche. Saubere Lungen Trachea und Bindegewebe zu entfernen, und übertragen Sie die Lungen in ein 1,5-ml-Röhrchen mit PBS (halten auf Eis bis zur Verarbeitung).
- Zu erzeugen , eine Zellsuspension, legen Lungen in einem geeigneten Schlauch für organ Dissoziation (C-Dissociator Rohr) , das 5 ml 10 mM HEPES-NaOH pH 7,4, 150 mM NaCl, 5 mM KCl, 1 mM MgCl 2 und 1,8 mM CaCl 2 Puffer.
- Füge 100 & mgr; l Kollagenase D 100 mg / ml (2 mg / ml Endkonzentration) und 40 & mgr; l DNAse I 20.000 IU / ml (160 IU / ml Endkonzentration.
HINWEIS: Stammlösungen von Kollagenase D oder DNaseI werden hergestellt , lyophilisiert Auflösen Enzyme in PBS oder Glycerol 50% (v / v), 20 mM Tris-HCl , pH 7,5 , y MgCl 2 1 mM, respectively. - Das Röhrchen wird in das Gewebe Dissociator und nutzen Sie das vordefinierte Programm m_lung_01 für Lungen Fragmentierung. Inkubieren der Röhrchen bei 37 ° C in einem Wasserbad für 30 min.
- Platz the Rohr im Dissociator und nutzen Sie das vordefinierte Programm m_lung_02 für die komplette Lunge Homogenisierung in einzelne Zellsuspension.
- Übergeben Sie die Zellsuspension durch ein 70 & mgr; m Sieb Nylon Zelle mit einem Schlauch 50-ml-Zentrifugen ausgestattet. Waschen Sie das Sieb mit 10 ml RPMI 1640-Medium.
- Centrifuge Zellen für 5 Minuten bei 400 · g und Überstand verwerfen.
- 1 ml der Erythrozyten Lysepuffer, mischen durch Vortexen und Inkubation für 1 min bei Raumtemperatur.
- 10 ml RPMI 1640-Medium und zentrifugieren Zellen für 5 Minuten bei 400 x g.
- Die Zellen in 0,5 ml komplettem Medium RPMI 1640 mit 10% hitzeinaktiviertem fötalen Kälberserum (FCS) supplementiert, 2 mM L-Glutamin, 100 ug / ml Streptomycin, 100 IU / ml Penicillin und 50 & mgr; M 2-Mercaptoethanol.
HINWEIS: FCS durch Inkubation für 30 Minuten bei 56 ° C inaktiviert wird. - Zählen von Zellen und fügen vollständigen RPMI 1640 - Medium bis zur endgültigen Zelldichte von 10 7 Zellen / ml erreichen.
HINWEIS: Für die Zellzahl, verwenden wir die automatische Zellzähler. - Verteilen von 100 & mgr; l Zellsuspension in U-Boden - 96-Well - sterile Platte (10 6 Zellen / Vertiefung).
- Werden 50 & mgr; l / Vertiefung vollständigem RPMI 1640-Medium mit 15 ug / ml kommerzieller H37Rv Purified Protein Derivative (PPD) (5 ug / ml Endkonzentration).
- Supernatant Sammlung für Zytokin Bestimmung durch ELISA
- Inkubieren Platte von 4.1.14 für 48 Stunden bei 37 ° C und 5% CO 2.
- Zentrifugenplatte für 5 Minuten bei 400 · g und erholen 100 ul Überstand.
- Bei -80 ° C.
- Verdünnen Stände 1/10 und 1/2 in Testpuffer für IFNy und IL17A Bestimmung sind. Bestimmen Sie Zytokin-Konzentrationen mit im Handel erhältlichen ELISA-Kits nach den Anweisungen des Herstellers (ELISA Development Kits).
- Intrazelluläre Färbung zur Bestimmung der Zytokin-produzierenden CD4 + Zellen mittels Durchflusszytometrie
- Inkubieren Platte von 4.1.14 für 18 h bei 37 ° C und 5% CO 2.
- In 1,5 ul Brefeldin A 1 mg / ml (Lager in DMSO gelöst) in jede Vertiefung (10 ug / ml Endkonzentration) und Inkubation für weitere sechs Stunden.
- Zentrifugieren Sie die Platte aus 4.3.2 für 1 min bei 3200 xg und Überstand verwerfen.
- Resuspendiere Zellen in 50 ul anti-Maus-CD4-FITC, verdünnt in RPMI 1640 mit 10% FCS (1/500) und bei 4 ° C für 10 min inkubieren.
- Zentrifugieren Sie die Platte aus 4.3.4 für 1 min bei 3200 × g Überstand verwerfen und mit 100 ul / Vertiefung Fixierungslösung. für 20 min bei 4 ° C inkubieren.
- Waschen Sie die Zellen zweimal mit 150 & mgr; l / Wäsche von Permeabilisierung Lösung.
HINWEIS: 10x konzentriert Lager wird in entionisiertem Wasser verdünnt, 1x Arbeitslösung herzustellen. - Resuspendiere Zellen in 50 ul anti-Maus IFN & ggr;-APC und Anti-Maus-IL17A APC.Cy7 in permeabil verdünntisierung Lösung (1/250 beide Antikörper).
- Inkubieren für 1 h bei RT.
- Waschen Sie die Zellen zweimal mit 150 & mgr; l / Wäsche von Permeabilisierung Lösung.
- Die Zellen in 200 ul PBS für die Durchflusszytometrie Akquisition.
5. Analyse von Immunglobulinen in Bronchiallavage (BAL)
- Gewinnung von BAL - Proben
- Opfere die Maus durch Genickbruch (oder andere anerkannte humane Methode) und gewährleisten Maus tot ist, den Augapfel zu berühren abwesend von Lidschlussreflexes zu bestätigen.
- Setzen Sie die Luftröhre unter Verwendung geeigneter Präzision einer sterilen Pinzette und Schere, und führen Sie einen kleinen Schnitt in die Luftröhre, so dass sicher nicht vollständig auszuschneiden. Achten Sie darauf, nicht zu Blutungen führen, die BAL Probe verunreinigen könnten.
- Einführung in die Trachea eine Kanüle mit einer sterilen 1-ml-Spritze mit 800 ul eiskaltem PBS.
- Impfen langsam die PBS in die Lungen und dann rEcover BAL Volumen der Spritze des Kolbens sehr langsam, um Zurückziehen Lungenkollaps zu vermeiden.
HINWEIS: Wiederherstellung von 500 bis 600 & mgr; l zufriedenstellend ist. - Übertragen BAL Volumen in ein 1,5-ml-Röhrchen und bestätigen BAL ungefärbt bleibt, was darauf hinweist, dass nicht mit Blut (halten auf Eis, bis die Verarbeitung) verunreinigt ist.
- Zentrifuge BAL-Proben für 5 min bei 400 xg und Überstand in ein neues Röhrchen.
- Store Überstand bei -80 ° C.
- Bestimmung von IgA in BAL Stände
HINWEIS: Alle verwendeten Reagenzien bei RT sind.- Coat High-Protein - Bindung Polystyrol - Flachboden - 96-Well - Platten mit 100 ul PPD verdünnt in PBS (10 ug / ml) für M. tuberculosis spezifisches IgA Bestimmung oder mit 100 ul Überstand BAL 10 - mal in PBS verdünnt , für Gesamt - IgA Bestimmung.
- Inkubieren über Nacht bei 4 ° C.
- Überstand verwerfen und tippen Sie auf die Platte auf einem Papiertuch zu dry. Waschen mit 200 ul / Vertiefung PBS.
- Blockieren mit 200 ul / Vertiefung einer Rinderserumalbumin (BSA) 1% (w / v) in PBS-Tween-80 0,05% (v / v) (Blockierungspuffer).
- Inkubiere 1 h bei RT.
- Wasche einmal mit 200 ul / Vertiefung PBS-Tween-80 0,05% (v / v) (Waschpuffer).
- 100 l unverdünntem BAL-Überstand in den PPD-beschichteten Vertiefungen. Inkubiere zwei Stunden bei Raumtemperatur.
HINWEIS: Wenn die gesamte IgA Bestimmung in parallel mit der PPD-spezifischen IgA, Gesamt-IgA lassen Vertiefungen mit 100 ul Waschpuffer während dieser Inkubation erfolgt. - Waschen dreimal mit 200 ul / Vertiefung Wasch buffer.0170004
- Je 100 ul Meerrettich-Peroxidase (HRP) -konjugiertem IgA-anti-Maus verdünnt in Blockierungspuffer (1 / 10.000).
- Inkubiere 1 h RT.
- Waschen fünfmal mit 200 ul / Vertiefung Waschpuffer.
- 100 l / Vertiefung von 3,3 ', 5,5'-Tetramethylbenzidin (TMB). Inkubiere 20 Minuten bei Raumtemperatur in ter dunkel.
- 100 l / Vertiefung von H 2 SO 4 0,5 N. Lesen Sie die Platte in einem Spektralphotometer bei einer Wellenlänge von 450 nm.
6. Bakterienbelastung Bestimmung in der Lunge
- Lung Homogenisierung und Galvanisieren
- Vier Wochen nach der Herausforderung, opfern, um die Maus durch Genickbruch (oder andere anerkannte humane Methode) und gewährleisten Maus tot ist, den Augapfel zu berühren abwesend von Lidschlussreflexes zu bestätigen.
- Platzieren Sie die Maus in Rückenlage fixiert auf einer flachen und desinfizierten Oberfläche innerhalb einer Laminarströmungsabzug.
- Einen Einschnitt und entfernen Sie die Haut von Brustbereich, um den Thoraxbereich sichtbar lassen.
- Schneiden Sie die Rippen und ernten die Lungen und das Herz mit einer sterilen Schere und Pinzette. Legen Organe auf eine saubere Oberfläche.
- Reinigen Sie die Lunge durch Entfernen des Herzens, der Trachea und Bindegewebe und übertragen Sie die Lungen in ein 1,5-ml-Röhrchen mit 1 ml VE-Wasser(Auf Eis halten, bis die Verarbeitung).
- Verwenden einer sterilen Pinzette in die Lungen jeder Maus in eine richtige Rohr für Orgel Homogenisierung zu übertragen (M - Dissociator Rohr), 1 ml VE-Wasser enthält.
- Das Röhrchen wird in das Gewebe Dissociator und nutzen Sie das vordefinierte Programm RNA_1, um die Lunge zu homogenisieren.
- Stellen fünf zehnfache serielle Verdünnungen in 1,5-ml-Röhrchen mit 100 ul Lungenhomogenat in 900 & mgr; l verdünnt beginnen.
- Platten Verdünnungen wie in 1,11-1,14 beschrieben.
- Eine Differenzierung zwischen BCG und H37Rv durch PCR
HINWEIS: In den Platten von 6.1.6 auf die Gruppe mit BCG durch den intranasalen Weg geimpft entsprechenden analysierten wir eine repräsentative Anzahl von Kolonien durch eine anspruchsvolle PCR zwischen BCG und H37Rv, um sicherzustellen, dass der CFU als Impfstoff-verliehenen Schutzwirkung zu beurteilen entsprach eindeutig H37Rv. Dieses PCR-Amplifikation von Zielen RD9, eine genomische Region unterschiedlich in BCG und M. tuberkulose, so dass ein Fragment von 2618 bp für H37Rv und 465 bp für BCG 11.- Bereiten Sie einen Master-Mix Lager für alle Proben mit einem Volumen pro Probe, wie angegeben, und verteilen dann in PCR-Röhrchen (9 ul / Probe).
HINWEIS: Puffer 5x: 2 & mgr; l. Forward - Primer 25 uM (GTGTAGGTCAGCCCCATCC): 0,32 & mgr; l, Reverse - Primer 25 uM (GCCCAACAGCTCGACATC): 0,32 & mgr; l, Taq - Polymerase 5 Einheiten / ul: 0,04 ul, Entionisiertes H 2 O: 6,32 ul. - Tippen Sie auf eine Kolonie mit einem sterilen Zahnstocher und tauchen Sie den Zahnstocher mit der Probe in einem PCR-Röhrchen mit dem Master-Mix.
- Führen Sie die PCR mit dem folgenden Programm: 10 min 95 ° C (dieser Schritt ist die bakterielle Unterbrechung auszulösen), 10 min 95 ° C (dieser Schritt ist die bakterielle Unterbrechung auszulösen), 35 Zyklen (30 Sekunden bei 95 ° C, 1 min bei 58 ° C und 4 min bei 72 ° C).
- Laden Sie die PCR-Proben in einem 1% igen Gel mit Ethidiumbromid und Laufproben, um die Fragmente zu visualisieren.
- Bereiten Sie einen Master-Mix Lager für alle Proben mit einem Volumen pro Probe, wie angegeben, und verteilen dann in PCR-Röhrchen (9 ul / Probe).
Ergebnisse
Diese Arbeit beschreibt den Vergleich von zwei Arten der Verabreichung von BCG: subkutane und intranasale. Subkutanem Weg ist vergleichbar mit dem intradermal, die der aktuellen klinischen Weg für BCG weltweit ist. Die intranasale Weg der Impfung zielt darauf ab , den natürlichen Weg der Infektion von M. zu imitieren tuberculosis mit dem Ziel - Immunantwort zu induzieren , direkt in die Lunge, das Hauptzielorgan dieses Erregers.
Abbildung 1 beschreibt den Workflow gefolgt. Acht bis zehn Wochen alte weibliche DBA / 2 - Mäuse werden mit 10 6 CFU von BCG Danish durch subkutane oder intranasale Verabreichungsweg geimpft. Acht Wochen später wurde eine Gruppe von Mäusen wird geopfert Lungenimmunantwort durch die Impfung induzierte analysieren. BAL-Proben werden zunächst erhalten und dann ernten wir Lunge. Um Impfstoff-verliehenen Schutzwirkung zu untersuchen, impfen wir eine different Gruppe von Mäusen mit einer niedrig dosierten intranasale Herausforderung M. tuberculosis H37Rv Stamm. Einen Monat später, wir Tiere und die Ernte Lungen opfern. In diesem Fall wird für jedes Tier verwenden wir die linke Lunge bakterielle Belastung und der rechten Lunge zu bestimmen Impfstoff-induzierten Immunantwort nach der Herausforderung zu beurteilen. Das Ziel ist die bakterielle Belastung und Immunantwortdaten in der Lunge für jedes Tier zu erzeugen, um potentielle Korrelate des Schutzes zu studieren.
Wie in Figur 2 gezeigt, wurden Lungen dissoziiert entweder ein Organ Homogenats oder eine Zellsuspension zu erhalten. Homogenisierte Lungen wurden auf festen Agarmedium Bakterienbelastung 4 Wochen nach der Herausforderung zu bestimmen. Cellular Suspension Impfstoff-induzierten Immunantwort zu untersuchen wurde nach einer Lungen enzymatische Verdauung mit Kollagenase D und DNaseI erhalten.
Unsere Ergebnisse zeigen deutlich, dass im Vergleich to der subkutanen Route, verleiht den intranasalen Weg der Impfung eine viel höhere Schutzwirkung in Lunge 4 Wochen nach dem Challenge (3A). Darüber hinaus konnten wir bestätigen, dass bakterielle Belastung in den Lungen von der intranasalen BCG-Impfstoff-Gruppe zu H37Rv entsprechen und nicht zu BCG-Impfstoff. Zu diesem Zweck untersuchten wir eine repräsentative Anzahl von Kolonien , die aus dieser Gruppe durch spezifische PCR für die RD9 Genomregion, die unterschiedliche Länge Fragmente in BCG und M. verstärkt Tuberkulose (3B). Figur deutlich gezeigt, daß alle Kolonien ein Fragment von 0,4 kbp vorgesehen analysiert, was zu H37Rv entsprach.
Unsere Daten zeigten Korrelation zwischen Schutzwirkung verliehen durch intranasale BCG-Impfung und Impfstoff-induzierten Immunantwort in der Lunge vor der Herausforderung. Die intranasale BCG deutlich ausgelöst höhere IL17 und IFNy Produktion in der Lunge, gemessen durch ELISA (Abbildung4A). Diese Daten wurden durch intrazelluläre Färbung (ICS) bestätigt und Durchflusszytometrie (Daten nicht gezeigt). Darüber hinaus fanden wir auch eine höhere Konzentration von sowohl Gesamt und PPD-spezifischen IgA - Konzentration in BAL - Proben (4B), was darauf hinweist , dass pulmonale BCG - Impfung die Produktion von IgA und Translokation in Atemwege induziert.
Schließlich haben wir untersucht Immunantwort in der Lunge nach dem Challenge-BCG induziert (Abbildung 5). Unsere Daten zeigten Unterschiede zwischen IL17 und IFNy; IL17A-produzierenden CD4 + Zellen wurden nur in der intranasalen BCG-Gruppe nachgewiesen werden, während IFNy-produzierenden Zellen in allen Gruppen mit H37Rv infiziert gefunden wurden, unabhängig von der Impfung. Darstellung der Daten jedes Tieres zu IL17-produzierenden Zellen und Bakterienlast entsprechenden zeigte eine signifikante Korrelation zwischen dem Vorhandensein von IL17 und Bakterienlastreduzierung Lunge, die nicht in dem Fall beobachtet wurde IFNy.
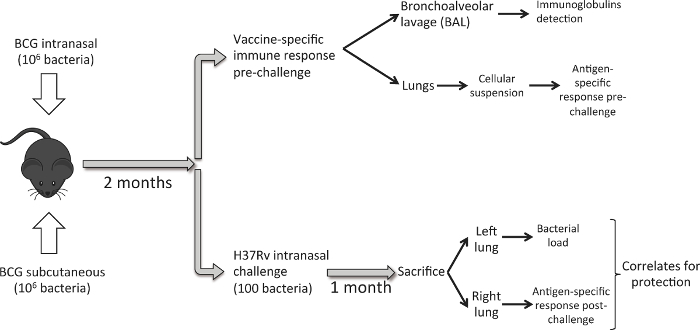
Abbildung 1. Workflow - intranasale und subkutaner BCG - Impfung zu vergleichen. Acht Wochen nach der BCG - Impfung, eine Gruppe von Mäusen (6 pro Versuchsgruppe) verwendet wird , Lunge zu ernten und eine BAL durchführen und pulmonale Immunantwort durch Impfung induziert analysieren. Eine weitere Gruppe von Mäusen (6 / Gruppe), ist mit einer niedrig dosierten intranasale Herausforderung M. geimpft tuberculosis H37Rv - Stamm (100 CFU). Einen Monat später werden die Tiere getötet und die bakterielle Belastung in der linken Lunge und PPD-spezifische Immunantwort in der rechten Lunge untersucht. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
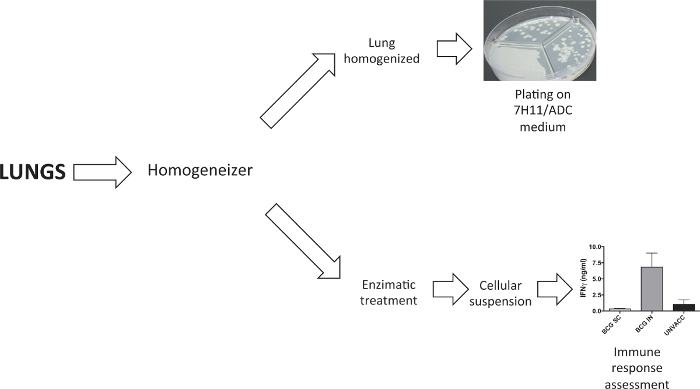
Abbildung 2. Die Verarbeitung von Lungenproben. Es wurde ein Gewebe Dissociator verwendet Lungen zu verarbeiten. In den Experimenten bakterielle Belastung zu bestimmen, wurden Lungen homogenisiert, bevor sie in festen Agarmedium zu plattieren. In Experimenten , die eine Lungenzellsuspension erfordern, dies folgende enzymatische Verdauung mit Kollagenase D und DNaseI generiert wurde. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 3. Die protektive Wirksamkeit verliehenen von BCG Impfung. Gruppen von 6 DBA / 2 - Mäuse wurden durch subkutane (BCG sc) geimpft, intranasal (BCG in) Route, oder nicht geimpften (Unvacc) mit BCG - Impfstoff Danish 10 6 CFU. Auf zwei Monate nach der Impfung wurden die Mäuse intranasal mit einer niedrigen Dosis inokuliert (100CFU) H37Rv Herausforderung und ein Monat später bakterielle Belastung der Lungen bestimmt. Ein repräsentatives Experiment von zwei unabhängigen gezeigt. (A) Daten in den Diagrammen sind als Mittelwert + SD dargestellt. One-way ANOVA - Test mit Bonferroni post - Analyse durchgeführt wurde eine statistische Signifikanz zu berechnen. (B) Eine repräsentative Anzahl von Einzelkolonien aus der BCG intranasalen Gruppe durch PCR spezifisch analysiert wurden für RD9 Region (verschiedene in BCG und H37Rv Genome) BCG zu erkennen und H37Rv Kolonien. (Früher 9 veröffentlicht). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 4. Impfstoff-spezifische Immunantwort Pulmonary Analysierte Vor mit H37Rv herauszufordern. Gruppen von 6 DBA / 2 - Mäuse warengeimpft durch subkutane (BCG sc) oder intranasal (BCG in) Route, oder nicht geimpften (Unvacc) mit BCG dänischen Impfstoff 10 6 CFU. (A) Mit zwei Monaten nach der Impfung wurde eine Zellsuspension aus geernteten Lunge erhalten. Die Zellen wurden mit PPD stimuliert wie in Abschnitt Methoden und IL17A (linkes Bild) und IFNy (rechtes Bild) Produktion wurden mittels ELISA analysiert beschrieben. (B) Gesamt IgA und M. tuberculosis (MTB) -spezifische IgA wurden aus BAL - Proben durch ELISA analysiert. Gepoolten Daten aus zwei unabhängigen Experimenten werden gezeigt. Die Daten in den Diagrammen sind als Mittelwert + SD dargestellt. (Früher 9 veröffentlicht). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
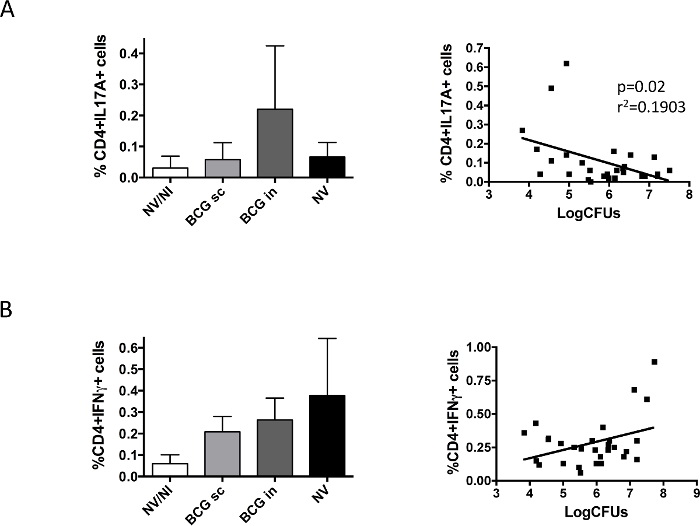
Abbildung 5. Impfstoff-spezifischenPulmonale Immunantwort vor Analysierte mit H37Rv herauszufordern. Gruppen von 6 DBA / 2 - Mäuse wurden durch subkutane (BCG sc) oder intranasal (BCG in) Route geimpft oder nicht geimpft (NV) mit BCG - Impfstoff Danish 10 6 CFU. Eine Kontrollgruppe von nicht geimpften, nicht-infizierten Mäusen wurde ebenfalls enthalten (NV / NI). Auf zwei Monate nach der Impfung wurden die Mäuse intranasal mit einer niedrigen Dosis H37Rv herausgefordert (100 CFU) und einem Monat später wurden die Tiere euthanasiert. Linke und rechte Lunge von demselben Tier wurden verwendet , um bakterielle Belastung und IL17A- (A) oder IFNγ- (B) Herstellung von CD4 + Zellen zu bestimmen, respectively. Daten in linke Felder entsprechen Prozentsatz der Cytokin-produzierenden Zellen durch Strömungs gemessen Zytometrie und sind als Mittelwert + SD dargestellt. Rechts-Panels stellen Daten aus Bakterienbelastung und Zytokin-produzierenden CD4 + Zellen für jede Maus erhalten. Lineare Regression wurde berechnet, und der p-Wert in jedem Fall erhalten werden, in dem Fall IL17A gezeigt. PooledDaten aus zwei unabhängigen Experimenten sind in der Abbildung dargestellt. (Früher 9 veröffentlicht). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Diskussion
Although current vaccine against tuberculosis, BCG, is the most widely administered vaccine in history, tuberculosis remains one of the leading causes of death and morbidity from infectious diseases worldwide. This paradox is explained by the lack of protection of this vaccine against pulmonary tuberculosis, the responsible form of transmission. New vaccination approaches effective against pulmonary forms of the disease are urgently needed, as they would have the greatest impact on disease transmission globally.
Our data clearly show that a change in the route of administration of BCG to mimic the natural route of infection could be a successful strategy to prevent pulmonary tuberculosis. Our results are in accordance with other authors showing equivalent data in different animal models, including guinea pigs and non-human primates (NHP) 6,9,12.
Remarkably, our unpublished data indicated that the volume of administration by the intranasal route is a critical step of the protocol. These results revealed that following intranasal delivery of 100 H37Rv bacteria resuspended in 10 μl (instead of 40 μl), we only recovered lung CFUs from around 20% of the animals (data not shown.
Importantly, one of the possible limitations of intranasal administration as a vaccine delivery route in clinic could be its proximity with the central nervous system13,14. In this regard, aerosol immunization might be safer as delivery route for pulmonary tuberculosis vaccines in humans.
This protocol describes a standardized methodology that can be adapted to other studies, as comparison of pulmonary vaccines, or different routes of pulmonary immunization, including aerosol.
Our data suggest that the analysis in parallel of protective efficacy and immune response, using lung samples from the same animal, could be a useful tool to identify biomarkers of protection. In this regard, our results reveal that lung IL17, but not IFNγ, seems to correlate with a better vaccine protective efficacy. These data highlight a possible role of IL17 in the protective response induced by intranasal BCG, which is in accordance with data reported by other authors using mucosal subunit TB vaccines 7,15. Our data also indicate that presence of IgA (both total and MTB-specific) in BAL samples correlates with protection conferred by intranasal BCG. Importantly, we described previously, in agreement with other works, that IL17 contributes to traslocation of IgA to respiratory airways and gut lumen.9,16,17
Offenlegungen
The authors have nothing to disclose.
Danksagungen
This work was supported by "Spanish Ministry of Economy and Competitiveness" [grant number BIO2014-5258P], "European Commission" by the H2020 programs [grant numbers TBVAC2020 643381].
Materialien
| Name | Company | Catalog Number | Comments |
| Middlebrook 7H9 broth | BD | 271310 | |
| Middlebrook ADC Enrichment | BD | 211887 | |
| Tween 80 | Scharlau | TW00800250 | |
| 3-mm diameter Glass Beads | Scharlau | 038-138003 | |
| Middlebrook 7H10 Agar | BD | 262710 | |
| 1-ml syringe 26GA 0.45x10 mm | BD | 301358 | |
| GentleMACS dissociator | Miltenyi Biotec | 130-093-235 | |
| C tubes | Miltenyi Biotec | 130-093-237 | |
| M tubes | Miltenyi Biotec | 130-093-236 | |
| Collagenase D | Roche | 11088882001 | |
| DNaseI | Applichem | A3778,0100 | |
| Falcon 70µm Cell Strainer | Corning | 352350 | |
| RPMI 1640 | Sigma | R0883 | |
| Red Blood Cell Lysing Buffer | Sigma | R7757 | |
| GlutaMAX Supplement | Gibco | 35050-061 | 100X concentrated |
| Penicillin-Streptomycin Solution | Sigma | P4333 | 100X concentrated |
| Fetal Calf Serum | Biological Industries | 04-001-1A | |
| 2-Mercaptoethanol | Sigma | M3148-25ML | |
| Scepter 2.0 Handheld Automated Cell Counter | Millipore | PHCC20040 | |
| Scepter Cell Counter Sensors, 40 µm | Millipore | PHCC40050 | |
| Mycobacterium Tuberculosis - Tuberculin PPD | Statens Serum Institut (SSI) | 2390 | |
| Mouse IFN-γ ELISA development kit | Mabtech | 3321-1H | |
| Mouse IL17A ELISA development kit | Mabtech | 3521-1H | |
| Brefeldin A | Sigma | B7651 | |
| FITC Rat Anti-Mouse CD4 | BD | 553047 | |
| BD Cytofix/Cytoperm Kit | BD | 555028 | |
| APC-Cy7 Rat Anti-mouse IL-17A | BD | 560821 | |
| APC Mouse Anti-mouse IFNg | BD | 554413 | |
| LACHRYMAL OLIVE LUER LOCK 0.60 x 30 mm. 23G x 1 1/4” | UNIMED | 27.134 | Used as trachea cannula for BAL |
| high-protein binding polystyrene flat-bottom 96-well plates MAXISORP | NUNC | 430341 | |
| Albumin, from bovine serum | Sigma | A4503 | |
| Goat Anti-Mouse IgA (α-chain specific)−Peroxidase antibody | Sigma | A4789 | |
| 3,3′,5,5′-Tetramethylbenzidine (TMB) | Sigma | T0440 | |
| MyTaq DNA Polymerase | Bioline | BIO-21107 | The kit Includes Buffer 5x |
Referenzen
- Zumla, A., et al. The WHO 2014 global tuberculosis report--further to go. Lancet Glob Health. 3 (1), e10-e12 (2015).
- Mangtani, P., et al. Protection by BCG vaccine against tuberculosis: a systematic review of randomized controlled trials. Clin Infect Dis. 58 (4), 470-480 (2014).
- Aguilo, N., et al. Pulmonary Mycobacterium bovis BCG vaccination confers dose-dependent superior protection compared to that of subcutaneous vaccination. Clin Vaccine Immunol. 21 (4), 594-597 (2014).
- Chen, L., Wang, J., Zganiacz, A., Xing, Z. Single intranasal mucosal Mycobacterium bovis BCG vaccination confers improved protection compared to subcutaneous vaccination against pulmonary tuberculosis. Infect Immun. 72 (1), 238-246 (2004).
- Giri, P. K., Verma, I., Khuller, G. K. Protective efficacy of intranasal vaccination with Mycobacterium bovis BCG against airway Mycobacterium tuberculosis challenge in mice. J Infect. 53 (5), 350-356 (2006).
- Lagranderie, M., et al. BCG-induced protection in guinea pigs vaccinated and challenged via the respiratory route. Tuber Lung Dis. 74 (1), 38-46 (1993).
- Gopal, R., et al. Interleukin-17-dependent CXCL13 mediates mucosal vaccine-induced immunity against tuberculosis. Mucosal Immunol. 6 (5), 972-984 (2013).
- Khader, S. A., et al. IL-23 and IL-17 in the establishment of protective pulmonary CD4+ T cell responses after vaccination and during Mycobacterium tuberculosis challenge. Nat Immunol. 8 (4), 369-377 (2007).
- Aguilo, N., et al. Pulmonary but Not Subcutaneous Delivery of BCG Vaccine Confers Protection to Tuberculosis-Susceptible Mice by an Interleukin 17-Dependent Mechanism. J Infect Dis. , (2015).
- Middlebrook, G., Cohn, M. L. Bacteriology of tuberculosis: laboratory methods. Am J Public Health Nations Health. 48 (7), 844-853 (1958).
- Brosch, R., et al. A new evolutionary scenario for the Mycobacterium tuberculosis complex. Proc Natl Acad Sci U S A. 99 (6), 3684-3689 (2002).
- Kaushal, D., et al. Mucosal vaccination with attenuated Mycobacterium tuberculosis induces strong central memory responses and protects against tuberculosis. Nat Commun. 6, 8533 (2015).
- Lochhead, J. J., Thorne, R. G. Intranasal delivery of biologics to the central nervous system. Adv Drug Deliv Rev. 64 (7), 614-628 (2012).
- Lochhead, J. J., Wolak, D. J., Pizzo, M. E., Thorne, R. G. Rapid transport within cerebral perivascular spaces underlies widespread tracer distribution in the brain after intranasal administration. J Cereb Blood Flow Metab. 35 (3), 371-381 (2015).
- Griffiths, K. L., et al. Cholera toxin enhances vaccine-induced protection against Mycobacterium tuberculosis challenge in mice. PLoS One. 8 (10), e78312 (2013).
- Hirota, K., et al. Plasticity of Th17 cells in Peyer's patches is responsible for the induction of T cell-dependent IgA responses. Nat Immunol. 14 (4), 372-379 (2013).
- Jaffar, Z., Ferrini, M. E., Herritt, L. A., Roberts, K. Cutting edge: lung mucosal Th17-mediated responses induce polymeric Ig receptor expression by the airway epithelium and elevate secretory IgA levels. J Immunol. 182 (8), 4507-4511 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten