Method Article
מגן היעילות ריאתי החיסונית בתגובה תת עורי ואת אפי BCG מינהל עכברים
In This Article
Summary
We herein detail the methodology followed to compare protective efficacy and lung immune response induced by intranasal and subcutaneous immunization with BCG in mouse model. Our results show the benefits of pulmonary vaccination and suggest a role for IL17-mediated response in vaccine-induced protection.
Abstract
Despite global coverage of intradermal BCG vaccination, tuberculosis remains one of the most prevalent infectious diseases in the world. Preclinical data have encouraged pulmonary tuberculosis vaccines as a promising strategy to prevent pulmonary disease, which is responsible for transmission. In this work, we describe the methodology used to demonstrate in the mouse model the benefits of intranasal BCG vaccination when compared to subcutaneous. Our data revealed greater protective efficacy following intranasal BCG administration. In addition, our results indicate that pulmonary vaccination triggers a higher immune response in lungs, including Th1 and Th17 responses, as well as an increase of immunoglobulin A (IgA) concentration in respiratory airways. Our data show correlation between protective efficacy and the presence of IL17-producing cells in lungs post-Mycobacterium tuberculosis challenge, suggesting a role for this cytokine in the protective response conferred by pulmonary vaccination. Finally, we detail the global workflow we have developed to study respiratory vaccination in the mouse model, which could be extrapolated to other tuberculosis vaccines, apart from BCG, targeting the mucosal response or other pulmonary routes of administration such as the intratracheal or aerosol.
Introduction
שחפת (TB) היא אחת המחלות הזיהומיות המובילים בגרימת מותם מזוהה יותר HIV בעולם בשילוב עם העלייה הגואה של זנים עמידים multidrug גורם שחפת בעיה בריאותית עולמית מדאיגה 1. כלי אבחון חדשים, תרופות יעילות יותר ופחות רעילות, וחיסוני TB בטוחים ויעילים חדשים הם צורך דחוף, במיוחד במדינות המתפתחות.
לחיות Bacille Calmette-גרן מוחלשים (BCG) היא כיום חיסון מורשה רק נגד שחפת, אשר כבר מנוהל intradermally בלידה מאז 1970 ברחבי העולם. BCG נחשב יעיל במניעת צורות חמורות של המחלה (דלקת קרום המוח שחפת miliary) בילדים, אך הראה יעילות עולה בקנה אחד נגד שחפת ריאתית אחראית של העברת מחלות 2.
חיסון ריאתי, אשר מחק מסלול טבעי של זיהום שחפת, מייצג גישה אטרקטיבית עבור תחול תגובה מקומי חיסון של פונדקאיים. בהקשר זה, יצירות פרה-קליניים שונים במודלים של בעלי חיים TB רלוונטיים שונים הוכיחו יעילות החיסון יותר בעקבות חיסון ריאתי כפי בהשוואה לתוואי תת עורית או תוך-3-6. עם זאת, מנגנוני ההגנה מופעלים על ידי חיסון ריאתי אינם מובנים היטב. בשנים האחרונות, כמה יצירות הצביעו לעבר בתגובה בתיווך IL17 כגורם חשוב של תגובה חיסונית ברירית ספציפית TB, כמו במודלים של עכברים לוקים עבור יעילות מגן עקב חיסון רירי IL17 נפגע 7,8.
לאחרונה הראינו לראשונה כי אפי ממשל BCG מוגן DBA / 2 עכברים, זן עכבר מאופיין בהיעדר הגנה לאחר תת עורית BCG חיסון 9. תוצאות אלו הראו כי חיסון TB נשימה יכול להיות יעיל יותר בהפחתת שיעור השחפת במדינות אנדמיות, שבו BCG תוך-עורית נחשב יעיל נגד pulmonTB האר"י.
Protocol
כל העכברים הוחזקו בתנאים מבוקרים וצופים לכל סימן של מחלה. עבודה ניסויית נערכת הסכם עם הדירקטיבות אירופאיות ולאומיות להגנה של חיות ניסוי ועם אישור ועדת האתיקה המקומית המוסמכת.
1. הכנת מניות לכמת גליצרול של דנית BCG ושחפת Mycobacterium H37Rv
הערה: כל הפרוטוקולים המתוארים בוצעו בתנאי BSL3.
- מניות גליצרול קפוא להפשיר של דנית BCG או זנים H37Rv לחסן 100 μl ב 10 מ"ל של 7H9 10 בינוני השלימו עם Tween-80 0.05% (v / v) ו- ADC (אלבומין, דקסטרוז, Catalase) 10% (V / V).
- דגירה בתנאים סטטי במשך שבוע אחד בכל 37 ° C עד התרבות נמצאת בצמיחת יומן פאזיים.
- בהיקף של עד תרבית החיידקים על ידי העברת התרבות של 10 מ"ל ל -200 מ"ל של מדיום חדש. דגירה של 20 נוספיםימים בתנאים סטטיים.
- העברה-מ"ל 50 צינורות צנטריפוגות צנטריפוגות במשך 15 דקות ב 2500 x גרם.
- בטל supernatants ו resuspend גלולה חיידקים בהיקף שיורית. הוסף כל חרוזי זכוכית צינור 3 מ"מ קוטר סטרילי (10 - 15 לכל צינור).
- וורטקס במרץ במהלך 1 דק 'על מנת לנתק גושים חיידקי. Resuspend כל גלולה ב 10 מ"ל של PBS עם Tween-80 0.05% (v / v).
- השאר צינורות במשך 10 דקות ומאפשרות המצרפים החיידקים הגדולים וחרוזי זכוכית להתיישב.
- שחזור 9.5 מ"ל של supernatant מכל אחת 4 צינורות המכילים גושים קטנים וחיידקים יחיד ואמצעי אחסון והעברת צינור צנטריפוגות יחיד טרי 50 מ"ל (נפח התאושש הסופי 38 מ"ל). צנטריפוגה במשך 10 דקות ב g 400 x.
- שחזור 35 מ"ל של supernatant (המכיל חיידקים יחיד בעיקר) בצינור יחיד טרי 50 מ"ל צנטריפוגות ולהוסיף 15 מ"ל של PBS עם גליצרול 50% (v / v), קבלת ריכוז גליצרול הסופי של 15% (V / V).
- מערבבים בעדינותולהפיץ ב aliquots 1 מיליליטר צינורות מתאימים להקפאה. חנות ב -80 ° C (הרבה אחד מספק כ -50 aliquots מלאי גליצרול).
- כדי לכמת מניות גליצרול, להפשיר גליצרול היום לאחר הקפאה ולבצע שבע דילולים סדרתי של פי עשרה 1.5 מ"ל צינורות נפרדים המכיל 900 μl של PBS.
- פלייט 100 μl של דילול כל ב 7H10 בינוני מוצק אגר 10 בתוספת 10% ADC (v / v) מוכן בצלחות פטרי בקוטר 55 מ"מ.
- בזהירות להוסיף 3 חרוזי זכוכית מ"מ בקוטר (כ. 10 לכל צלחת) ובעדינות לנער צלחת להפיץ פחות נפח על צלחת אגר. בטל חרוזים ולאטום צלחת אגר עם parafilm.
- דגירה במשך 21 ימים ב 37 מעלות צלזיוס ולקבוע ריכוז חיידקי ספירת יחידות מושבת יוצרים (CFU) של הדילולים שם מושבות אחת ניתן להבחין במדויק.
2. עכבר חיסון
- הפשרה גליצרול BCG מראש לכמת לדלל אותו ב PBS prepשתי השעיות. חישוב נפח סופי בהתחשב במינון לכל חיה הוא 100 μl עבור להזרקה (10 7 CFU לכל מיליליטר עבור חיסון תת עורית) ו -40 μl עבור ממשל אפי (2.5 x 10 7 CFU לחיסון אפים).
- השתמש תחנת עבודת הרדמה מיוחדת מכרסמים להרדים עכברים בתערובת של isoflurane וחמצן. השתמש isoflurane 5% כדי לגרום הרדמה ו -2% כדי לשמור על עכברים בתא הרדמה. (שיטת הרדמת מקובלים אחרת יכולה לשמש).
- עבור מתן החיסון תת עורית למלא מזרק 1 מ"ל עם מחט 26 G עם 1 מ"ל של ההשעיה חיידקי (10 7 CFU / ml). הסר בועות אוויר.
- מניחים עכבר הרדים על גבי משטח ישר אפרקדן בתוך מכסה המנוע זרימה למינרית ולחסן תת עורי 100 μl (10 6 CFU / מנה) של חיסון בתוך האגף של העכבר בחזרה. החזר את העכבר לכלוב ולנטר אותו כדי לוודא שהוא properly מתאושש מן ההרדמה.
- שנה את מחט המזרק בין כל ממשל עכבר. הוסר בועות אוויר כמתואר לעיל.
- עבור ממשל אפי, למקם עכבר הרדים במצב שכיבה בתוך מכסה המנוע.
- עם micropipette לקחת 20 μl של ההשעיה עם 2.5 x 10 7 CFU / ml. מניחים את טיפה אחר טיפה הבידוד בין שני הנחיריים עד נפח כולו הופקד, עוזב הזמן בין הטיפות כדי לאפשר העכבר לנשום את עוצמת הקול הערה:. עכברים יכולים לסבול ממצוקה נשימתית במהלך הליך זה ולכן הם צריכים להיות משמאל להטמיע כל טיפה לפני לנהל את אחד ליד למנוע אותה ככל האפשר.
- למלא מחדש את micropipette עם עוד 20 μl וחזור על הפעולה. אם העכבר מתחיל להתעורר מן ההרדמה לאחר החיסון הראשון, למקם אותו בתא ההרדמה לפני השנייה אחת. החזר את העכבר לכלוב ולהבטיח כי זה כמו שצריך משחזרמן ההרדמה.
3. אתגר intranasal עכבר עם זני H37Rv
- פשרת גליצרול H37Rv מראש לכמת לדלל אותו ב- PBS להכין השעית חיידקים של 2,500 CFU לכל מיליליטר. חישוב נפח סופי בהתחשב במינון לכל חיה הוא 40 μl.
- H37Rv הוא מחוסן intranasally כמתואר 2.5 - 2.7. מינון האתגר הסופי לכל עכבר הוא 10 2 CFU / 40 μl.
4. ניתוח של התגובה החיסונית מושרה בריאות
- השעיה הסלולר ריאות
הערה: הערכת התגובה חיסונית אדפטיבית-induced חיסון ריאות דורשת הדור של השעית תא בודדת. לשם כך, אנו משתמשים Dissociator רקמות כגון gentleMACS.- להקריב את העכבר על ידי נקע בצוואר הרחם (או מתודולוגיה אנושי מקובלות אחרות) ולהבטיח העכבר מת נגיעה גלגל העין כדי לאשר הנעדר של רפלקס מצמוץ.
- בתוך מכסה מנוע זרימה למינרית, לחלץ את lungs באמצעות מספריים מלקחיים סטריליות ומניחים אותם על משטח נקי. ריאות נקיות הסרת קנה נשימה ורקמות חיבור, ולהעביר את הריאות אל צינור 1.5 מיליליטר עם PBS (לשמור על קרח עד עיבוד).
- כדי ליצור ההשעיה הסלולר, למקם הריאות בתוך שפופרת ראוי דיסוציאציה איבר (צינור C-Dissociator) המכיל 5 מ"ל של 10 מ"מ HEPES-NaOH pH 7.4, 150 מ"מ NaCl, 5 מ"מ KCl, 1 מ"מ MgCl 2 ו -1.8 מ"מ CaCl 2 בַּלָם.
- הוספת 100 μl של Collagenase D 100 מ"ג / מ"ל (2 מ"ג / מ"ל ריכוז סופי), ו -40 μl של DNAse אני 20,000 IU / ml (160 IU / הריכוז הסופי מ"ל.
הערה: פתרונות המניות של Collagenase D או DNaseI ערוכים המסת אנזימים lyophilized ב PBS או גליצרול 50% (v / v), 20 mM Tris-HCl pH 7.5 y MgCl 2 1 מ"מ, בהתאמה. - מניח את הצינור ב Dissociator הרקמות ולהשתמש m_lung_01 התכנית המוגדר מראש עבור פיצול ריאות. דגירת הצינור ב 37 מעלות צלזיוס באמבט מים למשך 30 דקות.
- ה מקוםצינור הדואר ב Dissociator ולהשתמש m_lung_02 התכנית המוגדר מראש עבור המגון ריאות שלם לתוך השעיה הסלולר יחידה.
- לעבור את ההשעיה הסלולר דרך מסננת תא ניילון 70 מיקרומטר מצויד לצינור צנטריפוגות 50 מ"ל. שטפו את מסננת עם 10 מ"ל של מדיום RPMI 1640.
- תאי צנטריפוגה במשך 5 דקות ב 400 XG וזורקים supernatant.
- הוסף 1 מ"ל של אריתרוציטים lysing חיץ, ומערבבים על ידי vortexing ו דגירה של 1 דקות בטמפרטורת החדר.
- הוסף 10 מ"ל של תאים צנטריפוגות בינוני RPMI 1640 במשך 5 דקות ב 400 x ז.
- תאים Resuspend ב 0.5 מ"ל של מדיום שלם RPMI 1640 בתוספת 10% מומת חום עוברי עגל סרום (FCS), 2 מ"מ L- Glutamin, 100 מיקרוגרם / מ"ל סטרפטומיצין, 100 IU / ml פניצילין 50 מיקרומטר 2-mercaptoethanol.
הערה: FCS הוא מובטל ידי דגירה על 56 מעלות צלזיוס במשך 30 דקות. - ספירת תאים ולהוסיף שלם RPMI 1640 בינוני להגיע צפיפות הסלולר סופי של 10 7 תאים / מ"ל.
הערה: לקבלת ספירת תאים, אנו משתמשים דלפק התא האוטומטי. - הפיצו 100 μl של השעיה הסלולר בצלחת סטרילית 96-היטב U-תחתונה (10 6 תאים / טוב).
- הוסף 50 μl / טוב של מדיום RPMI להשלים 1640 עם 15 מיקרוגרם / מיליליטר של נגזרי חלבון המסחרי H37Rv המטוהר (PPD) (5 מיקרוגרם / ריכוז סופי מיליליטר).
- אוסף Supernatant לקביעת ציטוקינים על ידי ELISA
- דגירת צלחת מ 4.1.14 למשך 48 שעות ב 37 מעלות צלזיוס, 5% CO 2.
- צלחת צנטריפוגה במשך 5 דקות ב 400 XG ולשחזר 100 μl של supernatant.
- חנות ב -80 מעלות צלזיוס.
- לדלל supernatants 1/10 ו 1/2 חיץ assay עבור IFNγ ונחישות IL17A, בהתאמה. לקבוע ריכוזים ציטוקינים עם ערכות מסחריות ELISA, בהתאם להוראות היצרן (ערכות פיתוח ELISA).
- מכתים תאי עבור קביעת ציטוקינים-producing תאי CD4 + על ידי cytometry זרימה
- דגירת צלחת מ 4.1.14 במשך 18 שעות ב 37 מעלות צלזיוס, 5% CO 2.
- הוסף 1.5 μl של Brefeldin A 1 מ"ג / מ"ל (המניות מומס DMSO) לכל (הריכוז הסופי 10 מיקרוגרם / מ"ל) היטב דגירה במשך שש שעות נוספות.
- צנטריפוגה צלחת מ 4.3.2 דקות 1 XG ב 3200 וזורקים supernatant.
- תאים Resuspend ב 50 μl של אנטי עכבר CD4-FITC מדולל RPMI 1640 עם 10% FCS (1/500) דגירה במשך 10 דקות ב 4 °.
- צנטריפוגה צלחת מ 4.3.4 עבור 1 דקות ב 3,200 XG, להשליך supernatant ולהוסיף 100 μl / טוב של פתרון קיבעון. דגירה על 4 מעלות צלזיוס למשך 20 דקות.
- פעמיים שטפו תאים עם 150 μl / לשטוף של פתרון permeabilization.
הערה: 10x המניות מרוכז הוא מדולל במים deionized להכין פתרון העבודה 1x. - תאים Resuspend ב 50 μl של העכבר אנטי IFNγ-APC ואנטי עכבר IL17A-APC.Cy7 מדולל permeabilפתרון ization (1/250 הוא נוגדנים).
- דגירה במשך שעה 1 ב RT.
- פעמיים שטפו תאים עם 150 μl / לשטוף של פתרון permeabilization.
- תאים Resuspend ב 200 μl של PBS לרכישת cytometry הזרימה.
5. ניתוח של אימונוגלובולינים ב שטיפה ברונכואלוואולרית (BAL)
- הקניית דגימות BAL
- להקריב את העכבר על ידי נקע בצוואר הרחם (או מתודולוגיה אנושי מקובלות אחרות) ולהבטיח העכבר מת נגיעה גלגל העין כדי לאשר הנעדר של רפלקס מצמוץ.
- לחשוף את קנה הנשימה באמצעות מלקחיים סטריליות דיוק נאות ומספריים ולבצע חתך קטן קנה הנשימה, כדי לוודא שלא להעיף אותו לחלוטין. יש להיזהר שלא לגרום לדימום שיכול לזהם מדגם BAL.
- הציגו לתוך קנה הנשימה צינורית מחובר מזרק 1 מ"ל סטרילי עם 800 μl של PBS קר כקרח.
- לחסן לאט את PBS לריאות ואז rנפח אקובר BAL שהפיל הבוכנה של המזרק באיטיות רבה כדי למנוע קריסת ריאות.
הערה: שחזור של 500 עד 600 μl הוא משביע רצון. - העבר נפח BAL לתוך צינור 1.5 מ"ל ולאשר BAL נשאר לא צבוע, המציין כי אינו מזוהם עם דם (לשמור על הקרח עד עיבוד).
- צנטריפוגה BAL דגימות במשך 5 דקות ב 400 XG, והעברת supernatant לצינור חדש.
- supernatants חנות ב -80 מעלות צלזיוס.
- קביעת IgA ב supernatants BAL
הערה: כל חומרים כימיים המשמשים הן ב RT.- מעייל עתיר חלבון מחייב קלקר שטוח תחתון 96-גם צלחות עם 100 μl של PPD מדוללים PBS (10 מיקרוגרם / מיליליטר) עבור M. שחפת נחישות IgA -specific, או עם 100 μl של supernatant BAL מדולל 10 פעמים PBS לקביעת IgA הכולל.
- דגירת הלילה ב 4 מעלות צלזיוס.
- בטל supernatant והקש את הצלחת על מגבת נייר כדי דר"י. לשטוף עם 200 μl / גם של PBS.
- חסום עם 200 μl / גם של אלבומין בסרום שור (BSA) 1% (w / v) ב- PBS-Tween-80 0.05% (v / v) (חיץ חסימה).
- דגירה שעה 1 ב RT.
- שטפי פעם עם 200 μl / היטב (חיץ כביסה) 0.05% PBS-Tween-80 (V / V).
- הוספת 100 μl של supernatant BAL חי בבארות המצופות PPD. דגירת שעות בטמפרטורת חדר.
הערה: אם קביעת IgA הכולל נעשית במקביל IgA PPD ספציפי, להשאיר בארות IgA הכולל עם 100 μl חיץ כביסה במהלך הדגירה זה. - לשטוף שלוש פעמים עם 200 μl / טוב של כביסה buffer.0170004
- הוספת 100 μl של peroxidase חזרת (HRP), מצומדות אנטי עכבר IgA מדולל חסימת חיץ (1 / 10,000).
- דגירה RT שעה 1.
- חמש פעמים לשטוף עם 200 μl / היטב חיץ כביסה.
- הוספת 100 μl / טוב של 3,3 ', 5,5'-Tetramethylbenzidine (TMB). דגירה 20 דקות בטמפרטורת החדר ב tהוא כהה.
- הוספת 100 μl / טוב של H 2 SO 0.5N 4. קראו את הצלחת ספקטרופוטומטר באורך גל של 450 ננומטר.
6. קביעת עומס חיידקי בריאות
- המגון ציפוי ריאות
- ארבעה שבועות לאחר אתגר, להקריב את העכבר על ידי נקע בצוואר הרחם (או מתודולוגיה אנושי מקובלות אחרות) ולהבטיח העכבר מת נגיעה גלגל העין כדי לאשר הנעדר של רפלקס מצמוץ.
- מניח את העכבר במצב שכיבה קבוע על משטח שטוח ולחטא בתוך מכסה מנוע זרימה למינרית.
- עושים חתך ולהסיר את העור מאזור החזה לעזוב גלוי באזור החזה.
- חותכים את הצלעות לקצור את הריאות והלב באמצעות מספריים מלקחיים סטרילית. מניחים איברים על משטח נקי.
- יש לנקות את הריאות על ידי הסרת הלב, קנה הנשימה ורקמות החיבור ולהעביר את הריאות אל צינור 1.5 מ"ל עם 1 מ"ל של מים ללא יונים(לשמור על הקרח עד עיבוד).
- שימוש במלקחיים סטרילי להעביר את הריאות של כל עכבר לתוך צינור הולם המגון איבר (M - צינור Dissociator), המכילה 1 מ"ל של מים ללא יונים.
- מניחים את הצינור ב Dissociator רקמות ולהשתמש RNA_1 תוכנית מוגדרת מראש כדי homogenise הריאות.
- הפוך חמישה דילולים סדרתי של פי עשרה צינורות 1.5 מ"ל, החל עם 100 μl של homogenate ריאות מדולל 900 μl.
- דילולים פלייט כמתואר 1.11-1.14.
- בידול בין BCG ו H37Rv ידי PCR
הערה: את הצלחות מן 6.1.6 המתאים לקבוצה חוסנה עם BCG ידי תוואי אפים, נתחנו מספר מייצג של מושבות על ידי PCR הבחנה בין BCG ו H37Rv מנת להבטיח כי CFU נחשב להעריך יעילות מגן-נתונות חיסון תואמת באופן ייחודי H37Rv. הגברת מטרות PCR זה של RD9, אזור גנומי שונה BCG ומ 'tuberculosis, נותן שבר של 2618 נ"ב עבור H37Rv, ו 465 נ"ב עבור BCG 11.- הכינו מלאי מיקס מאסטר עבור כל הדגימות עם כרכים לדגימה כמצוין, ולאחר מכן להפיץ צינורות PCR (9 μl / מדגם).
הערה: הצפת 5x: 2 μl. פריימר קדימה 25 מיקרומטר (GTGTAGGTCAGCCCCATCC): 0.32 μl, הפוך פריימר 25 מיקרומטר (GCCCAACAGCTCGACATC): 0.32 μl, פולימראז תקי 5 יחידות / μl: 0.04 μl, Deionized H 2 O: 6.32 μl. - גע מושבה עם קיסם סטרילי לטבול את הקיסם עם המדגם בצינור PCR המכיל מיקס מאסטר.
- הפעל את ה- PCR עם התוכנית הבאה: 10 דק '95 ° C (שלב זה היא לעורר הפרעה בקטריאלי), 10 דק' 95 ° C (שלב זה היא לעורר הפרעה בקטריאלי), 35 מחזורים (30 שניות על 95 מעלות צלזיוס, 1 דקות ב -58 ° C ו 4 דק 'ב 72 מעלות צלזיוס).
- טען את דגימות ה- PCR בתוך ג'ל agarose 1% עם דגימות ברומיד ethidium וברח לדמיין את שברי.
- הכינו מלאי מיקס מאסטר עבור כל הדגימות עם כרכים לדגימה כמצוין, ולאחר מכן להפיץ צינורות PCR (9 μl / מדגם).
תוצאות
עבודה זו מתארת את ההשוואה של שני מסלולים של ממשל של BCG: תת עורי אף. מסלול תת עורי ניתן להשוות את intradermal, המהווה את הציר הקליני הנוכחי עבור BCG ברחבי העולם. מסלול אפי חיסון שואף לחקות את הקו הטבעי של זיהום של M. שחפת, במטרה להשרות תגובה חיסונית ישירות לריאות, איבר היעד העיקרי של הפתוגן.
איור 1 מתאר את זרימת העבודה אחריו. שמונה עד עשר בן שבוע הנקבה DBA / 2 עכברים מחוסנים עם 10 6 CFU של BCG דנית ידי תוואי תת עורית או אפי של הממשל. שמונה שבועות לאחר מכן, קבוצה של עכברים הוא הקריב לנתח בתגובת ריאות חיסונית הנגרמת על ידי חיסון. דגימות BAL מתקבלות ראשונות ולאחר מכן אנחנו קוצרים ריאות. על מנת ללמוד יעילות מגן-נתונות חיסון, אנו לחסן differeקבוצה של עכברים NT עם אתגר אפי במינון נמוך של M. זן שחפת H37Rv. חודש לאחר מכן, נקריב חיות וריאות קציר. במקרה זה, עבור כל חיה שאנו משתמשים הריאה השמאלית כדי לקבוע עומס חיידקים ואת הריאה הימנית להעריך-אתגר פוסט תגובה חיסונית עקב חיסון. המטרה היא ליצור עומס חיידקים ונתוני תגובה חיסוניים בריאות עבור כל חיה כדי ללמוד וקושרת פוטנציאל של הגנה.
כפי שניתן לראות בתרשים 2, הריאות היו מנותקים להשיג גם של homogenate איבר או השעיה הסלולר. ריאות הומוגני היו מצופות על מצע אגר מוצק לקבוע עומס חיידקים ארבעה שבועות לאחר אתגר. השעיה סלולרית ללמוד תגובה חיסונית עקב חיסון הושגה בעקבות עיכול אנזימטי ריאות עם D collagenase ו DNaseI.
התוצאות שלנו מצביעות בבירור כי, כאשר t לעומתo התוואי תת עורית, תוואי אפי חיסון מקנה יעילות מגן הרבה יותר ריאות ארבעה שבועות לאחר האתגר (איור 3 א). בנוסף, אנו מאשרים כי עומס חיידקי בריאות מקבוצת BCG-חיסון intranasal מתאים H37Rv ולא חיסון BCG. לשם כך, ניתחנו מספר מייצג של מושבות מהקבוצה הזאת על ידי PCR ספציפיים עבור האזור הגנום RD9, אשר מגביר שברי אורך שונים BCG ומ שחפת (איור 3 ב). איור הראה בבירור כי כל המושבות מנותחות ספקו שבר של 0.4 KBP, אשר תואם H37Rv.
הנתונים שלנו גילו קורלציה בין יעילות מגן שמעניקה חיסון BCG אפי ואת תגובה חיסונית עקב חיסון בריאות לפני לאתגר. אפי BCG בבירור מופעלות IL17 גבוה וייצור IFNγ הריאות, שהיא נמדדת על ידי ELISA (איור4A). נתונים אלה אושרו על ידי מכתים תאי (ICS) ו cytometry זרימה (מידע לא מוצג). בנוסף, מצאנו גם ריכוז גבוה של שניהם ריכוז IgA סך PPD ספציפי בדגימות BAL (איור 4 ב), המציין כי חיסון BCG ריאתי גורם הייצור של IgA ו טרנסלוקציה דרכי הנשימה.
לבסוף, למדנו תגובה חיסונית הנגרמת BCG ריאות לאחר האתגר (איור 5). הנתונים שלנו נמצאו הבדלים בין IL17 ו IFNγ; IL17A לייצור CD4 + תאים התגלו רק בקבוצת BCG אפי, ואילו תאים מייצרים IFNγ נמצאו בכל הקבוצות נגועות H37Rv ללא קשר לחיסון. ייצוג הנתונים של כל חיה המתאימה תאי מייצרי IL17 ו עומס חיידקים הראה קשר מובהק בין הנוכחות של IL17 והפחתת עומס ריאות חיידקית, אשר לא נצפה במקרה של IFNγ.
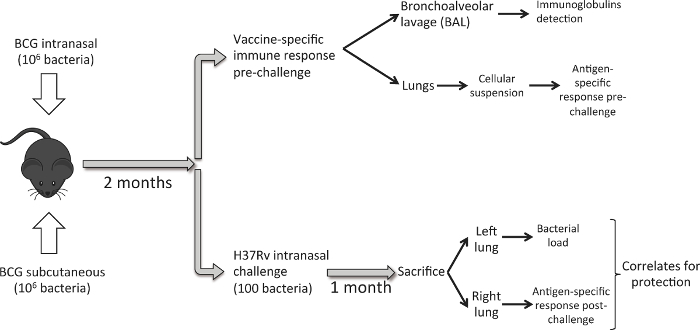
באיור 1. Workflow להשוואת אפים ואת תת עורי כביש של BCG חיסון. שמונה שבועות לפרסם חיסון BCG, קבוצה של עכברים (6 לכל קבוצת ניסוי) משמש כדי לקצור ריאות ולבצע BAL, ולנתח תגובה חיסונית ריאתי מושרה על ידי חיסון. קבוצה נוספת של עכברים (6 / קבוצה), הוא מחוסן עם אתגר אפים במינון נמוך של M. זן שחפת H37Rv (100 CFU). חודש לאחר מכן, חיות מוקרבים ואת עומס חיידקי מנותחת הריאה השמאלית התגובה החיסונית PPD ספציפי בריאה הימנית. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
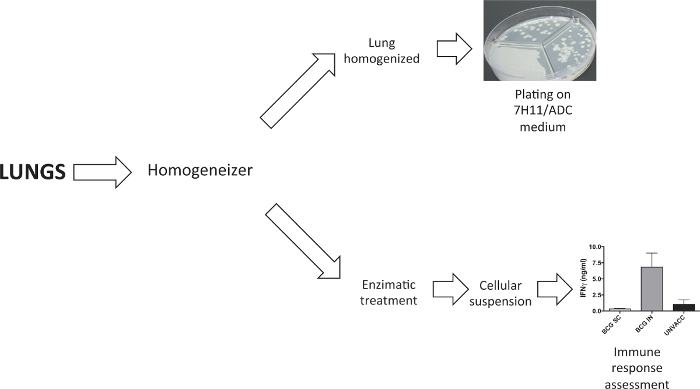
עיבוד איור 2. דוגמאות ריאות. Dissociator רקמות שמש לעבד ריאות. בניסויים כדי לקבוע עומס חיידקים, ריאות היו homogenised לפני הצלחת אותם במדיום אגר מוצק. בניסויים הדורשים השעיה הסלולר ריאות, זה נוצר בעקבות עיכול אנזימטי עם D collagenase ו DNaseI. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 3. מגן יעיל שמעניק BCG חיסון. קבוצות של 6 DBA / 2 עכברים שחוסנו על ידי תת עורית (SC BCG), אפים (BCG ב) מסלול, או שלא חוסן (Unvacc) עם חיסון BCG דנית 10 6 CFU. בשתיים חודשים לאחר חיסון, עכברים היו מחוסנים intranasally עם מינון נמוך (100CFU) אתגר H37Rv, ושלושה חודשים לאחר מכן נטל חיידקים הריאות נקבע. ניסוי נציג השני מוצג עצמאי. (א) נתונים בגרפים מיוצגים כממוצע + SD. כיוון אחד מבחן ANOVA עם ניתוח שלאחר Bonferroni בוצע לחשב מובהק סטטיסטי. (ב) מספר מייצג של מושבות אחת מקבוצת אפי BCG נותחו על ידי ספציפי PCR עבור אזור RD9 (שונה הגנומים BCG ו H37Rv) להבחין BCG ו מושבות H37Rv. (פורסם בעבר 9). נא ללחוץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 4. חיסון ספציפי ריאה חיסון התגובה נתחה לפני אתגר עם H37Rv. קבוצות של 6 DBA / 2 עכברים היוחוסן על ידי תת עורית (SC BCG) או אף (BCG ב) מסלול, או שלא חוסן (Unvacc) עם חיסון BCG דנית 10 6 CFU. (א) בשעה חודשית-חיסון פוסט, השעיה הסלולר מריאות שנקטפו הושגה. תאים היו מגורה עם PPD כמתואר בסעיף שיטות IL17A (פאנל משמאל) IFNγ (פאנל מימין) ייצור נותחו על ידי ELISA. (ב) סה"כ IgA, ומ שחפת (MTB) -specific IgA נותח ממדגם BAL ידי ELISA. נתונים ונקווה משני ניסויים בלתי תלויים מוצגים. נתונים בגרפים מיוצגים כממוצע + SD. (פורסם בעבר 9). נא ללחוץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
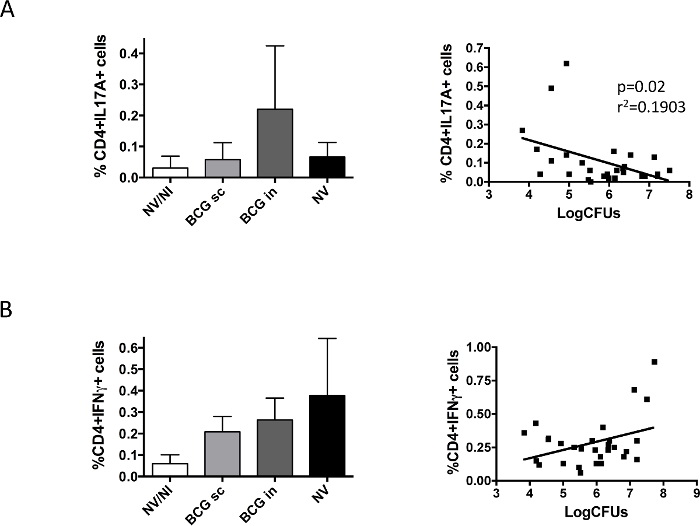
איור 5. חיסון ספציפיתגובת ריאתי חיסון נתחה לפני אתגר עם H37Rv. קבוצות של 6 DBA / 2 עכברים שחוסנו על ידי תת עורית (SC BCG) או אף (BCG ב) מסלול, או שלא חוסן (NV) עם חיסון BCG דנית 10 6 CFU. קבוצת ביקורת של עכברים שלא חוסנו, שאינם נגועים גם נכללה (NV / NI). בשניים חודשים לאחר חיסון, עכברים היו תיגר intranasally עם מנת H37Rv נמוכה (100 CFU), ומאוחר יותר של חודש אחד חיות היו מורדמות. הריאות על ימין ועל שמאל מאותה חיה שימשו כדי לקבוע עומס חיידקי ו IL17A- (א) או IFNγ- (B) בהפקת CD4 + תאים, בהתאמה. נתונים בפנלי שמאל מתאימים אחוז התאים מייצרי ציטוקינים נמדדו באמצעות flow cytometry, ומיוצגים כממוצע + SD. לוחות מימין לייצג נתוני עומס בקטריאלי cytokine- לייצר תאי CD4 + המתקבל עבור כל עכבר. רגרסיה לינארית חושבה ואת p-הערך המתקבל בכל מקרה מוצג המקרה של IL17A. אקווהנתונים משני ניסויים בלתי תלויים שמוצגים באיור. (פורסם בעבר 9). נא ללחוץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
Although current vaccine against tuberculosis, BCG, is the most widely administered vaccine in history, tuberculosis remains one of the leading causes of death and morbidity from infectious diseases worldwide. This paradox is explained by the lack of protection of this vaccine against pulmonary tuberculosis, the responsible form of transmission. New vaccination approaches effective against pulmonary forms of the disease are urgently needed, as they would have the greatest impact on disease transmission globally.
Our data clearly show that a change in the route of administration of BCG to mimic the natural route of infection could be a successful strategy to prevent pulmonary tuberculosis. Our results are in accordance with other authors showing equivalent data in different animal models, including guinea pigs and non-human primates (NHP) 6,9,12.
Remarkably, our unpublished data indicated that the volume of administration by the intranasal route is a critical step of the protocol. These results revealed that following intranasal delivery of 100 H37Rv bacteria resuspended in 10 μl (instead of 40 μl), we only recovered lung CFUs from around 20% of the animals (data not shown.
Importantly, one of the possible limitations of intranasal administration as a vaccine delivery route in clinic could be its proximity with the central nervous system13,14. In this regard, aerosol immunization might be safer as delivery route for pulmonary tuberculosis vaccines in humans.
This protocol describes a standardized methodology that can be adapted to other studies, as comparison of pulmonary vaccines, or different routes of pulmonary immunization, including aerosol.
Our data suggest that the analysis in parallel of protective efficacy and immune response, using lung samples from the same animal, could be a useful tool to identify biomarkers of protection. In this regard, our results reveal that lung IL17, but not IFNγ, seems to correlate with a better vaccine protective efficacy. These data highlight a possible role of IL17 in the protective response induced by intranasal BCG, which is in accordance with data reported by other authors using mucosal subunit TB vaccines 7,15. Our data also indicate that presence of IgA (both total and MTB-specific) in BAL samples correlates with protection conferred by intranasal BCG. Importantly, we described previously, in agreement with other works, that IL17 contributes to traslocation of IgA to respiratory airways and gut lumen.9,16,17
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by "Spanish Ministry of Economy and Competitiveness" [grant number BIO2014-5258P], "European Commission" by the H2020 programs [grant numbers TBVAC2020 643381].
Materials
| Name | Company | Catalog Number | Comments |
| Middlebrook 7H9 broth | BD | 271310 | |
| Middlebrook ADC Enrichment | BD | 211887 | |
| Tween 80 | Scharlau | TW00800250 | |
| 3-mm diameter Glass Beads | Scharlau | 038-138003 | |
| Middlebrook 7H10 Agar | BD | 262710 | |
| 1-ml syringe 26GA 0.45x10 mm | BD | 301358 | |
| GentleMACS dissociator | Miltenyi Biotec | 130-093-235 | |
| C tubes | Miltenyi Biotec | 130-093-237 | |
| M tubes | Miltenyi Biotec | 130-093-236 | |
| Collagenase D | Roche | 11088882001 | |
| DNaseI | Applichem | A3778,0100 | |
| Falcon 70µm Cell Strainer | Corning | 352350 | |
| RPMI 1640 | Sigma | R0883 | |
| Red Blood Cell Lysing Buffer | Sigma | R7757 | |
| GlutaMAX Supplement | Gibco | 35050-061 | 100X concentrated |
| Penicillin-Streptomycin Solution | Sigma | P4333 | 100X concentrated |
| Fetal Calf Serum | Biological Industries | 04-001-1A | |
| 2-Mercaptoethanol | Sigma | M3148-25ML | |
| Scepter 2.0 Handheld Automated Cell Counter | Millipore | PHCC20040 | |
| Scepter Cell Counter Sensors, 40 µm | Millipore | PHCC40050 | |
| Mycobacterium Tuberculosis - Tuberculin PPD | Statens Serum Institut (SSI) | 2390 | |
| Mouse IFN-γ ELISA development kit | Mabtech | 3321-1H | |
| Mouse IL17A ELISA development kit | Mabtech | 3521-1H | |
| Brefeldin A | Sigma | B7651 | |
| FITC Rat Anti-Mouse CD4 | BD | 553047 | |
| BD Cytofix/Cytoperm Kit | BD | 555028 | |
| APC-Cy7 Rat Anti-mouse IL-17A | BD | 560821 | |
| APC Mouse Anti-mouse IFNg | BD | 554413 | |
| LACHRYMAL OLIVE LUER LOCK 0.60 x 30 mm. 23G x 1 1/4” | UNIMED | 27.134 | Used as trachea cannula for BAL |
| high-protein binding polystyrene flat-bottom 96-well plates MAXISORP | NUNC | 430341 | |
| Albumin, from bovine serum | Sigma | A4503 | |
| Goat Anti-Mouse IgA (α-chain specific)−Peroxidase antibody | Sigma | A4789 | |
| 3,3′,5,5′-Tetramethylbenzidine (TMB) | Sigma | T0440 | |
| MyTaq DNA Polymerase | Bioline | BIO-21107 | The kit Includes Buffer 5x |
References
- Zumla, A., et al. The WHO 2014 global tuberculosis report--further to go. Lancet Glob Health. 3 (1), e10-e12 (2015).
- Mangtani, P., et al. Protection by BCG vaccine against tuberculosis: a systematic review of randomized controlled trials. Clin Infect Dis. 58 (4), 470-480 (2014).
- Aguilo, N., et al. Pulmonary Mycobacterium bovis BCG vaccination confers dose-dependent superior protection compared to that of subcutaneous vaccination. Clin Vaccine Immunol. 21 (4), 594-597 (2014).
- Chen, L., Wang, J., Zganiacz, A., Xing, Z. Single intranasal mucosal Mycobacterium bovis BCG vaccination confers improved protection compared to subcutaneous vaccination against pulmonary tuberculosis. Infect Immun. 72 (1), 238-246 (2004).
- Giri, P. K., Verma, I., Khuller, G. K. Protective efficacy of intranasal vaccination with Mycobacterium bovis BCG against airway Mycobacterium tuberculosis challenge in mice. J Infect. 53 (5), 350-356 (2006).
- Lagranderie, M., et al. BCG-induced protection in guinea pigs vaccinated and challenged via the respiratory route. Tuber Lung Dis. 74 (1), 38-46 (1993).
- Gopal, R., et al. Interleukin-17-dependent CXCL13 mediates mucosal vaccine-induced immunity against tuberculosis. Mucosal Immunol. 6 (5), 972-984 (2013).
- Khader, S. A., et al. IL-23 and IL-17 in the establishment of protective pulmonary CD4+ T cell responses after vaccination and during Mycobacterium tuberculosis challenge. Nat Immunol. 8 (4), 369-377 (2007).
- Aguilo, N., et al. Pulmonary but Not Subcutaneous Delivery of BCG Vaccine Confers Protection to Tuberculosis-Susceptible Mice by an Interleukin 17-Dependent Mechanism. J Infect Dis. , (2015).
- Middlebrook, G., Cohn, M. L. Bacteriology of tuberculosis: laboratory methods. Am J Public Health Nations Health. 48 (7), 844-853 (1958).
- Brosch, R., et al. A new evolutionary scenario for the Mycobacterium tuberculosis complex. Proc Natl Acad Sci U S A. 99 (6), 3684-3689 (2002).
- Kaushal, D., et al. Mucosal vaccination with attenuated Mycobacterium tuberculosis induces strong central memory responses and protects against tuberculosis. Nat Commun. 6, 8533 (2015).
- Lochhead, J. J., Thorne, R. G. Intranasal delivery of biologics to the central nervous system. Adv Drug Deliv Rev. 64 (7), 614-628 (2012).
- Lochhead, J. J., Wolak, D. J., Pizzo, M. E., Thorne, R. G. Rapid transport within cerebral perivascular spaces underlies widespread tracer distribution in the brain after intranasal administration. J Cereb Blood Flow Metab. 35 (3), 371-381 (2015).
- Griffiths, K. L., et al. Cholera toxin enhances vaccine-induced protection against Mycobacterium tuberculosis challenge in mice. PLoS One. 8 (10), e78312 (2013).
- Hirota, K., et al. Plasticity of Th17 cells in Peyer's patches is responsible for the induction of T cell-dependent IgA responses. Nat Immunol. 14 (4), 372-379 (2013).
- Jaffar, Z., Ferrini, M. E., Herritt, L. A., Roberts, K. Cutting edge: lung mucosal Th17-mediated responses induce polymeric Ig receptor expression by the airway epithelium and elevate secretory IgA levels. J Immunol. 182 (8), 4507-4511 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved