Method Article
Защитные Эффективность и легочная иммунный ответ После подкожного и Интраназальная БЦЖ администрации у мышей
В этой статье
Резюме
We herein detail the methodology followed to compare protective efficacy and lung immune response induced by intranasal and subcutaneous immunization with BCG in mouse model. Our results show the benefits of pulmonary vaccination and suggest a role for IL17-mediated response in vaccine-induced protection.
Аннотация
Despite global coverage of intradermal BCG vaccination, tuberculosis remains one of the most prevalent infectious diseases in the world. Preclinical data have encouraged pulmonary tuberculosis vaccines as a promising strategy to prevent pulmonary disease, which is responsible for transmission. In this work, we describe the methodology used to demonstrate in the mouse model the benefits of intranasal BCG vaccination when compared to subcutaneous. Our data revealed greater protective efficacy following intranasal BCG administration. In addition, our results indicate that pulmonary vaccination triggers a higher immune response in lungs, including Th1 and Th17 responses, as well as an increase of immunoglobulin A (IgA) concentration in respiratory airways. Our data show correlation between protective efficacy and the presence of IL17-producing cells in lungs post-Mycobacterium tuberculosis challenge, suggesting a role for this cytokine in the protective response conferred by pulmonary vaccination. Finally, we detail the global workflow we have developed to study respiratory vaccination in the mouse model, which could be extrapolated to other tuberculosis vaccines, apart from BCG, targeting the mucosal response or other pulmonary routes of administration such as the intratracheal or aerosol.
Введение
Туберкулез (ТБ) является одним из ведущих инфекционных заболеваний , вызывающих более связанных смертей , чем ВИЧ в мире , и в сочетании с растущим увеличением штаммов , устойчивых ко многим лекарственным делает туберкулез становится тревожной глобальной проблемой здравоохранения 1. Новые диагностические инструменты, более эффективные и менее токсичные препараты, а также новые безопасные и эффективные вакцины ТБ острая необходимость, особенно в развивающихся странах.
Живой ослабленный Кальметта-Герена (БЦЖ) в настоящее время является единственным лицензированным вакцина против туберкулеза, который был вводят внутрикожно при рождении с 1970 года во всем мире. BCG считается эффективным в предотвращении тяжелых форм заболевания (менингит и милиарный туберкулез) у детей, но показал противоречивую эффективность против туберкулеза легких , ответственной передачи заболевания 2.
Легочная вакцинация, которая имитирует естественный путь заражения туберкулезом, представляет собой привлекательный подход для грунтования иммунного ответа локального хостаs. В связи с этим, различные доклинических работ в различных соответствующих моделей ТБ на животных показали большую эффективность вакцины ниже легочной иммунизации , по сравнению с подкожным или внутрикожно 3-6. Тем не менее, защитные механизмы, спровоцированные вакцинацией легких недостаточно хорошо изучены. В последние годы, несколько работ указывали на IL17-опосредованной реакции в качестве важного фактора ТБ специфических слизистых оболочек иммунного ответа, как и в моделях мыши , дефицитные по IL17 слизистого поствакцинальный защитной эффективности нарушается 7,8.
Недавно мы показали впервые , что интраназальное введение БЦЖ защищены / 2 мышей DBA, штамм мыши , характеризующийся отсутствием защиты после подкожной иммунизации БЦЖ 9. Эти результаты свидетельствуют о том, что вакцинация туберкулезом органов дыхания может быть более эффективным в снижении темпов туберкулеза в эндемичных странах, где внутрикожные БЦЖ считается неэффективным против pulmonичных ТБ.
протокол
Все мыши содержались в контролируемых условиях и наблюдалось каких-либо признаков заболевания. Экспериментальная работа проводилась в соответствии с европейскими и национальными директивами по защите экспериментальных животных, а также с согласия компетентных местных комитетов по этике.
1. Приготовление квантифицированных глицерол Запасы БЦЖ датского и микобактерий туберкулеза H37Rv
Примечание: Все протоколы, описанные были выполнены в условиях BSL3.
- Размораживайте запасы глицерина БЦЖ датском или штаммов H37Rv и инокуляции 100 мкл в 10 мл 7H9 среды 10 , дополненных с твин-80 0,05% (об / об) и АЦП (альбумин, декстроза, каталаза) 10% (об / об).
- Выдержите в статических условиях в течение одной недели при 37 ° С до тех пор, пока культура в росте лог-фазы.
- Интенсификация бактериальной культуры путем переноса 10-мл культуры до 200 мл свежей среды. Выдержите в течение 20 дополнительногодней в статических условиях.
- Переход к 50-мл центрифужные пробирки и центрифуги в течение 15 мин при 2500 х г.
- Откажитесь супернатантов и ресуспендируют осадок в бактериальную остаточного объема. Добавить в каждую пробирку стерильные 3-мм диаметра стеклянных шариков (10 - 15 на пробирку).
- Vortex энергично в течение 1 мин для того, чтобы отделить бактериальные сгустки. Ресуспендируют каждую гранулу в 10 мл PBS с Tween-80 0,05% (об / об).
- Оставьте пробирки в течение 10 мин, позволяя наибольшие бактериальные агрегаты и стеклянные бусы осесть.
- Восстановление 9,5 мл надосадочной жидкости из каждого из 4-х трубок, содержащих небольшие комки и единичные бактерии и объемы передачи данных в один свежий 50-мл центрифужную пробирку (конечная выздоровел объем 38 мл). Центрифуга в течение 10 мин при 400 х г.
- Восстановление 35 мл надосадочной жидкости (содержащие в основном одиночные бактерии) в одной свежей 50-мл центрифужную пробирку и добавляют 15 мл PBS с глицерином 50% (об / об), получая конечную концентрацию глицерина в 15% (об / об).
- осторожно перемешатьи распространять в 1-мл аликвотами в соответствующие пробирки для замораживания. Хранить при температуре -80 ° С (одна серия обеспечивает примерно 50 аликвоты глицерине).
- Для количественной оценки запасов глицерина, оттаивать глицерина на следующий день после замораживания и выполнить семь десятикратном серийных разведений в отдельных 1,5 мл пробирки, содержащие 900 мкл PBS.
- Пластина 100 мкл каждого разбавления в 7H10 твердой агаровой среде , дополненной 10 АЦП 10% (об / об) , полученного в чашках Петри диаметром 55 мм.
- Осторожно добавьте 3 мм диаметра стеклянных шариков (прибл. 10 на чашку) и осторожно встряхните пластину равномерно распределяют объем над агаром. Откажитесь шарики и печать агаризованной с парафином.
- Инкубируют в течение 21 дней при 37 ° С и определяют концентрации бактерий путем подсчета колониеобразующих единиц (КОЕ) в разведениях, где единичные колонии можно точно отличить.
2. Мышь Вакцинация
- Оттепель предварительно количественно БЦЖ глицерина и разбавить его в PBS, чтобы препдве суспензии. Расчет конечного объема с учетом дозы на одно животное составляет 100 мкл для подкожного введения (10 7 КОЕ на мл для подкожной вакцинации) и 40 мкл для интраназального введения (2,5 х 10 7 КОЕ для интраназальной вакцинации).
- Используйте специализированную рабочую станцию для анестезии для грызунов обезболить мышей смесью изофлуран и кислорода. Использование изофлурановым 5%, чтобы вызвать анестезию, и 2% для поддержания мышей в анестезии камере. (Другой метод анестезии общепринятый может быть использован).
- Для подкожного введения вакцины заполняют 1 мл шприц с иглой 26 G 1 мл бактериальной суспензии (10 7 КОЕ / мл). Удалить пузырьки воздуха.
- Поместите наркозом мышь на ровной поверхности в положении лежа внутри ламинарный и прививают подкожно 100 мкл (10 6 КОЕ / доза) вакцины в бочке мыши обратно. Вернуть мышь к клетке и следить за ним, чтобы убедиться, что он PropeRly восстанавливается после анестезии.
- Измените иглу шприца между каждым введением мыши. Удалены пузырьки воздуха, как описано выше.
- Для интраназального введения, поместите наркозом мышь в положении лежа на спине внутри капота.
- С помощью микропипетки принять 20 мкл суспензии 2,5 × 10 7 КОЕ / мл. Поместите инокулята капельный между двумя ноздрями, пока весь объем не был сдан, оставляя время между каплями, чтобы позволить мышь дышать громкость. Примечание: мыши могут страдать от дыхательной недостаточности во время этой процедуры, таким образом они должны быть оставлены на ассимилировать каждую каплю перед администрировать следующий, чтобы предотвратить его как можно больше.
- Повторно заполнить микропипетки с еще 20 мкл и повторить операцию. Если мышь начинает просыпаться от наркоза после первой прививки, поместите его в наркоз камере до второго. Вернуть мышь к клетке и убедитесь, что он правильно восстанавливаетот наркоза.
3. Мышь Интраназальная Вызов с H37Rv Strain
- Разморозить предварительно количественно H37Rv глицерина и разбавить его в PBS для приготовления бактериальной суспензии в 2500 КОЕ на мл. Расчет конечного объема с учетом дозы на одно животное составляет 40 мкл.
- H37Rv, засевают интраназально, как описано в 2.5 - 2.7. Окончательная доза вызов на мышь 10 2 КОЕ / 40 мкл.
4. Анализ индуцированного иммунного ответа в Легких
- Легкое сотовая подвеска
Примечание: Оценка поствакцинальный адаптивного иммунного ответа в легких требует генерации суспензии отдельных клеток. Для этой цели мы используем диссоциатора ткани, такие как GentleMACS.- Жертвоприношение мыши по цервикальной дислокации (или другой общепринятой методологии гуманной) и обеспечить мышь мертва касаясь глазного яблока, чтобы подтвердить отсутствующим мигательного рефлекса.
- Внутри ламинаре, извлечь лUngs используя стерильные ножницы и пинцет и поместить их на чистую поверхность. Чистые легкие удаления трахеи и соединительной ткани, а не передавать легкие в 1,5-мл пробирку с PBS (поддерживать на льду до обработки).
- Для создания клеточной суспензии, поместить легкие в правильной трубки для диссоциации органов (С-Диссоциатор трубки) , содержащей 5 мл 10 мМ HEPES-NaOH , рН 7,4, 150 мМ NaCl, 5 мМ KCl, 1 мМ MgCl 2 и 1,8 мМ CaCl 2 буфер.
- Добавьте 100 мкл коллагеназы D 100 мг / мл (2 мг / мл конечной концентрации), и 40 мкл ДНКазы I 20000 МЕ / мл (160 МЕ / мл конечной концентрации.
Примечание: Маточные растворы коллагеназы D или DNAseI получают , растворяя лиофилизированный ферментов в PBS или глицерин 50% (об / об), 20 мМ Трис-HCl , рН 7,5 г MgCl 2 1 мМ, соответственно. - Поместите пробирку в диссоциатора ткани и использовать предопределенный программу m_lung_01 для фрагментации легких. Инкубируйте пробирку при 37 ° С в водяной бане в течение 30 мин.
- Место йе трубки в диссоциатора и использовать предопределенный программу m_lung_02 для полной гомогенизации легких в одной клеточной суспензии.
- Пропускают клеточной суспензии через сетчатый фильтр из нейлона ячейки 70 мкм, установленной на центрифужную пробирку на 50 мл. Промыть сетчатый фильтр с 10 мл RPMI 1640 среды.
- Центрифуга клетки в течение 5 минут при 400 мкг и отбросить супернатант.
- Добавить 1 мл эритроцитов лизиса буфера, перемешать встряхиванием и инкубировать в течение 1 мин при комнатной температуре.
- Добавьте 10 мл среды RPMI 1640 и центрифужные клеток в течение 5 минут при 400 х г.
- Ресуспендируют клеток в 0,5 мл полной среды RPMI 1640, дополненной 10% инактивированной нагреванием фетальной телячьей сывороткой (FCS), 2 мМ L-глутамина, 100 мкг / мл стрептомицина, 100 МЕ / мл пенициллина и 50 мкМ 2-меркаптоэтанола.
Примечание: FCS, инактивируют путем инкубирования при 56 ° С в течение 30 минут. - Граф клеток и добавить полную среду RPMI 1640 , чтобы достичь окончательной клеточной плотности 10 7 клеток / мл.
ПРИМЕЧАНИЕ: Для подсчета клеток, мы используем автоматический счетчик клеток. - Распределить 100 мкл клеточной суспензии в U-образным дном 96-луночного стерильной пластины (10 6 клеток / лунку).
- Добавить 50 мкл / лунку полной среды RPMI 1640 с 15 мкг / мл коммерческой H37Rv очищенного белкового деривата (PPD) (5 мкг / мл конечная концентрация).
- Супернатант коллекция для определения цитокинов ELISA
- Инкубируйте пластины от 4.1.14 в течение 48 ч при температуре 37 ° С и 5% CO 2.
- Центрифуга пластины в течение 5 мин при 400 мкг и восстановить 100 мкл супернатанта.
- Хранить при температуре -80 ° С.
- Развести супернатанты 1/10 и 1/2 в аналитическом буфере для определения и IFN & gamma; IL17A соответственно. Определение концентрации цитокинов с использованием коммерческих наборов ELISA, в соответствии с инструкциями производителя (наборы ELISA развития).
- Внутриклеточное окрашивание для определения цитокина-продуцирующих клеток CD4 + с помощью проточной цитометрии
- Инкубируйте пластины от 4.1.14 в течение 18 часов при температуре 37 ° С и 5% CO 2.
- Добавить 1,5 мкл брефелдин 1 мг / мл (запас растворенного в ДМСО) в каждую лунку (10 мкг / мл конечной концентрации) и инкубировать в течение шести дополнительных часов.
- Центрифуга пластину из 4.3.2 в течение 1 мин при 3200 мкг и отбросить супернатант.
- Ресуспендируют клеток в 50 мкл анти-мыши CD4-FITC разведенных в среде RPMI 1640 с добавлением 10% FCS (1/500) и инкубируют в течение 10 мин при температуре 4 ° С.
- Центрифуга пластину из 4.3.4 в течение 1 мин при 3200 мкг, отбросить супернатант и добавить 100 мкл раствора фиксации / лунку. Инкубируют при температуре 4 ° С в течение 20 мин.
- Вымойте клетки дважды с 150 мкл / промывки пермеабилизации раствора.
Примечание: 10-кратный концентрированный запас разбавленного в деионизированной воде для приготовления 1х рабочего раствора. - Ресуспендируют клеток в 50 мкл анти-мыши IFN & gamma; APC и анти-мыши IL17A-APC.Cy7 разводили в permeabilРешение зация (1/250 оба антитела).
- Инкубировать в течение 1 часа при комнатной температуре.
- Вымойте клетки дважды с 150 мкл / промывки пермеабилизации раствора.
- Ресуспендируют клеток в 200 мкл PBS для приобретения цитометрии потока.
5. Анализ иммуноглобулинов в БАЛ (BAL)
- Получение образцов БАЛ
- Жертвоприношение мыши по цервикальной дислокации (или другой общепринятой методологии гуманной) и обеспечить мышь мертва касаясь глазного яблока, чтобы подтвердить отсутствующим мигательного рефлекса.
- Expose трахеи с использованием надлежащей точности стерильного пинцета и ножниц и выполнить небольшой надрез в трахее, убедившись, что не иссечь его полностью. Будьте осторожны, чтобы не вызвать кровотечение, которое может загрязнить образец BAL.
- Введем в трахею канюлю, соединенную с стерильным 1 мл шприц с 800 мкл охлажденного льдом PBS.
- Привить медленно PBS в легкие, а затем гЭковер БАЛ объем оттягивая поршень шприца очень медленно, чтобы избежать коллапса легких.
Примечание: Восстановление от 500 до 600 мкл является удовлетворительным. - Перенести объем BAL в 1,5 мл трубки и подтвердить БАЛ остается неокрашенной, указывая, что не загрязненные кровью (поддерживать на льду до обработки).
- Центрифуга образцов BAL в течение 5 мин при 400 мкг, и передачи супернатант в новую пробирку.
- Хранить надосадочную жидкость при температуре -80 ° С.
- Определение IgA в БАЛ супернатантах
Примечание: Все используемые реагенты при комнатной температуре.- Пальто с высоким содержанием белка связывания полистирола с плоским дном 96-луночные планшеты с 100 мкл PPD разбавленных в PBS (10 мкг / мл) для M. туберкулез -специфический определение IgA, или 100 мкл БАЛ супернатанта разводили в 10 раз в PBS для определения общего IgA.
- Инкубируют в течение ночи при температуре 4 ° С.
- Удалите супернатант и нажмите планшет на бумажное полотенце, чтобы dгу. Промыть 200 мкл / лунку PBS.
- Блок с 200 мкл / лунку бычьего сывороточного альбумина (БСА) на 1% (вес / объем) в PBS-Tween-80 0,05% (об / об) (блокирующем буфере).
- Инкубируют 1 час при комнатной температуре.
- Промывают один раз 200 мкл / лунку PBS-Tween-80 0,05% (об / об) (промывочным буфером).
- Добавьте 100 мкл неразбавленного БАЛ супернатанте в лунках PPD покрытием. Выдержите два часа при комнатной температуре.
Примечание: Если общее определение IgA осуществляется параллельно с PPD-специфического IgA, оставить общий IgA лунки со 100 мкл буфера для промывки во время инкубации. - Промыть три раза с 200 мкл / лунку промывочного buffer.0170004
- Добавьте 100 мкл пероксидазы хрена (HRP) против мышиного IgA разводили в блокирующем буфере (1/10000).
- Выдержите 1 час RT.
- Промыть пять раз с 200 мкл / лунку буфера для промывки.
- Добавьте 100 мкл / лунку 3,3 ', 5,5'-тетраметилбензидин (TMB). Инкубировать 20 мин при комнатной температуре в тон темный.
- Добавить 100 мкл / лунку H 2 SO 4 0,5н. Прочитайте пластину в спектрофотометре при длине волны 450 нм.
6. Определение бактериальной нагрузки в легких
- Lung гомогенизацию и металлизированный
- Через четыре недели после того, как вызов, принести в жертву мыши по цервикальной дислокации (или другой общепринятой методологии гуманной) и обеспечить мышь мертва касаясь глазного яблока, чтобы подтвердить отсутствующим мигательного рефлекса.
- Поместите мышь в положении лежа на спине, закрепленной на плоской и дезинфицировать поверхности внутри ламинаре.
- Сделайте надрез и удалить кожу от области груди, чтобы оставить видимой грудной области.
- Вырез ребра и собирать легкие и сердце, используя стерильные ножницы и пинцет. Поместите органы на чистую поверхность.
- Продувка легкие путем удаления сердца, трахеи и соединительной ткани и переносят легкие в 1,5-мл пробирку с 1 мл деионизированной воды,(Поддерживать на льду до обработки).
- С помощью стерильного пинцета, чтобы передать легкие каждой мыши в нужную трубу для гомогенизацией органа (M - Диссоциатор трубка), содержащий 1 мл деионизированной воды.
- Поместите пробирку в диссоциатора ткани и использовать предопределенный программу RNA_1 гомогенизировать легкие.
- Сделать пять десятикратных серийных разведений в 1,5 мл пробирки, начиная с 100 мкл гомогената легких разведенных в 900 мкл.
- Пластинчатые разведений, как описано в 1.11-1.14.
- Разграничение между БЦЖ и H37Rv с помощью ПЦР
Примечание: В пластинах из 6.1.6, соответствующей группе вакцинированных БЦЖ интраназальным путем, мы анализировали репрезентативное число колоний путем разборчивого ПЦР между БЦЖ и H37Rv, чтобы гарантировать, что КОЕ считается для оценки вакцин присвоил защитной эффективности соответствовали однозначно H37Rv. Этот ПЦР-амплификации мишени RD9, геномная область отличается в BCG и М. Tuberculosis, давая фрагмент 2618 п.н. для H37Rv и 465 пар оснований для БЦЖ 11.- Подготовка мастер-микс запас для всех образцов с объемами на выборку, как указано, а затем распределяют в ПЦР-пробирки (9 мкл / образец).
Примечание: Буфер 5x: 2 мкл. Прямой праймер 25 мкМ (GTGTAGGTCAGCCCCATCC): 0,32 мкл, обратного праймера 25 мкм (GCCCAACAGCTCGACATC): 0,32 мкл, Taq полимеразы 5 единиц / мкл: 0,04 мкл деионизованной H 2 O: 6,32 мкл. - Сенсорный колонии с помощью стерильной зубочисткой и погружать зубочистку с образцом в ПЦР-пробирку, содержащую основной смеси.
- Запуск ПЦР со следующей программой: 10 мин 95 ° C (этот шаг, чтобы вызвать бактериальное разрушение), 10 мин 95 ° C (этот шаг, чтобы вызвать бактериальное разрушение), 35 циклов (30 секунд при 95 ° С, 1 мин при 58 & deg; C и 4 мин при 72 ° С).
- Загрузка образцов ПЦР в агарозном геле 1% этидиумбромидом и запустить образцы для визуализации фрагментов.
- Подготовка мастер-микс запас для всех образцов с объемами на выборку, как указано, а затем распределяют в ПЦР-пробирки (9 мкл / образец).
Результаты
Эта работа описывает сравнение двух способов введения БЦЖ: подкожное и интраназальное. Подкожное сравнима с внутрикожного, которая является текущей клинической маршрут для BCG по всему миру. Интраназально вакцинации ставит своей целью имитировать естественный путь заражения M. туберкулез, с целью вызвать иммунный ответ непосредственно в легких, основной целевой орган этого возбудителя.
Рисунок 1 описывает технологический процесс с последующим. От восьми до десяти недельных самок DBA / 2 мышей вакцинируют 10 6 КОЕ БЦЖ датского подкожного или интраназального пути введения. Восемь недель спустя, группа мышей умерщвляли для анализа иммунного ответа легких, вызванное прививкой. БАЛ образцы сначала получают, а затем жмем легкие. Для изучения вакцин-присвоил защитной эффективности, мы инокуляции differeнт группа мышей с низкой дозой интраназального заражения М. туберкулез H37Rv штамм. Через месяц, мы жертвуем животными и урожай легкие. В этом случае, для каждого животного мы используем левое легкое для определения бактериальной нагрузки и правого легкого для оценки вакцины индуцированного иммунного ответа после заражения. Цель состоит в том, чтобы генерировать бактериальной нагрузки и данные иммунного ответа в легких для каждого животного с целью изучения потенциальных коррелятов защиты.
Как показано на рисунке 2, легкие были диссоциированы , чтобы получить либо гомогената органа или клеточной суспензии. Усредненные легкие высевают на твердой агаровой среде, чтобы определить бактериальную нагрузку четыре недели после заражения. Клеточная суспензия для изучения вакцины индуцированного иммунного ответа был получен следующий легкого ферментативным расщеплением коллагеназой D и DNAseI.
Наши результаты ясно показывают, что, по сравнению то подкожном маршруте, интраназально вакцинации дает гораздо большую защитную эффективность в легких через четыре недели после заражения (рис 3А). Кроме того, мы подтвердили, что бактериальная нагрузка в легких от интраназального группы БЦЖ-вакцины соответствуют H37Rv, а не вакцины БЦЖ. С этой целью мы проанализировали репрезентативное число колоний из этой группы с помощью специфической ПЦР для генома региона RD9, который усиливает различные фрагменты длины в BCG и M. туберкулез (фигура 3В). На рисунке четко показал, что все колонии проанализированные при условии, фрагмент 0,4 т.п.н., что соответствовало H37Rv.
Наши данные показали корреляцию между защитной эффективностью предоставляемой интраназального БЦЖ вакцинации и поствакцинальный иммунный ответ в легких перед заражением. Интраназальная BCG явно вызвало высокую IL17 и производство в легких IFN & gamma, измеренный с помощью ELISA (рис4А). Эти данные были подтверждены с помощью внутриклеточного окрашивания (ICS) и проточной цитометрии (данные не показаны). Кроме того, мы также обнаружили более высокую концентрацию как общего , так и PPD-специфической концентрации IgA в образцах БАЛ (рис 4б), что свидетельствует о том , что легочная вакцинация БЦЖ индуцирует выработку IgA и транслокацию дыхательных путей.
И, наконец, мы изучали БЦЖ-индуцированный иммунный ответ в легких после заражения (рис 5). Наши данные показали различия между IL17 и IFN & gamma; IL17A-продуцирующие клетки CD4 + были обнаружены только в группе БЦЖ интраназально, в то время как IFN & gamma-продуцирующие клетки были обнаружены во всех группах зараженных H37Rv независимо от вакцинации. Представление данных каждого животного, соответствующего IL17-продуцирующих клеток и бактериальной нагрузки показали существенную корреляцию между наличием IL17 и легкого уменьшения бактериальной нагрузки, которая не наблюдалась в случае IFN & gamma;,
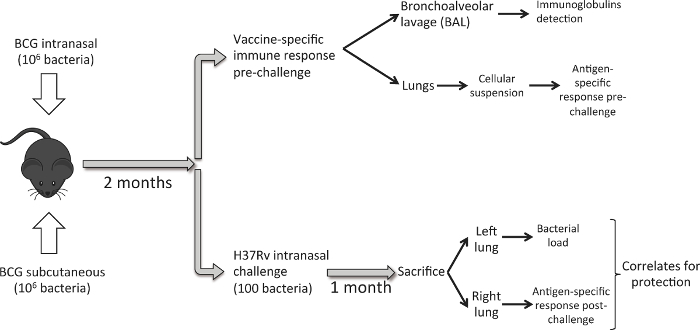
Рисунок 1. Рабочий процесс для сравнения интраназального и подкожным БЦЖ Вакцинация. Восемь недель после иммунизации БЦЖ, набор мышей (6 в экспериментальной группе) используется для сбора легких и выполнить БАЛ, а также анализировать легочный иммунный ответ , индуцированный с помощью вакцинации. Другой набор мышей (6 / группа), засевают низкими дозами интраназального заражения М. туберкулез H37Rv штамм (100 КОЕ). Через месяц животных умерщвляют и бактериальной нагрузки анализируют в левом легком и PPD-специфического иммунного ответа в правом легком. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
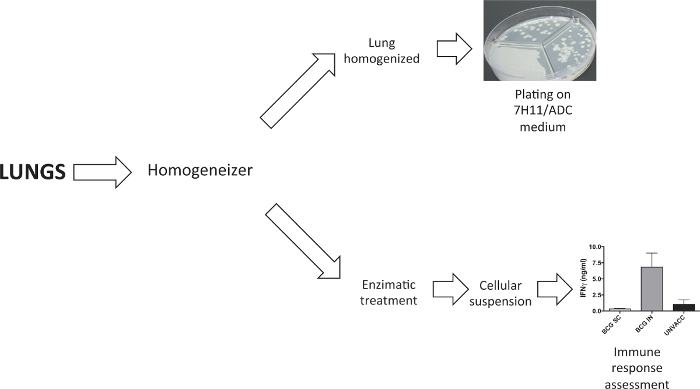
Рисунок 2. Обработка легких образцов. диссоциатора ткань используется для обработки легких. В экспериментах для определения бактериальной нагрузки, легкие гомогенизировали до пластины их в твердой агаризованной среде. В экспериментах , которые требуют легкого клеточной суспензии, это сгенерирован сразу же после ферментативного расщепления коллагеназой D и DNAseI. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 3. Защитная эффективность Присвоено вакцинацией БЦЖ. Групп от 6 DBA / 2 мышей вакцинировали подкожно (БЦЖ подкожно), интраназально (БЦЖ) маршруте, или невакцинированных (Unvacc) с БЦЖ датской вакцины 10 6 КОЕ. Через два месяца после вакцинации мышей инокулировали интраназально с низкой дозой (100КОЕ) H37Rv вызов, и один месяц спустя бактериальная нагрузка в легких была определена. Представитель эксперимент двух независимых показано. (A) Данные на графиках представлены в виде среднего значения ± стандартное отклонение. Односторонний тест ANOVA с пост анализа Бонферрони было проведено с целью расчета статистической значимости. (В) репрезентативное количество одиночных колоний от интраназального группы БЦЖ были проанализированы с помощью ПЦР , специфичных для RD9 региона (различные в БЦЖ и H37Rv геномов) различать БЦЖ и H37Rv колонии. (Ранее опубликованные 9). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 4. Вакцина конкретных Легочная иммунный ответ Исследуемый перед заражением H37Rv. Группы 6 DBA 2 мышей / быливакцинировали подкожным (БЦЖ подкожно) или интраназального (БЦЖ) маршрута или невакцинированных (Unvacc) с БЦЖ датской вакцины 10 6 КОЕ. (А) на два месяца после вакцинации, была получена клеточная суспензия из заготовленных легких. Клетки стимулировали ППД , как это описано в разделе Методы и IL17A (левая панель) и IFN & gamma ; (правая панель) производства были проанализированы с помощью ELISA. (B) Общий IgA - антител, и M. туберкулез (MTB) -специфический IgA анализировали из образцов БАЛ с помощью ELISA. Объединенные данные двух независимых экспериментов. Данные на графиках представлены в виде среднего значения ± стандартное отклонение. (Ранее опубликованные 9). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
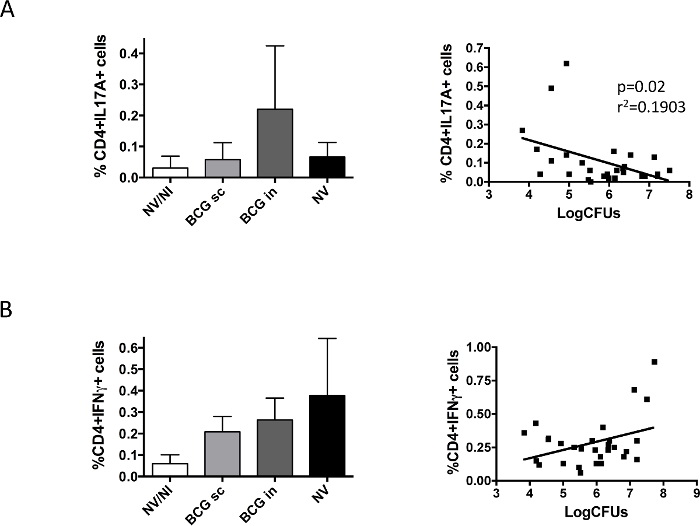
Рисунок 5. Вакцина против конкретныхЛегочная иммунный ответ Исследуемый перед заражением H37Rv. Групп от 6 DBA / 2 мышей вакцинировали подкожно (БЦЖ подкожно) или интраназального (БЦЖ) маршруте, или невакцинированных (NV) с БЦЖ датской вакцины 10 6 КОЕ. Контрольная группа не привитые, не-инфицированных мышей была также включена (NV / NI). Через два месяца после вакцинации мышей заражали интраназально с низкой дозой H37Rv (100 КОЕ), и один месяц спустя животные были подвергнуты эвтаназии. Левая и правая легкие от того же самого животного, использовали для определения бактериальной нагрузки и IL17A- (А) или (В IFNγ-) получение клеток CD4 +, соответственно. Данные в левой панели соответствуют процент цитокин-продуцирующих клеток, измеренных с помощью проточной цитометрии, и представлены в виде среднего значения ± стандартное отклонение. Правые панели представляют данные бактериальной нагрузки и cytokine- производства клеток CD4 +, полученные для каждой мыши. Линейная регрессия была рассчитана и р-значение, полученное в каждом случае показан в случае IL17A. объединенныйДанные из двух независимых экспериментов показаны на рисунке. (Ранее опубликованные 9). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
Although current vaccine against tuberculosis, BCG, is the most widely administered vaccine in history, tuberculosis remains one of the leading causes of death and morbidity from infectious diseases worldwide. This paradox is explained by the lack of protection of this vaccine against pulmonary tuberculosis, the responsible form of transmission. New vaccination approaches effective against pulmonary forms of the disease are urgently needed, as they would have the greatest impact on disease transmission globally.
Our data clearly show that a change in the route of administration of BCG to mimic the natural route of infection could be a successful strategy to prevent pulmonary tuberculosis. Our results are in accordance with other authors showing equivalent data in different animal models, including guinea pigs and non-human primates (NHP) 6,9,12.
Remarkably, our unpublished data indicated that the volume of administration by the intranasal route is a critical step of the protocol. These results revealed that following intranasal delivery of 100 H37Rv bacteria resuspended in 10 μl (instead of 40 μl), we only recovered lung CFUs from around 20% of the animals (data not shown.
Importantly, one of the possible limitations of intranasal administration as a vaccine delivery route in clinic could be its proximity with the central nervous system13,14. In this regard, aerosol immunization might be safer as delivery route for pulmonary tuberculosis vaccines in humans.
This protocol describes a standardized methodology that can be adapted to other studies, as comparison of pulmonary vaccines, or different routes of pulmonary immunization, including aerosol.
Our data suggest that the analysis in parallel of protective efficacy and immune response, using lung samples from the same animal, could be a useful tool to identify biomarkers of protection. In this regard, our results reveal that lung IL17, but not IFNγ, seems to correlate with a better vaccine protective efficacy. These data highlight a possible role of IL17 in the protective response induced by intranasal BCG, which is in accordance with data reported by other authors using mucosal subunit TB vaccines 7,15. Our data also indicate that presence of IgA (both total and MTB-specific) in BAL samples correlates with protection conferred by intranasal BCG. Importantly, we described previously, in agreement with other works, that IL17 contributes to traslocation of IgA to respiratory airways and gut lumen.9,16,17
Раскрытие информации
The authors have nothing to disclose.
Благодарности
This work was supported by "Spanish Ministry of Economy and Competitiveness" [grant number BIO2014-5258P], "European Commission" by the H2020 programs [grant numbers TBVAC2020 643381].
Материалы
| Name | Company | Catalog Number | Comments |
| Middlebrook 7H9 broth | BD | 271310 | |
| Middlebrook ADC Enrichment | BD | 211887 | |
| Tween 80 | Scharlau | TW00800250 | |
| 3-mm diameter Glass Beads | Scharlau | 038-138003 | |
| Middlebrook 7H10 Agar | BD | 262710 | |
| 1-ml syringe 26GA 0.45x10 mm | BD | 301358 | |
| GentleMACS dissociator | Miltenyi Biotec | 130-093-235 | |
| C tubes | Miltenyi Biotec | 130-093-237 | |
| M tubes | Miltenyi Biotec | 130-093-236 | |
| Collagenase D | Roche | 11088882001 | |
| DNaseI | Applichem | A3778,0100 | |
| Falcon 70µm Cell Strainer | Corning | 352350 | |
| RPMI 1640 | Sigma | R0883 | |
| Red Blood Cell Lysing Buffer | Sigma | R7757 | |
| GlutaMAX Supplement | Gibco | 35050-061 | 100X concentrated |
| Penicillin-Streptomycin Solution | Sigma | P4333 | 100X concentrated |
| Fetal Calf Serum | Biological Industries | 04-001-1A | |
| 2-Mercaptoethanol | Sigma | M3148-25ML | |
| Scepter 2.0 Handheld Automated Cell Counter | Millipore | PHCC20040 | |
| Scepter Cell Counter Sensors, 40 µm | Millipore | PHCC40050 | |
| Mycobacterium Tuberculosis - Tuberculin PPD | Statens Serum Institut (SSI) | 2390 | |
| Mouse IFN-γ ELISA development kit | Mabtech | 3321-1H | |
| Mouse IL17A ELISA development kit | Mabtech | 3521-1H | |
| Brefeldin A | Sigma | B7651 | |
| FITC Rat Anti-Mouse CD4 | BD | 553047 | |
| BD Cytofix/Cytoperm Kit | BD | 555028 | |
| APC-Cy7 Rat Anti-mouse IL-17A | BD | 560821 | |
| APC Mouse Anti-mouse IFNg | BD | 554413 | |
| LACHRYMAL OLIVE LUER LOCK 0.60 x 30 mm. 23G x 1 1/4” | UNIMED | 27.134 | Used as trachea cannula for BAL |
| high-protein binding polystyrene flat-bottom 96-well plates MAXISORP | NUNC | 430341 | |
| Albumin, from bovine serum | Sigma | A4503 | |
| Goat Anti-Mouse IgA (α-chain specific)−Peroxidase antibody | Sigma | A4789 | |
| 3,3′,5,5′-Tetramethylbenzidine (TMB) | Sigma | T0440 | |
| MyTaq DNA Polymerase | Bioline | BIO-21107 | The kit Includes Buffer 5x |
Ссылки
- Zumla, A., et al. The WHO 2014 global tuberculosis report--further to go. Lancet Glob Health. 3 (1), e10-e12 (2015).
- Mangtani, P., et al. Protection by BCG vaccine against tuberculosis: a systematic review of randomized controlled trials. Clin Infect Dis. 58 (4), 470-480 (2014).
- Aguilo, N., et al. Pulmonary Mycobacterium bovis BCG vaccination confers dose-dependent superior protection compared to that of subcutaneous vaccination. Clin Vaccine Immunol. 21 (4), 594-597 (2014).
- Chen, L., Wang, J., Zganiacz, A., Xing, Z. Single intranasal mucosal Mycobacterium bovis BCG vaccination confers improved protection compared to subcutaneous vaccination against pulmonary tuberculosis. Infect Immun. 72 (1), 238-246 (2004).
- Giri, P. K., Verma, I., Khuller, G. K. Protective efficacy of intranasal vaccination with Mycobacterium bovis BCG against airway Mycobacterium tuberculosis challenge in mice. J Infect. 53 (5), 350-356 (2006).
- Lagranderie, M., et al. BCG-induced protection in guinea pigs vaccinated and challenged via the respiratory route. Tuber Lung Dis. 74 (1), 38-46 (1993).
- Gopal, R., et al. Interleukin-17-dependent CXCL13 mediates mucosal vaccine-induced immunity against tuberculosis. Mucosal Immunol. 6 (5), 972-984 (2013).
- Khader, S. A., et al. IL-23 and IL-17 in the establishment of protective pulmonary CD4+ T cell responses after vaccination and during Mycobacterium tuberculosis challenge. Nat Immunol. 8 (4), 369-377 (2007).
- Aguilo, N., et al. Pulmonary but Not Subcutaneous Delivery of BCG Vaccine Confers Protection to Tuberculosis-Susceptible Mice by an Interleukin 17-Dependent Mechanism. J Infect Dis. , (2015).
- Middlebrook, G., Cohn, M. L. Bacteriology of tuberculosis: laboratory methods. Am J Public Health Nations Health. 48 (7), 844-853 (1958).
- Brosch, R., et al. A new evolutionary scenario for the Mycobacterium tuberculosis complex. Proc Natl Acad Sci U S A. 99 (6), 3684-3689 (2002).
- Kaushal, D., et al. Mucosal vaccination with attenuated Mycobacterium tuberculosis induces strong central memory responses and protects against tuberculosis. Nat Commun. 6, 8533 (2015).
- Lochhead, J. J., Thorne, R. G. Intranasal delivery of biologics to the central nervous system. Adv Drug Deliv Rev. 64 (7), 614-628 (2012).
- Lochhead, J. J., Wolak, D. J., Pizzo, M. E., Thorne, R. G. Rapid transport within cerebral perivascular spaces underlies widespread tracer distribution in the brain after intranasal administration. J Cereb Blood Flow Metab. 35 (3), 371-381 (2015).
- Griffiths, K. L., et al. Cholera toxin enhances vaccine-induced protection against Mycobacterium tuberculosis challenge in mice. PLoS One. 8 (10), e78312 (2013).
- Hirota, K., et al. Plasticity of Th17 cells in Peyer's patches is responsible for the induction of T cell-dependent IgA responses. Nat Immunol. 14 (4), 372-379 (2013).
- Jaffar, Z., Ferrini, M. E., Herritt, L. A., Roberts, K. Cutting edge: lung mucosal Th17-mediated responses induce polymeric Ig receptor expression by the airway epithelium and elevate secretory IgA levels. J Immunol. 182 (8), 4507-4511 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены