Method Article
Efficacité de protection et de la réponse immunitaire pulmonaire après l'administration sous-cutanée et intranasale BCG chez la souris
Dans cet article
Résumé
We herein detail the methodology followed to compare protective efficacy and lung immune response induced by intranasal and subcutaneous immunization with BCG in mouse model. Our results show the benefits of pulmonary vaccination and suggest a role for IL17-mediated response in vaccine-induced protection.
Résumé
Despite global coverage of intradermal BCG vaccination, tuberculosis remains one of the most prevalent infectious diseases in the world. Preclinical data have encouraged pulmonary tuberculosis vaccines as a promising strategy to prevent pulmonary disease, which is responsible for transmission. In this work, we describe the methodology used to demonstrate in the mouse model the benefits of intranasal BCG vaccination when compared to subcutaneous. Our data revealed greater protective efficacy following intranasal BCG administration. In addition, our results indicate that pulmonary vaccination triggers a higher immune response in lungs, including Th1 and Th17 responses, as well as an increase of immunoglobulin A (IgA) concentration in respiratory airways. Our data show correlation between protective efficacy and the presence of IL17-producing cells in lungs post-Mycobacterium tuberculosis challenge, suggesting a role for this cytokine in the protective response conferred by pulmonary vaccination. Finally, we detail the global workflow we have developed to study respiratory vaccination in the mouse model, which could be extrapolated to other tuberculosis vaccines, apart from BCG, targeting the mucosal response or other pulmonary routes of administration such as the intratracheal or aerosol.
Introduction
La tuberculose (TB) est l' une des principales maladies infectieuses causant plus de décès associés que le VIH dans le monde et combiné avec la hausse augmentation des souches multirésistantes rend TB un problème de santé mondiale alarmante 1. De nouveaux outils diagnostiques, des médicaments plus efficaces et moins toxiques, et de nouveaux vaccins sûrs et efficaces TB sont un besoin urgent, en particulier dans le monde en développement.
Vivant atténué Bacille Calmette-Guérin (BCG) est actuellement le seul vaccin homologué contre la tuberculose, qui a été administré par voie intradermique à la naissance depuis les années 1970 dans le monde entier. BCG est considéré comme efficace pour prévenir les formes graves de la maladie ( la méningite et la tuberculose miliaire) chez les enfants, mais a montré une efficacité incompatible contre la tuberculose pulmonaire responsable de la transmission de la maladie 2.
vaccination pulmonaire, qui imite voie naturelle de l'infection tuberculeuse, représente une approche intéressante pour amorcer la réponse immunitaire de l'hôte locals. À cet égard, divers travaux précliniques dans différents modèles TB animaux pertinents ont démontré une plus grande efficacité du vaccin après l' immunisation pulmonaire par rapport à la voie sous - cutanée ou intradermique 3-6. Néanmoins, les mécanismes de protection déclenchée par la vaccination pulmonaire ne sont pas bien comprises. Au cours des dernières années, plusieurs travaux ont pointé vers une réponse de IL17 médiée comme un facteur important de la muqueuse réponse immunitaire spécifique de la tuberculose, comme dans les modèles de souris déficientes pour IL17 muqueuse efficacité protectrice induite par le vaccin est altérée 7,8.
Récemment , nous avons démontré pour la première fois que l' administration intranasale BCG protégé DBA / 2 souris, une souche de souris caractérisé par l'absence de protection après la vaccination par le BCG sous - cutanée 9. Ces résultats suggèrent que la vaccination contre la tuberculose respiratoire pourrait être plus efficace dans la réduction des taux de tuberculose dans les pays d'endémie, où le BCG intradermique est considéré comme inefficace contre pulmonTB ary.
Protocole
Toutes les souris ont été maintenues dans des conditions contrôlées et respectées pour tout signe de maladie. Le travail expérimental a été menée en accord avec les directives européennes et nationales en matière de protection des animaux de laboratoire et avec l'approbation des commissions compétentes d'éthique locaux.
1. Préparation des stocks quantifiées glycériques de BCG danoise et Mycobacterium tuberculosis H37Rv
NOTE: Tous les protocoles décrits ont été réalisées dans des conditions de BSL3.
- Décongeler les stocks de glycerol congelé de BCG danoise ou souches H37Rv et ensemencer 100 ul dans 10 ml de milieu 7H9 10 supplémenté avec du Tween-80 0,05% (v / v) et l' ADC (Albumine, dextrose, catalase) 10% (v / v).
- Incuber dans des conditions statiques pendant une semaine à 37 ° C jusqu'à ce que la culture est en croissance en phase logarithmique.
- Plus grande échelle de la culture bactérienne en transférant la culture de 10 ml à 200 ml de milieu frais. Incuber 20 supplémentairesjours dans des conditions statiques.
- Transfert à tubes de centrifugation de 50 ml et centrifuger pendant 15 min à 2500 x g.
- Jeter surnageants et resuspendre culot bactérien dans le volume résiduel. Ajouter à chaque tube de perles de verre de 3 mm de diamètre stériles (10 - 15) par tube.
- Vortex vigoureusement pendant 1 min afin de dissocier des amas bactériens. Remettre en suspension chaque culot dans 10 ml de PBS avec du Tween-80 0,05% (v / v).
- Laisser les tubes pendant 10 minutes permettant aux plus grands agrégats bactériens et perles de verre à installer.
- Récupérer 9,5 ml de surnageant provenant de chacun des 4 tubes contenant de petites touffes et les bactéries individuelles et les volumes de transfert à un seul tube de centrifugeuse de 50 ml frais (volume final récupéré 38 ml). Centrifuger pendant 10 min à 400 x g.
- Récupérer 35 ml de surnageant (contenant les bactéries principalement simples) dans un seul tube centrifuge de 50 ml frais et ajouter 15 ml de PBS avec du glycerol à 50% (v / v), pour obtenir une concentration de glycérol finale de 15% (v / v).
- Mélanger doucementet distribuer dans des aliquotes de 1 ml dans des tubes appropriés pour la congélation. Conserver à -80 ° C (un lot fournit environ 50 aliquotes stock de glycérol).
- Pour quantifier les stocks de glycérol, décongeler un glycérol jour après congélation et effectuer sept dilutions en série de dix fois dans des tubes de 1,5 ml séparés contenant 900 pi de PBS.
- Plaque 100 ul de chaque dilution dans le milieu 7H10 agar solide complété avec 10 CAN 10% (v / v) préparé dans des plats de diamètre 55 mm de Petri.
- Soigneusement ajouter 3 billes de verre mm de diamètre (env. 10 par plaque) et agiter la plaque pour répartir équitablement le volume sur plaque de gélose doucement. Jeter des perles et sceller la plaque de gélose avec du parafilm.
- Incuber pendant 21 jours à 37 ° C et déterminer la concentration bactérienne en comptant les unités formant des colonies (UFC) dans les dilutions où des colonies individuelles peuvent être distinguées avec précision.
2. Souris Vaccination
- Décongeler un glycérol BCG pré-quantifiées et le diluer dans du PBS pour prepDeux suspensions. Calculer le volume final étant donné la dose par animal est de 100 ul pour une administration sous - cutanée (10 7 CFU par ml pour une vaccination sous - cutanée) et 40 ul pour une administration intranasale (2,5 x 10 7 UFC pour la vaccination intra - nasale).
- Utilisez une station d'anesthésie spécialisée pour les rongeurs pour anesthésier les souris avec un mélange d'isoflurane et de l'oxygène. Utiliser l'isoflurane 5% pour induire une anesthésie et 2% pour maintenir la souris dans la chambre d'anesthésie. (Autre méthode d'anesthésie acceptée peut être utilisé).
- Pour une administration sous - cutanée d' un vaccin remplir une seringue de 1 ml avec une aiguille 26 G avec 1 ml de suspension bactérienne (10 7 UFC / ml). Retirer les bulles d'air.
- Placer une souris anesthésiée sur une surface plane en position couchée à l' intérieur d' une hotte à flux laminaire et inoculer en sous - cutané 100 pi (10 6 UFC / dose) du vaccin dans un flanc de la souris arrière. Retour de la souris à la cage et de le surveiller pour qu'il Properly récupère de l'anesthésie.
- Changez l'aiguille de la seringue entre chaque administration de la souris. Enlevé les bulles d'air comme décrit ci-dessus.
- Pour l'administration intranasale, placer une souris anesthésiée en position couchée à l'intérieur de la hotte.
- Avec une micropipette prendre 20 pi de la suspension avec 2,5 x 10 7 UFC / ml. Placez le goutte-à-goutte inoculum entre les deux narines jusqu'à ce que le volume total a été déposé, laissant le temps entre les gouttes pour permettre la souris respirer le volume. Remarque: les souris peuvent souffrir de détresse respiratoire au cours de cette procédure, ils devraient être laissés à assimiler chaque goutte avant d'administrer la suivante afin d'éviter autant que possible.
- Re-remplir le micropipette avec un autre 20 pl et répéter l'opération. Si la souris commence à se réveiller de l'anesthésie après la première inoculation, le placer dans la chambre d'anesthésie avant la seconde. Retour de la souris à la cage et veiller à ce qu'il récupère correctementde l'anesthésie.
3. Souris intranasale Challenge H37Rv Strain
- Décongeler un glycérol H37Rv pré-quantifiées et le diluer dans du PBS pour préparer une suspension bactérienne de 2 500 UFC par ml. Calculer volume final compte tenu de la dose par animal est de 40 pi.
- H37Rv est inoculé par voie intranasale, comme décrit dans 02/05 à 02/07. Dose d'épreuve finale par souris est de 10 2 UFC / 40 pi.
4. Analyse de la réponse immunitaire induite en Poumons
- Suspension cellulaire pulmonaire
NOTE: L'évaluation de la réponse immune adaptative induite par le vaccin dans les poumons nécessite la génération d'une suspension cellulaire unique. A cet effet, on utilise un dissociateur tissulaire tel que gentleMACS.- Sacrifiez la souris par dislocation cervicale (ou autre méthode humaine acceptée) et de veiller à la souris est morte de toucher le globe oculaire pour confirmer l'absence de réflexe de clignement.
- Dans une hotte à flux laminaire, extraire le lUNGS avec des ciseaux et des pinces stériles et les placer sur une surface propre. poumons propres enlèvement de la trachée et du tissu conjonctif, et de transférer les poumons à un tube de 1,5 ml avec du PBS (conserver sur de la glace jusqu'à ce que la transformation).
- Pour produire une suspension cellulaire, placer les poumons dans un tube approprié pour la dissociation de l' organe (tube C-dissociateur) contenant 5 ml de 10 mM de HEPES-NaOH à pH 7,4, 150 mM de NaCl, 5 mM de KCl, 1 mM de MgCl2 et 1,8 mM de CaCl2 tampon.
- Ajouter 100 ul de la collagénase D 100 mg / ml (2 mg / ml de concentration finale) et 40 ul de DNase I 20000 UI / ml (160 UI / ml de concentration finale.
REMARQUE: Des solutions mères de la collagénase D ou DNasel sont préparés dissolvaient des enzymes lyophilisées dans du PBS ou du glycérol à 50% (v / v), Tris-HCl 20 mM pH 7,5 , MgCl 2 y 1 mM. - Placer le tube dans le dissociateur tissulaire et en utilisant la m_lung_01 prédéfinie du programme pour la fragmentation du poumon. Incuber le tube à 37 ° C dans un bain-marie pendant 30 min.
- La place etube e dans le dissociateur et utiliser le m_lung_02 programme prédéfini pour l'homogénéisation pulmonaire complète en suspension cellulaire unique.
- Passer la suspension cellulaire à travers un tamis cellulaire en nylon de 70 pm monté sur un tube de centrifugeuse de 50 ml. Laver le filtre avec 10 ml de milieu RPMI 1640.
- Centrifuger les cellules pendant 5 minutes à 400 xg et jeter le surnageant.
- Ajouter 1 ml de tampon de lyse des érythrocytes, mélanger au vortex et incuber pendant 1 min à température ambiante.
- Ajouter 10 ml de RPMI 1640 cellules moyennes et centrifuger pendant 5 minutes à 400 x g.
- Resuspendre les cellules dans 0,5 ml de milieu RPMI 1640 additionné de 10% inactivé par la chaleur sérum de veau fœtal (FCS), 2 mM de L-glutamine, 100 pg / ml de streptomycine, 100 IU / ml de pénicilline et 50 pM de 2-mercaptoéthanol.
REMARQUE: FCS est inactivée par incubation à 56 ° C pendant 30 minutes. - Compter les cellules et ajouter RPMI complète 1640 pour atteindre la densité cellulaire finale de 10 7 cellules / ml.
NOTE: Pour le nombre de cellules, nous utilisons le compteur de cellules automatisé. - Distribuer 100 ul de suspension cellulaire en fond U plaque de 96 puits stérile (10 6 cellules / puits).
- Ajouter 50 pl / puits de milieu complet RPMI 1640 avec 15 pg / ml de H37Rv commerciale protéine purifiée dérivée (PPD) (5 ug / ml concentration finale).
- La collecte surnageante pour la détermination des cytokines par ELISA
- Incuber la plaque à partir 01/04/14 pendant 48 heures à 37 ° C et 5% de CO 2.
- plaque Centrifugeuse pendant 5 minutes à 400 g et de récupérer 100 pi de surnageant.
- Conserver à -80 ° C.
- Diluer le surnageant 1/10 et 1/2 dans du tampon d'essai pour la détermination de l'IFN-y et IL17A, respectivement. Déterminer les concentrations de cytokines avec des kits ELISA commerciaux, selon les instructions du fabricant (kits de développement ELISA).
- Coloration intracellulaire pour la détermination des cytokinesproductrices de cellules CD4 + par cytométrie de flux
- Incuber la plaque à partir 01/04/14 pendant 18 heures à 37 ° C et 5% de CO 2.
- Ajouter 1,5 pl de Brefeldin A 1 mg / ml (stocks dissous dans du DMSO) à chaque (concentration finale de 10 pg / ml) puits et incuber pendant six heures supplémentaires.
- Centrifuger la plaque de 4.3.2 pendant 1 min à 3200 xg et jeter le surnageant.
- Resuspendre les cellules dans 50 ul d'anticorps anti-CD4 de souris-FITC dilué dans un milieu RPMI 1640 avec 10% de FCS (1/500) et incuber pendant 10 min à 4 ° C.
- Centrifuger la plaque de 4.3.4 pendant 1 min à 3.200 xg, éliminer le surnageant et ajouter 100 pl / puits de solution de fixation. Incuber à 4 ° C pendant 20 min.
- Laver les cellules deux fois avec 150 pl / lavage de la solution de perméabilisation.
NOTE: 10x concentré mère est diluée dans de l'eau déminéralisée pour préparer une solution de travail 1x. - Resuspendre les cellules dans 50 ul d'anticorps anti-IFNy de souris et d'APC anti-souris-IL17A APC.Cy7 dilués dans permeabilsolution sation (1/250 les deux anticorps).
- Incuber pendant 1 heure à température ambiante.
- Laver les cellules deux fois avec 150 pl / lavage de la solution de perméabilisation.
- Resuspendre les cellules dans 200 pi de PBS pour l'acquisition de la cytométrie de flux.
5. Analyse des immunoglobulines dans lavage broncho-alvéolaire (BAL)
- Obtention d'échantillons de BAL
- Sacrifiez la souris par dislocation cervicale (ou autre méthode humaine acceptée) et de veiller à la souris est morte de toucher le globe oculaire pour confirmer l'absence de réflexe de clignement.
- Exposer la trachée en utilisant la précision appropriée des pinces et des ciseaux stériles et effectuer une petite incision dans la trachée, en veillant à ne pas exciser complètement. Prenez soin de ne pas causer des saignements qui pourraient contaminer les échantillons BAL.
- Introduire dans la trachée d'une canule raccordée à une seringue de 1 ml stérile avec 800 pi de PBS glacé.
- Ensemencer lentement le PBS dans les poumons puis recover volume de BAL tirant le piston de la seringue très lentement afin d'éviter l'effondrement du poumon.
NOTE: La récupération de 500 à 600 pi est satisfaisante. - Transférer le volume BAL dans un tube de 1,5 ml et confirmer BAL reste incolore, ce qui indique que ne sont pas contaminés par du sang (maintenir sur la glace jusqu'à la transformation).
- Centrifugeuse échantillons BAL pendant 5 min à 400 g, et le transfert surnageant dans un nouveau tube.
- surnageants Conserver à -80 ° C.
- Détermination d'IgA dans le BAL surnageants
NOTE: Tous les réactifs utilisés sont à la température ambiante.- Polystyrène de liaison à haute teneur en protéines de Coat-fond plat des plaques à 96 puits avec 100 pl de PPD dilué dans du PBS (10 pg / ml) pour M. la tuberculose spécifique de la détermination des IgA ou avec 100 ul de surnageant BAL est dilué 10 fois dans du PBS pour une détermination totale IgA.
- Incuber une nuit à 4 ° C.
- Rejeter le surnageant et appuyez sur la plaque sur une serviette en papier à dry. Laver avec 200 pl / puits de PBS.
- Poulie à 200 pl / puits d'un sérum-albumine bovine (BSA) à 1% (p / v) dans du PBS-Tween-80 0,05% (v / v) (tampon de blocage).
- Incuber 1 heure à température ambiante.
- Laver une fois avec 200 pl / puits de PBS-Tween-80 0,05% (v / v) (tampon de lavage).
- Ajouter 100 pi de surnageant non dilué BAL dans les puits PPD revêtus. Incuber deux heures à température ambiante.
NOTE: Si la détermination totale IgA se fait en parallèle avec le PPD spécifique IgA, laissez le total des puits IgA avec un tampon de lavage de 100 pi pendant cette incubation. - Laver trois fois avec 200 pl / puits de lavage buffer.0170004
- Ajouter 100 pi de peroxydase de raifort (HRP) conjugué avec l'anti-IgA de souris dilué dans du tampon de blocage (1 / 10.000).
- Incuber 1 h RT.
- Laver à cinq reprises avec 200 pl / puits de tampon de lavage.
- Ajouter 100 pl / puits de 3,3 ', 5,5'-tétraméthylbenzidine (TMB). Incuber 20 min à température ambiante en til sombre.
- Ajouter 100 pl / puits de H 2 SO 4 0.5N. Lire la plaque dans un spectrophotomètre à une longueur d'onde de 450 nm.
6. détermination de la charge bactérienne dans les poumons
- Homogénéisation du poumon et le plaquage
- Quatre semaines après la provocation, sacrifier la souris par dislocation cervicale (ou autre méthode humaine acceptée) et de veiller à la souris est morte de toucher le globe oculaire pour confirmer l'absence de réflexe de clignement.
- Placer la souris en position couchée fixée sur une surface plane et désinfecté à l'intérieur d'une hotte à flux laminaire.
- Faire une incision et enlever la peau de la région de la poitrine pour laisser visible la région thoracique.
- Découpez les côtes et récolter les poumons et le cœur à l'aide de ciseaux et des pinces stériles. Placez les organes sur une surface propre.
- Nettoyer les poumons en enlevant le cœur, de la trachée et du tissu conjonctif et de transférer les poumons à un tube de 1,5 ml avec 1 ml d'eau déminéralisée(Maintenir sur la glace jusqu'à ce que le traitement).
- Utiliser des pinces stériles pour transférer les poumons de chaque souris dans un tube approprié pour l'homogénéisation d'un organe (M - Tube dissociateur) contenant 1 ml d'eau déminéralisée.
- Placer le tube dans le dissociateur tissulaire et en utilisant la RNA_1 prédéfinie du programme afin d'homogénéiser les poumons.
- Faire cinq dilutions en série de dix fois dans des tubes de 1,5 ml, à partir de 100 pi d'homogénat pulmonaire dilué dans 900 ul.
- dilutions de plaque comme décrit au 1.11 à 1.14.
- La différenciation entre le BCG et H37Rv par PCR
REMARQUE: Dans les plaques d'immatriculation 6.1.6 correspondant au groupe vacciné avec le BCG par voie intra-nasale, nous avons analysé un nombre représentatif de colonies par PCR en discernant entre le BCG et H37Rv pour garantir que le UFC examiné pour évaluer l'efficacité de protection vaccinale conférée correspondait unique pour H37Rv. Cette PCR cibles amplification de RD9, une région génomique différent dans le BCG et M. tutuberculosis, donnant un fragment de 2618 pb pour H37Rv, et 465 pb pour le BCG 11.- Préparer un mélange maître stock pour tous les échantillons avec des volumes par échantillon comme indiqué, puis les distribuer dans des tubes de PCR (9 pi / échantillon).
NOTE: Buffer 5x: 2 pl. Amorces Forward 25 uM (GTGTAGGTCAGCCCCATCC): 0,32 ul, amorce inverse 25 uM (GCCCAACAGCTCGACATC): 0,32 ul, Taq polymérase 5 unités / ul: 0,04 ul, désionisée H 2 O: 6,32 ul. - Touchez une colonie avec un cure-dent stérile et immerger le cure-dent avec l'échantillon dans un tube PCR contenant le mélange maître.
- Exécutez la PCR avec le programme suivant: 10 min 95 ° C (cette étape est de déclencher une perturbation bactérienne), 10 min 95 ° C (cette étape est de déclencher une perturbation bactérienne), 35 cycles (30 secondes à 95 ° C, 1 min à 58 ° C et 4 min à 72 ° C).
- Charger les échantillons de PCR dans un gel d'agarose à 1% avec des échantillons de bromure d'éthidium pour visualiser et exécuter les fragments.
- Préparer un mélange maître stock pour tous les échantillons avec des volumes par échantillon comme indiqué, puis les distribuer dans des tubes de PCR (9 pi / échantillon).
Résultats
Ce travail décrit la comparaison de deux voies d'administration du BCG: sous-cutanée et intranasale. voie sous-cutanée est comparable à celui intradermique, qui est la voie d'administration clinique actuel du BCG dans le monde entier. Intranasale voie de vaccination vise à imiter la voie naturelle de l' infection de M. la tuberculose, dont l'objectif est d'induire une réponse immunitaire directement dans les poumons, le principal organe cible de ce pathogène.
La figure 1 décrit le flux de travail suivi. Huit à dix semaines, âgé DBA femelle / 2 souris sont vaccinés avec 10 6 UFC de BCG danoise par voie sous - cutanée ou intranasale d'administration. Huit semaines plus tard, un groupe de souris est sacrifié pour analyser poumon réponse immunitaire induite par la vaccination. échantillons BAL sont d'abord obtenues et ensuite nous récoltons les poumons. Afin d'étudier l'efficacité de protection vaccinale conférée, nous inoculer un differegroupe nt des souris avec un défi de M. intranasale à faible dose souche tuberculosis H37Rv. Un mois plus tard, on sacrifie les animaux et les poumons récolte. Dans ce cas, pour chaque animal, nous utilisons le poumon gauche pour déterminer la charge bactérienne et le poumon droit d'évaluer induite par le vaccin réponse immunitaire après la provocation. L'objectif est de générer la charge bactérienne et les données de la réponse immunitaire dans les poumons pour chaque animal, afin d'étudier les corrélats potentiels de la protection.
Comme on le voit sur la figure 2, les poumons ont été dissociées pour obtenir soit un homogénéisat d' un organe ou d' une suspension cellulaire. poumons homogénéisées ont été étalées sur milieu gélose solide pour déterminer la charge bactérienne de quatre semaines après la provocation. suspension cellulaire pour étudier la réponse immunitaire induite par le vaccin a été obtenu à la suite du poumon digestion enzymatique avec de la collagénase D et DNaseI.
Nos résultats montrent clairement que, par rapport to la voie sous - cutanée, la voie de la vaccination intranasale confère une efficacité protectrice beaucoup plus grande dans les poumons quatre semaines après la provocation (figure 3A). En outre, nous avons confirmé que la charge bactérienne dans les poumons du groupe BCG vaccin intranasal correspondent à H37Rv et non vaccin BCG. A cette fin, nous avons analysé un nombre représentatif de colonies de ce groupe par PCR spécifique de la région du génome RD9, ce qui amplifie des fragments de longueurs différentes dans le BCG et M. la tuberculose (figure 3B). La figure montre clairement que toutes les colonies analysées ont fourni un fragment de 0,4 kpb, ce qui correspond à H37Rv.
Nos données ont révélé une corrélation entre l'efficacité de protection conférée par intranasale vaccination par le BCG et la réponse immunitaire induite par le vaccin dans les poumons avant de contester. Intranasale BCG déclenché clairement IL17 supérieur et la production d' IFNy dans les poumons, mesurée par ELISA (Figure4A). Ces données ont été confirmées par coloration intracellulaire (ICS) et cytométrie de flux (données non présentées). En outre, nous avons également constaté une plus forte concentration à la fois de la concentration totale et de PPD spécifique d' IgA dans les échantillons de BAL (figure 4B), ce qui indique que la vaccination par le BCG pulmonaire induit la production d'IgA et de translocation vers les voies respiratoires.
Enfin, nous avons étudié la réponse immunitaire induite par le BCG dans les poumons après une provocation (Figure 5). Nos données ont révélé des différences entre IL17 et IFNy; CD4 des cellules productrices IL17A + ont été détectées uniquement dans le groupe BCG intranasale, tandis que les cellules productrices d'IFN-y ont été trouvés dans tous les groupes infectés par H37Rv, indépendamment de la vaccination. La représentation des données de chaque animal correspondant à des cellules productrices IL17 et la charge bactérienne a montré une corrélation significative entre la présence d'IL17 et du poumon réduction de la charge bactérienne, qui n'a pas été observé dans le cas d'IFNy.
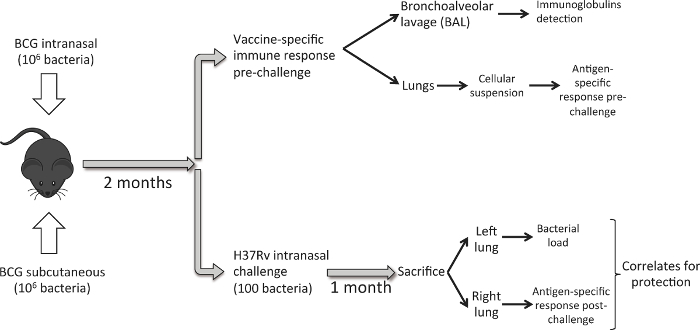
Figure 1. Workflow pour Comparer intranasale et sous - cutanée Route de vaccination par le BCG. Huit semaines après la vaccination par le BCG, un ensemble de souris (6 par groupe expérimental) est utilisé pour récolter les poumons et effectuer une BAL, et d' analyser la réponse immunitaire pulmonaire induite par la vaccination. Une autre série de souris (6 / groupe), est ensemencé avec un défi de M. intranasale à faible dose tuberculosis souche H37Rv (100 CFU). Un mois plus tard, les animaux sont sacrifiés et la charge bactérienne est analysée dans le poumon gauche et la réponse immunitaire PPD spécifique dans le poumon droit. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
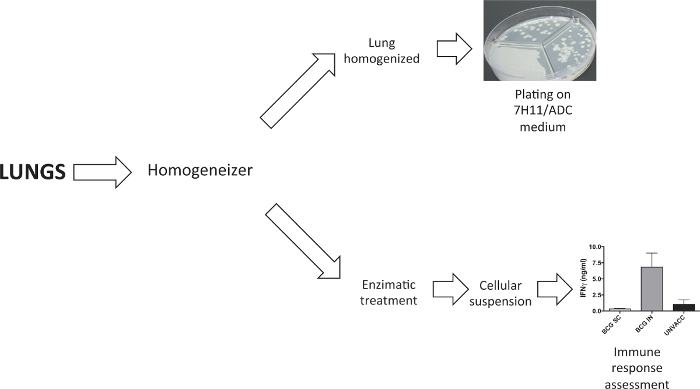
Figure 2. Traitement des échantillons pulmonaires. Un dissociateur de tissu a été utilisé pour traiter les poumons. Dans les expériences pour déterminer la charge bactérienne, les poumons ont été homogénéisés avant de les plaquer dans un milieu agar solide. Dans les expériences qui nécessitent une suspension cellulaire du poumon, cela a été générée après digestion enzymatique avec de la collagénase D et DNaseI. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 3. Efficacité de la protection conférée par le BCG vaccination. Des groupes de 6 souris DBA / 2 ont été vaccinés par voie sous - cutanée (sc BCG), intranasale (BCG) itinéraire ou non-vaccinés (Unvacc) avec le vaccin BCG danoise 10 6 UFC. A deux mois après la vaccination, les souris ont été inoculées par voie intranasale avec une faible dose (100CFU) défi H37Rv, et un mois plus tard, la charge bactérienne dans les poumons a été déterminée. Une expérience représentative de deux indépendants est montré. (A) Les données dans les graphiques sont représentés sous forme de moyenne + SD. One-way test ANOVA avec post - analyse Bonferroni a été effectuée pour calculer la signification statistique. (B) Un nombre représentatif de colonies isolées du groupe intranasale BCG ont été analysés par PCR spécifique pour la région RD9 (différente BCG et H37Rv génomes) de discerner le BCG et colonies H37Rv. (Précédemment publié 9). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 4. Vaccin spécifique Réponse immunitaire pulmonaire analysé avant Défiez avec H37Rv. Des groupes de 6 souris DBA / 2 ont étévaccinés par voie sous - cutanée (BCG sc) ou intranasale (BCG) itinéraire ou non-vaccinés (Unvacc) avec le vaccin BCG danoise 10 6 UFC. (A) A deux mois après la vaccination, une suspension cellulaire des poumons récoltés a été obtenu. Les cellules ont été stimulées avec PPD comme décrit dans la section Méthodes et IL17A (panneau de gauche) et IFNy (panneau de droite) la production ont été analysés par ELISA. (B) Total IgA, et M. tuberculosis (MTB) spécifique de IgA ont été analysés à partir d' échantillons BAL par ELISA. Les données regroupées de deux expériences indépendantes sont présentés. Les données dans les graphiques sont représentés sous forme de moyenne + SD. (Précédemment publié 9). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
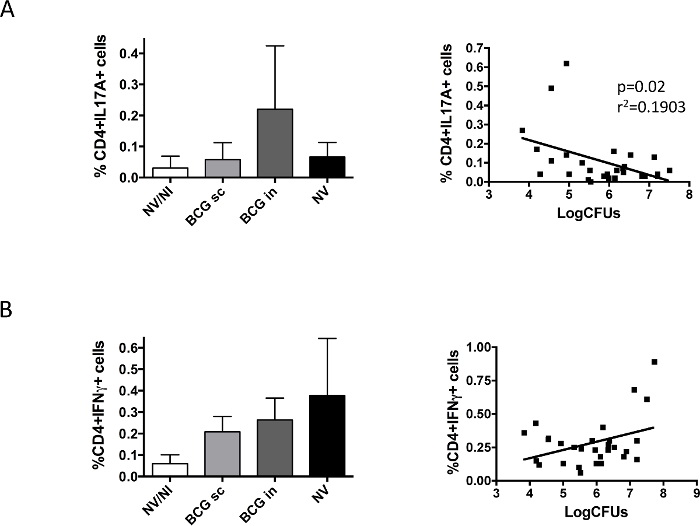
Figure 5. Vaccin spécifiqueRéponse immunitaire pulmonaire analysé avant Défiez avec H37Rv. Des groupes de 6 souris DBA / 2 ont été vaccinés par voie sous - cutanée (sc BCG) ou intranasale (BCG) itinéraire ou non-vaccinés (NV) avec le vaccin BCG danoise 10 6 UFC. Un groupe de souris non vaccinés, non infecté contrôle a également été inclus (NV / NI). A deux mois après la vaccination, les souris ont été contestées par voie intranasale avec une dose de H37Rv faible (100 CFU), et un mois plus tard, les animaux ont été euthanasiés. Gauche et droite poumons provenant du même animal ont été utilisés pour déterminer la charge bactérienne et IL17A- (A) ou IFNγ- (B) produisant des cellules CD4 +, respectivement. Les données dans les panneaux de gauche correspondent au pourcentage de cellules productrices de cytokines mesurées par cytométrie de flux, et sont représentées en tant que moyenne + écart-type. Panneaux de droite représentent les données de la charge bactérienne et de cytokine produire des cellules CD4 + obtenues pour chaque souris. La régression linéaire a été calculée et la p-valeur obtenue dans chaque cas est représenté dans le cas de IL17A. Pooledles données de deux expériences indépendantes sont présentés dans la figure. (Précédemment publié 9). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Although current vaccine against tuberculosis, BCG, is the most widely administered vaccine in history, tuberculosis remains one of the leading causes of death and morbidity from infectious diseases worldwide. This paradox is explained by the lack of protection of this vaccine against pulmonary tuberculosis, the responsible form of transmission. New vaccination approaches effective against pulmonary forms of the disease are urgently needed, as they would have the greatest impact on disease transmission globally.
Our data clearly show that a change in the route of administration of BCG to mimic the natural route of infection could be a successful strategy to prevent pulmonary tuberculosis. Our results are in accordance with other authors showing equivalent data in different animal models, including guinea pigs and non-human primates (NHP) 6,9,12.
Remarkably, our unpublished data indicated that the volume of administration by the intranasal route is a critical step of the protocol. These results revealed that following intranasal delivery of 100 H37Rv bacteria resuspended in 10 μl (instead of 40 μl), we only recovered lung CFUs from around 20% of the animals (data not shown.
Importantly, one of the possible limitations of intranasal administration as a vaccine delivery route in clinic could be its proximity with the central nervous system13,14. In this regard, aerosol immunization might be safer as delivery route for pulmonary tuberculosis vaccines in humans.
This protocol describes a standardized methodology that can be adapted to other studies, as comparison of pulmonary vaccines, or different routes of pulmonary immunization, including aerosol.
Our data suggest that the analysis in parallel of protective efficacy and immune response, using lung samples from the same animal, could be a useful tool to identify biomarkers of protection. In this regard, our results reveal that lung IL17, but not IFNγ, seems to correlate with a better vaccine protective efficacy. These data highlight a possible role of IL17 in the protective response induced by intranasal BCG, which is in accordance with data reported by other authors using mucosal subunit TB vaccines 7,15. Our data also indicate that presence of IgA (both total and MTB-specific) in BAL samples correlates with protection conferred by intranasal BCG. Importantly, we described previously, in agreement with other works, that IL17 contributes to traslocation of IgA to respiratory airways and gut lumen.9,16,17
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
This work was supported by "Spanish Ministry of Economy and Competitiveness" [grant number BIO2014-5258P], "European Commission" by the H2020 programs [grant numbers TBVAC2020 643381].
matériels
| Name | Company | Catalog Number | Comments |
| Middlebrook 7H9 broth | BD | 271310 | |
| Middlebrook ADC Enrichment | BD | 211887 | |
| Tween 80 | Scharlau | TW00800250 | |
| 3-mm diameter Glass Beads | Scharlau | 038-138003 | |
| Middlebrook 7H10 Agar | BD | 262710 | |
| 1-ml syringe 26GA 0.45x10 mm | BD | 301358 | |
| GentleMACS dissociator | Miltenyi Biotec | 130-093-235 | |
| C tubes | Miltenyi Biotec | 130-093-237 | |
| M tubes | Miltenyi Biotec | 130-093-236 | |
| Collagenase D | Roche | 11088882001 | |
| DNaseI | Applichem | A3778,0100 | |
| Falcon 70µm Cell Strainer | Corning | 352350 | |
| RPMI 1640 | Sigma | R0883 | |
| Red Blood Cell Lysing Buffer | Sigma | R7757 | |
| GlutaMAX Supplement | Gibco | 35050-061 | 100X concentrated |
| Penicillin-Streptomycin Solution | Sigma | P4333 | 100X concentrated |
| Fetal Calf Serum | Biological Industries | 04-001-1A | |
| 2-Mercaptoethanol | Sigma | M3148-25ML | |
| Scepter 2.0 Handheld Automated Cell Counter | Millipore | PHCC20040 | |
| Scepter Cell Counter Sensors, 40 µm | Millipore | PHCC40050 | |
| Mycobacterium Tuberculosis - Tuberculin PPD | Statens Serum Institut (SSI) | 2390 | |
| Mouse IFN-γ ELISA development kit | Mabtech | 3321-1H | |
| Mouse IL17A ELISA development kit | Mabtech | 3521-1H | |
| Brefeldin A | Sigma | B7651 | |
| FITC Rat Anti-Mouse CD4 | BD | 553047 | |
| BD Cytofix/Cytoperm Kit | BD | 555028 | |
| APC-Cy7 Rat Anti-mouse IL-17A | BD | 560821 | |
| APC Mouse Anti-mouse IFNg | BD | 554413 | |
| LACHRYMAL OLIVE LUER LOCK 0.60 x 30 mm. 23G x 1 1/4” | UNIMED | 27.134 | Used as trachea cannula for BAL |
| high-protein binding polystyrene flat-bottom 96-well plates MAXISORP | NUNC | 430341 | |
| Albumin, from bovine serum | Sigma | A4503 | |
| Goat Anti-Mouse IgA (α-chain specific)−Peroxidase antibody | Sigma | A4789 | |
| 3,3′,5,5′-Tetramethylbenzidine (TMB) | Sigma | T0440 | |
| MyTaq DNA Polymerase | Bioline | BIO-21107 | The kit Includes Buffer 5x |
Références
- Zumla, A., et al. The WHO 2014 global tuberculosis report--further to go. Lancet Glob Health. 3 (1), e10-e12 (2015).
- Mangtani, P., et al. Protection by BCG vaccine against tuberculosis: a systematic review of randomized controlled trials. Clin Infect Dis. 58 (4), 470-480 (2014).
- Aguilo, N., et al. Pulmonary Mycobacterium bovis BCG vaccination confers dose-dependent superior protection compared to that of subcutaneous vaccination. Clin Vaccine Immunol. 21 (4), 594-597 (2014).
- Chen, L., Wang, J., Zganiacz, A., Xing, Z. Single intranasal mucosal Mycobacterium bovis BCG vaccination confers improved protection compared to subcutaneous vaccination against pulmonary tuberculosis. Infect Immun. 72 (1), 238-246 (2004).
- Giri, P. K., Verma, I., Khuller, G. K. Protective efficacy of intranasal vaccination with Mycobacterium bovis BCG against airway Mycobacterium tuberculosis challenge in mice. J Infect. 53 (5), 350-356 (2006).
- Lagranderie, M., et al. BCG-induced protection in guinea pigs vaccinated and challenged via the respiratory route. Tuber Lung Dis. 74 (1), 38-46 (1993).
- Gopal, R., et al. Interleukin-17-dependent CXCL13 mediates mucosal vaccine-induced immunity against tuberculosis. Mucosal Immunol. 6 (5), 972-984 (2013).
- Khader, S. A., et al. IL-23 and IL-17 in the establishment of protective pulmonary CD4+ T cell responses after vaccination and during Mycobacterium tuberculosis challenge. Nat Immunol. 8 (4), 369-377 (2007).
- Aguilo, N., et al. Pulmonary but Not Subcutaneous Delivery of BCG Vaccine Confers Protection to Tuberculosis-Susceptible Mice by an Interleukin 17-Dependent Mechanism. J Infect Dis. , (2015).
- Middlebrook, G., Cohn, M. L. Bacteriology of tuberculosis: laboratory methods. Am J Public Health Nations Health. 48 (7), 844-853 (1958).
- Brosch, R., et al. A new evolutionary scenario for the Mycobacterium tuberculosis complex. Proc Natl Acad Sci U S A. 99 (6), 3684-3689 (2002).
- Kaushal, D., et al. Mucosal vaccination with attenuated Mycobacterium tuberculosis induces strong central memory responses and protects against tuberculosis. Nat Commun. 6, 8533 (2015).
- Lochhead, J. J., Thorne, R. G. Intranasal delivery of biologics to the central nervous system. Adv Drug Deliv Rev. 64 (7), 614-628 (2012).
- Lochhead, J. J., Wolak, D. J., Pizzo, M. E., Thorne, R. G. Rapid transport within cerebral perivascular spaces underlies widespread tracer distribution in the brain after intranasal administration. J Cereb Blood Flow Metab. 35 (3), 371-381 (2015).
- Griffiths, K. L., et al. Cholera toxin enhances vaccine-induced protection against Mycobacterium tuberculosis challenge in mice. PLoS One. 8 (10), e78312 (2013).
- Hirota, K., et al. Plasticity of Th17 cells in Peyer's patches is responsible for the induction of T cell-dependent IgA responses. Nat Immunol. 14 (4), 372-379 (2013).
- Jaffar, Z., Ferrini, M. E., Herritt, L. A., Roberts, K. Cutting edge: lung mucosal Th17-mediated responses induce polymeric Ig receptor expression by the airway epithelium and elevate secretory IgA levels. J Immunol. 182 (8), 4507-4511 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon