Method Article
Saç türetilmiş keratinositlerden Kullanarak Entegrasyon serbest İnsan uyarılmış pluripotent kök hücrelerin üretilmesi
Bu Makalede
Özet
This manuscript provides a step-by-step procedure for the derivation and maintenance of human keratinocytes from plucked hair and subsequent generation of integration-free human induced pluripotent stem cells (hiPSCs) by episomal vectors.
Özet
Recent advances in reprogramming allow us to turn somatic cells into human induced pluripotent stem cells (hiPSCs). Disease modeling using patient-specific hiPSCs allows the study of the underlying mechanism for pathogenesis, also providing a platform for the development of in vitro drug screening and gene therapy to improve treatment options. The promising potential of hiPSCs for regenerative medicine is also evident from the increasing number of publications (>7000) on iPSCs in recent years. Various cell types from distinct lineages have been successfully used for hiPSC generation, including skin fibroblasts, hematopoietic cells and epidermal keratinocytes. While skin biopsies and blood collection are routinely performed in many labs as a source of somatic cells for the generation of hiPSCs, the collection and subsequent derivation of hair keratinocytes are less commonly used. Hair-derived keratinocytes represent a non-invasive approach to obtain cell samples from patients. Here we outline a simple non-invasive method for the derivation of keratinocytes from plucked hair. We also provide instructions for maintenance of keratinocytes and subsequent reprogramming to generate integration-free hiPSC using episomal vectors.
Giriş
İnsan uyarılmış pluripotent kök hücreleri (hiPSCs) keşif hastaya özgü kök hücrelerin 1-3 üretimi için uygun bir yöntem sağlayan, rejeneratif tıp alanında devrim yarattı. hiPSCs başarılı fibroblastlar 4,5, hematopoietik hücrelerin 6,7, idrar 8 böbrek epitel hücreleri ve 9,10 keratinositler dahil olmak üzere çeşitli somatik hücre tiplerinin, elde edilmiştir. Bugüne kadar, deri fibroblastları ve hematopoietik hücreler hastaya özgü iPSCs üretilmesi için en yaygın olarak kullanılan hücre kaynağıdır. Muhtemelen, bu deri biyopsileri ve kan toplama rutin tıbbi prosedürler ve birçok ülkede kurulmuştur hastanın kan veya cilt örneklerinin büyük biyobankalar olmasından kaynaklanmaktadır.
Kan hücreleri ve invazif çıkarma yöntemleri gerektiren deri fibroblast aksine, keratinositler hiPSC üretimi için kolay erişilebilir bir hücre tipini temsil etmektedir. Keratinocytes cildin dış epidermal bariyer oluşturur ve ayrıca çivi ve saç 11'de bulunan keratin bakımından zengin epitel hücreleri vardır. Özellikle, keratinositler saç köklerinin, iç kök kılıfı (IRS) hücreleri (12, Şekil 1) ile birlikte saç gövdesine kaplı bir dış hücresel tabakanın dış kök kılıfı (ORS) bulunabilir. Saç toplama sağlık personelinin yardım gerektirmeyen, basit bir prosedür olduğu gibi hastaların toplamak ve büyük ölçüde hiPSC nesil için hasta örneklerinin koleksiyonu kolaylaştıracak laboratuvarlar, kendi saç örneklerini göndermek için, bir fırsat sağlar. Epidermal keratinositler, aynı zamanda hiPSC üretimi 9,13 başlangıç hücreleri gibi keratinositleri kullanmanın avantajları ekleyerek, fibroblastlar ile karşılaştırıldığında daha yüksek bir yeniden programlama verimliliği ve daha hızlı bir yeniden programlama kinetiği sahiptir. Ayrıca, hiPSCs da saç folikülü içinde diğer hücre popülasyonları kullanılarak üretilebilir,saç folikülü 14,15 tabanında bulunan dermal papilla hücrelerini dahildir.
Saç türetilmiş hücreleri kullanarak iPSC nesil Önceki raporlar genellikle retroviral veya lentiviral tabanlı yeniden programlama yöntemlerini 9,14,15 kullanmaktadır. Ancak, bu viral yöntemler yeniden programlama sırasında yabancı transgenlerin istenmeyen genomik entegrasyon tanıtmak. Karşılaştırma olarak, epizomal vektörlerin kullanımı entegrasyonu içermeyen iPSCs 4 oluşturmak için uygun bir non-viral yeniden programlama yöntemi temsil eder. Biz daha önce verimli epizomal vektörler 13 kullanan hiPSCs içine keratinosit yeniden programlamak için basit, düşük maliyetli ve viral olmayan bir yöntem geliştirdik. Burada koparıp saç büyüme ve keratinositler bakım ve hiPSCs oluşturmak için daha sonra yeniden programlama ile ilgili keratinosit türetilmesi dahil olmak üzere, keratinosit türetilmiş hiPSCs, üretimi için ayrıntılı bir protokol sağlar.
Protokol
bireylerin insan saçı örnek toplama konak kurumlarında insan araştırma etik komitesi tarafından etik onayı gerektirir ve kurumsal kurallarına uygun yapılmalıdır.
Mızraplı Saç gelen Keratinositler 1. İzolasyonu
- Buz O / N (yani, Matrigel) çözülme Ekstrasellüler Matriks (ECM) çözümü.
- Önceden soğutulmuş pipet uçları kullanılarak, soğutulmuş DMEM / F12 ortamında 12 ml 200 ul ECM çözeltisi ilave edilir. Kat her bir seyreltilmiş ECM çözeltisi, 1 ml ile 12 oyuklu plaka. 37 ° C 'de, kaplanmış plak O / N inkübe edin. Kullanmadan önce, önceden ısıtılmış DMEM / F12 ortamı ile kaplanmış plaka yıkanır.
- Saç köküne yakın parmakları yerleştirerek ve bir hızlı ve pürüzsüz hareket saç yolma ile bireyin kafasından birincil insan saçı toplamak. Her toplanan saç bozulmamış bir saç folikülü içerdiğini teyit ve saç un büyüme fazını belirlemek için kontrol edinbir mikroskop (Şekil 1) der.
- Keratinositler ayıklamak için her bireyin 5-10 anagen tüyleri toplayın. Süreç keratinositlerinin başarılı türetme sağlamak için en kısa sürede tüyleri koparıp.
Not: Şekil 1 büyüme döngüsünün farklı aşamalarında kılların morfolojisi göstermektedir. Anajen saç ORS olarak bilinen saç uzunluğunu çevreleyen epitel görünür bir dış tabaka ile, bir büyüme aşamasında. Öte yandan, telojen saç dinlenme aşamasında saç temsil eder ve görünür bir ORS sahip değildir, ancak telojen çıkıntı olarak bilinen saç kökü kapsayan hücrelerin net bir top yer alır.
- Keratinositler ayıklamak için her bireyin 5-10 anagen tüyleri toplayın. Süreç keratinositlerinin başarılı türetme sağlamak için en kısa sürede tüyleri koparıp.
- Oda sıcaklığında 5 dakika boyunca yıkama antibiyotik karışımı 10 ml ihtiva eden bir petri çanağı içine numuneler saç.
- Saç şaftının 1 cm - sterilize makas ve forseps kullanarak, sağlam bir saç folikülü ve yaklaşık 0.5 olan bir saç parçası bırakarak, aşırı saç şaft kesti.
- Dikkatle traforseps kullanılarak ECM kaplı plakanın her oyuğuna nsfer 1 saç parçası.
- Saç örnekleri göre - (200 ul ~ 100) bir 1 ml'lik bir pipet kullanarak, nakavt Serum Replacement (KSR) ortam, yaklaşık 3 damla ekleyin.
Not: eki ve sonraki keratinosit akıbet için izin vermek için plaka yüzeyine yakın temas içinde saç parçaları tutun. Bu aşamada aşırı medya ekleyerek olabilir saç parçaları float neden olur ve başarılı bir saç eki olasılığını azaltır. - % 5 CO 2 ile 37 ° C inkübatör saç örnekleri inkübe ve saç köklerinin / N O takmak için izin verir. Nemli saç örneği tutmak için - (200 ul ~ 100) Ertesi gün, yavaşça KSR ortamının başka bir 3 damla ekleyin.
- Saç folikülleri başarıyla eklenmiş onaylamak için günlük saç örnekleri dikkate alın. Genellikle saç köklerinin eki 1-3 gün içinde görülür. Ince tüyleri yüksek olması gibi kalın kıllar, ince kıllar ile karşılaştırıldığında takmak için genellikle daha kolayeğilim eki sürecini engelleyen hangi float.
- Saç kaplı plaka takılı sonra, kuyuya KSR orta 500 ul ekleyin. Saç örnekleri sıkıca bağlı olmayabilir olarak orta eklerken ekstra özen gösterin. Bu noktadan itibaren, her 2 gün medya değiştirin.
Not: Keratinosit çıkıntılar 3-7 gün (Şekil 2A-B) sonra saç fragmanı ORS bölgesinden görünür olmalıdır. Keratinositler sonraki bölümde açıklandığı gibi hücrelerin Pasajlanması 14 gün öncesine kadar büyümeye izin verin.
- Saç kaplı plaka takılı sonra, kuyuya KSR orta 500 ul ekleyin. Saç örnekleri sıkıca bağlı olmayabilir olarak orta eklerken ekstra özen gösterin. Bu noktadan itibaren, her 2 gün medya değiştirin.
2. Bakım ve Keratinositler arasında Pasajlanması
- Ön kaplama kaplama maddesi Kit kullanılarak, 6-çukurlu plaka. Kaplama matris solüsyon içerisinde 6.8 ul ve ardından her oyuğa kit, seyreltme ortamı 680 ul ekle. Plaka üzerinde kaplama maddesi solüsyonu homojen dağılımını sağlamak için plakayı sallayın.
- Kaplanmış levha oda sıcaklığında 30 dakika boyunca inkübasyona izin verin. KaldırKeratinositlerin kaplama öncesinde kaplama maddesi solüsyonu.
- 37 ° C'de 2-5 dakika boyunca oyuk başına% 0.25 tripsin 500 ul olan tek bir hücre süspansiyonu içine keratinositler ayrıştırmaları. Serum ihtiva eden kültür (örneğin, fetal sığır serumu (FBS) ortamı) 500 ul tripsin inaktive ve steril bir 15 ml tüp içine toplar. Sterilize forseps kullanarak saç fragmanı çıkarın.
- Bir hemositometre kullanılarak hasat hücrelerinin sayısını belirler.
- X g 200'de 3 dakika boyunca hücreleri Santrifüj. PBS ve tekrar santrifüj hücreleri yıkayın. PBS aspire ve taze keratinosit ortamında hücre pelletini.
- Keratinosit ortamın mevcudiyetinde ECM kaplı plakanın bir kuyuya plaka aşağı 4 x 10 4 keratinositler. % 5 CO2 (Şekil 2C) ile 37 ° C inkübatör keratinositler tutun. Kültür olduğunda ~ Ortam% 80 konfluent her gün ve geçiş hücreleri değiştirmek, WHIch keratinositlerinin geçiş numarası ve çoğalma hızına bağlı olarak yaklaşık 2-7 gün sürebilir. türetilmiş keratinositler standart yavaş dondurma dondurma yöntemleri kullanılarak 16 yeterli dondurulmuş stokları oluşturmak için yaygınlaştırılmalıdır.
Not: Tarif edilen kültür koşulları tipik arnavut kaldırımı morfolojisi (Şekil 2C) ile keratinosit homojen popülasyonunun büyümesini desteklemektedir. Bazen, birkaç farklı, büyük ve düz morfolojisi keratinositler ve replikatif potansiyeli kaybetmiş, kültür görülebilir. Keratinositlerin karakterizasyonu sitokeratin 14 karşı antikorlar kullanılarak imüno-boyama ile gerçekleştirilebilir, daha önce tarif edilen 17. Kurulan keratinosit hücre çizgileri aynı zamanda, ticari olarak mevcut bir kit kullanılarak 1-3 geçişten sonra mikoplazma için test edilmelidir.
Epizomal vektörlerin kullanılması keratinositlerinden hiPSCs 3. Nesil
- 6-çukurlu plaka ile ön-kaplama% 0.1 jelatin (2 ml / oyuk). Oda sıcaklığında en az 20 dakika süreyle kaplamak için jelatin izin verir.
- Yeniden programlama deneme için, kullanımı keratinositler geç geçiş 6'dan ayrışır, 37 ° C'de 2-5 dakika boyunca oyuk başına% 0.25 tripsin, 1 ml ile tek bir hücre süspansiyonu içine keratinositler. Ortam serum içeren (ör: FBS ortamı) 1 ml tripsin inaktive ve 15 ml bir tüp içinde toplayın.
- Keratinosit ortamı içinde 200 xg ve tekrar süspansiyon hücreleri 3 dakika boyunca santrifüj hücreleri. Bir jelatinleştirilmiş plaka O / N kuyu başına Levha 1 × 10 5 -1.5 × 10 5 keratinositler.
- Ertesi gün (Gün 0) günü, hücreler% 50-60 konfluent olduğundan emin olmak için plakayı kontrol edin.
Not: keratinositler ~% 50 konfluent onlar iyi transfeksiyondan sonra büyümek olmayabilir daha az ise. - Gün 0 günü, 2 ug plasmid DNA, toplam 8 ul transfeksiyon reaktifi bir oran kullanılarak, keratinositler üzerinde epizomal yeniden programlama vektörlerinin transfeksiyonu gerçekleştirin.
- 4, plazmidler (pCXLE EGFP, pCXLE-hOct3 / 4-shP53F, pCXLE-HSK, pCXLE-hul) her biri için 0.5 ug al ve düşük serum ortamında (örneğin, OPTI-MEM) 100 ul seyreltin.
Not: Plazmid pCXLE EGFP keratinositlerde transfeksiyon verimliliği izlenmesi için kullanılan ve başarılı bir yeniden programlama için gerekli değildir. - Seyreltilmiş DNA transfeksiyon reaktifi 8 ul ekleyin. Tüp hafifçe vurarak karıştırın. DNA, Reaksiyon karışımı 15 dakika boyunca oda sıcaklığında rahatsız dinlenmeye bırakın.
- Taze ortam ile keratinosit orta değiştirin.
- Yavaşça 4 saat boyunca% 5 CO2 ile 37 ° C inkübatör keratinosit kültürü DNA Reaksiyon karışımı ekleyin ve inkübe edilir.
Not: bunlar düşük hayatta kalma sonrası transfeksiyon sergileyen olarak keratinositler uzun süreli transfeksiyon O / N gerçekleştirmek için tavsiye edilmez. - 4 saat sonra, transfeksiyondan sonra, taze ortam ile keratinosit orta yerine.
- 4, plazmidler (pCXLE EGFP, pCXLE-hOct3 / 4-shP53F, pCXLE-HSK, pCXLE-hul) her biri için 0.5 ug al ve düşük serum ortamında (örneğin, OPTI-MEM) 100 ul seyreltin.
- Gün 1 (1 gün sonrası transFection), keratinosit orta değiştirmek ve bir floresan mikroskop altında EGFP pozitif hücrelerin yüzdesi tahmin edilerek transfeksiyon etkinliğini kontrol edin. Tipik haliyle>% 60-70 transfeksiyon verimi, bu protokol kullanılarak primer keratinositler gözlenmektedir.
- Aşama 3,5 anlatıldığı gibi 2. Gün, transfeksiyon tekrarlayın. İki ardışık transfeksiyonlar genellikle>% 90 transfeksiyon verim elde ederim. Keratinosit kültürü genellikle ikinci transfeksiyon sonunda izdiham ulaşır.
- Her yeniden programlama reaksiyon için fare embriyonik fibroblast (MEF) besleyici bir 10 cm çanak hazırlayın. Daha önce tarif edildiği gibi 18 mitotik inaktive MEF besleyiciler hazırlayın.
- Ön kaplama, en az 20 dakika süreyle,% 0.1 jelatin, 5 ml ile 10 cm tabak. FBS ortamında 10 cm çanak başına Plaka 4 × 10 6 mitotik inaktif MEF. Hücreler yerleşmek ve% 5 CO 2 ile 37 ° C inkübatör O / N takmak için izin verin.
- Gün 3 günü, haradım 3.2 ve 3.3 açıklandığı gibi% 0.25 tripsin ile keratinositler yelek. KSR ortamı içinde yeniden süspanse edin ve keratinositleri KSR ortamı ile, 10 cm MEF besleyici çanak içine bir 6-yuvalı plaka 1 kuyusundan keratinosit% 90 plaka.
- Itibaren Day 4, her gün KSR orta değiştirin.
- Alternatif Gün 18 sonra, her ikinci gün kültür ortamı değiştirin.
Not: İnsan embriyonik kök hücreleri (hESC) benzeyen tanımlanan sınır ile hiPSC koloniler Gün 14 çıkacak iken Sigara yeniden programlanan keratinositler, çoğalmaya sona erecek - 21.
- Alternatif Gün 18 sonra, her ikinci gün kültür ortamı değiştirin.
- Itibaren Gün 21 manuel diseksiyon ile hiPSC koloniler izole edin. Yakından birlikte kümelenmiş ve yalnızca açıkça diğerlerinden ayrılır hiPSC koloniler almak vardır hiPSC koloniler kaçının.
Not: hiPSC koloniler önce alınabilir, ancak belirlenen sınırları koloni küçük koloni büyüklüğü göz önüne alındığında erken zaman noktalarında belirgin olmayabilir. Yeniden programlama verimliliği fark arasında değişebilirFarklı hasta en keratinositler, ve aynı zamanda geçiş sayısı veya keratinosit proliferasyon hızı gibi diğer faktörler tarafından etkilenir.- HiPSC kolonilerinin manuel diseksiyon için, bir mikroskop altında hiPSC kolonileri kesmek için bir 26G iğne kullanın. Uzunluğunda 600 um - 300 civarında küçük parçalar halinde bir hiPSC koloni kesin. HiPSCs klonal çizgi oluşturmak için yeni bir MEF besleyici plakası (2.5 × 10 4 MEF / cm 2) içine bir hiPSC kolonisinden parçaları aktarın. Başlangıçta, kültür 12 kuyu plakası veya organ kültürü yemekleri tek kuyuda her hiPSC klonal çizgi, daha sonra 6 kuyu plaka formatına genişletin.
- MEF besleyiciler üzerinde KSR ortamda hiPSCs kurulan klonal hatları korumak. Kültür kez 70 ulaşır - hiPSC kolonileri ile% 80 confluency ~ çapı 1,5 mm, üreticinin talimatlarına göre standart enzimatik Pasajlanması yöntemleri (Accutase, Dispase veya kollajenaz IV) kullanarak geçiş hiPSCs.
- Kurulan hiPSC hattını karakterizes pluripotensini ve in vitro ve / veya in vivo 13,19 üç germ hücreleri temsil ayırt etme yeteneğini doğrulamak için. Ayrıca, piyasada mevcut kitler kullanılarak mikoplazma için rutin kurulan test hiPSC çizgiler patojen içermez sağlamak. Rutin karyotipleme ya da dizi tabanlı kopya sayısı varyasyonu (KNV) analizi ile hiPSC hatlarının genomik istikrarı izlemek.
Sonuçlar
anagen (büyüme fazı), katagen (regresyon fazı) ve telojen (dinlenme fazı) 20-21: saç 3 farklı büyüme döngüsünün evreleri geçer. anagen kıl folikülü epitel Birden çok katman içeren; Bu tabakalar ORS, IRS ve saç gövdesine (Şekil 1) içerir. Anagen kıl sonunda ORS ve saç şaft farklılaşma fesih apoptoz ile işaretlenir katajen faza, geçiş uğrar. Son olarak, apoptoz durur ve telojen folikül karakteristik telojen ile sakin olur telojen faza için katajen saç geçiş 20,21 şişer.
Şekil 1 telojen saç ve anajen saç morfolojisi göstermektedir. Biz genellikle keratinosit derivasyon için anagen saç kullanmaktadır. Bu protokol, keratinosit çıkıntılar gibi erken 3 gün gibi saç eki (Şekil 2A) fark edilebilir ve p devam edecektirroliferate (Şekil 2B). Bizim tecrübelerimize göre, bazı anagen saçlar takmak veya keratinosit akıbet uymayan başarısız olabilir; Başarılı keratinosit izolasyonunu sağlamak için her bireyden 10 anagen kıl - böylece en az 5 toplamak. Daha sonra, keratinositler, yeni bir levha üzerine geçirildi ve birden fazla geçit (Şekil 2C) için muhafaza edilebilir. Bu KSR orta Matrigel ile karşılaştırıldığında, bölüm 2'de tarif edildiği gibi keratinosit ortamı ile bir kaplama maddesi ile keratinosit iyi büyüme olduğuna dikkat etmek önemlidir.
Genişleme sonrasında, keratinositler yeniden programlama 32 gün sonra bölüm 3. Şekil 3A tipik keratinosit kaynaklı hiPSC koloni gösterir açıklandığı gibi hiPSCs oluşturmak için yeniden olabilir. Bu hiPSC koloni merkezinde bir farklılaşma gözlemlemek için ortaktır. Bir kez elle aldı, türetilmiş hiPSCs tipik sitoplazmik oranı ve bağlı tanımlanmış bir koloniye yüksek çekirdeği görüntülerli (Şekil 3B). Bu tür pluripotent belirteçleri Oct4, Nanog ve TRA-160 (Şekil 3C-E) ifadesi, daha önce tarif edildiği gibi 13,19 hiPSCs arasında kurulan hücre çizgileri daha sonra pluripotensin açısından karakterize edilebilir.
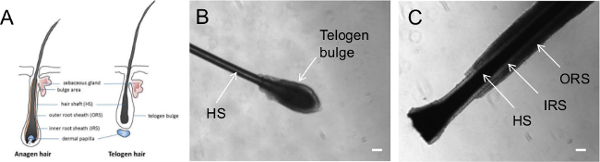
Şekil 1. Farklı büyüme aşamalarında koparıp kılların Temsilcisi görüntüler. (A) Diyagram anajen veya telojen faz tüyleri gösteren. (B) telogen faz ve (C) anagen fazda bir koparıp saç gösteren Faz kontrastlı görüntüler. HS = saç mil; IRS = İç Kök Kılıf; ORS = Dış Kök Kılıf. Ölçek çubuğu = 100 mikron. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Bir koparıp saç Şekil saç türetilmiş keratinositler 2. Temsilcisi görüntüler. Faz kontrastlı görüntüler (A) 3 gün ve (B) 10 gün boyunca aşağı kaplama. Beyaz oklar koparıp saç keratinosit akıbet işaretleyin. Pasajlanması sonra tipik bir arnavut kaldırımlı morfolojisi ile 3. Gün keratinosit kültürünün (C) Faz kontrastlı görüntü. Ölçek çubuğu = 100 mikron. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Şekil keratinosit kaynaklı hiPSCs 3. Temsilcisi görüntüler. Bir keratinosit kaynaklı hiPSC co gösteren bir Gün 32 yeniden programlama kültürünün (A) Faz kontrastlı görüntüLony. (B) El hESC benzer morfolojiye sahip keratinosit kaynaklı hiPSCs seçilmiş. Pluripotent işaretleri (C) NANOG ve (d) Oct4 ile hiPSCs immün (E) keratinosit türetilmiş hiPSCs TRA-160. Ölçek çubuğu = 100 mikron. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Tartışmalar
Hastaya özgü hiPSCs üretilmesi, in vitro olarak hastalıklı hücre tiplerinde patojenezinin araştırılması için eşsiz bir yaklaşım sunmaktadır ve ayrıca hastalığın fenotipleri kurtarabilir yeni moleküllerin belirlenmesi için ilaç tarama için bir platform sağlar. HiPSCs kullanılarak bu hastalığa modelleme yaklaşımı uzun QT sendromu, Huntington hastalığı, Parkinson hastalığı ve amiyotrofik lateral skleroz 22 de dahil olmak üzere çeşitli hastalıkların, umut vaat eden sonuçlar vermiştir. Çeşitli girişimler zaten ABD, Avrupa, Avustralya, Çin, Güney Kore ve Japonya'da 23,24 yılında konsorsiyumlar dahil hastaya özgü hiPSCs, büyük ölçekli kütüphaneler kurmak için çalışmalar devam etmektedir.
Burada saç türetilmiş keratinositlerinden hiPSCs kurmak için bir protokol kolaylaştırır ve hastalığa özel hiPSCs büyük ölçekli kütüphanelerinin kurulması hızlı izlemek için bir potansiyele sahip olan, tarif edilmektedir. Birincisi, epizomal: Bu protokol iki avantaj sunarBu protokolde kullanılan sistem, altı yeniden programlama faktörleri bir kokteyl ile entegrasyon-free hiPSCs üretir (Oct4, Sox2, Klf4 L-MYC, LIN28, p53 shRNA) nispeten yüksek verim 4 de. Retroviral veya lentiviral aracılı yeniden programlama yöntemleri ile karşılaştırıldığında, epizomal vektörü kullanımı reprogramming sırasında yabancı transgenlerin istenmeyen genomik entegrasyonunu önler. Bu nedenle, pek çok girişimler gibi büyük ölçekli hiPSC kütüphanelerinin kurulması için entegrasyon-free yeniden programlama yöntemlerinin kullanımını tercih epizomal vektörler, bütünleştirici yeniden programlama yöntemleri üzerinde 23 Sendai virüsü veya mRNA.
İkincisi, saç kolayca erişilebilir ve invaziv prosedürlerin kullanılması veya tıbbi personele katılım olmadan hastaların kendileri hasat edilebilir. Bu keratinosit türetme ve sonraki yeniden programlama için laboratuara kendi saç örneklerinde benzersiz toplamak için farklı bölgelerden hastalar için bir fırsat ve posta sağlar. Bu stratejinin uygulanabilirliği destek olarak, yayınlanmamış veriler keratinositler başarılı bir şekilde 10 gün boyunca 4 ° C'de saklanmıştır koparıp saç izole edilebilir olduğunu göstermektedir.
Burada anlatılan metodoloji koparıp saç keratinosit türetilmesi sağlayacaktır. Keratinositler sadece tek bir saç elde edilebilir olsa da, bizim önerimiz keratinosit derivasyon için en az 5 anagen tüyleri toplamaktır. Bu protokolün bir sınırlaması bazı kıllar iyi takmak olmayabilir ve keratinositler büyümeye başarısız olabilir olmasıdır. Daha kalın saç ince saç eki kayan önlemek ve geliştirmek için kaplama sırasında kültür ortamının düşük miktarda gerektirir ise, daha iyi takmak için eğilimindedir. Keratinositler elde edilir sonra, genişletmek ve standart yavaş dondurma dondurma yöntemleri kullanılarak 16 stoklarını aşağı dondurmak için tavsiye edilir. Keratinositlerin sonradan yeniden programlanması bu protokolü açıklanan şu adımları yapılabilir. Bu önemlidirazalmış yeniden programlama verimliliği geç pasajlar gözlenen ile hücrelerin hücre yaşlanmasının 25-27 ulaşması olarak başlayan hücrelerin çoğalması oranı, yeniden programlama verimliliğini etkileyebilir unutmayın. Bu bağlamda, en geç yeniden programlama deneyler için geçit 6 daha keratinositler kullanımı. Buna ek olarak, yeniden programlama verimleri farklı bireyin keratinositler arasında değişebilir.
Son çalışmalar ~ ile genom 29 somatik CNVs olduğu bildirilen deri fibroblast% 30 bedensel dokuların 28 çok tip yaygın genetik mozaisizim öneririz. Bu CNVs DNA replikasyonu, DNA onarımı ya da transpozon harekete hataları neden olabilir. Cilde uzun süreli UV ışınlarına maruz kalma fibroblastlar ve keratinositler dahil olmak üzere, epidermal hücreler ek CNVs neden olması da mümkündür, fakat bu ölçüde tam olarak anlaşılamamıştır. Keratinositlerde CNVs yeniden programlama işlemi sırasında üzerinden gerçekleştirilir gibi, important kurulan hiPSCs genomik istikrarı korumak sağlamak için rutin karyotiplemesi veya CNV analizi gerçekleştirmek için. Özet olarak, burada hastalık modelleme ve rejeneratif tıpta için kullanılabilir saç türetilmiş keratinositler gelen hiPSCs üretimi için işlemleri tarif.
Açıklamalar
The authors have no conflict of interest.
Teşekkürler
The authors wish to thank Harene Ranjithakumaran and Stacey Jackson for technical support. This work was supported in part by grants from the National Health and Medical Research Council (R.C.B. Wong, A. Pébay), the University of Melbourne (R.C.B. Wong), Retina Australia (R.C.B. Wong, S.S.C. Hung, A. Pébay) and the Ophthalmic Research Institute of Australia (R.C.B. Wong, S.S.C. Hung, A. Pébay); Australian Research Council Future Fellowship (A. Pébay, FT140100047), Cranbourne Foundation Fellowship (R.C.B. Wong); intramural funding from the National Institutes for Health (R.C.B. Wong, S.S.C. Hung) and operational infrastructure support from the Victorian Government.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Antibiotic Mix: | |||
| 250 ng/ml Antimycotic amphotericin B | Sigma | A2942-20ml | Antibiotic mix is made up in PBS. |
| 1X Penicillin/Streptomycin | Invitrogen | 15140-122 | |
| PBS (-) | Invitrogen | 14190-144 | |
| Knockout Serum Replacement (KSR) medium: | KSR medium is filtered using Stericup (Millipore, #SCGPU05RE) before use. bFGF is added fresh to the media before use. | ||
| 20% knockout serum replacement (KSR) | Invitrogen | 10828-028 | |
| DMEM/F12 with glutamax | Invitrogen | 10565-042 | |
| 1× MEM non-essential amino acid | Invitrogen | 11140-050 | |
| 0.5× Penicillin/Streptomycin | Invitrogen | 15140-122 | |
| 0.1 mM β-mercaptoethanol | Invitrogen | 21985 | |
| bFGF (10 ng/ml, added fresh) | Millipore | GF003 | |
| Keratinocyte medium: | |||
| EpiLife with 60 µM Calcium | Invitrogen | M-EPI-500-CA | |
| 1× Human keratinocyte growth supplement (HKGS) | Invitrogen | S-001-5 | |
| Fetal Bovine Serum (FBS) medium: | FBS medium is filtered using Stericup (Millipore, #SCGPU05RE) before use. | ||
| 10% fetal bovine serum (FBS) | Invitrogen | 26140079 | |
| DMEM | Invitrogen | 11995-073 | |
| 0.5x Penicillin/Streptomycin | Invitrogen | 15140-122 | |
| 2 mM L-glutamine | Invitrogen | 25030 | |
| 0.25% trypsin-EDTA | Invitrogen | 25200-056 | |
| Extracellular Matrix (ECM): | |||
| Matrigel | Corning | 354234 | Aliquot Matrigel stock and store in -80°C following manufacturer’s instructions. Stock concentration of Matrigel varies slightly from batch to batch (~9mg/ml). We recommend to use 200µl matrigel for coating a 12-well plate (~150µg/well). |
| Coating Matrix Kit | Invitrogen | R-011-K | |
| Plasmids: | Note that pCXLE-eGFP is only used for monitoring transfection efficiency and is not required for reprogramming. | ||
| - pCXLE-eGFP | Addgene | 27082 | |
| - pCXLE-hOct3/4-shP53F | Addgene | 27077 | |
| - pCXLE-hSK | Addgene | 27078 | |
| - pCXLE-hUL | Addgene | 27080 | |
| Transfection reagent Fugene HD | Promega | E231B | |
| Gelatin (from porcine skin) | Sigma | G1890 | Make up 0.1% gelatin in distilled water. Autoclave before use. |
| Reduced Serum medium: OPTI-MEM | Invitrogen | 31985062 | |
| Accutase | Sigma | A6964-100ml | |
| Mouse embryonic fibroblast (MEF) feeder | MEF can be inactivated by mitomycin C treatment or irradiation as described previously 16. | ||
| 26G needle | Terumo | NN2613R | |
| 6-well plate (tissue culture treated) | BD Biosciences | 353046 | |
| 12-well plate (tissue culture treated) | BD Biosciences | 353043 | |
| 10 cm dish (tissue culture treated) | BD Biosciences | 353003 | |
| Dispase | Invitrogen | 17105-041 | Use at 10 mg/ml |
| Collagenase IV | Invitrogen | 17104-019 | Use at 1 mg/ml |
| TRA-160 antibody | Millipore | MAB4360 | Use at 5 µg/ml |
| OCT4 antibody | Santa Cruz | SC-5279 | Use at 5 µg/ml |
| NANOG antibody | R&D Systems | AF1997 | Use at 10 µg/ml |
| MycoAlert Detection kit | Lonza | LT07-418 |
Referanslar
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126, 663-676 (2006).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131, 861-872 (2007).
- Yu, J., et al. Induced pluripotent stem cell lines derived from human somatic cells. Science. 318, 1917-1920 (2007).
- Okita, K., et al. A more efficient method to generate integration-free human iPS cells. Nat Methods. 8, 409-412 (2011).
- Park, I. H., et al. Reprogramming of human somatic cells to pluripotency with defined factors. Nature. 451, U141-U141 (2008).
- Okita, K., et al. An efficient nonviral method to generate integration-free human-induced pluripotent stem cells from cord blood and peripheral blood cells. Stem Cells. 31, 458-466 (2013).
- Dowey, S. N., Huang, X., Chou, B. K., Ye, Z., Cheng, L. Generation of integration-free human induced pluripotent stem cells from postnatal blood mononuclear cells by plasmid vector expression. Nat Protoc. 7, 2013-2021 (2012).
- Zhou, T., et al. Generation of induced pluripotent stem cells from urine. J Am Soc Nephrol. 22, 1221-1228 (2011).
- Aasen, T., et al. Efficient and rapid generation of induced pluripotent stem cells from human keratinocytes. Nat Biotechnol. 26, 1276-1284 (2008).
- Peters, A., Zambidis, E. Chapter 16. Generation of nonviral integration-free induced pluripotent stem cells from plucked human hair follicles. Human Embryonic and Induced Pluripotent Stem Cells: Lineage-Specific Differentiation Protocols.Springer Protocols Handbooks. Ye, K., Jin, S. , Springer. 203-227 (2012).
- Fuchs, E. Scratching the surface of skin development. Nature. 445, 834-842 (2007).
- Limat, A., Noser, F. K. Serial cultivation of single keratinocytes from the outer root sheath of human scalp hair follicles. J Invest Dermatol. 87, 485-488 (1986).
- Piao, Y., Hung, S. S., Lim, S. Y., Wong, R. C., Ko, M. S. Efficient generation of integration-free human induced pluripotent stem cells from keratinocytes by simple transfection of episomal vectors. Stem Cells Transl Med. 3, 787-791 (2014).
- Higgins, C. A., et al. Reprogramming of human hair follicle dermal papilla cells into induced pluripotent stem cells. J Invest Dermatol. 132, 1725-1727 (2012).
- Muchkaeva, I. A., et al. Generation of iPS Cells from Human Hair Follice Dermal Papilla Cells. Acta naturae. 6, 45-53 (2014).
- Naaldijk, Y., Friedrich-Stockigt, A., Sethe, S., Stolzing, A. Comparison of different cooling rates for fibroblast and keratinocyte cryopreservation. J Tissue Eng Regen. , (2013).
- Sporl, F., et al. Real-time monitoring of membrane cholesterol reveals new insights into epidermal differentiation. J Invest Dermatol. 130, 1268-1278 (2010).
- Conner, D. A., et al. Mouse embryo fibroblast (MEF) feeder cell preparation. Current protocols in molecular biology. Ausubel, F. N., et al. 23, Unit 23 22(2001).
- Pebay, A., et al. Essential roles of sphingosine-1-phosphate and platelet-derived growth factor in the maintenance of human embryonic stem cells. Stem Cells. 23, 1541-1548 (2005).
- Myung, P., Ito, M. Dissecting the bulge in hair regeneration. J Clin Invest. 122, 448-454 (2012).
- Alonso, L., Fuchs, E. The hair cycle. J Cell Sci. 119, 391-393 (2006).
- Robinton, D. A., Daley, G. Q. The promise of induced pluripotent stem cells in research and therapy. Nature. 481, 295-305 (2012).
- Soares, F. A., Sheldon, M., Rao, M., Mummery, C., Vallier, L. International coordination of large-scale human induced pluripotent stem cell initiatives: Wellcome Trust and ISSCR workshops white paper. Stem cell reports. 3, 931-939 (2014).
- McKernan, R., Watt, F. M. What is the point of large-scale collections of human induced pluripotent stem cells. Nat Biotechnol. 31, 875-877 (2013).
- Utikal, J., et al. Immortalization eliminates a roadblock during cellular reprogramming into iPS cells. Nature. 460, U1145-U1112 (2009).
- Xu, Y., et al. Proliferation rate of somatic cells affects reprogramming efficiency. J Biol Chem. 288, 9767-9778 (2013).
- Liu, J., et al. Late passage human fibroblasts induced to pluripotency are capable of directed neuronal differentiation. Cell Transplant. 20, 193-203 (2011).
- Huallachain, M., Karczewski, K. J., Weissman, S. M., Urban, A. E., Snyder, M. P. Extensive genetic variation in somatic human tissues. Proc Natl Acad Sci U S A. 109, 18018-18023 (2012).
- Abyzov, A., et al. Somatic copy number mosaicism in human skin revealed by induced pluripotent stem cells. Nature. 492, 438-442 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır