Method Article
Geração de Integração Induced-livre Human células estaminais pluripotentes usando o cabelo derivado queratinócitos
Neste Artigo
Resumo
This manuscript provides a step-by-step procedure for the derivation and maintenance of human keratinocytes from plucked hair and subsequent generation of integration-free human induced pluripotent stem cells (hiPSCs) by episomal vectors.
Resumo
Recent advances in reprogramming allow us to turn somatic cells into human induced pluripotent stem cells (hiPSCs). Disease modeling using patient-specific hiPSCs allows the study of the underlying mechanism for pathogenesis, also providing a platform for the development of in vitro drug screening and gene therapy to improve treatment options. The promising potential of hiPSCs for regenerative medicine is also evident from the increasing number of publications (>7000) on iPSCs in recent years. Various cell types from distinct lineages have been successfully used for hiPSC generation, including skin fibroblasts, hematopoietic cells and epidermal keratinocytes. While skin biopsies and blood collection are routinely performed in many labs as a source of somatic cells for the generation of hiPSCs, the collection and subsequent derivation of hair keratinocytes are less commonly used. Hair-derived keratinocytes represent a non-invasive approach to obtain cell samples from patients. Here we outline a simple non-invasive method for the derivation of keratinocytes from plucked hair. We also provide instructions for maintenance of keratinocytes and subsequent reprogramming to generate integration-free hiPSC using episomal vectors.
Introdução
A descoberta de humanos induzida por células estaminais pluripotentes (hiPSCs) revolucionou o campo da medicina regenerativa, proporcionando um método viável para a produção de células estaminais específicos do paciente 1-3. hiPSCs ter sido gerado com êxito a partir de vários tipos de células somáticas, incluindo fibroblastos, células hematopoiéticas 4,5 6,7, células epiteliais renais de urina 8 e queratinócitos 9,10. Até à data, os fibroblastos da pele e células hematopoiéticas representam as fontes de células mais comumente utilizados para gerar iPSCs específicos do paciente. Indiscutivelmente, isso se deve ao fato de que as biópsias de pele e coleta de sangue são procedimentos médicos de rotina e grandes biobancos de sangue ou de pele amostras de pacientes foram estabelecidos em muitos países.
Em contraste com as células sanguíneas e de fibroblastos da pele que requerem métodos de extracção invasiva, queratinócitos representam um tipo de células facilmente acessíveis para a geração hiPSC. Keratinocytes são células epiteliais rico em queratina que formam a barreira epidérmica exterior da pele e são também encontrados em unhas e cabelo 11. Em particular, os queratinócitos podem ser encontrados na bainha externa da raiz (ORS) dos folículos pilosos, uma camada celular externa que cobria o eixo do cabelo, juntamente com a bainha radicular interna (IRS), células (12, Figura 1). Como coleta de cabelo é um procedimento simples, que não requer a assistência de pessoal médico, ele fornece uma oportunidade para os pacientes de recolher e enviar suas próprias amostras de cabelo para laboratórios, o que facilitaria muito a recolha de amostras de doentes para a geração de hiPSC. Queratinócitos epidérmicos também têm uma maior eficiência de reprogramação e cinética de reprogramação mais rápidas em comparação com fibroblastos, a adição às vantagens da utilização de queratinócitos como as células de partida para a geração de hiPSC 9,13. Além disso, hiPSCs também pode ser gerado usando outras populações de células dentro do folículo piloso,incluindo as células de papila dérmicas localizadas na base do folículo piloso 14,15.
Relatórios anteriores de geração iPSC usando células derivadas de cabelo muitas vezes utilizam métodos de reprogramação retrovirais ou à base de lentivírus 9,14,15. No entanto, estes métodos virais introduzir integração genómica indesejável de transgenes estranhos durante a reprogramação. Em comparação, a utilização de vectores epissomais representa um método viável reprogramação, não-viral para gerar iPSCs livre de integração 4. Nós já desenvolveu um método simples, eficaz e não-viral para reprogramar eficiente queratinócitos em hiPSCs usando vetores epissomais 13. Aqui nós fornecemos um protocolo detalhado para a geração de hiPSCs derivado de queratinócitos, incluindo a derivação de queratinócitos a partir de cabelo arrancado, de expansão e de manutenção dos queratinócitos e reprogramação subsequente para gerar hiPSCs.
Protocolo
A coleta de amostra de cabelo humano de indivíduos requer aprovação ética pelo comitê de ética em pesquisa em humanos nas instituições de acolhimento e deve ser feito em conformidade com as diretrizes institucionais.
1. Isolamento de queratinócitos a partir de cabelo arrancado
- Descongelar solução Matriz Extracelular (ECM) (isto é, Matrigel) em gelo, O / N.
- Usando pontas de pipetas pré-refrigerados, adicione 200 mL de solução de ECM 12 ml de meio DMEM / F12 refrigerados. Bata de uma placa de 12 poços com 1 ml de solução diluída de ECM para cada poço. Incubar a placa revestida O / N a 37 ° C. Lavar a placa revestida com o meio DMEM pré-aquecido / F12 antes da utilização.
- Colete cabelo humano primário da cabeça do indivíduo, colocando os dedos perto da raiz do cabelo e arrancar o cabelo em um movimento rápido e suave. Verifique para confirmar que cada cabelo recolhido contém um folículo de cabelo intacto e determinar a fase de crescimento do cabelo under um microscópio de dissecação (Figura 1).
- Recolha 5-10 cabelos anágenos de cada indivíduo para extrair queratinócitos. Processo arrancado os cabelos tão rapidamente quanto possível para assegurar derivação bem sucedida de queratinócitos.
Nota: A Figura 1 ilustra a morfologia de cabelos em diferentes fases do ciclo de crescimento. Os cabelos anágenos está em fase de crescimento, com uma camada exterior visível do epitélio em torno do comprimento do cabelo, conhecidas como as ORS. Por outro lado, o cabelo eflúvio representa cabelo na fase de repouso e não tem uma ORS visíveis, mas tem uma bola de clara de células que cobrem a raiz dos cabelos, conhecido como o bojo telógena.
- Recolha 5-10 cabelos anágenos de cada indivíduo para extrair queratinócitos. Processo arrancado os cabelos tão rapidamente quanto possível para assegurar derivação bem sucedida de queratinócitos.
- Coloque as amostras de cabelo para uma placa de Petri contendo 10 ml de mistura de antibióticos para lavar durante 5 min à TA.
- Usando tesouras e pinças esterilizadas, cortar para fora do eixo de cabelo excessiva, deixando um fragmento de cabelo com um folículo de cabelo intacto e em torno de 0,5-1 cm de haste capilar.
- Cuidadosamente transfer fragmento de um cabelo em cada poço da placa revestida com ECM usando uma pinça.
- Usando uma pipeta de 1 ml, adicionar cerca de 3 gotas de KO substituição Serum (KSR) meio (~ 100-200 uL) com as amostras de cabelo.
Nota: Mantenha os fragmentos de cabelo em estreito contacto com a superfície da placa para permitir a fixação e posterior crescimento de queratinócitos. Adição excessiva da mídia nesta etapa pode faz com que os fragmentos de cabelo a flutuar e diminui a chance de fixação de cabelo bem sucedida. - Incubar as amostras de cabelo em um 37 ° C incubadora com 5% de CO 2 e permitir que os folículos pilosos para anexar O / N. No dia seguinte, adicionar mais suavemente 3 gotas de meio KSR (~ 100-200 uL) para manter as amostras de cabelo húmido.
- Observe as amostras de cabelo diariamente para confirmar que os folículos pilosos ter anexado com sucesso. Geralmente fixação dos folículos pilosos é evidente dentro de 1-3 dias. Pêlos grossos são geralmente mais fácil de anexar comparação com cabelos finos, como pêlos finos têm maiortendência a flutuar que retardam o processo de fixação.
- Uma vez que o cabelo se ligado à placa de revestimento, adicionar 500 uL de meio KSR para o poço. Tome cuidado extra ao adicionar a forma como amostras de cabelo pode não ter ligado com firmeza. A partir deste ponto, mudar de mídia a cada 2 dias.
Nota: excrescências queratinócitos deve ser visível a partir da região do fragmento de SRO cabelo após 3-7 dias (Figura 2A-B). Permitir que os queratinócitos a crescer até 14 dias antes da passagem das células, como descrito na próxima seção.
- Uma vez que o cabelo se ligado à placa de revestimento, adicionar 500 uL de meio KSR para o poço. Tome cuidado extra ao adicionar a forma como amostras de cabelo pode não ter ligado com firmeza. A partir deste ponto, mudar de mídia a cada 2 dias.
2. Manutenção e Passaging de queratinócitos
- Pré-revestimento de uma placa de 6 poços, utilizando o Kit de revestimento de matriz. Adicionar 680 ul de meio de diluição a partir do kit a cada poço, seguido de 6,8 ml de solução de revestimento de matriz. Agitar a placa para assegurar uma distribuição uniforme da solução de revestimento de matriz na placa.
- Permitir que a placa revestida com a incubar durante 30 min à temperatura ambiente. Removera solução de revestimento de matriz antes do plaqueamento de queratinócitos.
- Dissociar queratinócitos numa suspensão de células individuais com 500 ul de tripsina a 0,25% por poço durante 2-5 min a 37 ° C. Inactivar a tripsina com 500 ul de meio contendo soro (por exemplo, de Soro Fetal Bovino (FBS) meio) e juntar-se em um tubo de 15 mL estéril. Remover o fragmento de cabelo usando fórceps esterilizados.
- Determinar o número de células recolhidas utilizando um hemocitómetro.
- Centrifugar as células durante 3 minutos a 200 x g. Lavam-se as células com PBS e centrifugação repetida. Aspirar o PBS e ressuspender o sedimento de células em meio fresco de queratinócitos.
- Placa de deslocamento 4 × 10 4 queratinócitos para um poço de placa revestida com ECM na presença de meio de queratinócitos. Manter os queratinócitos em uma temperatura de 37 ° C incubadora com 5% de CO 2 (Figura 2C). Mudança de mídia a cada dia e células de passagem quando a cultura é de aproximadamente 80% confluentes, which pode demorar cerca de 2-7 dias dependendo do número de passagens e taxa de proliferação dos queratinócitos. Os queratinócitos derivados deve ser expandido para gerar stocks congelados suficientes usando métodos de criopreservação lento de congelamento padrão 16.
Nota: As condições de cultura descritas suporta a expansão da população homogénea de queratinócitos e com a morfologia típica de calçada (Figura 2C). Ocasionalmente, alguns queratinócitos diferenciadas, com morfologia de grande e plana e perderam potencial replicativo, pode ser observado na cultura. Caracterização de queratinócitos pode ser realizada por imunocoloração utilizando anticorpos contra citoqueratina 14, como previamente descrito 17. Linhas celulares de queratinócitos estabelecidas devem também ser testados para micoplasma após 1-3 passagens utilizando o kit disponível comercialmente.
3. Geração de hiPSCs de Queratinócitos Usando vectores epissomais
- Pré-revestimento de uma placa de 6 poços comGelatina a 0,1% (2 ml / poço). Permitir que a gelatina de revestimento durante pelo menos 20 min à temperatura ambiente.
- Para o experimento de reprogramação, de uso queratinócitos não mais tarde do que a passagem 6. dissociar os queratinócitos em uma única suspensão de células com 1 ml de tripsina a 0,25% por poço, durante 2-5 min a 37 ° C. Inactivar a tripsina com 1 ml de meio contendo soro (por exemplo, meios de FBS) e recolher num tubo de 15 ml.
- Centrifugar as células durante 3 min a 200 xg e ressuspender as células em meio de queratinócitos. Placa 1 × 10 × 10 5 -1,5 5 queratinócitos por cavidade em uma placa gelatinizado O / N.
- No dia seguinte (dia 0), verifique a placa para garantir células são 50-60% confluentes.
Nota: Se os queratinócitos são menos de ~ 50% confluentes eles podem não crescer bem após a transfecção. - No Dia 0, efectuar a transfecção dos vectores epissomais de reprogramação nos queratinócitos, usando uma proporção de reagente de transfecção de 8 ul a 2? G de DNA total de plasmídeo.
- Tirar 0,5 ug de cada um dos quatro plasmídeos (pCXLE-eGFP, pCXLE-hOct3 / 4-shP53F, pCXLE-HSK, pCXLE-Hul) e dilui-se em 100 ul de meio de soro reduzido (por exemplo, meio OPTI-MEM).
Nota: O plasmídeo pCXLE-eGFP é usado para monitorar as eficiências de transfecção em queratinócitos e não é necessário para reprogramação. - Adicionar 8 mL de reagente de transfecção de ADN diluída. Misture sacudindo o tubo. Permitir que a mistura de reacção contendo o ADN para descansar sem perturbação à temperatura ambiente durante 15 min.
- Substituir o meio de queratinócitos com meio fresco.
- Adicionar cuidadosamente a mistura reaccional para a cultura de queratinócitos de ADN e incubar numa incubadora a 37 ° C com 5% de CO 2 durante 4 horas.
Nota: Não é recomendado para executar prolongado transfecção O / N em queratinócitos como eles apresentam baixa sobrevivência pós-transfecção. - Depois de 4 horas após a transfecção, substituir o meio de queratinócitos com meio fresco.
- Tirar 0,5 ug de cada um dos quatro plasmídeos (pCXLE-eGFP, pCXLE-hOct3 / 4-shP53F, pCXLE-HSK, pCXLE-Hul) e dilui-se em 100 ul de meio de soro reduzido (por exemplo, meio OPTI-MEM).
- No Dia 1 (1 dia de pós-transinfecção), alterar a forma de queratinócitos e verificar a eficiência de transfecção pela estimativa da percentagem de células positivas eGFP sob um microscópio fluorescente. Tipicamente> 60-70% de eficiência de transfecção é observado para queratinócitos primários usando esse protocolo.
- No Dia 2, repetir a transfecção como descrito na etapa 3.5. Dois transfecções sucessivas seriam tipicamente atingir> 90% de eficiência de transfecção. Cultura de queratinócitos geralmente atinge confluência até ao final do segundo transfecção.
- Prepare uma placa de 10 cm de fibroblastos de rato embrionárias (MEF) alimentador para cada reação reprogramação. Prepare alimentadores MEF mitoticamente inactivadas como descrito anteriormente 18.
- Pré-revestimento de uma placa de 10 cm com 5 ml de gelatina a 0,1% durante pelo menos 20 min. Placa 4 × 10 6 MEF mitotically inativado por placa de 10 cm em meio FBS. Permitir que as células assentar e unir O / N em uma temperatura de 37 ° C incubadora com 5% de CO 2.
- No Dia 3, harcolete os queratinócitos com 0,25% de tripsina, tal como descrito no passo 3.2 e 3.3. Ressuspender as queratinócitos em meio KSR e placa 90% de queratinócitos a partir de um poço de uma placa de 6 poços num prato de 10 centímetros MEF alimentador com meio KSR.
- A partir do dia 4 em diante, mudar o meio KSR todos os dias.
- Alternativamente após o Dia 18, substituir o meio de cultura a cada segundo dia.
Nota: os queratinócitos não-reprogramado deixará de proliferar, enquanto colônias hiPSC com limite definido que se assemelham a células estaminais embrionárias humanas (hESCs) vão surgir a partir do dia 14-21.
- Alternativamente após o Dia 18, substituir o meio de cultura a cada segundo dia.
- Isolar colônias hiPSC por dissecção manual a partir do dia 21 em diante. Evite colônias hiPSC que estão intimamente agrupadas e apenas escolher colônias hiPSC que estão claramente separados dos outros.
Nota: colônias hiPSC pode ser pego mais cedo, mas a colônia com limites definidos pode não ser óbvio em momentos anteriores, dada a dimensão pequena colônia. Eficiências de reprogramação podem variar entre different queratinócitos do paciente, e também é influenciado por outros factores, tais como o número de passagens ou a taxa de proliferação de queratinócitos.- Para dissecção manual das colônias hiPSC, use uma agulha de 26G para cortar colônias hiPSC sob um microscópio de dissecação. Cortar uma colónia hiPSC em pequenos pedaços ao redor de 300-600 uM de comprimento. Transferir os pedaços de uma colônia hiPSC em um novo alimentador de placas MEF (2,5 × 10 4 MEF / cm 2) para estabelecer uma linha clonal de hiPSCs. Inicialmente, a cultura de cada linha clonal hiPSC em um poço de uma placa de 12 poços ou de cultura de órgãos pratos, em seguida, expanda a 6 formato de placa bem.
- Manter linhas clonais estabelecidos de hiPSCs em meio KSR sobre alimentadores MEF. Uma vez que a cultura atingir 70 - 80% de confluência com colónias hiPSC ~ 1,5 milímetros de diâmetro, hiPSCs passagem utilizando métodos padrão enzimáticas Passaging (Accutase, dispase ou colagenase IV) de acordo com as instruções do fabricante.
- Caracterizar linha hiPSC estabelecidos para confirmar pluripotência e sua capacidade de se diferenciar em células representativas das três camadas germinativas, in vitro e / ou in vivo 13,19. Além disso, linhas hiPSC Testar rotineiramente estabelecidos para micoplasma usando kits disponíveis comercialmente para garantir que eles são livres do patógeno. Rotineiramente monitorar estabilidade genômica de linhas hiPSC por cariótipo ou análise baseada em array variação do número de cópias (CNV).
Resultados
O cabelo passa por três fases diferentes do ciclo de crescimento: anágena (fase de crescimento), catágena (fase de regressão) e telógena (na fase de repouso) 20,21. O folículo piloso anágena contém várias camadas de epitélio; essas camadas incluem os ORS, IRS e do eixo do cabelo (Figura 1). Cabelos anágenos eventualmente sofre a transição para a fase catágena, que é marcado por apoptose das ORS e rescisão de diferenciação eixo do cabelo. Finalmente, a transição de cabelo catagen à fase telógena, onde cessa de apoptose e telógeno o folículo torna-se tranquila com um eflúvio característica bojo 20,21.
A Figura 1 ilustra a morfologia de um cabelo e uma eflúvio cabelo anágeno. Nós normalmente utilizam cabelos anágenos para queratinócitos derivação. Na sequência deste protocolo, excrescências de queratinócitos pode ser observado nas primeiras três dias após a fixação do cabelo (Figura 2A) e continuará a proliferate (Figura 2B). Em nossa experiência, alguns cabelos anágenos podem falhar para anexar ou deixar de observar queratinócitos conseqüência; assim, recolher, pelo menos, 5-10 cabelos anágenos de cada indivíduo para garantir o isolamento dos queratinócitos bem sucedido. Subsequentemente, os queratinócitos podem ser passadas para um novo prato e mantida durante várias passagens (Figura 2C). É importante notar que há um melhor crescimento de queratinócitos em uma matriz de revestimento com meio Keratinocyte conforme descrito no capítulo 2, em comparação com Matrigel com meio KSR.
Após a expansão, os queratinócitos podem ser reprogramadas de modo a gerar hiPSCs como descrito na secção 3. A Figura 3A mostra um derivado de queratinócito típico hiPSC colónia após 32 dias de reprogramação. É comum observar alguma diferenciação no centro da colónia hiPSC. Uma vez escolhido manualmente, os hiPSCs derivados geralmente exibem alta núcleo rácio citoplasmática e uma colônia definido ligadoAry (Figura 3B). As linhas celulares estabelecidas de hiPSCs pode, então, ser caracterizada por pluripotência como descrito anteriormente 13,19, tal como a expressão de marcadores pluripotentes OCT4, NANOG e TRA-160 (Figura 3C-E).
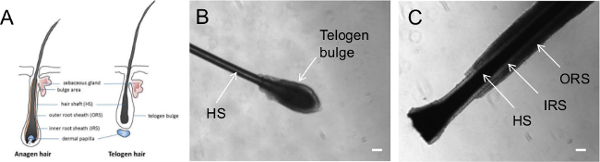
Figura 1. Imagens representativas de cabelos arrancados em diferentes fases de crescimento. (A) Diagrama ilustrando os pêlos na fase anágena ou telógeno. Imagens de contraste de fase mostrando uma cabelo arrancado em (B) fase telógena e (C) fase anágena. HS = eixo de cabelo; IRS = Inner Root bainha; ORS = Outer Root bainha. Scale bar = 100 mm. Por favor clique aqui para ver uma versão maior desta figura.

Figura 2. Imagens representativas de queratinócitos derivadas de cabelo. Imagens de contraste de fase de um fio de cabelo arrancado plaqueadas para baixo (A) 3 dias e (b) 10 dias. As setas brancas marcam o crescimento de queratinócitos a partir de um cabelo arrancado. Imagem de contraste (C) Fase do Dia 3 cultura de queratinócitos com uma morfologia típica calçada portuguesa após passaging. Scale bar = 100 mm. Por favor clique aqui para ver uma versão maior desta figura.

Figura 3. Imagens representativas de hiPSCs derivadas de queratinócitos. (A) imagem de contraste de fase de uma cultura de reprogramação Dia 32 mostrando um hiPSC co-derivado de queratinócitolony. (B) selecionado manualmente hiPSCs derivadas de queratinócitos com morfologia semelhante à hESCs. A imunocoloração de hiPSCs com marcadores pluripotentes (C) NANOG e (D) OCT4 e (E) de TRA-160 em hiPSCs derivadas de queratinócitos. Scale bar = 100 mm. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Geração de hiPSCs específicos do paciente oferece uma abordagem única para estudar patogênese nos tipos de células doentes in vitro, e também fornece uma plataforma para a triagem de drogas para identificar novas moléculas que podem resgatar os fenótipos da doença. Esta abordagem de modelagem doença usando hiPSCs tem produzido resultados promissores para uma variedade de doenças, incluindo a síndrome de QT longo, doença de Huntington, doença de Parkinson e esclerose lateral amiotrófica 22. Várias iniciativas já estão em andamento para estabelecer bibliotecas em larga escala de hiPSCs específicos do paciente, incluindo consórcios nos EUA, Europa, Austrália, China, Coréia do Sul e Japão 23,24.
Aqui um protocolo para estabelecer hiPSCs de queratinócitos derivados de cabelo é descrito, que tem o potencial de facilitar e fast-track a criação de bibliotecas em larga escala de hiPSCs de doenças específicas. Este protocolo oferece duas vantagens: em primeiro lugar, o epissomalsistema utilizado neste protocolo gera hiPSCs sem integração usando um coquetel de seis fatores de reprogramação (OCT4, SOX2, KLF4, L-MYC, LIN28, shRNA para p53) a relativamente alta eficiência 4. Comparado com os métodos de reprogramação retrovirais ou lentivirais mediada por, o uso de vector epissomal evita integração genómica indesejável de transgenes estranhos durante reprogramação., Assim, várias iniciativas favorecer a utilização de métodos de reprogramação livre de integração para a criação de bibliotecas hiPSC de grande escala, tais como a vetores epissomais, vírus Sendai ou mRNA, em relação aos métodos de reprogramação integrativas 23.
Em segundo lugar, o cabelo é facilmente acessível e pode ser colhida pelos próprios pacientes sem o uso de procedimentos invasivos ou a presença de equipes médicas. Isso fornece uma oportunidade única para os pacientes de diferentes regiões para coletar e-mail em suas próprias amostras de cabelo para o laboratório para a derivação de queratinócitos e reprogramação subsequente. Em apoio da viabilidade desta estratégia, os nossos dados não publicados indicam que os queratinócitos podem ser isolados com sucesso a partir de cabelo arrancado que foi armazenada a 4 ° C durante até 10 dias.
A metodologia aqui descrita vai permitir a derivação de queratinócitos a partir de cabelo arrancado. Enquanto os queratinócitos podem ser derivados a partir de apenas um único fio de cabelo, a nossa recomendação é coletar pelo menos 5 cabelos anágenos para queratinócitos derivação. Uma limitação deste protocolo é que alguns pêlos pode não prender bem e os queratinócitos podem deixar de crescer. Cabelo mais grosso tende a anexar melhor, enquanto o cabelo fino requer quantidade reduzida de meio de cultura durante chapeamento para evitar flutuante e aprimorar anexo. Uma vez que os queratinócitos são derivadas, é aconselhável para expandir e congelar para baixo stocks utilizando métodos de criopreservação lento de congelamento padrão 16. Reprogramação subsequente de queratinócitos podem ser realizadas etapas seguintes descritos neste protocolo. É importantenotar que a taxa de proliferação das células de partida podem afectar a eficiência reprogramação, com a diminuição da eficiência de reprogramação observado em passagens tardias como as células atingem 25-27 senescência celular. A este respeito, utilize queratinócitos, o mais tardar passagem 6 para experimentos de reprogramação. Além disso, a eficiência de reprogramação pode variar entre queratinócitos diferente do indivíduo.
Estudos recentes sugerem mosaicismo genético generalizada em vários tipos de tecidos somáticos 28, com ~ 30% de fibroblastos da pele relatados como possuindo somática CNVs no genoma 29. Estes CNVs podem ser causadas por erros na replicação do DNA, reparo de DNA ou mobilização transposon. É também possível que a exposição prolongada de UV para a pele podem causar CNVs adicionais em células da epiderme, incluindo fibroblastos e queratinócitos, mas a extensão deste não é bem compreendido. Como CNVs em queratinócitos será transferido durante o processo de reprogramação, é importante para executar cariotipagem rotina ou análise CNV para assegurar que as estabelecidas hiPSCs manter a estabilidade genómica. Em resumo, aqui descrevemos procedimentos para geração de hiPSCs de queratinócitos derivados de cabelo, que poderiam ser usados para a modelagem de doenças e medicina regenerativa.
Divulgações
The authors have no conflict of interest.
Agradecimentos
The authors wish to thank Harene Ranjithakumaran and Stacey Jackson for technical support. This work was supported in part by grants from the National Health and Medical Research Council (R.C.B. Wong, A. Pébay), the University of Melbourne (R.C.B. Wong), Retina Australia (R.C.B. Wong, S.S.C. Hung, A. Pébay) and the Ophthalmic Research Institute of Australia (R.C.B. Wong, S.S.C. Hung, A. Pébay); Australian Research Council Future Fellowship (A. Pébay, FT140100047), Cranbourne Foundation Fellowship (R.C.B. Wong); intramural funding from the National Institutes for Health (R.C.B. Wong, S.S.C. Hung) and operational infrastructure support from the Victorian Government.
Materiais
| Name | Company | Catalog Number | Comments |
| Antibiotic Mix: | |||
| 250 ng/ml Antimycotic amphotericin B | Sigma | A2942-20ml | Antibiotic mix is made up in PBS. |
| 1X Penicillin/Streptomycin | Invitrogen | 15140-122 | |
| PBS (-) | Invitrogen | 14190-144 | |
| Knockout Serum Replacement (KSR) medium: | KSR medium is filtered using Stericup (Millipore, #SCGPU05RE) before use. bFGF is added fresh to the media before use. | ||
| 20% knockout serum replacement (KSR) | Invitrogen | 10828-028 | |
| DMEM/F12 with glutamax | Invitrogen | 10565-042 | |
| 1× MEM non-essential amino acid | Invitrogen | 11140-050 | |
| 0.5× Penicillin/Streptomycin | Invitrogen | 15140-122 | |
| 0.1 mM β-mercaptoethanol | Invitrogen | 21985 | |
| bFGF (10 ng/ml, added fresh) | Millipore | GF003 | |
| Keratinocyte medium: | |||
| EpiLife with 60 µM Calcium | Invitrogen | M-EPI-500-CA | |
| 1× Human keratinocyte growth supplement (HKGS) | Invitrogen | S-001-5 | |
| Fetal Bovine Serum (FBS) medium: | FBS medium is filtered using Stericup (Millipore, #SCGPU05RE) before use. | ||
| 10% fetal bovine serum (FBS) | Invitrogen | 26140079 | |
| DMEM | Invitrogen | 11995-073 | |
| 0.5x Penicillin/Streptomycin | Invitrogen | 15140-122 | |
| 2 mM L-glutamine | Invitrogen | 25030 | |
| 0.25% trypsin-EDTA | Invitrogen | 25200-056 | |
| Extracellular Matrix (ECM): | |||
| Matrigel | Corning | 354234 | Aliquot Matrigel stock and store in -80°C following manufacturer’s instructions. Stock concentration of Matrigel varies slightly from batch to batch (~9mg/ml). We recommend to use 200µl matrigel for coating a 12-well plate (~150µg/well). |
| Coating Matrix Kit | Invitrogen | R-011-K | |
| Plasmids: | Note that pCXLE-eGFP is only used for monitoring transfection efficiency and is not required for reprogramming. | ||
| - pCXLE-eGFP | Addgene | 27082 | |
| - pCXLE-hOct3/4-shP53F | Addgene | 27077 | |
| - pCXLE-hSK | Addgene | 27078 | |
| - pCXLE-hUL | Addgene | 27080 | |
| Transfection reagent Fugene HD | Promega | E231B | |
| Gelatin (from porcine skin) | Sigma | G1890 | Make up 0.1% gelatin in distilled water. Autoclave before use. |
| Reduced Serum medium: OPTI-MEM | Invitrogen | 31985062 | |
| Accutase | Sigma | A6964-100ml | |
| Mouse embryonic fibroblast (MEF) feeder | MEF can be inactivated by mitomycin C treatment or irradiation as described previously 16. | ||
| 26G needle | Terumo | NN2613R | |
| 6-well plate (tissue culture treated) | BD Biosciences | 353046 | |
| 12-well plate (tissue culture treated) | BD Biosciences | 353043 | |
| 10 cm dish (tissue culture treated) | BD Biosciences | 353003 | |
| Dispase | Invitrogen | 17105-041 | Use at 10 mg/ml |
| Collagenase IV | Invitrogen | 17104-019 | Use at 1 mg/ml |
| TRA-160 antibody | Millipore | MAB4360 | Use at 5 µg/ml |
| OCT4 antibody | Santa Cruz | SC-5279 | Use at 5 µg/ml |
| NANOG antibody | R&D Systems | AF1997 | Use at 10 µg/ml |
| MycoAlert Detection kit | Lonza | LT07-418 |
Referências
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126, 663-676 (2006).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131, 861-872 (2007).
- Yu, J., et al. Induced pluripotent stem cell lines derived from human somatic cells. Science. 318, 1917-1920 (2007).
- Okita, K., et al. A more efficient method to generate integration-free human iPS cells. Nat Methods. 8, 409-412 (2011).
- Park, I. H., et al. Reprogramming of human somatic cells to pluripotency with defined factors. Nature. 451, U141-U141 (2008).
- Okita, K., et al. An efficient nonviral method to generate integration-free human-induced pluripotent stem cells from cord blood and peripheral blood cells. Stem Cells. 31, 458-466 (2013).
- Dowey, S. N., Huang, X., Chou, B. K., Ye, Z., Cheng, L. Generation of integration-free human induced pluripotent stem cells from postnatal blood mononuclear cells by plasmid vector expression. Nat Protoc. 7, 2013-2021 (2012).
- Zhou, T., et al. Generation of induced pluripotent stem cells from urine. J Am Soc Nephrol. 22, 1221-1228 (2011).
- Aasen, T., et al. Efficient and rapid generation of induced pluripotent stem cells from human keratinocytes. Nat Biotechnol. 26, 1276-1284 (2008).
- Peters, A., Zambidis, E. Chapter 16. Generation of nonviral integration-free induced pluripotent stem cells from plucked human hair follicles. Human Embryonic and Induced Pluripotent Stem Cells: Lineage-Specific Differentiation Protocols.Springer Protocols Handbooks. Ye, K., Jin, S. , Springer. 203-227 (2012).
- Fuchs, E. Scratching the surface of skin development. Nature. 445, 834-842 (2007).
- Limat, A., Noser, F. K. Serial cultivation of single keratinocytes from the outer root sheath of human scalp hair follicles. J Invest Dermatol. 87, 485-488 (1986).
- Piao, Y., Hung, S. S., Lim, S. Y., Wong, R. C., Ko, M. S. Efficient generation of integration-free human induced pluripotent stem cells from keratinocytes by simple transfection of episomal vectors. Stem Cells Transl Med. 3, 787-791 (2014).
- Higgins, C. A., et al. Reprogramming of human hair follicle dermal papilla cells into induced pluripotent stem cells. J Invest Dermatol. 132, 1725-1727 (2012).
- Muchkaeva, I. A., et al. Generation of iPS Cells from Human Hair Follice Dermal Papilla Cells. Acta naturae. 6, 45-53 (2014).
- Naaldijk, Y., Friedrich-Stockigt, A., Sethe, S., Stolzing, A. Comparison of different cooling rates for fibroblast and keratinocyte cryopreservation. J Tissue Eng Regen. , (2013).
- Sporl, F., et al. Real-time monitoring of membrane cholesterol reveals new insights into epidermal differentiation. J Invest Dermatol. 130, 1268-1278 (2010).
- Conner, D. A., et al. Mouse embryo fibroblast (MEF) feeder cell preparation. Current protocols in molecular biology. Ausubel, F. N., et al. 23, Unit 23 22(2001).
- Pebay, A., et al. Essential roles of sphingosine-1-phosphate and platelet-derived growth factor in the maintenance of human embryonic stem cells. Stem Cells. 23, 1541-1548 (2005).
- Myung, P., Ito, M. Dissecting the bulge in hair regeneration. J Clin Invest. 122, 448-454 (2012).
- Alonso, L., Fuchs, E. The hair cycle. J Cell Sci. 119, 391-393 (2006).
- Robinton, D. A., Daley, G. Q. The promise of induced pluripotent stem cells in research and therapy. Nature. 481, 295-305 (2012).
- Soares, F. A., Sheldon, M., Rao, M., Mummery, C., Vallier, L. International coordination of large-scale human induced pluripotent stem cell initiatives: Wellcome Trust and ISSCR workshops white paper. Stem cell reports. 3, 931-939 (2014).
- McKernan, R., Watt, F. M. What is the point of large-scale collections of human induced pluripotent stem cells. Nat Biotechnol. 31, 875-877 (2013).
- Utikal, J., et al. Immortalization eliminates a roadblock during cellular reprogramming into iPS cells. Nature. 460, U1145-U1112 (2009).
- Xu, Y., et al. Proliferation rate of somatic cells affects reprogramming efficiency. J Biol Chem. 288, 9767-9778 (2013).
- Liu, J., et al. Late passage human fibroblasts induced to pluripotency are capable of directed neuronal differentiation. Cell Transplant. 20, 193-203 (2011).
- Huallachain, M., Karczewski, K. J., Weissman, S. M., Urban, A. E., Snyder, M. P. Extensive genetic variation in somatic human tissues. Proc Natl Acad Sci U S A. 109, 18018-18023 (2012).
- Abyzov, A., et al. Somatic copy number mosaicism in human skin revealed by induced pluripotent stem cells. Nature. 492, 438-442 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados