Method Article
髪の由来ケラチノサイトを使用した統合フリーヒト誘導多能性幹細胞の生成
要約
This manuscript provides a step-by-step procedure for the derivation and maintenance of human keratinocytes from plucked hair and subsequent generation of integration-free human induced pluripotent stem cells (hiPSCs) by episomal vectors.
要約
Recent advances in reprogramming allow us to turn somatic cells into human induced pluripotent stem cells (hiPSCs). Disease modeling using patient-specific hiPSCs allows the study of the underlying mechanism for pathogenesis, also providing a platform for the development of in vitro drug screening and gene therapy to improve treatment options. The promising potential of hiPSCs for regenerative medicine is also evident from the increasing number of publications (>7000) on iPSCs in recent years. Various cell types from distinct lineages have been successfully used for hiPSC generation, including skin fibroblasts, hematopoietic cells and epidermal keratinocytes. While skin biopsies and blood collection are routinely performed in many labs as a source of somatic cells for the generation of hiPSCs, the collection and subsequent derivation of hair keratinocytes are less commonly used. Hair-derived keratinocytes represent a non-invasive approach to obtain cell samples from patients. Here we outline a simple non-invasive method for the derivation of keratinocytes from plucked hair. We also provide instructions for maintenance of keratinocytes and subsequent reprogramming to generate integration-free hiPSC using episomal vectors.
概要
ヒト誘導多能性幹細胞(hiPSCs)の発見は、患者特異的幹細胞1-3の生成のための実行可能な方法を提供し、再生医療の分野に革命をもたらしました。 hiPSCsは正常線維芽細胞4,5を含む種々の体細胞タイプ、造血細胞6,7、尿8およびケラチノサイト9,10からの腎上皮細胞から生成されています。これまで、皮膚線維芽細胞および造血細胞は、患者固有のiPS細胞を生成するための最も一般的に使用される細胞の供給源を表します。おそらく、これは、皮膚生検及び採血ルーチン医療処置および多くの国で確立された患者の血液または皮膚サンプルの大規模なバイオバンクであるという事実によるものです。
侵襲的な抽出方法を必要とする血液細胞および皮膚線維芽細胞とは対照的に、ケラチノサイトはhiPSCの生成のために容易にアクセスできる細胞型を表します。 KeratinocytESは、皮膚の外側表皮バリアを形成し、また、爪及び髪11に見出されるケラチン豊富な上皮細胞です。特に、ケラチノサイトは毛包、内毛根鞘(IRS)細胞(12、 図1)と一緒に毛幹をカバーし、外部の細胞膜の外毛根鞘(ORS)に記載されています。ヘアコレクションは医療関係者の支援を必要としない簡単な手順であるように、患者が収集し、大幅hiPSCの世代のための患者サンプルの収集を容易にするであろう実験室に自分の毛髪サンプルを送信するための機会を提供しています。表皮角化細胞はまた、hiPSCの生成9,13のための出発細胞としてのケラチノサイトを使用する利点に加えて、線維芽細胞と比較してより高い初期化の効率と高速再プログラミング速度を持っています。さらに、hiPSCsはまた毛包内の他の細胞集団を使用して生成することができ、毛包14,15の基部に位置毛乳頭細胞を含みます。
毛由来の細胞を用いてiPS細胞の発生以前の報告は、多くの場合、レトロウイルスまたはレンチウイルスベースの再プログラミング法9,14,15を利用します。しかし、これらのウイルスの方法は、再プログラミング中に外国の導入遺伝子の望ましくないゲノム組込みをご紹介します。対照的に、エピソームベクターの使用は、統合フリー性IPSC 4を生成するために実行可能な、非ウイルス性の再プログラミング方法を示しています。我々は以前に効率的にエピソームベクター13を使用してhiPSCsにケラチノサイトを再プログラムするための簡単な、費用対効果および非ウイルス法を開発しました。ここでは、hiPSCsを生成するためのケラチノサイトおよびその後の再プログラミングの撥髪、拡張やメンテナンスからケラチノサイトの導出を含むケラチノサイト由来hiPSCsの生成のための詳細なプロトコルを提供します。
プロトコル
個人からの人間の毛髪サンプルの収集は、ホスト機関における人間研究倫理委員会の倫理的な承認を必要とし、機関のガイドラインに準拠して行う必要があります。
撥弦楽器髪からケラチノサイトの1の単離
- アイスO / Nで( すなわち、マトリゲル)雪解け細胞外マトリックス(ECM)ソリューションを提供します。
- 予備冷却したピペットチップを使用して、冷却されたDMEM / F12培地12 mlに200μlのECMソリューションを追加します。コート希ECM溶液1 mlの12ウェルプレートの各ウェルに。 37℃でコーティングしたプレートO / Nをインキュベートします。使用前に予め温めておいたDMEM / F12培地でコーティングされたプレートを洗浄します。
- 髪の根元に近い指を置き、1迅速かつ滑らかな動きで髪を摘採して、個々の頭から一次ヒトの毛髪を収集します。各収集髪はそのまま毛包が含まれていることを確認し、毛アンの成長期を決定するためにチェック解剖顕微鏡( 図1)を DER。
- ケラチノサイトを抽出するために、各個体から5-10成長期毛を収集します。プロセスは、ケラチノサイトの正常な誘導を確保するために、できるだけ早く毛を摘み取ら。
注: 図1は、成長サイクルの異なる段階にある毛の形態を示しています。成長期毛をORSとして知られている髪の長さを、周囲の上皮の目に見える外側の層と、成長段階にあります。一方、休止期の毛は休止期にある毛を表し、可視ORSはありませんが、休止期の膨らみとして知られている毛の根元を覆う細胞の明確なボールを持っています。
- ケラチノサイトを抽出するために、各個体から5-10成長期毛を収集します。プロセスは、ケラチノサイトの正常な誘導を確保するために、できるだけ早く毛を摘み取ら。
- 室温で5分間洗浄するために抗生物質ミックスの10ミリリットルを含むペトリ皿に毛髪サンプルを置きます。
- 毛幹の1センチメートル - 滅菌ハサミとピンセットを使用して、無傷の毛包と約0.5とヘア断片を残し、過剰な毛をカット。
- 慎重TRAピンセットを用いてECMコーティングされたプレートの各ウェルに1ヘア断片nsfer。
- 毛髪試料に - (200μL〜100)を1mlピペットを用いて、ノックアウト血清代替(KSR)培地の約3滴を追加します。
注:添付ファイルとそれに続くケラチノサイト成長を可能にするために、プレートの表面に密着して毛髪断片を保管してください。この段階で過度のメディアを追加すると、髪の断片を浮遊させ、成功した髪の添付ファイルの可能性を減少させることができます。 - 5%CO 2で37℃インキュベーターで毛髪サンプルをインキュベートし、毛包は、O / Nを添付することができます。湿った毛髪サンプルを維持するために - (200μL〜100)は、次の日に、静かにKSR媒体の他の3滴を追加します。
- 毛包が正常に取り付けられていることを確認するために毎日の毛髪試料を観察します。一般的に毛包の付着は、1-3日以内に明らかです。細かい毛が高い持っているように太い毛は、通常、微細な毛に比べて取り付けが容易です添付ファイルのプロセスを妨害するフロートする傾向。
- 髪をコーティングしたプレートに取り付けられた後、ウェルにKSR培地500μlを添加します。毛髪サンプルがしっかりと取り付けられていない可能性がありますようにメディアを追加するときに細心の注意を払ってください。この点から、2日おきにメディアを変更します。
注:ケラチノサイト増殖物は3-7日( 図2A-B)後の毛髪断片のORS領域から見えるはずです。ケラチノサイトは、次のセクションで説明するように細胞を継代14日前までに成長することを可能にします。
- 髪をコーティングしたプレートに取り付けられた後、ウェルにKSR培地500μlを添加します。毛髪サンプルがしっかりと取り付けられていない可能性がありますようにメディアを追加するときに細心の注意を払ってください。この点から、2日おきにメディアを変更します。
2.メンテナンスとケラチノサイトの継代
- プレコートコーティングマトリックスキットを使用して、6ウェルプレート。コーティングのマトリックス溶液6.8μlを、続いて、キットの各ウェルに希釈媒体の680μlを添加します。プレート上にコーティングマトリックス溶液の均一な分布を確実にするためにプレートを振ります。
- コーティングされたプレートを室温で30分間インキュベートすることができます。削除しますケラチノサイトのメッキコーティング前Matrixソリューション。
- 37℃で2〜5分間、ウェル当たり0.25%トリプシン500μlので単一細胞懸濁液にケラチノサイトを解離します。血清( 例えば、ウシ胎児血清(FBS)培地)を含む培地500μlにトリプシンを不活性化し、滅菌15mlチューブに集めます。滅菌ピンセットを用いて毛の断片を削除します。
- 血球計数器を用いて採取した細胞の数を決定します。
- 遠心分離機200×gで3分間の細胞。 PBSを繰り返し、遠心分離で細胞を洗浄します。 PBSを吸引し、新鮮なケラチノサイト培地中で細胞ペレットを再懸濁します。
- ダウン4×10 4ケラチノサイトケラチノサイト培地の存在下でECMコーティングされたプレートの1ウェルにプレート。 5%CO 2( 図2C)を用いて37℃のインキュベーター内でケラチノサイトをしてください。文化があるときに、メディア毎日通路の細胞を変更〜80%コンフルエント、WHIchがケラチノサイトの通過数と増殖率に応じて約2-7日かかる場合があります。由来ケラチノサイトは、標準的なスロー凍結凍結保存方法16を使用して十分な凍結ストックを生成するように拡張されるべきです。
注:記載の培養条件は、典型的な敷石状の形態( 図2C)と角化細胞の均一な集団の拡大をサポートしています。時折、いくつかの分化した大規模かつフラットな形態のケラチノサイト、および複製能力を失っているが、文化の中で観察することができます。以前17に記載されているように、ケラチノサイトの特徴付けは、サイトケラチン14に対する抗体を用いて免疫染色することにより行うことができます。確立されたケラチノサイト細胞株はまた、市販のキットを使用して1~3継代後マイコプラズマについて試験されるべきです。
エピソームベクターを使用したケラチノサイトからhiPSCsの3世代
- 6ウェルプレートでプレコート0.1%のゼラチン(2ミリリットル/ウェル)。室温で少なくとも20分間コートにゼラチンを許可します。
- 再プログラミング実験のために、遅くとも通路6よりもケラチノサイトを使用しないで解離は、37℃で2〜5分間、ウェル当たり0.25%トリプシン1mlで単一細胞懸濁液にケラチノサイト。血清( 例えば、FBS培地)を含む培地1mlのトリプシンを不活性化し、15mlチューブに集めます。
- ケラチノサイト培地中で200×gで再懸濁した細胞で3分間遠心分離した細胞。板ゼラチン化プレートO / Nでウェル当たり1×10 5 -1.5×10 5ケラチノサイト。
- 次の日(0日目)に、細胞が50〜60%コンフルエントであることを確認するためにプレートをチェックしてください。
注:ケラチノサイトが、彼らはトランスフェクション後によく成長しない可能性があり〜50%コンフルエント未満である場合。 - 0日目に、2μgの全プラスミドDNAに8μlのトランスフェクション試薬の比を用いて、ケラチノサイトのエピソームリプログラミングベクターのトランスフェクションを行います。
- 4プラスミド(pCXLE-EGFP、pCXLE-hOct3 / 4-shP53F、pCXLE-HSK、pCXLE-HUL)のそれぞれについて、0.5μgのを取り、低血清培地( 例えば、OPTI-MEM)100μlに希釈します。
注:プラスミドpCXLE-EGFPは、ケラチノサイトにおけるトランスフェクション効率をモニターするために使用され、成功した再プログラミングのために必要とされません。 - 希釈したDNAへのトランスフェクション試薬の8μlを添加します。チューブをフリックすることにより混合します。 DNA反応混合物は室温で15分間邪魔されずに休ませることができます。
- 新鮮な培地とケラチノサイト培地を交換してください。
- ゆっくりケラチノサイト培養物にDNA反応ミックスを添加し、4時間、5%CO 2、37℃のインキュベーター中でインキュベートします。
注:それは彼らが低生存トランスフェクション後に示すように、ケラチノサイトに長期のトランスフェクションのO / Nを実行することは推奨されません。 - 4時間後、トランスフェクションした後、新鮮な培地でケラチノサイト培地を交換してください。
- 4プラスミド(pCXLE-EGFP、pCXLE-hOct3 / 4-shP53F、pCXLE-HSK、pCXLE-HUL)のそれぞれについて、0.5μgのを取り、低血清培地( 例えば、OPTI-MEM)100μlに希釈します。
- 1日目(1日後、トランスフェクション)、ケラチノサイト培地を変更し、蛍光顕微鏡下でのeGFP陽性細胞の割合を推定することにより、トランスフェクション効率を確認してください。典型的には> 60〜70%のトランスフェクション効率は、このプロトコルを使用して、初代ケラチノサイトで観察されます。
- ステップ3.5で説明したように2日目に、トランスフェクションを繰り返します。二つの連続したトランスフェクションは、典型的には> 90%のトランスフェクション効率を達成します。ケラチノサイトの培養は、通常、第二のトランスフェクションの終了までにコンフルエンスに達しました。
- 各再プログラミング反応のために、マウス胚性線維芽細胞(MEF)フィーダーの10cmの皿を準備します。以前に18を説明したように、有糸分裂不活性化MEFフィーダーを準備します。
- 少なくとも20分間、0.1%ゼラチンを5 mlのプレコート10cmディッシュ。 FBS培地中で10cmディッシュあたりプレート4×10 6有糸分裂的に不活性化MEF。細胞は、5%CO 2で37℃のインキュベーターでO / Nを解決し、添付することができます。
- 3日目に、HARステップ3.2および3.3に記載されているように、0.25%トリプシンでケラチノサイトを権利が確定します。 KSR培地中のケラチノサイトを再懸濁し、KSR培地で10センチメートルMEFフィーダー皿に6ウェルプレートの1ウェルからケラチノサイトの90%をプレート。
- 以降4日目から、毎日KSR培地を変更します。
- あるいは、18日目の後に、一日おきに培地を交換してください。
注: - 21ヒト胚性幹細胞(ヒトES細胞)の似ている定義された境界を有するhiPSCコロニーは14日目から出現する一方、非再プログラムケラチノサイトは、増殖しなくなります。
- あるいは、18日目の後に、一日おきに培地を交換してください。
- 以降21日目からの手動切開によりhiPSCコロニーを分離します。密接に一緒にクラスタ化されたhiPSCコロニーを避けるだけ明らかに他のものから分離されたhiPSCコロニーを選択します。
注:hiPSCコロニーは早く取り出すことができますが、定義された境界を有するコロニーは、小さなコロニーサイズ指定された以前の時点では明らかではないかもしれません。再プログラミング効率はデフの間で異なる場合がありますerent患者の角化細胞、およびそのような継代数またはケラチノサイトの増殖速度などの他の要因によって影響されます。- hiPSCコロニーのマニュアル解剖について、解剖顕微鏡下でhiPSCコロニーを切断するために26G針を使用しています。長さが600ミクロン - 約300小片にhiPSCコロニーをカットします。 hiPSCsのクローン株を確立するために、新しいMEFフィーダープレート(2.5×10 4 MEF / cm 2)を1にhiPSCコロニーから作品を転送します。最初に、文化は12ウェルプレートまたは器官培養皿の1つのウェル内の各hiPSCクローン株は、その後、6ウェルプレートフォーマットに展開します。
- MEFフィーダー上KSR培地中hiPSCsの確立クローン系を維持します。 hiPSCコロニーと80%の密集度、直径〜1.5ミリメートル、製造者の指示に従って、標準的な酵素継代方法(のAccutase、ディスパーゼまたはコラゲナーゼIV)を使用して、通路hiPSCs - 文化たら70に到達します。
- 確立されたhiPSCラインを特徴づけますSは多能性と、in vitroおよび / またはin vivo 13,19 で三胚葉の細胞の代表に分化する能力を確認することができます。また、日常的にテストは、それらが病原体を含まないであることを確認するために、市販のキットを用いて、マイコプラズマのためのhiPSCラインを確立しました。日常核型分析またはアレイベースのコピー数変動(CNV)解析によりhiPSCラインのゲノムの安定性を監視します。
結果
成長期(成長期)、退行期(退行期)および休止期(休止期)20,21:髪は成長サイクルの3つの異なる段階を通過します。成長期毛包上皮の複数の層を含んでいます。これらの層は、ORS、IRSと毛幹( 図1)を含みます。成長期の毛は最終的ORSと毛幹分化の終了のアポトーシスによってマークされて退行期への移行受けます。最後に、アポトーシスが停止し、休止期の毛包が休止期特性20,21の膨らみと静止なり休止期、退行期の毛に遷移。
図1は、休止期の毛および成長期毛の形態を示しています。当社は通常、ケラチノサイト誘導のため成長期毛を利用します。このプロトコルに続いて、ケラチノサイト増殖物は早くも3日間ヘアアタッチメント( 図2A)の後に観察することができるとpしていきますroliferate( 図2B)。我々の経験では、いくつかの成長期毛は、ケラチノサイト成長を観察するために添付したり、失敗に失敗することがあります。成功したケラチノサイトの分離を確実にするために、各個体からの10成長期毛 - このように、少なくとも5を収集します。続いて、ケラチノサイトは新しいプレートに継代し、複数の通路( 図2C)維持することができます。これは、KSR培地でマトリゲルと比較して、セクション2に記載されているようにケラチノサイト培地でコーティングマトリックスのケラチノサイトのより良い成長があることに留意することが重要です。
拡張に続いて、ケラチノサイトを、再プログラミングの32日後に部3、図3Aに典型的なケラチノサイト由来のhiPSCコロニーを示して説明したようにhiPSCsを生成するように再プログラムすることができます。これは、hiPSCコロニーの中心にいくつかの分化を観察することが一般的です。一度手動で選んだ、派生hiPSCsは、通常、細胞質比および結合した定義されたコロニーの高い核を表示します進( 図3B)。そのような多能性マーカーOCT4、NANOG、およびTRA-160( 図3C-E)の表現として、先に説明したように13,19 hiPSCsの確立された細胞株は、その後、多能性のために特徴付けることができます。
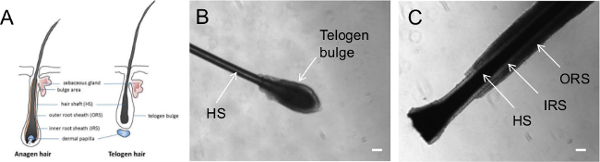
図1.異なる成長段階で摘み取ら毛の代表的な画像。(A)図は、成長期または休止期相で毛を示します。 (B)休止期および(C)成長期に撥弦楽器髪を示す位相差画像。 HS =毛幹。 IRS =内毛根鞘。 ORS =外毛根鞘。スケールバー=100μmである。 この図の拡大版を表示するには、こちらをクリックしてください。

摘ま髪の図毛由来ケラチノサイトの2代表的な画像。位相コントラスト画像は、(A)3日(B)10日間ダウンメッキ。白い矢印は摘み取ら毛髪からケラチノサイトの増殖をマーク。継代後の典型的な石畳の形態を有する第3日ケラチノサイト培養物の(C)位相コントラスト画像。スケールバー=100μmである。 この図の拡大版を表示するには、こちらをクリックしてください。

ケラチノサイト由来hiPSCsの図3.代表的な画像。ケラチノサイト由来のhiPSCコを示す32日目のリプログラミング文化の(A)位相コントラスト画像lony。 (B)は、手動でのhESCと同様の形態を有するケラチノサイト由来hiPSCsを選択します。多能性マーカー(C)NANOGとケラチノサイト由来hiPSCsにおける(D)OCT4および(E)TRA-160とhiPSCsの免疫染色。スケールバー=100μmである。 この図の拡大版を表示するには、こちらをクリックしてください。
ディスカッション
患者特有のhiPSCsの生成は、in vitroでの病気の細胞型において病因を研究するためのユニークなアプローチを提供し、また、疾患の表現型を救出することができる新規分子を同定するための薬物スクリーニングのためのプラットフォームを提供します。 hiPSCsを使用して、この疾患のモデリングアプローチは、QT延長症候群、ハンチントン病、パーキンソン病および筋萎縮性側索硬化症22を含む様々な疾患のための有望な結果をもたらしました。いくつかの取り組みはすでにアメリカ、ヨーロッパ、オーストラリア、中国、韓国と日本23,24でコンソーシアムを含む患者固有hiPSCsの大規模なライブラリーを確立するために進行中です。
ここで、毛髪由来ケラチノサイトからhiPSCsを確立するためのプロトコルは、疾患特異的hiPSCsの大規模ライブラリーの構築を容易にし、高速追跡する可能性を有する、記載されています。このプロトコルは、2つの利点があります。まず、エピソームをこのプロトコルで利用されるシステムは、6つの再プログラミング因子のカクテルを使用して統合フリーhiPSCsを生成する(OCT4、SOX2、KLF4、L-MYC、LIN28、p53のためのshRNA)比較的高い効率4時。レトロウイルスまたはレンチウイルス媒介性の再プログラミングの方法と比較して、エピソームベクターの使用は、再プログラミング中に外国の導入遺伝子の望ましくないゲノム統合を避けることができます。、したがって、多くの取り組みは、次のような大規模なhiPSCライブラリの確立のための統合フリーリプログラミング法の使用を好みます統合的再プログラミング方法23以上のエピソームベクター、センダイウイルスまたはmRNA、。
第二に、髪は簡単にアクセス可能であり、侵襲的処置の使用または医療従事者の出席なしに患者自身によって収穫することができます。これは、ケラチノサイト誘導およびその後の再プログラミングのための実験室に、独自の毛髪サンプルで収集し、メールに異なる地域からの患者のためのユニークな機会を提供します。この戦略の実現可能性を支持して、我々の未発表データは、ケラチノサイトが正常に最大10日間、4℃で保存した撥毛髪から単離することができることを示しています。
ここで説明する方法は、摘み取ら毛髪からケラチノサイトの導出が可能になります。ケラチノサイトは単に1つの毛に由来することができますが、私たちの推薦は、ケラチノサイトの誘導のために少なくとも5成長期の毛を収集することです。このプロトコルの1つの制限は、いくつかの毛がうまく取り付けない場合があり、ケラチノサイトが成長しない可能性があることです。太い髪が細い髪が添付ファイルをフローティング回避し、強化するためにめっき中の培地の低減量を必要としながら、より良い添付する傾向があります。ケラチノサイトが誘導されると、それは標準的なスロー凍結凍結保存方法16を使用して株式を拡張し、ダウンフリーズすることをお勧めします。ケラチノサイトのその後の再プログラミングは、このプロトコルで説明する次の手順を実行することができます。それはすることが重要です細胞は、細胞の老化25-27に達するように後半の通路で観察された減少初期化の効率と、出発細胞の増殖率は初期化の効率に影響を与える可能性があることに注意してください。この点で、遅くとも再プログラミング実験のための通路6よりもケラチノサイトを使用します。また、再プログラミング効率は、異なる個々のケラチノサイトの間で変化してもよいです。
最近の研究は、ゲノム中に29体のCNVを有することが報告された皮膚線維芽細胞の約30%の、体細胞組織28の複数種類の広範な遺伝的モザイクを示唆しています。これらのCNVは、DNA複製、DNA修復又はトランスポゾン動員の誤差によって引き起こされる可能性があります。これは、皮膚への長期UV露光は、線維芽細胞およびケラチノサイトを含む表皮細胞における追加のCNVを引き起こす可能性があることも可能であるが、この程度は十分に理解されていません。ケラチノサイト中のCNVが再プログラミングプロセス中に持ち越されるように、イムです確立hiPSCsはゲノム安定性を維持することを確実にするために、ルーチン核型分析またはCNV解析を実行するためのportant。要約すると、ここでは、病気のモデリングと再生医療のために使用することができる毛髪由来のケラチノサイトからhiPSCsを生成するための手順を説明しました。
開示事項
The authors have no conflict of interest.
謝辞
The authors wish to thank Harene Ranjithakumaran and Stacey Jackson for technical support. This work was supported in part by grants from the National Health and Medical Research Council (R.C.B. Wong, A. Pébay), the University of Melbourne (R.C.B. Wong), Retina Australia (R.C.B. Wong, S.S.C. Hung, A. Pébay) and the Ophthalmic Research Institute of Australia (R.C.B. Wong, S.S.C. Hung, A. Pébay); Australian Research Council Future Fellowship (A. Pébay, FT140100047), Cranbourne Foundation Fellowship (R.C.B. Wong); intramural funding from the National Institutes for Health (R.C.B. Wong, S.S.C. Hung) and operational infrastructure support from the Victorian Government.
資料
| Name | Company | Catalog Number | Comments |
| Antibiotic Mix: | |||
| 250 ng/ml Antimycotic amphotericin B | Sigma | A2942-20ml | Antibiotic mix is made up in PBS. |
| 1X Penicillin/Streptomycin | Invitrogen | 15140-122 | |
| PBS (-) | Invitrogen | 14190-144 | |
| Knockout Serum Replacement (KSR) medium: | KSR medium is filtered using Stericup (Millipore, #SCGPU05RE) before use. bFGF is added fresh to the media before use. | ||
| 20% knockout serum replacement (KSR) | Invitrogen | 10828-028 | |
| DMEM/F12 with glutamax | Invitrogen | 10565-042 | |
| 1× MEM non-essential amino acid | Invitrogen | 11140-050 | |
| 0.5× Penicillin/Streptomycin | Invitrogen | 15140-122 | |
| 0.1 mM β-mercaptoethanol | Invitrogen | 21985 | |
| bFGF (10 ng/ml, added fresh) | Millipore | GF003 | |
| Keratinocyte medium: | |||
| EpiLife with 60 µM Calcium | Invitrogen | M-EPI-500-CA | |
| 1× Human keratinocyte growth supplement (HKGS) | Invitrogen | S-001-5 | |
| Fetal Bovine Serum (FBS) medium: | FBS medium is filtered using Stericup (Millipore, #SCGPU05RE) before use. | ||
| 10% fetal bovine serum (FBS) | Invitrogen | 26140079 | |
| DMEM | Invitrogen | 11995-073 | |
| 0.5x Penicillin/Streptomycin | Invitrogen | 15140-122 | |
| 2 mM L-glutamine | Invitrogen | 25030 | |
| 0.25% trypsin-EDTA | Invitrogen | 25200-056 | |
| Extracellular Matrix (ECM): | |||
| Matrigel | Corning | 354234 | Aliquot Matrigel stock and store in -80°C following manufacturer’s instructions. Stock concentration of Matrigel varies slightly from batch to batch (~9mg/ml). We recommend to use 200µl matrigel for coating a 12-well plate (~150µg/well). |
| Coating Matrix Kit | Invitrogen | R-011-K | |
| Plasmids: | Note that pCXLE-eGFP is only used for monitoring transfection efficiency and is not required for reprogramming. | ||
| - pCXLE-eGFP | Addgene | 27082 | |
| - pCXLE-hOct3/4-shP53F | Addgene | 27077 | |
| - pCXLE-hSK | Addgene | 27078 | |
| - pCXLE-hUL | Addgene | 27080 | |
| Transfection reagent Fugene HD | Promega | E231B | |
| Gelatin (from porcine skin) | Sigma | G1890 | Make up 0.1% gelatin in distilled water. Autoclave before use. |
| Reduced Serum medium: OPTI-MEM | Invitrogen | 31985062 | |
| Accutase | Sigma | A6964-100ml | |
| Mouse embryonic fibroblast (MEF) feeder | MEF can be inactivated by mitomycin C treatment or irradiation as described previously 16. | ||
| 26G needle | Terumo | NN2613R | |
| 6-well plate (tissue culture treated) | BD Biosciences | 353046 | |
| 12-well plate (tissue culture treated) | BD Biosciences | 353043 | |
| 10 cm dish (tissue culture treated) | BD Biosciences | 353003 | |
| Dispase | Invitrogen | 17105-041 | Use at 10 mg/ml |
| Collagenase IV | Invitrogen | 17104-019 | Use at 1 mg/ml |
| TRA-160 antibody | Millipore | MAB4360 | Use at 5 µg/ml |
| OCT4 antibody | Santa Cruz | SC-5279 | Use at 5 µg/ml |
| NANOG antibody | R&D Systems | AF1997 | Use at 10 µg/ml |
| MycoAlert Detection kit | Lonza | LT07-418 |
参考文献
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126, 663-676 (2006).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131, 861-872 (2007).
- Yu, J., et al. Induced pluripotent stem cell lines derived from human somatic cells. Science. 318, 1917-1920 (2007).
- Okita, K., et al. A more efficient method to generate integration-free human iPS cells. Nat Methods. 8, 409-412 (2011).
- Park, I. H., et al. Reprogramming of human somatic cells to pluripotency with defined factors. Nature. 451, U141-U141 (2008).
- Okita, K., et al. An efficient nonviral method to generate integration-free human-induced pluripotent stem cells from cord blood and peripheral blood cells. Stem Cells. 31, 458-466 (2013).
- Dowey, S. N., Huang, X., Chou, B. K., Ye, Z., Cheng, L. Generation of integration-free human induced pluripotent stem cells from postnatal blood mononuclear cells by plasmid vector expression. Nat Protoc. 7, 2013-2021 (2012).
- Zhou, T., et al. Generation of induced pluripotent stem cells from urine. J Am Soc Nephrol. 22, 1221-1228 (2011).
- Aasen, T., et al. Efficient and rapid generation of induced pluripotent stem cells from human keratinocytes. Nat Biotechnol. 26, 1276-1284 (2008).
- Peters, A., Zambidis, E. Chapter 16. Generation of nonviral integration-free induced pluripotent stem cells from plucked human hair follicles. Human Embryonic and Induced Pluripotent Stem Cells: Lineage-Specific Differentiation Protocols.Springer Protocols Handbooks. Ye, K., Jin, S. , Springer. 203-227 (2012).
- Fuchs, E. Scratching the surface of skin development. Nature. 445, 834-842 (2007).
- Limat, A., Noser, F. K. Serial cultivation of single keratinocytes from the outer root sheath of human scalp hair follicles. J Invest Dermatol. 87, 485-488 (1986).
- Piao, Y., Hung, S. S., Lim, S. Y., Wong, R. C., Ko, M. S. Efficient generation of integration-free human induced pluripotent stem cells from keratinocytes by simple transfection of episomal vectors. Stem Cells Transl Med. 3, 787-791 (2014).
- Higgins, C. A., et al. Reprogramming of human hair follicle dermal papilla cells into induced pluripotent stem cells. J Invest Dermatol. 132, 1725-1727 (2012).
- Muchkaeva, I. A., et al. Generation of iPS Cells from Human Hair Follice Dermal Papilla Cells. Acta naturae. 6, 45-53 (2014).
- Naaldijk, Y., Friedrich-Stockigt, A., Sethe, S., Stolzing, A. Comparison of different cooling rates for fibroblast and keratinocyte cryopreservation. J Tissue Eng Regen. , (2013).
- Sporl, F., et al. Real-time monitoring of membrane cholesterol reveals new insights into epidermal differentiation. J Invest Dermatol. 130, 1268-1278 (2010).
- Conner, D. A., et al. Mouse embryo fibroblast (MEF) feeder cell preparation. Current protocols in molecular biology. Ausubel, F. N., et al. 23, Unit 23 22(2001).
- Pebay, A., et al. Essential roles of sphingosine-1-phosphate and platelet-derived growth factor in the maintenance of human embryonic stem cells. Stem Cells. 23, 1541-1548 (2005).
- Myung, P., Ito, M. Dissecting the bulge in hair regeneration. J Clin Invest. 122, 448-454 (2012).
- Alonso, L., Fuchs, E. The hair cycle. J Cell Sci. 119, 391-393 (2006).
- Robinton, D. A., Daley, G. Q. The promise of induced pluripotent stem cells in research and therapy. Nature. 481, 295-305 (2012).
- Soares, F. A., Sheldon, M., Rao, M., Mummery, C., Vallier, L. International coordination of large-scale human induced pluripotent stem cell initiatives: Wellcome Trust and ISSCR workshops white paper. Stem cell reports. 3, 931-939 (2014).
- McKernan, R., Watt, F. M. What is the point of large-scale collections of human induced pluripotent stem cells. Nat Biotechnol. 31, 875-877 (2013).
- Utikal, J., et al. Immortalization eliminates a roadblock during cellular reprogramming into iPS cells. Nature. 460, U1145-U1112 (2009).
- Xu, Y., et al. Proliferation rate of somatic cells affects reprogramming efficiency. J Biol Chem. 288, 9767-9778 (2013).
- Liu, J., et al. Late passage human fibroblasts induced to pluripotency are capable of directed neuronal differentiation. Cell Transplant. 20, 193-203 (2011).
- Huallachain, M., Karczewski, K. J., Weissman, S. M., Urban, A. E., Snyder, M. P. Extensive genetic variation in somatic human tissues. Proc Natl Acad Sci U S A. 109, 18018-18023 (2012).
- Abyzov, A., et al. Somatic copy number mosaicism in human skin revealed by induced pluripotent stem cells. Nature. 492, 438-442 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved