Method Article
דור של תאי גזע האינטגרציה נטול האדם המושרה pluripotent שימוש קרטינוציטים נגזר שיער
In This Article
Summary
This manuscript provides a step-by-step procedure for the derivation and maintenance of human keratinocytes from plucked hair and subsequent generation of integration-free human induced pluripotent stem cells (hiPSCs) by episomal vectors.
Abstract
Recent advances in reprogramming allow us to turn somatic cells into human induced pluripotent stem cells (hiPSCs). Disease modeling using patient-specific hiPSCs allows the study of the underlying mechanism for pathogenesis, also providing a platform for the development of in vitro drug screening and gene therapy to improve treatment options. The promising potential of hiPSCs for regenerative medicine is also evident from the increasing number of publications (>7000) on iPSCs in recent years. Various cell types from distinct lineages have been successfully used for hiPSC generation, including skin fibroblasts, hematopoietic cells and epidermal keratinocytes. While skin biopsies and blood collection are routinely performed in many labs as a source of somatic cells for the generation of hiPSCs, the collection and subsequent derivation of hair keratinocytes are less commonly used. Hair-derived keratinocytes represent a non-invasive approach to obtain cell samples from patients. Here we outline a simple non-invasive method for the derivation of keratinocytes from plucked hair. We also provide instructions for maintenance of keratinocytes and subsequent reprogramming to generate integration-free hiPSC using episomal vectors.
Introduction
הגילוי של תאי גזע אנושיים pluripotent מושרה (hiPSCs) חולל מהפכה בתחום של רפואת רגנרטיבית, מתן שיטה ריאלי עבור דור של תאי גזע מטופל ספציפי 1-3. hiPSCs כבר נוצר בהצלחה מסוגים שונים סומטי תא, כולל fibroblasts 4,5, תאי hematopoietic 6,7, תאי האפיתל כליות מהשתן 8 וקרטינוציטים 9,10. עד כה, fibroblasts עור ותאי hematopoietic מייצגים מקורות תא הנפוצים ביותר ליצירת iPSCs מטופל ספציפי. ניתן לטעון, וזאת בשל העובדה כי ביופסיות עור ואיסוף דם הם הליכים רפואיים שיגרתי וbiobanks הגדול של דגימות דם או עור מטופל הוקמו במדינות רבות.
בניגוד לתאי דם ופיברובלסטים עור הדורשים שיטות מיצוי פולשנית, קרטינוציטים מייצגים סוג תא נגיש לדור hiPSC. Keratinocytes הם תאי אפיתל קרטין עשיר היוצרים את מחסום האפידרמיס החיצוני של העור ונמצאים גם בציפורניים ושיער 11. בפרט, ניתן למצוא קרטינוציטים על המעטפת החיצונית השורש (ORS) של זקיקי שיער, שכבה חיצונית סלולרית שכיסתה את השערה יחד עם נדן השורש הפנימי (IRS) תאים (12, איור 1). כאוסף שיער הוא הליך פשוט שאינו דורש הסיוע של צוות רפואי, הוא מספק הזדמנות לחולים כדי לאסוף ולשלוח דגימות השיער שלהם למעבדות, אשר תאפשר איסוף דגימות מטופל לדור hiPSC מאוד. קרטינוציטים אפידרמיס יש גם יעילות גבוהה יותר תכנות מחדש וקינטיקה תכנות מחדש מהר יותר בהשוואה לfibroblasts, מוסיף ליתרונות של שימוש בקרטינוציטים כתאים מתחילים לדור hiPSC 9,13. יתר על כן, hiPSCs יכול גם להיות שנוצר באמצעות אוכלוסיות תאים אחרות בתוך זקיק השיער,כולל תאי עורי papilla ממוקמים בבסיס 14,15 זקיק שיער.
דיווחים קודמים של דור iPSC באמצעות תאים שמקורם בשיער לעתים קרובות להשתמש בשיטות תכנות מחדש retroviral או מבוסס lentiviral 9,14,15. עם זאת, שיטות נגיפיות אלה להציג את שילוב רצוי הגנומי של transgenes הזר בתכנות מחדש. לשם השוואה, השימוש בוקטורי episomal מייצג שיטה אפשרית, שאינה נגיפית תכנות מחדש כדי ליצור iPSCs ללא אינטגרציה 4. פיתחנו בעבר שיטה לתכנת מחדש keratinocyte לhiPSCs באמצעות וקטורי episomal 13 ביעילות פשוטה, חסכונית ושאינו נגיפית. כאן אנו מספקים פרוטוקול מפורט לדור של hiPSCs נגזר keratinocyte, כוללים הגזירה של קרטינוציטים מקטפו שיער, הרחבה ותחזוקה של קרטינוציטים ותכנות מחדש לאחר ליצור hiPSCs.
Protocol
האוסף של מדגם שיער אדם מאנשים דורש אישור אתי על ידי ועדת האתיקה מחקר האנושית במוסדות המארח וצריך להיעשות בהתאם להנחיות מוסדיות.
1. בידוד של קרטינוציטים משיער פריטה
- תאי מטריקס הפשרת פתרון (ECM) (כלומר, Matrigel) בO קרח / N.
- בעזרת הטיפים פיפטה מראש צונן, להוסיף 200 פתרון ECM μl 12 מיליליטר של מדיום DMEM / F12 המצונן. מעיל צלחת 12-היטב עם 1 מיליליטר של תמיסת ECM מדוללת לכל אחד. דגירה O הצלחת המצופה / N על 37 מעלות צלזיוס. לשטוף את הצלחת המצופה עם DMEM בינוני F12 / מראש חימם לפני השימוש.
- לאסוף את שיער אנושי ראשוני מראשו של הפרט על ידי הצבת את אצבעות קרובות לשורש השיער ומריטת השיער בתנועה אחת מהירה וחלקה. בדוק כדי לוודא שכל שיער שנאסף מכיל זקיקי שיער ללא פגע ולקבוע את שלב הצמיחה של האו"ם השיערder מיקרוסקופ לנתח (איור 1).
- לאסוף 5-10 שערות anagen מכל אדם כדי לחלץ קרטינוציטים. תהליך קטף שערות בהקדם האפשרי על מנת להבטיח גזירה מוצלחת של קרטינוציטים.
הערה: איור 1 מדגים את המורפולוגיה של שערות בשלבים שונים של מחזור הצמיחה. שיער אנגן הוא בשלב הצמיחה, עם שכבה חיצונית גלויה של האפיתל המקיף את אורכו של השיער, הידוע בשם ORS. מצד השני, שיער telogen מייצג שיער בשלב המנוחה ואין לי ORS גלוי, אך יש לו כדור ברור של תאים המכסים את השורש של השיער, הידוע בשם בליטת telogen.
- לאסוף 5-10 שערות anagen מכל אדם כדי לחלץ קרטינוציטים. תהליך קטף שערות בהקדם האפשרי על מנת להבטיח גזירה מוצלחת של קרטינוציטים.
- מניחים את דגימות שיער לתוך צלחת פטרי המכילה 10 מיליליטר של האנטיביוטיקה מיקס לשטוף במשך 5 דקות על RT.
- בעזרת מספריים ומלקחיים מעוקרים, מנותק שערה מוגזמת, עוזב בר שיער עם זקיק שיער ללא פגע וסביב 0.5-1 סנטימטר של שערה.
- טרה בזהירותnsfer בר שיער 1 לבאר כל צלחת ECM מצופה באמצעות מלקחיים.
- בעזרת פיפטה 1 מיליליטר, להוסיף טיפות כ 3 של החלפת נוק סרום בינוני (KSR) (~ 100 - 200 μl) על דגימות השיער.
הערה: שמור את שברי השיער בקשר הדוק אל פני השטח הצלחת כדי לאפשר התקשרות ותולדת keratinocyte שלאחר מכן. הוספת תקשורת מוגזמת בשלב זה רשאי גורם ברי השיער לצוף ומקטין את הסיכוי של קובץ מצורף שיער מוצלח. - דגירה דגימות השיער בחממה 37 ° C עם 5% CO 2 ולאפשר את זקיקי השיער לצרף O / N. ביום הבא, בעדינות להוסיף 3 טיפות נוספות של מדיום KSR (~ 100 - 200 μl) כדי לשמור על דגימות שיער לחים.
- שים לב לדגימות השיער מדי יום כדי לוודא שזקיקי השיער צירפו בהצלחה. בדרך כלל חיבור של זקיקי שיער הוא לכאורה בתוך 1-3 ימים. שערות עבות הן בדרך כלל קלים יותר לצרף לעומת שערות, כמו שערות עדינות יש לי גבוהה יותרנטייה לצוף אשר מעכבת את תהליך העיקול.
- ברגע שהשיער שצורף לצלחת המצופה, להוסיף 500 μl של מדיום KSR לטוב. קח טיפול נוסף בעת הוספה בינוני כדגימות שיער אולי לא מחוברת היטב. מנקודה זו, לשנות תקשורת כל 2 ימים.
הערה: בצמחים keratinocyte צריכים להיות גלויים מאזור ORS של בר השיער לאחר 3-7 ימים (איור 2 א-ב). לאפשר קרטינוציטים לגדול עד 14 ימים לפני passaging התאים כפי שתואר בסעיף הבא.
- ברגע שהשיער שצורף לצלחת המצופה, להוסיף 500 μl של מדיום KSR לטוב. קח טיפול נוסף בעת הוספה בינוני כדגימות שיער אולי לא מחוברת היטב. מנקודה זו, לשנות תקשורת כל 2 ימים.
2. תחזוקה וPassaging של קרטינוציטים
- טרום מעיל 6-גם צלחת באמצעות ערכת הציפוי מטריקס. להוסיף 680 μl של מדיום הדילול מהערכה היטב כל אחד, ואחריו 6.8 μl של ציפוי מטריקס פתרון. לנער את הצלחת על מנת להבטיח פיזור אחיד של פתרון מטריקס הציפוי על הצלחת.
- לאפשר את הצלחת המצופה לדגירה במשך 30 דקות ב RT. הסרפתרון הציפוי מטריקס לפני הציפוי של קרטינוציטים.
- לנתק קרטינוציטים להשעית תא בודד עם 500 μl של טריפסין 0.25% בכל טוב במשך 2-5 דקות על 37 מעלות צלזיוס. להשבית טריפסין עם 500 μl של סרום בינוני המכיל (למשל, שור עוברי סרום בינוני (FBS)) ולאסוף לתוך צינור 15 מיליליטר סטרילי. הסר את בר השיער באמצעות מלקחיים מעוקרים.
- לקבוע את מספר התאים שנקטפו באמצעות haemocytometer.
- צנטריפוגה התאים 3 דקות ב 200 x גרם. לשטוף את התאים עם PBS וצנטריפוגה החוזרת. לשאוב PBS וresuspend התא גלולה במדיום keratinocyte טרי.
- צלחת 4 × 10 4 קרטינוציטים לטובים אחד של צלחת ECM מצופה בנוכחות בינונית keratinocyte. שמור את קרטינוציטים בחממה 37 ° C עם 5% CO 2 (איור 2 ג). שינוי תקשורת בכל יום ותאי מעבר כאשר התרבות היא ~ 80% ומחוברות, WHIפרק יכול לקחת כ 2-7 ימים בהתאם לשיעור מספר המעבר והתפשטות של קרטינוציטים. יש להרחיב קרטינוציטים נגזרים ליצור מניות קפוא מספיק בשיטות הקפאת הקפאה איטיות סטנדרטית 16.
הערה: תנאי התרבות המתוארים לתמוך בהתרחבות של אוכלוסייה הומוגנית של קרטינוציטים עם מורפולוגיה מרוצפת טיפוסית (איור 2 ג). מדי פעם, כמה קרטינוציטים מובחנים, עם מורפולוגיה גדולה ושטוחה ואיבדתי את פוטנציאל replicative, אפשר לראות בתרבות. אפיון של קרטינוציטים יכול להתבצע על ידי immunostaining נוגדנים נגד שימוש cytokeratin 14 כפי שתואר קודם לכן 17. שורות תאי keratinocyte הוקמו גם צריכה להיבדק לmycoplasma אחרי 1-3 מעברים באמצעות ערכה זמינה מסחרי.
3. דור של hiPSCs מקרטינוציטים שימוש Episomal וקטורים
- טרום מעיל 6-גם צלחת עםג'לטין 0.1% (2 מיליליטר / טוב). לאפשר ג'לטין למעייל לפחות 20 דקות ב RT.
- לצורך ניסוי תכנות מחדש, קרטינוציטים שימוש לא יאוחרו מהחלוף 6. לנתק קרטינוציטים להשעית תא בודד עם 1 מיליליטר של 0.25% לטריפסין היטב במשך 2-5 דקות על 37 מעלות צלזיוס. להשבית טריפסין עם 1 מיליליטר של סרום המכיל תקשורת (למשל, תקשורת FBS) ולאסוף בצינור 15 מיליליטר.
- תאי צנטריפוגה במשך 3 דקות ב 200 תאי XG וגלולים במדיום keratinocyte. צלחת 1 × 10 × 10 5 -1.5 5 קרטינוציטים בכל טוב בצלחת O gelatinized / N.
- ביום הבא (יום 0), לבדוק את הצלחת כדי להבטיח תאים ומחוברות 50-60%.
הערה: אם קרטינוציטים הם פחות מ ~ 50% ומחוברות הם עלולים לא לגדול גם לאחר transfection. - ביום 0, לבצע transfection של וקטורי תכנות מחדש episomal על קרטינוציטים, באמצעות יחס של מגיב transfection 8 μl 2 מיקרוגרם הכולל פלסמיד דנ"א.
- קח 0.5 מיקרוגרם לכל אחד 4 פלסמידים (pCXLE-eGFP, pCXLE-hOct3 / 4-shP53F, pCXLE-HSK, pCXLE-גבעת הרמה) ולדלל בסרום של מדיום מופחת (למשל, OPTI-MEM) 100 μl.
הערה: פלסמיד pCXLE-eGFP משמש כדי לפקח יעיל transfection בקרטינוציטים ואינו נדרש לתכנות מחדש מוצלח. - הוסף 8 μl של מגיב transfection ל- DNA בדילול מלא. מערבבים על ידי מצליף את הצינורית. לאפשר את תערובת תגובת DNA לנוח ללא הפרעה על RT במשך 15 דקות.
- החלף את מדיום keratinocyte עם מדיום חדש.
- בעדינות להוסיף את תערובת תגובת DNA לתרבות keratinocyte דגירה בחממה 37 ° C עם 5% CO 2 למשך 4 שעות.
הערה: לא מומלץ לבצע O transfection הממושך / N בקרטינוציטים כפי שהם מפגינים הישרדות נמוכה לאחר transfection. - לאחר לאחר transfection 4 שעות, להחליף בינוני keratinocyte עם מדיום חדש.
- קח 0.5 מיקרוגרם לכל אחד 4 פלסמידים (pCXLE-eGFP, pCXLE-hOct3 / 4-shP53F, pCXLE-HSK, pCXLE-גבעת הרמה) ולדלל בסרום של מדיום מופחת (למשל, OPTI-MEM) 100 μl.
- ביום 1 (יום 1 פוסט-טראנסfection), לשנות את מדיום keratinocyte ולבדוק יעילות transfection על ידי אומדן אחוז התאים חיוביים eGFP תחת מיקרוסקופ פלואורסצנטי. בדרך כלל> 60-70% יעילות transfection הוא ציין לקרטינוציטים ראשוניים תוך שימוש בפרוטוקול זה.
- ביום 2, חוזר transfection כמתואר בשלב 3.5. שני transfections רצוף בדרך כלל היה להשיג> 90% יעילות transfection. תרבות keratinocyte בדרך כלל מגיעה למפגש בסוף transfection השני.
- הכן צלחת 10 סנטימטרים של מזין עכבר פיברובלסטים עובריים (MEF) עבור כל תגובת תכנות מחדש. הכן ניזונים MEF mitotically מומתים כפי שתואר קודם לכן 18.
- טרום מעיל צלחת 10 סנטימטרים עם 5 מיליליטר של ג'לטין 0.1% לפחות 20 דקות. הצלחת 4 × 10 6 MEF mitotically מומת לכל צלחת 10 ס"מ בינוניים FBS. אפשר התאים להתיישב ולצרף O / N בחממה 37 ° C עם 5% CO 2.
- ביום 3, הריבשילו קרטינוציטים עם טריפסין 0.25% כפי שמתואר בשלב 3.2 ו -3.3. Resuspend קרטינוציטים במדיום KSR וצלחת 90% מקרטינוציטים מהיטב 1 של 6-גם צלחת לתוך צלחת מזין MEF 10 סנטימטרים עם מדיום KSR.
- מיום 4 ואילך, לשנות את מדיום KSR כל יום.
- לחלופין לאחר 18 יום, להחליף בינוני תרבות בכל יום שני.
הערה: קרטינוציטים-לתכנות מחדש ללא יחדלו להתרבות, ואילו מושבות hiPSC עם גבול מוגדר דומים לתאי גזע עובריים אנושיים (hESCs) תצא מהיום 14-21.
- לחלופין לאחר 18 יום, להחליף בינוני תרבות בכל יום שני.
- לבודד מושבות hiPSC ידי נתיחה ידנית מיום 21 ואילך. הימנע מושבות hiPSC שהתקבצו יחד באופן הדוק ורק להרים מושבות hiPSC שברורות מופרדות מאחרים.
ניתן לאסוף מושבות hiPSC קודם לכן, אבל המושבה עם גבולות מוגדרים לא יכולה להיות ברורה בנקודות זמן קודמות בהתחשב בגודל המושבה הקטן: הערה. יעילות תכנות מחדש עשויה להשתנות בין ההבדלשל מטופל erent קרטינוציטים, והוא גם מושפעים מגורמים אחרים כגון מספר מעבר או שיעור התפשטות של קרטינוציטים.- לנתיחה במדריך של מושבות hiPSC, להשתמש במחט 26G לחתוך מושבות hiPSC תחת מיקרוסקופ לנתח. חותך מושבה hiPSC לחתיכות קטנות סביב 300-600 מיקרומטר באורך. העבר את החתיכות מאחד המושבה hiPSC לתוך צלחת חדשה MEF מזין (2.5 × 10 MEF 4/2 סנטימטר) להקים קו משובט של hiPSCs. בתחילה, תרבות כל שורה משובט hiPSC ובאחד 12 מנות צלחת או תרבות איבר היטב, לאחר מכן להרחיב עד 6 פורמט צלחת היטב.
- לשמור על קווים הוקמו משובטים של hiPSCs במדיום KSR על מתקני האכלת MEF. ברגע שהתרבות להגיע 70 - 80% confluency עם מושבות hiPSC ~ 1.5 מ"מ קוטר, hiPSCs מעבר תוך שימוש בשיטות סטנדרטיים האנזימטית passaging (Accutase, Dispase או Collagenase IV) על פי הוראות היצרן.
- לאפיין קו hiPSC הוקםים כדי לאשר pluripotency ויכולתם להתמיין לתאי נציג של שלוש השכבות נבט במבחנה ו / או בvivo 13,19. כמו כן, קווי hiPSC באופן שגרתי בדיקה שהוקמו לmycoplasma באמצעות ערכות זמינות מסחרי כדי לוודא שהם ללא הפתוגן. באופן שיגרתי לפקח יציבות גנומית של קווי hiPSC ידי karyotyping או ניתוח הווריאציה עותק מספר מבוסס מערך (CNV).
תוצאות
השיער עובר 3 שלבים שונים של מחזור צמיחה: anagen (שלב הצמיחה), Catagen (שלב רגרסיה) וטלוגן (שלב המנוחה) 20,21. זקיק שיער anagen מכיל מספר שכבות של אפיתל; שכבות אלה כוללות ORS, מס הכנסה ושערה (איור 1). שיער Anagen סופו של דבר עובר במעבר לשלב Catagen, שמסומן על ידי אפופטוזיס של ORS וסיום בידול שערה. לבסוף, מעבר שיער Catagen לשלב telogen, שבו הופסקה אפופטוזיס וזקיק telogen הופכים שקטים עם telogen אופיינית הבליטה 20,21.
איור 1 מדגים את המורפולוגיה של שיער telogen ושיער anagen. אנו מנצלים בדרך כלל שיער anagen לגזירת keratinocyte. בעקבות פרוטוקול זה, ניתן לצפות בצמחים keratinocyte מוקדם ככל 3 ימים לאחר התקשרות שיער (איור 2 א) וימשיכו עמ 'roliferate (איור 2). מניסיוננו, כמה שערות anagen עלולות להיכשל לצרף או לא לצפות תולדת keratinocyte; כך לאסוף לפחות 5 - 10 שערות anagen מכל פרט על מנת להבטיח בידוד keratinocyte מוצלח. בהמשך לכך, ניתן passaged קרטינוציטים על צלחת חדשה ומתוחזק לקטעים מרובים (איור 2 ג). חשוב לציין כי יש צמיחה טובה יותר של קרטינוציטים במטריקס ציפוי עם מדיום keratinocyte כפי שתוארה בסעיף 2, בהשוואה לMatrigel עם מדיום KSR.
בעקבות הרחבה, ניתן לתכנות מחדש קרטינוציטים ליצור hiPSCs כפי שתואר בסעיף 3. איור 3 א מציג מושבה hiPSC נגזר keratinocyte טיפוסית לאחר 32 ימים של תכנות מחדש. זה נפוץ להתבונן כמה בידול במרכז המושבה hiPSC. ברגע שהרים באופן ידני, hiPSCs נגזר בדרך כלל להציג גבוה גרעין יחס cytoplasmic ומושבה מוגדרת קשורה ארי (איור 3). שורות תאים הוקמו בhiPSCs אז יכולות להיות מאופיינות על pluripotency כפי שתוארו לעיל 13,19, כגון הביטוי של סמני pluripotent Oct4, NANOG וTRA-160 (איור 3 ג-ה).
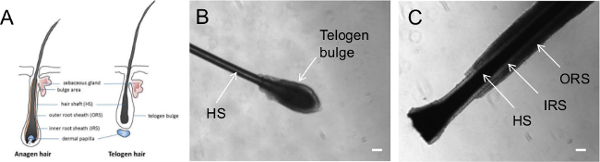
איור 1. נציג תמונות של שערות מרוטות בשלבי צמיחה שונים. () תרשים הממחיש שערות בשלב anagen או telogen. בניגוד שלב תמונות מראים שיער קטף בשלב telogen (ב) ו- (ג) anagen שלב. HS פיר = שיער; מס הכנסה = פנימי שורש נדן; ORS = חיצוני שורש נדן. סרגל = 100 מיקרומטר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
e = "תמיד"> 
איור 2. נציגי תמונות של קרטינוציטים נגזר שיער. בניגוד שלב תמונות של שיער קטף מצופה למטה () 3 ימים ו- (ב) 10 ימים. חיצים לבנים מסמנים את התוצאה של keratinocyte משיער מרוט. תמונת שלב (ג) לעומת של יום 3 תרבות keratinocyte עם מורפולוגיה מרוצפת אופיינית לאחר passaging. סרגל = 100 מיקרומטר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 3. נציגי תמונות של hiPSCs נגזר keratinocyte. (א) תמונה בניגוד שלב של תרבות תכנות מחדש יום 32 מראה שיתוף hiPSC נגזר keratinocyteט וני. (ב) באופן ידני נבחר hiPSCs נגזר keratinocyte עם מורפולוגיה דומה לhESCs. Immunostaining של hiPSCs עם סמני pluripotent NANOG (C) וOct4 (ד) ו- (ה) TRA-160 בhiPSCs נגזר keratinocyte. סרגל = 100 מיקרומטר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
דור של hiPSCs מטופל ספציפי מציע גישה ייחודית ללימוד פתוגנזה בסוגים החולים תאים במבחנה, וגם מספק פלטפורמה להקרנת סמים לזהות מולקולות רומן שיכול להציל את פנוטיפים המחלה. גישת דוגמנות זה מחלה באמצעות hiPSCs הניבה תוצאות מבטיחות עבור מגוון רחב של מחלות, כולל תסמונת Long QT, מחלת הנטינגטון, מחלת פרקינסון וטרשת לרוחב amyotrophic 22. מספר יוזמות כבר יצאו לדרך להקמתן של ספריות בקנה מידה גדולה של hiPSCs מטופל ספציפי, כוללים קונסורציומים בארה"ב, אירופה, אוסטרליה, סין, דרום קוריאה ויפן 23,24.
הנה פרוטוקול להקים hiPSCs מקרטינוציטים נגזר שיער מתואר, אשר יש לו הפוטנציאל להקל ומהיר לעקוב אחר הקמת ספריות בקנה מידה גדולה של hiPSCs ספציפית למחלה. פרוטוקול זה מציע שני יתרונות: ראשית, episomalמערכת מנוצלת בפרוטוקול זה מייצרת hiPSCs ללא אינטגרציה באמצעות קוקטייל של שישה גורמי תכנות מחדש (Oct4, Sox2, KLF4, L-MYC, LIN28, shRNA לp53) ביעילות גבוהה יחסית 4. בהשוואה לשיטות תכנות מחדש retroviral או בתיווך lentiviral, השימוש בוקטור episomal ימנע אינטגרציה הגנומי רצויה של transgenes הזר בתכנות מחדש., לכן, יוזמות רבות להעדיף את השימוש בשיטות ללא אינטגרציה תכנות מחדש להקמת ספריות hiPSC בקנה מידה גדולה, כגון וקטורי episomal, וירוס סנדאי או mRNA, על פני שיטות תכנות מחדש אינטגרטיבית 23.
שנית, שיער הוא נגיש בקלות ויכול להיות שנקטפו על ידי החולים עצמם ללא השימוש בהליכים פולשניים או הנוכחות של הצוותים רפואיים. זה מספק הזדמנות ייחודית לחולים מאזורים שונים כדי לאסוף ואלקטרוני בדגימות השיער שלהם למעבדה לגזירת keratinocyte ותכנות מחדש לאחר מכן. בתמיכה של ההיתכנות של אסטרטגיה זו, נתונים שלא פורסמו שלנו מצביעים על כך שקרטינוציטים יכולים להיות מבודדים בהצלחה משיער מרוט שמאוחסן על 4 מעלות צלזיוס למשך עד 10 ימים.
המתודולוגיה שתוארה כאן תאפשר הגזירה של keratinocyte משיער מרוט. בעוד ניתן לגזור מקרטינוציטים רק שערה אחת, ההמלצה שלנו היא לאסוף לפחות 5 שערות anagen לגזירת keratinocyte. מגבלה אחת של פרוטוקול זה היא שכמה שערות לא לצרף גם וקרטינוציטים עלולים להיכשל לגדול. שיער עבה יותר נוטה לצרף טוב יותר, ואילו שיער דק דורש סכום מופחת של מדיום התרבות בציפוי להימנע צף ולשפר את קובץ מצורף. ברגע שקרטינוציטים נגזרים, רצוי להרחיב ולהקפיא את מניות תוך שימוש בשיטות הקפאת הקפאה איטיות סטנדרטית 16. תכנות מחדש הבא של קרטינוציטים יכול להתבצע מתוארים בפרוטוקול זה הצעדים הבאים. חשובלציין כי קצב ההתפשטות של התאים מתחילים עלולה להשפיע על יעילות תכנות מחדש, עם יעילות תכנות מחדש ירידה שנצפתה בקטעים מאוחרים כתאים להגיע הזדקנות תאית 25-27. בהקשר זה, להשתמש קרטינוציטים לא יאוחר מהחלוף 6 לניסויי תכנות מחדש. בנוסף, יעילות תכנות מחדש עשויה להשתנות בין קרטינוציטים של הפרט שונה.
מחקרים אחרונים מראים הפסיפס גנטי נפוץ בסוגים שונים של רקמות סומטיות 28, עם ~ 30% של fibroblasts העור דווח כי CNVs הגופני בגנום 29. CNVs אלה עלולים להיגרם על ידי שגיאות בשכפול ה- DNA, תיקון דנ"א או גיוס transposon. ייתכן גם כי חשיפה ממושכת לקרינת UV העור יכולה לגרום CNVs נוסף בתאי האפידרמיס כולל fibroblasts וקרטינוציטים, אך היקף זה אינו מובן היטב. כCNVs בקרטינוציטים יבוצע על בתהליך תכנות מחדש, זה important לבצע karyotyping שיגרתי או ניתוח CNV כדי להבטיח שhiPSCs הוקם לשמור על יציבות גנומית. לסיכום, כאן תארנו נהלים לדור של hiPSCs מקרטינוציטים נגזר שיער, אשר יכול לשמש לדוגמנות מחלה ורפואת רגנרטיבית.
Disclosures
The authors have no conflict of interest.
Acknowledgements
The authors wish to thank Harene Ranjithakumaran and Stacey Jackson for technical support. This work was supported in part by grants from the National Health and Medical Research Council (R.C.B. Wong, A. Pébay), the University of Melbourne (R.C.B. Wong), Retina Australia (R.C.B. Wong, S.S.C. Hung, A. Pébay) and the Ophthalmic Research Institute of Australia (R.C.B. Wong, S.S.C. Hung, A. Pébay); Australian Research Council Future Fellowship (A. Pébay, FT140100047), Cranbourne Foundation Fellowship (R.C.B. Wong); intramural funding from the National Institutes for Health (R.C.B. Wong, S.S.C. Hung) and operational infrastructure support from the Victorian Government.
Materials
| Name | Company | Catalog Number | Comments |
| Antibiotic Mix: | |||
| 250 ng/ml Antimycotic amphotericin B | Sigma | A2942-20ml | Antibiotic mix is made up in PBS. |
| 1X Penicillin/Streptomycin | Invitrogen | 15140-122 | |
| PBS (-) | Invitrogen | 14190-144 | |
| Knockout Serum Replacement (KSR) medium: | KSR medium is filtered using Stericup (Millipore, #SCGPU05RE) before use. bFGF is added fresh to the media before use. | ||
| 20% knockout serum replacement (KSR) | Invitrogen | 10828-028 | |
| DMEM/F12 with glutamax | Invitrogen | 10565-042 | |
| 1× MEM non-essential amino acid | Invitrogen | 11140-050 | |
| 0.5× Penicillin/Streptomycin | Invitrogen | 15140-122 | |
| 0.1 mM β-mercaptoethanol | Invitrogen | 21985 | |
| bFGF (10 ng/ml, added fresh) | Millipore | GF003 | |
| Keratinocyte medium: | |||
| EpiLife with 60 µM Calcium | Invitrogen | M-EPI-500-CA | |
| 1× Human keratinocyte growth supplement (HKGS) | Invitrogen | S-001-5 | |
| Fetal Bovine Serum (FBS) medium: | FBS medium is filtered using Stericup (Millipore, #SCGPU05RE) before use. | ||
| 10% fetal bovine serum (FBS) | Invitrogen | 26140079 | |
| DMEM | Invitrogen | 11995-073 | |
| 0.5x Penicillin/Streptomycin | Invitrogen | 15140-122 | |
| 2 mM L-glutamine | Invitrogen | 25030 | |
| 0.25% trypsin-EDTA | Invitrogen | 25200-056 | |
| Extracellular Matrix (ECM): | |||
| Matrigel | Corning | 354234 | Aliquot Matrigel stock and store in -80°C following manufacturer’s instructions. Stock concentration of Matrigel varies slightly from batch to batch (~9mg/ml). We recommend to use 200µl matrigel for coating a 12-well plate (~150µg/well). |
| Coating Matrix Kit | Invitrogen | R-011-K | |
| Plasmids: | Note that pCXLE-eGFP is only used for monitoring transfection efficiency and is not required for reprogramming. | ||
| - pCXLE-eGFP | Addgene | 27082 | |
| - pCXLE-hOct3/4-shP53F | Addgene | 27077 | |
| - pCXLE-hSK | Addgene | 27078 | |
| - pCXLE-hUL | Addgene | 27080 | |
| Transfection reagent Fugene HD | Promega | E231B | |
| Gelatin (from porcine skin) | Sigma | G1890 | Make up 0.1% gelatin in distilled water. Autoclave before use. |
| Reduced Serum medium: OPTI-MEM | Invitrogen | 31985062 | |
| Accutase | Sigma | A6964-100ml | |
| Mouse embryonic fibroblast (MEF) feeder | MEF can be inactivated by mitomycin C treatment or irradiation as described previously 16. | ||
| 26G needle | Terumo | NN2613R | |
| 6-well plate (tissue culture treated) | BD Biosciences | 353046 | |
| 12-well plate (tissue culture treated) | BD Biosciences | 353043 | |
| 10 cm dish (tissue culture treated) | BD Biosciences | 353003 | |
| Dispase | Invitrogen | 17105-041 | Use at 10 mg/ml |
| Collagenase IV | Invitrogen | 17104-019 | Use at 1 mg/ml |
| TRA-160 antibody | Millipore | MAB4360 | Use at 5 µg/ml |
| OCT4 antibody | Santa Cruz | SC-5279 | Use at 5 µg/ml |
| NANOG antibody | R&D Systems | AF1997 | Use at 10 µg/ml |
| MycoAlert Detection kit | Lonza | LT07-418 |
References
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126, 663-676 (2006).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131, 861-872 (2007).
- Yu, J., et al. Induced pluripotent stem cell lines derived from human somatic cells. Science. 318, 1917-1920 (2007).
- Okita, K., et al. A more efficient method to generate integration-free human iPS cells. Nat Methods. 8, 409-412 (2011).
- Park, I. H., et al. Reprogramming of human somatic cells to pluripotency with defined factors. Nature. 451, U141-U141 (2008).
- Okita, K., et al. An efficient nonviral method to generate integration-free human-induced pluripotent stem cells from cord blood and peripheral blood cells. Stem Cells. 31, 458-466 (2013).
- Dowey, S. N., Huang, X., Chou, B. K., Ye, Z., Cheng, L. Generation of integration-free human induced pluripotent stem cells from postnatal blood mononuclear cells by plasmid vector expression. Nat Protoc. 7, 2013-2021 (2012).
- Zhou, T., et al. Generation of induced pluripotent stem cells from urine. J Am Soc Nephrol. 22, 1221-1228 (2011).
- Aasen, T., et al. Efficient and rapid generation of induced pluripotent stem cells from human keratinocytes. Nat Biotechnol. 26, 1276-1284 (2008).
- Peters, A., Zambidis, E. Chapter 16. Generation of nonviral integration-free induced pluripotent stem cells from plucked human hair follicles. Human Embryonic and Induced Pluripotent Stem Cells: Lineage-Specific Differentiation Protocols.Springer Protocols Handbooks. Ye, K., Jin, S. , Springer. 203-227 (2012).
- Fuchs, E. Scratching the surface of skin development. Nature. 445, 834-842 (2007).
- Limat, A., Noser, F. K. Serial cultivation of single keratinocytes from the outer root sheath of human scalp hair follicles. J Invest Dermatol. 87, 485-488 (1986).
- Piao, Y., Hung, S. S., Lim, S. Y., Wong, R. C., Ko, M. S. Efficient generation of integration-free human induced pluripotent stem cells from keratinocytes by simple transfection of episomal vectors. Stem Cells Transl Med. 3, 787-791 (2014).
- Higgins, C. A., et al. Reprogramming of human hair follicle dermal papilla cells into induced pluripotent stem cells. J Invest Dermatol. 132, 1725-1727 (2012).
- Muchkaeva, I. A., et al. Generation of iPS Cells from Human Hair Follice Dermal Papilla Cells. Acta naturae. 6, 45-53 (2014).
- Naaldijk, Y., Friedrich-Stockigt, A., Sethe, S., Stolzing, A. Comparison of different cooling rates for fibroblast and keratinocyte cryopreservation. J Tissue Eng Regen. , (2013).
- Sporl, F., et al. Real-time monitoring of membrane cholesterol reveals new insights into epidermal differentiation. J Invest Dermatol. 130, 1268-1278 (2010).
- Conner, D. A., et al. Mouse embryo fibroblast (MEF) feeder cell preparation. Current protocols in molecular biology. Ausubel, F. N., et al. 23, Unit 23 22(2001).
- Pebay, A., et al. Essential roles of sphingosine-1-phosphate and platelet-derived growth factor in the maintenance of human embryonic stem cells. Stem Cells. 23, 1541-1548 (2005).
- Myung, P., Ito, M. Dissecting the bulge in hair regeneration. J Clin Invest. 122, 448-454 (2012).
- Alonso, L., Fuchs, E. The hair cycle. J Cell Sci. 119, 391-393 (2006).
- Robinton, D. A., Daley, G. Q. The promise of induced pluripotent stem cells in research and therapy. Nature. 481, 295-305 (2012).
- Soares, F. A., Sheldon, M., Rao, M., Mummery, C., Vallier, L. International coordination of large-scale human induced pluripotent stem cell initiatives: Wellcome Trust and ISSCR workshops white paper. Stem cell reports. 3, 931-939 (2014).
- McKernan, R., Watt, F. M. What is the point of large-scale collections of human induced pluripotent stem cells. Nat Biotechnol. 31, 875-877 (2013).
- Utikal, J., et al. Immortalization eliminates a roadblock during cellular reprogramming into iPS cells. Nature. 460, U1145-U1112 (2009).
- Xu, Y., et al. Proliferation rate of somatic cells affects reprogramming efficiency. J Biol Chem. 288, 9767-9778 (2013).
- Liu, J., et al. Late passage human fibroblasts induced to pluripotency are capable of directed neuronal differentiation. Cell Transplant. 20, 193-203 (2011).
- Huallachain, M., Karczewski, K. J., Weissman, S. M., Urban, A. E., Snyder, M. P. Extensive genetic variation in somatic human tissues. Proc Natl Acad Sci U S A. 109, 18018-18023 (2012).
- Abyzov, A., et al. Somatic copy number mosaicism in human skin revealed by induced pluripotent stem cells. Nature. 492, 438-442 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved