Method Article
İleri Genetik Yaklaşım Farelerde Stres Direnci Genler ortaya çıkarmak için - ES Hücrelerde bir Yüksek verim Ekranı
Bu Makalede
Özet
Stres direnci uzun ömürlü özelliklerinden biridir ve genetik yönetilmeye bilinmektedir. Burada, uzun ömürlü çalışmaları için fare modelleri geliştirmek için hangi ES hücreleri stres direnci kazandıran mutasyonlar taranması için tarafsız bir yüksek verimli bir yöntem geliştirdi.
Özet
Phenotype-driven genetic screens in mice is a powerful technique to uncover gene functions, but are often hampered by extremely high costs, which severely limits its potential. We describe here the use of mouse embryonic stem (ES) cells as surrogate cells to screen for a phenotype of interest and subsequently introduce these cells into a host embryo to develop into a living mouse carrying the phenotype. This method provides (1) a cost effective, high-throughput platform for genetic screen in mammalian cells; (2) a rapid way to identify the mutated genes and verify causality; and (3) a short-cut to develop mouse mutants directly from these selected ES cells for whole animal studies. We demonstrated the use of paraquat (PQ) to select resistant mutants and identify mutations that confer oxidative stress resistance. Other stressors or cytotoxic compounds may also be used to screen for resistant mutants to uncover novel genetic determinants of a variety of cellular stress resistance.
Giriş
Ömür stres direnci ile samimi bir ilişki vardır. Genel olarak, uzun ömürlü türler genellikle hidrojen peroksit paraquatın (PQ), UV, ısı ve ağır metaller 1,2 gibi birden stres, doğru direncin artmasına işlemini göstermektedir. Bunun aksine, strese karşı artan hassasiyet, kısalmış ömür ve / veya daha fazla hastalık eğilimli fenotipi tahmin etmek eğilimindedir. Anti-oksidanın, tutucu yolu uzun hayvana gerilme direnci veren önemli bir rol oynadığı tahmin edilmektedir. Bununla birlikte, birkaç istisna dışında, çeşitli anti-oksidan enzimler (örneğin, akciğer), manipülasyonlara sahip transgenik hayvanların çeşitli çalışmalar, oksitleyici kirleticilerin alınmasına yönelik enzim düzeyi artan yaşam süresi ya da sağlık aralığı 3 arttırmadığını gösterir. Bu veriler sürekli olarak uzun ömürlü hayvanlarda gözlenen stres direnç özelliği henüz ortaya için diğer hücresel yolların aracılık ettiğini göstermektedir.
Biz tarafsız bir ileriye aldıGenetik mutasyona uğramış bir yaklaşım üzerine, kültürlü embriyonik kök (ES) hücrelerde stres direnci fenotipi olabilir genleri tanımlamak için. ES hücreleri Bu çalışmada iki ana avantaj sağlar: (1) sofistike genetik manipülasyonlar ES hücrelerinin genomunun modifiye edilmesi için kullanılabilir; ve (2) ekranında elde herhangi bir strese karşı ES hücreleri ile doğrudan ömrü, sağlık yayılma ölçmek için bütün hayvan çalışmalarında içine hızlı şekilde çevrilmesine izin veren fare üretimi için de kullanılabilir.
Bu yazıda Blm alleller bir tetrasiklin duyarlı eleman tarafından kontrol altına bulundukları C9 ES hücre hattı kullanımını tarif. Doksisiklin (Ortodoks) tedavisi geçici kardeş kromatid değişimi artan olaya lider BLM ifadesini kapalı. Bu kısa vadeli Blm knock-out heterozigot nüfus içerisindeki homozigot mutasyon üretimi için izin stres direnci için çekinik mutasyonlar tarama sürecinde yakalanan olabilir ki. BizAyrıca rastgele genom genlerin mutasyona bir poli-A tuzak kaseti (PB-UPA) eklemek için mutajen olarak piggyBac (PB) transpozonun kullanımını tarif. Poli-A tuzağı ile bir gen bozulması olan hücreler, G418 dirençli hale ve gen-trap mutantlar (gen trap kütüphanesi) oluşan bir koleksiyon yapılmış ve daha sonra, karşı stres olan mutant klonları için tarandı olabilir, böylece elde edilebilir.
Seçim kurtarıldı Stres dirençli klonlar eklemeleri sayısı (qPCR) arasında bağlamda moleküler tekniklerle oldukça hızlı karakterize edilebilir, ekleme site (splinkerette PCR), bozulmuş gen (ŞOK) kimliği ve onun ifade seviyesi ( RT-qPCR). PB yerleştirme Yabani tür bir DNA dizisini ve bu nedenle geri stres direnci kaybını test klonu MPB transpozazın geçici ifade yolu ile remobilized edilebilir. Bunlar önce yapılmalıdır mutasyon nedenselliğini onaylamak için güçlü yollar vardırpahalı bir fare üretimi. Önceki çalışmalar stres maruz kalan hücreler pluripotency 4,5 kaybettiklerini gösterdi. Böylece, bu protokolde, stres ile tedavi olmaz mutant hücreler kümesi bir yineleme, korunması başarılı fare üretimi için kritik öneme sahiptir.
Bizim laboratuvar hem istek üzerine diğer araştırmacılar için kullanılabilir, C9 ES hücre hattı ve PB-UPA vektörü tasarladı. Burada rapor edilen protokol, stres dayanıklı klonların (Şekil 1B) izole etmek için replika plaka ve stres seçimi, ardından PB-UPA (Şekil 1A) gen tuzak ES hücreleri, de novo arşivinin oluşturulması yoluyla başlar. Biz paraquat, hücreler içinde güçlü bir serbest kök üretici madde ile noktası göstermiştir. Hemen hemen, örneğin herhangi bir sitotoksik bileşik veya toksin, ER stres (örneğin, thapsigargin ve tunikamisin), nöronal oksitleyici (örneğin, MPP +, 6-hidroksi dopamin ve rotenon), ısı ve ağırmetaller (örneğin, Cd, Se), ilgili dirençli mutantların seçmek için bir yöntem adapte edilebilir.
Protokol
PiggyBac transpozonunun kullanma 1. Gen-tuzak ES Hücre Kütüphane İnşaatı
- ES hücre kültürü için besleyici olarak birincil fare embriyonik fibroblast (PMEF) hazırlayın
- 37 ° C su banyosu içinde mitomisin C ile inaktive PMEF (5.0 x 10 6) bir şişe çözülme. DMEM,% 15 FBS ihtiva eden ES hücre ortamı, 5 ml (1000 ünite / lösemi önleyici faktörler mi, 100 uM esansiyel olmayan amino asitler, 2 mM glutamin, 55 uM 2-merkaptoetanol, ve 25 birim / ml penisilin / streptomisin içine hücreleri aktarın ) ve 5 dakika boyunca 100 x g'de santrifüje tabi tutulur.
- Süpernatant aspire ve iki T25 şişelerinde (her biri 5 mi) ile, iki 100 mm tabak (10 mL) ekstrakte edildi içine dağıtılması ve ardından ES hücre ortamı 30 ml hücreler tekrar süspansiyon. 24 saat boyunca 37 ° C'de,% 5 CO2 inkübe edin.
- Kültür ve C9 ES hücreleri genişletmek
- 37 ° C su banyosu içinde C9 ES hücreleri bir vial (0,5 ml, 2.5 x 10 6 hücre) çözülme ve aktarmaES hücre ortamı 5 ml hücre. 5 dakika boyunca 100 x g'de santrifüjleyin.
- T25 besleme şişesi içine kaplama ardından süpernatan ve ES hücre ortamı 5 ml tekrar süspansiyon ES hücrelerinin aspire. 37 ° C'de,% 5 CO2 inkübe edin. Günlük ES hücre ortamı değiştirin.
- Kültür 2 gün sonra ES hücreleri ~% 80 konfluent hale gelir ve geçişli hazırdır gerekir. (2+ + ve Mg2 Ca olmadan) PBS, 5 ml hücreleri yıkayın ve daha sonra 2.5 ml tripsin-EDTA,% 0,25 önceden ısıtılmış. 10 dakika boyunca 37 ° C'de inkübe edilir. Tripsin durdurmak için 2.5 ml ES hücre orta ekleyin; yukarı pipet ve 15 kez aşağı hücre kümeleri break up. 5 dakika boyunca 100 x g'de santrifüjleyin.
- ES hücre ortamı 4 ml supernatant ve tekrar süspansiyon hücreleri aspire. Aktarım 9 mi ES hücre ortamı içeren 100-mm plaka başına hücre 1 mi; iki adet 100 mm'lik plakaları hazırlamak. 8 geçişi: Bu 1'dir. 10 mi ES hücre ortamı ile günlük olarak hücrelerin besleyin.
- Kütüphane için 96 oyuklu plakalar hazırlamak besleyici
- 1.1.1 tarif edildiği gibi, 33.3 mi ES hücre ortamı ile her şişeye üç mitomisin-C şişeleri PMEF deaktive (her biri 5 x 10 6 hücre) ve tekrar süspansiyon hücreleri eritin. 100 ml hücre süspansiyonu elde etmek için hücreleri birleştirir.
- De üzerine on adet 96-yuvalı plakalar her plaka 100 ul hücre. Bu 96-kuyu besleyici plakaları PB transposon ile C9 ES hücrelerinin transfecting önce en az bir gün hazırlanmalıdır.
- PB-UPA vektörü C9 ES hücrelerinin elektroporasyonu
- Trypsinize ve otomatik hücre sayıcı kullanarak genişletilmiş C9 ES hücreleri saymak. 10 ml PBS ile C9 ES hücrelerinin her 100 mm plaka yıkanır. 8 ml ilave edilir,% 0.25 tripsin-EDTA önceden ısıtılmış ve 10 dakika boyunca 37 ° C'de inkübe edin.
- 2 ml ES hücre ortamı ekleyerek tripsin durdurun. Hücre kümeleri bozmaya 15 ml tüp ve pipet yukarı aşağı 15 kez hücre süspansiyonu aktarın. Hemen süpernatan aspire ardından 5 dakika boyunca 100 x g'de santrifüjlenir.
- Tekrar süspansiyon hücre10 ml ES hücre ortamında s ve hemasitometre kullanarak ES hücreleri saymak. Hücre süspansiyonu, altı 15-ml tüpler her biri 5 x 10 6 ES hücreleri hazırla. 5 dakika boyunca 100 x g'de santrifüjleyin. Süpernatantı aspire ve 0.8 ml PBS her hücre pelletini.
- Altı elektroporasyon küvetler (4 mm boşluk) 0.8 ml hücre aktarılır hazırlanın. Her küvete için, 1 ug PB-UPA ve 20 ug MPB transposaz (mPBase) ekleyin; Yukarı ve aşağı pipetleme hafifçe karıştırın. Buz üzerinde küvetler koyun. Bir 250 V de üstel ayarını kullanarak Elektroporatör, 500 iF ve sonsuzluk ohm ile elektroporasyon gerçekleştirin.
Not: Genellikle, zaman sabiti, yaklaşık 10 5 x 10 6 hücre başına 1.500 2.000 G418 dirençli transformantların elde başarılı bir elektroporasyon için 12 ms, etmektir. - Al ve 98 mi ES hücre ortamı içeren bir T75 kabına transfekte edilmiş hücrelerin havuz. Yumuşak bir pipetleme ile hücreleri karıştırın ve daha sonra bir hazne (50 mi) hücreleri transferi. Bize12 kanallı bir pipet, ing (toplam 10) daha önce hazırlanmış 96 oyuklu besleme plâkalarına oyuk başına 100 ul hücre transfer edin. 37 ° C'de,% 5 CO2 inkübe edin.
- 24 saat sonra, gen tuzak klonların seçilmesi için yeni ES hücre ortamı ihtiva eden G418 (150 ug / mi) ile günlük olarak hücreler beslenir.
NOT: Genellikle her bir kuyunun yaklaşık on G418 dirençli koloniler içerecektir. Bu koloniler (tipik olarak 5-7 gün) yeterli bir boyuta büyüdüklerinde, 96 oyuklu plakalar (kütüphanesi), sırasıyla depolama ve seçimi için 2 kümeler halinde çoğaltılacaktır. Bu durumda, 10 alt-kütüphaneler yani kütüphanede Her bir plaka, 'alt kütüphane "olarak belirlenmiştir.
2. Kütüphane Çoğaltma
- Usta plakaları Çoğalt
- 24-48 saat 50-60% Ortak akışkanlığa eriştikten G418 dirençli koloniler önce, besleyiciler (bölüm 1,3 bakınız), on 96-yuvalı plakalar üzerine mitomisin C ile inaktive PMEF diğer üç şişe eritin. Jelatinen az 15, 37 ° C'de,% 0.1 jelatin inkübe edilerek on 96-yuvalı plakalar ize (/ oyuk 100 ul) - 30 dakika; O / N inkübasyon kabul edilebilir.
- Tripsinizasyon ile 96 oyuklu plakalar içinde, tek hücre süspansiyonlarının hazırlanması. Aspire 96 oyuklu plakalar ile orta ve (Ca + 2, Mg + 2 olmadan) PBS ile bir kez eşit hacimde yıkayın. Önceden ısıtılmış% 0.25 tripsin-EDTA 50 ul ekle 10 dakika boyunca% 5 CO2 içinde 37 ° C'de inkübe edin. ES hücre ortamı 50 ul tripsin bırak. Çok kanallı pipet aşağı 15 kere yukarı pipetleme ve hücre kümeleri parçalayın.
- Transferi zaten 150 ul ES hücre ortamı içeren besleyici plakası (Yüksek Lisans) zaten 150 ul ES hücre ortamı içeren jelatinleştirilmiş plaka (yineleme) karşılık gelen satırda kalan 50 ul karşılık gelen satıra tripsinize hücre süspansiyonu 50 ul. Master ve çoğaltma plakasına hücrelerin her satırı işleyin. Şimdi 200 ul c içeren (inkübe37 ° C 'de ulture hacim),% 5 CO2 O / N.
NOT: Yirmi 96-gözlü plakalar, şimdi vardır. - Ertesi gün, 150 ug / ml G418 içeren 100 ul taze ES hücre ortamı ile hücreleri besler. Kuyular% 80-90 konfluent kadar günlük orta yerine.
- Usta plakaları Freeze
- Ana plakalar yaklaşık% 80 konfluent olduğunda, (bölüm 2.1.2 bakınız) tarif edildiği gibi, hücreler trypsinize.
- Plakaları çıkarın ve orta (60% ES hücre ortamı,% 20 FBS,% 20 DMSO) dondurma 2x 50 ul tripsin reaksiyonu durdurun. Pipet yukarı ve çok kanallı pipet ile 10 kez aşağı dondurma ortamının düzgün karışmasını sağlamak için.
- Sıkıca kapatılmış bir styrofoam kutusunda 96 oyuklu plakalar koyun ve en fazla dört ay depolama için -80 ° C dondurucu içine koyun. Dört ay stres seçimini tamamlamak ve Master plakadan kuyu ilgi klonları ihtiva eden tanımlamak için yeterli zamanı sağlayacak.
NOT: -80 & # Depolama176 C daha uzun 4 ay hücre canlılığının bir düşüş ile sonuçlanır. Bir depolama uzun bir süre boyunca sıvı azot, buhar fazında saklanabilir 96 oyuklu bir formatta kriyo-tüp de kullanılabilir.
- Çoğaltma plakalardan DNA plakaları ve alt kütüphane havuzları hazırlayın
- 24-48 saat alt kütüphane havuzu için mitomisin C ile inaktive PMEF on 100 mm plakaları hazırlamak DNA levha ve alt kütüphane havuzlara daha replike önce ve DNA plakası çoğaltır on 96-yuvalı plakalar jelatinleştirilmiş. Genel prosedür için bölüm 1.3 bakınız.
- 96-kuyu kopya plakalarda hücreleri Trypsinize (bölüm 2.1.2 bakınız). 10 dakika tripsinizasyon adımı sırasında, aspirat DNA plakalarından jelatin ve 150 ul ES hücre ortamı ihtiva eden G418 (150 mg / ml) ile değiştirin. Aynı zamanda, 100 mm'lik besleme plakası içine 'alt-kütüphaneler' bir havuzda toplanması için ES hücre ortamı 5 ml ihtiva eden bir hazne hazırlar.
- Trypsinization ardından, denemek durdurmak12 kanallı bir pipet kullanarak aynı anda ES hücre ortamı bir sıranın 50 ul psin. Pipet yukarı ve 10 kez aşağı hücre kümeleri parçalayın.
- Aktarım 50 DNA plakası, karşılık gelen satıra hücre süspansiyonu ul ve 5 ml ES hücre ortamı içeren hazneye geri kalan 50 ul transfer. Bir tam 96 oyuklu plaka tamamlandıktan sonra, 100 mm besleyici plaka ortam, bir araya getirilmiş hücreler aktarılır için aspire. Bu havuzlanan mutagenize hücreler 'alt kütüphane' olarak adlandırılır.
- Geri kalan dokuz 96 oyuklu plakalar için tekrarlayın. ES hücre ortamı ihtiva eden G418 (150 ug / mi) ile günlük olarak 96-çukurlu bir DNA plakaları ve 100 mm'lik bir araya getirilmiş "alt kütüphane plakaların besleyin.
NOT: Şimdi on 96-iyi 'DNA' plakaları ve on 100 mm 'alt kütüphane' plakaları vardır.
- DNA plakaları dondurun. DNA, plâkanın içindeki hücreler% 80-90 konfluent olduğunda, orta aspire 100 ile iki kez yıkama hücreleriDaha sonra genomik DNA izolasyonu 6 -20 ° C de PBS ve mağaza mcL. Bunlar DNA plakalar 'Usta' plaka iyi gelen ilgi klon içeren belirlemek için PCR ile izleyicilerle buluşacak.
3. Doksisiklin kaynaklı homozigot mutantlar
- Doksisiklin tedavisi için alt kütüphane havuzları ve geçiş hücreleri Freeze
- 24 saat,% 70-80 confluency verim doksisiklin tedavisi için 100 mm plakaları Jelatinize on bir dizi hazırlamak için yeterince büyük koloniler sahip 100 mm 'alt kütüphane' plakalara önce.
- Her bir alt-kütüphane tek hücre süspansiyonları hazırlayın (bölümler 1.4.1 ve detaylar için 1.4.2 bakınız). Doksisiklin (1 ug / ml) ile jelatinize 100-mm plaka transfer 5 x 10 6 hücre; 37 ° C'de,% 5 CO2 inkübe edilir. Flakon başına 5 x 10 6 hücre dışı kalan doksisiklin tedavi alt kütüphane havuzları dondurun.
- Mevcudiyetinde Geçiş hücreleriBLM nakavt doksisiklinin
- Geçiş 1 alt-kütüphaneler: İki hafta içinde doksisiklin (1 ug / ml) varlığında, 8, her 2-3 günde, bu süre içinde knock-out BLM hücresinin heterozigosite kaybı teşvik edecektir doks-kaynaklı Nüfus, homozigoz mutantlarının üretimi için izin.
4. Stres Seçimi ve Dayanıklı Klonların İzolasyonu
- Stres seçimi için Konu doksisiklin ile tedavi edilen hücreler
- Hazırlanması önceden gerilme seçimi için doksisiklin işlenmiş hücreleri pasajlanarak 24 saat on 37 ° C,% 5 CO2 ile nemlendirilmiş inkübatörde kuluçkalaşmıştır 150 mm tabak, yer jelatinize.
- Tripsinizasyon ile her bir alt kütüphane tek bir hücre süspansiyonu hazırlayın (bölüm 1.4.1 ve detaylar için 1.4.2 bakınız). Hücreler eşit dağıtmak, 30 ml toplam kültür hacmi her 150 mm plaka üzerine 6.6 x 10 6 hücre Tohum. Stres (10 mcM paraquat veya β-mercaptoethanol ihmal ile inkübe hücreleri,kalan hücreler toplamak için koloniler halinde büyümeye izin normal ES hücre ortamı ile yerine sonra 7 gün boyunca FBS deaktive% 7.5 ısı) içeren bir ES hücre ortamı içinde.
- İsteğe bağlı: flakon başına 5.0 x 10 6 hücre doksisiklin ile tedavi hücreleri üzerinde sol dondurun.
- Stres dayanıklı koloniler seçin
- Bir hafta boyunca normal bir medya eski haline sonra, dirençli koloniler mevcut kaç stres gözlemleyin. Kolonilerin sayısı aldı olmak bağlı olarak, 96-yuvalı plakalar üzerinde mitomisin C ile inaktive PMEF yeterli kuyu hazırlanması Bir gün önce buna göre (ayrıntılar için bölüm 1.1 ye bakınız).
- Ve toplama, aspirat günde, 100 ul taze bir ES hücre ortamı ile 96-çukurlu plaka içindeki besleyici orta yerine 37 ° C'de,% 5 CO2 ile nemlendirilmiş inkübatörde kuluçkalaşmıştır geri koyun. Şu anda, 50 ul% 0.25 tripsin-EDTA ile U-tabanlı 96-çukurlu plaka hazırlanması ile sabitleştirilir. Aspire 150 mm stres seçimi plaka orta ve e eklemekPBS qual hacmi.
- 2 ul mikropipet ayarlayın ve iyi başına bir koloni toplama, kuyu içeren U-alt tripsin içine koloniler hayatta 'almak'. Bu kolonilerin istediğiniz sayı aldı kadar plaka oda sıcaklığında bekletin kabul edilebilir. Daha sonra, 10 dakika için 37 ° C,% 5 CO2 de U tabanlı bir plaka inkübe edin.
NOT: Genellikle, biz 96 koloniler almaya 1 saat sürebilir. - 50 ul ES hücre ortamı, çok kanallı pipet kullanılarak her seferinde tripsin reaksiyon bir satır durdurun. Pipet yukarı ve aşağı 15 kez tek bir hücre süspansiyonu elde etmek ve daha önce ES hücre ortamı 100 ul ihtiva eden besleyici plaka karşılık gelen satıra hücrelerinin 100 ul aktarma. Tüm plaka transferi tamamlamak. Kültür hücreleri 200 ul O / N. Ertesi sabah, aspirat orta ve 100 ul ES hücre ortamı ile değiştirin.
- 96 oyuklu plakalar çoğaltma
- Aldı kolonilerin kuyuları% 80-90 conflue olduğundant iki eşleşen plakaları, DNA izolasyonu için bir ve hücreler back-up için diğer içine çoğaltırlar. Bu plakalar, jelatinleştirilmiş ve mitomisin C ile pasifleştirilmiş PMEF içermez.
- Kültür ortamı basınçla, ve 100 ul PBS ile yıkayın. Her bir oyuğa 50 ul% 0.25 tripsin-EDTA ekleyin, 10 dakika için 37 ° C'de inkübe edin. 150 ul ES hücre ortamı ile tripsin durdurma pipetleme karıştırılmakta ve içindekiler iki 96 oyuklu plakalar karşılık gelen satıra hücre süspansiyonu 100 ul transfer. Orta gazetesine değiştirin.
- Plakalar% 80-90 konfluent olduğunda, bir 'back-up' (detaylar için bölüm 2.2 bakınız) olarak plakaları bir set dondurma. Plakalarının diğer grubu aşağıda daha ayrıntılı olarak tarif edildiği gibi genişletilir.
- Genomik DNA izolasyonu için Genişleyen hücreler
- 96-çukurlu bir DNA plakası (ayrıntılar için bakınız 2.1.2) ve tek bir hücre süspansiyonu hazırlanır.
- Bir MICR kullanılarak 24 gözenekli bir plaka (4 total) oyuğuna 96 oyuklu plakanın her bir kuyudan hücre süspansiyonu aktarınopipette. 'Aldı' koloniler kökenli 'klonal' olarak herhangi bir hücre çapraz kontaminasyon, olduğundan emin olun. Kuyular kadar her gün ortam değiştirilerek 0,5 mi ES hücre ortamı içinde kültür hücreleri,% 80-90 konfluent.
NOT: 24-çukurlu plaka PCR analizi için, genomik DNA'nın yeterli verim sağlayacaktır.
PB Yerleştirme Siteleri ve Trapped Genlerin 5. Tanımlama
- 24 oyuklu plaka genomik DNA izolasyonu: Lyse 24 oyuklu plâkanın içindeki hücreler ve RNA içermeyen genomik DNA izole eder.
- 7,8 tarif edildiği gibi PB transpozon entegrasyon sahayı kuşatan sekans fragmanları üretmek için Splinkerette PCR (SpPCR) uygulayın.
NOT: SpPCR olsa zamanında eller her gün az, beş günlük bir süreçtir.
Mutant Klonların 6. Genetik Analiz
- Iyi usta bulun ve ilgi klon arındırmak.
- PB entegrasyon sitesi olmuştur zamaneşlenen bir PB ters primer (örneğin, PB3'-1) 8 ile kullanmak ve tekabül eden DNA plakası taranması için entegrasyon mevkinin üst akışında bir ileri primer tasarımı aynı 'alt kütüphane stres dayanıklı bir klon seçildi olan. Tüm 96 kuyu DNA plaka üzerinde tek olumlu kuyu bulmak için bekliyoruz. Besleyiciler üzerinde 24 plaka için 'Usta' plaka tam da bu çözülme ve% 80-90 confluency kadar hücreleri büyür.
NOT: Bu noktada, bu iyi gen tuzak klonlardan oluşan bir karışımı içerir. - 24-çukurlu plaka% 80-90 ortak akışlı, Hücreleri tripsinize edin ve 100 mm'lik besleme plakasındaki 1000 ES hücreleri plaka (tek bir hücre süspansiyonu sağlayacak) olduğunda. Passage genişlemesi için besleyici bir T25 balonuna kalan hücreler. Koloniler% 80-90 konfluent olduğunda T25 şişesi hücreleri dondurun. Yedekler olarak T25 şişesi başına 4 flakon dondurun.
- Koloniler 7 gün büyümeye ve daha sonra 96 oyuklu bir fe içine 96 almaya izin kolonilereder plaka. Prosedürü seçmek için bölüm 4.2 bakınız. Bir 'DNA' plakasına plaka hazır çoğaltmak ve plaka '-master 2 nci' gibi diğer dondurma (dondurma için bölüm 2.2 bakınız).
- Koloniler% 80-90 confluency ulaşmak için bekleyin. Ilgi saflaştırılmış klon içeren kuyu bulmak için DNA plakasını Ekran. 24-iyi ve daha sonra T25 şişesi (besleyiciler Tüm) 96 oyuklu 2. -master hücreleri plakadan aç. T25 şişesi başına 4 flakon dondurun.
NOT: Bu noktada, klonal bir gen tuzak hücre çizgisi, bir stres maruz ve fare üretim için uygundur edilmemiştir.
- PB entegrasyon sitesi olmuştur zamaneşlenen bir PB ters primer (örneğin, PB3'-1) 8 ile kullanmak ve tekabül eden DNA plakası taranması için entegrasyon mevkinin üst akışında bir ileri primer tasarımı aynı 'alt kütüphane stres dayanıklı bir klon seçildi olan. Tüm 96 kuyu DNA plaka üzerinde tek olumlu kuyu bulmak için bekliyoruz. Besleyiciler üzerinde 24 plaka için 'Usta' plaka tam da bu çözülme ve% 80-90 confluency kadar hücreleri büyür.
- PB yerleştirilmesi sayısını belirlemek: stres dirençli hücre hattının bir şişe çözülme ve jelatinize T25 balonuna hücreleri genişletin. Genomik DNA izole edin ve PB transpozonun kopya sayısı kontrol edin. Bu neomisin geni hedef qPCR elde edilebilir.
- Gen ekspresyonu seviyesini ölçmek: konfi sonrailgi hücre hattı tek bir PB entegrasyon olayı yoktur rming, her gen için spesifik Taqman probu kullanılarak RT-qPCR sıkışıp genin ifade seviyesini ölçer.
- Mutant mRNA sırası: Bir ekson bir üst astar tavlama ve gen tuzak kasetinin bağlayıcı alıcı dizisine bir alt astar tavlama kullanarak PCR ile bir cDNA amplikon oluşturun. Sıra cDNA fragmanı beklenen ekleme tuzağa gende meydana onaylamak için.
- Tuzağa gen ve stres direnci arasındaki nedensellik ilişkisini test etmek piggyBac transpozonun Remobilize.
- 24-48 saat tek T25 şişesi üzerinde PB remobilizasyon, çözülme ve plaka DR4 besleyiciler ve iki adet 100 mm'lik levhalar için hücreleri çözülme önce. DR4 besleyiciler T25 şişesi üzerine kaplanmıştır sonra en az bir gün, PB ilavesini içeren hücre çizgisinin bir vial çözülmesi ve DR4 besleyiciler ihtiva eden T25 şişesi içinde hücreler plaka. ES hücre ortamı hücreleri büyümek48 saat süre ile, her gün ortam değiştirilerek.
- ES hücrelerinin tek bir hücre süspansiyonu hazırlanır. Otomatik bir hücre sayacı ile hücre sayımı ve 15 ml'lik bir tüpe 5.0 x 10 6 ES hücreleri transferi. 100 xg'de Santrifüj, 800 ul PBS hücrelerin tekrar süspansiyon ve. 4 mm küvete süspansiyon aktarın.
- , Küvete 20 ug mPBase Puro ekle pipetleme karıştırın ve electroporate hücreler (detaylar için bölüm 1.4 bakınız). İki 100-mm DR4 besleme plâkalarına transfekte edilmiş hücrelerin dağıtın. Kültür hücreleri O / N ES hücre ortamı içinde.
- Ertesi sabah, 48 saat boyunca 1 ug / ml puromisin ve Kültür hücreleri ES ortamı ile hücrelerin beslenir. 5 gün boyunca hücrelerin puromisin seçimi çekiniz ve kültür devam ediyor. Koloniler toplama için yeterince büyük olduğunda, 96 çukurlu bir besleyici plaka (bölüm 4.2 bakınız) içine almak.
- Aldı hücreler% 80-90 confluency ulaştığında, bir DNA plaka içine plaka 1/6 inci bölmek ve pl 1/6 incidonmuş orijinal plaka hücrelerin 2/3 bırakarak, G418 tabağa yedik (dondurma için bölüm 2.2 bakınız).
- Kültür daha sonra DNA izolasyonu için ES hücre ortamı içinde, DNA plakası ve 150 ug / ml G418 içinde G418 plakası neomisin direnç kaybı test etmek için. G418 içeren kültür içinde 72-96 saat sonra hiçbir canlı hücreler ile Wells gen yakalama PB transpozonun başarılı remobilizasyon gösterir.
- 'DNA' plaka karşılık gelen kuyu kaldırıldı PB transpozonun onaylamak için PCR ile izleyicilerle buluşacak. DNA plakası% 90 konfluent olduğunda, yabani-türdeki dizinin restorasyonu ve geri dönüşü teyit etmek için bir araç olarak, neo-IRES bulunmaması için PCR taraması için 96 oyuklu bir plaka biçiminde, 4 genomik DNA izole eder.
- 24 plaka Master plakadan eşleşen kuyuları çözülme ve T25 şişesi (besleyiciler ile) genişletin. Back-up olarak T25 şişesi başına dört şişeleri dondurun.
Fare Mutantlarının 7. Nesil
- Master plakalardan dayanıklı ES hücreleri kurtarmak ve Chimera oluşturmak için embriyo enjeksiyon için bunları kullanın. Yaklaşık 15-20 ES hücreleri bağımsız bir C57BL / 6 blastokist içine enjekte edilir. Transfer yalancı kadın (suş ICR) rahmine fare başına 15 blastosist. Germ hattı iletimi için test etmek için, mutant farelerde bir koloni oluşturmak için çok sayıda genç bakire C57BL / 6J dişileri ile çöp geri kazanılır (ES hücreleri özel bir agouti kaplama renk ile belirtilir), erkek kimera Mate.
- Izole edin ve reaktif oksijen türleri (ROS) ve direnç seviyesi F1 mutant farelerde ve yabani tip yavru test kuyruk derisi fıbroblastları paraquat 9.
Sonuçlar
Tipik bir mutajenez deneyde, transfeksiyon PB-UPA ve MPB transpozaz ile 3 x 10 7 ES hücrelerinin toplam oluşur. Iki bağımsız deneyin üretilen gen tuzak ES hücre sayısı, Tablo 1 'de özetlenmiştir. Gen tuzak etkinliği, yaklaşık 0.04%' dir. Kombine gen tuzak kütüphaneleri 22400 bağımsız mutantlar, fare genomu hakkında tam bir kapsama (23.000 kodlayan genlerin) içerirler. Aşırı kapsama tekrarlanan mutasyon yoluyla daha mutantlar üreten ve / veya süreci ölçekleme elde edilebilir.
Gen-tuzak kütüphaneleri rastgele mutasyonlar içerdiğinden, bir stres direnci fenotip sahip mutantların sayısını tahmin etmek mümkün değildir. PQ direnci için iki bağımsız seçimler yapıldı; 22.440 bağımsız gen tuzağı mutasyonlarının kombine tarama PQ hücresel direnci (% 0.08) (Tablo 1) 17 kazandıran mutasyonlar ortaya çıkardı.
Biz daha fazla analiz ve fare üretimi için master plakalardan, 3 mutant klon, Pigl, Tiam1 ve R- arıtılmış var. Heterozigot R- mutasyonu ile hücreler başarılı bir şekilde BLM nakavt ile homozigot döl üretmek için uyarıldı. Ancak, Pigl ve Tiam1 mutantlardan ki tahminen bu, bir homozigosite-bağlantılı hücre öldürücülüğü herhangi bir homozigoz mutantları üretmek için başarısız oldu. 2-merkaptoetanol (2-ME) ve PQ ihmal (Şekil 2), bu saflaştırılmıştır klonların stres direnci stres 2 farklı tipleri kullanılarak teyit edilmiştir. Bu klonlar ile ilgili PB çıkarılması üzerine, ilişkili stres direnci fenotipi gen trap mutasyonları nedensel faktör olduğunu teyit eden (Şekil 2) kayboldu. Bu gözlenen fenotip nedeni olarak stres seçimi sırasında stokastik lezyonu ekarte gibi master plakalardan kurtarıldı klonların karakterizasyonu önemlidir.
3 OutMutant ES hücreleri, fare üretimi (Tablo 2), 2 hatları (Pigl ve Tiam1) tohum çizgisi iletimini göstermektedir için blastosist içeriye sokulur. R- enjeksiyonu ile başlayan kimeranın optimal sayı değil sadece bir kadın chimera üretti. Böylece, R- germline iletimi başarısızlığı nedeniyle bir beceriksiz chimera muhtemeldir. Biz Pigl mutant farelerden izole edilen deri fibroblastları hücresel fenotipi test ve PQ indirgenmiş endojen reaktif oksijen türlerinin seviyesi (ROS) ve gerilme dayanımı (Şekil 3), muhafaza gösterdi.
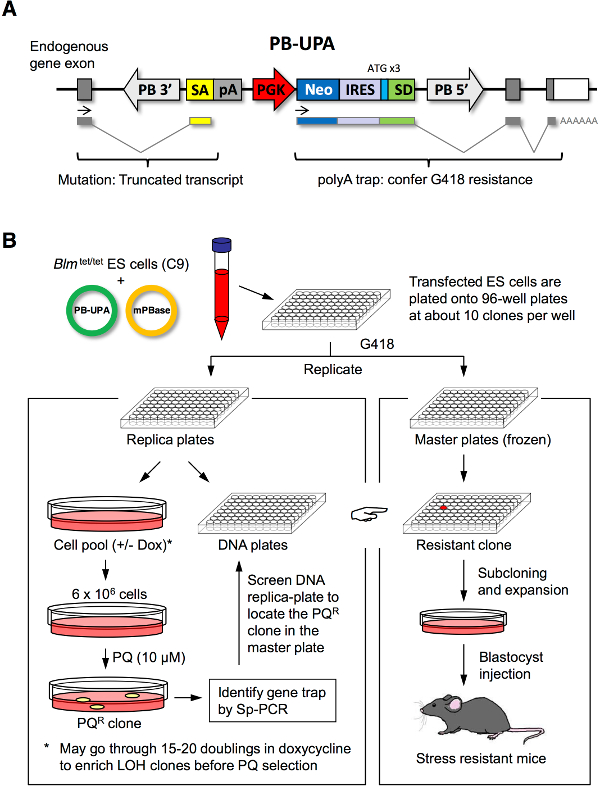
Şekil 1. ES hücre mutagenez ve stres seçimi. (A) PB-UPA vektör. Bir ekleme alıcı (SA), sığır büyüme hormonu poli-adenilasyon sinyali (pA) phosphog oluşan tarafsız bir poliA (BPA) tuzak vektörlycerate kinaz (PGK) promoteri, neomisin fosfotransferaz (neo), ensefalomiyokarditis (IRES), ve (3, farklı okuma çatılarında) bir bağlantı yeri donör yapay ATG ile (SD) 3 'ile takviye, piggyBac transposon klonlanmıştır ve 5 'uzun terminal tekrarı (LTR). Stres dirençli klonların (B) Rastgele ES hücrelerinin mutagenez ve seçme. ES hücreleri 96 oyuklu plakalar üzerine kaplama ardından PB-UPA ve mPBase elektroporasyon yoluyla birlikte transfekte edilir. Gen tuzak klonlar G418 direnci ile seçilmiştir; birleşmiş bir kez onlar 2 çoğaltma kümesi ayrıldı. Bir yineleme kümesi ayrıca paraquat (PQ) ile DNA izolasyonu ve stres seçimi için iki yarıya bölündü; Diğer yineleme kümesi (master) aşağı donduruldu. Stres tedavisi kurtarıldı kalan ES hücre kolonileri Sp-PCR ile PB yerleştirilmesi için moleküler analiz edildi. Astarlar sonra hangi iyi SIBLI içeren çoğaltma DNA plaka taranması için tasarlanmıştırng PQ R klon ana plakası üzerinde yer olabilir. Bu hücreler, farklı stres stres direnci deneyi için ve fare üretimi içindir. Chick vd. 7'den Modifiye. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Mutant ES hücreleri Şekil 2. Gerilme direnci. 2-merkaptoetanol (2-ME) çekilmesi (A) Direnç. (B) paraquat (PQ) karşı direnç. Önceki bir çalışmada 5 elde: (kırmızı 4C11), ve üç gen trap klon (gri), stres dayanıklı kontrol ES hücre klonu,: Ebeveyn doğal tipte ES hücreleri (sarı C9) gösterilmiştir. Hücreler, canlı hücre sayısı sayılmıştır, sonra iki gün süreyle tedavi stres tabi tutuldu. < em> Pigl, Tiam1 ve R- heterozigot. (PB / +: koyu gri), bu streslerinin hem sergi direnci R- homozigot (PB / PB: siyah) heterozigotlar kıyasla daha güçlü stres direnci gösterirler. (: Açık gri + / +) PB eklemeleri çıkarıldı her iki stres direnç kaybetti. Hata çubukları, ortalamanın SD temsil (n = 4). * P <0.001, # P = Student t-testi ile değerlendirildi gen trap klonlar ve vahşi tip ebeveyn C9 arasındaki 0,01. PQ (10 uM) tedavi edilen (C) ES hücre koloni oluşumu. Stres dayanıklı ES klonlan vahşi tip klonundan kolonilerin sayısı ve büyüklüğü önemli ölçüde azalır ise PQ tedavi altında kültür koloniler oluşturmak mümkün. Chick vd. 7'den Modifiye. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
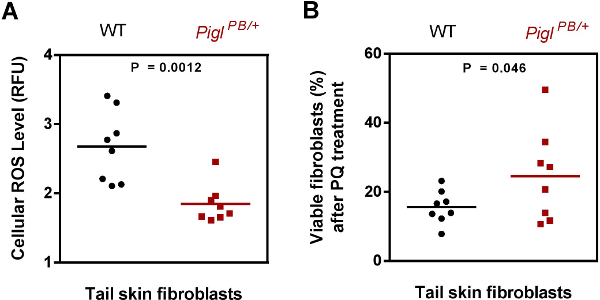
Pigl PB / + fibroblast Şekil 3. Karakterizasyonu. (A) Reaktif oksijen türleri (ROS) seviyesi. Vahşi tip (WT) ve Pigl PB / + farelerden izole edilen kuyruk derisi fıbroblastları CM-DCFCA ile boyandı ve floresan Hoechst karşı normalize edildi. ROS içeriği nispi floresan ünitesi (RFU) olarak ifade edildi. P değeri iki kuyruklu Student t-testi ile değerlendirildi (n = 8). (B) PQ direnç. Vahşi tip (WT) ve Pigl PB / + farelerin kuyruk derisi fıbroblastları hücrelerin yaşama yeteneği MTT tahlilleri ile ölçüldü sonra 6 saat için 4 mM PQ maruz bırakılmıştır. PQ tedaviden sonra canlı hücre yüzdesi, PQ-muamele ce elde edilen absorbans oranı hesaplanmıştırlls ve un-tedavi hücrelerden söyledi. P değeri bir kuyruklu Student t-testi ile değerlendirildi (n = 8). Chick vd. 7'den Modifiye. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
| Kütüphane | Alt kütüphaneler | ES hücre suşu | Gen tuzağa klonun sayılı | PQ R klon No. |
| 1 | C9PA01 - C9PA10 | C9 (Blm tet / tet) | 9000 | 7 |
| 2 | C9PA11 - C9PA20 | C9 (Blm tet / tet) | 13440 | 10 |
| Toplam | 22440 | 17 |
Tablo 1. piggyBac gen tuzak kütüphane yapımı ve PQ dirençli klonların kurtarma. Chick ark Modifiye. 7.
| ES hücre klonu enjekte | Chimera sayılı kurtarıldı | Germline iletimi * |
| Pigl PB / Pigl + | 4 | Evet |
| Tiam1 PB / Tiam1 + | 2 | Evet |
| R- PB / R- + | 1 | Hayır |
Farelerin Tablo 2. Nesil. Chick ark. 7'den Modifiye.
* Germline iletim PCR genotiplemesiyle tarafından tespit edilen gen tuzak allelinin miras yoluyla teyit edilmiştir.
Tartışmalar
Forward genetic analysis allows for an unbiased interrogation of the genome for genes responsible for a specific phenotype. This method is very powerful to uncover novel gene functions. It has been widely used in lower organisms but not in mammal, such as the mouse, mainly due to the extremely high cost associated with the infrastructure and logistics that would entail. Here, we moved the genetic screening process to the ES cell culture platform, greatly increasing the efficiency and throughput in generating mutants and identifying mutations.
To effectively select for resistant mutants, a lethal dose of stressor and period of treatment needs to be established such that all of the wild-type cells would be killed. The higher the stringency of the selection, the fewer occurrence of false positive will result. Fibroblast feeders have a higher tolerance to oxidative stress than ES cells; the presence of feeders would rescue the nearby ES cells which would otherwise be killed by the stressor. Thus, omission of feeders during stress selection was very critical for an effective killing. In skin fibroblasts, serum deprivation was necessary to reveal the stress resistance phenotype in long lived mice 10. However, this application was not feasible in ES cells because they cannot survive without serum. As an alternative, we discovered that the use of heat inactivated serum at reduced level (7.5%) achieved a similar result.
In this report, we employed poly-A trap rather than a promoter trap because promoter trap will only trap actively transcribed genes, which is estimated to be 60% of the genome in ES cells, under normal conditions 11. In contrast, a poly-A trap would trap genes regardless of their transcriptional activities, in theory giving us the potential to screen for mutations in all genes in the genome. A major drawback of the conventional poly-A trap is the strong bias towards trapping the last exon, appeared to be mediated by an endogenous nonsense-mediated decay (NMD) mechanism 12. By incorporating the unbiased poly-A trap (UPA) strategy in the PB-UPA transposon to suppresses NMD 13, we were able to eliminate biased trapping.
One distinguishing advantage of using ES cells is that these pluripotent cells make direct derivation of mice possible, speeding up the transition to in vivo studies. For this to happen, the replica plating strategy is critical, preserving a subset of clones sheltered from manipulations that can diminish pluripotency, such as knocking out of Blm and exposure to stressors. We have shown that mutant ES cells recovered from these screens were capable of participating in forming the entire mouse and transmitting the mutations to the germline. Most importantly, consistent with previous studies, the stress resistance phenotype was also transmitted and maintained in the adult mouse.
We and others showed that a variant phenotype observed in ES cells resulting from environmental induced lesion or deliberated engineered mutations was able to transmit to the differentiated progeny cells 4,5,9,14, and probably the whole mouse. This protocol describes the utilization of ES cells as surrogate cells to screen for stress resistance mutations in the mouse. In addition to screening for stress resistance genes, this method may have a broader implication to screen ES cells, identify targets, and to develop a variety of mouse models with a phenotype of interest.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
We would like to thank the Wellcome Trust Sanger Institute for the gifts of piggyBac transposon and piggyBac transposase. This work was supported by the Butcher grant of Colorado and the NIH R01 AG041801 (W.S.C).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Vector | |||
| PB-UPA | |||
| mPBase | |||
| mPBasePuro | |||
| Tissue Culture | |||
| 500-ml Stericup filters | EMD Millipore | SCGPU05RE | |
| 250-ml Stericup filters | EMD Millipore | SCGPU02RE | |
| 50-ml Steriflip-GV filters | EMD Millipore | SE1M179M6 | |
| KO DMEM | Life Technologies | 10829-018 | |
| DMEM | Sigma-Aldrich | D6429 | |
| FBS | Tissue Culture Biologicals | 104 | |
| Heat Inactivated FBS | Sigma-Aldrich | F4135-500 | |
| LIF | EMD Millipore | ESG1107 | |
| Non-essential Amino Acids | Life Technologies | 11140-050 | |
| GlutaMAX | Life Technologies | 35050-061 | |
| Pen/Strep | Life Technologies | 15140148 | |
| β-Mercaptoethanol | Life Technologies | 21985-023 | |
| Methyl Viologen dichloride (Paraquat) | Sigma-Aldrich | 856177 | |
| Dimethyl Sulphoxide Hybri-MAX | Sigma-Aldrich | D2650 | |
| EmbryoMAX 0.1% gelatin | EMD Millipore | ES006B | |
| DPBS/Modified | HyClone | SH30028.02 | |
| 0.25% Trypsin-EDTA | Life Technologies | 25200-056 | |
| T25 Flask | Corning | 353108 | |
| T75 flask | Corning | 353135 | |
| 100-mm plate | Corning | 353003 | |
| 150-mm plate | Corning | 430599 | |
| 96-well plate | Corning | 3585 | |
| 96-well U-bottom plate | Corning | 3799 | |
| 24-well plate | Corning | 3526 | |
| 50-ml reservoir | Corning | 4870 | |
| 15-ml tubes | VWR International, LLC | 82050-276 | |
| Primary Mouse Embryonic Fibroblasts | EMD Millipore | PMEF-NL | |
| DR4 Mouse Embryonic Fibroblasts | Applied StemCell | ASF-1001 | |
| Mitomycin C | Fisher BioReagents | BP25312 | |
| Geneticin (G418) | Life Technologies | 11811-023 | |
| Doxycycline | Fisher BioReagents | BP26531 | |
| Cryotubes | Thermo Scientific | 377267 | |
| Centrifuge | Eppendorf | Centrifuge 5702 | |
| TC10 cell counter | Bio-Rad | ||
| Counting Slides (for TC10) | Bio-Rad | 1450011 | |
| Electroporation | |||
| Gene Pulser Xcell | Bio-Rad | 1652611 | |
| Gene Pulser Cuvettes (4 mm gap) | Bio-Rad | 1652088 | |
| Molecular Biology | |||
| Thermal Cycler | Eppendorf | Mastercylcer ep Gradient S | |
| Puregene Core kit B | Qiagen | 158745 | |
| Topo-TA Cloning kit | Life Technologies | 450030 | |
| High Capacity cDNA synthesis kit | Applied Biosystems | 4368814 | |
| NaCl | Fisher BioReagents | BP358-212 | |
| 100% ethanol | Decon Laboratories, Inc. | 2716 | |
| Double Processed Tissue Culture Water | Sigma-Aldrich | W3500 | |
| Sau3A1 | New England BioLabs | R0169L | |
| T4 DNA Ligase | New England BioLabs | M0202T | |
| EcoRV | New England BioLabs | R3195S | |
| 96-well Lysis Buffer (Ramires-Solis et al. 1992) | |||
| Trizma Base | Sigma-Aldrich | T1503 | |
| Hydrochloric Acid | Fisher BioReagents | A144-212 | |
| EDTA | Sigma-Aldrich | E5134 | |
| N-Lauroylsarcosine sodium salt | Sigma-Aldrich | L5777 | |
| Proteinase-K | Fisher BioReagents | BP1700 | |
| Electrophoresis | |||
| Mini-Sub Cell GT | Bio-Rad | 170-4469EDU | |
| LE Agarose | GeneMate | E3120500 | |
| Ethidium Bromide | Fisher BioReagents | BP1302 | |
| 100 BP DNA Ladder | New England BioLabs | N3231S | |
| 1Kb DNA Ladder | New England BioLabs | N3232S | |
| 2-log DNA Ladder | New England BioLabs | N3200L |
Referanslar
- Johnson, T. E., et al. Longevity genes in the nematode Caenorhabditis elegans also mediate increased resistance to stress and prevent disease. J Inherit Metab Dis. 25, 197-206 (2002).
- Murakami, S., Salmon, A., Miller, R. A. Multiplex stress resistance in cells from long-lived dwarf mice. Faseb J. 17, 1565-1566 (2003).
- Perez, V. I., et al. The overexpression of major antioxidant enzymes does not extend the lifespan of mice. Aging Cell. 8, 73-75 (2009).
- Martin, G. M. Genetic engineering of mice to test the oxidative damage theory of aging. Ann NY Acad Sci. 1055, 26-34 (2005).
- Chick, W. S., Drechsel, D. A., Hammond, W., Patel, M., Johnson, T. E. Transmission of mutant phenotypes from ES cells to adult mice. Mamm Genome. 20, 734-740 (2009).
- Ramirez-Solis, R., et al. Genomic DNA microextraction: a method to screen numerous samples. Anal Biochem. 201, 331-335 (1992).
- Uren, A. G., et al. A high-throughput splinkerette-PCR method for the isolation and sequencing of retroviral insertion sites. Nat Protoc. 4, 789-798 (2009).
- Wang, W., Bradley, A., Huang, Y. A piggyBac transposon-based genome-wide library of insertionally mutated Blm-deficient murine ES cells. Genome Res. 19, 667-673 (2009).
- Chick, W. S., et al. Screening for stress-resistance mutations in the mouse. Front Genet. 5, 310 (2014).
- Salmon, A. B., et al. Fibroblast cell lines from young adult mice of long-lived mutant strains are resistant to multiple forms of stress. Am J Physiol Endocrinol Metab. 289, 23-29 (2005).
- Skarnes, W. C., et al. A public gene trap resource for mouse functional genomics. Nat Genet. 36, 543-544 (2015).
- Baker, K. E., Parker, R. Nonsense-mediated mRNA decay: terminating erroneous gene expression. Curr Opin Cell Biol. 16, 293-299 (2004).
- Shigeoka, T., Kawaichi, M., Ishida, Y. Suppression of nonsense-mediated mRNA decay permits unbiased gene trapping in mouse embryonic stem cells. Nucleic Acids Res. 33, e20 (2004).
- Symula, D. J., Zhu, Y., Schimenti, J. C., Rubin, E. M. Functional annotation of mouse mutations in embryonic stem cells by use of expression profiling. Mamm Genome. 15, 1-13 (2004).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır