Method Article
גישה גנטית קדימה ללחשוף גני התנגדות מתח בעכברים - מסך תפוקה גבוהה בתאי גזע עובריים
In This Article
Summary
התנגדות מתח היא אחד מסימני ההיכר לאריכות ימים, והוא ידוע להיות נשלטת גנטי. כאן, פיתחנו שיטת תפוקה גבוהה משוחדת למסך למוטציות המעניקות התנגדות מתח בתאי גזע עובריים שבה לפתח מודלים של עכברים ללימודי אריכות ימים.
Abstract
Phenotype-driven genetic screens in mice is a powerful technique to uncover gene functions, but are often hampered by extremely high costs, which severely limits its potential. We describe here the use of mouse embryonic stem (ES) cells as surrogate cells to screen for a phenotype of interest and subsequently introduce these cells into a host embryo to develop into a living mouse carrying the phenotype. This method provides (1) a cost effective, high-throughput platform for genetic screen in mammalian cells; (2) a rapid way to identify the mutated genes and verify causality; and (3) a short-cut to develop mouse mutants directly from these selected ES cells for whole animal studies. We demonstrated the use of paraquat (PQ) to select resistant mutants and identify mutations that confer oxidative stress resistance. Other stressors or cytotoxic compounds may also be used to screen for resistant mutants to uncover novel genetic determinants of a variety of cellular stress resistance.
Introduction
יש אריכות ימים מערכת יחסים אינטימיות עם התנגדות ללחץ. באופן כללי, מיני חיים ארוכים לעתים קרובות להפגין גדלו התנגדות ללחצים מרובים, כגון מי חמצן, paraquat (PQ), UV, חום, ומתכות כבדות 1,2. לעומת זאת, רגישות מוגברת ללחץ נוטה לנבא תוחלת חיים מקוצרים ו / או פנוטיפ מחלה נוטה יותר. מסלול הדחה נוגד החמצון כבר זמן רב העריך לשחק תפקיד מרכזי בהענקת התנגדות מתח לבעלי החיים. עם זאת, עם כמה יוצאים מן הכלל, מחקרים ממגוון רחב של בעלי חיים מהונדסים עם מניפולציות באנזימים שונים נוגד חמצון (לדוגמא, SOD) מצביעים על כך שהגדלת רמת אנזימי הדחה חמצון אינו מגבירה את תוחלת חיים או בריאות תוחלת 3. נתונים אלה מצביעים על כך שתכונת התנגדות המתח נצפתה באופן עקבי בבעלי חיים חיים ארוכים מתווכת על ידי מסלולים סלולריים אחרים עדיין לא נחשפו.
לקחנו קדימה משוחדגישה גנטית לזיהוי גנים, אשר על מוטציה, יכול להעניק הפנוטיפ התנגדות מתח בתאי גזע עוברי בתרבית (ES). תאי גזע עובריים מציעים שני יתרונות עיקריים במחקר זה: (1) מניפולציות גנטיות מתוחכמות זמינות כדי לשנות את הגנום של תאי גזע עובריים; ו- (2) בכל תאי גזע עובריים עמידים לחץ התאוששו מהמסך ניתן להשתמש ישירות לייצור עכבר, המאפשרים תרגום מהיר למחקרים בבעלי חיים שלמים כדי למדוד את תוחלת חיים ותוחלת בריאות.
בדו"ח זה, שתארנו את השימוש בקו תא C9 ES, שבו אללים BLM היו בשליטה על ידי אלמנט תגובה טטרציקלין. הטיפול בדוקסיציקלין (DOX) כבוי זמני הביטוי של BLM המוביל לאירוע מוגבר של בורסה כרומטידה אחות. לטווח קצר זה BLM נוק-אאוט אפשר לדור של מוטציות הומוזיגוטים בתוך אוכלוסיית heterozygote כך שמוטציות רצסיבי להתנגדות ללחץ יכולות להיות שנתפסו בתהליך המיון. אנחנוגם תאר את השימוש בpiggyBac transposon (PB) כmutagen להכניס באופן אקראי פולי-קלטת מלכודת (PB-UPA) להשתנות גנים בגנום. תאים עם הפרעה של גן על ידי פולי-מלכודת הפכו G418 עמידים ויכולים להיות התאוששו, כך שאוסף של מוטציות גנטי מלכודת (ספריית גן-מלכודת) יכול להתבצע, ולאחר מכן הוקרן לשיבוטי מוטציה שהיו מתח עמיד.
שיבוטים עמידים מתח התאוששו מהבחירה יכולים להיות מאופיינים ולא במהירות על ידי טכניקות מולקולריות בהקשר של מספר ההוספות (qPCR), האתר של הכנסה (splinkerette PCR), את זהותו של הגן שיבש (פיצוץ), ורמת הביטוי שלה ( RT-qPCR). הכנסת PB יכולה להיות remobilized על ידי ביטוי חולף של transposase MPB בשיבוט כדי לשחזר את רצף ה- DNA wild-type ובכך לבדוק את אובדן התנגדות לחץ. אלה הם דרכים רבות עוצמה כדי לאשר סיבתיות של המוטציה, אשר צריך להיעשות לפנילייצור עכבר יקר. מחקרים קודמים הראו כי תאים שנחשפו ללחצים איבדו 4.5 pluripotency. כך, בפרוטוקול זה, השמירה על העתק קבוצה של תאים שעברו מוטציה, שלא להיות מטופלים עם גורמי לחץ היא קריטית לייצור עכבר מוצלח.
המעבדה שלנו מהונדסת קו תא C9 ES ווקטור PB-UPA, שניהם זמינות לחוקרים אחרים על פי דרישה. הפרוטוקול דיווח כאן יתחיל בדור של ספריית דה נובו של תאים לכודים גן ES עם PB-UPA (איור 1 א), ואחריו ציפוי העתק ובחירת מתח כדי לבודד שיבוטים לחץ עמידים (איור 1). אנחנו הוכחנו את הבחירה בparaquat, גנרטור רדיקלים חופשי חזק בתוך תאים. כמעט, כל מתחם ציטוטוקסיות או רעלן, למשל, גורמי לחץ ER (למשל, thapsigargin וtunicamycin), חמצון עצבי (למשל, MPP +, דופמין 6-הידרוקסי, וrotenone), חום, וכבדמתכות (למשל, CD, Se), יכולות להיות מותאמות לשיטה כדי לבחור למוטציות עמידות בהתאמה.
Protocol
1. תא ES-לכוד ג'ין ספריית בנייה באמצעות piggyBac טרנספוזון
- הכן fibroblasts העכבר העיקרי העוברי (PMEF) כמתקני האכלה לתרבות תאי גזע עובריים
- להפשיר בקבוקון אחד של PMEF mitomycin מומת C (5.0 x 10 6) באמבט מים 37 מעלות צלזיוס. להעביר את התאים לתוך 5 מיליליטר של מדיום בתאי הגזע העובריים (DMEM המכיל 15% FBS, 1,000 יחידה / מיליליטר של גורמים מעכבים לוקמיה, 100 מיקרומטר חומצות אמינו חיוניים, 2 גלוטמין מ"מ, 55 מיקרומטר 2-mercaptoethanol, ו -25 יחידות / מיליליטר פניצילין / סטרפטומיצין ), וצנטריפוגות ב 5 דקות 100 XG.
- לשאוב supernatant וresuspend התאים 30 מיליליטר של מדיום בתאי הגזע העובריים ואחרי החלוקה לשתי צלוחיות T25 (5 מיליליטר כל אחד) ושתי צלחות 100 מ"מ (10 מיליליטר כל אחד). לדגור על 37 מעלות צלזיוס, 5% CO 2 למשך 24 שעות.
- תרבות ולהרחיב את תאי C9 ES
- להפשיר בקבוקון אחד של תאי C9 ES (2.5 x 10 6 תאים ב0.5 מיליליטר) באמבט מים 37 מעלות צלזיוס ולהעביר אתתאים לתוך 5 מיליליטר של מדיום בתאי גזע עובריים. צנטריפוגה ב 100 XG במשך 5 דקות.
- לשאוב supernatant ותאי גזע עובריים גלולים ב 5 מיליליטר של מדיום בתאי גזע עובריים ואחריו ציפוי לתוך בקבוק מזין T25. לדגור על 37 מעלות צלזיוס, 5% CO 2. החלף בינוני בתאי גזע עובריים יומי.
- אחרי 2 ימים של תרבות, תאי הגזע העובריים צריכים להיות מחוברות ~ 80%, והם מוכנים להיות passaged. לשטוף את התאים עם 5 מיליליטר של PBS (ללא Ca 2 + וMg 2 +) ולאחר מכן להוסיף 2.5 מיליליטר מראש חימם 0.25% טריפסין- EDTA. לדגור על 37 מעלות צלזיוס למשך 10 דקות. להוסיף 2.5 מיליליטר בינוני בתאי גזע עובריים להפסיק טריפסין; פיפטה למעלה ולמטה 15 פעמים כדי לשבור את גושי תאים. צנטריפוגה ב 100 XG במשך 5 דקות.
- לשאוב את תאי supernatant ו resuspend ב 4 מיליליטר של מדיום בתאי גזע עובריים. העברה 1 מיליליטר של תאים לכל צלחת 100 מ"מ המכילה מדיום סלולארי 9 ES מיליליטר; להכין שתי צלחות 100 מ"מ. זה 1: 8 מעבר. להאכיל את התאים יומיים עם 10 מיליליטר בינוני בתאי גזע עובריים.
- הכן 96-גם צלחות מזין לספרייה
- כפי שתואר ב1.1.1, להפשיר שלושה בקבוקונים של mitomycin-C מומת PMEF (כל 5 x 10 6 תאים המכילים) ותאים גלולים מכל בקבוקון עם מדיום סלולארי ES 33.3 מיליליטר. לשלב תאים להניב השעיה תא 100 מ"ל.
- צלחת 100 תאי μl לכל גם על עשר 96-גם צלחות. צריכה להיות מוכנות צלחות מזין 96-גם אלה לפחות יום אחד לפני transfecting תאי C9 ES עם transposon PB.
- Electroporation של תאי C9 ES עם וקטור PB-UPA
- Trypsinize ולספור את תאי C9 ES המורחב באמצעות דלפק תא אוטומטי. לשטוף כל צלחת 100 מ"מ של תאי C9 ES עם 10 מיליליטר PBS. הוסף 8 מיליליטר מראש חימם 0.25% טריפסין- EDTA ולדגור על 37 מעלות צלזיוס למשך 10 דקות.
- תפסיק טריפסין ידי הוספת מדיום סלולארי 2 ES מיליליטר. מעבירים את ההשעיה תא צינור 15 מ"ל ופיפטה למעלה ולמטה 15 פעמים להתפרק גושי תא. מייד צנטריפוגות ב 100 XG במשך 5 דקות ואחריו aspirating supernatant.
- תא גלולים ב 10 מדיום סלולארי ES מיליליטר ולספור את תאי הגזע העובריים באמצעות hemocytometer. הכן שישה צינורות 15 מ"ל של השעיה תא כל 5 x 10 6 תאי גזע עובריים המכילים. צנטריפוגה ב 100 XG במשך 5 דקות. לשאוב supernatant ו resuspend כל גלולה תא ב0.8 מיליליטר PBS.
- הכן שש cuvettes electroporation (4 פער מ"מ) כדי ש0.8 מיליליטר התאים מועברים. לכל קובט, להוסיף 1 מיקרוגרם PB-UPA ו -20 מיקרוגרם transposase MPB (mPBase); מערבב בעדינות על ידי pipetting למעלה ולמטה. שים cuvettes על קרח. בצע electroporation עם electroporator באמצעות הגדרת מעריכי ב 250 V, 500 μF, ואוהם אינסוף.
הערה: בדרך כלל, קבוע הזמן הוא על 10 עד 12 אלפיות שניים לelectroporation מוצלח, שיניבו כ -1,500 עד 2,000 G418 transformants עמיד לכל 5 x 10 6 תאים. - אחזר וברכת תאי transfected לבקבוק T75 המכיל מדיום סלולארי 98 ES מיליליטר. מערבבים את התאים על ידי pipetting העדין ולאחר מכן להעביר תאים למאגר (50 מיליליטר). לָנוּing פיפטה 12 ערוצים, להעביר 100 μl של תאים לכל גם לצלחות מזין 96-גם בעבר הכין (10 בסך הכל). לדגור על 37 מעלות צלזיוס, 5% CO 2.
- לאחר 24 שעות, להאכיל את התאים יומיים עם G418 הטרי ES הבינוני תא המכיל (150 מיקרוגרם / מיליליטר) כדי לבחור עבור שיבוטים-לכוד גן.
הערה: בדרך כלל כל הטוב יכיל כעשר G418 מושבות עמידות. כאשר מושבות אלה יגדלו לגודל מספיק (בדרך כלל 5-7 ימים), 96-גם הצלחות (הספרייה) תהיה משוכפלת ל -2 סטים לאחסון ובחירה, בהתאמה. כל צלחת בספרייה מיועדת כ'תת-ספרייה ", כך במקרה זה, יש 10 תת-ספריות.
2. ספריית שכפול
- לשכפל צלחות מאסטר
- 24-48 שעות לפני המושבות עמידות G418 מגיעים 50-60% confluency, להפשיר שלושה בקבוקונים אחר של PMEF מומת C mitomycin על עשרה לוחות 96-גם מתקני האכלה (ראה סעיף 1.3). ג'לטיןize עשר 96-גם צלחות על ידי דוגרים ג'לטין 0.1% (μl 100 / טוב) על 37 מעלות צלזיוס לפחות 15 - 30 דקות; O / הדגירה N היא מקובלת.
- הכן השעיות תא בודדות ב96-גם צלחות על ידי trypsinization. בינוני לשאוב מ96-גם צלחות ולשטוף פעם אחת עם נפח שווה של PBS (ללא Ca 2 +, Mg 2 +). הוסף 50 μl של 0.25% טריפסין- EDTA מראש חימם, לדגור על 37 מעלות צלזיוס ב 5% CO 2 למשך 10 דקות. תפסיק טריפסין עם 50 μl של מדיום בתאי גזע עובריים. להתפרק גושי תאים על ידי pipetting למעלה ולמטה 15 פעמים עם פיפטה רבת ערוצים.
- העברה 50 μl של השעיה תא trypsinized לשורה המקבילה צלחת המזין (מאסטר) כבר מכילה 150 מדיום סלולארי μl ES וμl 50 נותר לשורה המקבילה צלחת gelatinized (העתק) כבר מכיל 150 μl בינוני בתאי גזע עובריים. לעבד כל שורה של תאים לצלחת מאסטר והעתק. דגירה הצלחות (כיום מכילה ג 200 μlulture נפח) על 37 מעלות צלזיוס, 5% CO 2 O / N.
הערה: כיום יש עשרים 96-גם צלחות. - למחרת להאכיל את התאים עם 100 μl מדיום סלולארי טרי ES מכיל G418 / מיליליטר 150 מיקרוגרם. החלף את המדיום יומי עד הבארות הן 80-90% ומחוברות.
- להקפיא את צלחות מאסטר
- כאשר צלחות האדון הן כ -80% ומחוברות, trypsinize התאים כפי שתואר (ראה סעיף 2.1.2).
- הסר את הצלחות ולעצור תגובת טריפסין עם 50 μl של 2x הקפאה בינוני (60% בינוניים בתאי גזע עובריים, 20% FBS, 20% DMSO). פיפטה למעלה ולמטה 10 פעמים עם פיפטה רבה כדי להבטיח ערבוב נכון של מדיום ההקפאה.
- שים את צלחות 96-היטב בקופסא קלקר סגורה היטב ולמקם אותו במקפיא -80 מעלות צלזיוס לאחסון של עד ארבעה חודשים. ארבעה חודשים יאפשר מספיק זמן כדי להשלים את בחירת המתח ולזהות בי בארות מצלחת מאסטר מכילות את השיבוטים של עניין.
הערה: אחסון ב -80 & #176; C יותר מ -4 חודשים יגרמו ירידה של כדאיות תא. אפשר לנצל cryo-צינורות ב96-גם בפורמט שניתן לאחסן בשלב האדים של חנקן נוזלי לתקופה ארוכה של אחסון.
- הכן צלחות DNA ובריכות תת-ספרייה מצלחות העתק
- 24-48 שעות לפני משכפלים נוסף לצלחות DNA ובריכות תת-ספרייה, להכין עשר צלחות 100 מ"מ עם PMEF מומת C mitomycin לבריכה תת-ספרייה, ועשר gelatinized 96-גם צלחות לצלחת ה- DNA משכפל. עיין בסעיף 1.3 לנוהל כללי.
- Trypsinize התאים בצלחות העתק 96-היטב (ראה סעיף 2.1.2). במהלך שלב trypsinization 10 דקות, ג'לטין לשאוב מהצלחות DNA ולהחליף עם G418 150 μl בינוני בתאי גזע עובריים המכיל (150 מיקרוגרם / מיליליטר). כמו כן, להכין מאגר המכיל 5 מיליליטר של מדיום בתאי גזע עובריים לאיגום של 'תת-הספריות' לתוך צלחת מזין 100 מ"מ.
- בעקבות trypsinization, מפסיק לנסותpsin עם 50 μl של שורה אחת בינונית בתאי גזע עובריים בזמן בעזרת פיפטה 12 ערוצים. פיפטה למעלה ולמטה 10 פעמים להתפרק גושי תא.
- העברה 50 μl של ההשעיה התא לשורה המקבילה צלחת ה- DNA ולהעביר את 50 μl נותר למאגר המכיל מדיום סלולארי 5 ES מיליליטר. לאחר שסיים את צלחת 96-היטב אחד מלאה, לשאוב את המדיום של צלחת מזין 100 מ"מ שהתאים נקוו מועברים. נקווה תאי mutagenized הללו מיועדים 'תת-ספרייה ".
- חזור לתשע 96-גם צלחות שנותרו. להאכיל את צלחות DNA 96-היטב וצלחות 100 מ"מ נקווה 'תת-ספרייה' יומי עם G418 בינוני בתאי גזע עובריים המכיל (150 מיקרוגרם / מיליליטר).
הערה: כיום יש עשר 96-גם צלחות "DNA", וצלחות עשר 100 מ"מ 'תת-ספרייה ".
- להקפיא את צלחות DNA. כאשר התאים בצלחת ה- DNA הם 80-90% ומחוברות, לשאוב את המדיום, לשטוף את התאים פעמיים עם 100μl PBS ולאחסן ב -20 ° C לבידוד הדנ"א הגנומי מאוחר יותר 6. צלחות DNA אלה יוקרנו על ידי PCR לזהות שמתאים היטב בצלחת "מאסטר" מכילה את השיבוט של עניין.
3. מוטציות הומוזיגוטים מושרה דוקסיציקלין
- להקפיא את הבריכות תת-ספרייה ותאי מעבר לטיפול בדוקסיציקלין
- 24 שעות לפני צלחות 100 מ"מ "תת-ספרייה" יש מושבות גדולות מספיק כדי להניב 70-80% confluency, להכין סט של עשרה gelatinized צלחות 100 מ"מ לטיפול דוקסיציקלין.
- הכן השעיות תא בודדות של כל תת-ספרייה (ראה סעיף 1.4.1 ו1.4.2 לפרטים נוספים). העברת 5 x 10 6 תאים לצלחת 100 מ"מ gelatinized עם דוקסיציקלין (1 מיקרוגרם / מיליליטר); לדגור על 37 מעלות צלזיוס, 5% CO 2. להקפיא את הבריכות שאינם דוקסיציקלין שנותרו טופלו תת-ספרייה בשעת 5 x 10 6 תאים לכל בקבוקון.
- תאי מעבר בנוכחותשל דוקסיציקלין לדפוק את BLM
- מעבר תת-הספריות ב1: 8 כל 2-3 ימים בנוכחות דוקסיציקלין (1 מיקרוגרם / מיליליטר) לתקופה של עד שבועיים, במהלכן DOX מושרה נוק-אאוט של BLM יקדם אובדן הטרוזיגוטיות בתא אוכלוסייה, המאפשר לדור של מוטציות הומוזיגוטים.
4. בחירת מתח ובידוד של המשובטים עמידים
- תאים שטופל דוקסיציקלין נושא לבחירת מתח
- עשר 24 שעות לפני passaging תאים שטופלו דוקסיציקלין לבחירת מתח, להכין gelatinized צלחות 150 מ"מ, מקום ב37 ° C, 2 באינקובטור humidified 5% CO.
- הכן השעיה תא בודדת של כל תת-ספרייה ידי trypsinization (ראה סעיף 1.4.1 ו1.4.2 לפרטים נוספים). זרעי 6.6 x 10 6 תאים על כל צלחת 150 מ"מ בסך הכל 30 מיליליטר תרבות נפח, להפיץ תאים באופן שווה. דגירה תאים עם לחץ (10 מיקרומטר paraquat או מחדל של β-mercaptoethanol,במדיום סלולארי ES מכיל חום 7.5% מובטל FBS) במשך 7 ימים, לאחר שיחליפו עם מדיום סלולארי ES רגיל כדי לאפשר לתאים לשרוד לגדול לתוך מושבות לקטיף.
- אופציונאלי: להקפיא את השמאל על תאים שטופל דוקסיציקלין על 5.0 x 10 6 תאים לכל בקבוקון.
- פיק מושבות עמידות מתח
- לאחר החזרת תקשורת נורמלית במשך שבוע, לצפות כמה לחץ מושבות עמידות נוכחים. בהתאם למספר מושבות שיאספו, להכין מספיק בארות עם PMEF מומת C mitomycin על 96-גם צלחות יום אחד לפני כן בהתאם (ראה סעיף 1.1 לפרטים נוספים).
- ביום קטיף, לשאוב ולהחליף בינוני בצלחת מזין 96-היטב עם 100 μl מדיום סלולארי ES טרי, להציב בחזרה ל37 מעלות צלזיוס, 5% 2 חממת humidified CO. בשלב זה, להכין צלחת 96-היטב U-תחתונה עם 50 μl 0.25% טריפסין-EDTA בכל טוב. בינוני לשאוב מצלחת בחירת מתח 150 מ"מ ולהוסיף דוארנפח qual של PBS.
- הגדר את micropipette 2 μl, ו 'להרים' ששרד מושבות לטריפסין U-התחתון המכילות בארות, לקטוף מושבה אחת בכל טוב. זה מקובל לתת לצלחת לשבת על RT עד המספר הרצוי של מושבות כבר הרים. לאחר מכן, דגירה הצלחת התחתונה U על 37 מעלות צלזיוס, 5% CO 2 למשך 10 דקות.
הערה: בדרך כלל, אנחנו לוקחים 1 שעה לאסוף 96 מושבות. - קץ טריפסין שורה אחת בכל פעם עם 50 μl בינוני בתאי גזע עובריים באמצעות פיפטה רבה. פיפטה 15 פעמים למעלה ולמטה כדי לקבל השעיה תא בודדת ולהעביר תאי 100 μl לשורה המקבילה צלחת המזין המכילה כבר של מדיום סלולארי ES 100 μl. להשלים את ההעברה לכל הצלחת. תרבות תאי O / N ב -200 μl. בוקר, בינוני לשאוב והבא להחליף עם 100 μl בינוני בתאי גזע עובריים.
- לשכפל צלחות 96-היטב
- כאשר הבארות של המושבות הרימו הן conflue 80-90%NT, לשכפל לשתי צלחות תואמות, אחד לבידוד DNA ואחר לתאי גיבוי. צלחות אלה gelatinized ואינו מכילות PMEF מומת C mitomycin.
- בינוני לשאוב, ולשטוף עם 100 μl PBS. הוסף 50 μl 0.25% טריפסין-EDTA היטב כל אחד, לדגור על 37 מעלות צלזיוס למשך 10 דקות. לעצור את טריפסין עם מדיום סלולארי ES 150 μl, לערבב ידי pipetting, ולהעביר את ההשעיה תא 100 μl לשורה המקבילה של שתי צלחות 96-היטב. שנה בינונית יומי.
- כאשר הצלחות הן 80-90% ומחוברות, להקפיא סט אחד של צלחות כ'גיבוי '(ראה סעיף 2.2 לפרטים נוספים). הסט האחר של צלחות מורחבים נוסף כמפורט להלן.
- תאי הרחבת לבידוד הדנ"א הגנומי
- הכן השעיה תא בודדת בצלחת ה- DNA 96-היטב (עיין 2.1.2 לפרטים נוספים).
- העבר את ההשעיה תא מכל טוב בודד של הצלחת 96-היטב לטובה של 24 גם צלחת (4 סך הכל) באמצעות MICRopipette. ודא שאין זיהום צולב של כל תאים, כמושבות 'הרימו' הן 'משובטים' במקור. תרבות תאים במדיום סלולארי 0.5 ES מיליליטר, שינוי בינוני מדי יום עד בארות הם מחוברות 80-90%.
הערה: צלחת 24 גם תאפשר תשואה מספקת של הדנ"א הגנומי לניתוח PCR.
5. זיהוי של אתרי החדרת PB וגני לכודים
- בידוד הדנ"א הגנומי מצלחת 24 גם: תאי Lyse בצלחת 24 גם ובודד הדנ"א הגנומי ללא RNA.
- בצע Splinkerette PCR (SpPCR) כדי ליצור רצף שברי איגוף אתר האינטגרציה transposon PB כמתואר 7,8.
הערה: SpPCR היא תהליך של חמישה ימים, אם כי ידיים על זמן בכל יום הוא מינימאלי.
6. ניתוח גנטי של השיבוטים Mutant
- אתר השני גם ולטהר שיבוט של עניין.
- כאשר אתר האינטגרציה PB כברממופה, לעצב פריימר קדימה במעלה הזרם של אתר האינטגרציה לשימוש עם פריימר ההפוך PB (למשל, PB3'-1) 8 ומסך צלחת ה- DNA המתאים לאותו 'תת-הספרייה "שממנו השיבוט עמיד המתח נבחר. מצפה למצוא גם חיובי אחד בלבד על פני צלחת ה- DNA 96-היטב כולו. להפשיר זה מדויק גם מהצלחת "מאסטר" לצלחת 24 גם על מתקני האכלה ולגדל תאים עד confluency 80-90%.
הערה: בשלב זה, גם זה מכיל תערובת של שיבוטים-לכוד גן. - כאשר הצלחת 24 גם הוא ומחוברות 80-90%, trypsinize תאים וצלחת 1,000 ES תאים בצלחת מזין 100 מ"מ (להבטיח השעיה תא בודדת). מעבר התאים שנותרו בבקבוק T25 במתקני האכלה להרחבה. להקפיא את התאים מן בקבוק T25 כאשר מושבות הן 80-90% ומחוברות. להקפיא 4 בקבוקונים לכל בקבוק T25 כגיבויים.
- לאפשר המושבות לגדול במשך 7 ימים ולאחר מכן לבחור 96 מושבות לפה 96-היטבצלחת עדר. עיין בסעיף 4.2 לנוהל בחירה. לשכפל את הצלחת כשהמוכנה לצלחת "DNA" ולהקפיא אחרים כמו '2 nd -master' צלחת (ראה סעיף 2.2 להקפאה).
- לאפשר מושבות להגיע 80-90% confluency. מסך צלחת ה- DNA למצוא בארות המכילות שיבוט המטוהר של עניין. להרחיב תאים מצלחת 2 nd -master 96-גם 24-היטב ולאחר מכן לבקבוק T25 (כל על מתקני האכלה). להקפיא 4 בקבוקונים לכל בקבוק T25.
הערה: בשלב זה, את קו התא-לכוד גן הוא משובט, לא נחשפה ללחץ, והוא מתאים לייצור עכבר.
- כאשר אתר האינטגרציה PB כברממופה, לעצב פריימר קדימה במעלה הזרם של אתר האינטגרציה לשימוש עם פריימר ההפוך PB (למשל, PB3'-1) 8 ומסך צלחת ה- DNA המתאים לאותו 'תת-הספרייה "שממנו השיבוט עמיד המתח נבחר. מצפה למצוא גם חיובי אחד בלבד על פני צלחת ה- DNA 96-היטב כולו. להפשיר זה מדויק גם מהצלחת "מאסטר" לצלחת 24 גם על מתקני האכלה ולגדל תאים עד confluency 80-90%.
- לקבוע את מספר החדרת PB: הפשירי בקבוקון אחד של הקו הסלולרי עמיד המתח ולהרחיב את התאים בבקבוק T25 gelatinized. לבודד הדנ"א הגנומי ולבדוק עותק מספר transposon PB. זו יכולה להיות מושגת על ידי qPCR מיקוד גן נאומיצין.
- למדוד את רמת ביטוי גן: לאחר confirming יש אירוע אינטגרציה PB יחיד בקו התא של עניין, למדוד את רמת הביטוי של הגן לכוד על ידי RT-qPCR באמצעות בדיקות TaqMan ספציפיות עבור כל גן.
- רצף ה- mRNA המוטציה: צור amplicon cDNA על ידי PCR באמצעות חישול במעלה הזרם פריימר לאקסון וחישול פריימר במורד הזרם לרצף acceptor אחוי של קלטת מלכודת הגן. רצף בר cDNA כדי לאשר שהשחבור הצפוי מתרחש בגן הלכודים.
- Remobilize transposon piggyBac לבדיקת קשר סיבתי בין הגן הלכוד והתנגדות ללחץ.
- 24-48 שעות לפני הפשרת תאים למתקני האכלה PB remobilization, הפשרה וDR4 צלחת על בקבוק T25 אחד ושתי צלחות 100 מ"מ. לפחות יום אחד אחרי ההאכלה DR4 הם מצופות על בקבוק T25, להפשיר בקבוקון אחד של קו התא המכיל את הכנסת PB וצלחת התאים בבקבוק T25 המכיל מתקני האכלת DR4. לגדול התאים במדיום סלולארי ESבמשך 48 שעות, שינוי בינוני יומית.
- הכן השעיה תא בודדת של תאי הגזע העובריים. ספירת תאים עם דלפק תא אוטומטי, ולהעביר 5.0 x 10 6 תאי גזע עובריים לצינור 15 מ"ל. צנטריפוגה ב 100 XG, וresuspend תאי 800 μl PBS. מעבירים את ההשעיה לקובט 4 מ"מ.
- הוסף 20 מיקרוגרם mPBase Puro לקובט, לערבב ידי pipetting, ותאי electroporate (ראו סעיף 1.4 לפרטים נוספים). להפיץ את תאי transfected על שתי צלחות מזין DR4 100 מ"מ. תרבות תאי O / N במדיום תאי גזע עובריים.
- למחרת בבוקר, להאכיל את התאים עם מדיום ES עם תאי puromycin והתרבות / מיליליטר 1 מיקרוגרם במשך 48 שעות. לסגת בחירת puromycin ולהמשיך תרבות התאים במשך 5 ימים. כאשר המושבות גדולות מספיק למסיק, לאסוף לתוך צלחת מזין 96-היטב (ראה סעיף 4.2).
- כאשר התאים הרימו הגיעו 80-90% confluency, לפצל 1/6 ה של הצלחת לצלחת ה- DNA ו1/6 ה של plאכלתי לתוך צלחת G418, עוזב 2/3 RDS של התאים בצלחת המקורית להיות קפוא (ראה סעיף 2.2 להקפאה).
- תרבות צלחת ה- DNA בתאי גזע עובריים בינוני לבידוד DNA מאוחר יותר, ואת צלחת G418 G418 ב/ מיליליטר 150 מיקרוגרם לבדיקת אובדן התנגדות נאומיצין. ולס ללא תאי קיימא לאחר 72-96 שעות בתרבות המכילה G418 מצביע remobilization המוצלח של transposon PB השמנת הגן.
- הבארות המקבילות בצלחת "DNA" יוקרן על ידי PCR כדי לאשר את transposon PB הוסר. כאשר צלחת ה- DNA היא מחוברות 90%, לבודד את הדנ"א הגנומי בפורמט צלחת 96-היטב 4 להקרנת PCR לשיקום רצף wild-type והעדר הניאו-IRES כאמצעי כדי לאשר חזרה.
- להפשיר את בארות התאמה מצלחת מאסטר לצלחת 24 גם ולהרחיב לבקבוק T25 (כל עם מתקני האכלה). להקפיא ארבעה בקבוקונים לכל בקבוק T25 כגיבוי.
7. דור של מוטציות עכבר
- לשחזר תאי גזע עובריים עמידים מהצלחות ההורים ולהשתמש בם להזרקת עובר ליצור כימרה. כ 15-20 תאי גזע עובריים הם שהוחדרו לתוך C57BL / 6 הבלסטוציסט בודד. העברה 15 blastocysts לכל עכבר לרחם של נקבת pseudopregnant (זן ICR). Mate הכימרה הזכר (מסומנת בצבע ES התאים הספציפי האגוטי המעיל) התאוששה מההמלטה עם מספר C57BL / 6J נקבות בתולה צעירות לבדיקת הולכה נבט-קו, ולבנות את מושבה של עכברים שעברו מוטציה.
- לבודד וfibroblasts עור זנב מבחן מעכברי F1 המוטציה וlittermate wild-type למיני חמצן מגיבים רמה והתנגדות (ROS) לparaquat 9.
תוצאות
בניסוי mutagenesis טיפוסי, transfection מורכב מסכום כולל של 3 x 10 7 תאי גזע עובריים עם PB-UPA וtransposase MPB. המספרים של תאי גזע עובריים-לכוד גן שנוצרו בשני ניסויים בלתי תלויים מסוכמים בטבלה 1. היעילות של גן-מלכוד היא% על 0.04. ספריות גן-מלכודת המשולבת מכילות 22,400 מוטציות עצמאיות, על כיסוי מלא של גנום העכבר (23,000 גני קידוד). כיסוי מוגזם יכול להיות מושגת על ידי יצירה יותר מוטציות באמצעות mutagenesis חזר ו / או דרוג את התהליך.
בגלל ספריות גן-מלכודת מכילות מוטציות אקראיות, לא ניתן לחזות את מספר מוטציות בעלי פנוטיפ התנגדות לחץ. שתי בחירות עצמאיות להתנגדות PQ בוצעו; ההקרנה בשילוב של 22440 מוטציות גנטי מלכודת עצמאיות נחשפה 17 מוטציות שמקנות עמידות לסלולרית PQ (0.08%) (טבלת 1).
יש לנו מטוהר 3 שיבוטים מוטציה, Pigl, Tiam1, וRffl, מהצלחות האב לניתוח נוסף וייצור עכבר. תאים עם המוטציה Rffl הטרוזיגוטיים היו מושרה בהצלחה לייצר צאצאים הומוזיגוטים על ידי לדפוק את BLM. עם זאת, אנחנו לא הצליחו לייצר שום מוטציות הומוזיגוטים ממוטציות Pigl וTiam1, ככל הנראה בשל קטלני תא צמוד homozygosity. ההתנגדות ללחץ של שיבוטים המטוהרים אלה אושרה על ידי שימוש 2 סוגים שונים של לחץ: השמטה של 2-mercaptoethanol (2-ME) וPQ (איור 2). עם הסרת PB משיבוטים אלה, הפנוטיפ התנגדות הלחץ קשור גם איבד (איור 2), המאשר כי המוטציות גנטי המלכודת הן הגורם סיבתי. אפיון של שיבוטים התאוששו מהצלחות ההורים הוא חיוני כפי שהיה פוסל את נגע סטוכסטיים במהלך בחירת מתח כגורם לפנוטיפ הנצפה.
מתוך 3תאי גזע עובריים מוטציה שהוצגו לblastocysts לייצור עכבר (טבלה 2), 2 קווים (Pigl וTiam1) להראות שידור germline. הזרקת Rffl מיוצרת הכימרה נקבה יחידה שלא היה מספר אופטימלי של הכימרה מלכתחילה. לפיכך, הכישלון של העברת germline של Rffl עשוי הכימרה בשל אחד פסול. בדקנו את הפנוטיפ הסלולרי של fibroblasts העור מבודד מהעכברים שעברו המוטציה Pigl והראיתי שהם שמרו על הרמה המופחתת של מיני חמצן מגיבים אנדוגני (ROS), כמו גם התנגדות ללחץ PQ (איור 3).
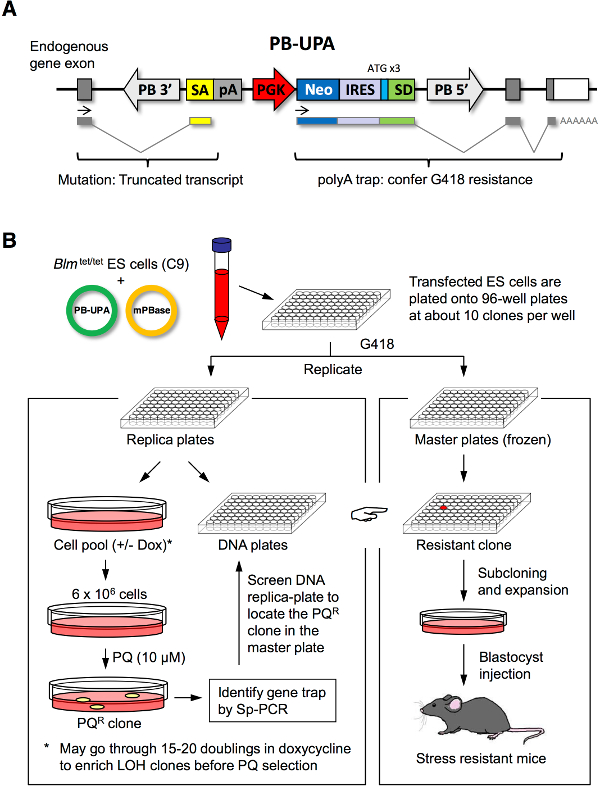
איור 1. ES mutagenesis תא ובחירת מתח. וקטור () PB-UPA. וקטור הפולה מלכודת (UPA) משוחד הכולל acceptor אחוי (SA), אות פולי-adenylate הורמון גדילת שור (הרשות הפלסטינית), phosphogקינאז lycerate אמרגן (PGK), phosphotransferase נאומיצין (ניאו), אתר כניסת ריבוזומלי הפנימי (IRES), ותורם אחוי (SD) עם ATG המלאכותי (ב 3 מסגרות קריאה שונות) שובט לתוך transposon piggyBac, מוקף 3 ' וחזור על 5 'מסוף ארוך (LTR). (ב) mutagenesis אקראי של תאי גזע עובריים ובחירה לשיבוטים עמידים לחץ. תאי גזע עובריים היו שיתוף transfected ידי electroporation עם PB-UPA וmPBase אחרי ציפוי על 96-גם צלחות. שיבוטים לכודים גן נבחרו על ידי התנגדות G418; פעם אחת ומחוברות, הם חולקו לקבוצות 2 העתק. סט העתק אחד לשתי מחצית לבידוד DNA ובחירת מתח על ידי paraquat (PQ); הסט האחר ההעתק (אב) היה קפוא במורד. מושבות תאי הגזע העובריים ששרדו התאוששו מטיפול הלחץ נותחו מולקולריות להחדרת PB על ידי Sp-PCR. Primers אז נועד להקרין את צלחת ה- DNA ההעתק ממנו מכילה גם sibliשיבוט ng PQ R יכול להיות ממוקם על צלחת האדון. תאים אלה הם עבור assay התנגדות לחץ על גורמי לחץ שונים ולייצור עכבר. שונה מהאפרוח et al. 7. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

התנגדות 2. מתח איור בתאי גזע עובריים מוטציה. התנגדות () 2-mercaptoethanol נסיגה (2-ME). (ב) התנגדות לparaquat (PQ). מוצגים הם תאי ההורים wild-type ES (C9: צהוב), שיבוט תאי גזע עובריים שליטה עמידה לעקות, (4C11: אדום), התאוששו ממחקר קודם 5, ושלושה שיבוטים גנטי מלכודת (אפורים). תאים היו נתונים ללחץ טיפול במשך יומיים, לאחר שמספר תאי קיימא נספר. < em> heterozygotes Pigl, Tiam1, וRffl. (PB / +: אפור כהה) התנגדות תערוכה לשניהם הלחץ הללו הומוזיגוטים Rffl (PB / PB: שחור) להפגין התנגדות ללחץ חזקה בהשוואה לheterozygotes. התנגדות לשני גורמי הלחץ אבדה כאשר הוספות PB הוסרו (+ / +: אפורה בהירה). ברים שגיאה מייצגים SD של ממוצע (n = 4). * P <0.001, p = 0.01 # בין השיבוטים גנטי המלכודת וC9 ההורים wild-type, הוערכו על ידי -test t של הסטודנט. הקמת מושבה (C) ES תא תחת PQ טיפול (10 מיקרומטר). השיבוטים ES עמידים לעקות היו מסוגלים ליצור מושבות בתרבות תחת טיפול PQ תוך המספר והגודל של מושבות משיבוט wild-type הופחתו באופן משמעותי. שונה מהאפרוח et al. 7. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
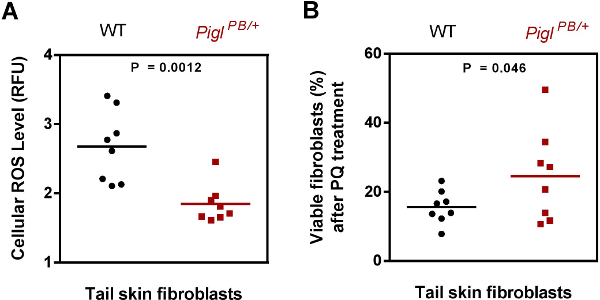
איור 3. אפיון של Pigl PB / + fibroblasts. רמה () מיני חמצן תגובתי (ROS). fibroblasts עור זנב מבודד מwild-type (WT) וPigl PB / + העכברים הוכתמו CM-DCFCA והקרינה הייתה מנורמל נגד Hoechst. תוכן ROS בא לידי ביטוי כיחידה יחסי הקרינה (RFU). ערך P הוערך על ידי -test t שני סטודנטים זנב (n = 8). התנגדות (ב) PQ. fibroblasts עור זנב מwild-type (WT) וPigl PB / + העכברים נחשפו ל4 מ"מ PQ עבור שעה 6, לאחר שהכדאיות של התאים נמדדו על ידי מבחני MTT. אחוז של תאי חיים לאחר טיפול PQ היה מחושב על ידי היחס של הספיגה המתקבל מהספירה שטופלה PQLLS וכי מהתאים שטופל האו"ם. ערך P הוערך על ידי -test t של סטודנט אחד הזנב (n = 8). שונה מהאפרוח et al. 7. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
| סִפְרִיָה | תת-ספריות | מתח בתאי גזע עובריים | מס 'של שיבוט גן לכוד | מס 'של שיבוטים PQ R |
| 1 | C9PA01 - C9PA10 | C9 (BLM ט / ט) | 9,000 | 7 |
| 2 | C9PA11 - C9PA20 | C9 (BLM ט / ט) | 13440 | 10 |
| סה"כ | 22440 | 17 |
שולחן בניית 1. PiggyBac גן-מלכודת ספרייה וההתאוששות של שיבוטים עמידים PQ. השתנה מet al צ'יק. 7.
| שיבוט תאי גזע עובריים שהוחדר | מס 'של הכימרה התאושש | שידור germline * |
| Pigl PB / Pigl + | 4 | כן |
| Tiam1 PB / Tiam1 + | 2 | כן |
| Rffl PB / Rffl + | 1 | לֹא |
דור טבלה 2. של עכברים. השתנה מet al צ'יק. 7.
* שידור germline אושר על ידי ירושה של אלל גן-המלכודת זוהה על ידי genotyping PCR.
Discussion
Forward genetic analysis allows for an unbiased interrogation of the genome for genes responsible for a specific phenotype. This method is very powerful to uncover novel gene functions. It has been widely used in lower organisms but not in mammal, such as the mouse, mainly due to the extremely high cost associated with the infrastructure and logistics that would entail. Here, we moved the genetic screening process to the ES cell culture platform, greatly increasing the efficiency and throughput in generating mutants and identifying mutations.
To effectively select for resistant mutants, a lethal dose of stressor and period of treatment needs to be established such that all of the wild-type cells would be killed. The higher the stringency of the selection, the fewer occurrence of false positive will result. Fibroblast feeders have a higher tolerance to oxidative stress than ES cells; the presence of feeders would rescue the nearby ES cells which would otherwise be killed by the stressor. Thus, omission of feeders during stress selection was very critical for an effective killing. In skin fibroblasts, serum deprivation was necessary to reveal the stress resistance phenotype in long lived mice 10. However, this application was not feasible in ES cells because they cannot survive without serum. As an alternative, we discovered that the use of heat inactivated serum at reduced level (7.5%) achieved a similar result.
In this report, we employed poly-A trap rather than a promoter trap because promoter trap will only trap actively transcribed genes, which is estimated to be 60% of the genome in ES cells, under normal conditions 11. In contrast, a poly-A trap would trap genes regardless of their transcriptional activities, in theory giving us the potential to screen for mutations in all genes in the genome. A major drawback of the conventional poly-A trap is the strong bias towards trapping the last exon, appeared to be mediated by an endogenous nonsense-mediated decay (NMD) mechanism 12. By incorporating the unbiased poly-A trap (UPA) strategy in the PB-UPA transposon to suppresses NMD 13, we were able to eliminate biased trapping.
One distinguishing advantage of using ES cells is that these pluripotent cells make direct derivation of mice possible, speeding up the transition to in vivo studies. For this to happen, the replica plating strategy is critical, preserving a subset of clones sheltered from manipulations that can diminish pluripotency, such as knocking out of Blm and exposure to stressors. We have shown that mutant ES cells recovered from these screens were capable of participating in forming the entire mouse and transmitting the mutations to the germline. Most importantly, consistent with previous studies, the stress resistance phenotype was also transmitted and maintained in the adult mouse.
We and others showed that a variant phenotype observed in ES cells resulting from environmental induced lesion or deliberated engineered mutations was able to transmit to the differentiated progeny cells 4,5,9,14, and probably the whole mouse. This protocol describes the utilization of ES cells as surrogate cells to screen for stress resistance mutations in the mouse. In addition to screening for stress resistance genes, this method may have a broader implication to screen ES cells, identify targets, and to develop a variety of mouse models with a phenotype of interest.
Disclosures
The authors have nothing to disclose.
Acknowledgements
We would like to thank the Wellcome Trust Sanger Institute for the gifts of piggyBac transposon and piggyBac transposase. This work was supported by the Butcher grant of Colorado and the NIH R01 AG041801 (W.S.C).
Materials
| Name | Company | Catalog Number | Comments |
| Vector | |||
| PB-UPA | |||
| mPBase | |||
| mPBasePuro | |||
| Tissue Culture | |||
| 500-ml Stericup filters | EMD Millipore | SCGPU05RE | |
| 250-ml Stericup filters | EMD Millipore | SCGPU02RE | |
| 50-ml Steriflip-GV filters | EMD Millipore | SE1M179M6 | |
| KO DMEM | Life Technologies | 10829-018 | |
| DMEM | Sigma-Aldrich | D6429 | |
| FBS | Tissue Culture Biologicals | 104 | |
| Heat Inactivated FBS | Sigma-Aldrich | F4135-500 | |
| LIF | EMD Millipore | ESG1107 | |
| Non-essential Amino Acids | Life Technologies | 11140-050 | |
| GlutaMAX | Life Technologies | 35050-061 | |
| Pen/Strep | Life Technologies | 15140148 | |
| β-Mercaptoethanol | Life Technologies | 21985-023 | |
| Methyl Viologen dichloride (Paraquat) | Sigma-Aldrich | 856177 | |
| Dimethyl Sulphoxide Hybri-MAX | Sigma-Aldrich | D2650 | |
| EmbryoMAX 0.1% gelatin | EMD Millipore | ES006B | |
| DPBS/Modified | HyClone | SH30028.02 | |
| 0.25% Trypsin-EDTA | Life Technologies | 25200-056 | |
| T25 Flask | Corning | 353108 | |
| T75 flask | Corning | 353135 | |
| 100-mm plate | Corning | 353003 | |
| 150-mm plate | Corning | 430599 | |
| 96-well plate | Corning | 3585 | |
| 96-well U-bottom plate | Corning | 3799 | |
| 24-well plate | Corning | 3526 | |
| 50-ml reservoir | Corning | 4870 | |
| 15-ml tubes | VWR International, LLC | 82050-276 | |
| Primary Mouse Embryonic Fibroblasts | EMD Millipore | PMEF-NL | |
| DR4 Mouse Embryonic Fibroblasts | Applied StemCell | ASF-1001 | |
| Mitomycin C | Fisher BioReagents | BP25312 | |
| Geneticin (G418) | Life Technologies | 11811-023 | |
| Doxycycline | Fisher BioReagents | BP26531 | |
| Cryotubes | Thermo Scientific | 377267 | |
| Centrifuge | Eppendorf | Centrifuge 5702 | |
| TC10 cell counter | Bio-Rad | ||
| Counting Slides (for TC10) | Bio-Rad | 1450011 | |
| Electroporation | |||
| Gene Pulser Xcell | Bio-Rad | 1652611 | |
| Gene Pulser Cuvettes (4 mm gap) | Bio-Rad | 1652088 | |
| Molecular Biology | |||
| Thermal Cycler | Eppendorf | Mastercylcer ep Gradient S | |
| Puregene Core kit B | Qiagen | 158745 | |
| Topo-TA Cloning kit | Life Technologies | 450030 | |
| High Capacity cDNA synthesis kit | Applied Biosystems | 4368814 | |
| NaCl | Fisher BioReagents | BP358-212 | |
| 100% ethanol | Decon Laboratories, Inc. | 2716 | |
| Double Processed Tissue Culture Water | Sigma-Aldrich | W3500 | |
| Sau3A1 | New England BioLabs | R0169L | |
| T4 DNA Ligase | New England BioLabs | M0202T | |
| EcoRV | New England BioLabs | R3195S | |
| 96-well Lysis Buffer (Ramires-Solis et al. 1992) | |||
| Trizma Base | Sigma-Aldrich | T1503 | |
| Hydrochloric Acid | Fisher BioReagents | A144-212 | |
| EDTA | Sigma-Aldrich | E5134 | |
| N-Lauroylsarcosine sodium salt | Sigma-Aldrich | L5777 | |
| Proteinase-K | Fisher BioReagents | BP1700 | |
| Electrophoresis | |||
| Mini-Sub Cell GT | Bio-Rad | 170-4469EDU | |
| LE Agarose | GeneMate | E3120500 | |
| Ethidium Bromide | Fisher BioReagents | BP1302 | |
| 100 BP DNA Ladder | New England BioLabs | N3231S | |
| 1Kb DNA Ladder | New England BioLabs | N3232S | |
| 2-log DNA Ladder | New England BioLabs | N3200L |
References
- Johnson, T. E., et al. Longevity genes in the nematode Caenorhabditis elegans also mediate increased resistance to stress and prevent disease. J Inherit Metab Dis. 25, 197-206 (2002).
- Murakami, S., Salmon, A., Miller, R. A. Multiplex stress resistance in cells from long-lived dwarf mice. Faseb J. 17, 1565-1566 (2003).
- Perez, V. I., et al. The overexpression of major antioxidant enzymes does not extend the lifespan of mice. Aging Cell. 8, 73-75 (2009).
- Martin, G. M. Genetic engineering of mice to test the oxidative damage theory of aging. Ann NY Acad Sci. 1055, 26-34 (2005).
- Chick, W. S., Drechsel, D. A., Hammond, W., Patel, M., Johnson, T. E. Transmission of mutant phenotypes from ES cells to adult mice. Mamm Genome. 20, 734-740 (2009).
- Ramirez-Solis, R., et al. Genomic DNA microextraction: a method to screen numerous samples. Anal Biochem. 201, 331-335 (1992).
- Uren, A. G., et al. A high-throughput splinkerette-PCR method for the isolation and sequencing of retroviral insertion sites. Nat Protoc. 4, 789-798 (2009).
- Wang, W., Bradley, A., Huang, Y. A piggyBac transposon-based genome-wide library of insertionally mutated Blm-deficient murine ES cells. Genome Res. 19, 667-673 (2009).
- Chick, W. S., et al. Screening for stress-resistance mutations in the mouse. Front Genet. 5, 310 (2014).
- Salmon, A. B., et al. Fibroblast cell lines from young adult mice of long-lived mutant strains are resistant to multiple forms of stress. Am J Physiol Endocrinol Metab. 289, 23-29 (2005).
- Skarnes, W. C., et al. A public gene trap resource for mouse functional genomics. Nat Genet. 36, 543-544 (2015).
- Baker, K. E., Parker, R. Nonsense-mediated mRNA decay: terminating erroneous gene expression. Curr Opin Cell Biol. 16, 293-299 (2004).
- Shigeoka, T., Kawaichi, M., Ishida, Y. Suppression of nonsense-mediated mRNA decay permits unbiased gene trapping in mouse embryonic stem cells. Nucleic Acids Res. 33, e20 (2004).
- Symula, D. J., Zhu, Y., Schimenti, J. C., Rubin, E. M. Functional annotation of mouse mutations in embryonic stem cells by use of expression profiling. Mamm Genome. 15, 1-13 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved