Method Article
Enfoque genético adelante para descubrir Estrés Los genes de resistencia en ratones - Una pantalla de alto rendimiento en células madre embrionarias
En este artículo
Resumen
Resistencia al estrés es una de las señas de identidad de la longevidad y es conocido por ser gobernado genéticamente. Aquí, hemos desarrollado un método de alto rendimiento imparcial para la detección de mutaciones que confieren resistencia al estrés en células madre embrionarias con el que desarrollan modelos de ratón para estudios de longevidad.
Resumen
Phenotype-driven genetic screens in mice is a powerful technique to uncover gene functions, but are often hampered by extremely high costs, which severely limits its potential. We describe here the use of mouse embryonic stem (ES) cells as surrogate cells to screen for a phenotype of interest and subsequently introduce these cells into a host embryo to develop into a living mouse carrying the phenotype. This method provides (1) a cost effective, high-throughput platform for genetic screen in mammalian cells; (2) a rapid way to identify the mutated genes and verify causality; and (3) a short-cut to develop mouse mutants directly from these selected ES cells for whole animal studies. We demonstrated the use of paraquat (PQ) to select resistant mutants and identify mutations that confer oxidative stress resistance. Other stressors or cytotoxic compounds may also be used to screen for resistant mutants to uncover novel genetic determinants of a variety of cellular stress resistance.
Introducción
La longevidad tiene una íntima relación con la resistencia al estrés. En general, las especies de larga vida a menudo muestran una mayor resistencia a múltiples factores de estrés, como el peróxido de hidrógeno, el paraquat (PQ), UV, calor, y metales pesados 1,2. Por el contrario, el aumento de la sensibilidad al estrés tiende a predecir acortada duración de la vida y / o un fenotipo más propenso a la enfermedad. La vía de eliminación de anti-oxidante mucho tiempo se ha especulado que desempeñar un papel importante en el estrés que confiere resistencia al animal. Sin embargo, con pocas excepciones, los estudios de una variedad de animales transgénicos con manipulaciones en varias enzimas antioxidantes (por ejemplo, SOD) indican que el aumento del nivel de las enzimas oxidantes de barrido no aumenta la vida útil o la duración de la salud 3. Estos datos sugieren que el rasgo de resistencia al estrés observado consistentemente en animales de larga vida está mediada por otras vías celulares aún no se ha descubierto.
Tomamos un avance imparcialenfoque genético para identificar genes, que tras la mutado, puede conferir un fenotipo de resistencia a la tensión en las células madre embrionarias cultivadas (ES). Células ES ofrecen dos ventajas importantes en este estudio: (1) las manipulaciones genéticas sofisticados están disponibles para modificar el genoma de las células ES; y (2) cualesquiera células ES resistentes a estrés recuperados de la pantalla se pueden utilizar directamente para la producción de ratón, que permite la traducción rápida en los estudios en animales enteros para medir duración de la vida y la duración de la salud.
En este informe, se describe el uso de la línea celular de C9 ES, en el que los alelos Blm estaban bajo el control de un elemento sensible a la tetraciclina. El tratamiento de doxiciclina (dox) transitoriamente apagó la expresión de Blm que representan un aumento de incidentes de intercambio de cromátidas hermanas. Este corto plazo Blm Knock-Out permitido para la generación de mutaciones homocigóticas dentro de la población heterocigoto para que mutaciones recesivas para la resistencia al estrés podrían ser capturados en el proceso de selección. NosotrosTambién se describe el uso de piggyBac (PB) transposón como el mutágeno para insertar aleatoriamente un poli-A trampa de casete (PB-UPA) para mutar genes en el genoma. Las células con alteración de un gen por la poli-Una trampa convirtieron G418 resistentes y pueden ser recuperados de manera que una colección de mutantes gen-trampa (gen-trampa de biblioteca) se podría hacer, y posteriormente se proyectó para los clones mutantes que eran resistentes estrés.
Los clones resistentes a estrés recuperados de la selección se podrían caracterizar con bastante rapidez por técnicas moleculares con respecto del número de inserciones (qPCR), el sitio de inserción (splinkerette PCR), la identidad del gen alterado (BLAST), y su nivel de expresión ( RT-qPCR). La inserción PB podría removilizado por la expresión transitoria de MPB transposasa en el clon para restaurar la secuencia de ADN de tipo salvaje y por lo tanto la prueba de la pérdida de resistencia al estrés. Estas son formas poderosas para confirmar la causalidad de la mutación, que se deben hacer antesa la producción de ratón caro. Estudios anteriores demostraron que las células expuestas a factores estresantes perdieron 4,5 pluripotencia. Por lo tanto, en este protocolo, la preservación de un conjunto de réplicas de células mutantes, que no se puede tratar con los factores de estrés es fundamental para la producción exitosa de ratón.
Nuestro laboratorio ha diseñado la línea celular de C9 ES y el vector PB-UPA, ambos están a disposición de otros investigadores que lo soliciten. El protocolo informó aquí se iniciará por la generación de novo de la biblioteca de genes de las células ES-atrapado con PB-UPA (Figura 1A), seguido por réplica en placa y la selección de estrés para aislar clones resistentes de estrés (Figura 1B). Hemos demostrado la selección con paraquat, un potente generador de radicales libres en las células. Prácticamente, cualquier compuesto citotóxico o una toxina, por ejemplo, factores de estrés ER (por ejemplo, thapsigargin y tunicamicina), oxidante neuronal (por ejemplo, MPP +, la dopamina 6-hidroxi, y rotenona), el calor, y pesadometales (por ejemplo, CD, Se), podrían adaptarse para el método para seleccionar para mutantes resistentes respectivos.
Protocolo
1. Gen-atrapado ES Cell Biblioteca de construcción que usa piggyBac Transposón
- Preparar fibroblastos de embriones de ratón primaria (PMEF) como alimentadores para el cultivo de células ES
- Descongelar un vial de C inactivado PMEF mitomicina (5,0 x 10 6) en un baño de agua a 37 ° C. Transferencia de las células en 5 ml de medio de células ES (DMEM que contiene 15% de FBS, 1.000 unidades / ml de factores inhibidor de la leucemia, 100 mM aminoácidos no esenciales, glutamina 2 mM, 55 mM 2-mercaptoetanol, y 25 unidades / ml de penicilina / estreptomicina ), y centrifugar a 100 xg durante 5 min.
- Aspirar el sobrenadante y resuspender las células en 30 ml de medio de células ES, seguido de la distribución de en dos matraces T25 (5 ml cada una) y dos placas de 100 mm (10 ml cada una). Se incuba a 37 ° C, 5% de CO 2 durante 24 horas.
- Cultura y expandir células C9 ES
- Descongelar un vial de células ES C9 (2,5 x 10 6 células en 0,5 ml) en un baño de agua a 37 ° C y transferir ellas células en 5 ml de medio de células ES. Centrifugar a 100 xg durante 5 min.
- Aspirar el sobrenadante y resuspender las células ES en 5 ml de medio de células ES seguido de chapado en el matraz T25 alimentador. Incubar a 37 ° C, 5% de CO 2. Reemplazar medio de células ES diaria.
- Después de 2 días de cultivo, las células madre embrionarias deben convertirse en ~ 80% de confluencia, y están listos para ser pases. Lavar las células con 5 ml de PBS (sin Ca y Mg 2+ 2+) y luego añadir 2,5 ml pre-calentado 0,25% de tripsina-EDTA. Incubar a 37 ° C durante 10 min. Añadir 2,5 ml de medio de células ES para detener la tripsina; pipetear arriba y hacia abajo 15 veces para romper grupos de células. Centrifugar a 100 xg durante 5 min.
- Aspirar las células sobrenadante y resuspender en 4 ml de medio de células ES. Transferir 1 ml de células por 100 mm de placa que contiene medio de células ES 9 ml; preparar dos platos de 100 mm. Este es un 1: paso 8. Alimentar a las células de todos los días con 10 ml de medio de células ES.
- Preparar placas de 96 pocillos de alimentación para la biblioteca
- Como se describe en 1.1.1, descongelar tres viales de mitomicina C inactivadas PMEF (cada uno conteniendo células 5 x 10 6) y volver a suspender las células de cada vial con medio celular 33,3 ml ES. Combinar las células para producir una suspensión de células 100-ml.
- Plate 100 células en l por pocillo de diez placas de 96 pocillos. Estas placas de alimentación de 96 pozos deben estar preparados por lo menos un día antes de la transfección de las células madre embrionarias C9 con PB transposón.
- Electroporación de células ES C9 con el vector PB-UPA
- Trypsinize y contar las células C9 ES expandido usando un contador de células automatizado. Lave cada placa de 100 mm de células C9 embrionarias con 10 ml de PBS. Añadir 8 ml pre-calentado 0,25% de tripsina-EDTA y se incuba a 37 ° C durante 10 min.
- Detener la tripsina mediante la adición de medio de células ES de 2 ml. Transferir la suspensión celular a un tubo de 15 ml y la pipeta hacia arriba y hacia abajo 15 veces para romper grupos de células. Centrifugar a 100 xg Inmediatamente durante 5 min seguido de aspirar el sobrenadante.
- Resuspender celulars en ml de medio de células ES 10 y cuenta las células ES utilizando un hemocitómetro. Preparar seis tubos de 15 ml de suspensión de células que contienen cada uno 5 x 10 6 células ES. Centrifugar a 100 xg durante 5 min. Aspirar el sobrenadante y resuspender cada pellet de células en 0,8 ml de PBS.
- Preparar seis cubetas de electroporación (4 gap mm) a la que se transfieren las células 0,8 ml. A cada cubeta, añadir 1 g PB-UPA y 20 mg MPB transposasa (mPBase); mezclar suavemente pipeteando arriba y abajo. Ponga las cubetas de hielo. Realizar electroporación con un electroporador utilizando el ajuste exponencial a 250 V, 500 mF, y el infinito ohmios.
NOTA: Por lo general, la constante de tiempo es de 10 a 12 ms para una electroporación éxito, que producen alrededor de 1.500 a 2.000 G418 transformantes resistentes por 5 x 10 6 células. - Recuperar y poner en común las células transfectadas a un matraz T75 que contiene medio celular 98 ml ES. Mezclar las células por pipeteo suave y luego transferir las células a un depósito (50 ml). Nosing una pipeta de 12 canales, transferir 100 l de células por pocillo a las placas de alimentación previamente preparada de 96 pocillos (10 en total). Incubar a 37 ° C, 5% de CO 2.
- Después de 24 h, alimentar a las células a diario con medio de células ES fresco que contiene G418 (150 mg / ml) para seleccionar los clones de genes-atrapado.
NOTA: Por lo general cada pocillo contendrá alrededor de diez colonias resistentes a G418. Cuando estas colonias crecen hasta un tamaño suficiente (típicamente 5-7 días), las placas de 96 pocillos (la biblioteca) se replicarán en 2 juegos para el almacenamiento y la selección, respectivamente. Cada placa en la biblioteca se designa como "sub-biblioteca ', por lo que en este caso, hay 10 sub-bibliotecas.
2. Biblioteca de replicación
- Replicar las placas Maestro
- 24-48 h antes de las colonias resistentes a G418 que alcanzan 50-60% de confluencia, descongelar otros tres viales de mitomicina C PMEF inactivado en diez placas de 96 pocillos como alimentadores (consulte la sección 1.3). Gelatinaize diez placas de 96 pocillos mediante la incubación de 0,1% de gelatina (100 l / pocillo) a 37 ° C durante al menos 15 - 30 min; O / N de incubación es aceptable.
- Preparar suspensiones de células individuales en las placas de 96 pocillos por tripsinización. Aspirar medio de placas de 96 pocillos y lavar una vez con un volumen igual de PBS (sin Ca2 +, Mg2 +). Añadir 50 l de pre-calentado 0,25% de tripsina-EDTA, se incuba a 37 ° C en 5% de CO2 durante 10 min. Detener la tripsina con 50 l de medio de células ES. Separación de los grupos de células pipeteando arriba y hacia abajo 15 veces con la pipeta multicanal.
- Transferencia de 50 l de suspensión de células se tripsinizaron a la fila correspondiente de la placa de alimentación (Master) que ya contiene 150 l medio de células ES y los 50 l restantes a la fila correspondiente de la placa gelatinizado (réplica) que ya contiene 150 l medio de células ES. Procesar cada fila de células a una placa master y réplica. Incubar las placas (ahora contiene un 200 l cvolumen ultura) a 37 ° C, 5% de CO 2 O / N.
NOTA: En la actualidad hay veinte placas de 96 pocillos. - Al día siguiente se alimentan las células con medio celular 100 l fresca ES que contiene 150 mg / ml de G418. Reemplace el medio a diario hasta los pozos son un 80-90% de confluencia.
- Congelar las placas Maestro
- Cuando las placas maestras son alrededor del 80% de confluencia, trypsinize las células como se describe (consulte la sección 2.1.2).
- Retire las placas y detener la reacción con tripsina 50 l de 2x medio de congelación (60% medio de células ES, 20% de FBS, 20% de DMSO). Pipeta arriba y hacia abajo 10 veces con una pipeta multicanal para asegurar una mezcla adecuada del medio de congelación.
- Coloque las placas de 96 pocillos en una caja de espuma de poliestireno cerrado herméticamente y colóquela en -80 ° C congelador para el almacenamiento de hasta cuatro meses. Cuatro meses le permitirá tiempo suficiente para completar la selección estrés y para identificar qué pozos de la placa principal contienen los clones de interés.
NOTA: El almacenamiento a -80 & #176; C más de 4 meses, el declive de la viabilidad celular. Uno puede utilizar crio-tubos en formato de 96 pocillos que se puede almacenar en la fase de vapor de nitrógeno líquido durante un periodo largo de almacenamiento.
- Preparar placas de ADN y piscinas sub-biblioteca de placas de réplica
- 24-48 h antes de la replicación de ADN aún más a las placas y piscinas sub-biblioteca, preparar diez placas de 100 mm con mitomicina C PMEF inactivado para la piscina sub-biblioteca, y el diez gelatinizado placas de 96 pocillos para la placa de ADN se replica. Consulte la sección 1.3 para el procedimiento general.
- Trypsinize las células en las placas de réplica de 96 pocillos (véase la sección 2.1.2). Durante la etapa de tripsinización 10 min, aspirado de gelatina a partir de las placas de ADN y reemplazar con 150 l medio de células ES que contiene G418 (150 mg / ml). Además, prepara un depósito que contiene 5 ml de medio de células ES para la puesta en común de los "sub-bibliotecas en la placa de alimentación de 100 mm.
- Después de tripsinización, deje de tratarpsin con 50 l de células ES medio de una fila a la vez utilizando una pipeta de 12 canales. Pipeta arriba y hacia abajo 10 veces para separar grupos de células.
- Transferencia de 50 l de la suspensión celular a la fila correspondiente de la placa de DNA y transferir los 50 l restantes para el depósito que contiene 5 ml medio de células ES. Después de completar una placa de 96 pocillos completa, aspirar el medio de una placa de alimentador de 100-mm a la que se transfieren las células agrupadas. Estas células mutadas agrupados se designan como "sub-biblioteca.
- Repita el procedimiento para las nueve placas de 96 pocillos restantes. Alimentar a los platos de ADN de 96 pocillos y placas de 100 mm agruparon 'sub-biblioteca' diario con medio de células ES que contiene G418 (150 mg / ml).
NOTA: En la actualidad hay diez placas de 96 pocillos 'ADN', y las placas de 'sub-biblioteca' diez por 100 mm.
- Congelar las placas de ADN. Cuando las células en la placa de DNA son el 80-90% de confluencia, aspirar el medio, se lavan las células dos veces con 100l de PBS y se almacena a -20 ° C para el aislamiento de ADN genómico tarde 6. Estas placas de ADN se seleccionaron por PCR para identificar qué correspondiente pocillo en la placa 'Maestro' contiene el clon de interés.
3. Los mutantes homocigotos inducida Doxiciclina-
- Congelar las piscinas sub-biblioteca y células de paso para el tratamiento doxiciclina
- 24 horas antes de las placas de 100 mm 'sub-biblioteca "que tienen colonias lo suficientemente grandes como para producir un 70-80% de confluencia, preparar un conjunto de diez por gelatiniza placas de 100 mm para el tratamiento doxiciclina.
- Preparar suspensiones de células individuales de cada sub-biblioteca (consulte las secciones 1.4.1 y 1.4.2 para más detalles). Transferencia de 5 x 10 6 células a la placa de 100-mm gelatinizado con doxiciclina (1 mg / ml); incubar a 37 ° C, 5% de CO 2. Congele los no doxiciclina tratados piscinas sub-biblioteca restantes a 5 x 10 6 células por vial.
- Passage células en presenciade doxiciclina para noquear a Blm
- Pasaje las sub-bibliotecas en 1: 8 cada 2-3 días en presencia de doxiciclina (1 mg / ml) durante un máximo de dos semanas, tiempo durante el cual dox inducida ronda de Blm promoverá la pérdida de heterozigosidad en la celda población, lo que permite la generación de mutantes homocigotos.
4. Selección estrés y el aislamiento de clones resistentes
- Asunto células doxiciclina tratados para la selección de la tensión
- 24 horas antes de pases células tratadas doxiciclina para la selección de la tensión, preparar las diez gelatiniza placas de 150 mm, el lugar en un 37 ° C, 5% de CO 2 humidificado incubadora.
- Preparar una suspensión de células individuales de cada sub-biblioteca por tripsinización (consulte la sección 1.4.1 y 1.4.2 para más detalles). Seed 6.6 x 10 6 células en cada placa de 150 mm en 30 ml de volumen total de la cultura, distribuir uniformemente las células. Se incuban las células con factor de estrés (10 mM paraquat u omisión de β-mercaptoetanol,en medio de células ES que contiene 7,5% de FBS inactivado por calor) durante 7 días, después de lo cual reemplazan con medio de células ES normales para permitir que las células supervivientes para crecer en colonias para el picking.
- Opcional: Congelar la izquierda sobre las células tratadas con doxiciclina en 5.0 x 10 6 células por vial.
- Escoja colonias resistentes a estrés
- Después de restablecimiento de los medios de comunicación normal para una semana, observan cuántas colonias resistentes a la tensión están presentes. Dependiendo del número de colonias para ser recogidos, preparar suficientes pozos con mitomicina C PMEF inactivado en placas de 96 Bueno, un día de antemano en consecuencia (véase la sección 1.1 para más detalles).
- En el día de la recolección, aspirado y reemplazar medio de la placa de alimentación de 96 pocillos con 100 l medio de células ES fresca, coloque de nuevo en 37 ° C, 5% de CO 2 humidificado incubadora. En este momento, preparar una placa de 96 pocillos de fondo en U con 50 l 0,25% de tripsina-EDTA por pocillo. Aspirar medio de la placa de selección de tensión de 150 mm y añadir evolumen qual de PBS.
- Establezca la micropipeta a 2 l, y el 'pick' colonias supervivientes en la tripsina de fondo en U que contiene pozos, recogiendo una colonia por pocillo. Es aceptable para que la placa de sentarse a temperatura ambiente hasta que el número deseado de colonias ha sido recogido. Entonces, se incuba la placa inferior U a 37 ° C, 5% de CO2 durante 10 min.
NOTA: Por lo general, se toma 1 hora para recoger 96 colonias. - Deje de reacción tripsina una fila a la vez con 50 l medio de células ES utilizando una pipeta multicanal. Pipeta arriba y abajo 15 veces para obtener una suspensión de células individuales y transferir 100 l de las células a la fila correspondiente de la placa de alimentación que ya contiene 100 l de medio de células ES. Complete la transferencia de toda la placa. Células de cultivo O / N en 200 l. A la mañana siguiente, el medio aspirado y reemplazar con 100 l medio de células ES.
- Replicar las placas de 96 pocillos
- Cuando los pocillos de las colonias escogidas son 80-90% confluent, replicar en dos placas coincidentes, uno para el aislamiento de ADN y el otro para las células de respaldo. Estas placas son gelatinizada y no contienen mitomicina C PMEF inactivado.
- Medio Aspirar y lavar con 100 l de PBS. Añadir 50 l 0,25% de tripsina-EDTA a cada pocillo, se incuba a 37 ° C durante 10 min. Detener la tripsina con 150 l medio de células ES, mezclar mediante pipeteo, y transferir 100 l de suspensión celular a la fila correspondiente de dos placas de 96 pocillos. Cambio de medio al día.
- Cuando las placas son 80 a 90% de confluencia, congelar un juego de placas como 'back-up' (consulte la sección 2.2 para más detalles). El otro conjunto de placas se expandió adicionalmente como se describe a continuación.
- Células en expansión para el aislamiento de ADN genómico
- Preparar una suspensión de células individuales en la placa de ADN de 96 pocillos (consulte 2.1.2 para más detalles).
- Transferir la suspensión de células de cada pocillo individual de la placa de 96 pocillos para el bienestar de un 24 pocillos placa (4 en total) utilizando un micropipette. Asegúrese de que no hay contaminación cruzada de las células, como las colonias escogidas 'son' clonal 'en su origen. Células de cultivo en medio de células 0,5 ml ES, el cambio de medio diario hasta los pozos son un 80-90% de confluencia.
NOTA: La placa de 24 pocillos permitirá rendimiento suficiente de ADN genómico para el análisis de PCR.
5. Identificación de los sitios de inserción de PB y Genes Trapped
- El aislamiento de ADN genómico de placa de 24 pocillos: células Lyse en la placa de 24 pocillos y aislar el ADN genómico de ARN libre.
- Realizar Splinkerette PCR (SpPCR) para generar fragmentos de secuencias que flanquean el sitio de integración transposón PB como se describe 7,8.
NOTA: SpPCR es un proceso de cinco días, a pesar de manos a tiempo cada día es mínima.
6. Análisis genético de los clones mutantes
- Busque maestro bien y purificar el clon de interés.
- Cuando el sitio de integración PB ha sidoasignada, diseñar un cebador directo aguas arriba del sitio de integración de usar con un cebador inverso PB (por ejemplo, PB3'-1) 8 y la pantalla de la placa de ADN correspondiente a la misma 'sub-biblioteca' desde el que se recogió el clon resistente al estrés. Espera encontrar sólo un bien positivo en toda la placa de ADN de 96 pocillos. Descongele esta exacta y de la placa de 'Maestro' a una placa de 24 pocillos en los alimentadores y hacer crecer las células hasta un 80-90% de confluencia.
NOTA: En este punto, esto también contiene una mezcla de clones genéticamente atrapado. - Cuando la placa de 24 pocillos es del 80-90% de confluencia, las células trypsinize y placa 1.000 células ES en una placa de alimentador de 100-mm (asegurarse de suspensión de células individuales). Pasaje las células restantes a un matraz T25 en los alimentadores de expansión. Congelar las células del matraz T25 cuando las colonias son el 80-90% de confluencia. Congele 4 viales por matraz T25 como copias de seguridad.
- Permita que las colonias crezcan durante 7 días y luego se recogen 96 colonias en un 96 pocillos feplaca de eder. Consulte la sección 4.2 para el procedimiento de recolección. Replicar la placa cuando esté listo en una placa de 'ADN' y congelar el otro como '2 nd -master' placa (consulte la sección 2.2 de congelación).
- Permitir colonias para llegar a un 80-90% de confluencia. Screen la placa de ADN para encontrar pozos que contienen el clon purificado de intereses. Expandir las células de la placa de 96 pocillos 2º -master de 24 pocillos y, posteriormente, a un matraz T25 (todo en alimentadores). Congele 4 viales por matraz T25.
NOTA: En este punto, la línea celular de genes atrapado es clonal, no se ha expuesto al factor de estrés, y es adecuado para la producción de ratón.
- Cuando el sitio de integración PB ha sidoasignada, diseñar un cebador directo aguas arriba del sitio de integración de usar con un cebador inverso PB (por ejemplo, PB3'-1) 8 y la pantalla de la placa de ADN correspondiente a la misma 'sub-biblioteca' desde el que se recogió el clon resistente al estrés. Espera encontrar sólo un bien positivo en toda la placa de ADN de 96 pocillos. Descongele esta exacta y de la placa de 'Maestro' a una placa de 24 pocillos en los alimentadores y hacer crecer las células hasta un 80-90% de confluencia.
- Determinar el número de inserción PB: Descongelar un vial de la línea celular resistente al estrés y expandir las células en un matraz T25 gelatinizada. Aislar el ADN genómico y verifique el número de copias del transposón PB. Esto se puede lograr por qPCR dirigida al gen de la neomicina.
- Medir el nivel de expresión génica: Después de confimediante tonos hay un solo evento de integración PB en la línea celular de interés, medir el nivel de expresión del gen atrapado por RT-qPCR usando sondas Taqman específicas para cada gen.
- Secuenciar el ARNm mutante: Generar una amplificación de cDNA por PCR utilizando una hibridación del cebador aguas arriba de un exón y un primer recocido posterior a la secuencia aceptora de empalme del casete trampa de genes. Secuencia del fragmento de ADNc para confirmar que el corte y empalme esperado se produce en el gen atrapado.
- Removilizar transposón piggyBac para probar la relación causal entre el gen atrapado y la resistencia al estrés.
- 24-48 h antes de la descongelación de las células de PB removilización, descongelación y la placa DR4 alimentadores en matraz de un T25 y dos placas de 100 mm. Por lo menos un día después de los alimentadores DR4 se sembraron en el matraz T25, descongelar un vial de la línea celular que contiene la inserción PB y la placa de las células en el matraz T25 que contiene alimentadores DR4. Cultivar las células en medio de células ESdurante 48 horas, cambiando de medio día.
- Preparar una suspensión de células individuales de las células ES. Contar las células con un contador de células automatizado, y la transferencia de 5.0 x 10 6 células ES a un tubo de 15 ml. Centrifugar a 100 xg, y resuspender las células en 800 l de PBS. Transferir la suspensión a una cubeta de 4 mm.
- Añadir 20 g mPBase Puro a la cubeta, mezclar con la pipeta, y las células electroporar (consulte la sección 1.4 para más detalles). Distribuir las células transfectadas en dos placas de alimentación DR4 100 mm. Células de cultivo O / N en medio de células ES.
- A la mañana siguiente, a alimentar las células con medio ES con células puromicina y cultura / ml 1 mg durante 48 horas. Retirar la selección puromicina y continuar para cultivar las células durante 5 días. Cuando las colonias son lo suficientemente grandes para recoger, recoger en una placa de alimentación de 96 pocillos (véase la sección 4.2).
- Cuando las células escogidas han alcanzado el 80-90% de confluencia, dividir 1/6 º de la placa en una placa de ADN y 1.6 º de la plcomió en una placa de G418, dejando 2/3 rds de las células en la placa original a congelar (consulte la sección 2.2 de congelación).
- Cultura la placa de ADN en medio de células ES para el aislamiento de ADN más tarde, y la placa de G418 en 150 mg / ml de G418 para poner a prueba la pérdida de resistencia a la neomicina. Wells sin células viables después de 72 a 96 h en cultivo que contiene G418 indican removilización exitosa del PB transposón gen que atrapan.
- Los pocillos correspondientes en la placa de 'DNA' serán seleccionadas por PCR para confirmar la transposón PB se ha eliminado. Cuando la placa de ADN es 90% confluentes, aislar el ADN genómico en formato de placa de 96 pocillos 4 para el cribado de PCR para la restauración de la secuencia de tipo salvaje y la ausencia de neo-IRES como un medio para confirmar la reversión.
- Descongele los pozos correspondientes de la placa principal a la placa de 24 pocillos y se expanda a un matraz T25 (todos con alimentadores). Congele cuatro viales por matraz T25 como respaldo.
7. Generación de Ratón Mutantes
- Recuperar células ES resistentes de las placas maestras y los utilizan para la inyección de embriones para generar quimera. Cerca de 15-20 células ES se inyectan en un individuo C57BL / 6 de blastocisto. Transferencia de 15 blastocistos por ratón en el útero de una hembra pseudopreñada (cepa ICR). Mate de la quimera masculina (indicado por el ES células color específico pelaje agouti) recuperado de la basura con varios jóvenes vírgenes C57BL / 6J hembras para poner a prueba para la transmisión de la línea germinal, y para construir una colonia de ratones mutantes.
- Aislar y fibroblastos de la piel de la cola de prueba de los ratones mutantes de F1 y de tipo salvaje camada de especies reactivas del oxígeno nivel y la resistencia (ROS) al paraquat 9.
Resultados
En un experimento típico mutagénesis, la transfección se compone de un total de 3 x 10 7 células madre embrionarias con PB-UPA y MPB transposasa. Los números de células ES de genes generadas atrapado en dos experimentos independientes se resumen en la Tabla 1. La eficiencia de atrapamiento de genes es de aproximadamente 0,04%. Las bibliotecas de genes trampa combinados contienen 22.400 mutantes independientes, acerca de una cobertura completa del genoma del ratón (23.000 genes codificantes). El exceso de cobertura podría lograrse mediante la generación de más mutantes mediante mutagénesis repetida y / o la ampliación del proceso.
Debido a que las bibliotecas de genes trampa contienen mutaciones al azar, no es posible predecir el número de mutantes que poseen un fenotipo de resistencia a la tensión. Se realizaron dos selecciones independientes para la resistencia PQ; la proyección combinada de 22.440 mutaciones gen-trampa independientes no cubierto 17 mutaciones que confieren resistencia celular a PQ (0,08%) (Tabla 1).
Hemos purificado 3 clones mutantes, la Pigl, Tiam1 y Rffl, desde las placas maestras para su posterior análisis y la producción de ratón. Las células con mutación Rffl heterocigotos fueron inducidos con éxito para producir progenie homocigótica al noquear a Blm. Sin embargo, no hemos podido producir ningún mutantes homocigotos de los mutantes Pigl y Tiam1, presumiblemente debido a una letalidad celular homocigosis ligado. La resistencia a la tensión de estos clones purificados se confirmó mediante el uso de 2 tipos diferentes de factores de estrés: omisión de 2-mercaptoetanol (2-ME) y PQ (Figura 2). Tras la eliminación de la PB partir de estos clones, el fenotipo de resistencia estrés asociado también se perdió (Figura 2), confirmando que las mutaciones de genes de trampa son el factor causal. Caracterización de los clones recuperados de las placas maestras es crucial, ya que descarta lesión estocástico durante la selección de estrés como la causa del fenotipo observado.
Fuera de 3células ES mutantes se introducen en blastocistos para la producción de ratón (Tabla 2), 2 líneas (Pigl y Tiam1) muestran la transmisión de la línea germinal. La inyección Rffl produjo sólo una quimera mujer que no era un número óptimo de quimera, para empezar. Por lo tanto, el fracaso de la transmisión de la línea germinal de Rffl es probablemente debido a uno quimera incompetente. Hemos probado el fenotipo celular de fibroblastos de la piel aisladas de los ratones mutantes Pigl y demostramos que mantuvieron el nivel reducido de especies reactivas del oxígeno endógenas (ROS), así como resistencia al estrés a PQ (Figura 3).
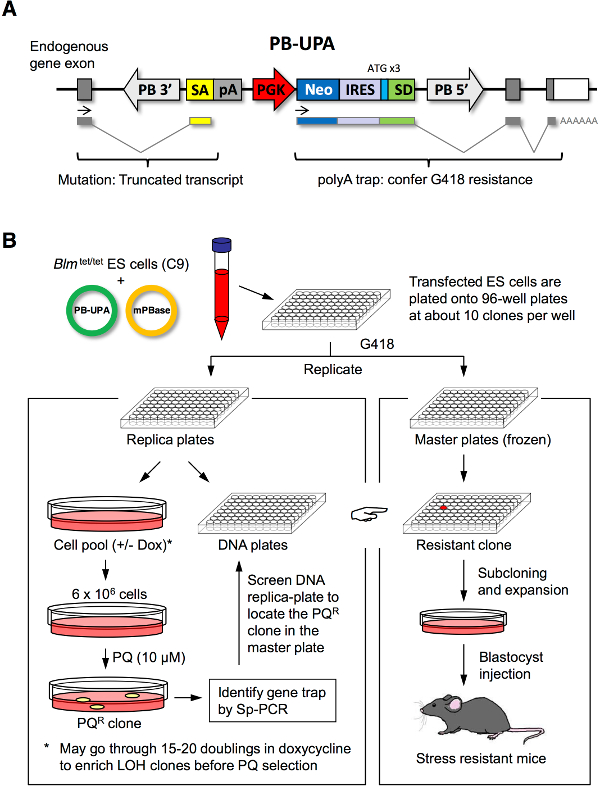
Figura 1. ES mutagénesis y selección de células estrés. Vector (A) PB-UPA. Un vector de polyA (UPA) trampa imparcial que comprende de un aceptor de empalme (SA), la señal de poli-ciclasa hormona de crecimiento bovina (pA), phosphoglycerate quinasa (PGK), el promotor de la neomicina fosfotransferasa (neo), sitio interno de entrada ribosomal (IRES), y un donador de empalme (SD) con ATG artificial (en 3 marcos de lectura diferentes) se clonó en el transposón piggyBac, flanqueado por el 3 ' y 5 'de repetición terminal larga (LTR). (B) La mutagénesis aleatoria de las células ES y selección para los clones resistentes a estrés. ES células fueron co-transfectadas por electroporación con PB-UPA y mPBase seguido por chapado en placas de 96 pocillos. Gene clones atrapados fueron seleccionados por resistencia a G418; una vez confluentes, que se dividieron en 2 conjuntos de réplicas. Set Una réplica se divide en dos mitades para el aislamiento de ADN y la selección de estrés por paraquat (PQ); otro conjunto de réplicas (maestro) se congeló abajo. Los supervivientes colonias de células ES recuperados del tratamiento de estrés se analizaron molecularmente para la inserción PB por Sp-PCR. Primers fueron diseñados para detectar la placa ADN réplica de la que el bien que contiene la SIBLIng PQ R clon podría estar situado en la placa maestra. Estas células son para el ensayo de resistencia al estrés en diferentes factores de estrés y para la producción de ratón. Modificado de polluelo et al. 7. Haga clic aquí para ver una versión más grande de esta figura.

Figura resistencia 2. El estrés en células madre embrionarias mutantes. (A) Resistencia a 2-mercaptoetanol (2-ME) retirada. (B) Resistencia al paraquat (PQ). Se muestran los de tipo salvaje células parentales ES (C9: amarilla), un control clon de células ES resistente a la tensión, (4C11: rojo), recuperado de un estudio previo 5, y tres clones gen-trampa (gris). Las células fueron sometidas a estrés tratamiento durante dos días, después de lo cual se contó el número de células viables. < em> heterocigotos Pigl, Tiam1 y Rffl. (PB / +: gris oscuro) resistencia exposición a estos dos factores de estrés Rffl homocigotos (PB / PB: negro) exhiben fuerte resistencia al estrés en comparación con los heterocigotos. La resistencia a los dos factores de estrés se perdió cuando las inserciones PB fueron retirados (+ / +: gris claro). Las barras de error representan SD de la media (n = 4). * P <0,001, # P = 0,01 entre los clones gen-trampa y el C9 parental de tipo salvaje, evaluados por la prueba t de Student. La formación de colonias (C) ES célula bajo PQ tratamiento (10 mM). Resistente a la tensión ES clones fueron capaces de formar colonias en cultivo bajo tratamiento PQ mientras que el número y tamaño de las colonias de la de tipo salvaje clon se redujeron significativamente. Modificado de polluelo et al. 7. Haga clic aquí para ver una versión más grande de esta figura.
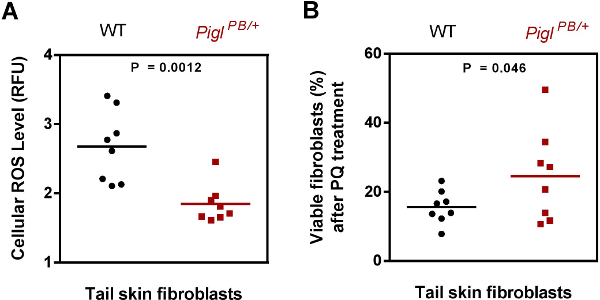
Figura 3. Caracterización de Pigl Pb / + fibroblastos. Nivel (A) las especies reactivas de oxígeno (ROS). Fibroblastos de la piel de la cola aislados de tipo salvaje (WT) y Pigl Pb / + ratones fueron teñidas con CM-DCFCA y la fluorescencia se normalizaron en contra de Hoechst. El contenido de ROS se expresó como unidad de fluorescencia relativa (RFU). El valor P se evaluó mediante la prueba t de Student de dos de cola (n = 8). (B) PQ resistencia. Fibroblastos de la piel de la cola de tipo salvaje (WT) y Pigl Pb / + ratones fueron expuestos a 4 mM PQ durante 6 horas, después de lo cual la viabilidad de las células se mide por ensayos de MTT. El porcentaje de células vivas después del tratamiento PQ se calculó mediante la relación de la absorbancia obtenida de la ce tratada-PQLLS y que a partir de las células de un-tratada. El valor P se evaluó mediante la prueba t de Student se cola (n = 8). Modificado de polluelo et al. 7. Haga clic aquí para ver una versión más grande de esta figura.
| Biblioteca | Sub-bibliotecas | Cepa de células ES | No. de gen atrapado clon | Número de clones PQ R |
| 1 | C9PA01 - C9PA10 | C9 (BLM tet / tet) | 9000 | 7 |
| 2 | C9PA11 - C9PA20 | C9 (BLM tet / tet) | 13440 | 10 |
| Cantidad | 22440 | 17 |
Tabla 1. PiggyBac gen-trampa de construcción de la biblioteca y la recuperación de los clones resistentes PQ. Modificado de polluelo et al. 7.
| Clon de células ES inyecta | Número de quimera recuperó | Transmisión de la línea germinal * |
| Pigl PB / Pigl + | 4 | Sí |
| Tiam1 PB / Tiam1 + | 2 | Sí |
| Rffl PB / Rffl + | 1 | No |
Tabla 2. Generación de ratones. Modificado de polluelo et al. 7.
* La transmisión de la línea germinal fue confirmada por la herencia del gen de la trampa alelo detectado por PCR genotipo.
Discusión
Forward genetic analysis allows for an unbiased interrogation of the genome for genes responsible for a specific phenotype. This method is very powerful to uncover novel gene functions. It has been widely used in lower organisms but not in mammal, such as the mouse, mainly due to the extremely high cost associated with the infrastructure and logistics that would entail. Here, we moved the genetic screening process to the ES cell culture platform, greatly increasing the efficiency and throughput in generating mutants and identifying mutations.
To effectively select for resistant mutants, a lethal dose of stressor and period of treatment needs to be established such that all of the wild-type cells would be killed. The higher the stringency of the selection, the fewer occurrence of false positive will result. Fibroblast feeders have a higher tolerance to oxidative stress than ES cells; the presence of feeders would rescue the nearby ES cells which would otherwise be killed by the stressor. Thus, omission of feeders during stress selection was very critical for an effective killing. In skin fibroblasts, serum deprivation was necessary to reveal the stress resistance phenotype in long lived mice 10. However, this application was not feasible in ES cells because they cannot survive without serum. As an alternative, we discovered that the use of heat inactivated serum at reduced level (7.5%) achieved a similar result.
In this report, we employed poly-A trap rather than a promoter trap because promoter trap will only trap actively transcribed genes, which is estimated to be 60% of the genome in ES cells, under normal conditions 11. In contrast, a poly-A trap would trap genes regardless of their transcriptional activities, in theory giving us the potential to screen for mutations in all genes in the genome. A major drawback of the conventional poly-A trap is the strong bias towards trapping the last exon, appeared to be mediated by an endogenous nonsense-mediated decay (NMD) mechanism 12. By incorporating the unbiased poly-A trap (UPA) strategy in the PB-UPA transposon to suppresses NMD 13, we were able to eliminate biased trapping.
One distinguishing advantage of using ES cells is that these pluripotent cells make direct derivation of mice possible, speeding up the transition to in vivo studies. For this to happen, the replica plating strategy is critical, preserving a subset of clones sheltered from manipulations that can diminish pluripotency, such as knocking out of Blm and exposure to stressors. We have shown that mutant ES cells recovered from these screens were capable of participating in forming the entire mouse and transmitting the mutations to the germline. Most importantly, consistent with previous studies, the stress resistance phenotype was also transmitted and maintained in the adult mouse.
We and others showed that a variant phenotype observed in ES cells resulting from environmental induced lesion or deliberated engineered mutations was able to transmit to the differentiated progeny cells 4,5,9,14, and probably the whole mouse. This protocol describes the utilization of ES cells as surrogate cells to screen for stress resistance mutations in the mouse. In addition to screening for stress resistance genes, this method may have a broader implication to screen ES cells, identify targets, and to develop a variety of mouse models with a phenotype of interest.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
We would like to thank the Wellcome Trust Sanger Institute for the gifts of piggyBac transposon and piggyBac transposase. This work was supported by the Butcher grant of Colorado and the NIH R01 AG041801 (W.S.C).
Materiales
| Name | Company | Catalog Number | Comments |
| Vector | |||
| PB-UPA | |||
| mPBase | |||
| mPBasePuro | |||
| Tissue Culture | |||
| 500-ml Stericup filters | EMD Millipore | SCGPU05RE | |
| 250-ml Stericup filters | EMD Millipore | SCGPU02RE | |
| 50-ml Steriflip-GV filters | EMD Millipore | SE1M179M6 | |
| KO DMEM | Life Technologies | 10829-018 | |
| DMEM | Sigma-Aldrich | D6429 | |
| FBS | Tissue Culture Biologicals | 104 | |
| Heat Inactivated FBS | Sigma-Aldrich | F4135-500 | |
| LIF | EMD Millipore | ESG1107 | |
| Non-essential Amino Acids | Life Technologies | 11140-050 | |
| GlutaMAX | Life Technologies | 35050-061 | |
| Pen/Strep | Life Technologies | 15140148 | |
| β-Mercaptoethanol | Life Technologies | 21985-023 | |
| Methyl Viologen dichloride (Paraquat) | Sigma-Aldrich | 856177 | |
| Dimethyl Sulphoxide Hybri-MAX | Sigma-Aldrich | D2650 | |
| EmbryoMAX 0.1% gelatin | EMD Millipore | ES006B | |
| DPBS/Modified | HyClone | SH30028.02 | |
| 0.25% Trypsin-EDTA | Life Technologies | 25200-056 | |
| T25 Flask | Corning | 353108 | |
| T75 flask | Corning | 353135 | |
| 100-mm plate | Corning | 353003 | |
| 150-mm plate | Corning | 430599 | |
| 96-well plate | Corning | 3585 | |
| 96-well U-bottom plate | Corning | 3799 | |
| 24-well plate | Corning | 3526 | |
| 50-ml reservoir | Corning | 4870 | |
| 15-ml tubes | VWR International, LLC | 82050-276 | |
| Primary Mouse Embryonic Fibroblasts | EMD Millipore | PMEF-NL | |
| DR4 Mouse Embryonic Fibroblasts | Applied StemCell | ASF-1001 | |
| Mitomycin C | Fisher BioReagents | BP25312 | |
| Geneticin (G418) | Life Technologies | 11811-023 | |
| Doxycycline | Fisher BioReagents | BP26531 | |
| Cryotubes | Thermo Scientific | 377267 | |
| Centrifuge | Eppendorf | Centrifuge 5702 | |
| TC10 cell counter | Bio-Rad | ||
| Counting Slides (for TC10) | Bio-Rad | 1450011 | |
| Electroporation | |||
| Gene Pulser Xcell | Bio-Rad | 1652611 | |
| Gene Pulser Cuvettes (4 mm gap) | Bio-Rad | 1652088 | |
| Molecular Biology | |||
| Thermal Cycler | Eppendorf | Mastercylcer ep Gradient S | |
| Puregene Core kit B | Qiagen | 158745 | |
| Topo-TA Cloning kit | Life Technologies | 450030 | |
| High Capacity cDNA synthesis kit | Applied Biosystems | 4368814 | |
| NaCl | Fisher BioReagents | BP358-212 | |
| 100% ethanol | Decon Laboratories, Inc. | 2716 | |
| Double Processed Tissue Culture Water | Sigma-Aldrich | W3500 | |
| Sau3A1 | New England BioLabs | R0169L | |
| T4 DNA Ligase | New England BioLabs | M0202T | |
| EcoRV | New England BioLabs | R3195S | |
| 96-well Lysis Buffer (Ramires-Solis et al. 1992) | |||
| Trizma Base | Sigma-Aldrich | T1503 | |
| Hydrochloric Acid | Fisher BioReagents | A144-212 | |
| EDTA | Sigma-Aldrich | E5134 | |
| N-Lauroylsarcosine sodium salt | Sigma-Aldrich | L5777 | |
| Proteinase-K | Fisher BioReagents | BP1700 | |
| Electrophoresis | |||
| Mini-Sub Cell GT | Bio-Rad | 170-4469EDU | |
| LE Agarose | GeneMate | E3120500 | |
| Ethidium Bromide | Fisher BioReagents | BP1302 | |
| 100 BP DNA Ladder | New England BioLabs | N3231S | |
| 1Kb DNA Ladder | New England BioLabs | N3232S | |
| 2-log DNA Ladder | New England BioLabs | N3200L |
Referencias
- Johnson, T. E., et al. Longevity genes in the nematode Caenorhabditis elegans also mediate increased resistance to stress and prevent disease. J Inherit Metab Dis. 25, 197-206 (2002).
- Murakami, S., Salmon, A., Miller, R. A. Multiplex stress resistance in cells from long-lived dwarf mice. Faseb J. 17, 1565-1566 (2003).
- Perez, V. I., et al. The overexpression of major antioxidant enzymes does not extend the lifespan of mice. Aging Cell. 8, 73-75 (2009).
- Martin, G. M. Genetic engineering of mice to test the oxidative damage theory of aging. Ann NY Acad Sci. 1055, 26-34 (2005).
- Chick, W. S., Drechsel, D. A., Hammond, W., Patel, M., Johnson, T. E. Transmission of mutant phenotypes from ES cells to adult mice. Mamm Genome. 20, 734-740 (2009).
- Ramirez-Solis, R., et al. Genomic DNA microextraction: a method to screen numerous samples. Anal Biochem. 201, 331-335 (1992).
- Uren, A. G., et al. A high-throughput splinkerette-PCR method for the isolation and sequencing of retroviral insertion sites. Nat Protoc. 4, 789-798 (2009).
- Wang, W., Bradley, A., Huang, Y. A piggyBac transposon-based genome-wide library of insertionally mutated Blm-deficient murine ES cells. Genome Res. 19, 667-673 (2009).
- Chick, W. S., et al. Screening for stress-resistance mutations in the mouse. Front Genet. 5, 310 (2014).
- Salmon, A. B., et al. Fibroblast cell lines from young adult mice of long-lived mutant strains are resistant to multiple forms of stress. Am J Physiol Endocrinol Metab. 289, 23-29 (2005).
- Skarnes, W. C., et al. A public gene trap resource for mouse functional genomics. Nat Genet. 36, 543-544 (2015).
- Baker, K. E., Parker, R. Nonsense-mediated mRNA decay: terminating erroneous gene expression. Curr Opin Cell Biol. 16, 293-299 (2004).
- Shigeoka, T., Kawaichi, M., Ishida, Y. Suppression of nonsense-mediated mRNA decay permits unbiased gene trapping in mouse embryonic stem cells. Nucleic Acids Res. 33, e20 (2004).
- Symula, D. J., Zhu, Y., Schimenti, J. C., Rubin, E. M. Functional annotation of mouse mutations in embryonic stem cells by use of expression profiling. Mamm Genome. 15, 1-13 (2004).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados