Method Article
Bir Fare Modeli Doku mühendisliği Kapların Üretimi ve Tırnak
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, biz çift tohumlama kısmen uyarılmış pluripotent kök hücre ile farelere aşılama için fonksiyonel doku mühendisliği gemi greft oluşturmak için bir protokol mevcut (PiPSC) - Bir decellularized damar iskele biyoreaktör üzerinde elde edilen endotel hücreleri - düz kas hücreleri ve PiPSC türetilmiş.
Özet
The construction of vascular conduits is a fundamental strategy for surgical repair of damaged and injured vessels resulting from cardiovascular diseases. The current protocol presents an efficient and reproducible strategy in which functional tissue engineered vessel grafts can be generated using partially induced pluripotent stem cell (PiPSC) from human fibroblasts. We designed a decellularized vessel scaffold bioreactor, which closely mimics the matrix protein structure and blood flow that exists within a native vessel, for seeding of PiPSC-endothelial cells or smooth muscle cells prior to grafting into mice. This approach was demonstrated to be advantageous because immune-deficient mice engrafted with the PiPSC-derived grafts presented with markedly increased survival rate 3 weeks after surgery. This protocol represents a valuable tool for regenerative medicine, tissue engineering and potentially patient-specific cell-therapy in the near future.
Giriş
vasküler kanalların yapımı kardiyovasküler hastalıklar sonucu hasar ve yaralı damarların cerrahi onarımı için bir temel stratejidir. , Alograftlarını, otolog doku (perikard veya safen ven) ve xenografts 1; Bugüne kadar, cerrahide kullanılan greft materyalleri biyouyumlu sentetik polimerler ([Gore-Tex ePTFE] veya polietilen tereftalat [Dacron] politetraflüoroetilen [Teflon], genişletilmiş politetrafloroetilen) içerir. Yapay greftler (örn, Gore-Tex ve Dacron) en sık kullanılan iken, bu malzemeler büyük olasılıkla darlık, kalsiyum birikimi, trombo-embolizasyon ve enfeksiyonlar dahil birçok kısa ve uzun vadeli komplikasyonlara neden. Ile mevcut biyolojik greft olan hastalar tromboembolik olaylar azalmış olsa da, hala bu tür kireçlenme bozulması 2 sayesinde ikincil greft yetmezliği ve kısaltılmış dayanıklılık gibi sınırlamalarla karşılaşabilirler. Bu nedenle, cerrahi t önemli gelişmelere rağmenyaş, araştırmacılar ve klinisyenler üzerinde tekniki hala damar hastalıkları için ideal bir kanal tanımlamak için ihtiyaç yükü vardır. Daha yakın zamanlarda, vasküler doku mühendisliği araştırma alanı hücreleri başarılı aşılama 1 için fonksiyonel gemi özetler bir biomimetic ortamı yaratmak amacı ile, biyolojik olarak parçalanabilen iskeleleri dahil edildiği bir kavram üretti. Temelde, vasküler yapıların başarısı üç temel bileşenleri bağlıdır; yani iskele, bir endotelyal hücre iç tabaka ve bir düz kas hücresi tabakası, ana damar karşılaştırılabilir mekanik özelliklerinin temin edilmesi için uygun olan hücre dışı matris içeren bir iskele ve / regülatör başlatılması için gerekli olan hücre / moleküler sinyali meydana getiren hücreler onarım.
Uzun vadeli greft açıklığı ve neo-dokuların sürekli gelişim, inci iskelelerinin etkin hücre tohumlama son derece bağımlı olanereby kritik öneme sahip, hücre tipi kararını hale getirir. Çeşitli raporlar, küçük çaplı devreleri 3-6 geliştirmek için olgun endotelyal ve çeşitli kaynaklardan yumuşak kas hücrelerinin kullanımını göstermektedir. Umut verici olmasına rağmen, yeterli otolog damarların olmaması, olgun endotel ve düz kas hücrelerinin önemli bir yük olarak kalmaktadır elde edildi. Daha yakın zamanlarda, çeşitli kaynaklardan alınan kök hücreler vasküler doku mühendisliği uygulamaları için istismar edilmiştir. Gerçekten de, embriyonik kök hücreler 7 de dahil olmak üzere, kök hücre tipleri, çeşitli uyarılmış pluripotent kök hücreler (iPSCs) 8,9, PiPSC 10,11, kemik iliğinden türetilmiş mononükleer hücreler, 12, mezenkimal kök hücreler 13, endotelyal progenitör hücreler ve erişkin damar duvarı kök türevi hücre antijeni-1 (Sca-1) + 14,15 tanımlanmış tüm ortam yanıt olarak fonksiyonel endotel veya düz kas hücreleri ya da farklılaşma yeteneğine sahip olduğu gösterilmiştir kök / progenitör hücreleri veKültür koşulları. Ayrıca, kök hücrelerin sınırsız kendini yenileme kapasitesi onlara olgun endotel ve sadece büyüme tutuklama ve yaşlanmayı geçiren kez önce sonlu sayıda bölebilirsiniz düz kas hücrelerinin aksine daha aday olun.
aşılama gibi biyouyumluluk, biyomekanik özellikleri ve biyolojik ayrışma oranı gibi çeşitli faktörlere bağlıdır için iskele malzemesinin seçimi başarılı doku mühendisliği gemi üretmek için. Temelde, malzeme biyobozunur olmalıdır greft için iskeleler oluşturmak için kullanılan ve gereksiz alıcı bağışıklık yanıtları monte olmaz. Ayrıca, hücre eki ve sonraki yaşam için uygun bir gözeneklilik ve mikro kapsaması gerekir. Bugüne kadar, vasküler doku mühendisliği iskeleleri için kullanılan en yaygın malzeme poliglikolik asit, polilaktik asit, ve poli ε-kaprolakton 16 polimerleri içerir. Daha yakın zamanlarda, decellularized biyolojik maddeler varAyrıca bazı başarı ile uygulanmıştır. Çeşitli laboratuarlar otolog hücreler hücresizleştirilmiş bir insan, köpek veya domuz damarları tohumlama pıhtılaşma ve intimal hiperplazi 17-19 karşı biyolojik bir greft mesafede olduğunu göstermiştir. Vasküler doku mühendisliğinde diğer stratejiler iskele desteği 20, 21 olmadan örneğin hücre dışı matriks proteinleri tabanlı vasküler greft, fibrin jel 13 tohumlama hücreleri ve üreten hücre tabakaları içerir.
Mevcut protokol fonksiyonel endotel ve düz kas hücreleri, ağır kombine immün yetmezlik içine doku mühendisliği gemilerin fonksiyonel PiPSC türetilmiş damar hücrelerini liman için decellularized damar iskele oluşan biyoreaktör ve grefti nesil (SCID içine insan PiPSC farklılaşmasını gösteriyor ) fareler. PiPSC bu hücreler farelerde tümörler oluşturur ya da etik zam yok, çünkü damar greft doku mühendisliği için kullanılacak optimum hücre tipi veallo-immün yanıtlar. Ayrıca, biz pip-endotel hücreleri ve tırtıl-düz kas hücrelerinin üretilmesi için strateji verimli ve 10,11 tekrarlanabilir olduğunu göstermiştir. Bundan sonra, biz, böylece aşılama ve hayatta kalma etkinliğini arttırmak, yakından bir yerli geminin içinde var matriks proteinleri taklit etmek PiPSC türetilmiş vasküler hücrelerin tohumlama için bir decellularized gemi tasarladı. Bundan başka, tohumlama PiPSC damarların decellularization makrofajlar gibi bağışıklık hücre tipleri ile monte enflamatuar yanıtların ortaya çıkmasını engellemektedir. Daha da önemlisi, bu protokol sadece insanlar içine çeviri için damar olukları umut oluşturmak için bir metodoloji temsil etmez, aynı zamanda eğitim ve fare modelleri ile vasküler doku yenilenmesini yöneten moleküler mekanizmaları anlamak değerli bir araç sağlar.
Protokol
Laboratuvar Hayvanları Kullanımı ve Bakımı Kurumsal Komitesi tarafından onaylanan protokollere göre tüm hayvan deneyleri.
Kültür Medya 1. Hazırlık
- F-12K ortamı,% 10 fetal sığır serumu (FBS) ve 100 U / ml penisilin ve streptomisin: insan fibroblast hücre çizgisi CCL-153 kültür ortamı olun.
- PiPSC üretimi için yeniden programlanması Ortamın: Nakavt Dulbecco modifiye kartal ortamı (DMEM)% 20 Nakavt serum değiştirilmesi, 0.1 mM β-merkaptoetanol, 0.1 mM Minimum Esansiyel Medium (MEM) Aslî Olmayan Amino Asitler, 10 ng / ml temel fibroblast büyüme faktörü 2 (bFGF-2) ve 100 U / ml penisilin ve streptomisin üzerine yayıldı. Medyayı kullanmadan önce bFGF-2 taze her zaman ekleyin.
- Düz kas hücresi uyarılması için Farklılaşma Ortamı (DM) olun (SMC) farklılaşması:% 10 FBS, 0.1 mM β-merkaptoetanol, 100 U / ml penisilin ve streptomisin ve 25 ng / ml Platelet Derive Büyüme Faktörü içeren medya-MEM α(PDGF-ββ).
- Yap Endotel Farklılaşma Ortam endotel hücre (AK) farklılaşmasını uyarması (AT-DM): Endotel Büyüme ortamı-2 (EGM-2), 50 ng içeren ortam / ml Vasküler Endotel Büyüme Faktörü (VEGF) ve 100 U / ml penisilin ve streptomisin üzerine yayıldı.
Kısmen kaynaklı Pluripotent Kök Hücre içine 2. yeniden programlanması İnsan Fibroblastlar (PiPSC)
- Kültür ortamı içinde,% 0.04 jelatin çözeltisi kaplamalı şişeler Kültür insan fibroblast hücre çizgisi CCL-153.
- Geçiş hücreleri 1 arasında bir oranda her 3 günde bir, 6. PiPSC kuşak en yüksek verimlilik için geçit 9 önce hücrelerin kullanın. % 90 ortak akışkanlığa - Hücreler 80 ulaştıktan sonra transfeksiyon için hazırdır.
- 4 yeniden programlama faktörleri içeren polisistronik plazmid pCAG2LMKOSimO linearize oktamer bağlayıcı transkripsiyon faktörü 4 (Oct4), Sox2 Kruppel benzeri faktör 4 (Klf4) ve c-myc (pCAG-OSKM). 37 ° C'de 3 saat Pvu I kısıtlama enzimi 5 adet olan plazmid 5 ug Digest. Arındırmaküreticinin protokolüne göre, ticari bir kit kullanılarak plazmid.
- Transfekte üreticinin protokolüne uygun olarak insan deri fibroblast (NHDF) nucleofection kiti ile elektroporasyon yoluyla doğrusallaştırılmış pCAG-OSKM plazmid 4 ug 2 x 10 6, insan fibroblast. Yavaşça önceden ısıtılmış yeniden programlanması Medya 5 ml ihtiva eden ön% 0.04 jelatin kaplı T25 şişesi üzerine transfekte edilmiş hücreleri, tohum.
- 24 saat sonra, transfekte edilen hücrelerin saf popülasyonu seçmek için 25 ug / ml neomisin ve ek orta değiştirin.
- 4 gün kadar her gün orta değiştirin.
Not: İnsan fibroblastları yeniden programlama 4 gün sonra PiPSC olur.
Endotel ve düz kas hücrelerinin içine PiPSC 3. Farklılaşma
- 4 gün boyunca DM içeren kolajen IV önceden kaplanmış yemekleri Tohum PiPSC SMC'ler içine farklılaşmayı teşvik etmek. 4 gün kadar her gün orta değiştirin.
- Kolajen IV önceden kaplanmış yemekleri c Tohum PiPSC6 gün süre ile endotelyal-DM ontaining endotel hücrelerine farklılaşmasını uyarması. 6 gün kadar her gün orta değiştirin.
4. decellularized Aort Greft Hazırlanması
Not: Tüm çözümler ve ekipman steril olmalıdır.
- Servikal dislokasyon ile fare Kurban ve diseksiyon mikroskop altında yatar pozisyonda fare sabitleyin.
- Göğüs boşluğu açmak için sternum üzerinden ve göğüs kafesi etrafında kesin. Aorta maruz kalp, akciğerler ve yemek borusu çıkarın. Yavaşça forseps ile peri-aort yağ çıkarmak.
- Makasla ön ucundan aort kesin ve hafifçe künt forseps ile sona tutun. Künt diseksiyon ile arkasında omurga sütununda aort ayırın. Dikkatle bipolar elektrokoagulatör ile ligasyonu ile aort tüm dallanma arterlerin kapatın ve makas ile ligasyon uzak ucundan kesim.
- 3 m ile aort lümeni temizlemek için bir 5 ml şırınga kullanınkan pıhtılarının oluşumunu önlemek için, heparin, 100 U ihtiva eden tuz çözeltisi l.
- Böbrek içine şube önce aort arka ucunu kesin. Aort bütünlüğünü tutulması tüm prosedür sırasında çok önemlidir.
- Fosfat tamponlu tuzlu su (PBS) içinde sulandırılmış% 0.075 sodyum dodesil sülfat (SDS) çözeltisi, 5 ml ile aort lümeni yıkayın.
- 10 cm Petri kabındaki 0.075% SDS çözeltisi içinde torasik aorta bekletin. Oda sıcaklığında 150 rpm'de 2 saat boyunca orbital bir karıştırıcı üzerinde Petri tabağına yerleştirin.
- PBS 5 ml aort lümeni yıkayın.
- 10 cm Petri için PBS içinde aort bekletin. Oda sıcaklığında 150 rpm'de 2 saat boyunca orbital bir karıştırıcı üzerinde Petri tabağına yerleştirin. PBS her 20 dakikada yenileyin.
- PBS 5 ml aort lümeni yıkayın.
- En fazla bir hafta boyunca 4 ° C'de PBS içinde hücresizleştirilmiş aort greft tutun.
PiPSC ve Biyoreaktör Havalandırma 5. Çift Tohumculuk
Not: Tüm çözüms ve ekipmanlar steril olmalıdır. Bir doku kültürü kaputu tüm işlemleri gerçekleştirin.
- Şekil 1'de gösterildiği gibi. Biyoreaktör akış devreyi kurunuz boru ile kuluçka odasına, medya rezervuar, peristaltik pompa ve uyum odasını bağlayın. Dolaşımı için gerekli ortamın az hacmi 40 ml'dir.
- Ön-koşul, bir 10 cm Petri için DM ortamı aortu ıslatılması ile kültür ortamı ile hücresizleştirilmiş damar. Oda sıcaklığında 50 rpm'de 1 saat boyunca orbital bir karıştırıcı üzerinde Petri tabağına yerleştirin.
- Mikroskop altında decellularized kabın iki ucunda içine 1 cm uzunluğunda Naylon tüpleri (OD 0.9 mm, ID 0.75 mm) takın. Gemi ve 8-0 ipek dikişlerle tüpleri kravat.
- Bölme duvar giriş ve çıkış portları (1/32 "boru) ile Naylon tüpler bağlanarak kuluçka odasında decellularized aort greft birleştirin. Orta 5mls her seferinde inkübasyon odası koruyun.
- Ekleyerek önceden ısıtılmış tarafından Trypsinize PiPSCtripsin kültür çanak kapağı ve hafifçe çanak 10 kez rock. Tripsin atın ve 2 inkübatör çanak bırakın - 3 dk. Tabak önceden ısıtılmış bir kültür ortamı ilave edin ve hücreleri ile orta karıştırın.
- Hemasitometre kullanarak hücre sayısını sayın. Santrifüj 300 x g 5 dakika boyunca 5 x 10 5 hücre, her biri hücre süspansiyonları iki alikot. Tamamen süpernatant aspire.
- Tamamen süpernatant aspire sonra, DM 50 ul pip hücre pelet 1 pelletini. Decellularized damar lümenine bu hücre süspansiyonu enjekte.
- Ardından, Matrigel 100 ul diğer tırtıl hücre pelletini. Dikkatle decellularized aort greft üzerine karışımı pipetle.
- Karışım damar dış yüzeyi etrafında sarar eşit bir jel gibi devlet dönüşür kadar 15 dakika - 10 için bekleyin. DM inkübasyon odası doldurun.
- 37 ° C'de bir% 5 CO2 inkübatörü içinde ayarını bütün biyoreaktör yerleştirin. Elle ilk 2 saat içinde decellularized greft boyuna ekseni her yarım saatte yaklaşık 90 ° döndürün.
- Hücre yapışmasını sağlamak için 12 saat için statik kültür tutun.
- Düz kas hücre değişimini etkileme peristaltik pompa ile lümen yoluyla DM verin. 5 ml / dakika ve 24 saat boyunca 20 ml / dakika için adım adım artış, başlangıç akış hızını başlatın.
- 24 saat süre ile 20 ml / dak dolaşım aracı, akış hızı tutun.
- Orta akışını durdurun ve inkübatör dışına ayarı biyoreaktör taşımak.
- Yeniden tohum PiPSC ile greft lümen. 5.6 - Trypsinize, adımlarda 5.5 olarak saymak ve santrifüj 1 x 10 6 PiPSC. 50 ng / ml VEGF ihtiva eden EGM-2 ortamında 50 ul içinde tekrar süspansiyon hücreleri. Greft lümenine hücre karışımı enjekte edilir.
- Endotel değişimi etkilemek için 50 ng / ml VEGF ihtiva eden EGM-2 ortamında inkübasyon odası ve bütün dolaşımda orta değiştirin.
- Inci geri ayarı biyoreaktör TaşıE inkübatör. Manuel greft ilk 2 saat içinde 90 ° her 30 dk döndürmek ve daha sonra 12 saat için statik bir kültür tutun.
- 5 ml / dakika ve 35 ml / dak kadar adım adım artış, akışı dolaşan başlatın. 5 gün boyunca 35 ml / dakika akış hızındaki tutun. Her gün dolaşan ve oda ortamı değiştirin.
- Fare daha fazla aşılama için tasarlanmış greft Hasat.
Fareler içine Çift numaralı seribaşı PiPSC Graft 6. Tırnak
- Kullanım NOD.CB17-Prkdc scid / damar grefti alıcı olarak NcrCrl erkek fareler. 35 gr, ve iyi sağlık koşulları içinde - Her zaman fareler, yaklaşık 10 haftalık olan yaklaşık 25 tartmak emin olun.
- Periton boşluğu içine Hypnorm (25 mg / kg) ve Hypnovel (25 mg / kg) 'in bir bileşimini vermek suretiyle alıcı fare anestezisi. Anestezi altında iken kuruluğu önlemek için göze vazelin oftalmik merhem sürün. Fareler rahat kasları var ve sürekli nefes sağlayarak verimli anesthetization onaylayın.
- Onun boynu tıraş ve genişletilmiş bir yatar pozisyonda fare sabitleyin. Fare solunum yolu açık kalmasını sağlamak için anestetikler ile kombinasyon halinde atropin sülfat (1,7 mg / kg) uygulayınız.
- Fare sternum alt çenenin bir orta hat kesi hazırlayın. 5- ila 10 kat büyütme ile bir mikroskop altında, yanal sağ tükürük bezleri kaldırın ve sağ karotis arter ortaya çıkarmak için doğru cleidomastoid kas çıkarın.
- Yavaşça yakın ucuna doğru uzak ucundan sağ ortak karotid arteri harekete geçirmek için bağlanmış dokular çıkarın. Bir 8-0 ipek sütür ile iki kez karotis arter orta kısmını bağlayan ve iki bağları arasında teşrih.
- Her gemi sonunda otoklav naylon tüp yapılmış bir manşet geçmek ve microhemostat kelepçeleri her ucunu sabitleyin.
- Bir ucunda dikiş bağı sökün ve heparinin bir damla (100 U / ml) uygulanır. Hemen sonra, th uzak ucunu terse arter tüm manşet vücudu kapsayacak ve manşete bir 8-0 ipek sütür ile ters gemi düzeltmek için.
- Arterin diğer kısmına aynı işlemi tekrarlayın. Tuzlu su çözeltisi ile yıkayın arter kan pıhtıları kaldırmak için.
- Arter manşetleri aşkın decellularized damar uçlarını sürgülü ve 8-0 ipek sütür ile sabitlemek karotis arter iki ucu arasında bir decellularized damar grefti implante. Greft atışını değerlendiren önce ya biter vasküler kelepçeleri çıkartın.
- Geri orijinal konumuna doğru tükürük bezi yerleştirin. 6-0 polyglactin sütür kullanarak bir kesintiye sütür ile cerrahi yere cilt kapatın.
- Prosedür tamamlandıktan sonra bilincini yeniden başlayıncaya kadar tutarlı, fare hayati belirtilerini gözlemlemek. Servikal dislokasyon ve hasat damar grefti ile 24 saat ya da daha sonra daha fazla analiz için 3 hafta ya alıcı fareler Kurban.
Sonuçlar
PiPSC başarılı üretimi 4 transkripsiyon faktörleri, Oct4, Sox2, Klf4 ve c-myc (OSKM) taşıyan bir doğrusallaştırılmış pCAG2LMKOSimO plazmitle insan fibroblastları nucleofecting 4 gün sonra doğrulanmıştır. PiPSC fibroblastlar (Şekil 2A) ile karşılaştırıldığında belirgin bir şekilde farklı bir fenotipini gösterdi ve mRNA (Şekil 2B) ve protein (Şekil 2C) seviyelerinin 10 4 yeniden programlama faktörleri olarak ifade edilmiştir. Bir PiPSC tabanlı vasküler greft etkinliği olarak endotel ve düz kas soy ayırt etmek PiPSC kabiliyeti son derece bağlıdır. Bu Şekil 3. Damar greftleri oluşturmak için bunları kullanan önce oluşturulmuş ortam içinde hücrelerin farklılaşma ile in vitro PiPSC bu özellikleri teyit etmek için kritiktir (her iki geni (Şekil 3A) fonksiyonel endotel hücrelerine farklılaşmak üzere PiPSC kapasitesini gösterir ve protein Şekil 3B-D) levels, endotel-spesifik belirteçler 10 dayalı. Benzer şekilde, PiPSC da özel bir ortam (Şekil 3E-H) 11 tepki olarak, düz kas soy ayırt etmek mümkün bulunmaktadır.
Tüm aort decellularization SDS, hücreler lize ve sitoplazmik eritmesi bir anyonik deterjan ile muamele ile elde edilmiştir. Taze hasat edilmiş aort (Şekil 4A-B), 22 ile karşılaştırıldığında tedavi 2 saat sonra, hücresizleştirilmiş aort saydam bir hücresel olmayan yapı iskelesi olarak ortaya çıktı. Şekil 4C-F histolojik değerlendirme değil, normal fare aorta, çekirdeklerin veya decellularized damarlarda sitoplazmik boyanma olmadığını göstermektedir. PiPSC türevli endotel ve hücresizleştirilmiş aorta düz kas hücrelerinin iki tohum sonra, mühendislikten geçirilen vasküler greftler, sırasıyla endotel ve düz kas hücre özellikleri gösterir. Çift-s Hematoksilen ve eozin (HE) boyamadüz kas-22α (SM22), düz kas-α aktin için pozitif boyanma (SMA) tarafından tespit edildiği gibi eeded greft, düz kas hücrelerinin ve endotel hücrelerin tek bir tabakası bulunan çok katmanlı doğal damarlara (Şekil 4G) benzer bir mimari ortaya sırasıyla (Şekil 4H-M) 11 CD31 ve CD144 belirteçleri.
In vivo doku mühendisliği damarların açıklığını doğrulamak için çift tohumlu PiPSC türetilmiş kaplar farelere aşılandı - normal fare ve hücresizleştirilmiş arterler iki kontrol grubu olarak kullanıldı. Daha sonraki analiz fareler gibi erken 1 gün gibi oldukça yüksek mortalite oranları ile sunulan decellularized gemiler ile aşılanmış ise, PiPSC damar greft 3 hafta 11 transplantasyon (Şekil 5A) sonra% 60 sağkalım oranı haiz olduğunu göstermiştir. Buna ek olarak, 3 haftalık PiPSC türetilmiş greft tamamen insan PiPSC türetilmiş endotelyal mevcudiyeti için karakterize edilmiş ve düz kas hücreleri ve ana makrofaj infiltrasyonu (Şekil 5B ve Tablo 1) 11. Birlikte ele alındığında, sonuçlar PiPSC her iki damar soy içine ayırt etme kapasitesine sahip ve in vivo olarak ana damarların yerini işlevsel doku mühendisliği damarları üretilmesi için etkili olduğuna işaret etmektedir.
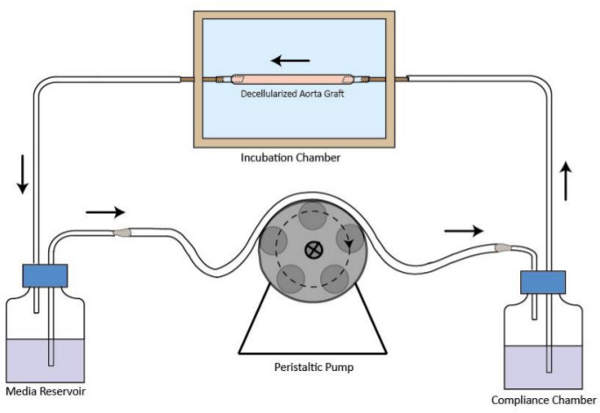
Decellularized greft biyoreaktör akım devresi 1. şematik gösterimi Şekil. Decellularized damar greft kuluçka odasına monte edilir. Bir peristaltik pompa istikrarlı orta perfüzyon akışını sağlamak için kuluçka odasının memba yer almaktadır. Medya rezervuar kuluçka odasının mansabında yer almaktadır. uyum odası akış sistemi iyileştirmektir. akış yönü oklarla gösterilmiştir.large.jpg "target =" _ blank "> bu rakamın daha büyük bir versiyonunu görmek için burayı tıklayınız.

Şekil insan fibroblastlar gelen PiPSC 2. Nesil. İnsan fibroblastlar ya dört yeniden programlanması genler ile nucleofected edildi (Oct4, Sox2, Klf4 ve C-MYC) veya boş vektör (kontrol). (A) Faz kontrast resimler 4 gün sonra pip morfoloji göstermektedir. PiPSC mRNA (B) ve proteinin (C) düzeyinde dört transkripsiyon faktörleri, ifade edilmektedir. Gösterilen görüntüler için Ölçek çubuğu 50 mikron olan ve veri ortalama ± SEM (n = 3); * P <0.05, *** p <0.001. Bu rakam Margariti, A. et al modifiye edilmiştir. 10 Bu rakamın büyük halini görmek için lütfen buraya tıklayınız. </ A>
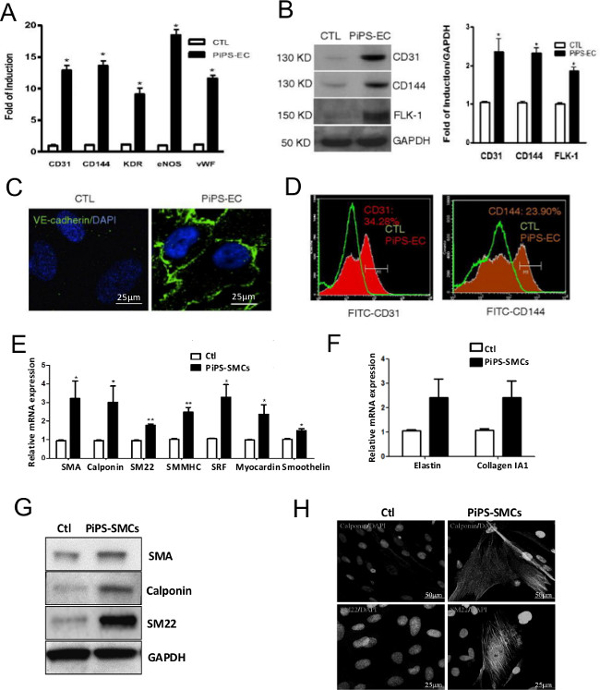
PiPSC olarak endotel ve düz kas hücrelerinin farklılaşabildiği Şekil 3.. PiPSC veya kontrol hücreleri, endotelyal hücreler içine farklılaştırılmıştır. Kontrol hücreleri ile karşılaştırıldığında (A), endotel hücreleri PiPSC türevi örneğin CD31, CD144, kinaz ek alanı reseptörü (KDR), mRNA endotel nitrik oksit sentaz (NOS) ve von Willebrand faktörü (vWF) ve endotel spesifik ifade edilen işaretçileri değiştirmemiştir seviye. (B) bu Western blot analizi kullanılarak protein düzeyinde doğrulandı. (C) İmmünofloresan boyama CD144 PiPSC-endotelyal (VE-kaderin) pozitif boyanma belirtilen, ancak hücreleri kontrol edemez. (D) Akış sitometrik analizi CD31 ve CD144 ve PiPSC-endotel hücre ifadesini doğruladı. Kollajen IV numaralı seribaşı PiPSC (veya kontrol hücreleri) de içine farklılaştırılmış edildidüz kas hücreleridir. (E, F), kontrol hücrelerine aksine, PiPSC türetilen düz kas hücreleri SMA calponin, SM22, düz kas miyozin ağır zincir II (SMMHC), serum yanıt faktörü (SRF) de dahil olmak üzere gen seviyesinde düz kas özel ifade edilen işaretçileri değiştirmemiştir , myocardin, smoothelin, elastin ve kolajen 1A1. (G) PiPSC türetilmiş hücrelerde SMA calponin ve SM22 ekspresyon seviyeleri, Western blot analizi kullanılarak teyit edilmiştir. Konfokal mikroskopi kullanılarak (H) İmmünofloresan boyama calponin ve SM22 için tipik bir düz kas işaretleyici boyama gösterdi. Veriler ortalama ± SEM temsil eder (n = 3); * P <0.05, ** P P <0.01, *** P <0.001. Gösterilen görüntüler için Ölçek çubuğu 25 mikron ya da 50 mikron bulunmaktadır. Bu rakamlar Margariti, A. ve diğ., 10 ve Karamariti, ve ark. 11 E. değiştirilmiş edinBu rakamın büyük halini görmek için buraya tıklayın.
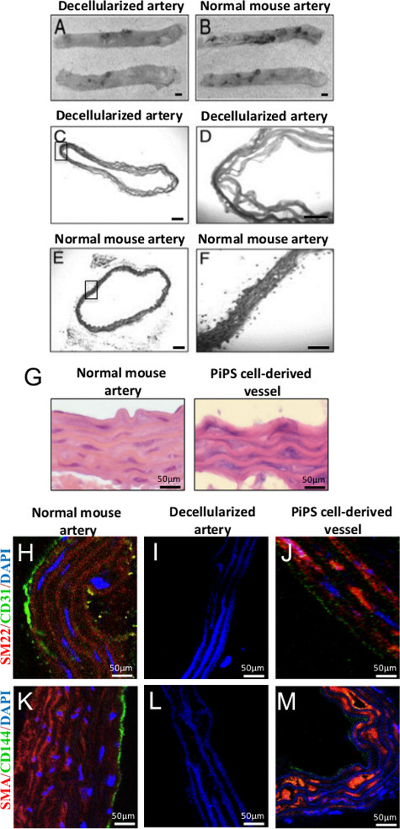
Çift numaralı seribaşı PiPSC-kaynaklı doku mühendisliği vasküler greft Şekil 4. Nesil. (A, B) fare torasik aorta Decellularization yapısını korudu ve hala andıran normal geminin, orijinal büyütme 2X. 50X veya 200X: kontroller, orijinal büyütme göre decellularized aort (CF) HE boyama başarılı decellularization ve hücrelerin tamamen kaldırılması doğruladı. PiPSC türevli endotel ve düz kas hücrelerinin (G) HE boyama çift tohumlu kaplar bir damar için benzer bir mimari saptandı. (J, M) ile endotel (CD31 ve CD144) için pozitif boyandı çift tohumlu PiPSC doku mühendisliği damarları ve düz kas hücreleri (SM22 ve SMA) Dece farklı belirteçlerllularized damar grefti. (H, K) vasküler belirteç olarak PiPSC türevli endotel ve medial ve intimal alanlar içinde yumuşak kas hücrelerinin karakteristik morfolojisi ve lokalizasyon birlikte ifadesi doğal damarlara karşılaştırılabilir. Gösterilen görüntüler için Ölçek çubuğu 50 mikron bulunmaktadır. Bu rakamlar Tsai, T. ve ark. 22 ve Karamariti, E. ve ark modifiye edilmiş. 11 , bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
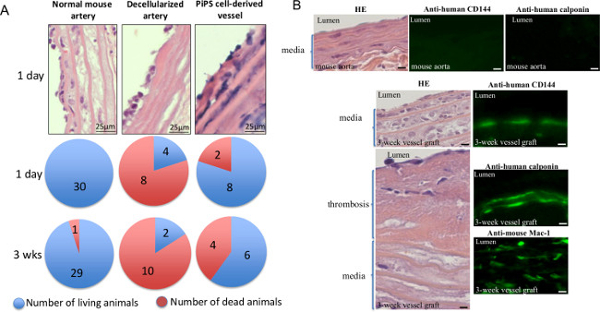
Şekil 5. Çift numaralı seribaşı PiPSC-kaynaklı doku mühendisliği vasküler greft in vivo yerli gemiler ikame patent vardır. PiPSC türetilmiş gemiler ağır kombine immün yetmezlik karotis arter (SCID) fareler normal mou aşılanmıştırSE ve hücresizleştirilmiş arterler kontroller olarak kullanılmıştır. PiPSC türevli gemi ile aşılanmış farelerin (A) Analiz sağkalım oranı 3 hafta sonrası cerrahi% 60 gösterdi, belirgin yüksek ölüm oranları ve düşük yaşam (% 20) ile sunulan decellularized gemiler ile aşılanmış farelerde ise. Veriler (n = 10) ortalamaları temsil eder. (B), doku mühendisliği kaplar da aşılama 3 hafta sonra hasat edildi ve HE (sol panel) ya da insan CD144 ve calponin veya fare CD11b / CD18 (Mac-1) varlığında için immünofloresan boyama (sağ panel) tabi tutuldu; boyama ölçümü Tablo 1'de özetlenmiştir. belirtilmedikçe gösterilen görüntüler için Orijinal büyütme 400X vardır. Bu rakam Karamariti modifiye edilmiş, E. ve ark. 11 , bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
| Pozitif hücreler Alan (40X) | Aşılama öncesi tasarlandı-damar | Engineered-damar grefti (3 hafta) |
| calponin | 72 ± 9 | 22 ± 11 * |
| CD144 | 20 ± 8 | 5 ± 6 * |
| Mac-1, | 0 | 71 ± 11 * |
3 hafta aşılama sonrası doku mühendisliği damarların Tablo 1. karakterizasyonu. PiPSC-endotel ve düz kas hücrelerinin ve taşıyıcı makrofajlar sayısı, insan calponin ile immünofloresan boyama aşağıdaki nicelleştirilmiştir insan CD144 ve fare Mac-1 ve. Veriler, ortalama ± SEM temsil eder (n = 6); * P <0.05, aşılama öncesi doku mühendisliği damarlardan anlamlı fark. Bu tablo, Karamariti, E. ve arkadaşları modifiye edilmiştir. 11
Tartışmalar
Mevcut protokol fonksiyonel doku mühendisliği kaplar insan fibroblastlardan PiPSC kullanılarak üretilebilir olan bir ses, hızlı, basit, verimli ve tekrarlanabilir bir strateji gösterir. Bu teknik, yakın gelecekte rejeneratif tıp, doku mühendisliği ve potansiyel hastaya özgü hücre tedavisi için değerli bir araç temsil eder. Protokol etkinliğini sağlamak için kritik adım vasküler biyoreaktör içinde PiPSC hazırlanmasını, steril ve tamamen hücresizleştirilmiş aort greft, iskeleleri PiPSC başarılı tohum ve farklılaşmasının hazırlanmasını ve aort greft sterilliğin muhafaza edilmesi yer alır.
Doku mühendisliği greft başarılı yaratılması işleminin başlatılması için, PiPSC hazırlanması etkin bir şekilde yapılmasını sağlamak için büyük önem taşımaktadır. Protokol başarılı bir şekilde pCAG2LMKOSimO OSKM plazmid ile nucleofection ile PiPSC bir insan fibroblast hücre hattı 'yeniden programlanması' vardır. survivnucleofection sonra fibroblast el gibi yüksek kaliteli OSKM plazmidler kullanımı gibi birçok önemli noktalarda dayanır, 500 arasında değişen konsantrasyonlarda plazmidler - hücrelerin tanıtımı aşağıdaki özellikle hassas olarak 1.000 ng / ul, hemen nucleofection sonra fibroblast tohumlama gecikmeleri önlemek Son olarak, nispeten büyük plazmidler ve çok önemlidir ve kullanımdan hemen önce taze hazırlanmış ortam içine ilave edilmelidir FGF-2 eklenmesi. Ayrıca, biz endotel ve düz kas hücrelerine PiPSC ve sonraki farklılaşma içine verimli 'yeniden programlama' sağlamak için geçit 9, replikatif yaşlanmayı önlemek için yukarı hücreleri kullanmak için çok önemli olduğunu öğrendim. PiPSC saflığı, neomisine sahip nucleofected hücrelerin seçilmesiyle geliştirilebilir. pCAG2LMKOSimO plazmid saf bir nüfus seçilmesine de neden olur bir neomisin dirençli gen ve 3 gün nucleofection sonra 25 ug / ml bir gün aralığında neomisin, böylece ek vardırPiPSC. Farelere aşılanması için etkin bir PiPSC gemi mühendisi, biz decellularized aorta bütünlüğü ve sterilite yüksek öncelikli olarak kabul. Önce aorta bütünlüğünü korumak ve sürekli onlar nispeten kırılgan ve boyutu oldukça küçücük olduğu gibi, gemileri ele ederken el becerisi uygulamak için decellularization sonra, gerekli oldu. perivasküler doku ve iki kutuplu bir elektro-koagülatör dallanma arterlerin sızdırmazlık çıkartılmasına sonraki yetkin hücre tohumlama sağlamak ve ortam kaçağı önlemek için önemlidir. Herhangi bir noktada, hepimiz malzemeler ve cihazlar biyoreaktör (yani, forseps, tüpler, şişeler, odalar, makas, adaptörler ve konektörler) dolayısıyla bakteriyel kontaminasyon ve cerrahi öncesinde vasküler greft başarısızlık risklerini azaltarak, otoklav edildi oluşturmak için kullanılan sağlanmalıdır .
Mevcut protokol kardiyovasküler dise umut verici klinik uygulamaları tutar ikengazlar, ayrıca metodolojiyi geliştirmek için yakın gelecekte geliştirilmesi gereken bir kaç sınırlamalar vardır. Şimdiye kadar, OSKM transkripsiyon faktörleri nucleofection ile insan fibroblastları içerisinde hazır edildi. Bu teknik, nispeten basit ve kolay olmakla birlikte, aynı zamanda, farklı deneysel zamanlarda değişken transfeksiyon verimliliği ile sonuçlanmıştır. Özellikle, bu uyumsuzluk daha önce zikredilen neomisin seçimi ek bir adım verilmesi ile ortadan kaldırılabilir. Benzer şekilde, bir potansiyel enfeksiyon aşağıdaki hücrelerin hayatta kalma 'reprogramming' verimliliğini artırmak ve artırabilir lentivirüs entegrasyonu kullanılarak insan fibroblastlar içine dört faktöre, giriş düşünebiliriz. Biyoreaktör açısından, aorta tam decellularization% 0.075 SDS kullanılarak elde edilebilir olduğu bulunmuştur. Bu teknik, hücre ayrılması için uygun olduğu kabul edildiği halde başka deterjanlar (örneğin, Triton X-100), bununla birlikte, s neden olabilir karşılaştırıldığındahücre-dışı matris proteinlerinin 23 ultra-yapılar içinde otential değişiklikler. Bu olgu, bu nedenle ilişkili hücre-dışı matris proteinlerinin bozulmasını en aza indirmek için daha etkili decellularization stratejileri garanti etmektedir. Buna ek olarak, aynı zamanda hücresizleştirilmiş aorta çapı ve duvar kalınlığı, yaş, gerilme ve arka planına bağlı olarak, fareler arasında değişir ve böylece biyoreaktörler içinde akış ve kesme geriliminin hızı ve PiPSC Tohumlanmayı takiben PiPSC dağılımında potansiyel farklara sebep olduğu düşünülmektedir . Bütün bu netleştirilmelidir.
Bu protokol, burada kardiyovasküler hastalık için kök hücre tedavisi gelecekteki klinik uygulamalar için umut verici bir potansiyele sahip PiPSC fonksiyonel doku mühendisliği greft nesil nitelendirdi. Atlayarak başka (endotel veya düz kas hücreleri ya) bir somatik soyu (fibroblastlar) doğrudan yeniden programlama kullanan bu süreç pluripogerekır ilgi güvenli ve uygun hücreleri elde etmek için bir yol olabilir. Nitekim, birkaç protokoller ancak hala klinikte kullanımları açısından konularla ilgili yükseltmek hepsi insan embriyolarının, iPS hücreleri ve yetişkin kök hücreleri 24-26 kök hücre hatları, nesil tanımlamak için yayınlanmıştır. Hemen PiPSC bu nedenle, tümör oluşumu sorununu ortadan kaldırır, SCID farelerinde teratomlar gelişmediğini bilinmektedir. Ayrıca, hücreler üretmek, kültür ve 10,11 ayırt etmek anlamlı kısa zaman alır, ve yerli aorta karşılaştırılabilir başarılı ve fonksiyonel doku mühendisliği gemiler greft oluşturmak gösterilmiştir. Bu nedenle, (deriden örneğin) fibroblastlar, belirli bir bireyden elde edilebilir, çünkü kişiselleştirilmiş hücre tedavisi ile hastaların tedavisi için gelecek vaat eden bir hücre kaynağı olarak PiPSC mevcut. Bu protokolde hücresizleştirilmiş damar sistemi extracellul ile seribaşı hücreler sağlayan bir daha biyomimetik bir model sağlarBir yerli aort 11 o daha temsilcisini olan ar matriks proteini. Bu anahtar noktalar daha sonra numaralı seribaşı hücreleri ve doku mühendisliği gemilerin yaşam, farklılaşma ve işlevsellik sağlamak için kritik öneme sahiptir. Sumitran-Holgersson ve meslektaşları tarafından son çalışmada, böylece yakın gelecekte insanlar içine mevcut protokolün bir öteleme değeri varsayarak, 27 engraftmınt önce ölmüş bir kişiden daha önce decellularized ilyak ven greft başarılı nı gösterdi. Ayrıca, hücresizleştirilmiş damar greftleri rolü ve doku mühendisliği greft katkıda bulunan diğer vasküler hücre tiplerinin davranışı değerlendirilebildiği iyi bir modeli temsil edebilir. Farelerde bu model sistem gelecekte ilaç tarama ve aynı zamanda damar kök hücre biyolojisi dahil hücresel ve moleküler mekanizmaların tanıtılması güçlü bir araç sağlayabilir. Birlikte ele alındığında, mevcut protokol Vasc onun uygulanması için umut verici değeri tutanular doku mühendisliği ve kişiselleştirilmiş tıp bir atılım.
Açıklamalar
Yazarlar herhangi çatışan mali çıkarları var.
Teşekkürler
This work was supported by The British Heart Foundation and The Oak Foundation.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Human Fibroblasts CCL-153 | ATCC | CCL-153 | Prenatal human embryonic fibroblasts |
| ATCC F-12K Medium (Kaighn's Modification of Ham's F-12 Medium) | ATCC | 30-2004 | |
| Fetal Bovine Serum | ATCC | 30-2020 | |
| Knockout DMEM medium optimized for embryonic stem cells | Life technologies (Gibco) | 12660-012 | |
| Knockout Serum Replacement | Life technologies (Invitrogen) | 10828-028 | |
| Human Basic FGF-2 | Miltenyi Biotech | 130-093-837 | |
| alpha-MEM medium | Life technologies (Invitrogen) | 32571093 | |
| Human PDGF | R&D System | 120-HD-001 | |
| Gelatin Solution 2% | Sigma | G1393 | |
| Plasmid 20866: pCAG2LMKOSimO (SOX2, OCT4, KLF4, C-MYC) | Addgene | 20866 | |
| PvuI Restriction Enzyme | New England Biolabs | RO150S | |
| SureClean Plus | Bioline | BIO-37047 | |
| Nucelofection Kit (NHDF Kit) | LONZA | VPD-1001 | |
| Neomycin | SIGMA | G418 | |
| KL 1500 LCD, Illumination for Stereo Microscopy | SCHOTT | KL 1500 LCD | Cold light illumination for stereo microscopy |
| Nikon Zoom Steromicroscope SMZ800 | Nikon | SMZ800 | |
| Heparin sodium salt | Sigma | H3393 | |
| 10% SDS Stock Solution Molecular Biology Reagent | Severn Biotech | CAS 151-21-3 | |
| Dulbecco's Phosphate Buffered Saline | Sigma | D8537 | |
| Matrigel (10mg/ml) | BD | A6661 | |
| Shaker IKA Vibrax with Shaking platform VX 7 | Jepson Bolton's, Janke&Kunkel | S32-102 | |
| Masterflex L/S Digital Pump Drive | Cole-Parmer | WZ-07523-80 | |
| Masterflex L/S 6-channel, 6-roller cartridge pump head | Cole-Parmer | EW-07519-15 | |
| Masterflex L/S large cartridges for pump head | Cole-Parmer | EW-07519-75 | |
| Masterflex platinum-cured silicone pump tubing, L/S 14, 25 ft | Cole-Parmer | WZ-96410-14 | Tubing goes through the peristaltic pump |
| 0.5mm ID, 0.8 mm OD Silicone Tubing | SILEX | N/A | Tubings connect incubation chamber, media reservoir and compliance chamber |
| Fitting Reducer 0.5 to 1.6, natural Polypropyline | Ibidi | 10829 | Adapter connect above two types of tubings |
| 1/32" Tubing, ID 0.01" (250µm) Material: PEEK | LabSmith | T-132-010P | Tubing through the incubation chamber wall which connects the graft with outside tubing |
| One-Piece Fittings | LabSmith | T-132-100 | Fix the above tubings through the incubation chamber wall |
| Nylon tubes (OD 0.9mm, ID 0.75mm) | Smiths Medical | N/A | Tubings insert into two ends of the aorta graft |
| NOD.CB17-Prkdcscid/NcrCrl mouse | Charles River | ||
| Surgical sutures, 8-0 silk | ETHICON | W819 | |
| Hypnorm | Vetapharm | Vm21757/4000 | Neuroleptanalgesic for use in mice |
| Hypnovel (Midazolam) | Roche | 59467-70-8 | Induction of anaesthesia |
| Dissecting microscope | Carl Zeiss | Stemi 2000 | |
| Nylon Tubing | Portex LTD | 800/200/100/200 | 0.65 mm in diameter and 1 mm in length; to make artery cuff |
| Electrocoagulator | Martin | SN 54.131 | Ligation of artery branches on aorta |
| Bipolar micro hemostat forceps | Martin | 80-91-12-04 | Fixation of vessel ends |
| Vessel Dilator | S&T | JFX-7 | |
| Vessel Dilator | S&T | JFL-3dZ | |
| Vessel Dilator | S&T | D-5aZ | |
| Mini applier | AESCULAP | FE572K | |
| Micro hemostats clips | AESCULAP | FE720K | |
| Surgical sutures, 6-0 VICRYL | ETHICON | V489 |
Referanslar
- Kurobe, H., Maxfield, M. W., Breuer, C. K., Shinoka, T. Concise Review: Tissue-Engineered Vascular Grafts for Cardiac Surgery: Past, Present, and Future. Stem Cells Transl Med. 1 (7), 566-571 (2012).
- Jonas, R. A., Freed, M. D., Mayer, J. E. Jr Long-term follow-up of patients with synthetic right heart conduits. Circulation. 72, II77-II83 (1985).
- Heureux, N., et al. Technology insight: the evolution of tissue-engineered vascular grafts-from research to clinical practice. Nat Clin Pract Cardiovasc Med. 4, 389-395 (2007).
- Zhang, W. J., Liu, W., Cui, L., Cao, Y. Tissue engineering of blood vessel. J Cell Mol Med. 11, 945-957 (2007).
- Cearbhaill, E. D., et al. Response of mesenchymal stem cells to the biomechanical environment of the endothelium on a flexible tubular silicone substrate. Biomaterials. 29, 1610-1619 (2008).
- Gong, Z., Niklason, L. E. Small-diameter human vessel wall engineered from bone marrow-derived mesenchymal stem cells (hMSCs). FASEB J. 22, 1635-1648 (2008).
- Wong, M. M., et al. Over-expression of HSP47 augments mouse embryonic stem cell smooth muscle differentiation and chemotaxis. PLoS One. 9 (1), e86118(2014).
- Park, S. W., et al. Efficient differentiation of human pluripotent stem cells into functional CD34+ progenitor cells by combined modulation of the MEK/ERK and BMP4 signaling pathways. Blood. 116, 5762-5772 (2010).
- Samuel, R., et al. Generation of functionally competent and durable engineered blood vessels from human induced pluripotent stem cells. Proc Natl Acad Sci USA. 110, 12774-12779 (2013).
- Margariti, A., et al. Reprogramming of fibroblasts into endothelial cells capacble of angiogenesis and reendothelialization in tissue-engineered vessels. Proc Natl Acad Sci USA. 109, 13793-13798 (2012).
- Karamariti, E., et al. Smooth muscle cells differentiated from reprogrammed embryonic lung fibroblasts through DKK3 signaling are potent for tissue engineering of vascular grafts. Circ Res. 112, 1433-1443 (2013).
- Udelsman, B., et al. Development of an operator-independent method for seeding tissue-engineered vascular grafts. Tissue Eng Part C Methods. 17 (7), 731-736 (2011).
- Cearbhaill, E. D., Murphy, M., Barry, F., McHugh, P. E., Barron, V. Behavior of human mesenchymal stem cells in fibrin-based vascular tissue engineering constructs. Ann Biomed Eng. 38 (3), 649-657 (2010).
- Wong, M. M., et al. Macrophages control vascular stem/progenitor cell plasticity through tumor necrosis factor-α-mediated nuclear factor-κB activation. Arterioscler Thromb Vasc Biol. 34 (3), 635-643 (2014).
- Wong, M. M., et al. Sirolimus stimulates vascular stem/progenitor cell migration and differentiation into smooth muscle cells via epidermal growth factor receptor/extracellular signal-regulated kinase/β-catenin signaling pathway. Arterioscler Thromb Vasc Biol. 33 (10), 2397-2406 (2013).
- Lee, J., Cuddihy, M. J., Kotov, N. A. Three-dimensional cell culture matrices: State of the art. Tissue Eng Part B Rev. 14, 61-86 (2008).
- Hung, H. S., Hsu, S. H. Current Advances of stem cell-based approaches to tissue-engineering vascular grafts. OA Tissue Engineering. 1 (1), 2(2013).
- Quint, C., et al. Decellularized tissue-engineered blood vessel as an arterial conduit. Proc Natl Acad Sci USA. 108 (22), 9214-9219 (2011).
- Zhang, X., Xu, Y., Thomas, V., Bellis, S. L., Vohra, Y. K. Engineering an antiplatelet adhesion layer on an electrospun scaffold using porcine endothelial progenitor cells. J Biomed Mater Res A. 97 (2), 145-151 (2011).
- Hibino, N., et al. Evaluation of the use of an induced puripotent stem cell sheet for the construction of tissue-engineered vascular grafts. J Thorac Cardiovasc Surg. 143 (3), 696-703 (2012).
- Zhao, J., et al. A novel strategy to engineer small-diameter vascular grafts from marrow-derived mesenchymal stem cells. Artif Organs. 36 (1), 93-101 (2012).
- Tsai, T., et al. Contribution of stem cells to neointimal formation of decellularized vessel grafts in a novel mouse model. Am J Pathol. 181 (1), 362-373 (2012).
- Kasimir, M. T., et al. Comparison of different decellularization procedures of porcine heart valves. Int J Artif Organs. 26 (5), 421-427 (2003).
- Stephenson, E., et al. Derivation and propagation of human embryonic stem cell lines from frozen embryos in an animal product-free environment. Nature Protocols. 7, 1366-1381 (2012).
- Takahashi, K., Okita, K., Nakagawa, M., Yamanaka, S. Induction of pluripotent stem cells from fibroblast cultures. Nature Protocols. 2, 3081-3089 (2007).
- McCall, F. C., et al. Myocardial infarction and intramyocardial injection models in swine. Nature Protocols. 7, 1479-1496 (2012).
- Olausson, M., et al. Transplantation of an allogeneic vein bioengineered with autologous stem cells: a proof-of-concept study. Lancet. 380 (9838), 230-237 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır