Method Article
Generierung und Pfropfen von Tissue Engineering Gefäße in einem Maus-Modell
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier zur Gewebezüchtung Gefäßimplantate, die zum Pfropfen in Mäusen durch Impfen Doppel partiell pluripotenten Stammzellen funktional erzeugen präsentieren wir ein Protokoll (PiPSC) - abgeleiteten glatten Muskelzellen und PiPSC - abgeleitete Endothelzellen auf einer dezellularisierten Gefäßgerüst Bioreaktor.
Zusammenfassung
The construction of vascular conduits is a fundamental strategy for surgical repair of damaged and injured vessels resulting from cardiovascular diseases. The current protocol presents an efficient and reproducible strategy in which functional tissue engineered vessel grafts can be generated using partially induced pluripotent stem cell (PiPSC) from human fibroblasts. We designed a decellularized vessel scaffold bioreactor, which closely mimics the matrix protein structure and blood flow that exists within a native vessel, for seeding of PiPSC-endothelial cells or smooth muscle cells prior to grafting into mice. This approach was demonstrated to be advantageous because immune-deficient mice engrafted with the PiPSC-derived grafts presented with markedly increased survival rate 3 weeks after surgery. This protocol represents a valuable tool for regenerative medicine, tissue engineering and potentially patient-specific cell-therapy in the near future.
Einleitung
Der Bau des vaskulären Conduits ist eine grundlegende Strategie für chirurgische Reparatur von beschädigten und verletzte Gefäße von Herz-Kreislauf- Erkrankungen resultieren. Bis heute sind in der Chirurgie Transplantatmaterialien biokompatible synthetische Polymere (Polytetrafluorethylen [Teflon], expandiertem Polytetrafluorethylen [ePTFE, Gore-Tex] oder Polyethylenterephthalat [Dacron]), allogene Transplantate, körpereigenes Gewebe (Herzbeutel oder Vena saphena) und Xenotransplantate 1. Während künstliche Transplantate (zB Gore-Tex und Dacron) werden am häufigsten verwendet, diese Materialien wahrscheinlich dazu führen zahlreiche kurz- und langfristige Komplikationen, die Stenose, Kalziumablagerung, thrombo-Embolisation und Infektionen gehören. Obwohl Patienten mit mit vorhandenen biologische Transplantate verringert thromboembolischer Ereignisse, sie immer noch Grenzen stoßen, wie sekundären Transplantatversagen und verkürzt die Haltbarkeit wegen Verkalkung Abbau 2. Daher ist trotz erheblichen Verbesserungen in der chirurgischen techniques über die Jahre, Forschern und Klinikern immer noch die Notwendigkeit zur Identifizierung der idealen Leitung für Gefäßerkrankungen belastet. In jüngerer Zeit hat sich die Forschung zur vaskulären Gewebetechnik, ein Konzept, bei dem Zellen in biologisch abbaubare Gerüst eingebaut, mit dem Ziel, einen biomimetischen Umgebung, die eine funktionelle Gefäß zur erfolgreichen Pfropfung 1 verkörpert erzeugt. Grundsätzlich ist der Erfolg der Gefäßkonstrukte hängen von drei wesentlichen Komponenten; Zellen, die das Gerüst, das heißt, eine Endothelzelle innere Schicht und eine glatte Muskelzellschicht, ein Gerüst, das die entsprechende extrazelluläre Matrix auf vergleichbare mechanische Eigenschaften der nativen Vaskulatur bereitzustellen, und das Molekular / zelluläre Signalübertragung, das zur Initiierung / Regel erforderliche umfassen Reparatur.
Langzeittransplantatdurchgängigkeit und nachhaltige Entwicklung der neo-Gewebe sind in hohem Maße auf effektive Zellaussaat von Gerüsten, thereby Rendern der Entscheidung des Zelltyp von entscheidender Bedeutung. Mehrere Berichte zeigen die Verwendung von reifen Endothelzellen und glatte Muskelzellen aus verschiedenen Quellen, um Leitungen 3-6 kleinen Durchmesser zu entwickeln. Obwohl vielversprechend, um das Fehlen einer ausreichenden autologen Gefäße erhalten reifen Endothelzellen und glatte Muskelzellen vor eine erhebliche Belastung. In jüngerer Zeit haben Stammzellen aus verschiedenen Quellen für Gefäßgewebe-Engineering-Anwendungen genutzt. Tat eine Vielzahl von Stammzelltypen einschließlich embryonaler Stammzellen 7, pluripotenten Stammzellen (iPS) 8,9, PiPSC 10,11, Knochenmark stammenden mononukleären Zellen 12, mesenchymale Stammzellen 13, endotheliale Vorläuferzellen und adulte Gefßwand -abgeleiteten Stammzellenantigen-1 (Sca-1) + Stammzellen / Vorläuferzellen 14,15 wurden alle gezeigt, dass sie in der Lage, die Differenzierung werden entweder funktionelle Endothelzellen oder Zellen der glatten Muskulatur als Antwort auf definierten Medien undKulturbedingungen. Darüber hinaus machen die unbegrenzte Selbsterneuerungsfähigkeit der Stammzellen ihnen bessere Kandidaten Gegensatz reifen Endothelzellen und glatte Muskelzellen, die nur für eine begrenzte Anzahl von Malen teilen können vor einer Wachstumsarrest und Seneszenz.
Die Auswahl der Gerüstmaterial für eine erfolgreiche Gewebezüchtung Behälter erzeugen für die Veredelung von mehreren Faktoren abhängig, wie Biokompatibilität, biomechanischen Eigenschaften und Geschwindigkeit des biologischen Abbaus. Grundsätzlich verwendeten Materialien, um Gerüste für Transplantate erstellen sollten biologisch abbaubar sein und wird nicht gemountet unnötige Empfänger Immunantworten. Darüber hinaus müssen sie eine geeignete Porosität und Mikrostruktur für die Zellanheftung und anschließende Überlebens umfassen. Bis heute sind die am häufigsten für Gerüste in vaskulären Gewebetechnik verwendeten Materialien umfassen Polymere von Polyglykolsäure, Polymilchsäure und Poly-ε-caprolacton 16. In jüngerer Zeit haben dezellularisierten biologischen Materialienauch mit einigem Erfolg angewendet. Mehrere Labors haben gezeigt, dass der Aussaat dezellularisierte Mensch, Hund oder Schwein Gefäße mit patienteneigenen Zellen ein biologischen Transplantats, die Blutgerinnung und Intimahyperplasie 17-19 widerstanden. Andere Strategien in der Gefäß Tissue Engineering sind extrazellulären Matrixproteinen basierenden Gefäßprothesen zB Aussaat Zellen in Fibrin-Gel 13 und das Erzeugen Zellschichten ohne Stützträger 20, 21.
Die aktuelle Protokoll zeigt die Differenzierung von humanen PiPSC in funktionelle Endothel- und glatte Muskelzellen, die Erzeugung von einem Bioreaktor, bestehend aus einer dezellularisierten Gefäßgerüst funktionelle PiPSC abgeleiteten Gefäßzellen beherbergen, und Pfropfen der Gewebezüchtung Gefäßen in severe combined immunodeficiency (SCID ) Mäusen. PiPSC sind eine optimale Zelltyp für das Tissue Engineering von Gefäßtransplantaten zu verwenden, da diese Zellen nicht-Tumoren in Mäusen bilden oder ethische undallo-Immunantworten. Darüber hinaus haben wir gezeigt, dass die Strategie zur Erzeugung von pips-Endothelzellen und Zacken-glatten Muskelzellen ist effiziente und reproduzierbare 10,11. Danach haben wir eine dezellularisierte Gefäß für die Aussaat von PiPSC abgeleiteten Gefäßzellen, um die Matrixproteine, die in einem nativen Gefäß existiert genau imitieren und somit eine Verbesserung Pfropfen und Überleben Wirksamkeit. Ferner die Dezellularisierung der Gefäße vor PiPSC Aussaat verhindert das Auftreten von entzündlichen Reaktionen, die durch Immunzelltypen montiert, wie Makrophagen. Noch wichtiger ist, hat das Protokoll nicht nur stellen eine Methode zur Erzeugung von vielversprechenden Gefäßleitungen für die Übersetzung in Menschen, sondern auch eine wertvolle Hilfe von Studium und Verständnis der molekularen Mechanismen, die Gefäßgeweberegeneration durch Mausmodellen zu regieren.
Protokoll
Führen Sie alle Tierversuche nach Protokollen des Institutionellen Ausschusses für Benutzung und Pflege von Labortieren zugelassen.
1. Vorbereitung der Nährmedien
- Make Kulturmedien für den menschlichen Fibroblastenzelllinie CCL-153: F-12K-Medium, das 10% fötales Rinderserum (FBS) und 100 U / ml Penicillin und Streptomycin.
- Stellen Reprogrammierung Medien für PiPSC Generation: Knockout Dulbeccos modifiziertem Eagle-Medium (DMEM), das 20% Knockout Serum Replacement, 0,1 mM β-Mercaptoethanol, 0,1 mM Minimum Essential Medium (MEM) Non-essentiellen Aminosäuren, 10 ng / ml Grund Fibroblasten-Wachstumsfaktor 2 (bFGF-2) und 100 U / ml Penicillin und Streptomycin. Frisch jedes Mal hinzufügen bFGF-2, bevor Sie die Medien.
- Make Differenzierungsmedium (DM) zu der glatten Muskelzellen induzieren (SMC) Differenzierung: α-MEM-Medium, enthaltend 10% FBS, 0,1 mM β-Mercaptoethanol, 100 U / ml Penicillin und Streptomycin und 25 ng / ml Blutplättchen-Wachstumsfaktor(PDGF-ββ).
- Make Endotheldifferenzierung Medien (EC-DM) von Endothelzellen (EC) Differenzierung zu induzieren: Endotheliale Wachstumsmedien-2 (EGM-2) Medien, die 50 ng / ml Vascular Endothelial Growth Factor (VEGF) und 100 U / ml Penicillin und Streptomycin.
2. Reprogramming menschlichen Fibroblasten in Teilweise induzierte pluripotente Stammzellen (PiPSC)
- Kultur menschlichen Fibroblasten-Zelllinie CCL-153 auf 0,04% Gelatinelösung beschichtet Kolben in Kulturmedium.
- Passage-Zellen alle 3 Tage in einem Verhältnis von 1: 6. Verwenden Sie vor dem Durchgang 9 Zellen für eine optimale Effizienz der PiPSC Generation. Die Zellen sind bereit für die Transfektion bei Erreichen von 80 bis 90% Konfluenz.
- Linearisieren polycistronischen Plasmid pCAG2LMKOSimO enthaltend 4 Reprogrammierungsfaktoren Octamer bindenden Transkriptionsfaktors 4 (OCT4) SOX2, Kruppel artigen Faktor 4 (KLF4) und C-MYC (pCAG-OSKM). Digest 5 ug Plasmid mit 5 Einheiten Restriktionsenzym PvuI 3 h bei 37 ° C. Reinigendas Plasmid mit einem kommerziellen Kit nach Herstellerprotokoll.
- Transfizieren 2 x 10 6 menschlichen Fibroblasten, die mit 4 & mgr; g linearisierter pCAG-OSKM Plasmid durch Elektroporation mit humanen dermalen Fibroblasten (NHDF) Nukleofektion Set nach dem Protokoll des Herstellers. Sanft Saatgut transfizierten Zellen auf Vor- 0,04% Gelatine beschichtete T25-Kolben mit 5 ml vorgewärmtem Reprogrammierung Medien.
- Nach 24 Stunden wechseln Medium mit Ergänzungen von 25 ug / ml Neomycin, um eine reine Population transfizierter Zellen auszuwählen.
- Ändern Medium jeden zweiten Tag bis zum Tag 4.
Hinweis: Humane Fibroblasten werden PiPSC nach 4 Tagen der Umprogrammierung.
3. Differenzierung der PiPSC in Endothelzellen und glatte Muskelzellen
- Seed PiPSC auf Kollagen IV vorbeschichteten Schalen mit DM für 4 Tage, um die Differenzierung in SMCs induzieren. Ändern Medium jeden zweiten Tag bis zum Tag 4.
- Seed PiPSC auf Kollagen IV vorbeschichtete Gerichte containing Endothel-DM für 6 Tage, um die Differenzierung zu Endothelzellen zu induzieren. Ändern Medium jeden zweiten Tag bis zum Tag 6.
4. Dezellularisierte Aorta Graft Vorbereitung
Hinweis: Alle Lösungen und Geräte sollten steril sein.
- Opfern Sie die Maus durch Genickbruch und befestigen Sie die Maus in Rückenlage unter Dissektionsmikroskop.
- Durch das Brustbein und um den Brustkorb geschnitten, um die Brusthöhle zu öffnen. Entfernen Sie die Herz, Lunge und Speiseröhre, um die Aorta aus. Entfernen Sie vorsichtig die peri-Aorta Fett mit einer Pinzette.
- Schneiden Sie die Aorta vom vorderen Ende mit einer Schere und sanft halten Sie das Ende mit stumpfen Pinzette. Nehmen Sie die Aorta von der Wirbelsäule Spalte hinter stumpf. Alle Verzweigungs Arterien sorgfältig schließen aus der Aorta durch Ligation mit einem bipolaren Elektrokoagulator und Schneiden von dem fernen Ende der Ligation mit einer Schere.
- Verwenden Sie ein 5-ml-Spritze, um die Aorta Lumen mit 3 m spülenl Kochsalzlösung, enthaltend 100 U Heparin, um die Bildung von Blutgerinnseln zu verhindern.
- Schneiden Sie das hintere Ende der Aorta, bevor es von Verzweigungen in die Nieren. Beibehaltung der Unversehrtheit des Aorta ist das ganze Verfahren sehr wichtig.
- Spülen Sie die Aorta Lumen mit 5 ml 0,075% Natriumdodecylsulfat (SDS) Lösung in Phosphat-gepufferter Salzlösung (PBS) verdünnt.
- Weichen die Aorta in 0,075% SDS-Lösung in einer 10 cm Petrischale. Platzieren Sie die Petrischale auf einem Orbitalschüttler für 2 Stunden bei 150 Upm bei RT.
- Spülen Sie die Aorta Lumen mit 5 ml PBS.
- Weichen Sie die Aorta in PBS in einer 10 cm Petrischale. Platzieren Sie die Petrischale auf dem Orbitalschüttler für 2 Stunden bei 150 Upm bei RT. Aktualisieren PBS alle 20 min.
- Spülen Sie die Aorta Lumen mit 5 ml PBS.
- Halten dezellularisierten Transplantats Aorta in PBS bei 4 ° C für bis zu einer Woche.
5. Dual-Seeding von PiPSC und Bioreaktoranlage
Hinweis: Alle Lösungs und Geräte sollten steril sein. Führen Sie alle Vorgänge in einer Gewebekultur Kapuze.
- Montieren Sie den Bioreaktor Strömungskreislauf, wie in Abbildung 1 dargestellt. Schließen Sie Inkubationskammer, Medienspeicher, Schlauchpumpe und Ausgleichkammer mit Schlauch. Minimal Volumen des Mediums für den Umlauf gebraucht wird, ist 40 ml.
- Vorbedingung das dezellularisierte Gefäß mit Kulturmedium durch Einweichen der Aorta in DM Medium in einer 10 cm Petrischale. Platzieren Sie die Petrischale auf dem Orbitalschüttler für 1 Stunde bei 50 Umdrehungen pro Minute bei RT.
- Setzen Sie 1 cm Länge Nylon Rohre (OD 0,9 mm, 0,75 mm ID) in beiden Enden des dezellularisierten Gefäß unter dem Mikroskop. Binden Sie das Schiff und die Schläuche mit 8-0 Seidenfäden.
- Montieren Sie die dezellularisierte Aorta Graft in die Inkubationskammer durch die Einlass- und Auslasskanäle (1/32 "Schlauch) von der Kammerwand, welche die Nylonrohre. Pflegen Inkubationskammer mit 5mls mittel jedes Mal.
- Trypsinieren PiPSC durch Zugabe von vorgewärmtenTrypsin, um die Kulturschale zu decken und schaukeln das Gericht 10 Mal. Entsorgen Sie die Trypsin und lassen Sie das Gericht in Inkubator für 2-3 min. In vorgewärmten Kulturmedium in die Schüssel und mischen Sie das Medium mit den Zellen.
- Graf Zellzahl mit einer Zählkammer. Zentrifuge zwei Aliquots von Zellsuspension mit 5 x 10 5 Zellen je 5 min bei 300 x g. Saugen Sie den Überstand vollständig.
- Nach Absaugen der Überstand vollständig resuspendieren ein Pellet der PiPS Zellpellets in 50 ul DM. Spritzen Sie diese Zellsuspension in die dezellularisierte Gefäßlumen.
- Dann resuspendieren anderen PiPS Zellpellet in 100 & mgr; l Matrigel. Beim Pipettieren der Mischung auf die dezellularisierte Aorta Graft.
- Warten Sie 10 bis 15 Minuten, bis die Mischung in einen gelartigen Zustand und wickelt sich um den Behälter Außenfläche gleichmäßig. Füllen Sie die Inkubationskammer mit DM.
- Setzen Sie den ganzen Bioreaktor Einstellung in einem 5% CO 2 Inkubator bei 37 ° C. Manuelles drehen Sie den dezellularisierten Transplantats 90 ° um die Längsachse jede halbe Stunde in der ersten 2 h.
- Halten statischer Kultur für 12 Stunden, um die Zelladhäsion zu ermöglichen.
- Liefern DM durch das Lumen durch die peristaltische Pumpe an der glatten Muskulatur-Zelldifferenzierung zu induzieren. Starten anfänglichen Flussrate bei 5 ml / min und die stufenweise Erhöhung auf 20 ml / min über 24 h.
- Halten Sie das zirkulierende Medium Durchfluss bei 20 ml / min für 24 Stunden.
- Halten Sie den Medienstrom und bewegen Sie den Bioreaktor Einstellung aus dem Inkubator.
- Re-Samen das Lumen des Transplantats mit PiPSC. Trypsinieren, zählen und Zentrifuge 1 x 10 6 PiPSC wie in Schritten von 5,5 bis 5,6. Resuspendieren der Zellen in 50 & mgr; l EGM-2-Medium, enthaltend 50 ng / ml VEGF. Spritzen den Zellgemisch in das Lumen des Transplantats.
- Ändern Sie das Medium in der Inkubationskammer und Vollblutung EGM-2 Medium mit 50 ng / ml VEGF an endotheliale Differenzierung zu induzieren.
- Bewegen Sie den Bioreaktor Einstellung zurück auf thE-Inkubator. Hand drehen das Transplantat 90 ° alle 30 Minuten in der ersten 2 h und dann halten eine statische Kultur für 12 Stunden.
- Starten Zirkulationsströmung von 5 ml / min und der stufenweisen Erhöhung auf 35 ml / min. Halten der Strömungsrate auf 35 ml / min für 5 Tage. Ändern zirkulierenden und Kammer Medium jeden zweiten Tag.
- Ernten Sie die entwickelt Transplantat für die weitere Veredelung zu Maus.
6. Pfropfen von Doppel ausgesät PiPSC Graft in Mäuse
- Verwenden NOD.CB17-Prkdc scid / NcrCrl männlichen Mäusen als Gefäßtransplantat-Empfänger. Achten Sie immer darauf, dass die Mäuse sind ca. 10 Wochen alt, wiegt etwa 25 - 35 g, und in einem guten gesundheitlichen Bedingungen.
- Anesthetize Empfängermaus durch Verabreichung einer Kombination von Hypnorm (25 mg / kg) und Hypnovel (25 mg / kg) intraperitoneal. Bewerben Vaseline Augensalbe auf die Augen bis zur Trockenheit während der Narkose zu verhindern. Bestätigen effiziente Betäubung, indem sichergestellt wird, dass Mäuse entspannt Muskeln und stetig zu atmen.
- Befestigen Sie die Maus in Rückenlage mit seinem Hals rasiert und erweitert. Verabreichen Atropinsulfat (1,7 mg / kg) in Kombination mit den Anästhetika, um sicherzustellen, dass die Atemwege der Maus klar bleibt.
- Bereiten Sie ein Mittellinienschnitt aus dem Unterkiefer zu Brustbein der Maus. Unter einem Binokular mit 5- bis 10-fache Verstärkung, heben Sie die richtigen Speicheldrüsen seitlich und nehmen Sie die richtige sternocleidomastoideus, um die rechte Arteria carotis communis freizulegen.
- Entfernen sanft angebracht Geweben, die rechte Arteria carotis communis aus dem distalen Ende zu dem proximalen Ende zu mobilisieren. Ligieren der mittlere Abschnitt der Arteria carotis communis zweimal mit einem 8-0-Seidenfaden und sezieren zwischen den beiden Bindungen.
- Fahren Sie durch eine Manschette aus autoklavierbarem Nylonschlauch in jedem Gefäß Ende gemacht und fixieren Sie jedes Ende mit microhemostat Schellen.
- Entfernen Nahtverbindungs an einem Ende und einen Tropfen Heparin (100 U / ml). Unmittelbar danach invertieren das distale Ende des the Arterie, die ganze Manschette Körper bedecken und befestigen Sie den umgekehrten Gefäß mit einem 8-0 Seidennaht an der Manschette.
- Das Verfahren wird wiederholt, um den anderen Abschnitt der Arterie. Flush Arterie mit Kochsalzlösung, um Blutgerinnsel zu entfernen.
- Implantieren eine dezellularisierte Gefäßtransplantat zwischen zwei Enden der Halsschlagader durch Verschieben der dezellularisierten Gefäßenden die in den Arterien Bündchen und Befestigung mit 8-0 Seidenfäden. Entfernen Gefäßklemmen entweder endet, bevor die Bewertung der Pulsation des Transplantats.
- Legen Sie den rechten Speicheldrüsen wieder in seine ursprüngliche Position. Schließen der Haut an der chirurgischen Stelle mit einer unterbrochenen Naht unter Verwendung eines 6-0 Polyglactin Naht.
- Konsequent beobachten Vital Maus, nachdem die Prozedur abgeschlossen ist, bis es das Bewußtsein wieder. Sacrifice Empfängermäuse durch Genickbruch und Erntegefäßimplantate entweder 24 Stunden oder 3 Wochen später für weitere Analysen.
Ergebnisse
Die erfolgreiche Generation von PiPSC wurde 4 Tage nach der bestätigten nucleofecting menschlichen Fibroblasten mit einem linea pCAG2LMKOSimO Plasmid, das 4-Transkriptionsfaktoren, OCT4, SOX2, Klf4 und c-MYC (OSKM). PiPSC zeigte eine deutlich unterschiedliche Phänotyp im Vergleich zu Fibroblasten (2A) und drückte die 4 Reprogrammierungsfaktoren an mRNA (2B) und Eiweiß (2C) Ebenen 10. Die Wirksamkeit eines PiPSC Basis Gefßtransplantat ist stark abhängig von der Fähigkeit des PiPSC in beide Endothel- und glatten Muskelzellen Linien unterscheiden. Es ist daher wichtig, diese Eigenschaften PiPSC in vitro durch Differenzieren der Zellen in definierten Medien vor der Anwendung sie Gefäßimplantate erzeugen bestätigen, Fig. 3 zeigt die Kapazität PiPSC in funktionale Endothelzellen differen sowohl Gen (3A) und Protein ( 3B-D) levels, bezogen auf Endothelzellen-spezifischen Markern 10. Ebenso sind PiPSC auch in Reaktion auf bestimmte Medien (3E-H) 11 in die glatte Muskelabstammungslinie zu differenzieren.
Whole Aorta Dezellularisierung wurde durch Behandlung mit SDS, einem anionischen Detergens, die Zellen lysiert und solubilisiert cytoplasmatische Komponenten erreicht. Nach 2 Stunden der Behandlung sah die Stelle dezellularisierte Aorta schein azellulären Gerüst im Vergleich zu einer frisch geernteten Aorta (4A-B) 22. Histologische Beurteilung in 4C-F zeigt die Abwesenheit von Keimen oder zytoplasmatische Färbung in dezellularisierten Gefäßen, aber nicht in der normalen Maus-Aorta. Nach Doppel Animpfen PiPSC abgeleiteten endothelialen und glatten Muskelzellen innerhalb dezellularisierte Aorten, die gentechnisch Gefßtransplantate anzuzeigen Endothel- und glatten Muskelzellen Eigenschaften jeweils. Hämatoxylin und Eosin (HE) -Färbung des Doppel ssie benötigt werden Transplantate zeigte eine Architektur ähnlich der nativen Gefäße (4G) mit mehreren Schichten von glatten Muskelzellen und eine Monoschicht von Endothel-Zellen, wie durch positive Färbung für glatten Muskel-22α (SM22), glatte Muskelzellen-α-Aktin (SMA) wurde bestätigt, , CD31 und CD144 Marker jeweils (4H-M) 11.
Um die Durchlässigkeit der Gewebezüchtung Gefäße in vivo zu bestätigen, wurden die Doppel seeded PiPSC abgeleiteten Gefäßen in Mäuse transplantiert - normale Maus und dezellularisierte Arterien wurden als Kontrollen verwendet. Die anschließende Analyse zeigte, daß, während Mäuse, die mit dezellularisierten Gefäße mit deutlich höheren Sterblichkeit bereits an Tag 1 dargestellt gepfropft tragenen PiPSC Gefäßimplantate eine Überlebensrate von 60% 3 Wochen nach der Transplantation (5A) 11. Zusätzlich wurden 3 Wochen alte PiPSC abgeleiteten Transplantate vollständig auf die Anwesenheit von Human PiPSC abgeleiteten endothelialen gekennzeichnet und glatten Muskelzellen und Wirtsmakrophageninfiltration (5B und Tabelle 1) 11. Zusammengenommen Ergebnisse zeigen, dass PiPSC haben die Fähigkeit, in die beiden Kreislinien differenzieren und sind potente zur Erzeugung von funktionellen Tissue-Engineering-Gefäße, die Mutterschiffe in vivo ersetzen kann.
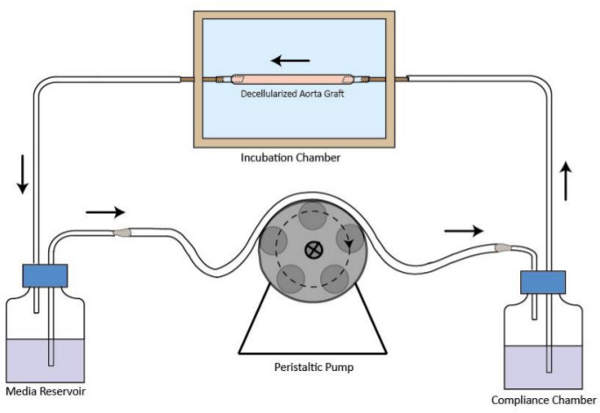
Abbildung 1. Schematische Darstellung des dezellularisierten Transplantats Bioreaktor Strömungskreislauf. Die dezellularisierte Gefäßtransplantat ist in der Inkubationskammer montiert. Eine peristaltische Pumpe ist an der stromaufwärts von der Inkubationskammer zu stabilen Mediumperfusion Strömung bereitzustellen. Der Medienspeicher ist an der stromabwärts von der Inkubationskammer. Die Compliance-Kammer ist, die Strömungsbedingungen zu verbessern. Die Strömungsrichtung ist durch Pfeile gekennzeichnet.large.jpg "target =" _ blank "> Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.

Abbildung 2. Erzeugung von PiPSC aus menschlichen Fibroblasten. Humane Fibroblasten wurden entweder mit vier Umprogrammierung Gene nucleofected (OCT4, SOX2, KLF4 und c-myc) oder einem leeren Vektor (Kontrolle). (A) Phasenkontrast-Bilder zeigen die Morphologie der Kerne nach 4 Tagen. PiPSC ausgedrückt alle vier Transkriptionsfaktoren, sowohl auf mRNA (B) und Protein (C) Ebenen. Maßstab für Bilder dargestellt sind 50 & mgr; m und Daten sind Mittelwerte ± SEM (n = 3); * P <0,05, *** P <0,001. Diese Zahl hat sich von Margariti, A. et al modifiziert. 10 Klicken Sie hier, um eine größere Version dieser Figur zu sehen. </ A>
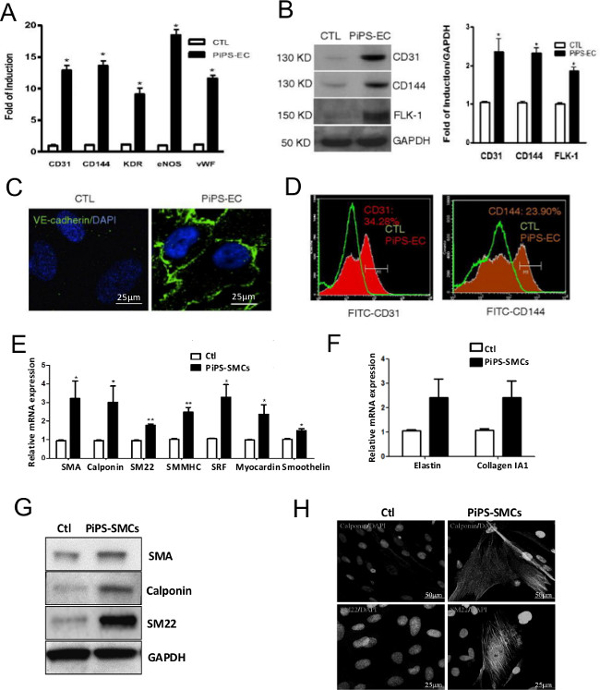
Abbildung 3. PiPSC in beide Endothel- und glatten Muskelzellen differenzieren. PiPSC oder Kontrollzellen zu Endothelzellen differenziert. (A) im Vergleich zu Kontrollzellen, PiPSC abgeleitete Endothelzellen Endothelzellen-spezifische Marker wie CD31, CD144, Kinaseinsertdomänenrezeptor (KDR), endotheliale NO-Synthase (eNOS) und von Willebrand-Faktor (vWF) an der mRNA Ebene. (B) Dieses wurde auf Proteinebene mittels Western-Blot-Analyse bestätigt. (C) Immunfluoreszenzfärbung angegeben positive Färbung von CD144 (VE-Cadherin) in PiPSC-Endothelzellen, aber Zellen nicht kontrollieren. (D) Durchflusszytometrische Analyse bestätigt PiPSC-Endothelzellen die Expression von CD31 und CD144. Collagen IV ausgesät PiPSC (oder Kontrollzellen) wurden ebenfalls in differenzierteglatten Muskelzellen. (E, F) Im Gegensatz zu Kontrollzellen, ausgedrückt PiPSC abgeleitete Zellen der glatten Muskulatur der glatten Muskulatur spezifische Marker auf Genebene, einschließlich SMA, Calponin, SM22, glatten Muskelzellen Myosin II (SMMHC), Serum Response Factor (SRF) , myocardin, Smoothelin, Elastin und Kollagen 1A1. (G) Die Expression von SMA, Calponin und SM22 in PiPSC abgeleiteten Zellen wurden mittels Western-Blot-Analyse bestätigt. (H) Immunfluoreszenzfärbung mit der konfokalen Mikroskopie zeigte eine typische Muskel Marker Färbung für Calponin und SM22 glatt. Die Daten stellen Mittelwerte ± SEM (n = 3); * P <0,05, ** p <0,01, *** P <0,001. Maßstab für die Bilder angezeigt werden 25 & mgr; m oder 50 & mgr; m. Diese Zahlen wurden von Margariti, A. et al. 10 und Karamariti, E. et al. 11 geändert wurden BitteKlicken Sie hier, um eine größere Version dieser Figur zu sehen.
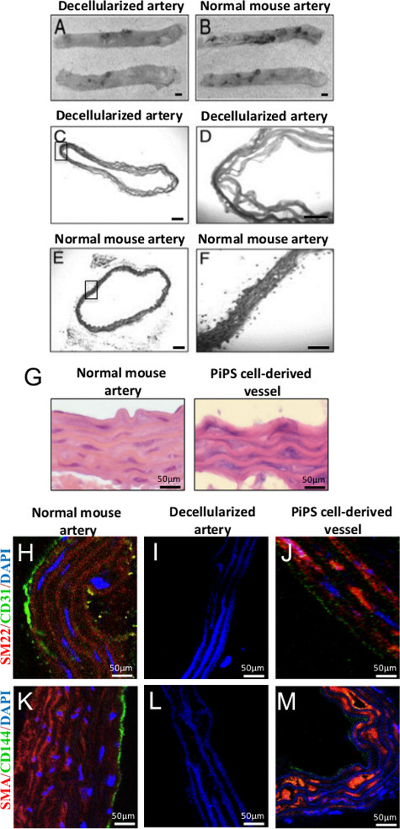
Abbildung 4. Erzeugung von Doppel-seeded PiPSC abgeleiteten Gewebezüchtung Gefßtransplantate. (A, B) Dezellularisierung von Mausbrustschlagader erhaltenen Struktur und glich noch die eines normalen Behälter, ursprüngliche Vergrößerung 2X. (CF) HE-Färbung von dezellularisierten Aorta bestätigt erfolgreiche Dezellularisierung und vollständige Entfernung der Zellen im Vergleich zu Kontrollen, Originalvergrößerung: 50X oder 200X. (G) HE-Färbung von PiPSC abgeleiteten endothelialen und glatten Muskelzellen Doppel ausgesät Gefäße zeigten eine Architektur, die ähnlich zu einem nativen Behälter war. (J, M) Doppel ausgesät PiPSC Tissue Engineering Gefäße gebeizt positiv für Endothelzellen (CD31 und CD144) und glatte Muskelzellen (SM22 und SMA) Marker Gegensatz decellularized Gefäßimplantate. (H, K) Die gleichzeitige Expression von vaskulärem Marker sowie der charakteristischen Morphologie und Lokalisation PiPSC abgeleiteten endothelialen und glatten Muskelzellen im medialen und intimalen Bereichen war vergleichbar mit nativem Gefäße. Maßstab für die Bilder angezeigt werden 50 um. Diese Zahlen wurden von Tsai, T. et al. 22 und Karamariti, E. et al modifiziert. 11 Klicken Sie hier, um eine größere Version dieser Figur zu sehen.
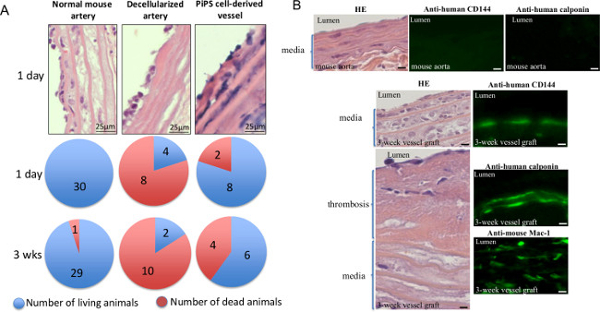
Abbildung 5. Doppelklicken ausgesät PiPSC abgeleitete Gewebezüchtung Vaskulartransplantate Patent zur Substitution von nativen Gefäße in vivo. PiPSC stammenden Schiffe wurden in die Halsschlagader des schweren kombinierten Immundefekt (SCID) Mäusen, normal mou gepfropftse und dezellularisierte Arterien wurden als Kontrollen verwendet. (A) Analyse von Mäusen mit PiPSC abgeleitete Gefäße gepfropft zeigten 60% Überlebensrate 3 Wochen nach der Operation, während Mäuse, die mit dezellularisierten Gefäße mit deutlich höheren Sterberaten und niedrigere Überlebensrate (20%) vorgelegt gepfropft. Daten repräsentieren Mittelwerte (n = 10). (B) Die Tissue-Engineering-Schiffe wurden auch Erntegut 3 Wochen nach der Transplantation und HE (linke Felder) oder Immunfluoreszenzfärbung (rechte Bilder) auf das Vorhandensein von menschlichen CD144 und Calponin oder Maus CD11b / CD18 (Mac-1) unterzogen wird; Quantifizierung der Färbung ist in Tabelle 1 zusammengefasst. ursprüngliche Vergrößerung für Bilder dargestellt sind 400X sofern nicht anders angegeben. Diese Zahl hat sich von Karamariti geändert wurde, E. et al. 11 Klicken Sie hier, um eine größere Version dieser Figur zu sehen.
| Positive Zellen Field (40X) | Engineered-Schiff vor dem Pfropfen | Engineered-Gefäßtransplantat (3 Wochen) |
| Calponin | 72 ± 9 | 22 ± 11 * |
| CD144 | 20 ± 8 | 5 ± 6 * |
| Mac-1 | 0 | 71 ± 11 * |
Tabelle 1 Charakterisierung von Gewebezüchtung Gefäße 3 Wochen nach der Transplantation. Die Anzahl der PiPSC abgeleiteten endothelialen und glatten Muskelzellen und Makrophagen wurde nach Wirtsimmunfluoreszenzfärbung mit menschlichem Calponin quantifiziert menschlichen CD144 und Maus-Mac-1 auf. Die Daten stellen den Mittelwert ± SEM (n = 6); * P <0,05, signifikanter Unterschied zu Tissue-Engineering Gefäße vor dem Pfropfen. Diese Tabelle ist aus Karamariti, E. et al modifiziert. 11
Diskussion
Das aktuelle Protokoll wird der Ton, schnelle, einfache, effiziente und reproduzierbare Strategie, bei der funktionellen Tissue Engineering Tanks können über PiPSC aus humanen Fibroblasten erzeugt werden. Diese Technik stellt ein wertvolles Werkzeug für die regenerative Medizin, Tissue Engineering und möglicherweise patientenspezifischer Zelltherapie in naher Zukunft. Kritische Schritte, um die Wirksamkeit des Protokolls sicher umfassen die Herstellung von PiPSC, Herstellung von sterilen und voll dezellularisierten Aortatransplantate erfolgreiche Aussaat und Differenzierung PiPSC in den Gerüsten und die Sterilität der Aortatransplantate im Gefäß Bioreaktor.
Um die erfolgreiche Erzeugung von Tissue-Engineering-Transplantaten zu initiieren, ist es von äußerster Wichtigkeit, um sicherzustellen, dass die Herstellung von PiPSC heraus wirksam durchgeführt. Das Protokoll ist erfolgreich "umprogrammiert" eine menschliche Fibroblasten-Zelllinie in PiPSC über Nukleofektion mit pCAG2LMKOSimO OSKM Plasmid. Die überlebendenal von Fibroblasten nach Nukleofektion beruht auf mehreren wichtigen Punkten, wie die Verwendung von hochwertigen OSKM Plasmide Plasmide Konzentrationen im Bereich zwischen 500 - 1000 ng / & mgr; l, zu vermeiden Verzögerungen Animpfen von Fibroblasten unmittelbar nach Nukleofektion als Zellen besonders empfindlich nach der Einführung sind relativ große Plasmide und schließlich die Zugabe von FGF-2, die von entscheidender Bedeutung ist und sollte kurz vor der Verwendung in die frisch zubereiteten Medien geben. Zusätzlich fanden wir, dass es von entscheidender Bedeutung, um Zellen von bis zu Durchgang 9 replikative Seneszenz zu vermeiden, um eine effiziente "Neuprogrammierung" in PiPSC und nachfolgende Differenzierung in Endothel- und glatten Muskelzellen zu gewährleisten war. Die Reinheit PiPSC kann durch Auswahl der nucleofected Zellen mit Neomycin verbessert werden. Die pCAG2LMKOSimO Plasmid ein Neomycin-resistentes Gen und damit die Zugabe von Neomycin in einem Bereich von 25 & mgr; g / ml einen Tag nach der Nukleofektion für 3 Tage wird bei der Auswahl einer reinen Population führenPiPSC. Um eine effiziente PiPSC Schiff zum Pfropfen in Mäuse zu konstruieren, die wir als die Integrität und die Sterilität der dezellularisierten Aorten zu der höchsten Priorität. Um die Integrität der Aorten vor zu halten und nach Dezellularisierung, war es notwendig, ständig gelten Fingerfertigkeit ist im Betrieb und die Gefäße, da sie recht instabil und in der Größe erheblich Diminutiv waren. Die effiziente Entfernung von perivaskulären Gewebe und Abdichtung von Verzweigungsarterien Verwendung eines bipolaren elektro Koagulator war kritisch, um nachfolgende kompetenten Zellaussaat zu sichern und um eine Leckage von Medium zu vermeiden. An jedem Punkt haben wir sichergestellt, daß alle Materialien und der Vorrichtung verwendet, um den Bioreaktor (dh, Pinzetten, Tuben, Flaschen, Kammern, Scheren, Adapter und Stecker) wurden autoklavierbar, damit Verringerung der Risiken einer bakteriellen Kontamination und Versagen von vaskulären Transplantaten vor der Operation zu erzeugen, .
Während das aktuelle Protokoll hält viel versprechende klinische Anwendungen in der Herz-Kreislauf diseasen, gibt es einige Einschränkungen, die in der nahen Zukunft verbessert werden sollte, um die Methode weiter zu verbessern. Bisher wurden die OSKM Transkriptionsfaktoren in menschlichen Fibroblasten via Nukleofektion eingeführt. Während diese Technik relativ einfach und unkompliziert, aber auch in variablen Transfektionseffizienzen bei verschiedenen Versuchszeiten geführt. Insbesondere kann diese Inkonsistenz durch Einführung eines zusätzlichen Schritt des vorgenannten Neomycinselektion überwinden. Ähnlich lässt sich die Einführung der vier Faktoren in menschlichen Fibroblasten mit Lentivirus Integration, die potenziell erhöhen kann die Effizienz der "Neuprogrammierung" und verbessern die Überlebensrate der Zellen nach der Infektion zu betrachten. In Bezug auf den Bioreaktor, haben wir festgestellt, dass eine vollständige Dezellularisierung von Aorten kann mit 0,075% SDS erreicht werden. Obwohl diese Technik wurde als optimal für Zellentfernung zu sein im Vergleich zu anderen Reinigungsmitteln (beispielsweise Triton X-100), kann jedoch dazu führen, potential Veränderungen in der Ultrastruktur der extrazellulären Matrixproteine 23. Dieses Phänomen gewährleistet daher effizienter Dezellularisierung Strategien zur Unterbrechung der zugeordneten extrazellulären Matrixproteinen zu minimieren. Zusätzlich haben wir auch berücksichtigt, dass die Dicke des dezellularisierten Aorten Durchmesser und Wand variieren zwischen Mäusen, die je nach Alter, Dehnung und Hintergrund, und damit zu potentiellen Unterschiede in der Strömungsgeschwindigkeit und der Scherspannung in Bioreaktoren und die Verteilung der PiPSC folgenden PiPSC Aussaat . All dies bleibt zu klären.
Dieses Protokoll hier beschrieben die Erzeugung von funktionellen biotechnologisch bearbeitete Gewebetransplantaten mit PiPSC, die ein vielversprechendes Potential für zukünftige klinische Anwendungen in der Stammzelltherapie für kardiovaskuläre Erkrankungen zu halten. Dieses Verfahren, das die direkte Umprogrammierung von einer somatischen Linie (Fibroblasten) zu einem anderen (entweder Endothel- oder glatte Muskelzellen) durch Überspringen nutzt pluripotenz kann ein Weg, um sichere und geeignete Zellen von Interesse zu erhalten. In der Tat, mehrere Protokolle wurden veröffentlicht, die Erzeugung von Stammzelllinien aus menschlichen Embryonen, iPS-Zellen und adulte Stammzellen 24-26, die alle aber noch erhöhen zu Fragen in Bezug auf ihre Verwendung in der Klinik zu beschreiben. Es ist nun bekannt, dass PiPSC nicht Teratome in SCID-Mäusen entwickeln, wodurch die Besorgnis der Tumorbildung. Ferner nehmen die Zellen eine signifikant kürzere Zeit in Anspruch, die Kultur und differen 10,11 und haben gezeigt, dass eine erfolgreiche und funktionellen Tissue Engineering Gefäße Transplantate, die vergleichbar mit nativem Aorten sind erzeugen. Daher PiPSC als vielversprechende Zellquelle für die Behandlung von Patienten mit personalisierten Zelltherapie, da Fibroblasten (zB von Haut) kann von einer bestimmten Person abgeleitet werden vorhanden. Die dezellularisierten Gefäßsystem in diesem Protokoll sorgt für eine biomimetische Modell, die angesiedelten Zellen mit einem extracellul bietetar-Matrix-Protein, das mehrere repräsentative dem eines nativen Aorta 11. Diese Eckpunkte sind entscheidend für das Überleben, die Differenzierung und die Funktionalität der angesiedelten Zellen und Gewebezüchtung Gefäße danach. Aktuelle Studie Sumitran-Holgersson und Kollegen gezeigt, eine erfolgreiche Wiederbesiedlung eines zuvor dezellularisiert ILLIAC Venentransplantat von einem Verstorbenen vor der Transplantation 27, so postulieren eine translatorische Wert des aktuellen Protokolls in den Menschen in der nahen Zukunft. Ferner kann das dezellularisierte Gefäßtransplantaten ein gutes Modell, in dem die Rolle und das Verhalten der anderen vaskulären Zelltypen, die auch auf Tissue-Engineering-Transplantaten beitragen kann beurteilt werden darstellen. Dieses Modellsystem bei Mäusen konnte eine leistungsfähiges Werkzeug für zukünftige Arzneimittel-Screening und bei der Aufklärung der zellulären und molekularen Mechanismen der vaskulären Stammzellenbiologie beteiligt. Insgesamt hält die aktuelle Protokollvielversprechenden Mehrwert für seine Anwendung in vascdere Tissue Engineering und ein Durchbruch in der personalisierten Medizin.
Offenlegungen
Die Autoren haben keine widerstreitenden finanziellen Interessen.
Danksagungen
This work was supported by The British Heart Foundation and The Oak Foundation.
Materialien
| Name | Company | Catalog Number | Comments |
| Human Fibroblasts CCL-153 | ATCC | CCL-153 | Prenatal human embryonic fibroblasts |
| ATCC F-12K Medium (Kaighn's Modification of Ham's F-12 Medium) | ATCC | 30-2004 | |
| Fetal Bovine Serum | ATCC | 30-2020 | |
| Knockout DMEM medium optimized for embryonic stem cells | Life technologies (Gibco) | 12660-012 | |
| Knockout Serum Replacement | Life technologies (Invitrogen) | 10828-028 | |
| Human Basic FGF-2 | Miltenyi Biotech | 130-093-837 | |
| alpha-MEM medium | Life technologies (Invitrogen) | 32571093 | |
| Human PDGF | R&D System | 120-HD-001 | |
| Gelatin Solution 2% | Sigma | G1393 | |
| Plasmid 20866: pCAG2LMKOSimO (SOX2, OCT4, KLF4, C-MYC) | Addgene | 20866 | |
| PvuI Restriction Enzyme | New England Biolabs | RO150S | |
| SureClean Plus | Bioline | BIO-37047 | |
| Nucelofection Kit (NHDF Kit) | LONZA | VPD-1001 | |
| Neomycin | SIGMA | G418 | |
| KL 1500 LCD, Illumination for Stereo Microscopy | SCHOTT | KL 1500 LCD | Cold light illumination for stereo microscopy |
| Nikon Zoom Steromicroscope SMZ800 | Nikon | SMZ800 | |
| Heparin sodium salt | Sigma | H3393 | |
| 10% SDS Stock Solution Molecular Biology Reagent | Severn Biotech | CAS 151-21-3 | |
| Dulbecco's Phosphate Buffered Saline | Sigma | D8537 | |
| Matrigel (10mg/ml) | BD | A6661 | |
| Shaker IKA Vibrax with Shaking platform VX 7 | Jepson Bolton's, Janke&Kunkel | S32-102 | |
| Masterflex L/S Digital Pump Drive | Cole-Parmer | WZ-07523-80 | |
| Masterflex L/S 6-channel, 6-roller cartridge pump head | Cole-Parmer | EW-07519-15 | |
| Masterflex L/S large cartridges for pump head | Cole-Parmer | EW-07519-75 | |
| Masterflex platinum-cured silicone pump tubing, L/S 14, 25 ft | Cole-Parmer | WZ-96410-14 | Tubing goes through the peristaltic pump |
| 0.5mm ID, 0.8 mm OD Silicone Tubing | SILEX | N/A | Tubings connect incubation chamber, media reservoir and compliance chamber |
| Fitting Reducer 0.5 to 1.6, natural Polypropyline | Ibidi | 10829 | Adapter connect above two types of tubings |
| 1/32" Tubing, ID 0.01" (250µm) Material: PEEK | LabSmith | T-132-010P | Tubing through the incubation chamber wall which connects the graft with outside tubing |
| One-Piece Fittings | LabSmith | T-132-100 | Fix the above tubings through the incubation chamber wall |
| Nylon tubes (OD 0.9mm, ID 0.75mm) | Smiths Medical | N/A | Tubings insert into two ends of the aorta graft |
| NOD.CB17-Prkdcscid/NcrCrl mouse | Charles River | ||
| Surgical sutures, 8-0 silk | ETHICON | W819 | |
| Hypnorm | Vetapharm | Vm21757/4000 | Neuroleptanalgesic for use in mice |
| Hypnovel (Midazolam) | Roche | 59467-70-8 | Induction of anaesthesia |
| Dissecting microscope | Carl Zeiss | Stemi 2000 | |
| Nylon Tubing | Portex LTD | 800/200/100/200 | 0.65 mm in diameter and 1 mm in length; to make artery cuff |
| Electrocoagulator | Martin | SN 54.131 | Ligation of artery branches on aorta |
| Bipolar micro hemostat forceps | Martin | 80-91-12-04 | Fixation of vessel ends |
| Vessel Dilator | S&T | JFX-7 | |
| Vessel Dilator | S&T | JFL-3dZ | |
| Vessel Dilator | S&T | D-5aZ | |
| Mini applier | AESCULAP | FE572K | |
| Micro hemostats clips | AESCULAP | FE720K | |
| Surgical sutures, 6-0 VICRYL | ETHICON | V489 |
Referenzen
- Kurobe, H., Maxfield, M. W., Breuer, C. K., Shinoka, T. Concise Review: Tissue-Engineered Vascular Grafts for Cardiac Surgery: Past, Present, and Future. Stem Cells Transl Med. 1 (7), 566-571 (2012).
- Jonas, R. A., Freed, M. D., Mayer, J. E. Long-term follow-up of patients with synthetic right heart conduits. Circulation. 72, II77-II83 (1985).
- Heureux, N., et al. Technology insight: the evolution of tissue-engineered vascular grafts-from research to clinical practice. Nat Clin Pract Cardiovasc Med. 4, 389-395 (2007).
- Zhang, W. J., Liu, W., Cui, L., Cao, Y. Tissue engineering of blood vessel. J Cell Mol Med. 11, 945-957 (2007).
- Cearbhaill, E. D., et al. Response of mesenchymal stem cells to the biomechanical environment of the endothelium on a flexible tubular silicone substrate. Biomaterials. 29, 1610-1619 (2008).
- Gong, Z., Niklason, L. E. Small-diameter human vessel wall engineered from bone marrow-derived mesenchymal stem cells (hMSCs). FASEB J. 22, 1635-1648 (2008).
- Wong, M. M., et al. Over-expression of HSP47 augments mouse embryonic stem cell smooth muscle differentiation and chemotaxis. PLoS One. 9 (1), e86118 (2014).
- Park, S. W., et al. Efficient differentiation of human pluripotent stem cells into functional CD34+ progenitor cells by combined modulation of the MEK/ERK and BMP4 signaling pathways. Blood. 116, 5762-5772 (2010).
- Samuel, R., et al. Generation of functionally competent and durable engineered blood vessels from human induced pluripotent stem cells. Proc Natl Acad Sci USA. 110, 12774-12779 (2013).
- Margariti, A., et al. Reprogramming of fibroblasts into endothelial cells capacble of angiogenesis and reendothelialization in tissue-engineered vessels. Proc Natl Acad Sci USA. 109, 13793-13798 (2012).
- Karamariti, E., et al. Smooth muscle cells differentiated from reprogrammed embryonic lung fibroblasts through DKK3 signaling are potent for tissue engineering of vascular grafts. Circ Res. 112, 1433-1443 (2013).
- Udelsman, B., et al. Development of an operator-independent method for seeding tissue-engineered vascular grafts. Tissue Eng Part C Methods. 17 (7), 731-736 (2011).
- Cearbhaill, E. D., Murphy, M., Barry, F., McHugh, P. E., Barron, V. Behavior of human mesenchymal stem cells in fibrin-based vascular tissue engineering constructs. Ann Biomed Eng. 38 (3), 649-657 (2010).
- Wong, M. M., et al. Macrophages control vascular stem/progenitor cell plasticity through tumor necrosis factor-α-mediated nuclear factor-κB activation. Arterioscler Thromb Vasc Biol. 34 (3), 635-643 (2014).
- Wong, M. M., et al. Sirolimus stimulates vascular stem/progenitor cell migration and differentiation into smooth muscle cells via epidermal growth factor receptor/extracellular signal-regulated kinase/β-catenin signaling pathway. Arterioscler Thromb Vasc Biol. 33 (10), 2397-2406 (2013).
- Lee, J., Cuddihy, M. J., Kotov, N. A. Three-dimensional cell culture matrices: State of the art. Tissue Eng Part B Rev. 14, 61-86 (2008).
- Hung, H. S., Hsu, S. H. Current Advances of stem cell-based approaches to tissue-engineering vascular grafts. OA Tissue Engineering. 1 (1), 2 (2013).
- Quint, C., et al. Decellularized tissue-engineered blood vessel as an arterial conduit. Proc Natl Acad Sci USA. 108 (22), 9214-9219 (2011).
- Zhang, X., Xu, Y., Thomas, V., Bellis, S. L., Vohra, Y. K. Engineering an antiplatelet adhesion layer on an electrospun scaffold using porcine endothelial progenitor cells. J Biomed Mater Res A. 97 (2), 145-151 (2011).
- Hibino, N., et al. Evaluation of the use of an induced puripotent stem cell sheet for the construction of tissue-engineered vascular grafts. J Thorac Cardiovasc Surg. 143 (3), 696-703 (2012).
- Zhao, J., et al. A novel strategy to engineer small-diameter vascular grafts from marrow-derived mesenchymal stem cells. Artif Organs. 36 (1), 93-101 (2012).
- Tsai, T., et al. Contribution of stem cells to neointimal formation of decellularized vessel grafts in a novel mouse model. Am J Pathol. 181 (1), 362-373 (2012).
- Kasimir, M. T., et al. Comparison of different decellularization procedures of porcine heart valves. Int J Artif Organs. 26 (5), 421-427 (2003).
- Stephenson, E., et al. Derivation and propagation of human embryonic stem cell lines from frozen embryos in an animal product-free environment. Nature Protocols. 7, 1366-1381 (2012).
- Takahashi, K., Okita, K., Nakagawa, M., Yamanaka, S. Induction of pluripotent stem cells from fibroblast cultures. Nature Protocols. 2, 3081-3089 (2007).
- McCall, F. C., et al. Myocardial infarction and intramyocardial injection models in swine. Nature Protocols. 7, 1479-1496 (2012).
- Olausson, M., et al. Transplantation of an allogeneic vein bioengineered with autologous stem cells: a proof-of-concept study. Lancet. 380 (9838), 230-237 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten