Method Article
Generación y Acrecentamiento de buques de ingeniería de tejidos en un modelo de ratón
* Estos autores han contribuido por igual
En este artículo
Resumen
A continuación, presentamos un protocolo para generar ingeniería tisular injertos de vasos que son funcionales para el injerto en ratones por doble siembra de células madre pluripotentes inducidas parcialmente (PIPSC) - deriva células musculares lisas y PIPSC - células endoteliales derivadas de un biorreactor andamio buque descelularizado.
Resumen
The construction of vascular conduits is a fundamental strategy for surgical repair of damaged and injured vessels resulting from cardiovascular diseases. The current protocol presents an efficient and reproducible strategy in which functional tissue engineered vessel grafts can be generated using partially induced pluripotent stem cell (PiPSC) from human fibroblasts. We designed a decellularized vessel scaffold bioreactor, which closely mimics the matrix protein structure and blood flow that exists within a native vessel, for seeding of PiPSC-endothelial cells or smooth muscle cells prior to grafting into mice. This approach was demonstrated to be advantageous because immune-deficient mice engrafted with the PiPSC-derived grafts presented with markedly increased survival rate 3 weeks after surgery. This protocol represents a valuable tool for regenerative medicine, tissue engineering and potentially patient-specific cell-therapy in the near future.
Introducción
La construcción de conductos vasculares es una estrategia fundamental para la reparación quirúrgica de los vasos dañados y heridos resultantes de enfermedades cardiovasculares. Hasta la fecha, los materiales utilizados en la cirugía de injerto biocompatible incluyen polímeros sintéticos (politetrafluoroetileno [teflón], politetrafluoroetileno expandido [ePTFE; Gore-Tex] o tereftalato de polietileno [Dacron]), aloinjertos, tejido autólogo (pericardio o vena safena) y xenoinjertos 1. Mientras que los injertos artificiales (por ejemplo, Gore-Tex y Dacron) son los más utilizados, estos materiales probablemente causan numerosas complicaciones a corto y largo plazo que incluyen la estenosis, la deposición de calcio, trombo-embolia y las infecciones. Aunque los pacientes con injertos biológicos presentes con una disminución de eventos tromboembólicos, todavía se encuentran con limitaciones, como el fracaso del injerto secundaria y durabilidad acortada debido a la degradación de la calcificación 2. Por lo tanto, a pesar de las mejoras significativas en t quirúrgicaechniques largo de los años, los investigadores y los médicos todavía están cargados con la necesidad de identificar el conducto ideal para enfermedades vasculares. Más recientemente, el campo de la investigación de la ingeniería de tejido vascular ha generado un concepto en el que las células se incorporan en estructuras biodegradables, con el objetivo de crear un entorno biomimético que personifica un recipiente funcional para injerto realizado con éxito 1. Fundamentalmente, el éxito de las construcciones vasculares depende de tres componentes esenciales; las células que componen el andamio, es decir, una capa interna de células endoteliales y una capa de células del músculo liso, un andamio que contiene la matriz extracelular apropiado para proporcionar propiedades mecánicas comparables a la vasculatura nativa, y la señalización molecular / celular que se requiere para iniciar / regulador reparación.
La permeabilidad del injerto a largo plazo y el desarrollo sostenido de los neo-tejidos son altamente dependientes de la siembra de células eficaz de andamios, THereby haciendo que la decisión del tipo de célula de importancia crítica. Varios informes demuestran el uso de endoteliales maduras y las células musculares lisas de diferentes fuentes para desarrollar conductos de pequeño diámetro de 3-6. Aunque prometedores, la falta de vasos autólogos suficiente para obtener endoteliales maduras y las células musculares lisas siguen siendo una carga considerable. Más recientemente, las células madre a partir de diversas fuentes han sido explotados para aplicaciones de ingeniería de tejidos vasculares. Células mononucleares de hecho, las células madre pluripotentes una variedad de tipos de células madre, incluyendo células madre embrionarias 7, inducida (CMPI) 8,9, PIPSC 10,11, derivadas de la médula ósea 12, células madre mesenquimales 13, las células progenitoras endoteliales y la pared del vaso adulto -derivado células madre antígeno-1 (Sca-1) + células madre / progenitoras 14,15 todos se han demostrado que son capaces de diferenciarse en células endoteliales ya sea funcional o de músculo liso en respuesta a los medios de comunicación definidos ycondiciones de cultivo. Además, la capacidad ilimitada de auto renovación de las células madre a tomar mejores candidatos a diferencia endoteliales maduras y las células musculares lisas que sólo se puede dividir por un número finito de veces antes de someterse a la detención del crecimiento y la senescencia.
La selección del material de andamio para generar tejido éxito recipiente diseñado para el injerto depende de varios factores tales como la biocompatibilidad, propiedades biomecánicas, y la velocidad de biodegradación. Fundamentalmente, los materiales utilizados para crear andamios para los injertos deben ser biodegradables y no se montarán las respuestas inmunes receptores innecesario. Además, debe abarcar una porosidad adecuada y la microestructura para la fijación celular y la supervivencia posterior. Hasta la fecha, los materiales más comunes usados para andamios en la ingeniería de tejidos vascular incluyen polímeros de ácido poliglicólico, ácido poliláctico, y poli ε-caprolactona 16. Más recientemente, los materiales biológicos descelularizados tienenTambién ha aplicado con cierto éxito. Varios laboratorios han demostrado que la siembra de los vasos porcina humana descelularizado, canino o con células autólogas proporciona un injerto biológico que resistió la coagulación y la hiperplasia intimal 17-19. Otras estrategias de ingeniería de tejidos vascular incluyen injertos vasculares extracelulares basado proteínas de matriz por ejemplo, células de siembra en gel de fibrina 13 y generando láminas de células sin el apoyo del andamio 20, 21.
El protocolo actual demuestra la diferenciación de PIPSC humano en endotelial funcional y células musculares lisas, la generación de un biorreactor que consiste en un andamio recipiente descelularizado para albergar células vasculares derivadas de PIPSC funcionales, y el injerto de los vasos de ingeniería tisular en la inmunodeficiencia combinada severa (SCID ) ratones. PIPSC son un tipo de célula óptima a utilizar para la ingeniería de tejidos de injertos de vasos ya que estas células no forman tumores en ratones o plantean ético yallo respuestas inmunes. Por otra parte, hemos demostrado que la estrategia para la generación de células musculares Pipa-células endoteliales y Pipa-lisas es eficiente y reproducible 10,11. A partir de entonces, se diseñó un recipiente de descelularizado para la siembra de las células vasculares derivadas de PIPSC para imitar las proteínas de la matriz que existe dentro de un vaso nativo, mejorando así la supervivencia de injerto y la eficacia. Además, la descelularización de los vasos antes de la siembra PIPSC previene la aparición de las respuestas inflamatorias montadas por tipos de células inmunes, tales como macrófagos. Más importante aún, este protocolo no sólo representan una metodología para generar prometiendo conductos vasculares para la traducción a los seres humanos, sino que también proporciona medios valiosos para el estudio y la comprensión de los mecanismos moleculares que regulan la regeneración del tejido vascular a través de modelos de ratón.
Protocolo
Realice todos los experimentos con animales de acuerdo a los protocolos aprobados por el Comité Institucional de Uso y Cuidado de Animales de Laboratorio.
1. Preparación de Medios de Cultivo
- Hacer medios de cultivo para la línea celular de fibroblastos humanos CCL-153: F-12K mediana, suero bovino fetal al 10% (FBS) y 100 U / ml de penicilina y estreptomicina.
- Hacer reprogramación de medios para la generación de PIPSC: medio de Eagle modificado de Knockout Dulbecco (DMEM) que contiene 20% suero sustitución Knockout, 0,1 mM β-mercaptoetanol, 0,1 mM Medio Esencial Mínimo (MEM) de ácidos no esencial Amino, 10 ng / factor de crecimiento de fibroblastos básico ml 2 (bFGF-2) y 100 U / ml de penicilina y estreptomicina. Añadir bFGF-2 frescos cada vez antes de usar los medios de comunicación.
- Hacer Diferenciación Media (DM) para inducir células del músculo liso (SMC) Diferenciación: α-MEM medios que contienen 10% de FBS, Factor de Crecimiento 0,1 mM β-mercaptoetanol, 100 U / penicilina y estreptomicina y 25 ml ng / ml derivado de las plaquetas(PDGF-ββ).
- Hacer endotelial Diferenciación Media (EC-DM) para inducir células endoteliales (CE) Diferenciación: medios que contienen 50 ng de crecimiento endotelial medios de comunicación-2 (EGM-2) / ml factor de crecimiento vascular endotelial (VEGF) y 100 U / ml de penicilina y estreptomicina.
2. Reprogramación fibroblastos humanos en células madre pluripotentes inducidas (parcialmente PIPSC)
- Cultura línea celular de fibroblastos humanos CCL-153 en 0.04% de la solución de gelatina frascos revestidos en medio de cultivo.
- Células Passage cada 3 días en una proporción de 1: 6. Utilice las células antes del paso 9 para una óptima eficiencia de la generación PIPSC. Las células están listas para la transfección al llegar a 80 - 90% de confluencia.
- Linealizar pCAG2LMKOSimO plásmido policistrónico que contiene 4 factores de reprogramación octamer vinculante factor de transcripción 4 (OCT4), Sox2, factor de Kruppel-like 4 (KLF4) y C-MYC (pCAG-OSKM). Digerir 5 g de plásmido con 5 unidades de enzima de restricción PvuI durante 3 horas a 37 ° C. Purificarel plásmido con un kit comercial según el protocolo del fabricante.
- Transfectar 2 x 10 6 fibroblastos humanos con 4 g de plásmido pCAG-OSKM linealizado mediante electroporación con el kit de fibroblastos dérmicos humanos (NHDF) nucleofection según el protocolo del fabricante. Sembrar suavemente las células transfectadas en pre 0,04% de gelatina recubierta matraz T25 que contiene 5 ml de pre-calentado reprogramación de medios.
- Después de 24 horas, cambio de medio con suplementos de 25 mg / ml de neomicina para seleccionar una población pura de células transfectadas.
- Cambio de medio cada dos días hasta el día 4.
Nota: Los fibroblastos humanos se convierten en PIPSC después de 4 días de reprogramación.
3. Diferenciación de PIPSC en células endoteliales y musculares lisas
- PIPSC Seed en platos de colágeno IV pre-recubiertos que contienen DM durante 4 días para inducir la diferenciación en las SMC. Cambio de medio cada dos días hasta el día 4.
- PIPSC Semilla de colágeno IV pre-recubierto platos containing endotelial-DM durante 6 días para inducir la diferenciación en las células endoteliales. Cambie medio cada dos días hasta el día 6.
4. Descelularizado Aorta Preparación del injerto
Nota: Todas las soluciones y equipos deben ser estériles.
- Sacrificar el ratón por dislocación cervical y fijar el ratón en una posición supina bajo microscopio de disección.
- Corte a través del esternón y alrededor de la caja torácica para abrir la cavidad torácica. Quite el corazón, los pulmones y el esófago para exponer la aorta. Retire con cuidado la grasa peri-aorta con fórceps.
- Cortar la aorta desde el extremo anterior con unas tijeras y coloque un lado del extremo con fórceps romos. Separe la aorta de la columna de la columna vertebral por detrás mediante disección roma. Cierre con cuidado todas las arterias de ramificación de la aorta por la ligadura con un electrocoagulador bipolar y el corte desde el otro extremo de la ligadura con unas tijeras.
- Utilice una jeringa de 5 ml para limpiar el lumen de la aorta con 3 ml de solución salina que contiene 100 U de heparina para prevenir la formación de coágulos de sangre.
- Cortar el extremo posterior de la aorta antes se ramifica en el renal. Mantener la integridad de la aorta es muy importante durante todo el procedimiento.
- Enjuague el lumen de la aorta con 5 ml de dodecilsulfato de sodio (SDS) solución de 0,075% diluido en tampón fosfato salino (PBS).
- Remojar la aorta torácica en solución de SDS al 0,075% en una placa de Petri de 10 cm. Coloque la placa de Petri en un agitador orbital durante 2 horas a 150 rpm a temperatura ambiente.
- Enjuague el lumen de la aorta con 5 ml de PBS.
- Remoje la aorta en PBS en una placa de 10 cm de Petri. Coloque la placa de Petri en el agitador orbital durante 2 horas a 150 rpm a temperatura ambiente. Actualizar PBS cada 20 minutos.
- Enjuague el lumen de la aorta con 5 ml de PBS.
- Mantenga injerto aorta descelularizado en PBS a 4 ° C durante un máximo de una semana.
5. Dual Siembra de PIPSC y biorreactor acondicionado
Nota: Todas solución des y el equipo deben ser estériles. Realizar todas las operaciones en una campana de cultivo de tejidos.
- Montar el circuito de flujo de biorreactor, como se ilustra en la Figura 1. Conectar cámara de incubación, depósito de medio, la bomba peristáltica y la cámara de cumplimiento de la tubería. Volumen mínimo de medio necesario para la circulación es de 40 ml.
- Pre-condición del recipiente descelularizado con medio de cultivo empapando la aorta en un medio de DM en un plato de 10 cm Petri. Coloque la placa de Petri en el agitador orbital durante 1 hora a 50 rpm a temperatura ambiente.
- Introduzca 1 cm tubos de nylon de longitud (OD 0,9 mm, ID 0,75 mm) en ambos extremos de la vasija descelularizado bajo el microscopio. Ate el recipiente y los tubos con 8-0 suturas de seda.
- Montar el injerto de aorta descelularizado en la cámara de incubación mediante la conexión de los tubos de nylon con los puertos de entrada y salida (1/32 ") de tubos de la pared de la cámara. Mantener cámara de incubación con 5 ml de medio cada vez.
- Trypsinize PIPSC añadiendo precalentadotripsina para cubrir la placa de cultivo y el rock suavemente el plato 10 veces. Deseche la tripsina y dejar el plato en la incubadora durante 2 - 3 minutos. Añadir medio de cultivo pre-calentado en el plato y mezclar el medio con las células.
- Contar el número de células usando un hemocitómetro. Centrifugar dos alícuotas de suspensiones celulares que contienen 5 x 10 5 células cada uno durante 5 min a 300 x g. Aspirar el sobrenadante por completo.
- Después de aspirar el sobrenadante por completo, resuspender 1 pellet de las pepitas sedimentos celulares en 50 l de DM. Inyectar esta suspensión de células en la luz del vaso descelularizados.
- A continuación, volver a suspender el sedimento celular otra pips en 100 l de Matrigel. Pipetear con cuidado la mezcla sobre el injerto de aorta descelularizado.
- Espere de 10 - 15 min hasta que la mezcla se convierte en un estado similar a un gel uniformemente y se envuelve alrededor de la superficie externa del vaso. Llene la cámara de incubación con DM.
- Configuración de lugar en una incubadora de CO2 al 5% todo el biorreactor a 37 ° C. Girar manualmente el injerto descelularizado 90 ° alrededor del eje longitudinal cada media hora en el primero 2 hr.
- Mantenga la cultura estática durante 12 horas para permitir la adhesión celular.
- Entregar DM a través del lumen por la bomba peristáltica para inducir la diferenciación de células musculares lisas. Iniciar la velocidad de flujo inicial en 5 ml / min y aumento escalonado a 20 ml / min durante 24 hr.
- Mantener la tasa de flujo del medio circulante a 20 ml / min durante 24 horas.
- Detener el flujo del medio y mover el ajuste de la incubadora biorreactor.
- Re-semilla del lumen del injerto con PIPSC. Trypsinize, recuento y centrifugar 1 x 10 6 PIPSC como en los pasos 5.5 a 5.6. Resuspender las células en 50 l de medio EGM-2 que contienen 50 ng / ml de VEGF. Inyectar la mezcla de células en el lumen del injerto.
- Cambiar el medio en la cámara de incubación y toda la circulación en EGM-2 medio que contiene 50 ng de VEGF / ml para inducir la diferenciación endotelial.
- Mueva retrasando a th el biorreactore incubadora. Gire manualmente el injerto 90 ° cada 30 minutos en las primeras 2 horas y luego mantener una cultura estática durante 12 horas.
- Iniciar la circulación de flujo de 5 ml / min y aumento escalonado a 35 ml / min. Mantener el caudal a 35 ml / min durante 5 días. Cambiar circulante y medio cámara de cada dos días.
- Se recoge el injerto de ingeniería para su posterior injerto de ratón.
6. El injerto de doble cabeza de serie PIPSC injerto en ratones
- Uso NOD.CB17-Prkdc scid / NcrCrl ratones macho como receptores de injertos buque. Asegúrese siempre de que los ratones son alrededor de 10 semanas de edad, pesan aproximadamente 25 - 35 g, y se encuentran en buenas condiciones de salud.
- Anestesie ratón receptor mediante la administración de una combinación de Hypnorm (25 mg / kg) y Hypnovel (25 mg / kg) por vía intraperitoneal. Aplicar vaselina pomada oftálmica en los ojos para evitar la sequedad mientras que bajo anestesia. Confirme anestesia eficiente, garantizando que los ratones tienen los músculos relajados y están respirando constantemente.
- Fijar el ratón en una posición supina con su cuello afeitó y extendido. Administrar sulfato de atropina (1,7 mg / kg) en combinación con los anestésicos para asegurar que las vías respiratorias del ratón sigue siendo clara.
- Preparar una incisión en la línea media de la mandíbula al esternón del ratón. Bajo un microscopio de disección con 5 a 10 veces la amplificación, levantar las glándulas salivales derecha lateralmente y eliminar el músculo esternocleido- derecho a exponer la arteria carótida común derecha.
- Retire con cuidado los tejidos unidos a movilizar a la arteria carótida común derecha desde el extremo distal hacia el extremo proximal. Ligar la porción media de la arteria carótida común dos veces con una sutura de seda 8-0 y disecar entre los dos lazos.
- Pasar a través de un manguito de tubo de nylon autoclavable en cada extremo del vaso y fijar cada extremo con pinzas microhemostat.
- Quitar el lazo de sutura en un extremo y aplicar una gota de heparina (100 U / ml). Inmediatamente después, invertir el extremo distal del ésimoe arteria para cubrir todo el cuerpo del manguito y fijar el recipiente invertido con una sutura de seda 8-0 en el manguito.
- Repetir el mismo procedimiento para la otra porción de la arteria. Arteria Lavar con solución salina para eliminar los coágulos de sangre.
- Implantar un injerto de vaso descelularizado entre dos extremos de la arteria carótida por deslizamiento los extremos de los vasos de la descelularizados a través de los puños de la arteria y la fijación con suturas de seda 8-0. Eliminar pinzas vasculares de cualquiera de los extremos antes de evaluar la pulsación del injerto.
- Coloque la glándula salival de vuelta a su posición original. Cierre de la piel en la ubicación quirúrgica con una sutura interrumpida usando una sutura de poliglactina 6-0.
- Consistentemente observar los signos vitales de ratón después de que se completa el procedimiento, hasta que se reanude la conciencia. Sacrificar los ratones receptores por dislocación y de los vasos de la cosecha injertos cervicales ya sea 24 horas o 3 semanas más tarde para su posterior análisis.
Resultados
La generación exitosa de PIPSC fue confirmado 4 días después nucleofecting fibroblastos humanos con un plásmido linealizado pCAG2LMKOSimO llevar 4 factores de transcripción, Oct4, SOX2, KLF4 y c-myc (OSKM). PIPSC muestra un fenotipo notablemente distinta en comparación con fibroblastos (Figura 2A) y expresó los 4 factores de reprogramación en el mRNA (Figura 2B) y los niveles de proteína (Figura 2C) 10. La eficacia de un injerto vascular a base de PIPSC es altamente dependiente de la capacidad de la PIPSC de diferenciarse en ambos linajes endoteliales y de músculo liso. Por tanto, es crítico para confirmar estas propiedades de PIPSC in vitro mediante la diferenciación de las células en medios definidos antes de utilizar para generar injertos de vasos. La Figura 3 muestra la capacidad de PIPSC para diferenciarse en células endoteliales funcionales tanto en gen (Figura 3A) y la proteína ( Figura 3B-D) levels, basado en marcadores endoteliales específica 10. Del mismo modo, PIPSC también son capaces de diferenciarse en el linaje del músculo liso en respuesta a los medios de comunicación específico (Figura 3E-H) 11.
Descelularización aorta completa se logra mediante el tratamiento con SDS, un detergente aniónico que lisa las células y solubiliza componentes citoplasmáticos. Después de 2 h de tratamiento, la aorta descelularizado apareció como un andamio acelular translúcida en comparación con una aorta recién cosechado (Figura 4A-B) 22. La evaluación histológica en la Figura 4C-F ilustra la ausencia de núcleos o tinción citoplásmica en los vasos descelularizados, pero no en la aorta de ratón normal. Después de la siembra de doble endotelial derivado de PIPSC y células de músculo liso dentro de aortas descelularizados, los injertos vasculares de ingeniería muestran propiedades de células endoteliales y de músculo liso, respectivamente. Hematoxilina y eosina (HE) tinción de la doble-sinjertos ecesarios revelaron una arquitectura similar a la de los vasos nativos (Figura 4G) con múltiples capas de células musculares lisas y una monocapa de células endoteliales según lo confirmado por tinción positiva para músculo liso-22α (SM22), actina músculo liso-α (SMA) , CD31 y CD144 marcadores respectivamente (Figura 4H-M) 11.
Para confirmar la permeabilidad de los vasos de tejido de ingeniería in vivo, los cabezas de serie buques de doble derivados de PIPSC fueron injertados en ratones - tanto de ratón normal y las arterias descelularizados se utilizaron como controles. El análisis posterior mostró que mientras que los ratones injertados con vasos descelularizados presentados con las tasas de mortalidad notablemente superiores ya en el día 1, injertos de vasos PIPSC confieren una tasa de supervivencia del 60% 3 semanas después del trasplante (Figura 5) 11. Adicionalmente, 3 semanas de edad injertos derivados de PIPSC estaban completamente caracterizan por la presencia de endotelial derivado de PIPSC humana y células musculares lisas y la infiltración de macrófagos host (Figura 5B y Tabla 1) 11. Tomados en conjunto, los resultados indican que PIPSC tienen la capacidad de diferenciarse en ambos linajes vascular y son potentes para la generación de vasos de ingeniería tisular funcionales que puedan sustituir los vasos nativos in vivo.
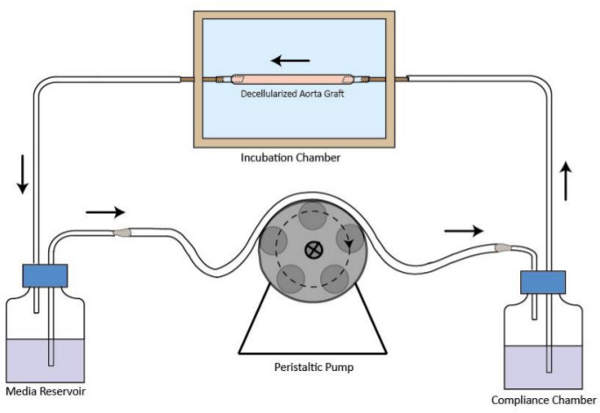
Figura 1. Representación esquemática del circuito de flujo de biorreactor de injerto descelularizado. El injerto de vaso descelularizado se monta en la cámara de incubación. Una bomba peristáltica está en la aguas arriba de la cámara de incubación para proporcionar un flujo de perfusión del medio estable. El depósito de medio está en la corriente abajo de la cámara de incubación. La cámara de cumplimiento es mejorar el régimen de flujo. La dirección del flujo se indica mediante flechas.large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.

Figura 2. Generación de PIPSC a partir de fibroblastos humanos. Fibroblastos humanos fueron nucleofected ya sea con cuatro genes de reprogramación (Oct4, Sox2, Klf4 y c-Myc) o un vector vacío (control). (A) Fase de contraste imágenes muestran la morfología de pips después de 4 días. PIPSC expresó los cuatro factores de transcripción, tanto en los niveles de proteína (C) mRNA (B) y. La barra de escala para las imágenes que se muestran son de 50 micras y los datos son medias ± SEM (n = 3); * P <0,05, *** p <0,001. Esta cifra ha sido modificado desde Margariti, A. et al. 10 Por favor haga clic aquí para ver una versión más grande de esta figura. </ A>
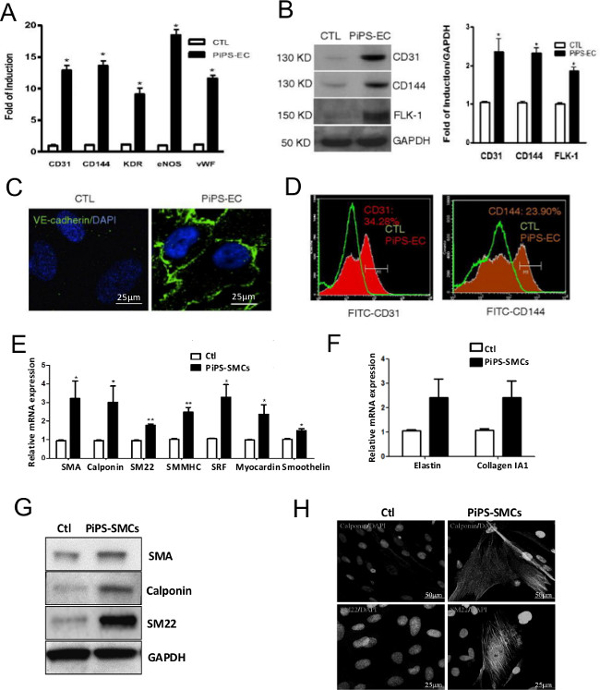
Figura 3. PIPSC puede diferenciarse en ambas células endoteliales y de músculo liso. PIPSC células o de control se diferenciaron en células endoteliales. (A) En comparación con las células control, PIPSC deriva-células endoteliales expresó marcadores endoteliales específicos tales como CD31, CD144, receptor de dominio de inserción de quinasa (KDR), la sintasa de óxido nítrico endotelial (eNOS) y el factor de von Willebrand (vWF) en el ARNm nivel. (B) Esto fue confirmado a nivel de proteínas mediante Western blot. (C) La tinción de inmunofluorescencia indica la tinción positiva de CD144 (VE-cadherina) en PIPSC-endotelial, pero no las células control. (D) Análisis de citometría de flujo confirmó la expresión de células PIPSC-endotelial de CD31 y CD144. El colágeno IV de semilla PIPSC (o de control de las células) también se diferenciaron encélulas musculares lisas. (E, F) A diferencia de las células de control, las células musculares lisas derivadas de PIPSC expresan marcadores específicos de músculo liso a nivel de genes, incluyendo SMA, calponin, SM22, músculo liso miosina de cadena pesada II (SMMHC), el factor de respuesta a suero (SRF) , myocardin, smoothelin, la elastina y el colágeno 1A1. (G) Los niveles de expresión de SMA, calponin y SM22 en las células derivadas de PIPSC se confirmaron mediante análisis de transferencia Western. (H) La tinción de inmunofluorescencia usando microscopía confocal mostró una tinción marcador de músculo liso típico para calponin y SM22. Los datos representan la media ± SEM (n = 3); * P <0,05, ** P <0,01, *** p <0,001. La barra de escala para las imágenes que se muestran son de 25 micras o 50 micras. Estas cifras se han modificado desde Margariti, A. et al. 10 y Karamariti, E. et al. 11 Por favor,haga clic aquí para ver una versión más grande de esta figura.
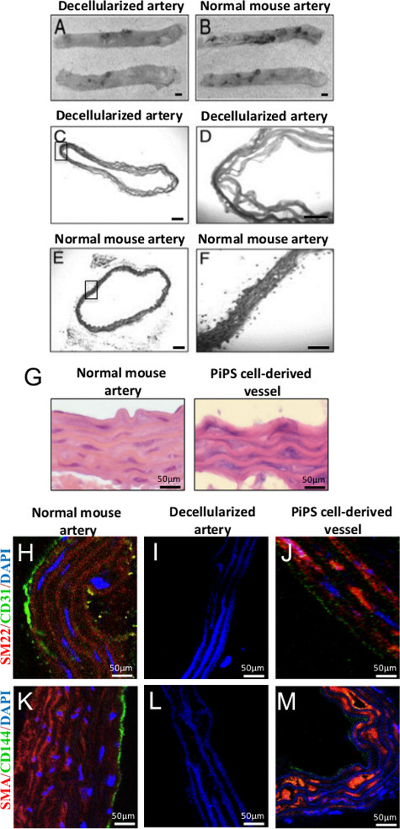
Figura 4. Generación de doble cabeza de serie de tejidos derivados de PIPSC ingeniería injertos vasculares. (A, B) descelularización de ratón aorta torácica conserva su estructura y todavía se parecía a la de un vaso normal, aumento original 2X. Tinción (CF) HE de aorta descelularizado confirmó descelularización éxito y retirar todas las células en comparación con los controles, aumento original: 50X o 200X. Tinción (G) de HE endotelial derivado de PIPSC y las células musculares lisas buques de doble cabeza de serie reveló una arquitectura que era similar a un vaso nativo. (J, M) de ingeniería tisular buques de doble cabeza de serie PIPSC teñidas positivo para endotelial (CD31 y CD144) y células de músculo liso (SMA) y SM22 marcadores a diferencia de deceinjertos de vasos llularized. (H, K) La expresión concomitante de marcadores vasculares, así como la morfología característica y localización de endotelial derivado de PIPSC y células de músculo liso dentro de las áreas medial y la íntima era comparable a los vasos nativos. La barra de escala para las imágenes que se muestran son de 50 micras. Estas cifras se han modificado de Tsai, T. et al., 22 y Karamariti, E. et al. 11 Por favor haga clic aquí para ver una versión más grande de esta figura.
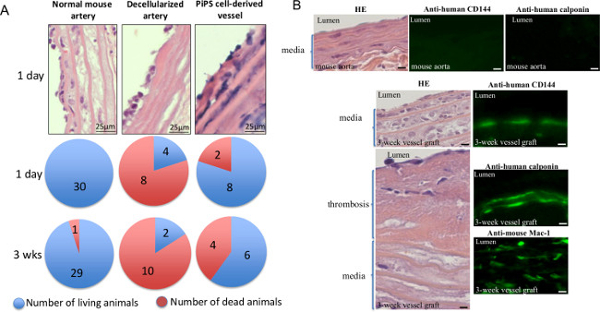
Figura 5. ingeniería tisular doble semillas injertos vasculares derivados de PIPSC son patentes para la sustitución de los vasos nativos in vivo. Vasos derivados de PIPSC se injertaron en la arteria carótida de inmunodeficiencia combinada severa (SCID), mou normalesSE y arterias descelularizados se utilizaron como controles. (A) Análisis de los ratones injertados con vasos derivados de PIPSC mostró que el 60% de supervivencia 3 semanas después de la cirugía, mientras que los ratones injertados con vasos descelularizados presentados con marcadamente mayores tasas de mortalidad y menor supervivencia (20%). Los datos representan las medias (n = 10). (B) Los vasos de ingeniería tisular también se cosecharon 3 semanas después del injerto y se sometió a HE (paneles izquierdos) o la tinción de inmunofluorescencia (paneles derechos) para la presencia de CD144 humano y calponin o el ratón CD11b / CD18 (Mac-1); cuantificación de la tinción se resume en la Tabla 1. Aumento original para las imágenes que se muestran son 400X menos que se indique. Esta cifra ha sido modificado desde Karamariti, E. et al. 11 Por favor haga clic aquí para ver una versión más grande de esta figura.
| Las células positivas Field (40X) | -Recipiente de ingeniería antes del injerto | Injerto recipiente de ingeniería (3 semanas) |
| calponin | 72 ± 9 | 22 ± 11 * |
| CD144 | 20 ± 8 | 5 ± 6 * |
| Mac-1 | 0 | 71 ± 11 * |
Tabla 1. Caracterización de los vasos de la ingeniería tisular 3 semanas después del injerto. El número de endoteliales derivadas de PIPSC y células musculares lisas y macrófagos de acogida se cuantificó después de la tinción de inmunofluorescencia con calponin humana, CD144 humano y el ratón Mac-1, respectivamente. Los datos representan la media ± SEM (n = 6); * P <0,05, una diferencia significativa de los vasos de la ingeniería tisular antes del injerto. Esta tabla ha sido modificado desde Karamariti, E. et al. 11
Discusión
El protocolo actual indica un sonido, la estrategia rápido, simple, eficiente y reproducible en la que los vasos de ingeniería tisular funcionales se pueden generar utilizando PIPSC a partir de fibroblastos humanos. Esta técnica representa una herramienta valiosa para la medicina regenerativa, la ingeniería de tejidos y terapia celular específica del paciente potencialmente en el futuro cercano. Los pasos críticos para garantizar la eficacia del protocolo incluyen la preparación de PIPSC, preparación de injertos aórticos estériles y totalmente descelularizados, siembra exitosa y diferenciación de PIPSC en los andamios y el mantenimiento de la esterilidad de los injertos aórticos en el biorreactor vascular.
Para iniciar la generación con éxito de los injertos de ingeniería tisular, es de suma importancia para asegurar que la preparación de PIPSC se lleva a cabo de manera efectiva. El protocolo ha exitosamente 'reprogramar' una línea celular de fibroblastos humanos en PIPSC través nucleofection con un plásmido pCAG2LMKOSimO OSKM. El survival de los fibroblastos después de nucleofection se basa en varios puntos clave, tales como el uso de plásmidos OSKM de alta calidad, los plásmidos de concentraciones que oscilan entre 500 - 1000 ng / l, evitar retrasos en la siembra de los fibroblastos inmediatamente después de nucleofection como células son particularmente sensibles tras la introducción de relativamente grandes plásmidos y, finalmente, la adición de FGF-2, que es crucial y debe ser agregado en medios recién preparados justo antes de su uso. Además, se encontró que era crucial usar células de hasta el paso 9 para evitar la senescencia replicativa, para asegurar eficiente 'reprogramación' en PIPSC y la posterior diferenciación en células endoteliales y de músculo liso. La pureza de PIPSC se puede mejorar mediante la selección de las células nucleofected con neomicina. El plásmido pCAG2LMKOSimO tiene un gen de resistencia a neomicina y por lo tanto la adición de neomicina en una gama de 25 mg / ml un día después de la nucleofection durante 3 días dará lugar a la selección de una población pura dePIPSC. Para diseñar un buque PIPSC eficiente para injertar en ratones, hemos considerado la integridad y la esterilidad de las aortas descelularizados sean de la más alta prioridad. Para mantener la integridad de las aortas antes y después descelularización, era necesario aplicar constantemente la destreza manual, mientras que el manejo de las embarcaciones, ya que eran relativamente frágil y diminuto considerablemente de tamaño. La eliminación eficaz del tejido perivascular y sellado de las arterias de ramificación utilizando un electro-coagulador bipolar era fundamental para garantizar la posterior siembra de células competentes y de evitar que los medios de comunicación. En cualquier punto, nos aseguramos de que todos los materiales y aparatos utilizados para generar el biorreactor (es decir, fórceps, tubos, botellas, cámaras, tijeras, adaptadores y conectores) eran esterilizable en autoclave, reduciendo así los riesgos de contaminación bacteriana y el fracaso de los injertos vasculares antes de la cirugía .
Mientras que el protocolo actual tiene aplicaciones clínicas prometedoras en dise cardiovascularases, hay algunas limitaciones que deben ser mejorados en el futuro próximo para mejorar aún más la metodología. Hasta el momento, los factores de transcripción OSKM se introdujeron en fibroblastos humanos a través de nucleofection. Si bien esta técnica es relativamente simple y directo, que también dio lugar a eficiencias de transfección variables en diferentes momentos experimentales. En particular, esta inconsistencia puede ser superada mediante la introducción de una etapa adicional de la selección de neomicina antes mencionado. Del mismo modo, se podría considerar la introducción de los cuatro factores en fibroblastos humanos utilizando la integración lentivirus, que pueden potencialmente aumentar la eficiencia de 'reprogramación' y mejorar la supervivencia de las células después de la infección. En términos del biorreactor, se encontró que descelularización completa de aortas se puede lograr usando 0,075% de SDS. Aunque esta técnica se consideró óptima para la eliminación de células en comparación con otros detergentes (por ejemplo, Triton X-100), puede sin embargo causar palteraciones otencial dentro de los ultra-estructuras de las proteínas de la matriz extracelular 23. Por tanto, este fenómeno amerita estrategias Descelularización más eficientes para minimizar la interrupción de las proteínas de la matriz extracelular asociados. Además, también consideramos que el diámetro y espesor de aortas descelularizados varían entre los ratones, dependiendo de su edad, la tensión y el fondo, y por lo tanto causan las posibles diferencias en la velocidad de flujo y la tensión de corte dentro de biorreactores y la distribución de PIPSC siguiente PIPSC siembra . Todo esto queda por aclarar.
Este protocolo se describe aquí la generación de ingeniería tisular injertos funcionales utilizando PIPSC que mantienen un potencial prometedor para futuras aplicaciones clínicas en terapia con células madre para la enfermedad cardiovascular. Este proceso que utiliza la reprogramación directa de un linaje somáticas (fibroblastos) a otro (cualquiera de las células musculares lisas endoteliales o) saltando por pluripotencia puede ser una manera para obtener células seguras y adecuadas de interés. De hecho, varios protocolos se han publicado para describir la generación de líneas de células madre a partir de embriones humanos, células iPS y células madre adultas 24-26, todas las cuales sin embargo, todavía plantean sobre cuestiones con respecto a su uso en clínica. Ahora se sabe que PIPSC no desarrollan teratomas en ratones SCID, eliminando así la preocupación de la formación de tumores. Además, las células toman un tiempo significativamente más corto para generar, cultura y diferenciar 10,11, y se ha demostrado para generar exitosas y funcionales vasos de ingeniería tisular injertos que son comparables a aortas nativas. Por lo tanto, PIPSC presente como una fuente de células prometedora para el tratamiento de pacientes que utilizan la terapia de células personalizado porque fibroblastos (por ejemplo, de la piel) se pueden derivar de un individuo específico. El sistema de vasos decellularised en este protocolo ofrece un modelo más biomimético que proporciona células sembradas con una extracellulproteína de la matriz ar que es más representativo a la de una aorta nativa 11. Estos puntos clave son críticos para asegurar la supervivencia, la diferenciación y la funcionalidad de las células sembradas y los vasos de ingeniería tisular a partir de entonces. Estudio reciente de Sumitran-Holgersson y colegas demostraron una repoblación con éxito de un injerto de vena ilíaca previamente descelulariza de una persona fallecida antes de injerto 27, postulando así un valor de traslación de la actual protocolo en humanos en un futuro próximo. Por otra parte, los injertos de vasos descelularizados pueden representar un buen modelo en el que el papel y el comportamiento de otros tipos de células vasculares que también contribuyen a los injertos de ingeniería tisular se pueden evaluar. Este sistema modelo en ratones podría proporcionar una herramienta poderosa para la detección de drogas futuro y también en la elucidación de los mecanismos celulares y moleculares implicados en la biología de células madre vascular. En conjunto, el protocolo actual tiene un valor prometedor para su aplicación en Vascingeniería de tejidos ular y un gran avance en la medicina personalizada.
Divulgaciones
Los autores no tienen conflictos de intereses financieros.
Agradecimientos
This work was supported by The British Heart Foundation and The Oak Foundation.
Materiales
| Name | Company | Catalog Number | Comments |
| Human Fibroblasts CCL-153 | ATCC | CCL-153 | Prenatal human embryonic fibroblasts |
| ATCC F-12K Medium (Kaighn's Modification of Ham's F-12 Medium) | ATCC | 30-2004 | |
| Fetal Bovine Serum | ATCC | 30-2020 | |
| Knockout DMEM medium optimized for embryonic stem cells | Life technologies (Gibco) | 12660-012 | |
| Knockout Serum Replacement | Life technologies (Invitrogen) | 10828-028 | |
| Human Basic FGF-2 | Miltenyi Biotech | 130-093-837 | |
| alpha-MEM medium | Life technologies (Invitrogen) | 32571093 | |
| Human PDGF | R&D System | 120-HD-001 | |
| Gelatin Solution 2% | Sigma | G1393 | |
| Plasmid 20866: pCAG2LMKOSimO (SOX2, OCT4, KLF4, C-MYC) | Addgene | 20866 | |
| PvuI Restriction Enzyme | New England Biolabs | RO150S | |
| SureClean Plus | Bioline | BIO-37047 | |
| Nucelofection Kit (NHDF Kit) | LONZA | VPD-1001 | |
| Neomycin | SIGMA | G418 | |
| KL 1500 LCD, Illumination for Stereo Microscopy | SCHOTT | KL 1500 LCD | Cold light illumination for stereo microscopy |
| Nikon Zoom Steromicroscope SMZ800 | Nikon | SMZ800 | |
| Heparin sodium salt | Sigma | H3393 | |
| 10% SDS Stock Solution Molecular Biology Reagent | Severn Biotech | CAS 151-21-3 | |
| Dulbecco's Phosphate Buffered Saline | Sigma | D8537 | |
| Matrigel (10mg/ml) | BD | A6661 | |
| Shaker IKA Vibrax with Shaking platform VX 7 | Jepson Bolton's, Janke&Kunkel | S32-102 | |
| Masterflex L/S Digital Pump Drive | Cole-Parmer | WZ-07523-80 | |
| Masterflex L/S 6-channel, 6-roller cartridge pump head | Cole-Parmer | EW-07519-15 | |
| Masterflex L/S large cartridges for pump head | Cole-Parmer | EW-07519-75 | |
| Masterflex platinum-cured silicone pump tubing, L/S 14, 25 ft | Cole-Parmer | WZ-96410-14 | Tubing goes through the peristaltic pump |
| 0.5mm ID, 0.8 mm OD Silicone Tubing | SILEX | N/A | Tubings connect incubation chamber, media reservoir and compliance chamber |
| Fitting Reducer 0.5 to 1.6, natural Polypropyline | Ibidi | 10829 | Adapter connect above two types of tubings |
| 1/32" Tubing, ID 0.01" (250µm) Material: PEEK | LabSmith | T-132-010P | Tubing through the incubation chamber wall which connects the graft with outside tubing |
| One-Piece Fittings | LabSmith | T-132-100 | Fix the above tubings through the incubation chamber wall |
| Nylon tubes (OD 0.9mm, ID 0.75mm) | Smiths Medical | N/A | Tubings insert into two ends of the aorta graft |
| NOD.CB17-Prkdcscid/NcrCrl mouse | Charles River | ||
| Surgical sutures, 8-0 silk | ETHICON | W819 | |
| Hypnorm | Vetapharm | Vm21757/4000 | Neuroleptanalgesic for use in mice |
| Hypnovel (Midazolam) | Roche | 59467-70-8 | Induction of anaesthesia |
| Dissecting microscope | Carl Zeiss | Stemi 2000 | |
| Nylon Tubing | Portex LTD | 800/200/100/200 | 0.65 mm in diameter and 1 mm in length; to make artery cuff |
| Electrocoagulator | Martin | SN 54.131 | Ligation of artery branches on aorta |
| Bipolar micro hemostat forceps | Martin | 80-91-12-04 | Fixation of vessel ends |
| Vessel Dilator | S&T | JFX-7 | |
| Vessel Dilator | S&T | JFL-3dZ | |
| Vessel Dilator | S&T | D-5aZ | |
| Mini applier | AESCULAP | FE572K | |
| Micro hemostats clips | AESCULAP | FE720K | |
| Surgical sutures, 6-0 VICRYL | ETHICON | V489 |
Referencias
- Kurobe, H., Maxfield, M. W., Breuer, C. K., Shinoka, T. Concise Review: Tissue-Engineered Vascular Grafts for Cardiac Surgery: Past, Present, and Future. Stem Cells Transl Med. 1 (7), 566-571 (2012).
- Jonas, R. A., Freed, M. D., Mayer, J. E. Jr Long-term follow-up of patients with synthetic right heart conduits. Circulation. 72, II77-II83 (1985).
- Heureux, N., et al. Technology insight: the evolution of tissue-engineered vascular grafts-from research to clinical practice. Nat Clin Pract Cardiovasc Med. 4, 389-395 (2007).
- Zhang, W. J., Liu, W., Cui, L., Cao, Y. Tissue engineering of blood vessel. J Cell Mol Med. 11, 945-957 (2007).
- Cearbhaill, E. D., et al. Response of mesenchymal stem cells to the biomechanical environment of the endothelium on a flexible tubular silicone substrate. Biomaterials. 29, 1610-1619 (2008).
- Gong, Z., Niklason, L. E. Small-diameter human vessel wall engineered from bone marrow-derived mesenchymal stem cells (hMSCs). FASEB J. 22, 1635-1648 (2008).
- Wong, M. M., et al. Over-expression of HSP47 augments mouse embryonic stem cell smooth muscle differentiation and chemotaxis. PLoS One. 9 (1), e86118(2014).
- Park, S. W., et al. Efficient differentiation of human pluripotent stem cells into functional CD34+ progenitor cells by combined modulation of the MEK/ERK and BMP4 signaling pathways. Blood. 116, 5762-5772 (2010).
- Samuel, R., et al. Generation of functionally competent and durable engineered blood vessels from human induced pluripotent stem cells. Proc Natl Acad Sci USA. 110, 12774-12779 (2013).
- Margariti, A., et al. Reprogramming of fibroblasts into endothelial cells capacble of angiogenesis and reendothelialization in tissue-engineered vessels. Proc Natl Acad Sci USA. 109, 13793-13798 (2012).
- Karamariti, E., et al. Smooth muscle cells differentiated from reprogrammed embryonic lung fibroblasts through DKK3 signaling are potent for tissue engineering of vascular grafts. Circ Res. 112, 1433-1443 (2013).
- Udelsman, B., et al. Development of an operator-independent method for seeding tissue-engineered vascular grafts. Tissue Eng Part C Methods. 17 (7), 731-736 (2011).
- Cearbhaill, E. D., Murphy, M., Barry, F., McHugh, P. E., Barron, V. Behavior of human mesenchymal stem cells in fibrin-based vascular tissue engineering constructs. Ann Biomed Eng. 38 (3), 649-657 (2010).
- Wong, M. M., et al. Macrophages control vascular stem/progenitor cell plasticity through tumor necrosis factor-α-mediated nuclear factor-κB activation. Arterioscler Thromb Vasc Biol. 34 (3), 635-643 (2014).
- Wong, M. M., et al. Sirolimus stimulates vascular stem/progenitor cell migration and differentiation into smooth muscle cells via epidermal growth factor receptor/extracellular signal-regulated kinase/β-catenin signaling pathway. Arterioscler Thromb Vasc Biol. 33 (10), 2397-2406 (2013).
- Lee, J., Cuddihy, M. J., Kotov, N. A. Three-dimensional cell culture matrices: State of the art. Tissue Eng Part B Rev. 14, 61-86 (2008).
- Hung, H. S., Hsu, S. H. Current Advances of stem cell-based approaches to tissue-engineering vascular grafts. OA Tissue Engineering. 1 (1), 2(2013).
- Quint, C., et al. Decellularized tissue-engineered blood vessel as an arterial conduit. Proc Natl Acad Sci USA. 108 (22), 9214-9219 (2011).
- Zhang, X., Xu, Y., Thomas, V., Bellis, S. L., Vohra, Y. K. Engineering an antiplatelet adhesion layer on an electrospun scaffold using porcine endothelial progenitor cells. J Biomed Mater Res A. 97 (2), 145-151 (2011).
- Hibino, N., et al. Evaluation of the use of an induced puripotent stem cell sheet for the construction of tissue-engineered vascular grafts. J Thorac Cardiovasc Surg. 143 (3), 696-703 (2012).
- Zhao, J., et al. A novel strategy to engineer small-diameter vascular grafts from marrow-derived mesenchymal stem cells. Artif Organs. 36 (1), 93-101 (2012).
- Tsai, T., et al. Contribution of stem cells to neointimal formation of decellularized vessel grafts in a novel mouse model. Am J Pathol. 181 (1), 362-373 (2012).
- Kasimir, M. T., et al. Comparison of different decellularization procedures of porcine heart valves. Int J Artif Organs. 26 (5), 421-427 (2003).
- Stephenson, E., et al. Derivation and propagation of human embryonic stem cell lines from frozen embryos in an animal product-free environment. Nature Protocols. 7, 1366-1381 (2012).
- Takahashi, K., Okita, K., Nakagawa, M., Yamanaka, S. Induction of pluripotent stem cells from fibroblast cultures. Nature Protocols. 2, 3081-3089 (2007).
- McCall, F. C., et al. Myocardial infarction and intramyocardial injection models in swine. Nature Protocols. 7, 1479-1496 (2012).
- Olausson, M., et al. Transplantation of an allogeneic vein bioengineered with autologous stem cells: a proof-of-concept study. Lancet. 380 (9838), 230-237 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados