Method Article
جيل ومسمار سفن الهندسة الأنسجة في نموذج الفأر
* These authors contributed equally
In This Article
Summary
هنا، نقدم بروتوكول لتوليد الأنسجة المهندسة ترقيع الأوعية التي هي وظيفية للتطعيم في الفئران عن طريق بذر المزدوج الناجم جزئيا الخلايا الجذعية المحفزة (PiPSC) - المشتقة خلايا العضلات الملساء وPiPSC - الخلايا البطانية مشتقة على decellularized سفينة سقالة مفاعل حيوي.
Abstract
The construction of vascular conduits is a fundamental strategy for surgical repair of damaged and injured vessels resulting from cardiovascular diseases. The current protocol presents an efficient and reproducible strategy in which functional tissue engineered vessel grafts can be generated using partially induced pluripotent stem cell (PiPSC) from human fibroblasts. We designed a decellularized vessel scaffold bioreactor, which closely mimics the matrix protein structure and blood flow that exists within a native vessel, for seeding of PiPSC-endothelial cells or smooth muscle cells prior to grafting into mice. This approach was demonstrated to be advantageous because immune-deficient mice engrafted with the PiPSC-derived grafts presented with markedly increased survival rate 3 weeks after surgery. This protocol represents a valuable tool for regenerative medicine, tissue engineering and potentially patient-specific cell-therapy in the near future.
Introduction
بناء قنوات الأوعية الدموية هي استراتيجية أساسية للإصلاح الجراحي للتلف وإصابة الأوعية الناتجة عن أمراض القلب والأوعية الدموية. حتى الآن، والمواد الكسب غير المشروع المستخدمة في الجراحة وتشمل حيويا البوليمرات الاصطناعية (تترافلوروإيثيلين [تفلون]، وسعت تترافلوروإيثيلين [EPTFE، غور تكس] أو البولي ايثلين [الداكرون])، المغايرة، الأنسجة ذاتي (التامور أو الوريد الصافن) وxenografts 1. في حين الطعوم الاصطناعية (على سبيل المثال، غور تكس والداكرون) هي الأكثر شيوعا، وهذه المواد المحتمل أن يسبب العديد من المضاعفات على المدى القصير والمدى الطويل التي تشمل تضيق، ترسب الكالسيوم وخثرات الانصمام والالتهابات. على الرغم من أن المرضى الذين يعانون من الطعوم البيولوجية الحالية مع تراجع أحداث خثرات صمية، فإنها لا تزال تواجه القيود مثل فشل الكسب غير المشروع الثانوي والمتانة تقصير بسبب تدهور تكلس 2. لذلك، على الرغم من التحسينات الكبيرة في تي الجراحيةلا تزال مثقلة echniques على مر السنين، والباحثين والأطباء مع ضرورة تحديد قناة مثالية لأمراض الأوعية الدموية. وفي الآونة الأخيرة، وقد ولدت مجال أبحاث هندسة الأنسجة الوعائية مفهوم التي تدرج بها الخلايا في السقالات القابلة للتحلل، وذلك بهدف خلق بيئة بيوميمتيك التي تجسد سفينة الوظيفية لنجاح تطعيم 1. في الأساس، فإن نجاح يبني الأوعية الدموية يعتمد على ثلاثة عناصر أساسية. الخلايا التي تتكون من سقالة، أي طبقة داخلية خلية البطانية وطبقة الخلايا العضلية الملساء، سقالة تحتوي على المصفوفة خارج الخلية المناسبة لتوفير الخصائص الميكانيكية مماثلة لالأوعية الدموية الأصلي، والإشارات الجزيئية / الخلوي ما هو مطلوب لبدء / تنظيم إصلاح.
طويلة المدى المباح الكسب غير المشروع والتنمية المستدامة للأنسجة الجدد تعتمد اعتمادا كبيرا على بذر خلية فعالة السقالات، عشرereby تقديم قرار نوع من الخلايا ذات أهمية حاسمة. وتظهر عدة تقارير استخدام البطانية ناضجة وخلايا العضلات الملساء من مصادر مختلفة لتطوير قنوات صغيرة قطرها 3-6. وعلى الرغم من واعدة، وعدم وجود السفن ذاتي كافية للحصول تبقى البطانية ناضجة وخلايا العضلات الملساء عبئا كبيرا. وفي الآونة الأخيرة، تم استغلال الخلايا الجذعية من مصادر مختلفة لتطبيقات هندسة الأنسجة الوعائية. خلايا وحيدات النوى في الواقع، ومجموعة متنوعة من أنواع الخلايا الجذعية بما في ذلك الخلايا الجذعية الجنينية 7، الناجم عن الخلايا الجذعية المحفزة (iPSCs) 8،9، PiPSC 10،11، والمستمدة نخاع العظم 12، الخلايا الجذعية الوسيطة 13، الخلايا الاصلية البطانية وجدار الوعاء الدموي الكبار -derived الخلايا الجذعية مستضد 1 (SCA-1) + الخلايا الجذعية / السلف كلها قد أثبتت 14،15 لتكون قادرة على التمايز إلى خلايا إما البطانية وظيفية أو العضلات الملساء ردا على وسائل الاعلام محددة وشروط الثقافة. وعلاوة على ذلك، فإن القدرة تجديد الذات غير محدودة من الخلايا الجذعية جعلها المرشحين الأفضل على عكس البطانية ناضجة وخلايا العضلات الملساء التي يمكن أن يقسم إلا لعدد محدود من المرات قبل ان يخضع لاعتقال النمو والشيخوخة.
اختيار المواد سقالة لتوليد الأنسجة ناجحة سفينة هندسيا للتطعيم يعتمد على عدة عوامل مثل توافق مع الحياة، خصائص النشاط الحيوي، ومعدل التحلل البيولوجي. في الأساس، والمواد المستخدمة في إنشاء السقالات لترقيع يجب أن تكون قابلة للتحلل ولن جبل المتلقي لزوم لها الاستجابات المناعية. بالإضافة إلى ذلك، يجب أن تشمل المسامية مناسبة والمجهرية لمرفق الخلية والبقاء على قيد الحياة لاحق. حتى الآن، والمواد الأكثر شيوعا لالسقالات في هندسة الأنسجة الوعائية وتشمل البوليمرات من حمض polyglycolic، عديد حمض اللبنيك، وبولي ε-caprolactone 16. وفي الآونة الأخيرة، المواد البيولوجية decellularized لهاكما تم تطبيقه مع بعض النجاح. وقد أظهرت العديد من المختبرات التي البذر السفن الخنازير البشرية decellularized، والكلاب أو مع خلايا ذاتي قدمت الكسب غير المشروع البيولوجي التي قاومت تخثر وباطنة تضخم 17-19. وتشمل الاستراتيجيات الأخرى في هندسة الأنسجة الوعائية خارج الخلية ترقيع الأوعية الدموية القائمة على البروتينات المصفوفة على سبيل المثال، بذر الخلايا في الليفين هلام 13 وأوراق خلية توليد دون دعم سقالة 20 و 21.
يوضح البروتوكول الحالي تمايز PiPSC الإنسان في البطانية الوظيفية وخلايا العضلات الملساء، وتوليد مفاعل حيوي يتكون من سقالة سفينة decellularized لإيواء خلايا الأوعية الدموية PiPSC المشتقة وظيفية، وترقيع الأوعية الأنسجة المهندسة إلى نقص المناعة الشديد مجتمعة (SCID ) الفئران. PiPSC تشكل نوع من الخلايا الأمثل لاستخدامها لهندسة الأنسجة الطعوم السفينة لأن هذه الخلايا لا تشكل الأورام في الفئران أو رفع الأخلاقي وردود ألو-المناعية. وعلاوة على ذلك، لقد أظهرنا أن استراتيجية لتوليد بالنقاط، البطانية الخلايا ونقطة على نحو سلس خلايا العضلات هي فعالة وقابلة للتكرار 10،11. بعد ذلك، قمنا بتصميم سفينة decellularized لزرع البذور من خلايا الأوعية الدموية PiPSC المشتقة من لتقليد بشكل وثيق البروتينات المصفوفة موجود داخل سفينة الأم، وبالتالي تعزيز التطعيم وبقاء فعالية. وعلاوة على ذلك، فإن decellularization من السفن قبل PiPSC البذر يمنع وقوع الاستجابات الالتهابية التي شنت من قبل أنواع الخلايا المناعية مثل الضامة. الأهم من ذلك، هذا البروتوكول لا تمثل سوى منهجية لتوليد واعدة قنوات الأوعية الدموية للترجمة إلى البشر، ولكنها توفر أيضا وسيلة قيمة لدراسة وفهم الآليات الجزيئية التي تتحكم في تجديد الأنسجة الوعائية من خلال نماذج الماوس.
Protocol
أداء جميع التجارب على الحيوانات وفقا لبروتوكولات وافقت عليها اللجنة المؤسسية لاستخدام ورعاية الحيوانات المختبرية.
1. إعداد الثقافة وسائل الإعلام
- جعل وسائل الإعلام ثقافة لخط الخلية الليفية البشري CCL-153: F-12K متوسطة، و 10٪ مصل بقري جنيني (FBS) و 100 U / البنسلين مل والستربتومايسين.
- جعل إعادة برمجة وسائل الإعلام لتوليد PiPSC: النسر خروج المغلوب Dulbecco لتعديل متوسطة (DMEM) تحتوي على 20٪ استبدال خروج المغلوب المصل، 0.1 ملم β المركابتويثانول، 0.1 ملي الدنيا الأساسية المتوسطة (MEM) الأحماض الأمينية غير الأساسية، و 10 نانوغرام / عامل نمو الخلايا الليفية الأساسية مل 2 (bFGF-2) و 100 U / البنسلين مل والستربتومايسين. إضافة bFGF-2 حديثا في كل مرة قبل استخدام وسائل الإعلام.
- جعل التمايز وسائل الإعلام (DM) للحث على خلية العضلات الملساء (SMC) التمايز: α-MEM وسائل الإعلام التي تحتوي على 10٪ FBS عامل نمو، 0.1 ملم β المركابتويثانول، و 100 U / مل البنسلين والستربتومايسين و 25 نانوغرام / مل صفائح الدم المشتقة(PDGF-ββ).
- جعل غشائي التمايز وسائل الإعلام (EC-DM) للحث الخلايا البطانية (EC) التمايز: نمو بطانة الإعلام-2 (EGM-2) وسائل الإعلام التي تحتوي على 50 نانوغرام / مل الأوعية الدموية غشائي عامل النمو (VEGF)، و 100 U / البنسلين مل والستربتومايسين.
2. إعادة برمجة الخلايا الليفية الإنسان إلى الناجمة جزئيا الخلايا الجذعية المحفزة (PiPSC)
- ثقافة خط الخلية الليفية البشري CCL-153 على 0.04٪ من محلول الجيلاتين قوارير المغلفة في مستنبت.
- خلايا مرور كل 3 أيام في نسبة 1: 6. استخدام الخلايا قبل مرور 9 لالكفاءة المثلى من الجيل PiPSC. الخلايا جاهزة للترنسفكأيشن عند بلوغه 80-90٪ confluency.
- خطي متعدد المقارين pCAG2LMKOSimO البلازميد التي تحتوي على 4 عوامل إعادة برمجة-octamer ملزمة النسخ عامل 4 (OCT4)، SOX2، عامل Kruppel شبيهة 4 (KLF4) وC-MYC (pCAG-OSKM). هضم 5 ميكروغرام البلازميد مع 5 وحدات من PvuI انزيم التقييد لمدة 3 ساعة على 37 درجة مئوية. طهرالبلازميد مع مجموعة تجارية وفقا لبروتوكول الشركة الصانعة.
- بالنقل 2 × 10 6 الخلايا الليفية الإنسان مع 4 ميكروغرام من خطي pCAG-OSKM البلازميد التي كتبها Electroporation للمع مجموعة الخلايا الليفية الجلدية الإنسان (NHDF) nucleofection وفقا لبروتوكول الشركة الصانعة. بلطف البذور الخلايا المصابة بالعدوى بالنقل على ما قبل 0.04٪ الجيلاتين المغلفة T25 قارورة تحتوي على 5 مل من قبل تحسنت إعادة برمجة وسائل الإعلام.
- بعد 24 ساعة، وتغيير المتوسطة مع المكملات الغذائية من 25 ميكروغرام / مل النيوميسين لتحديد السكان نقية من الخلايا المصابة بالعدوى بالنقل.
- تغيير المتوسطة كل يوم حتى يوم 4.
ملاحظة: الخلايا الليفية الإنسان أن تصبح PiPSC بعد 4 أيام من إعادة برمجة.
3. تمايز PiPSC إلى غشائي وخلايا العضلات الملساء
- PiPSC البذور على أطباق المغلفة قبل الكولاجين IV تحتوي DM لمدة 4 أيام للحث على التمايز إلى SMCS. تغيير المتوسطة كل يوم حتى يوم 4.
- PiPSC البذور على الكولاجين IV-المغلفة قبل أطباق جontaining البطانية-DM لمدة 6 أيام للحث على التمايز في الخلايا البطانية. تغيير المتوسطة كل يوم حتى يوم 6.
4. Decellularized الأبهر الكسب غير المشروع التحضير
ملاحظة: ينبغي لجميع الحلول والمعدات يكون معقم.
- التضحية الماوس عن طريق خلع عنق الرحم وإصلاح الماوس في موقف ضعيف تحت المجهر تشريح.
- قطع طريق القص وحول القفص الصدري لفتح التجويف الصدري. إزالة القلب والرئتين والمريء لفضح الشريان الأورطي. بلطف إزالة الدهون شبه الشريان الأورطي بالملقط.
- قطع الشريان الأورطي من نهاية الأمامي مع مقص وعقد بلطف نهاية بالملقط حادة. فصل الشريان الأورطي من العمود الفقري وراء من قبل تشريح حادة. إغلاق بعناية جميع الشرايين المتفرعة من الشريان الأورطي عن طريق ربط مع electrocoagulator القطبين وقطع من النهاية البعيدة للربط مع مقص.
- استخدام حقنة 5 مل لطرد لمعة الشريان الأورطي مع 3 ملتر من محلول ملحي يحتوي على 100 U الهيبارين لمنع تشكيل جلطات الدم.
- قطع نهاية الخلفي من الشريان الأورطي قبل أن فروع في الكلى. الحفاظ على سلامة الشريان الأورطي من المهم جدا خلال الإجراء بأكمله.
- مسح التجويف الشريان الأورطي مع 5 مل من 0.075٪ دوديسيل كبريتات الصوديوم (SDS) محلول مخفف في الفوسفات مخزنة المالحة (PBS).
- نقع الأبهر الصدري في 0.075٪ SDS الحل في 10 سم طبق بتري. وضع طبق بتري على شاكر المداري لمدة 2 ساعة على 150 دورة في الدقيقة في RT.
- مسح التجويف الشريان الأورطي مع 5 مل من برنامج تلفزيوني.
- نقع الشريان الأورطي في برنامج تلفزيوني في 10 سم طبق بتري. وضع طبق بتري على شاكر المداري لمدة 2 ساعة على 150 دورة في الدقيقة في RT. تحديث PBS كل 20 دقيقة.
- مسح التجويف الشريان الأورطي مع 5 مل من برنامج تلفزيوني.
- الحفاظ decellularized الكسب غير المشروع الشريان الأورطي في برنامج تلفزيوني في 4 درجات مئوية لمدة تصل إلى واحد.
5. المزدوج البذر من PiPSC وتكييف مفاعل حيوي
ملاحظة: جميع حليجب أن تكون الصورة والمعدات المعقمة. أداء جميع العمليات في نسيج الثقافة هود.
- تجميع الدوائر تدفق مفاعل حيوي كما هو موضح في الشكل رقم 1. قم بتوصيل غرفة الحضانة، خزان سائل الإعلام، مضخة تحوي غرفة والامتثال الأنابيب. حجم الحد الأدنى من المتوسط اللازمة للتداول هو 40 مل.
- الشرط المسبق السفينة decellularized مع الثقافة المتوسطة عن طريق نقع الشريان الأورطي في DM المتوسطة في 10 سم طبق بتري. وضع طبق بتري على شاكر المداري لمدة 1 ساعة على 50 دورة في الدقيقة في RT.
- تضاف 1 سم طول أنابيب نايلون (OD 0.9 ملم، ID 0.75 مم) في كلا طرفي السفينة decellularized تحت المجهر. ربط السفينة وأنابيب مع 8-0 خيوط الحرير.
- تجميع الكسب غير المشروع الشريان الأورطي decellularized في غرفة الحضانة من خلال ربط أنابيب نايلون مع مدخل ومخرج الموانئ (1/32 "أنابيب) من جدار الغرفة. الحفاظ على غرفة الحضانة مع 5mls من المتوسط في كل مرة.
- يعرض للتريبسين PiPSC بإضافة قبل حرارةالتربسين لتغطية الطبق الثقافة وصخرة بلطف الطبق 10 مرات. تجاهل التربسين وترك الطبق في الحاضنة لمدة 2-3 دقيقة. إضافة قبل تحسنت مستنبت في طبق وتخلط المتوسطة مع الخلايا.
- عد عدد الخلايا باستخدام عدادة الكريات. الطرد المركزي اثنين aliquots من تعليق خلية تحتوي على 5 × 10 5 خلايا لكل لمدة 5 دقائق في 300 × ز. نضح طاف تماما.
- بعد الشفط طاف تماما، و resuspend 1 بيليه من نقطة الكريات الخلايا في 50 ميكرولتر من DM. حقن هذا تعليق خلية في التجويف سفينة decellularized.
- ثم، و resuspend الآخرين بيليه الخلية نقطة في 100 ميكرولتر من Matrigel. ماصة بعناية الخليط على الشريان الأورطي الكسب غير المشروع decellularized.
- الانتظار لمدة 10 - 15 دقيقة حتى يتحول الخليط إلى دولة مثل هلام وبشكل متساو يلتف حول السطح الخارجي السفينة. ملء غرفة الحضانة مع DM.
- وضع مفاعل حيوي كله وضع في 5٪ CO 2 حاضنة عند 37 درجة مئوية. تدوير يدويا الكسب غير المشروع decellularized 90 درجة حول المحور الطولي كل نصف ساعة في ساعة 2 الأولى.
- حافظ على ثقافة ثابتة لمدة 12 ساعة لتمكين التصاق الخلية.
- تقديم DM من خلال التجويف بواسطة مضخة تحوي للحث على نحو سلس تمايز الخلايا العضلية. بدء معدل التدفق الأولي في 5 مل / دقيقة وزيادة تدريجية إلى 20 مل / دقيقة أكثر من 24 ساعة.
- الحفاظ على معدل التدفق المتوسط المتداولة في 20 مل / دقيقة لمدة 24 ساعة.
- وقف تدفق المتوسط ونقل مفاعل حيوي يحدد من الحاضنة.
- إعادة البذور لمعة من الكسب غير المشروع مع PiPSC. يعرض للتريبسين، عد وأجهزة الطرد المركزي 1 × 10 6 PiPSC كما في الخطوات 5،5-5،6. resuspend الخلايا في 50 ميكرولتر من EGM-2 المتوسط تحتوي على 50 نانوغرام / مل VEGF. حقن الخليط خلية في التجويف من الكسب غير المشروع.
- تغيير المتوسطة في غرفة الحضانة والدورة الدموية كله لEGM-2 المتوسط تحتوي على 50 نانوغرام / مل VEGF للحث على تمايز البطانية.
- نقل مفاعل حيوي وضع العودة إلى thالبريد الحاضنة. تدوير يدويا الكسب غير المشروع 90 درجة كل 30 دقيقة في ساعة 2 الأولى ومن ثم الحفاظ على ثقافة ثابتة لمدة 12 ساعة.
- بدء تعميم تدفق من 5 مل / دقيقة وزيادة تدريجية إلى 35 مل / دقيقة. الحفاظ على معدل التدفق في 35 مل / دقيقة لمدة 5 أيام. تغيير تعميم وغرفة متوسطة كل يوم.
- حصاد الكسب غير المشروع هندسيا لمزيد من التطعيم إلى الماوس.
6. مسمار مزدوج المصنف PiPSC الكسب غير المشروع في الفئران
- استخدام NOD.CB17-Prkdc SCID / NcrCrl ذكور الفئران كمتلقين سفينة الكسب غير المشروع. تأكد دائما أن الفئران هي حوالي 10 أسابيع من العمر، تزن حوالي 25 - 35 جم، وتكون في حالة صحية جيدة.
- تخدير الماوس المتلقي عن طريق إعطاء مزيج من Hypnorm (25 ملغ / كلغ) وHypnovel (25 ملغ / كلغ) البريتونى. تطبيق الفازلين مرهم للعين على العيون لمنع جفاف بينما تحت التخدير. تأكيد التخدير كفاءة من خلال ضمان أن الفئران لها استرخاء العضلات والتنفس بشكل مطرد.
- إصلاح الماوس في موقف ضعيف مع عنقه حلق ومددت. إدارة سلفات الأتروبين (1.7 ملغ / كلغ) في تركيبة مع أدوية التخدير للتأكد من أن الجهاز التنفسي الماوس لا يزال واضحا.
- إعداد شق خط الوسط من الفك السفلي لعظمة القص من الفأرة. تحت المجهر تشريح مع 5- إلى 10 أضعاف التضخيم، ورفع الغدد اللعابية اليمنى أفقيا وإزالة العضلات ترقوي خشائي الصحيحة لفضح الصحيح الشريان السباتي المشترك.
- بلطف إزالة الأنسجة المرفقة لتعبئة الصحيح الشريان السباتي المشترك من نهاية البعيدة نحو نهاية القريبة. Ligate الجزء الأوسط من الشريان السباتي المشترك مرتين مع خياطة الحرير 8-0 وتشريح بين علاقات البلدين.
- تمر عبر صفعة مصنوعة من autoclavable أنبوب النايلون في نهاية كل سفينة وإصلاح كل طرف مع المشابك microhemostat.
- إزالة خياطة ربطة عنق واحدة على نهاية وتطبيق قطرة من الهيبارين (100 U / مل). بعدها مباشرة، عكس النهاية البعيدة من الالشريان الإلكترونية لتغطي الجسم كله صفعة وإصلاح السفينة المقلوبة مع خياطة 8-0 الحرير لالكفة.
- كرر نفس الإجراء إلى الجزء الآخر من الشريان. الشريان مطاردة مع محلول ملحي لإزالة جلطات الدم.
- زرع الكسب غير المشروع سفينة decellularized بين طرفي من الشريان السباتي عن طريق تحريك نهايات سفينة decellularized من خلال الأصفاد الشريان وتحديد ذلك مع 8-0 خيوط الحرير. إزالة المشابك الأوعية الدموية من أي تنتهي قبل تقييم نبض من الكسب غير المشروع.
- ضع الغدة اللعابية الحق في العودة إلى موقعها الأصلي. إغلاق الجلد على موقع الجراحية مع خياطة متقطعة باستخدام خياطة 6-0 polyglactin.
- مراقبة العلامات الحيوية باستمرار من الماوس بعد الانتهاء من إجراءات، حتى يستأنف الوعي. التضحية الفئران المتلقي عن طريق عنق الرحم التفكك والأوعية الحصاد الطعوم إما 24 ساعة أو 3 أسابيع في وقت لاحق لمزيد من التحليل.
النتائج
وأكد الجيل الناجح لPiPSC 4 أيام بعد nucleofecting الخلايا الليفية الإنسان مع البلازميد pCAG2LMKOSimO خطي تحمل 4 عوامل النسخ، OCT4، SOX2، KLF4 وج-MYC (OSKM). PiPSC عرض النمط الظاهري واضح بشكل ملحوظ بالمقارنة مع الخلايا الليفية (الشكل 2A)، وأعرب عن عوامل إعادة برمجة 4 في مرنا (الشكل 2B) والبروتين (الشكل 2C) مستويات 10. فعالية الكسب غير المشروع الأوعية الدموية مقرها PiPSC-تعتمد بشكل كبير على قدرة PiPSC على التمايز إلى كل من الأنساب العضلات البطانية وعلى نحو سلس. لذلك من المهم لتأكيد هذه الخصائص من PiPSC في المختبر عن طريق التفريق الخلايا في وسائل الإعلام تعريف قبل الاستفادة منها لتوليد ترقيع الأوعية الشكل 3 يبين قدرة PiPSC على التمايز إلى خلايا بطانة الأوعية الدموية وظيفية في كل من الجين (الشكل 3A) والبروتين ( الشكل 3B-D) ليفإلس، استنادا إلى علامات البطانية محددة 10. وبالمثل، PiPSC هي أيضا قادرة على التمايز إلى نسب العضلات الملساء ردا على وسائل الاعلام محددة (الشكل 3E-H) 11.
وقد تحقق كله الشريان الأورطي decellularization عن طريق العلاج مع SDS، والمنظفات أنيوني أن lyses الخلايا وsolubilizes مكونات حشوية. بعد 2 ساعة من العلاج، وبدا الشريان الأورطي decellularized كما سقالة ديكي شفافة بالمقارنة مع الشريان الأورطي المقطوع حديثا (الشكل 4A-B) 22. ويوضح التقييم النسيجي في الشكل 4C-F غياب نوى أو تلطيخ حشوية في الأوعية decellularized، ولكن ليس في الشريان الأورطي الفأر العادي. بعد غرس البذور مزدوج من البطانية PiPSC المشتقة وخلايا العضلات الملساء داخل aortas decellularized، عرض الطعوم الأوعية الدموية المهندسة خصائص الخلايا العضلية البطانية وسلس على التوالي. الهيماتوكسيلين ويوزين (HE) تلطيخ للق مزدوجكشفت الطعوم eeded بنية مماثلة لتلك السفن الأم (الشكل 4G) مع طبقات متعددة من خلايا العضلات الملساء وأحادي الطبقة من الخلايا البطانية كما أكد تلطيخ إيجابي لسلسة العضلات 22α (SM22)، على نحو سلس العضلات α الأكتين (SMA) ، CD31 وعلامات CD144 على التوالي (الشكل 4H-M) 11.
لتأكيد المباح من نسيج الأوعية هندسيا في الجسم الحي، والمطعمة على المصنفة السفن مزدوجة PiPSC المشتقة في الفئران - استخدمت كل من الفأر العادي والشرايين decellularized والضوابط. وأظهر تحليل لاحق أنه في حين أن الفئران المطعمة مع السفن decellularized قدمت مع ارتفاع معدلات الوفيات بشكل ملحوظ في وقت مبكر من يوم 1، تمنح PiPSC ترقيع الأوعية معدل البقاء على قيد الحياة من 60٪ بعد 3 أسابيع زرع (الشكل 5A) 11. بالإضافة إلى ذلك، تم الأسبوع 3 الطعوم PiPSC المستمدة من العمر تتميز بشكل كامل لوجود الإنسان البطانية PiPSC المستمدة من و خلايا العضلات الملساء والتسلل بلعم المضيف (الشكل 5B والجدول 1) 11. أخذت معا، وتشير النتائج إلى أن PiPSC لديها القدرة على التمايز إلى كل من الأنساب الأوعية الدموية وتكون قوية لتوليد الأوعية الأنسجة المهندسة الوظيفية التي يمكن أن تكون بديلا السفن الأم في الجسم الحي.
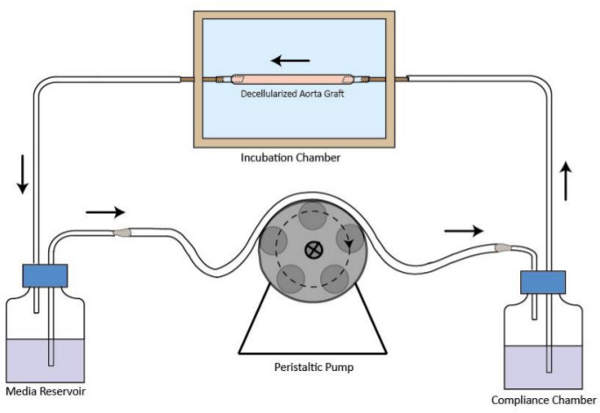
الشكل 1. تمثيل تخطيطي للdecellularized دائرة الكسب غير المشروع تدفق مفاعل حيوي. يتم تجميعها والكسب غير المشروع سفينة decellularized في غرفة الحضانة. مضخة تحوي هي في المنبع من غرفة الحضانة لتوفير مستقر تدفق نضح المتوسط. خزان سائل الإعلام في المصب من غرفة الحضانة. غرفة الامتثال هو تحسين نظام التدفق. يشار الاتجاه تدفق من السهام.large.jpg "الهدف =" _ فارغة "> الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.

الشكل 2. جيل من PiPSC من الخلايا الليفية الإنسان. وقد nucleofected الخلايا الليفية الإنسان مع أي أربع جينات إعادة برمجة (OCT4، SOX2، KLF4 وC-MYC) أو ناقلات الفارغة (السيطرة). (A) المرحلة الصور المقابل تظهر مورفولوجية نقطة بعد 4 أيام. وأعرب PiPSC كل عوامل النسخ الأربع، سواء في مرنا (B) وبروتين (C) المستويات. شريط مقياس للصور المعروضة هي 50 ميكرون والبيانات هي وسائل ± SEM (ن = 3)؛ * P <0.05، *** P <0.001. تم تعديل هذا الرقم من Margariti، A. وآخرون 10 الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم <./ أ>
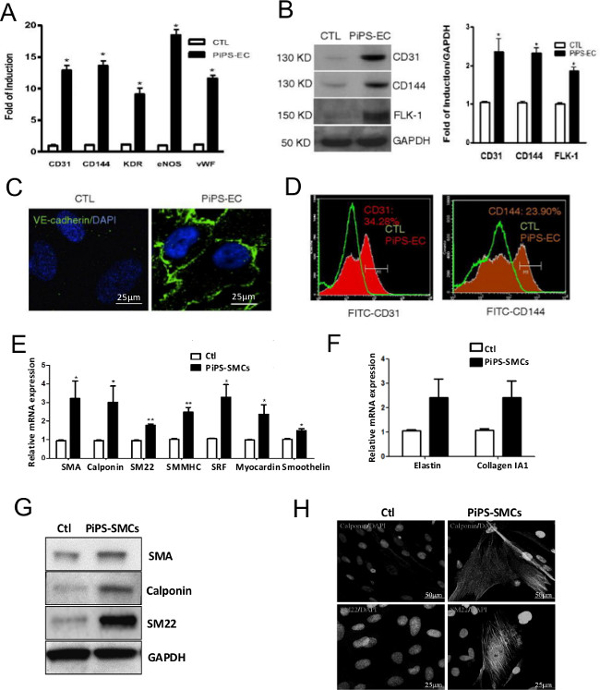
الشكل 3. PiPSC يمكن أن تفرق في كل من خلايا العضلات البطانية وعلى نحو سلس. وتختلف الخلايا PiPSC أو السيطرة على الخلايا البطانية. (A) وبالمقارنة مع السيطرة على الخلايا، PiPSC المشتقة من الخلايا البطانية أعرب علامات البطانية محددة مثل CD31، CD144، مستقبلات كيناز إدراج النطاق (KDR)، البطانية سينسيز أكسيد النيتريك (أنوش) وفون ويلبراند عامل (VWF) في مرنا المستوى. (B) وأكد ذلك في مستوى البروتين باستخدام تحليل لطخة الغربي. (C) المناعي تلطيخ أشار تلطيخ الإيجابي للCD144 (VE كادهيرين) في PiPSC-البطانية، ولكن ليس السيطرة على الخلايا. (D) تحليل تدفق cytometric أكد التعبير خلية PiPSC-البطانية من CD31 و CD144. تم التفريق PiPSC (أو السيطرة خلايا) الكولاجين IV-المصنفة أيضا فيخلايا العضلات الملساء. (E، F) خلافا للسيطرة على الخلايا، أعربت خلايا العضلات الملساء PiPSC المستمدة من علامات العضلات الملساء محددة على مستوى الجينات، بما في ذلك SMA، calponin، SM22، الميوسين العضلات الملساء السلسلة الثقيلة II (SMMHC)، عامل استجابة المصل (SRF) ، myocardin، smoothelin، الإيلاستين والكولاجين 1A1. (G) وأكد مستويات التعبير عن SMA، calponin وSM22 في الخلايا PiPSC المشتقة باستخدام تحليل لطخة الغربي. (H) المناعي تلطيخ باستخدام المجهر مبائر أظهر نموذجي سلس تلطيخ علامة العضلات لcalponin وSM22. تمثل البيانات يعني ± SEM (ن = 3)؛ * P <0.05، ** P <0.01، *** P <0.001. شريط مقياس للصور المعروضة هي 25 ميكرون أو 50 ميكرون. تم تعديل هذه الأرقام من Margariti، A. وآخرون. (10) وKaramariti، E. وآخرون 11 الرجاءانقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
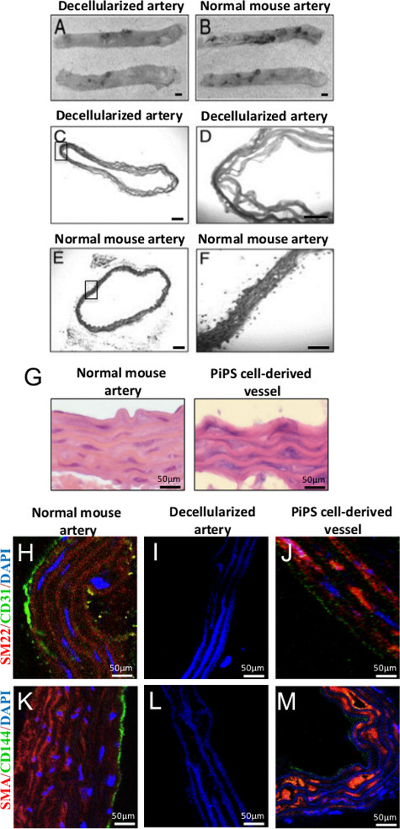
الشكل 4. توليد نقرا مزدوجا المصنفة الأنسجة PiPSC المستمدة الهندسة ترقيع الأوعية الدموية. (A، B) Decellularization من الماوس الأبهر الصدري الحفاظ على هيكلها ومازال يشبه أن سفينة العادية، التكبير الأصلي 2X. (CF) سعادة تلطيخ من الشريان الأورطي decellularized أكد decellularization ناجحة والإزالة الكاملة للخلايا بالمقارنة مع الضوابط، التكبير الأصلي: 50X أو 200X. (G) سعادة تلطيخ البطانية PiPSC المشتقة وخلايا العضلات الملساء كشفت السفن نقرا مزدوجا المصنفة في العمارة التي كانت مشابهة لسفينة الأم. (J، M) PiPSC الأنسجة المهندسة السفن مزدوجة المصنف ملطخة إيجابية لالبطانية (CD31 وCD144) وخلايا العضلات الملساء (SM22 وSMA) علامات على عكس deceترقيع الأوعية llularized. (H، K) والتعبير يصاحب ذلك من علامات الأوعية الدموية وكذلك مورفولوجيا مميزة وتوطين البطانية PiPSC المشتقة وخلايا العضلات الملساء داخل المناطق الإنسي وباطنة كانت مماثلة لسفن الأم. شريط مقياس للصور المعروضة هي 50 ميكرون. تم تعديل هذه الأرقام من تساي، T. وآخرون. 22 وKaramariti، E. وآخرون 11 الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
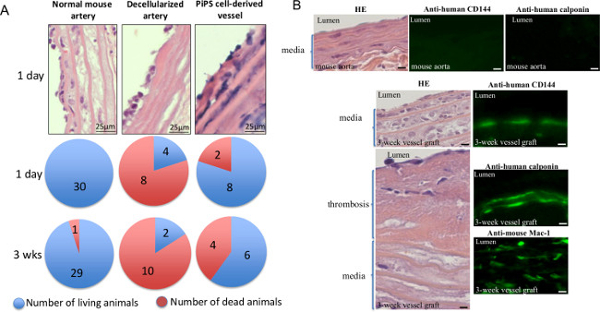
الشكل 5. انقر نقرا مزدوجا المصنفة PiPSC المشتقة من الأنسجة المهندسة ترقيع الأوعية الدموية هي براءة اختراع لاستبدال السفن الأم في الجسم الحي. والمطعمة السفن PiPSC المشتقة في الشريان السباتي من نقص المناعة المشترك الشديد (SCID) الفئران، ومذكرة التفاهم العاديواستخدمت حد ذاته والشرايين decellularized والضوابط. (A) تحليل الفئران المطعمة مع السفن PiPSC المستمدة من أظهر 60٪ معدل البقاء على قيد الحياة بعد الجراحة 3 أسابيع، في حين أن الفئران المطعمة مع السفن decellularized قدمت مع ارتفاع معدلات الوفيات بشكل ملحوظ والبقاء على قيد الحياة أقل (20٪). تمثل البيانات سائل (ن = 10). (ب) كانت تحصد السفن الأنسجة المهندسة أيضا 3 أسابيع بعد التطعيم وتعرض للسعادة (لوحات اليسار) أو تلطيخ المناعي (لوحات اليمين) لوجود CD144 البشري وcalponin أو الماوس CD11b / CD18 (ماك-1)؛ وتتلخص الكمي لتلطيخ في الجدول 1. التكبير الأصلي للصور المعروضة هي 400X ما لم يذكر. تم تعديل هذا الرقم من Karamariti، E. وآخرون 11 الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
| خلايا إيجابية الميدانية (40X) | هندستها السفينة قبل التطعيم | المهندسة والأوعية الدموية الكسب غير المشروع (3 أسابيع) |
| calponin | 72 ± 9 | 22 ± 11 * |
| CD144 | 20 ± 8 | 5 ± 6 * |
| ماك-1 | 0 | 71 ± 11 * |
الجدول 1. توصيف السفن الأنسجة المهندسة بعد 3 أسابيع التطعيم. وكان كميا عدد البطانية PiPSC المشتقة والعضلات الملساء الخلايا والضامة المضيف التالية المناعي تلطيخ مع calponin الإنسان، CD144 الإنسان والفأر ماك-1 على التوالي. تمثل البيانات يعني ± SEM (ن = 6)؛ * P <0.05، فرق كبير من السفن الأنسجة المهندسة قبل التطعيم. تم تعديل هذا الجدول من Karamariti، E. وآخرون 11
Discussion
ويشير البروتوكول الحالي لوسريعة استراتيجية سليمة وبسيطة وفعالة وقابلة للتكرار الذي يمكن توليد الأنسجة المهندسة السفن الوظيفية باستخدام PiPSC من الخلايا الليفية الإنسان. هذه التقنية تمثل أداة قيمة للطب التجديدي، هندسة الأنسجة والعلاج بالخلايا يحتمل المريض محددة في المستقبل القريب. وتشمل الخطوات الحاسمة لضمان فعالية بروتوكول إعداد PiPSC، وإعداد ترقيع الشريان الأبهر معقمة وdecellularized بالكامل، بذر ناجحة والتفريق بين PiPSC في السقالات والحفاظ على عقم ترقيع الشريان الأبهر في مفاعل حيوي الأوعية الدموية.
لبدء الجيل الناجح لترقيع الأنسجة المهندسة، فإنه من الأهمية بمكان لضمان أن إعداد PiPSC ونفذت على نحو فعال. بروتوكول تمت بنجاح "برمجة" خط الخلية الليفية البشري إلى PiPSC عبر nucleofection مع البلازميد pCAG2LMKOSimO OSKM. وsurvivآل الخلايا الليفية بعد nucleofection تعتمد على عدة نقاط رئيسية مثل استخدام البلازميدات OSKM جودة عالية، البلازميدات تركيزات تتراوح بين 500 - 1،000 نانوغرام / ميكرولتر، وتجنب التأخير في البذر من الخلايا الليفية مباشرة بعد nucleofection باسم خلايا حساسة بشكل خاص بعد إدخال البلازميدات كبيرة نسبيا، وأخيرا إضافة FGF-2 وهو أمر حاسم وينبغي أن يضاف إلى وسائل الإعلام الطازجة فقط قبل الاستخدام. بالإضافة إلى ذلك، وجدنا أنه من الضروري استخدام الخلايا لمدة تصل إلى مرور 9 لتجنب الشيخوخة تنسخي، لضمان كفاءة "إعادة برمجة" في PiPSC والتمايز لاحقا إلى خلايا البطانية والعضلات الملساء. نقاء PiPSC يمكن تحسين اختيار الخلايا nucleofected مع النيوميسين. البلازميد pCAG2LMKOSimO لديه الجين المقاوم بالنيوميسين وبالتالي إضافة النيوميسين في مجموعة من 25 ميكروغرام / مل بعد يوم واحد nucleofection لمدة 3 أيام سيؤدي في اختيار من السكان نقية منPiPSC. مهندس سفينة PiPSC فعالة للتطعيم في الفئران، رأيناها على سلامة والعقم من aortas decellularized أن تكون ذات أولوية قصوى. للحفاظ على سلامة aortas قبل وبعد decellularization، كان من الضروري أن تطبق باستمرار البراعة اليدوية في حين التعامل مع السفن، كما كانت هشة نسبيا وضآلة كبيرا من حيث الحجم. وكانت إزالة فعالة من الأنسجة المحيطة بالأوعية وختم المتفرعة الشرايين باستخدام ثنائي القطب الكهربائي مخثار حاسمة لضمان احق البذر الخلية المختصة وتجنب تسرب سائل الإعلام. في أي لحظة، ونحن ضمان أن جميع المواد والأجهزة المستخدمة لتوليد مفاعل حيوي كانت (أي ملقط، وأنابيب وقوارير والغرف، ومقص، ومحولات والموصلات) autoclavable، وبالتالي تقليل مخاطر التلوث الجرثومي والفشل الطعوم الوعائية قبل الجراحة .
في حين أن البروتوكول الحالي يحمل التطبيقات السريرية الواعدة في فردوس القلب والأوعية الدمويةASES، وهناك عدد قليل من القيود التي ينبغي تحسينها في المستقبل القريب لمواصلة تعزيز منهجية. حتى الآن، تم عرض عوامل النسخ OSKM في الخلايا الليفية الإنسان عبر nucleofection. في حين أن هذا الأسلوب هو بسيطة نسبيا ومباشرة، وأسفرت أيضا عن الكفاءة ترنسفكأيشن متغيرة في بعض الأحيان التجريبية المختلفة. والجدير بالذكر، يمكن التغلب على هذا التناقض من خلال إدخال خطوة إضافية من اختيار النيوميسين المذكورة آنفا. وبالمثل، يمكن للمرء أن ينظر مقدمة من العوامل الأربعة في الخلايا الليفية الإنسان باستخدام التكامل الفيروسة البطيئة، والتي قد يحتمل زيادة كفاءة "إعادة برمجة" وتعزيز بقاء الخلايا بعد الإصابة. من حيث مفاعل حيوي، وجدنا أن decellularization كاملة من aortas يمكن تحقيقه باستخدام 0.075٪ SDS. على الرغم من أن هذا الأسلوب كان يعتبر الأمثل لإزالة الخلايا بالمقارنة مع المنظفات الأخرى (على سبيل المثال، تريتون X-100)، فإنه قد يسبب ومع ذلك عالتعديلات otential داخل هياكل جدا من البروتينات المصفوفة خارج الخلية 23. ولهذه الظاهرة يستوجب استراتيجيات decellularization أكثر كفاءة للحد من اختلال المرتبطة البروتينات المصفوفة خارج الخلية. بالإضافة إلى ذلك، رأيناها أيضا أن قطر وجدار سمك aortas decellularized تختلف بين الفئران، اعتمادا على السن والسلالة والخلفية، وبالتالي يسبب اختلافات محتملة في سرعة تدفق وإجهاد القص داخل المفاعلات الحيوية وتوزيع PiPSC التالية PiPSC البذر . كل هذا لا يزال بحاجة إلى توضيح.
هذا البروتوكول وصفت هنا توليد الأنسجة المهندسة وظيفية ترقيع باستخدام PiPSC التي تحمل إمكانات واعدة لالتطبيقات السريرية في المستقبل في العلاج بالخلايا الجذعية لمرض القلب والأوعية الدموية. هذه العملية التي يستخدم برمجة مباشرة من النسب الجسدية واحد (الليفية) إلى آخر (إما خلايا العضلات الملساء أو البطانية) من خلال تخطي pluripotency قد يكون وسيلة للحصول على خلايا آمنة ومناسبة للاهتمام. في الواقع، وقد نشرت عدة بروتوكولات لوصف جيل من خطوط الخلايا الجذعية من الأجنة البشرية، وخلايا الجذع والخلايا الجذعية البالغة 24-26، والتي مع ذلك لا تزال تثير فيما يتعلق بقضايا فيما يتعلق باستخدامها في العيادة. ومن المعروف الآن أن PiPSC لا تتطور مسخي المبيض في الفئران SCID، وبالتالي القضاء على القلق من تشكيل الورم. وعلاوة على ذلك، فإن الخلايا تستغرق وقتا أقصر بكثير لتوليد والثقافة والتفريق 10،11، وقد أظهرت لتوليد الأنسجة المهندسة السفن ترقيع ناجحة وظيفية قابلة للمقارنة لaortas الأم. ولذلك، PiPSC الحاضر كمصدر خلية واعد لعلاج المرضى الذين يستخدمون العلاج بالخلايا شخصية لأن الخلايا الليفية (على سبيل المثال، من الجلد) يمكن أن تستمد من شخص معين. النظام سفينة decellularised في هذا البروتوكول يوفر نموذج أكثر بيوميمتيك التي توفر خلايا المصنف مع extracellulالبروتين مصفوفة AR الذي هو أكثر تمثيلا لتلك التي من الشريان الأورطي الأصلي 11. هذه النقاط الرئيسية هي حاسمة لضمان بقاء والتمايز وظائف الخلايا والأنسجة المهندسة المصنفة السفن بعد ذلك. أظهرت دراسة حديثة أجرتها Sumitran-Holgersson وزملاؤه إعادة تعمير الناجح لdecellularized سابقا الكسب غير المشروع illiac الوريد من شخص متوفى قبل engraftment 27، وبالتالي الافتراض قيمة متعدية من البروتوكول الحالي إلى البشر في المستقبل القريب. وعلاوة على ذلك، يجوز للترقيع الأوعية decellularized تمثل نموذجا جيدا التي يمكن تقييم دور والسلوك من أنواع الخلايا الوعائية الأخرى التي تسهم أيضا في ترقيع الأنسجة المهندسة. ويمكن لهذا النظام النموذجي في الفئران توفر أداة قوية لفحص المخدرات في المستقبل، وأيضا في توضيح الآليات الخلوية والجزيئية المشاركة في الأوعية الدموية بيولوجيا الخلايا الجذعية. أخذت معا، فإن البروتوكول الحالي يحمل قيمة واعدة لتطبيقه في VASCهندسة الأنسجة الجزيئية وطفرة في الطب شخصية.
Disclosures
الكتاب ليس لديهم مصالح مالية متضاربة.
Acknowledgements
This work was supported by The British Heart Foundation and The Oak Foundation.
Materials
| Name | Company | Catalog Number | Comments |
| Human Fibroblasts CCL-153 | ATCC | CCL-153 | Prenatal human embryonic fibroblasts |
| ATCC F-12K Medium (Kaighn's Modification of Ham's F-12 Medium) | ATCC | 30-2004 | |
| Fetal Bovine Serum | ATCC | 30-2020 | |
| Knockout DMEM medium optimized for embryonic stem cells | Life technologies (Gibco) | 12660-012 | |
| Knockout Serum Replacement | Life technologies (Invitrogen) | 10828-028 | |
| Human Basic FGF-2 | Miltenyi Biotech | 130-093-837 | |
| alpha-MEM medium | Life technologies (Invitrogen) | 32571093 | |
| Human PDGF | R&D System | 120-HD-001 | |
| Gelatin Solution 2% | Sigma | G1393 | |
| Plasmid 20866: pCAG2LMKOSimO (SOX2, OCT4, KLF4, C-MYC) | Addgene | 20866 | |
| PvuI Restriction Enzyme | New England Biolabs | RO150S | |
| SureClean Plus | Bioline | BIO-37047 | |
| Nucelofection Kit (NHDF Kit) | LONZA | VPD-1001 | |
| Neomycin | SIGMA | G418 | |
| KL 1500 LCD, Illumination for Stereo Microscopy | SCHOTT | KL 1500 LCD | Cold light illumination for stereo microscopy |
| Nikon Zoom Steromicroscope SMZ800 | Nikon | SMZ800 | |
| Heparin sodium salt | Sigma | H3393 | |
| 10% SDS Stock Solution Molecular Biology Reagent | Severn Biotech | CAS 151-21-3 | |
| Dulbecco's Phosphate Buffered Saline | Sigma | D8537 | |
| Matrigel (10mg/ml) | BD | A6661 | |
| Shaker IKA Vibrax with Shaking platform VX 7 | Jepson Bolton's, Janke&Kunkel | S32-102 | |
| Masterflex L/S Digital Pump Drive | Cole-Parmer | WZ-07523-80 | |
| Masterflex L/S 6-channel, 6-roller cartridge pump head | Cole-Parmer | EW-07519-15 | |
| Masterflex L/S large cartridges for pump head | Cole-Parmer | EW-07519-75 | |
| Masterflex platinum-cured silicone pump tubing, L/S 14, 25 ft | Cole-Parmer | WZ-96410-14 | Tubing goes through the peristaltic pump |
| 0.5mm ID, 0.8 mm OD Silicone Tubing | SILEX | N/A | Tubings connect incubation chamber, media reservoir and compliance chamber |
| Fitting Reducer 0.5 to 1.6, natural Polypropyline | Ibidi | 10829 | Adapter connect above two types of tubings |
| 1/32" Tubing, ID 0.01" (250µm) Material: PEEK | LabSmith | T-132-010P | Tubing through the incubation chamber wall which connects the graft with outside tubing |
| One-Piece Fittings | LabSmith | T-132-100 | Fix the above tubings through the incubation chamber wall |
| Nylon tubes (OD 0.9mm, ID 0.75mm) | Smiths Medical | N/A | Tubings insert into two ends of the aorta graft |
| NOD.CB17-Prkdcscid/NcrCrl mouse | Charles River | ||
| Surgical sutures, 8-0 silk | ETHICON | W819 | |
| Hypnorm | Vetapharm | Vm21757/4000 | Neuroleptanalgesic for use in mice |
| Hypnovel (Midazolam) | Roche | 59467-70-8 | Induction of anaesthesia |
| Dissecting microscope | Carl Zeiss | Stemi 2000 | |
| Nylon Tubing | Portex LTD | 800/200/100/200 | 0.65 mm in diameter and 1 mm in length; to make artery cuff |
| Electrocoagulator | Martin | SN 54.131 | Ligation of artery branches on aorta |
| Bipolar micro hemostat forceps | Martin | 80-91-12-04 | Fixation of vessel ends |
| Vessel Dilator | S&T | JFX-7 | |
| Vessel Dilator | S&T | JFL-3dZ | |
| Vessel Dilator | S&T | D-5aZ | |
| Mini applier | AESCULAP | FE572K | |
| Micro hemostats clips | AESCULAP | FE720K | |
| Surgical sutures, 6-0 VICRYL | ETHICON | V489 |
References
- Kurobe, H., Maxfield, M. W., Breuer, C. K., Shinoka, T. Concise Review: Tissue-Engineered Vascular Grafts for Cardiac Surgery: Past, Present, and Future. Stem Cells Transl Med. 1 (7), 566-571 (2012).
- Jonas, R. A., Freed, M. D., Mayer, J. E. Jr Long-term follow-up of patients with synthetic right heart conduits. Circulation. 72, II77-II83 (1985).
- Heureux, N., et al. Technology insight: the evolution of tissue-engineered vascular grafts-from research to clinical practice. Nat Clin Pract Cardiovasc Med. 4, 389-395 (2007).
- Zhang, W. J., Liu, W., Cui, L., Cao, Y. Tissue engineering of blood vessel. J Cell Mol Med. 11, 945-957 (2007).
- Cearbhaill, E. D., et al. Response of mesenchymal stem cells to the biomechanical environment of the endothelium on a flexible tubular silicone substrate. Biomaterials. 29, 1610-1619 (2008).
- Gong, Z., Niklason, L. E. Small-diameter human vessel wall engineered from bone marrow-derived mesenchymal stem cells (hMSCs). FASEB J. 22, 1635-1648 (2008).
- Wong, M. M., et al. Over-expression of HSP47 augments mouse embryonic stem cell smooth muscle differentiation and chemotaxis. PLoS One. 9 (1), e86118(2014).
- Park, S. W., et al. Efficient differentiation of human pluripotent stem cells into functional CD34+ progenitor cells by combined modulation of the MEK/ERK and BMP4 signaling pathways. Blood. 116, 5762-5772 (2010).
- Samuel, R., et al. Generation of functionally competent and durable engineered blood vessels from human induced pluripotent stem cells. Proc Natl Acad Sci USA. 110, 12774-12779 (2013).
- Margariti, A., et al. Reprogramming of fibroblasts into endothelial cells capacble of angiogenesis and reendothelialization in tissue-engineered vessels. Proc Natl Acad Sci USA. 109, 13793-13798 (2012).
- Karamariti, E., et al. Smooth muscle cells differentiated from reprogrammed embryonic lung fibroblasts through DKK3 signaling are potent for tissue engineering of vascular grafts. Circ Res. 112, 1433-1443 (2013).
- Udelsman, B., et al. Development of an operator-independent method for seeding tissue-engineered vascular grafts. Tissue Eng Part C Methods. 17 (7), 731-736 (2011).
- Cearbhaill, E. D., Murphy, M., Barry, F., McHugh, P. E., Barron, V. Behavior of human mesenchymal stem cells in fibrin-based vascular tissue engineering constructs. Ann Biomed Eng. 38 (3), 649-657 (2010).
- Wong, M. M., et al. Macrophages control vascular stem/progenitor cell plasticity through tumor necrosis factor-α-mediated nuclear factor-κB activation. Arterioscler Thromb Vasc Biol. 34 (3), 635-643 (2014).
- Wong, M. M., et al. Sirolimus stimulates vascular stem/progenitor cell migration and differentiation into smooth muscle cells via epidermal growth factor receptor/extracellular signal-regulated kinase/β-catenin signaling pathway. Arterioscler Thromb Vasc Biol. 33 (10), 2397-2406 (2013).
- Lee, J., Cuddihy, M. J., Kotov, N. A. Three-dimensional cell culture matrices: State of the art. Tissue Eng Part B Rev. 14, 61-86 (2008).
- Hung, H. S., Hsu, S. H. Current Advances of stem cell-based approaches to tissue-engineering vascular grafts. OA Tissue Engineering. 1 (1), 2(2013).
- Quint, C., et al. Decellularized tissue-engineered blood vessel as an arterial conduit. Proc Natl Acad Sci USA. 108 (22), 9214-9219 (2011).
- Zhang, X., Xu, Y., Thomas, V., Bellis, S. L., Vohra, Y. K. Engineering an antiplatelet adhesion layer on an electrospun scaffold using porcine endothelial progenitor cells. J Biomed Mater Res A. 97 (2), 145-151 (2011).
- Hibino, N., et al. Evaluation of the use of an induced puripotent stem cell sheet for the construction of tissue-engineered vascular grafts. J Thorac Cardiovasc Surg. 143 (3), 696-703 (2012).
- Zhao, J., et al. A novel strategy to engineer small-diameter vascular grafts from marrow-derived mesenchymal stem cells. Artif Organs. 36 (1), 93-101 (2012).
- Tsai, T., et al. Contribution of stem cells to neointimal formation of decellularized vessel grafts in a novel mouse model. Am J Pathol. 181 (1), 362-373 (2012).
- Kasimir, M. T., et al. Comparison of different decellularization procedures of porcine heart valves. Int J Artif Organs. 26 (5), 421-427 (2003).
- Stephenson, E., et al. Derivation and propagation of human embryonic stem cell lines from frozen embryos in an animal product-free environment. Nature Protocols. 7, 1366-1381 (2012).
- Takahashi, K., Okita, K., Nakagawa, M., Yamanaka, S. Induction of pluripotent stem cells from fibroblast cultures. Nature Protocols. 2, 3081-3089 (2007).
- McCall, F. C., et al. Myocardial infarction and intramyocardial injection models in swine. Nature Protocols. 7, 1479-1496 (2012).
- Olausson, M., et al. Transplantation of an allogeneic vein bioengineered with autologous stem cells: a proof-of-concept study. Lancet. 380 (9838), 230-237 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ISSN 2578-2614
Copyright © 2025 MyJoVE Corporation. All rights reserved
We use cookies to enhance your experience on our website.
By continuing to use our website or clicking “Continue”, you are agreeing to accept our cookies.
