Method Article
组织工程血管在小鼠模型的生成和嫁接
摘要
在这里,我们提出了一个协议,以产生组织工程血管移植物中有功能的移植入小鼠双播部分诱导多能干细胞(PiPSC) - 来源的平滑肌细胞和PiPSC - 在脱细胞血管支架的生物反应器来源的内皮细胞。
摘要
The construction of vascular conduits is a fundamental strategy for surgical repair of damaged and injured vessels resulting from cardiovascular diseases. The current protocol presents an efficient and reproducible strategy in which functional tissue engineered vessel grafts can be generated using partially induced pluripotent stem cell (PiPSC) from human fibroblasts. We designed a decellularized vessel scaffold bioreactor, which closely mimics the matrix protein structure and blood flow that exists within a native vessel, for seeding of PiPSC-endothelial cells or smooth muscle cells prior to grafting into mice. This approach was demonstrated to be advantageous because immune-deficient mice engrafted with the PiPSC-derived grafts presented with markedly increased survival rate 3 weeks after surgery. This protocol represents a valuable tool for regenerative medicine, tissue engineering and potentially patient-specific cell-therapy in the near future.
引言
血管管道的建设是由心血管疾病导致受损和损伤血管修复手术的基本策略。迄今为止,在外科手术中使用的接枝物质包括生物相容的合成聚合物(聚四氟乙烯[聚四氟乙烯],膨胀的聚四氟乙烯[膨体聚四氟乙烯;奥亚特克斯]或聚对苯二甲酸乙酯[涤纶]),同种异体移植物,自体组织(心包或隐静脉)和异种移植物1。虽然人工移植物( 例如,戈尔特斯和涤纶)是最常用的,这些材料可能会导致大量的短期和长期的并发症,包括狭窄,钙沉积,血栓栓塞和感染。尽管患者目前生物移植减少血栓栓塞事件,他们还是遇到限制,如二次移植失败,缩短耐久性由于钙化退化2。因此,尽管在手术吨显著改善被echniques多年来,研究人员和临床医生仍然背负着需要用于识别提供了理想的导管用于血管疾病。最近,血管组织工程的研究领域已产生了在其中细胞掺入可生物降解的支架,以创建缩影成功移植1的官能容器仿生环境的目的的概念。根本的是,血管构建体的成功取决于三个主要组分;细胞组成的支架, 即,内皮细胞内层和平滑肌细胞层,含有合适的细胞外基质,以提供相当的机械性能与天然血管的支架,并且所需要用于启动/调节分子/细胞信号修理。
长期移植通畅和新组织的持续发展在很大程度上取决于支架的有效细胞接种,日ereby渲染的至关重要的细胞类型决定。一些报告展示了利用成熟的内皮细胞,并从各种来源的平滑肌细胞的发育小口径管道3-6。尽管有希望,缺乏足够的自体血管,以获得成熟的内皮细胞和平滑肌细胞保持一个相当大的负担。最近,从各种来源的干细胞已被开发用于血管组织工程的应用程序。确实,多种干细胞类型,包括胚胎干细胞7,诱导多能干细胞(iPS细胞)8,9,PiPSC 10,11,骨髓来源的单核细胞12,间质干细胞13,内皮祖细胞和成血管壁衍生干细胞抗原-1(SCA-1)+干/祖细胞14,15都被证明是能够分化成任何官能内皮或平滑肌细胞响应于确定的培养基和培养条件。此外,干细胞的无限自我更新能力使得它们不同于成熟的内皮细胞和平滑肌细胞可以经历生长停滞和衰老之前仅划分为次数有限数量的更好的候选。
支架材料的选择,以产生成功的组织工程血管接枝取决于几个因素,例如生物相容性,生物力学性能,和生物降解的速率。从根本上说,用料打造的支架移植物应该是可生物降解,不会安装不必要的接受者的免疫反应。此外,它必须包括合适的孔隙度和微结构用于细胞附着和随后的存活。迄今为止,用于在血管组织工程支架中最常见的材料包括聚乙醇酸,聚乳酸和聚ε己内酯16的聚合物。最近,脱细胞的生物材料具有也已应用取得了一些成功。几个实验室证明,脱细胞播种人,犬或猪血管自体细胞提供了一个生物学的移植物的抵制凝血和内膜增生17-19。在血管组织工程等战略包括细胞外基质蛋白为基础的血管移植物如种子细胞的纤维蛋白胶13,并产生细胞片无支架支持20,21。
当前协议证明人类PiPSC分化为功能性内皮细胞和平滑肌细胞中,生成的组织工程血管的生物反应器,包括一个脱细胞血管支架怀有官能PiPSC源性血管细胞的,和接枝到重症联合免疫缺陷病(SCID )小鼠。 PiPSC是一个最佳的细胞类型以用于容器的移植物的组织工程,因为这些细胞不形成在小鼠中的肿瘤或提高的伦理和同种异体的免疫应答。此外,我们已经表明,该策略用于产生PIPS内皮细胞和PIPS平滑肌细胞是有效的和可再现的10,11。此后,我们设计用于PiPSC源性血管细胞密切模仿天然容器内存在的基质蛋白播种去细胞的容器中,从而提高了移植存活和功效。此外,前PiPSC播种血管的脱细胞防止安装在由免疫细胞类型的炎症反应,如巨噬细胞的产生。更重要的是,该协议不只是代表了一种方法,以产生希望的血管导管翻译成人类,而且还提供了学习和理解,通过小鼠模型支配的血管组织再生的分子机制的有价值的手段。
研究方案
根据批准的机构委员会使用实验动物和护理协议执行所有的动物实验。
1.准备文化传媒
- 使培养基为CCL-153人成纤维细胞系:F-12K培养基,10%胎牛血清(FBS)和100单位/毫升青霉素和链霉素。
- 使重新编程媒体为PiPSC代:敲除Dulbecco改良的Eagle培养基(DMEM)中含有20%敲除血清替代品,0.1mM的β巯基乙醇,0.1mM的极限必需培养基(MEM)非必需氨基酸,10纳克/毫升碱性成纤维细胞生长因子2(bFGF的-2)和100U / ml的青霉素和链霉素。新鲜每次使用媒体之前添加的bFGF-2。
- 使分化培养基(DM),以诱导平滑肌细胞(SMC)的分化:α-MEM中含有10%FBS,0.1mM的β巯基乙醇,100U / ml青霉素和链霉素和25毫微克/毫升的血小板源生长因子的媒体(PDGF-ββ)。
- 使内皮分化培养基(EC-DM)诱导内皮细胞(EC)的分化:内皮生长培养基-2(EGM-2)含有50纳克媒体/ ml的血管内皮生长因子(VEGF)和100U / ml的青霉素和链霉素。
2.重新编程人类成纤维细胞进入部分诱导的多能干细胞(PiPSC)
- 培养人成纤维细胞系:CCL-153上的0.04%的培养基中的明胶溶液涂布烧瓶中。
- 传代细胞每3天以1:1的比例:6。通过9 PiPSC一代最佳效率之前使用细胞。细胞是准备在到达80转 - 90%汇合。
- 线性化含有4重编程因子多顺反子质粒pCAG2LMKOSimO八聚体结合转录因子4(OCT4),SOX2,Kruppel样因子4(KLF4)和c-Myc(pCAG-OSKM)。消化5微克的质粒的5个单位的PvuⅠ的限制性内切酶为3小时,在37℃。净化该质粒具有根据制造商的协议商业试剂盒。
- 转染2×10 6人成纤维细胞用4微克线性化的pCAG-OSKM质粒通过电穿孔具有根据制造商的协议的人真皮成纤维细胞(NHDF)核转染试剂盒。轻轻种子转染的细胞上的预0.04%明胶涂布含有5ml预热的重编程媒体的T25培养瓶中。
- 24小时后,改变培养基的25微克/ ml的新霉素补充来选择转染细胞的纯群体。
- 改变中的每一天,直到第4天。
注:人类成纤维细胞后第4天重编程成为PiPSC。
3.分化PiPSC成内皮细胞和平滑肌细胞
- 种子PiPSC上含DM 4天IV型胶原预涂菜以诱导分化成平滑肌细胞。改变中的每一天,直到第4天。
- 种子PiPSC胶原IV预涂菜çontaining内皮-DM 6天以诱导分化为内皮细胞。改变中的每一天,直到6天。
4.脱细胞移植主动脉准备
注:所有的解决方案和设备应是无菌的。
- 牺牲小鼠颈椎脱位并修复鼠标在解剖显微镜下仰卧位。
- 通过胸骨和周围的肋骨切开以打开胸腔。取出心脏,肺和食管暴露主动脉。轻轻地用钳子取出围主动脉脂肪。
- 切从前端用剪刀主动脉,轻轻按住结束钝钳。分离从后面用钝性分离脊椎柱的主动脉。小心关闭所有分支动脉从主动脉结扎用双极electrocoagulator并从用剪刀结扎的远端切割。
- 使用5ml的注射器冲洗主动脉管腔带3米升的含有肝素的100单位,以防止血液凝块的形成盐溶液。
- 削减它分支成肾前主动脉的后端。保持主动脉的完整性是在整个过程中非常重要的。
- 冲洗主动脉管腔用5ml稀释在磷酸盐缓冲盐水(PBS)0.075%十二烷基硫酸钠(SDS)的溶液中。
- 浸泡在0.075%SDS溶液胸主动脉在10cm培养皿。将培养皿在定轨振荡器2小时以150rpm在室温。
- 冲洗主动脉管腔用5ml PBS中。
- 浸泡在PBS主动脉在一个10cm培养皿。放置在轨道摇床培养皿2小时以150rpm在室温。 PBS刷新每隔20分钟。
- 冲洗主动脉管腔用5ml PBS中。
- 请PBS脱细胞移植主动脉在4℃下长达一个星期。
PiPSC和生物反应器调理5.双播种
注意:所有的溶液s和设备应是无菌的。在组织培养罩进行所有操作。
- 组装的生物反应器流动回路, 如图1,连接孵育室,媒体库,蠕动泵和柔性小室与管。需要流通中的最小体积为40毫升
- 前提条件,通过浸泡在DM介质主动脉在一个10cm培养皿的脱细胞的容器中的培养基中。放置在定轨摇床上1小时培养皿在50rpm在RT。
- 插入1cm长的尼龙管(外径0.9毫米,ID 0.75mm)组合成显微镜下对脱细胞的容器的两端。领带的容器中,并用8-0丝缝线在管。
- 通过连接尼龙管具有从腔室壁的入口和出口端口(1/32"管)组装在孵育室的脱细胞的主动脉移植物。保持孵育室与介质的每次5mls。
- Trypsinize PiPSC通过加入预热的胰蛋白酶以覆盖培养皿,并轻轻摇动培养皿10倍。弃去胰蛋白酶和保留在孵化器的菜2 - 3分钟。添加预热的培养基在盘中混合并与该细胞的培养基。
- 计数使用血球细胞数。离心机含有每5×10 5细胞5分钟,在300×g下的细胞悬液的2等分。完全吸出上清液。
- 完全吸出上清液后,重悬沉淀1的PIPS细胞沉淀中加入50μl的DM。这种注入细胞悬液到脱细胞血管腔。
- 然后,悬浮等PIPS细胞沉淀在100微升基质胶。认真吸取到脱细胞移植主动脉混合物。
- 等待10 - 15分钟,直到混合物变成凝胶状态和均匀环绕该容器的外部表面。填写孵化室DM。
- 将整个生物反应器中在5%CO 2培养箱设定在37℃的。手动旋转脱细胞移植物周围的纵向轴线每半小时90°在第2小时。
- 保持静止培养12小时,使细胞粘附。
- 通过内腔递送的DM通过蠕动泵以诱导平滑肌细胞的分化。启动初始流速为5毫升/分钟,并逐步增加至20毫升/分钟以上24小时。
- 保持在流通介质的流速为20毫升/分钟24小时。
- 阻止介质流动和移动的生物反应器设置了孵化器。
- 重种子与PiPSC移植物的内腔。 Trypsinize,计数和离心1×10 6个PiPSC与步骤5.5 - 5.6。重悬在50微升EGM-2培养基的含有50纳克/ ml的VEGF的细胞。注入细胞混合物进入移植物的管腔。
- 改变在孵育室并且整个循环到含有50纳克/ ml的VEGF诱导的内皮分化EGM-2培养基的培养基。
- 将生物反应器设置回THË孵化器。手动旋转接枝90°,每30分钟在第2小时,然后保持静置培养12小时。
- 开始从5毫升/分钟,并逐步增加至35毫升/分钟的循环流量。保持/流速在35毫升分钟5天。改变循环和室中的每一天。
- 收获的设计移植进一步嫁接到鼠标。
6.嫁接双种子PiPSC移植到小鼠
- 使用NOD.CB17-SCID PRKDC / NcrCrl雄性小鼠血管移植受者。始终确保小鼠约10周龄,体重约25 - 35克,并处于良好的健康状况。
- 通过施用Hypnorm(25毫克/千克)和Hypnovel(25毫克/千克)经腹膜内的组合麻醉受体小鼠。取适量涂抹于眼睛凡士林眼药膏,以防止干燥,而在麻醉下。通过确保小鼠有放松肌肉,并呼吸平稳确认有效的麻醉。
- 解决鼠标在仰卧位,其颈部剃光和扩展。施用阿托品硫酸盐(1.7毫克/千克)与麻醉剂组合,以确保鼠标呼吸道保持清亮。
- 准备从下颌骨中线切口鼠标的胸骨。在解剖显微镜下用5〜10倍的放大,解除右唾液腺横向并取出右cleidomastoid肌肉以暴露右颈总动脉。
- 轻轻除去附着组织,从朝向近端的远端动员的右颈总动脉。用8-0丝线缝合结扎颈总动脉的中间部分的两倍,并在两个关系之间解剖。
- 通过在每个容器最终由高压灭菌尼龙管袖口和修复两端与microhemostat夹。
- 去除缝线领带一端并申请下降肝素(100单位/毫升)。紧接着,反转次的前端ë动脉以覆盖整个箍套主体和固定倒置容器用8-0丝线缝合到箍。
- 重复同样的步骤,以在动脉的其它部分。同花顺动脉生理盐水,以消除血凝块。
- 通过在动脉袖口滑动的脱细胞容器端部,并与8-0丝线缝合将其固定植入颈动脉的两端之间的脱细胞的容器接枝。除去血管钳从任一评估移植物的脉动之前结束。
- 将右唾液腺回其原来的位置。使用6-0聚乳糖的缝线间断缝合关闭皮肤上的手术位置。
- 持续观察小鼠生命体征的程序完成后,直到它恢复意识。颈椎脱位和收获血管移植牺牲受体小鼠无论是24小时或更高版本以供进一步分析3周。
结果
成功代PiPSC的确认4天nucleofecting人成纤维细胞用线性pCAG2LMKOSimO质粒携带4转录因子OCT4,SOX2,KLF4和c-Myc(OSKM)之后。 PiPSC显示明显不同的表型相比,成纤维细胞( 图2A),并表示4程序重编因子在mRNA( 图2B)和蛋白质( 图2C)的水平10。一个PiPSC基于血管移植物的效力是高度依赖于PiPSC的分化为内皮细胞和平滑肌细胞系的能力。因此,至关重要的,利用它们来生成容器移植之前分化的细胞中确定的培养基,以确认PiPSC 在体外这些特性。 图3示出了PiPSC的分化为功能性的内皮细胞的能力,在这两种基因( 图3A)和蛋白质( 图3B-D)列弗ELS,基于内皮特异性标记物10。同样,PiPSC还能够分化成平滑肌谱系响应于特定的媒体( 图3E-H)11。
整个主动脉脱细胞用治疗用SDS,阴离子洗涤剂是将细胞溶解和溶解细胞质成分来实现。 2小时后的治疗,相对于一个新鲜收获的主动脉( 图4A-B)的 22的脱细胞的主动脉呈现为半透明脱细胞支架。在图4C-F的组织学评估显示了不存在核或在脱细胞的血管细胞质染色的,而不是在正常小鼠主动脉。以下的PiPSC衍生内皮细胞和脱细胞的主动脉内平滑肌细胞的双播种,工程化血管移植物显示内皮细胞和平滑肌细胞的特性分别。双-S的苏木精和伊红(HE)染色eeded移植物显示类似于天然血管( 图4G)与平滑肌细胞和内皮细胞的单层多层的结构证实了阳性染色平滑肌-22α(SM22),平滑肌α肌动蛋白(SMA)的,分别为( 图4H-M)11 CD31和CD144标记。
为了确认体内的组织工程血管的通畅,双种子PiPSC源性血管移植到小鼠中-无论是正常小鼠和脱细胞动脉作为对照。随后的分析表明,虽然小鼠中接枝有呈现显着更高的死亡率,早1天脱细胞血管,PiPSC容器移植物所赋予的60%的存活率3周后移植( 图5A)11。另外,3个周龄PiPSC源性移植物完全表征人类PiPSC衍生内皮的存在,并平滑肌细胞和宿主巨噬细胞浸润( 图5B和表1)11。两者合计,结果表明,PiPSC具有分化成两个血管谱系的能力,并是有效的,用于产生功能性组织工程血管可在体内替代天然血管。
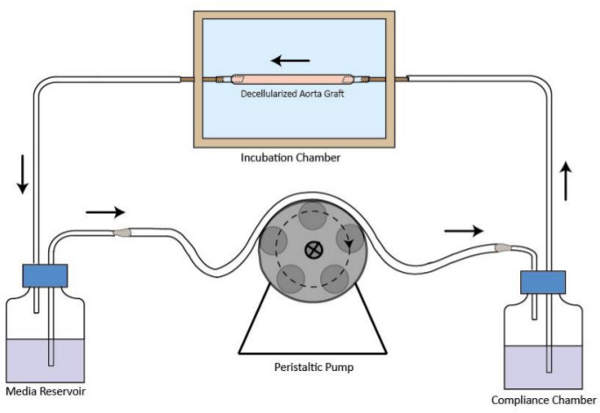
图脱细胞移植物的生物反应器流动回路的1示意图。该脱细胞容器接枝组装在孵育室。蠕动泵是在孵育室,以提供稳定的灌注介质流动的上游。媒体储存器是在孵育室的下游。该柔性小室是改善流动状态。流动方向由箭头指示。large.jpg"目标="_空白">点击此处查看该图的放大版本。

图2.代PiPSC从人成纤维细胞,人类成纤维细胞nucleofected与任一4重新编程基因(OCT4,SOX2,KLF4和c-Myc)或空载体(对照)。 (A)相衬图片显示点子后4天的形态。 PiPSC在mRNA(B)和蛋白(C)的水平表示所有四个转录因子,两者。为显示图像的比例尺是50微米和数据的平均值±SEM(N = 3); * P <0.05,*** P <0.001。这个数字已经被修改Margariti,A。等 10 请点击此处查看该图的放大版本。</ A>
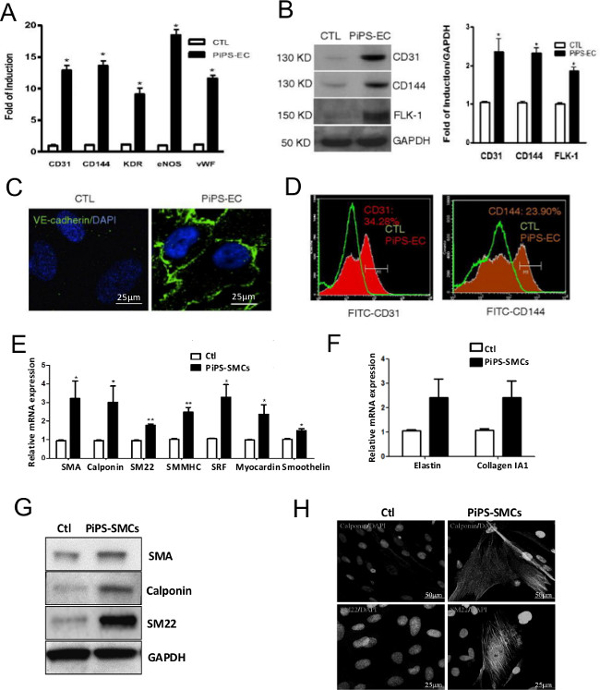
图3. PiPSC可以分化成内皮细胞和平滑肌细胞。PiPSC或控制细胞分化为内皮细胞。 (A) 的相比较,以控制细胞,PiPSC衍生的内皮细胞表达的内皮特异性标志物例如CD31,CD144,激酶插入结构域受体(KDR),在mRNA的内皮型一氧化氮合酶(eNOS)和冯维勒布兰德因子(vWF)水平。 (B)中,在使用Western印迹分析蛋白水平证实了这一点。 (C)免疫荧光染色表明CD144(VE-cadherin的)的PiPSC内皮染色阳性,但无法控制的细 胞。 (D)流式细胞仪分析证实CD31和CD144的PiPSC内皮细胞表达。 IV型胶原种子PiPSC(或对照细胞)也分化成平滑肌细胞。 (E,F)的相反,以控制细胞,PiPSC衍生平滑肌细胞表达平滑肌特异性标记在基因水平上,包括形状记忆合金,调宁蛋白,SM22,平滑肌肌球蛋白重链二(SMMHC),血清应答因子(SRF) ,心肌素,smoothelin,弹性蛋白和胶原蛋白1A1。 (G)的SMA,调宁蛋白和SM22在PiPSC源性细胞中的表达水平采用Western blot分析证实。利用共聚焦显微镜(H)免疫荧光染色呈典型的平滑肌标记染色调宁蛋白和SM22。数据表示平均值±SEM(N = 3); * P <0.05,** P <0.01,*** P <0.001。为显示图像比例尺是25微米或50微米。这些数字已被修改从Margariti,A。等人 10和Karamariti,E。等11 请点击此处查看该图的放大版本。
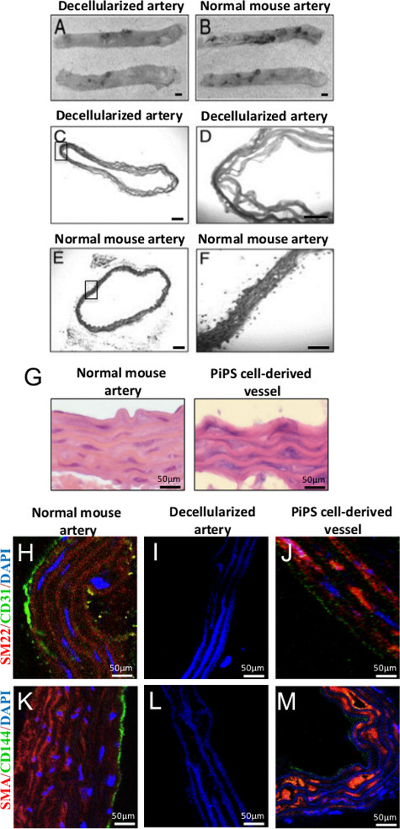
图4.代双种子PiPSC衍生的组织工程血管移植物:(A,B)的小鼠胸主动脉脱细胞保留其结构和仍然好像是正常血管,原始放大率2X的那个。 50X或200X:当与对照组相比,原来的放大倍数脱细胞主动脉(CF)HE染色证实成功脱细胞彻底清除细胞。的PiPSC衍生的内皮细胞和平滑肌细胞(G)的 HE染色双种子船只显示类似于天然血管的架构。 (J,M)染色阳性内皮(CD31和CD144)双种子PiPSC组织工程血管和平滑肌细胞(SM22和SMA)标记物不同于癸llularized血管移植。 (H,K)的血管标记物,以及PiPSC衍生内皮细胞和内侧和内膜的区域内的平滑肌细胞的形态特征和本地化的相伴表达比得上天然血管。为显示图像比例尺是50微米。这些数字都被修改仔,T 等22 Karamariti,E 等11 请点击此处查看该图的放大版本。
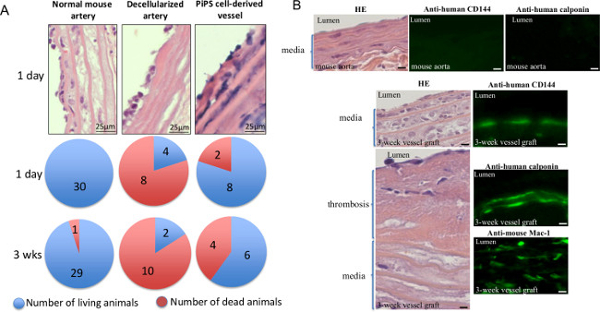
图5.双种子PiPSC衍生的组织工程血管移植物是专利在体内代天然血管。PiPSC源性血管移植到重症联合免疫缺陷的颈动脉(SCID)小鼠,正常谋本身和脱细胞动脉作为对照。接枝PiPSC源性血管小鼠(A)的分析显示,60%的存活率3周手术后,而接枝呈现显着更高的死亡率和生存率较低(20%),脱细胞血管小鼠。数据表示的装置(10例)。 (B)中的组织工程血管也被收获3周接枝后,进行HE(左图)或免疫荧光染色(右图)对人类CD144和调宁蛋白或小鼠的CD11b / CD18(MAC-1)的存在下;染色的量化总结于表1。原倍率为示出图像是400X除非另有说明。这个数字已经被修改Karamariti,E 等11 请点击此处查看该图的放大版本。
| 阳性细胞场(40X) | 术前设计的船 | 工程血管移植(3周) |
| 调宁 | 72±9 | 22±11 * |
| CD144 | 20±8 | 5±6 * |
| 的Mac-1 | 0 | 71±11 * |
表1的组织工程血管移植3周后的表征。以下免疫荧光染色与人调宁蛋白PiPSC衍生的内皮细胞和平滑肌细胞和宿主巨噬细胞的数量进行定量,人CD144和分别鼠标的Mac-1。数据代表平均值±SEM(N = 6); * P <0.05,从接枝前的组织工程血管显著差异。该表已经被修改Karamariti,E。 等。11
讨论
当前协议指示声音,快速,简单,高效和可重复性,其中功能性的组织工程血管可使用PiPSC从人成纤维细胞产生的策略。这种技术代表了用于再生医学,组织工程和潜在的患者特异性细胞治疗在不久的将来的宝贵工具。关键步骤,以确保协议的功效包括PiPSC的制备中,制备无菌的,且完全脱细胞主动脉移植物,PiPSC在支架成功播种和分化和主动脉移植物保持无菌在血管的生物反应器。
要启动成功代组织工程移植物,它是最重要的,以确保PiPSC的制备可被有效。经核转用pCAG2LMKOSimO OSKM质粒协议已成功"重新编程"一人成纤维细胞系为PiPSC。该surviv核转染后的成纤维细胞的人依赖于几个关键点,如使用高品质OSKM质粒,浓度范围之间500的质粒 - 1,000纳克/微升,核转染后立即避免在成纤维细胞播种延误细胞是特别敏感的,在采用新的相对较大的质粒,最后加入FGF-2的这一点至关重要,应加入新制备的培养基在使用前。此外,我们发现,这是至关重要的,以使用高达通道9,以避免复制衰老,细胞,以确保有效的"重编程"成PiPSC和随后的分化为内皮细胞和平滑肌细胞。 PiPSC的纯度可以通过选择nucleofected细胞新霉素的改进。该pCAG2LMKOSimO质粒具有新霉素抗性基因,因此添加新霉素的范围为25微克/毫升一天核转染3天后,将导致在一个纯群体的选择PiPSC。要接枝到小鼠工程师一个高效PiPSC船只,我们认为是脱细胞主动脉的完整性和无菌性是最高优先级的。之前保持主动脉的完整性和脱细胞后,有必要不断申请手巧,同时处理的船只,因为他们比较脆弱,在规模相当矮小。有效去除血管周围组织和使用双极电凝支动脉的密封是至关重要的,以确保后续能干细胞接种,并避免介质泄漏。在任何点上,我们确保所有的材料和设备,用于产生所述生物反应器( 即,钳子,管,瓶,腔室,剪刀,适配器和连接器)是可高压灭菌,从而减少细菌污染和血管移植手术前的失败的风险。
虽然当前协议持有心血管DISE前途的临床应用ASES,也有一些限制,应在不久的将来得到改进,以进一步提高的方法。迄今为止,OSKM转录因子引入到通过核转染人成纤维细胞。虽然这一技术相对比较简单和直接,这也导致了可变的转染效率在不同的实验次数。值得注意的是,这种不一致可以通过引入上述的新霉素选择的附加步骤来克服。类似的,可以考虑引入的四个因素导入人的成纤维细胞用慢病毒的整合,这可能潜在地增加"重新编程"的效率和增强细胞的感染后的存活的影响。在生物反应器而言,我们发现,可以用0.075%SDS中来实现主动脉完全脱细胞。尽管该技术被认为是最适合于细胞去除相比,其它洗涤剂( 例如,曲通X-100),它可能会导致然而Potential改变细胞外基质蛋白23的超结构中。因此这种现象值得更高效的脱细胞的策略,以减少相关联的细胞外基质蛋白的破坏。此外,我们还认为,脱细胞的主动脉的直径和壁厚小鼠之间变化,这取决于他们的年龄,应变和背景,并因此导致在生物反应器内的流动和剪切应力的速度和PiPSC之后PiPSC播种分布的电位差。所有这一切都还有待澄清。
此处这个协议描述的使用PiPSC持有一个有前途的潜在的心血管疾病中的干细胞疗法未来的临床应用中的功能的组织工程移植物的产生。这个方法,该方法通过跳过利用从一个体细胞谱系(成纤维细胞)的直接重编程到另一个(或内皮细胞或平滑肌细胞)pluripotency可以是一种方法,以获得感兴趣的安全和合适的细胞。事实上,几个协议已经发表来描述从人类胚胎,iPS细胞和成体干细胞24-26干细胞系,所有这些然而仍提高与问候它们在临床应用有关的问题的产生。它现在已知PiPSC不发展在SCID小鼠中的畸胎瘤,从而消除肿瘤形成的关注。此外,细胞需要显著更短的时间来产生,培养和分化10,11,并已显示出,以产生成功的和功能性的组织工程血管移植物是比得上天然主动脉。因此,PiPSC目前作为一个有前途的细胞来源治疗使用个性化细胞疗法,因为成纤维细胞( 如皮肤),可以从一个特定的个体得出的患者。该脱细胞的血管系统,该协议提供了一个更仿生模型,提供了种子细胞的extracellulAR基质蛋白是比较有代表性的,以一个本地主动脉11。这些关键点是保证接种的细胞和组织工程血管的存活,分化和功能,之后是至关重要的。最近的一项研究Sumitran-Holgersson的和他的同事证明,从之前死者以前脱细胞髂静脉移植的成功复育,以植入27,从而在的假设当前协议的平移值到人类在不久的将来。此外,该脱细胞移植血管可能代表了良好的模型,其中的角色和其他血管的细胞类型也有助于组织工程移植物的行为可以被评估。在小鼠中该模型系统可以提供一个强有力的工具未来药物筛选,也阐明参与血管干细胞生物学的细胞和分子机制。两者合计,当前协议保持有为价值为其在VASC应用ular组织工程和个性化医疗的突破。
披露声明
作者有没有冲突的财务权益。
致谢
This work was supported by The British Heart Foundation and The Oak Foundation.
材料
| Name | Company | Catalog Number | Comments |
| Human Fibroblasts CCL-153 | ATCC | CCL-153 | Prenatal human embryonic fibroblasts |
| ATCC F-12K Medium (Kaighn's Modification of Ham's F-12 Medium) | ATCC | 30-2004 | |
| Fetal Bovine Serum | ATCC | 30-2020 | |
| Knockout DMEM medium optimized for embryonic stem cells | Life technologies (Gibco) | 12660-012 | |
| Knockout Serum Replacement | Life technologies (Invitrogen) | 10828-028 | |
| Human Basic FGF-2 | Miltenyi Biotech | 130-093-837 | |
| alpha-MEM medium | Life technologies (Invitrogen) | 32571093 | |
| Human PDGF | R&D System | 120-HD-001 | |
| Gelatin Solution 2% | Sigma | G1393 | |
| Plasmid 20866: pCAG2LMKOSimO (SOX2, OCT4, KLF4, C-MYC) | Addgene | 20866 | |
| PvuI Restriction Enzyme | New England Biolabs | RO150S | |
| SureClean Plus | Bioline | BIO-37047 | |
| Nucelofection Kit (NHDF Kit) | LONZA | VPD-1001 | |
| Neomycin | SIGMA | G418 | |
| KL 1500 LCD, Illumination for Stereo Microscopy | SCHOTT | KL 1500 LCD | Cold light illumination for stereo microscopy |
| Nikon Zoom Steromicroscope SMZ800 | Nikon | SMZ800 | |
| Heparin sodium salt | Sigma | H3393 | |
| 10% SDS Stock Solution Molecular Biology Reagent | Severn Biotech | CAS 151-21-3 | |
| Dulbecco's Phosphate Buffered Saline | Sigma | D8537 | |
| Matrigel (10mg/ml) | BD | A6661 | |
| Shaker IKA Vibrax with Shaking platform VX 7 | Jepson Bolton's, Janke&Kunkel | S32-102 | |
| Masterflex L/S Digital Pump Drive | Cole-Parmer | WZ-07523-80 | |
| Masterflex L/S 6-channel, 6-roller cartridge pump head | Cole-Parmer | EW-07519-15 | |
| Masterflex L/S large cartridges for pump head | Cole-Parmer | EW-07519-75 | |
| Masterflex platinum-cured silicone pump tubing, L/S 14, 25 ft | Cole-Parmer | WZ-96410-14 | Tubing goes through the peristaltic pump |
| 0.5mm ID, 0.8 mm OD Silicone Tubing | SILEX | N/A | Tubings connect incubation chamber, media reservoir and compliance chamber |
| Fitting Reducer 0.5 to 1.6, natural Polypropyline | Ibidi | 10829 | Adapter connect above two types of tubings |
| 1/32" Tubing, ID 0.01" (250µm) Material: PEEK | LabSmith | T-132-010P | Tubing through the incubation chamber wall which connects the graft with outside tubing |
| One-Piece Fittings | LabSmith | T-132-100 | Fix the above tubings through the incubation chamber wall |
| Nylon tubes (OD 0.9mm, ID 0.75mm) | Smiths Medical | N/A | Tubings insert into two ends of the aorta graft |
| NOD.CB17-Prkdcscid/NcrCrl mouse | Charles River | ||
| Surgical sutures, 8-0 silk | ETHICON | W819 | |
| Hypnorm | Vetapharm | Vm21757/4000 | Neuroleptanalgesic for use in mice |
| Hypnovel (Midazolam) | Roche | 59467-70-8 | Induction of anaesthesia |
| Dissecting microscope | Carl Zeiss | Stemi 2000 | |
| Nylon Tubing | Portex LTD | 800/200/100/200 | 0.65 mm in diameter and 1 mm in length; to make artery cuff |
| Electrocoagulator | Martin | SN 54.131 | Ligation of artery branches on aorta |
| Bipolar micro hemostat forceps | Martin | 80-91-12-04 | Fixation of vessel ends |
| Vessel Dilator | S&T | JFX-7 | |
| Vessel Dilator | S&T | JFL-3dZ | |
| Vessel Dilator | S&T | D-5aZ | |
| Mini applier | AESCULAP | FE572K | |
| Micro hemostats clips | AESCULAP | FE720K | |
| Surgical sutures, 6-0 VICRYL | ETHICON | V489 |
参考文献
- Kurobe, H., Maxfield, M. W., Breuer, C. K., Shinoka, T. Concise Review: Tissue-Engineered Vascular Grafts for Cardiac Surgery: Past, Present, and Future. Stem Cells Transl Med. 1 (7), 566-571 (2012).
- Jonas, R. A., Freed, M. D., Mayer, J. E. Jr Long-term follow-up of patients with synthetic right heart conduits. Circulation. 72, II77-II83 (1985).
- Heureux, N., et al. Technology insight: the evolution of tissue-engineered vascular grafts-from research to clinical practice. Nat Clin Pract Cardiovasc Med. 4, 389-395 (2007).
- Zhang, W. J., Liu, W., Cui, L., Cao, Y. Tissue engineering of blood vessel. J Cell Mol Med. 11, 945-957 (2007).
- Cearbhaill, E. D., et al. Response of mesenchymal stem cells to the biomechanical environment of the endothelium on a flexible tubular silicone substrate. Biomaterials. 29, 1610-1619 (2008).
- Gong, Z., Niklason, L. E. Small-diameter human vessel wall engineered from bone marrow-derived mesenchymal stem cells (hMSCs). FASEB J. 22, 1635-1648 (2008).
- Wong, M. M., et al. Over-expression of HSP47 augments mouse embryonic stem cell smooth muscle differentiation and chemotaxis. PLoS One. 9 (1), e86118(2014).
- Park, S. W., et al. Efficient differentiation of human pluripotent stem cells into functional CD34+ progenitor cells by combined modulation of the MEK/ERK and BMP4 signaling pathways. Blood. 116, 5762-5772 (2010).
- Samuel, R., et al. Generation of functionally competent and durable engineered blood vessels from human induced pluripotent stem cells. Proc Natl Acad Sci USA. 110, 12774-12779 (2013).
- Margariti, A., et al. Reprogramming of fibroblasts into endothelial cells capacble of angiogenesis and reendothelialization in tissue-engineered vessels. Proc Natl Acad Sci USA. 109, 13793-13798 (2012).
- Karamariti, E., et al. Smooth muscle cells differentiated from reprogrammed embryonic lung fibroblasts through DKK3 signaling are potent for tissue engineering of vascular grafts. Circ Res. 112, 1433-1443 (2013).
- Udelsman, B., et al. Development of an operator-independent method for seeding tissue-engineered vascular grafts. Tissue Eng Part C Methods. 17 (7), 731-736 (2011).
- Cearbhaill, E. D., Murphy, M., Barry, F., McHugh, P. E., Barron, V. Behavior of human mesenchymal stem cells in fibrin-based vascular tissue engineering constructs. Ann Biomed Eng. 38 (3), 649-657 (2010).
- Wong, M. M., et al. Macrophages control vascular stem/progenitor cell plasticity through tumor necrosis factor-α-mediated nuclear factor-κB activation. Arterioscler Thromb Vasc Biol. 34 (3), 635-643 (2014).
- Wong, M. M., et al. Sirolimus stimulates vascular stem/progenitor cell migration and differentiation into smooth muscle cells via epidermal growth factor receptor/extracellular signal-regulated kinase/β-catenin signaling pathway. Arterioscler Thromb Vasc Biol. 33 (10), 2397-2406 (2013).
- Lee, J., Cuddihy, M. J., Kotov, N. A. Three-dimensional cell culture matrices: State of the art. Tissue Eng Part B Rev. 14, 61-86 (2008).
- Hung, H. S., Hsu, S. H. Current Advances of stem cell-based approaches to tissue-engineering vascular grafts. OA Tissue Engineering. 1 (1), 2(2013).
- Quint, C., et al. Decellularized tissue-engineered blood vessel as an arterial conduit. Proc Natl Acad Sci USA. 108 (22), 9214-9219 (2011).
- Zhang, X., Xu, Y., Thomas, V., Bellis, S. L., Vohra, Y. K. Engineering an antiplatelet adhesion layer on an electrospun scaffold using porcine endothelial progenitor cells. J Biomed Mater Res A. 97 (2), 145-151 (2011).
- Hibino, N., et al. Evaluation of the use of an induced puripotent stem cell sheet for the construction of tissue-engineered vascular grafts. J Thorac Cardiovasc Surg. 143 (3), 696-703 (2012).
- Zhao, J., et al. A novel strategy to engineer small-diameter vascular grafts from marrow-derived mesenchymal stem cells. Artif Organs. 36 (1), 93-101 (2012).
- Tsai, T., et al. Contribution of stem cells to neointimal formation of decellularized vessel grafts in a novel mouse model. Am J Pathol. 181 (1), 362-373 (2012).
- Kasimir, M. T., et al. Comparison of different decellularization procedures of porcine heart valves. Int J Artif Organs. 26 (5), 421-427 (2003).
- Stephenson, E., et al. Derivation and propagation of human embryonic stem cell lines from frozen embryos in an animal product-free environment. Nature Protocols. 7, 1366-1381 (2012).
- Takahashi, K., Okita, K., Nakagawa, M., Yamanaka, S. Induction of pluripotent stem cells from fibroblast cultures. Nature Protocols. 2, 3081-3089 (2007).
- McCall, F. C., et al. Myocardial infarction and intramyocardial injection models in swine. Nature Protocols. 7, 1479-1496 (2012).
- Olausson, M., et al. Transplantation of an allogeneic vein bioengineered with autologous stem cells: a proof-of-concept study. Lancet. 380 (9838), 230-237 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
ISSN 2578-2614
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。
我们使用 cookie 来增强您在我们网站上的体验。
继续使用我们的网站或单击“继续”,即表示您同意接受我们的 cookie。
