Method Article
Генерация и прививка тканевой инженерии сосудов в мышиной модели
* Эти авторы внесли равный вклад
В этой статье
Резюме
Здесь мы приводим протокол для создания тканей инженерии трансплантаты сосудов, которые являются функциональными для прививки мышам дважды посева частично индуцированных плюрипотентных стволовых клеток (PiPSC) - производное клетки гладких мышц и PiPSC - эндотелиальных клеток на decellularized судно лесов биореакторе.
Аннотация
The construction of vascular conduits is a fundamental strategy for surgical repair of damaged and injured vessels resulting from cardiovascular diseases. The current protocol presents an efficient and reproducible strategy in which functional tissue engineered vessel grafts can be generated using partially induced pluripotent stem cell (PiPSC) from human fibroblasts. We designed a decellularized vessel scaffold bioreactor, which closely mimics the matrix protein structure and blood flow that exists within a native vessel, for seeding of PiPSC-endothelial cells or smooth muscle cells prior to grafting into mice. This approach was demonstrated to be advantageous because immune-deficient mice engrafted with the PiPSC-derived grafts presented with markedly increased survival rate 3 weeks after surgery. This protocol represents a valuable tool for regenerative medicine, tissue engineering and potentially patient-specific cell-therapy in the near future.
Введение
Строительство сосудистых трубопроводов является фундаментальной стратегией для хирургического восстановления поврежденных и раненых сосудов в результате сердечно-сосудистых заболеваний. На сегодняшний день, привитые материалы, используемые в хирургии, включают биосовместимые синтетические полимеры (политетрафторэтилен [тефлоновую], вспененного политетрафторэтилена [ПТФЭ; Gore-Tex] или полиэтилентерефталат [дакрона]), аллотрансплантатов, аутологичной ткани перикарда (или подкожной вены) и ксенотрансплантатов 1. Несмотря на то, искусственные трансплантаты (например, Gore-Tex и дакрона) наиболее часто используются такие материалы скорее всего, причиной многочисленных краткосрочных и долгосрочных осложнений, которые включают стеноз, отложение кальция, тромбофлебита эмболизация и инфекций. Хотя пациенты с биологическими трансплантатов присутствующих со снижением тромбоэмболических событий, они по-прежнему сталкиваются ограничения, такие как вторичные отказ трансплантата и укороченной длительности из-за деградации кальцификации 2. Поэтому, несмотря на значительные улучшения в хирургической тechniques на протяжении многих лет, исследователей и клиницистов по-прежнему обременены необходимостью для определения идеального канал для сосудистых заболеваний. Совсем недавно, полевые исследования тканевой инженерии сосудов породило концепцию, в которой клетки были включены в биологически разлагаемых лесов, с целью создания Биомиметические среду, которая олицетворяет собой функциональную емкость для успешной прививки 1. По существу, успех сосудистых конструкций зависит от трех основных компонентов; Клетки, которые составляют каркас, т.е. внутренний слой эндотелиальных клеток и гладкий слой мышечных клеток, каркас, содержащий соответствующий внеклеточный матрикс, чтобы обеспечить механические свойства, сравнимые с нативной сосудистой и молекулярную / клеточной сигнализации, необходимой для инициирования / регулировании ремонт.
Длинные проходимость термин трансплантата и устойчивое развитие нео-тканей в значительной степени зависят от эффективного посева клеток матрикса йereby рендеринга решение типа клеток решающее значение. Несколько докладов продемонстрировать использование зрелых эндотелиальных и гладкомышечных клеток из различных источников для разработки трубопроводов малого диаметра 3-6. Хотя перспективным, отсутствие достаточных аутологичных сосудов для получения зрелых эндотелиальных и гладкомышечных клеток остаются значительным бременем. Совсем недавно, стволовые клетки из различных источников были использована для тканевой инженерии сосудов. Действительно, разнообразие типов стволовых клеток, включая эмбриональные стволовые клетки 7, индуцированных плюрипотентных стволовых клеток (иПСК) 8,9, PiPSC 10,11, костного мозга, полученные мононуклеары 12, мезенхимальные стволовые клетки 13, эндотелиальные клетки-предшественники и взрослых стенки сосуда -derived антиген стволовой клетки-1 (SCA-1) + стволовых клеток / клеток-предшественников 14,15 все была подтверждена способны дифференцироваться в любой функциональный эндотелиальных или гладкомышечных клеток в ответ на определенных средах иУсловия культивирования. Кроме того, неограниченная емкость самообновления стволовых клеток делает их более кандидатов в отличие от зрелого эндотелиальных и гладкомышечных клеток, которые могут делиться только на конечное число раз, прежде чем подвергнуться аресту роста и старения.
Выбор каркасного материала для создания успешной тканей инженерных судно для прививки зависит от нескольких факторов, таких как биосовместимость, биомеханических свойств и скорости биодеградации. По существу, материалы, используемые для создания каркасов для трансплантатов должны быть биоразлагаемыми и не будет устанавливать ненужные получателей иммунные ответы. Кроме того, он должен включать в себя соответствующую пористость и микроструктуру для прикрепления клеток и последующего выживания. На сегодняшний день, наиболее распространенные материалы, используемые для строительных лесов тканевой инженерии сосудов включают полимеры полигликолевой кислоты, полимолочной кислоты и поли ε-капролактона 16. Совсем недавно, decellularized биологические материалы имеютТакже были применены с некоторым успехом. Несколько лабораторий показали, что посев decellularized человека, собак или свиные сосуды с аутологичных клеток при условии, биологический трансплантат которые сопротивлялись свертывания и гиперплазия интимы 17-19. Другие стратегии в тканевой инженерии сосудов включают белки внеклеточного матрикса на основе сосудистых трансплантатов например, посев клеток в фибрин геля 13 и генерации клеток листы без лесов поддержки 20, 21.
В настоящее время протокол демонстрирует дифференцировку человеческих PiPSC в функциональную эндотелиальных и гладкомышечных клеток, образование биореакторе, состоящей из decellularized помост сосуда питать функциональные производные PiPSC-сосудистых клеток и трансплантации тканей из инженерии сосудов в тяжелой комбинированным иммунодефицитом (SCID ) мышей. PiPSC являются оптимальным тип клеток для использования в тканевой инженерии трансплантатов сосудов, так как эти клетки не образуют опухолей у мышей или повысить этические иалло-иммунные реакции. Кроме того, мы показали, что стратегия для создания Пункты эндотелиальных клеток и Пункты-клеток гладких мышц является эффективным и воспроизводимым 10,11. После этого, мы разработали decellularized сосуд для посева PiPSC, полученных из клеток сосудов тесно имитируют матричные белки, которые существует в родной судна, тем самым повышая прививки и выживания эффективность. Кроме того, decellularization сосудов до посева PiPSC предотвращает возникновение воспалительных реакций, установленных по видам иммунных клеток, таких как макрофаги. Что еще более важно, этот протокол не только представляют собой методологию для создания перспективных сосудистых каналы для перевода на человека, но и дает ценные средства изучения и понимания молекулярных механизмов, которые регулируют регенерацию ткани сосудов через мышиных моделях.
протокол
Выполните все эксперименты на животных в соответствии с процедурами, утвержденными институциональной Комитета по уходу и применению лабораторных животных.
1. Подготовка питательных сред
- Сделать питательных сред для линии фибробластов человек CCL-153: F-12K Medium, 10% фетальной бычьей сыворотки (FBS) и 100 ед / мл пенициллина и стрептомицина.
- Сделать перепрограммирования носителя для генерации PiPSC: средний модифицированной орла Knockout Игла (DMEM), содержащей 20% Нокаут сыворотки замены, 0,1 мМ β-меркаптоэтанол, 0,1 мМ минимально необходимой среды (MEM) Non-незаменимые аминокислоты, 10 нг / мл основной фактор роста фибробластов 2 (bFGF-2) и 100 ед / мл пенициллина и стрептомицина. Добавить bFGF-2 свежемолотый каждый раз перед использованием средств массовой информации.
- Сделать среде для дифференцировки (DM), чтобы вызвать клетки гладкой мышцы (SMC) дифференциации: α-MEM среде, содержащей 10% FBS, 0,1 мМ β-меркаптоэтанола, 100 ед / мл пенициллина и стрептомицина и 25 нг / мл тромбоцитарный фактор роста(PDGF-ββ).
- Сделать дифференцировки эндотелия Медиа (ИС-ДМ), чтобы вызвать эндотелиальных клеток (EC) дифференциацию: роста эндотелия медиа-2 (EGM-2) носитель, содержащий 50 нг / мл фактор роста эндотелия сосудов (VEGF) и 100 ед / мл пенициллина и стрептомицина.
2. перепрограммировать фибробласты человека в частично-индуцированных плюрипотентных стволовых клеток (PiPSC)
- Культура человеческого линия фибробластов CCL-153 на 0,04% раствор желатина колб с покрытием в культуральной среде.
- Прохождение клетки каждые 3 дня в соотношении 1: 6. Используйте клетки до прохождения 9 для оптимальной эффективности генерации PiPSC. Клетки готовы для трансфекции при достижении 80 - 90% слияния.
- Линеаризуем полицистронные плазмиды pCAG2LMKOSimO, содержащий 4 факторов перепрограммирования октамер-связывающий фактор транскрипции 4 (OCT4), SOX2, Kruppel-фактор 4 (KLF4) и C-MYC (pCAG-OSKM). Дайджест 5 мкг плазмидной 5 единицами PvuI рестриктазой в течение 3 ч при 37 ° С. Очищатьплазмиды с коммерческой комплект в соответствии с протоколом производителя.
- Трансфецировать 2 х 10 6 фибробластов человека с 4 мкг линеаризованной pCAG-OSKM плазмиды электропорации с человеком кожная фибробластов (NHDF) nucleofection комплект в соответствии с протоколом производителя. Аккуратно семян трансфекции клеток на предварительной 0.04% желатина покрытием T25 колбу, содержащую 5 мл подогретого перепрограммируя СМИ.
- После 24 ч, изменить среду с добавками 25 мкг / мл неомицина, чтобы выбрать чистый население трансфицированных клеток.
- Измените среднего каждый день до 4 дня.
Примечание: Фибробласты человека стать PiPSC после 4 дней перепрограммирования.
3. Дифференциация PiPSC в эндотелиальных и гладкомышечных клетках
- Семя PiPSC на коллаген IV, предварительно покрытых блюд, содержащих ДМ в течение 4 дней, чтобы индуцировать дифференцировку в ГМК. Измените среднего каждый день до 4 дня.
- Семя PiPSC на коллаген IV, предварительно покрытых блюд сontaining эндотелиальных-DM в течение 6 дней, чтобы индуцировать дифференцировку в эндотелиальных клетках. Измените среднего каждый день до 6 суток.
4. Decellularized аорты трансплантата Подготовка
Примечание: Все растворы и оборудование должно быть стерильным.
- Жертвоприношение мыши путем смещения шейных позвонков и закрепить мышь в положении лежа на спине под микроскопом рассечение.
- Разрезать грудины и вокруг грудной клетки, чтобы открыть грудную полость. Удалить Сердце, легкие и пищевод, чтобы разоблачить аорты. Аккуратно снимите пригородных аорты жира щипцами.
- Вырезать аорты от переднего конца с ножницами и осторожно провести конец с тупыми щипцами. Снять аорты от позвоночного столба сзади тупым. Осторожно закройте все ветвления артерий от аорты путем лигирования с биполярным электрокоагулятора и резки от дальнем конце перевязки ножницами.
- Используйте 5 мл шприц для промывки аорты просвет с 3 мл солевого раствора, содержащего 100 U гепарина, чтобы предотвратить образование тромбов.
- Разрежьте задний конец аорты, прежде чем он отраслях в почечную. Сохранение целостности аорты очень важно в течение всей процедуры.
- Флеш аорты просвет 5 мл 0,075% додецилсульфата натрия (SDS) раствора, разведенного в физиологическом растворе с фосфатным буфером (PBS).
- Замочите грудной аорты в 0,075% раствора SDS в 10 см чашки Петри. Поместите чашку Петри на орбитальном шейкере в течение 2 ч при 150 оборотах в минуту при комнатной температуре.
- Промойте аорты просвет с 5 мл PBS.
- Замочите аорты в PBS в 10 см чашки Петри. Поместите чашку Петри на орбитальном шейкере в течение 2 ч при 150 оборотах в минуту при комнатной температуре. Обновить PBS через каждые 20 мин.
- Промойте аорты просвет с 5 мл PBS.
- Держите decellularized аорты трансплантата в PBS при 4 ° С в течение одной недели.
5. Двойной Посев PiPSC и биореактора кондиционирования
Примечание: Все решенияс и оборудование должно быть стерильным. Выполните все операции в капот культуры ткани.
- Соберите схему биореактор потока, как показано на рисунке 1. Подключите инкубационной камере, медиа резервуар, перистальтического насоса и камеру соблюдения с трубками. Минимальный объем среды, необходимых для обращения составляет 40 мл.
- Предварительным условием decellularized сосуд с питательной среды путем замачивания аорты в DM среды в 10 см чашки Петри. Поместите чашку Петри на орбитальном шейкере в течение 1 часа при 50 оборотах в минуту при комнатной температуре.
- Вставка 1 см длины нейлоновых труб (OD 0,9 мм, ID 0,75 мм) в обоих концах decellularized судна под микроскопом. Свяжите судна и трубы с 8-0 швами из шелка.
- Сборка decellularized аорты трансплантата в инкубационной камере при подключении нейлоновой трубки с впускным и выпускным портами (1/32 ") из труб стенки камеры. Поддержание инкубационной камере с 5mls среды каждый раз.
- Trypsinize PiPSC, добавив предварительно нагретойтрипсин, чтобы покрыть культуры блюдо и осторожно встряхните блюдо 10 раз. Откажитесь от трипсина и оставить блюдо в инкубаторе в течение 2 - 3 мин. Добавить подогретого культуральной среды в чашке и смешать среду с клетками.
- Количество количество клеток с помощью гемоцитометра. Центрифуга два аликвоты суспензии клеток, содержащих 5 × 10 5 клеток каждый в течение 5 мин при 300 х г. Аспирата супернатант полностью.
- После аспирации супернатант полностью, ресуспендируют осадок 1 из Пункты клеток гранул в 50 мкл DM. Внедрить эту клеточную суспензию в decellularized просвета сосуда.
- Затем ресуспендируют другой Пункты осадок клеток в 100 мкл Matrigel. Тщательно пипетки смесь на decellularized аорты трансплантата.
- Подождите 10 - 15 мин, пока смесь не превратится в состоянии гелеобразной и равномерно обтекает судна внешней поверхности. Заполните инкубационный камеру с DM.
- Поместите все биореактор установки в 5% CO 2 инкубаторе при 37 ° C, Вручную поверните decellularized привитые на 90 ° вокруг продольной оси каждые полчаса в первые 2 часа.
- Хранить статического культуру в течение 12 ч, чтобы позволить адгезию клеток.
- Доставка DM через просвет от перистальтического насоса индуцировать дифференцировку гладкой мышечной клетки. Начните начальную скорость потока на 5 мл / мин, а ступенчатое увеличение до 20 мл / мин в течение 24 часов.
- Держать скорость потока циркулирующего среде при 20 мл / мин в течение 24 ч.
- Остановка потока среды и перемещать биореактор установки из инкубатора.
- Re семян просвет трансплантата с PiPSC. Trypsinize, считать и центрифуга 1 х 10 6 PiPSC, как в шагах 5,5 - 5,6. Ресуспендируют клеток в 50 мкл EGM-2 среды, содержащей 50 нг / мл VEGF. Вводят смесь клеток в просвет трансплантата.
- Изменение среды в инкубационной камере и весь оборот в EGM-2 среды, содержащей 50 нг / мл VEGF, чтобы индуцировать дифференцировку эндотелиальных.
- Настройки Переместить обратно в го биореакторае-инкубатор. Вручную поверните привитые 90 ° через каждые 30 мин в первые 2 ч и затем сохранить статический культуру в течение 12 ч.
- Начните циркулирующего потока от 5 мл / мин, а ступенчатое увеличение до 35 мл / мин. Держите скорость потока на 35 мл / мин в течение 5 дней. Изменить циркуляции и камера среднего каждый день.
- Урожай инженерии трансплантата для дальнейшего пересаживания мыши.
6. Наращивание Двухместный семенами PiPSC трансплантат мышам
- Использование NOD.CB17-Prkdc SCID / NcrCrl самцов мышей в качестве получателей судно привитых. Всегда убедитесь, что у мышей около 10 недель, вес около 25 - 35 г, а в хороших условиях для здоровья.
- Обезболить получатель мышь путем введения комбинации Hypnorm (25 мг / кг) и Hypnovel (25 мг / кг) внутрибрюшинно. Применить вазелин глазной мази на глазах, чтобы предотвратить сухость в то время как под наркозом. Подтвердите эффективное обезболивание, гарантируя, что мыши имеют расслабленной мышцы и дышите устойчиво.
- Fix мыши в лежачем положении с его шеи бреют и расширен. Администрирование атропин сульфат (1,7 мг / кг) в сочетании с анестетики, чтобы гарантировать, что дыхательные пути мыши остается прозрачным.
- Подготовка срединный разрез от нижней челюсти к грудине мыши. Под микроскопом рассекает с 5 до 10-кратного увеличения, поднимите правую слюнных желез в сторону и снимите правую cleidomastoid мышцы, чтобы выставить правильный общей сонной артерии.
- Осторожно удалить прикрепленные тканей для мобилизации правой общей сонной артерии от дистального конца к проксимальному концу. Лигировать среднюю часть общей сонной артерии в два раза с 8-0 шелковой нити и рассекают между двумя связями.
- Пройдите через манжеты из автоклавируемом нейлоновой трубки в каждом конце сосуда и зафиксировать каждый конец с microhemostat зажимов.
- Удалить шовного связь на одном конце и наносить каплю гепарина (100 ЕД / мл). Сразу же после инвертирования дистальный конец гое артерии, чтобы покрыть все тело манжеты и закрепите перевернутый сосуд с 8-0 шелковой нити к манжете.
- Повторите ту же процедуру на другом участке артерии. Флеш артерии с физиологическим раствором, чтобы удалить сгустки крови.
- Имплантировать decellularized трансплантат сосуда между двумя концами сонной артерии, сдвинув decellularized концы судна над манжетами артерии и фиксации его с 8-0 швами из шелка. Удалить сосудистые зажимы из обоих концах прежде чем давать оценку пульсацию трансплантата.
- Положи правую слюнные железы вернуться к своей первоначальной позиции. Закройте кожу на операционном помещении с прерванного шва с помощью 6-0 полиглактин шов.
- Последовательно наблюдать жизненные признаки мыши после завершения процедуры, пока не возобновится сознание. Жертвоприношение мышей-реципиентов путем смещения шейных позвонков и урожай сосудов трансплантатов либо 24 ч или 3 недели спустя для дальнейшего анализа.
Результаты
Успешно поколение PiPSC было подтверждено через 4 дня после nucleofecting фибробластов человека с линеаризованной pCAG2LMKOSimO плазмидой, несущей 4 транскрипционные факторы, OCT4, Sox2, KLF4 и с-Мус (OSKM). PiPSC отображается заметно явное фенотип по сравнению с фибробластами (рис 2А) и выразил 4 факторов перепрограммирования в мРНК (рис 2б) и белка (рис 2С) уровнях 10. Эффективность в PiPSC основе сосудистого трансплантата в значительной степени зависит от способности PiPSC дифференцироваться в обоих эндотелиальных и гладких мышечных линий. Поэтому очень важно, чтобы подтвердить эти свойства PiPSC в пробирке путем дифференцирования клеток в определенных средствах массовой информации перед использованием их для получения трансплантатов сосудов. Рисунок 3 показывает способность PiPSC дифференцироваться в функциональных эндотелиальных клеток в обоих генов (рис 3а) и белка ( 3В-D), LevELS, на основе эндотелиальных-специфических маркеров 10. Кроме того, PiPSC также способны дифференцироваться в линии гладких мышц в ответ на физическом носителе (рис 3E-H) 11.
Всего аорты decellularization было достигнуто путем обработки SDS, анионного моющего средства, что лизирует клетки и растворяет компоненты цитоплазмы. После 2 ч обработки, decellularized аорты появился как полупрозрачного бесклеточной строительные леса, по сравнению с только что собранных аорты (фиг.4А-В) 22. Гистологическое исследование на фиг.4С-F иллюстрирует отсутствие ядер или окрашивание цитоплазмы в decellularized сосудов, но не в нормальной аорте мышей. После двойного посева PiPSC-эндотелиальных и гладкомышечных клеток в пределах decellularized аорты, сконструированные сосудистые протезы отображения эндотелиальных и гладких свойства мышечных клеток, соответственно. Гематоксилином и эозином (HE) окрашивание двойной-хeeded трансплантаты показали архитектуру, подобную нативных сосудов (рис 4G) с несколькими слоями гладких мышечных клеток и монослой эндотелиальных клеток, что подтверждается положительным окрашиванием на гладких мышц-22α (SM22), гладкие мышцы-α актина (SMA) , CD31 и CD144 маркеры соответственно (рис 4H-М) 11.
Чтобы подтвердить проходимость ткани инженерных судов в естественных условиях, двойные семенами PiPSC получаемые из судов были привиты в мышей - как обычный мыши и decellularized артерии были использованы в качестве контроля. Последующий анализ показал, что в то время у мышей с привитой decellularized судов, представленных с заметно более высокой смертности в начале 1 день, PiPSC трансплантаты сосудов присвоено выживаемость 60% через 3 недели после трансплантации (рис 5А) 11. Кроме того, три недельных PiPSC-производные трансплантаты были полностью проанализированы на присутствие человека PiPSC-эндотелиальных и гладкомышечных клеток и макрофагов хост инфильтрации (фиг.5В и в таблице 1) 11. Взятые вместе, результаты показывают, что PiPSC имеют способность дифференцироваться в обоих сосудистых линий и мощным для создания функциональных тканевой инженерии сосудов, которые могут заменить родные сосуды в естественных условиях.
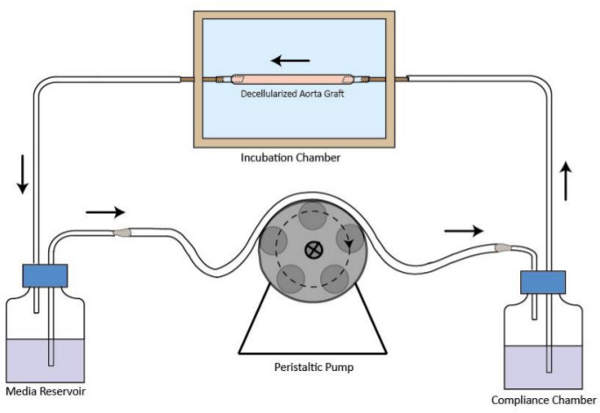
Рисунок 1. Схематическое изображение контура потока трансплантата биореактор decellularized. Decellularized трансплантата контейнер собран в инкубационной камере. Перистальтический насос находится в верхнем течении в инкубационной камере, чтобы обеспечить стабильную потока среды перфузии. Носитель резервуар на выходе из инкубационной камере. Камера соблюдение является улучшение режима течения. Направление потока указано стрелками.large.jpg "TARGET =" _ пустое "> Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.

Рисунок 2. Генерирование PiPSC из человеческих фибробластов. Фибробласты человека были nucleofected или с четырьмя перепрограммирования генов (OCT4, Sox2, KLF4 и С-Myc) или пустым вектором (контроль). Контрастные фотографии () Фазовые показать морфологию Пункты после 4 дней. PiPSC выразил все четыре фактора транскрипции, как в мРНК (B) и белка (C) уровнях. Масштабная линейка для изображений показаны 50 мкм и данные средства ± SEM (n = 3); * P <0,05, *** р <0,001. Эта цифра была изменена с Margariti А. и др. 10 Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого показателя. </>
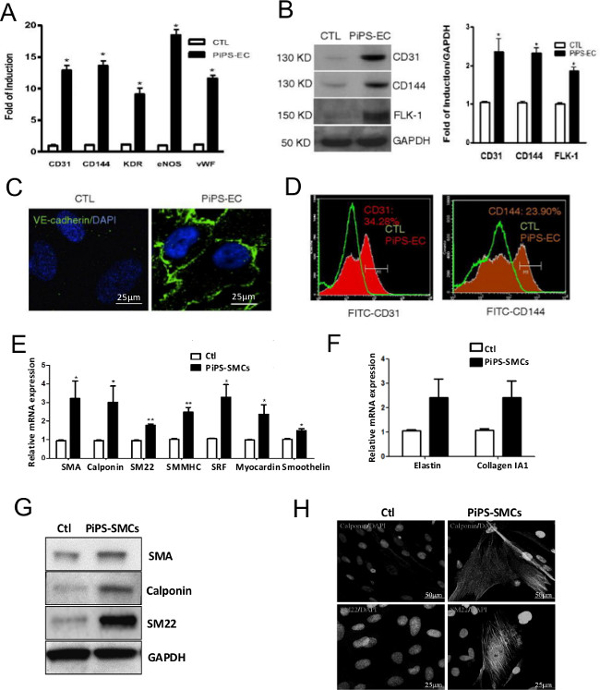
Рисунок 3. PiPSC могут дифференцироваться в обоих эндотелиальных и гладких мышечных клеток. PiPSC или контрольные клетки дифференцировались в эндотелиальные клетки. (А) по сравнению с контрольными клетками, PiPSC полученные эндотелиальные клетки экспрессируют специфические эндотелиальные маркеры, такие как CD31, CD144, рецептора киназы домена KDR (вставка), эндотелиальной синтазы оксида азота (Енос) и фон фактора Виллебранда (ФВ) в мРНК Уровень. (B) Это было подтверждено на уровне белка с помощью Вестерн-блоттинга. (C) Иммунофлуоресцентное окрашивание указано положительное окрашивание CD144 (VE-кадгерина) в PiPSC-эндотелиальной, но не контролирует клетки. (D) Цитометрический анализ подтвердил PiPSC-эндотелиальной выражение клеток CD31 и CD144. Коллаген IV семенами PiPSC (или контрольные клетки) также дифференцированы вклетки гладкой мышцы. (E, F) В отличие от контрольных клеток, PiPSC-полученные клетки гладких мышц выразил гладких мышц-специфических маркеров на генном уровне, в том числе SMA, calponin, SM22, гладкая миозина мышц тяжелой цепи II (SMMHC), сывороточный фактор ответ (РВСН) , myocardin, smoothelin, эластин и коллаген 1A1. (G) уровни экспрессии SMA, calponin и SM22 в PiPSC-клеток, полученных были подтверждены с помощью Вестерн-блоттинга. (H) иммунофлуоресценции окрашивание с помощью конфокальной микроскопии показал типичный гладкой окрашивание мышц Маркер для calponin и SM22. Данные представляют собой средства ± SEM (n = 3); * P <0,05, ** Р <0,01, *** р <0,001. Масштабная линейка для изображений, показанных на 25 мкм или 50 мкм. Эти цифры были изменены с Margariti А. и др. 10 и Karamariti, Е. и др. 11 Пожалуйста,Нажмите здесь, чтобы посмотреть большую версию этой цифры.
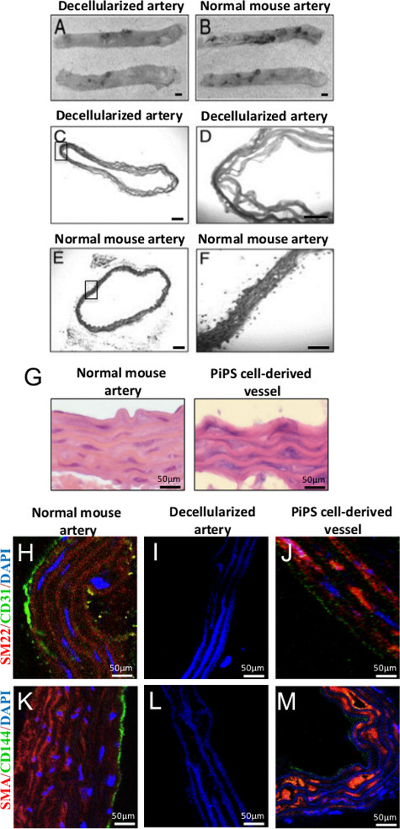
Рисунок 4. Генерация дважды семенами PiPSC полученных тканей инженерии сосудистых трансплантатов. (A, B) Decellularization мышиного грудной аорты сохранил свою структуру и по-прежнему напоминал обычный судна, оригинальное увеличения 2X. (CF) Его окрашивание decellularized аорты подтвердил успешную decellularization и полное удаление клеток по сравнению с контролем, оригинальный увеличение: 50X или 200X. (G) Его окрашивание PiPSC-эндотелиальных и гладкомышечных клеток дважды семенами судов показал, архитектуру, которая была похожа на родном судна. (J, M) Двухместный семенами ткани инженерии сосудов PiPSC окрашенных положительным для эндотелиальных (CD31 и CD144) и гладкие мышечные клетки (SM22 и SMA) маркеры отличие от DECEllularized трансплантаты судна. (H, K) сопутствующей экспрессии маркеров сосудистых, а также характерной морфологии и локализации PiPSC-эндотелиальных и гладкомышечных клеток в пределах средних и интимных областей была сравнима с носителями сосудов. Масштабная линейка для изображений, показанных на 50 мкм. Эти цифры были изменены с Цай Т. и др., 22 и Karamariti, Е. и др. 11 Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
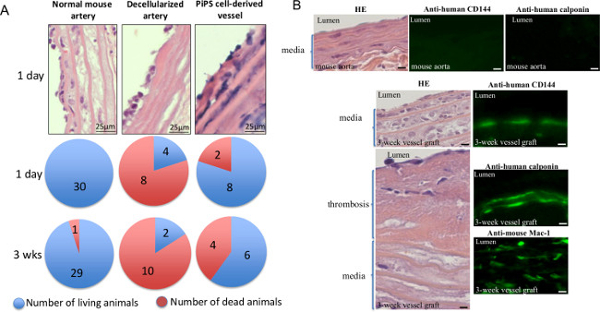
Рисунок 5. Дважды семенами PiPSC получаемые из тканей разработаны сосудистые трансплантаты патент для замены родных судов в естественных условиях. PiPSC получаемые из судов были привиты в сонную артерию тяжелым комбинированным иммунодефицитом (SCID) Мышей, нормальный моусути и decellularized артерии использовали в качестве контролей. () Анализ мышей, привитых с PiPSC, полученных из судов показал 60% выживаемость 3 недели после операции, тогда как мыши, привитые decellularized судов, представленных с заметно более высокой смертности и низкой выживаемости (20%). Данные представляют собой средства (п = 10). (B) тканевой инженерии суда были также собраны через 3 недели после прививки и подвергали HE (слева панели) или иммунофлуоресценции окрашивания (правая панели) на наличие человеческого CD144 и calponin мыши или CD11b / CD18 (Mac-1); Количественное окрашивания представлены в таблице 1. Оригинал увеличения изображений показанных 400X, если не указано иное. Эта цифра была изменена с Karamariti, Е. и др. 11 Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
| Положительные клетки поля (40X) | Разработано сосудов до пересадки | Разработано сосудов трансплантата (3 недели) |
| calponin | 72 ± 9 | 22 ± 11 * |
| CD144 | 20 ± 8 | 5 ± 6 * |
| Mac-1 | 0 | 71 ± 11 * |
Таблица 1. Характеристика тканевой инженерии сосудов 3 недели после прививки. Количество PiPSC-эндотелиальных и гладкомышечных клеток и принимающих макрофагов количественно после иммунофлюоресценции окрашивания человека calponin, человек CD144 и мышь Mac-1 соответственно. Данные представляют среднее ± SEM (n = 6); * P <0,05, существенное отличие от тканевой инженерии сосудов до трансплантации. Эта таблица была изменена с Karamariti E. и др. 11
Обсуждение
Текущий протокол указывает на звук, быстрый, простой, эффективный и воспроизводимый стратегию, при которой функциональные ткани разработаны суда могут быть получены с использованием PiPSC из фибробластов человека. Эта техника представляет собой ценный инструмент для регенеративной медицины, тканевой инженерии и потенциально конкретного пациента клеточной терапии в ближайшем будущем. Критические шаги, чтобы обеспечить эффективность протокола включают подготовку PiPSC, подготовка стерильных и полностью decellularized аорты трансплантатов, успешное посева и дифференциации PiPSC в каркасах и поддержания стерильности аорты трансплантатов в сосудистой биореакторе.
Чтобы начать успешную поколение тканевой инженерии трансплантатов, это крайне важно обеспечить, чтобы подготовка PiPSC осуществляется эффективно. Протокол успешно "перепрограммировать" человеческий линию клеток фибробластов в PiPSC с помощью nucleofection с плазмиды pCAG2LMKOSimO OSKM. Survivаль фибробластов после nucleofection зависит от нескольких ключевых точках, таких как использование высококачественных OSKM плазмид, плазмиды концентрации в диапазоне от 500 - 1000 нг / мкл, во избежание задержки в посева фибробластов сразу после nucleofection как клетки особенно чувствительны после введения Относительно крупные плазмиды и, наконец, добавлением FGF-2, который имеет решающее значение, и должны быть добавлены в свежеприготовленных средах непосредственно перед использованием. Кроме того, мы обнаружили, что это было важно использовать клетки до прохода 9, чтобы избежать репликативной старение, для обеспечения эффективного «перепрограммирование» в PiPSC и последующей дифференциации в эндотелиальные и гладкомышечные клетки. Чистота PiPSC может быть улучшена путем отбора клеток с nucleofected неомицина. PCAG2LMKOSimO плазмида имеет неомицину ген устойчивости и, следовательно, добавление неомицина в диапазоне от 25 мкг / мл через день после nucleofection в течение 3 дней приведет к выбору чистой популяцииPiPSC. Для инженера эффективной PiPSC судно для прививки мышам, мы рассмотрели целостность и стерильность decellularized аорты, чтобы быть наивысшим приоритетом. Для поддержания целостности аорты до и после decellularization, необходимо было постоянно применять ловкость рук во время обработки сосуды, как они были относительно хрупкими и значительно миниатюрные размеры. Эффективное удаление периваскулярной ткани и герметизации ветвящихся артерий с использованием биполярного электро-коагулятор имеет решающее значение для обеспечения последующей компетентный посев клеток и, чтобы избежать утечки информации. В любой момент, мы обеспечили, что все материалы и установка для получения биореактор (то есть, щипцы, трубки, бутылки, камеры, ножницы, адаптеры и разъемы) были автоклавируемый, тем самым уменьшая риск бактериального загрязнения и разрушения сосудистых трансплантатов до операции ,
Несмотря на то, Текущий протокол имеет многообещающие клинические приложения в сердечно-сосудистой DiSEасы, есть несколько ограничений, которые должны быть улучшены в ближайшем будущем для дальнейшего повышения методологию. До сих пор OSKM транскрипционные факторы были введены в фибробластах человека через nucleofection. В то время как этот метод является относительно простым и понятным, что также приводит к повышению эффективности трансфекции переменных на различных экспериментальных раз. Следует отметить, что это несоответствие может быть преодолено путем введения дополнительной стадии вышеуказанного неомицина выбора. Кроме того, можно было бы рассмотреть вопрос о введении четырех факторов в человеческих фибробластов с использованием лентивирус интеграции, которые могут потенциально увеличить эффективность "перепрограммирования" и повышению выживаемости клеток после заражения. С точки зрения биореактора, мы обнаружили, что полное decellularization из аорты может быть достигнуто с помощью 0,075% SDS. Хотя этот метод был признан оптимальным для удаления клеток по сравнению с другими моющими средствами (например, тритон Х-100), что может привести к р однакоotential изменения в пределах ультра-структур белков внеклеточного матрикса 23. Это явление, поэтому гарантирует более эффективных стратегий decellularization чтобы свести к минимуму нарушение соответствующих белков внеклеточного матрикса. Кроме того, мы также считает, что диаметра и толщины стенки decellularized аорты варьироваться в зависимости от мышей, в зависимости от их возраста, процедить и фона, и тем самым вызвать потенциальные различия в скорости потока и напряжения сдвига в биореакторах и распределения PiPSC следующей PiPSC посева , Все это еще предстоит уточнить.
Здесь Этот протокол описан в поколение функциональных тканей инженерии трансплантатов с использованием PiPSC, которые держат многообещающий потенциал для будущих клинических применений в терапии стволовых клеток для сердечно-сосудистых заболеваний. Это процесс, который использует прямой перепрограммирование от одного соматического клона (фибробластов) в другую (либо эндотелиальных или гладкомышечных клеток), пропуская pluripoСтихийность может быть способ получить безопасные и подходящие клетки интерес. В самом деле, несколько протоколов были опубликованы, чтобы описать поколение клеточных линий стволовых из эмбрионов человека, плюрипотентных клеток и взрослых стволовых клеток 24-26, все из которых, однако все еще поднимают в отношении вопросов в отношении их применения в клинике. В настоящее время известно, что PiPSC не развиваются тератомы в SCID мышей, тем самым устраняя обеспокоенность образования опухоли. Кроме того, клетки принимают значительно меньше времени для создания, культуры и дифференцировать 10,11, и, как было показано, чтобы генерировать успешные и функциональные ткани разработаны сосудов трансплантатов, которые сопоставимы с носителями аорты. Таким образом, PiPSC присутствует в качестве перспективного источника клеток для лечения пациентов с использованием персонализированной терапии клеток, так как фибробласты (например, из кожи), могут быть получены из конкретного индивидуума. Decellularised сосудистой системы в данном протоколе обеспечивает более Биомиметические модель, которая предоставляет сеяных клетки с extracellulAR белковая матрица, которая более репрезентативная, что родного аорты 11. Эти ключевые моменты имеют решающее значение для обеспечения выживания, дифференцировки и функциональность семенами клеток и тканей инженерии сосудов после этого. Недавнее исследование, проведенное Sumitran-Holgersson и коллег продемонстрировали успешное заселение ранее decellularized illiac шунта у умершего лица до приживления 27, таким образом, постулируя поступательной текущего протокола в людей в ближайшем будущем. Кроме того, decellularized трансплантаты сосудов могут представлять собой хорошую модель, в которой могут быть оценены роль и поведение других типов клеток сосудов, что также способствуют тканевой инженерии трансплантатов. Эта модель системы у мышей может обеспечить мощный инструмент для дальнейшего скрининга лекарственных средств, а также в выяснении клеточных и молекулярных механизмов, участвующих в биологии сосудов стволовых клеток. Взятые вместе, ток протокол имеет перспективное значение для его применения в Vascулар инженерно ткани и прорыв в персонализированной медицины.
Раскрытие информации
Авторы не имеют противоречивые финансовые интересы.
Благодарности
This work was supported by The British Heart Foundation and The Oak Foundation.
Материалы
| Name | Company | Catalog Number | Comments |
| Human Fibroblasts CCL-153 | ATCC | CCL-153 | Prenatal human embryonic fibroblasts |
| ATCC F-12K Medium (Kaighn's Modification of Ham's F-12 Medium) | ATCC | 30-2004 | |
| Fetal Bovine Serum | ATCC | 30-2020 | |
| Knockout DMEM medium optimized for embryonic stem cells | Life technologies (Gibco) | 12660-012 | |
| Knockout Serum Replacement | Life technologies (Invitrogen) | 10828-028 | |
| Human Basic FGF-2 | Miltenyi Biotech | 130-093-837 | |
| alpha-MEM medium | Life technologies (Invitrogen) | 32571093 | |
| Human PDGF | R&D System | 120-HD-001 | |
| Gelatin Solution 2% | Sigma | G1393 | |
| Plasmid 20866: pCAG2LMKOSimO (SOX2, OCT4, KLF4, C-MYC) | Addgene | 20866 | |
| PvuI Restriction Enzyme | New England Biolabs | RO150S | |
| SureClean Plus | Bioline | BIO-37047 | |
| Nucelofection Kit (NHDF Kit) | LONZA | VPD-1001 | |
| Neomycin | SIGMA | G418 | |
| KL 1500 LCD, Illumination for Stereo Microscopy | SCHOTT | KL 1500 LCD | Cold light illumination for stereo microscopy |
| Nikon Zoom Steromicroscope SMZ800 | Nikon | SMZ800 | |
| Heparin sodium salt | Sigma | H3393 | |
| 10% SDS Stock Solution Molecular Biology Reagent | Severn Biotech | CAS 151-21-3 | |
| Dulbecco's Phosphate Buffered Saline | Sigma | D8537 | |
| Matrigel (10mg/ml) | BD | A6661 | |
| Shaker IKA Vibrax with Shaking platform VX 7 | Jepson Bolton's, Janke&Kunkel | S32-102 | |
| Masterflex L/S Digital Pump Drive | Cole-Parmer | WZ-07523-80 | |
| Masterflex L/S 6-channel, 6-roller cartridge pump head | Cole-Parmer | EW-07519-15 | |
| Masterflex L/S large cartridges for pump head | Cole-Parmer | EW-07519-75 | |
| Masterflex platinum-cured silicone pump tubing, L/S 14, 25 ft | Cole-Parmer | WZ-96410-14 | Tubing goes through the peristaltic pump |
| 0.5mm ID, 0.8 mm OD Silicone Tubing | SILEX | N/A | Tubings connect incubation chamber, media reservoir and compliance chamber |
| Fitting Reducer 0.5 to 1.6, natural Polypropyline | Ibidi | 10829 | Adapter connect above two types of tubings |
| 1/32" Tubing, ID 0.01" (250µm) Material: PEEK | LabSmith | T-132-010P | Tubing through the incubation chamber wall which connects the graft with outside tubing |
| One-Piece Fittings | LabSmith | T-132-100 | Fix the above tubings through the incubation chamber wall |
| Nylon tubes (OD 0.9mm, ID 0.75mm) | Smiths Medical | N/A | Tubings insert into two ends of the aorta graft |
| NOD.CB17-Prkdcscid/NcrCrl mouse | Charles River | ||
| Surgical sutures, 8-0 silk | ETHICON | W819 | |
| Hypnorm | Vetapharm | Vm21757/4000 | Neuroleptanalgesic for use in mice |
| Hypnovel (Midazolam) | Roche | 59467-70-8 | Induction of anaesthesia |
| Dissecting microscope | Carl Zeiss | Stemi 2000 | |
| Nylon Tubing | Portex LTD | 800/200/100/200 | 0.65 mm in diameter and 1 mm in length; to make artery cuff |
| Electrocoagulator | Martin | SN 54.131 | Ligation of artery branches on aorta |
| Bipolar micro hemostat forceps | Martin | 80-91-12-04 | Fixation of vessel ends |
| Vessel Dilator | S&T | JFX-7 | |
| Vessel Dilator | S&T | JFL-3dZ | |
| Vessel Dilator | S&T | D-5aZ | |
| Mini applier | AESCULAP | FE572K | |
| Micro hemostats clips | AESCULAP | FE720K | |
| Surgical sutures, 6-0 VICRYL | ETHICON | V489 |
Ссылки
- Kurobe, H., Maxfield, M. W., Breuer, C. K., Shinoka, T. Concise Review: Tissue-Engineered Vascular Grafts for Cardiac Surgery: Past, Present, and Future. Stem Cells Transl Med. 1 (7), 566-571 (2012).
- Jonas, R. A., Freed, M. D., Mayer, J. E. Long-term follow-up of patients with synthetic right heart conduits. Circulation. 72, II77-II83 (1985).
- Heureux, N., et al. Technology insight: the evolution of tissue-engineered vascular grafts-from research to clinical practice. Nat Clin Pract Cardiovasc Med. 4, 389-395 (2007).
- Zhang, W. J., Liu, W., Cui, L., Cao, Y. Tissue engineering of blood vessel. J Cell Mol Med. 11, 945-957 (2007).
- Cearbhaill, E. D., et al. Response of mesenchymal stem cells to the biomechanical environment of the endothelium on a flexible tubular silicone substrate. Biomaterials. 29, 1610-1619 (2008).
- Gong, Z., Niklason, L. E. Small-diameter human vessel wall engineered from bone marrow-derived mesenchymal stem cells (hMSCs). FASEB J. 22, 1635-1648 (2008).
- Wong, M. M., et al. Over-expression of HSP47 augments mouse embryonic stem cell smooth muscle differentiation and chemotaxis. PLoS One. 9 (1), e86118 (2014).
- Park, S. W., et al. Efficient differentiation of human pluripotent stem cells into functional CD34+ progenitor cells by combined modulation of the MEK/ERK and BMP4 signaling pathways. Blood. 116, 5762-5772 (2010).
- Samuel, R., et al. Generation of functionally competent and durable engineered blood vessels from human induced pluripotent stem cells. Proc Natl Acad Sci USA. 110, 12774-12779 (2013).
- Margariti, A., et al. Reprogramming of fibroblasts into endothelial cells capacble of angiogenesis and reendothelialization in tissue-engineered vessels. Proc Natl Acad Sci USA. 109, 13793-13798 (2012).
- Karamariti, E., et al. Smooth muscle cells differentiated from reprogrammed embryonic lung fibroblasts through DKK3 signaling are potent for tissue engineering of vascular grafts. Circ Res. 112, 1433-1443 (2013).
- Udelsman, B., et al. Development of an operator-independent method for seeding tissue-engineered vascular grafts. Tissue Eng Part C Methods. 17 (7), 731-736 (2011).
- Cearbhaill, E. D., Murphy, M., Barry, F., McHugh, P. E., Barron, V. Behavior of human mesenchymal stem cells in fibrin-based vascular tissue engineering constructs. Ann Biomed Eng. 38 (3), 649-657 (2010).
- Wong, M. M., et al. Macrophages control vascular stem/progenitor cell plasticity through tumor necrosis factor-α-mediated nuclear factor-κB activation. Arterioscler Thromb Vasc Biol. 34 (3), 635-643 (2014).
- Wong, M. M., et al. Sirolimus stimulates vascular stem/progenitor cell migration and differentiation into smooth muscle cells via epidermal growth factor receptor/extracellular signal-regulated kinase/β-catenin signaling pathway. Arterioscler Thromb Vasc Biol. 33 (10), 2397-2406 (2013).
- Lee, J., Cuddihy, M. J., Kotov, N. A. Three-dimensional cell culture matrices: State of the art. Tissue Eng Part B Rev. 14, 61-86 (2008).
- Hung, H. S., Hsu, S. H. Current Advances of stem cell-based approaches to tissue-engineering vascular grafts. OA Tissue Engineering. 1 (1), 2 (2013).
- Quint, C., et al. Decellularized tissue-engineered blood vessel as an arterial conduit. Proc Natl Acad Sci USA. 108 (22), 9214-9219 (2011).
- Zhang, X., Xu, Y., Thomas, V., Bellis, S. L., Vohra, Y. K. Engineering an antiplatelet adhesion layer on an electrospun scaffold using porcine endothelial progenitor cells. J Biomed Mater Res A. 97 (2), 145-151 (2011).
- Hibino, N., et al. Evaluation of the use of an induced puripotent stem cell sheet for the construction of tissue-engineered vascular grafts. J Thorac Cardiovasc Surg. 143 (3), 696-703 (2012).
- Zhao, J., et al. A novel strategy to engineer small-diameter vascular grafts from marrow-derived mesenchymal stem cells. Artif Organs. 36 (1), 93-101 (2012).
- Tsai, T., et al. Contribution of stem cells to neointimal formation of decellularized vessel grafts in a novel mouse model. Am J Pathol. 181 (1), 362-373 (2012).
- Kasimir, M. T., et al. Comparison of different decellularization procedures of porcine heart valves. Int J Artif Organs. 26 (5), 421-427 (2003).
- Stephenson, E., et al. Derivation and propagation of human embryonic stem cell lines from frozen embryos in an animal product-free environment. Nature Protocols. 7, 1366-1381 (2012).
- Takahashi, K., Okita, K., Nakagawa, M., Yamanaka, S. Induction of pluripotent stem cells from fibroblast cultures. Nature Protocols. 2, 3081-3089 (2007).
- McCall, F. C., et al. Myocardial infarction and intramyocardial injection models in swine. Nature Protocols. 7, 1479-1496 (2012).
- Olausson, M., et al. Transplantation of an allogeneic vein bioengineered with autologous stem cells: a proof-of-concept study. Lancet. 380 (9838), 230-237 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены