Method Article
İnce tabaka kromatografi (TLC) Ayırımı ve bitki özleri Biyodenemeler Antimikrobiyal Bileşikler tanımak
Bu Makalede
Özet
Yöntem bitki özleri, ince katman kromatografisi (TLC) ile ayırma antibakteriyel metabolitlerin tespit etmek için iletişim bioautography açıklanmaktadır. Yöntem sığır işkembe için yerel aşırı amonyak üreten bakteri (HAB) inhibe kırmızı yonca fenolik bileşiklerin taranması uygulanır.
Özet
Bitki antimikrobiyal bileşikler için ortak bir elek (örneğin, bakteri veya mantarların suyu içinde veya agar), mikroplar için zaman büyümeye izin veren mikrobiyal süspansiyonlar için kromatogramlar maruz bırakılması, kağıt ya da ince-tabaka kromatografisi (PC veya TLC) ile ayırma bitki özleri oluşmaktadır nemli bir ortam, ve mikrobik büyüme bölgeleri görselleştirme. Bioautography olarak bilinen bu tarama yönteminin, etkinliği, kromatografik ayırma kalitesi ve mikrobiyal kültür koşulları ile alınan bakım hem de bağlıdır. Bu kağıt asit fermente bakterileri amino yeni bir uygulama ile TLC ve temas bioautography için standart protokoller açıklanmaktadır. Ekstre esnek (alüminyum destekli), silika TLC plakaları üzerinde ayrılmış ve bantlar ultraviyole (UV) ışık altında görselleştirilebilir. Bölgeleri Test mikroorganizma ile aşılanmış agar üzerine kesilmiş ve yüzü aşağı inkübe edilir. İnhibitör grupları agar plaka lekeleme ile görselleştirildis ile tetrazolyum kırmızı. Yöntem, kırmızı yonca ayrılmasından (Trifolium pratense ev. Kenland) fenolik bileşikler ve Clostridium sticklandii, sığır işkembe özgüdür bir hiper amonyak üreten bir bakterinin (HAB) karşı aktivite için, bunların yapılan tarama uygulanır. TLC yöntemleri (aerobik veya anaerobik), hem de mantar bitki özleri ve diğer bakteri türleri arasında, çok çeşitli kültür koşulları için geçerlidir türün büyüme gereklerine uyacak şekilde tadil edilmiş halinde, test organizmalarının olarak kullanılabilir.
Giriş
Bitkilerde antimikrobiyal bileşikler için tahlil, bir bitki ekstraktı bileşenlerinin ayrılması ve bu bileşenlerin, bir test mikroorganizmanın maruz bırakılması, ve mikroorganizmaların büyüme bileşiklerin herhangi biri ile inhibe olup olmadığının belirlenmesini gerektirir. Birçok bileşik düzlemsel bir yüzeye ayrılabilir, çünkü kağıt veya ince tabakalı kromatografi (PC veya TLC) ile Separations uygundur. Ayırma bazı bileşikler, adsorban (PC durumunda selüloz, ve TLC durumunda adsorbanların çeşitli) sıkıca bağlanması ve diğerlerine 1 daha az geçirme ile, polarite dayanmaktadır. Şekil 1, göreli pozisyonlarının bir örnek teşkil silis TLC plakası üzerinde ayrılmasından sonra, polar ve polar olmayan fenolik bileşikler.
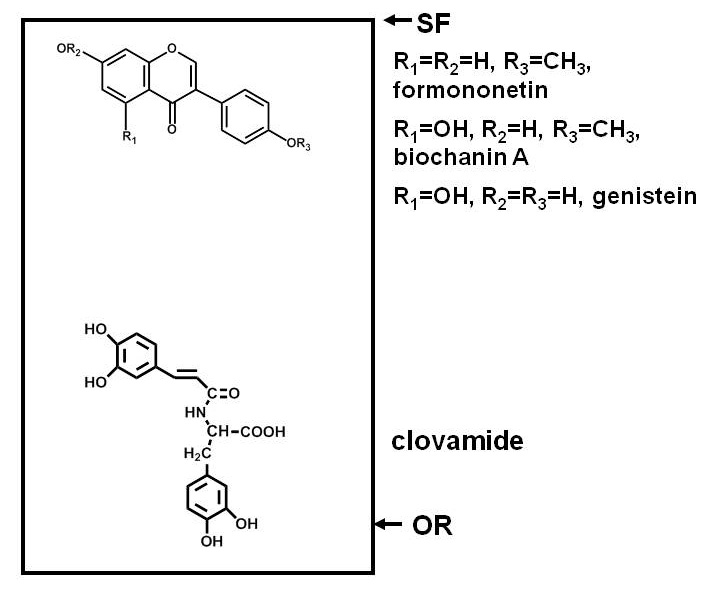
Şekil 1. Bir silika ince tabakalı kromatografi (TLC) üzerinde plaka ayrıldıktan sonra farklı polariteye sahip bileşiklerin dağılımı gösteren bir diyagramdır. Kırmızı yonca (Trifolium pratense L.) fenolik bileşikler, bir örnek olarak kullanılmaktadır. Örneğin clovamide gibi Polar bileşikler, silika gibi bir polar adsorban için güçlü bir afiniteye sahip ve kökeni (OR) yakın devam ederken böyle bir çözücü önünde yakınındaki üç izoflavon (SF), bölme daha kolay çözücü içine daha az polar bileşikler, (su, asitler, bazlar ya da içerdiği sürece, silika daha az polar olan) ve daha uzak plaka yukarı göç ederler.
Bir TLC plakası üzerinde bir ekstresinin ayrılmasından sonra, deney mikroorganizmalar bu nedenle bir özü 2'nin aktif bileşenlerinin tanımlanmasını hız, plaka üzerinde tüm bileşiklere maruz kalabilir. , Bir mantar ya da bakteri kültürü kromatogramında maruz kalırsa, mikrobiyal büyüme büyüme inhibitörü olan alanlarda dışında her yerde ortaya çıkary bileşikler yer alır. Engel bölgeleri daha sonra mantar 3 uygulanmış olması halinde miselial büyüme ve büyüme içermeyen alanlar arasındaki kontrast gözlemleyerek ya da canlı hücreler 4 azaltılabilir ya da hidrolize edilmiş renk değiştiren bileşiklerle püskürtme ile görselleştirilebilir. Antimikrobiyal tahliller için kağıt veya ince tabakalı kromatogramların kullanımı ilk antibiyotik 5 ve mantar öldürücüler 3,6 uygulandı, ancak, bitki ekstreleri, sık sık bioautography olarak adlandırılan bu yöntemle antimikrobiyal bileşikler için taranmaktadır. Bu buluşta tarif edilen protokoller, ince tabakalı kromatogramların bioautography için de geçerlidir. Nispeten hızlıdır ve farklı adsorban (örneğin, silika, nişasta, alümina), hem de iyi bir çözünürlük ve hassasiyeti 1 sağlanması gerçekleştirilebilir, çünkü TLC yaygın olarak kullanılmaktadır.
Bitki özleri birçok yönden TLC için hazırlanabilir. Yaygın yöntemler ALC açılan bitki materyali içerirörneğin muhtemelen bir asit veya baz 9 eklenmesiyle% 80 etanol 7,8 yanı ohol-su karışımları. Bir minimal hacimde TLC plakalarına tatbik edilebilir, böylece bir miktar su içerir ve muhtemelen, asidik veya bazik olan bu gibi çözgenler içinde, bir ekstre edilmesinden sonra, ekstreler konsantre edilmelidir. Alkol-su özleri konsantrasyonu, su ile karışmayan bir organik çözücü 8 ile ya da etil asetat-etil eter (1:1, v / v) 10,11 gibi çözücülerin bir karışımı ile bölünmesi ile elde edilebilir. Farklı bitki metabolitleri, kutupları bağlı olarak, farklı bir organik çözücü içine ekstre edilmektedir. Bu bitki, organik asitler ya da bazlar, bu aşamada, organik çözücüler ile ekstre emin olmak için, bir alkol-su ekstrenin pH yükseltilmiş veya daha sonra da nondissociated formları haline ayrışmış analitlerin dönüştürmek için bir suda çözünür bir asit veya baz ile düşürülebilir nötr organik çözücü 9 çözünür. Organik faz daha sonra e olabilir,indirgenmiş basınç altında ya da azot altında vaporated ve TLC için istenen hacme ayarlanabilir. Ekstrenin pH nötr solventler, küçük bir nihai hacme, önceki ayırma TLC plakası üzerinde ekstraktın buharlaştırılması içine analitlerin bölünmesi nedeniyle biyolojik tayin mikroorganizmalar için öldürücü olması pek mümkün değildir.
Mantar ve bakteri her ikisi de 2, bitki ekstrelerinin bioautography test mikroorganizmalar gibi kullanılır. Bir besleyici çözelti içinde plakalar üzerine püskürtülür ve birkaç gün 3 boyunca nemli bir ortamda inkübe bu tür Cladosporium cucumerinum gibi bazı mantarlar, sporları, (ayrı önleyici bileşikler ile alanlardan) TLC plakalar üzerinde filizlenmesi. C. karanlık miselyum noninhibitory bölgeler üzerinde cucumerinum misel büyüme serbest bölgelere keskin bir kontrast sağlar. Bakteriler ile aynı şekilde 4,12 ince tabakalı kromatografi (TLC) plakaları uygulanmış olsa da, bakteriler, TLC üzerinde dökülüragar plaka yüzeyleri 13,14 bindirmeleri. Örneğin Candida albicans gibi maya, hem de 14 agar kaplamalar olarak uygulanabilir. Seçenek olarak ise, TLC levhaları, bakteri ya da maya 8 10,15, kontak bioautography 2 olarak bilinen bir yöntem ile aşılanmış agar üzerine yüzü aşağı yerleştirilebilir.
Bu, kırmızı yonca (Trifolium pratense ev. Kenland) için antimikrobiyal fenolik bileşiklerin taranması için temas bioautography için bir yöntem tarif eder. Test mikroorganizma Clostridium sticklandii, bir rumen hiper amonyak üreten bakteri (HAB) ve anaerob zorunlu olduğunu. Kullanılan ayırma ekstrenin tüm bileşenlerini gidermek de, böylece olası antimikrobiyal bileşiklerin havuz daralma, antimikrobiyal aktivite bölgelerin belirlenmesini kolaylaştırır. Protokol TLC 1 için standart yöntemler kullanmaktadır. Bu protokol, aynı zamanda kültür obli için gerekli olan bazı teknikler açıklanmaktadırBöyle bir tahlil için kapı anaeroblar canlı hücreler 2,4 lekeleyen bir tetrazolyum tuzu ile temas bioautography 15 ve bir görselleştirme yöntemi, bir kullanım.
Protokol
1.. Bitki Özü hazırlanması
- Pratense cv fenolik bileşiklerin çıkarılması için Kağan ve Flythe 10 Bkz. Kenland.
- Diğer bitkilerde diğer bileşikler ayıklamak için, (pek tarif edilir) bitki veya metaboliti özel ekstraksiyon yöntemleri için fitokimyasal analizi literatürü kontrol veya geniş birçok bileşikleri izole böyle Khurram ve ark. 7,8 olanlar gibi protokoller için bakmak kutuplulukların aralığı.
2. İnce tabaka levhası hazırlanması
- Uzak gelişim bölgesinden adsorbe kirletici maddelerin hareket ettirmek amacıyla, bir veya daha fazla polar nötr çözücü maddeler içinde geliştirerek temiz TLC plakaları.
- Bir duman başlığı içinde, yeterli temizlik çözücü hazırlanması (etil asetat-metanol 2:1, örneğin 15-100 ml, v / v) TLC gelişmekte olan odasının alt, hem de bir TLC levhasının alt kenarı grubu kapsayacak odasının içine.
- Ticari ürünler kullanınlikle mevcut cam TLC veya folyo kaplı Pyrex kaplardan ya da konserve kavanozu (kapaklı mevcut farklı boyutlarda,) odaları gelişmekte.
- Alüminyum-ya da mevcut gelişmekte odasını uygun, çeşitli boyutlarda (20 cm x 20 cm ve daha küçük) gelip plastik destekli (esnek) silika jel plakaları kesmek için makas kullanın. (Dikkat:. Silis solunması halinde bir davlumbaz çalışın akciğer hasarına neden ve silis üzerine deri yağlarını önlemek için eldiven ile TLC plakaları işleyebilir.)
- Odası duvarlarına yaslanmış üstleri ile, bölmenin içine plakaları yerleştirin. Plakalar birbirine temas etmemelidir. Bölmesi kapağı ve çözücü kılcal eylem tarafından plakasını yukarı hareket edelim.
- Solvent levhaların üst ulaştığı zaman, odasından plakaları kaldırmak ve çözücü buharlaştırıldı kadar çeker ocak içinde bir ayakta durma konumunda düzenlemek.
- Kirlilikler görünür altında sarı bir bant bakarak TLC plakasının üstüne yakın göç olmadığını görmek için kontrol edinışık, veya ultraviyole altında floresan bant (UV) ışık (Şekil 2B "kirlilik ön" veya IF bakınız). Levhanın çoğunluğu yine sarımsı bir renk varsa, temizleme işlemini tekrarlayın.
- Odasından TLC plakaları ayrılmasından sonra, çözücü atın. Bakiye solvent Protokolü 2 odacığı kullanılarak önce tamamen buharlaşmasına izin verin.
- Bir 20 cm x 20 cm plaka, ve x 10 cm plakalar 7 cm boyunca 5 dakika boyunca silis 16 üzerinde bileşiklerin göç etkileyebilir kalan nemi çıkarmak için 100 ° C'de bir kurutma fırınında dik destek plakaları (10-15 min .)
- 100 ° C kurutma fırını kullanılabilir durumda değilse, daha düşük sıcaklıklarda (60 ° C 'de, yani 40 dakika) daha uzun bir süre için bir ısı plakalar.
- Plakalar kuruduktan sonra, yüklemeden önce çevre sıcaklığına soğumaya bırakın.
3. Özü Ayrılık için Chambers geliştirilmesi hazırlanması
- Biraz kamara yükseklikten aşağıda filtre bir parça kağıt, ve genişliği yaklaşık yarım kamara çevresini kesmek için makas kullanın. Bu kağıt, böylece ayırımlar 1 çoğaltılabilmesini iyileştirilmesi, bölme duvar solvent ve solvent buharları ile odasını doyurmak çizmek için bir fitil gibi davranır.
- Bir duman başlığı içinde, çözücü (bu çalışma için etil asetat-metanol 04:01, v / v) karışımı. Odacık içine dökün ve çözücü karışımı kapsamaktadır. Tüm fitil çözücü ile ıslak kadar odasına tabak koymak, oda doygunluk belirten bekleyin.
4. TLC Plakaların yükleme ve Geliştirme
- Hafifçe kalemle kökeni işaretleyin. TLC plakası emen yumuşak ve kolay zarar ise, kenarlarda işaretleri yapmak. Bileşikler plakaları TLC haznesine eklenir gelişmekte çözücünün yüzeyi üzerinde olmalıdır.
- Yerine bulanık bir konsantre çözelti olması için yeterli organik çözücü (bu durumda, metanol) içerisinde özü çözülürsüspansiyon.
- Plakanın yüzüne bir 1 cm sınır bırakarak bir mikrolitre şırınga ya da kılcal mikropipetler ile dar şeritler halinde yük numuneleri ve standartları,. Bantları (davlumbaz plaka havalandırarak ya da yükleme olur) kurumasını bekleyin.
- Örnek daha büyük bir konsantrasyon kurutuldu, bantlar yeniden yükleme örnekleri bir plaka, "overspot" ile ilgili gerekli ise.
- Forseps ya da maşa ile, doymuş TLC odasının içine plaka (lar) ayarlayın. Bu nedenle bileşiğin göç yolunu değiştiren, temas noktalarında plakalara solvent sağlayabilir, çünkü levhalar fitil temas etmemelidir. Bölmesi kapağı ve plakalar geliştirmeye izin.
5. Biyolojik deney için Plakaların hazırlanması
- Çözücü, ön plakasının üstüne ulaşmadan TLC tankı plakasını (ler) çıkarın ve bir kalem ile çözücü ön yüksekliğini işaretleyiniz. Davlumbaz plaka kurumasını bekleyin.
- Ge olan aynı TLC odası, herhangi bir geri kalan TLC plakaları geliştirilmesitutulması halinde bir gün boyunca Ekseriyetle kullanılabilir kapatıldı. Odacık içinde çözücünün miktarı azalır, özellikle eğer TLC bölmesi için çözücü karışımı versiyonu.
- Plakalar kuru sonra, görünür veya UV ışık altında bantları görselleştirmek, ve bir kalem ile bantları tasvir. Lamba 254 nm (kısa dalga UV) ve 365 nm (uzun dalga UV) hem de eden bileşikleri tespit edebilir, özellikle de bir taşınabilir bir UV lambası ile bir görüntüleme odası, uygundur.
Not: Bu noktada, ya da bir sonraki aşamada sonra, plakalar folyo ile kaplanmış, plastik sargı sarılmış olabilir ve -20 ° C'de saklanır Maksimum saklama süresi bileşik istikrar bağlıdır. Silika nötr değildir, çünkü bazı bileşikler TLC plakası üzerinde süre düşebilir. - Plakaları fotoğraf veya çizin.
- Havai UV ve / veya görünür ışıkları ile donatılmış bir varsa bir jel biyomikroskop sistemi kullanın.
- Hiçbir ticari biyomikroskop sistemi varsa, bir kutu içinde fotoğraf plakaları wi, karanlık bir kağıt veya bezle kaplıBir tripod üzerinde kamera seti ve taşınabilir UV ışığı inci 17 durmak bir halka kenetlenir. Hiçbir floresan göstergesi var tabak fotoğrafı çekerken, bant görünümünü 17 iyileştirmek için kamera lensi üzerinde bir mavi ışık filtresi kullanın.
- , Bantlar karakterize yardımcı bileşiği ve solvent ön tarafından seyahat mesafe ölçme ve ikinci (Şekil 2A) ile önceki bölünerek tutma faktörü (Rf) değerlerini hesaplamak için.
6. Bakteri kültürü ve Deneyi
- Hazırlayın ve anaerobik koşullarda ortamı aşılamak. Bu durumda kullanılan kültür James B. Russell, Cornell University, Ithaca, NY kültür koleksiyonundan elde edildi Clostridium sticklandii soyu SR oldu.
- Flythe ve Kagan 13 ve HAB medya açıklaması için malzeme listesine bakınız.
- Üslü veya sabit faza kültür büyütün. Steril anaerobik techniqu kullanınes anaerobik mikroorganizmalar ile çalışırken.
- En az 60 ° C'ye düşmüştür agar (a / h% 0.75) sıcaklığından sonra erimiş agar içine (% 1 v / v) kültürü inoküle İyice karıştırın ve hemen dökmek için (HAB medya için% 95 CO 2 -5% H 2 atmosfer) bir anaerobik odasına getirmek.
- 15 mm x 100 mm plastik Petri kapları içine dökün ve katılaşmaya izin.
- Makas ile, ilgi konusu grup (lar) ihtiva eden bölgeye TLC plaka kesti. Bantları TLC plakası üzerinde orijinal yönü izlemek için plaka desteğinde bantları işaretleme, agar plakaları üzerine yüz aşağı yatıyordu. Bir kontrol olarak agar plaka üzerine kullanılmayan bir TLC şeridi yatıyordu.
- Agar, aşağı tarafı ağar, anaerobik odasındaki (24 saat, 39 ° C) inkübe.
7. Biyoanaliz Agar Plakaların Görselleştirme
- Anaerobik odası içinde iken forseps ile, agar levhalarından bantları çıkarın.
- % 1 ekleme (w / v) tesu içinde hazırlanabilir trazolium kırmızı, agar plakalarının yüzeyleri üzerine damla damla eklenir. Kontrol plakası, anaerobik bölmeden çıkarmadan önce, tam olarak kırmızı olana kadar renk en az 20 dakika boyunca geliştirmek ya da izin verir. Anaerobik bakteri hemen havasız odadan çıkarıldıktan sonra canlılığı kaybetmeye başlar, ancak renk fazla 24 saat boyunca stabildir.
- Görünür ışık altında fotoğraf.
Sonuçlar
Kırmızı yonca (Trifolium pratense ev. Kenland) ekstreler fenolik bileşikleri ihtiva eden, temsili silis TLC ayrımı, Şekil 2 'de gösterilmiştir. Etil asetat-heksan içinde kırmızı yonca özütünün ayrılması (9:1, v / v), 8.5 cm den fazla, beş bantları, tam olarak kökenli çözülmüş bir (Şekil 2A) ile sonuçlanmıştır. Bununla birlikte, Şekil 2B, kırmızı yonca özütü (aynı çeşidinden, ancak aynı çiftlikte ayrı bir arsa yetiştirilen) farklı bir numune daha büyük bir mesafe üzerinde ayrıldı (15 cm yerine zaman yaklaşık iki kat daha fazla olduğunu ortaya bantları gösterir 8,5 cm) ve farklı çözücü sistemlerinde iki ardışık gelişmeler. Şekil 2B'de kromatogramı (9:1, v / v), ve daha sonra kurumaya bırakıldı ve etil asetat-metanol içinde ayrılmış, etil asetat-heksan içinde ilk geliştirilmiştir (78:22, v / v). Bu sonuçlar göstermektedir ki, bir çözücü sistemi (ya da çözücü s dizi plaka boyutu ve hem de bir seçimystems) bir kromatogram üzerinde ayrılır bileşiklerin sayısını etkileyebilir. Bu özel durumda, elüsyon ve aynı özlerinin TLC ayrımı diğer gruplar da yüksek performanslı sıvı kromatografisi (HPLC) kökeni veya yakınında kalan bileşikler öncelikle polar yarımına konjüge edilmiş fenolik bileşikler (fenolik asitler ya da izoflavonlar) oluşuyordu doğruladı amino asit türevleri, şekerler ya da malik asit gibi. Bunun aksine, polar yarımına konjüge edilmiş değildir izoflavon uzak TLC plakaları 10 yukarı göç etti.
Clostridium sticklandii, bir rumen hiper amonyak üreten bakteri (HAB), Şekil 2A'da gösterilen TLC plakasının bir biyo-deney sonuçları Şekil 3'te gösterilmiştir. Canlı hücreler boyandı zaman (a / h), 24 saat kuluçkadan sonra agar plakalarına tetrazolyum kırmızı sulu bir çözelti, parlak kırmızı renkli sonuçlanan bir% 1 ekleme. Bant 1 inkübasyonu (A biokanin) ve ba parçasınd-2 bakteri tohumlu agar üzerinde (formononetin) inhibisyonu iyi tanımlanmış bir bölge (Şekil 3A) ile sonuçlanmıştır. Bununla birlikte, şeritler 3 ve 4 ile birlikte bant 2'nin kalan inkübasyonu, bakteri büyümesi (Şekil 3B) önlemedi. Bu sonuçlar, biokanin A C'ye önleyici olduğunu gösterdi sticklandii büyümesi, fakat formononetin değildi.
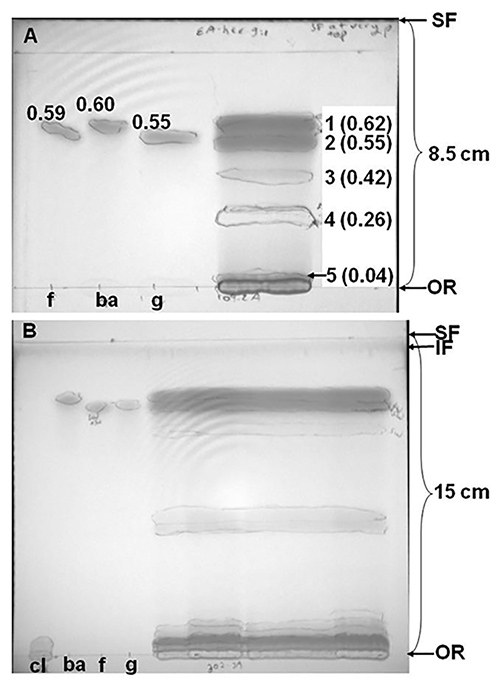
Pratense cv özü Şekil 2.. Silika ince tabaka kromatografik (TLC) ayırımları. Aynı çözücü (78:22, v / v). Mesafe göre göç eden, etil asetat-metanol içinde geliştirilmesi yolu ile takip ettiği (A), etil asetat-heksan (9:1, v / v) ya da (B) geliştirilmiştir Kenland, Kalkış (OR) ve solvent ön (SF) arasındaki çözücü yakın belirtilirBu iki sınır arasında parantez. Şekil 2B, "yabancı madde önünde" ise (IF, yabancı maddelerin yer polar çözücüler içinde ön yıkama ile plaka taşındı), plakanın üst tarafında koyu bir bant olarak görülmektedir. 180-250 mg dondurularak kurutulmuş bir kırmızı yonca yaprakları ve sapları hazırlanan ekstreler, metanol içinde çözündürüldü ve özü (A) ya da% 32 (B)% 10 silika plakaları üzerine yüklenmiştir. Standartlar yüklü A (BA, 7.4 nmol), biokanin, (f, 7.1 nmol) formononetin edildi, genistein (g, 9.8 nmol) ve clovamide (Cl, Şekil 2B, sadece 8.7 nmol). 254 nm (kısa dalga UV) ve 365 nm (uzun dalga UV) de bir el UV lamba altında görürken bantları çember. Bir dijital fotoğraf makinesi, kısa dalga UV altında plaka fotoğraflamak için kullanılmıştır. Şekil 2A yonca özü bantları bölgelere bakın sağındaki sayılar biyoanalizlere için biçilmiş kaftan. Tutma faktörler (R f mesafe traveleSF ile seyahat bant / mesafe) tarafından d Şekil 2A bant sayılardan sonra parantez içinde gösterilmiştir.

Şekil 3,. (A) grubu 1 ve Şekil 2A, ve (B) gruplarından aynı TLC plakasından 2-4 TLC plakasından bant 2'nin tam olarak çözülmesi üst kısmının TLC plakası Biyo-Analiz Sonuçları. Gruplar yüzü aşağı atılmıştır HAB orta Clostridium sticklandii ile aşılanır ve 39 ° C'de anaerobik olarak 24 saat süre ile inkubasyona üzerine Bu kuluçka süresinin sonunda, bantlar çıkarıldı ve agar plakalar% 1 sulu çözeltisi (w / v) tetrazolium kırmızı ve görünür ışık altında fotoğraflandı ile boyandı.
Tartışmalar
Bu protokol bileşikler alt-grup halinde bir özü ayrılması ve kontakt bioautography ile bu alt kümeleri test etmek için basit bir yöntem tarif etmektedir. Yöntem, belsoğukluğu neden olan bakteriler için inhibitör bitki metabolitleri için ekrana Chomnawang ve ark. 15 tarafından kullanılan birine oldukça benzer. Antimikrobiyal bitkisel bileşikler için ekrana kullanılan bioautography tipi testi mikroorganizma, laboratuar kurulumu ve biyodeney gerçekleştiren kişi (ler) tercihlerine dahil olmak üzere birçok faktöre bağlıdır. İletişim bioautography, bu çalışmada kullanılan yöntem, aşılanmış ortam 12 içine nüfuz bir bileşiğin yeteneğine bağlı için eleştirilmiştir. Büyüme difüzatı aşağıdaki agar oluşursa, düşük konsantrasyonlarda bileşikler üzerinde inhibisyon veya ortam içine nüfuz az yeteneği olan zonları, tespit olmayabilir. Ayrıca, bir grup tarafından oluşturulan inhibisyon zonu Grubun ilk ötesine yayılabilirsınırlar, böylece muhtemelen komşu bileşik 14 tarafından oluşturulan inhibisyon bölgeleri maskeleme. Bununla birlikte, temas bioautography kullanımı kolay bir yöntemdir ve Petri plakaları yığın yeteneği gerekli alan miktarını en aza indirir. Buna ek olarak, ağar üzerine TLC bantları döşeme bant çözünme ve bir TLC plakası aşılanmış agar ile kaplanmış ya da test mikroorganizma ile püskürtüldüğü zaman bu oluşabilir yayılma riskini ortadan kaldırır.
Bioautography yukarıdaki türde bir bilgi elde kromatografik koşullar, deney mikroorganizma konsantrasyonu ve kültür / inkübasyon koşullarına bağlıdır. Antimikrobiyal bantları kromatografik çözünürlüğü vazgeçilmez değildir, ancak hassasiyet, iyi çözülmüş bant 6 için daha büyük olabilir. Gruplar 90 derece gelişmeden önce, bir TLC levhası çevirerek bir boyutu (Şekil 2B) ya da iki boyutlu olarak daha uzun levhalar üzerinde veya birden çok çözücü sistemlerinde geliştirilmesi yolu ile ayrılabilirikinci bir çözücü 16,19 içinde. Polar bileşikler, asitler ya da bazlar içeren çözücü karışımları kullanılarak silika üzerinde olmaksızın ayırmak zor olabilir. Asitlerin küçük miktarlarda kullanılmasıdır 14,15 rapor edilmiştir, ancak bu, test 12 mikroorganizma için öldürücü olabilir. Alternatif çözücü sistemleri bileşenleri 20,21 su veya metanol içerebilir. Polar bileşikler, aynı zamanda, 18 ° C bir adzorbent veya mikrokristalin selüloz ile kaplanmış plakalar olarak TLC plakaları, farklı türlerde çözülebilir. Ancak, büyüme 12 veya görselleştirme ajan 14 duyarlılık olumsuz bu adsorbanlarla bazı etkilenebilir.
Test mikroorganizma ve medya birçok farklı kombinasyonları bioautography için kullanılabilir. Mikroorganizma ve medya seçerken Ancak, çeşitli faktörler dikkate alınmalıdır. Medya tet azaltmak hiçbir bileşeni olduğunu belirlemek için test edilmelidirtuz razolium ve biyolojik olmayan renk değişimine neden olur. Agar da lekeli hücreler ve lekelenmemiş inhibisyon bölgeleri arasındaki kontrast sağlamak için yeterli hafif bir renk olmalıdır. Ancak agar yüzeyinde büyüyebilir mikroorganizmada TLC bant ile birlikte kaldırılır veya boyama sırasında kapalı yıkanabilir. Buna ek olarak, gaz üretimini en aza indirir mikroorganizma / orta kombinasyonunun seçimi, agar kabarcıklar azaltacaktır. Rumen HAB büyüme alt-tabaka olarak amino asitlerin ya da peptitlerin bir karışımı ile bir karbonat tamponlu, karbonhidrat içermeyen bir ortamda büyür. Agar plakaları hafif altın ve şeffaf. Ne C. sticklandii ortamda yetiştirilir, ürünlerin çoğu (uçucu yağlı asitler, amonyak) ile çözünebilir. Çok az gaz kabarcığı ile düzgün bir agar plakası ile sonuçlanan, üretilir.
Bu bioassay potansiyel uygulamaların bir çift var. Inhibisyon bölgesinin boyutu, kaba bir tahmin olarak da kullanılabilirönleyici bileşik miktarı, inhibitör bölge yarıçapına yana önlenmesini 17,22 neden olan bileşik miktarı logaritması ile orantılıdır. Belki TLC plakası biyoanalizlerin en yaygın kullanımı bir bitki ekstresi olası antimikrobiyal bileşiklerin aralığını daraltmak için. Inhibe edici bölgeler, bir biyo-deney ile tanımlanır sonra yinelenen bir TLC plakası üzerinde karşılık gelen bölgeleri, örneğin metanol veya etil asetat gibi bir çözücü ile elüt edilmiş ve biyolojik olarak aktif bileşikleri 10,14 karakterize başlatmak için ultraviyole spektroskopisi saptama için HPLC ile analiz edilebilir.
Açıklamalar
Makalede ticari isimleri veya ticari ürünlerinin anılmasının özel bilgi sağlama amacıyla sadece ve USDA tarafından tavsiye veya onaylandığı anlamına gelmez. Yazarlar herhangi bir mali çıkarı beyan.
Teşekkürler
Biz bize bu çalışma için onun kırmızı yonca parsellerden örnekleri kullanmak için izin için, merhum Dr Norm Taylor, Bölümü Bitki ve Kentucky Üniversitesi Toprak Bilimi teşekkür ederim. Bu proje Tarım Amerika Birleşik Devletleri Bakanlığı tarafından finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Silica F254 TLC plates, aluminum-backed, 0.2 mm thickness, 20 cm x 20 cm | EMD Chemicals | 5554/7 | These plates are coated with silica that contains an indicator fluorescing at 254 nm. Compounds absorbing at that wavelength appear dark on a fluorescent green background. Alternative sources include Analtech, Selecto Scientific, Fluka. Adsorbents other than silica may be needed. Plastic-backed plates may be suitable, depending on the solvents to be used. |
| Sharp, heavy-duty scissors | any sewing supply company | similar to Fiskars 175800-1002 | For cutting TLC plates. A paper cutter with a sharp blade can be used as well. Do not inhale silica dust. |
| Drying oven at 100 °C (mechanical convection) | Thermo Scientific | PR305225M | Quincy Lab, Inc, Chicago, IL (www.quincylab.com); Cascade Technical Sciences, Hillsboro, OR (www.cascadetek.com) |
| TLC chamber | Kimble Chase | 416180-0000 | Alternative sources: Aldrich. Pyrex beakers or preserving jars can be used for small plates (i.e. 5 cm x 10 cm). Cover with aluminum foil (jar lids may contain material extractable by solvent vapors). |
| 50 µl Syringe with flat needle tip | Hamilton | 80965 | For loading amounts of standard or sample exceeding 5-10 µl. Alternative sources are equivalent. |
| Micropipettes | Drummond | 2-000-001 | For loading small amounts of standards or samples. Alternative sources: VWR. Also, Pasteur pipets can be stretched to a thinner diameter with a butane torch. |
| Filter paper (#1 grade) | Whatman | 1001 917 | Serves as a chamber wick. Other grades of filter paper are OK. This size can be trimmed for the chambers holding 20 cm x 20 cm plates. |
| Beaker tongs | Fisher Scientific | 15-186 | For putting plates in and out of a large TLC chamber. Alternate sources: VWR |
| Flat-edge forceps | Fisher Scientific | 10-275 | For putting plates in and out of a small chamber. Alternate sources: VWR |
| Small portable UV lamp with 4 W or 6 W bulbs for short- and long-wave UV light illumination (254 and 365 nm, respectively) | Ultraviolet Products | 95-0271-01 | Alternate sources: Spectronics Corporation (www.spectroline.net) |
| Viewing cabinet for use with hand-held UV lamp | Ultraviolet Products | Chromato-Vue C-10E | UV-active bands are more easily circled if plates can be set in here. Alternate sources: Spectronics Corporation. |
| Photodocumentation system with overhead UV lamp and visible lamp | Kodak | Gel Logic 200 | Alternate sources: Ultraviolet Products (www.uvp.com). See protocol for homemade alternative. |
| Anaerobic Chamber, Type A, Vinyl | Coy | 7150000 | This chamber is appropriate for anaerobic bacteria, like Clostridium sticklandii, as described. However, growth conditions must be tailored to organism used in the assay. A biosafety cabinet and other precautions should be taken if pathogenic organisms are used. Alternate sources: Anaerobe Systems, BioRad, Plas Labs, others |
| Tetrazolium red | Sigma-Aldrich | T8877 | Alternate sources: MP Biomedicals, Santa Cruz Biotechnology, Alfa Aesar |
| Ingredients for HAB media | |||
| Pyridoxamine · 2HCl | Sigma-Aldrich | P9380 | For this and for all the other reagents in this table, alternative sources are equivalent. |
| Riboflavin | Sigma-Aldrich | R4500 | |
| Thiamine HCl | Sigma-Aldrich | T3902 | |
| Nicotinamide | Sigma-Aldrich | N3376 | |
| Calcium D-Pantothenate | Sigma-Aldrich | C8731 | |
| Lipoic Acid | Sigma-Aldrich | T5625 | |
| p-Aminobenzoic acid | Sigma-Aldrich | A9878 | |
| Folic acid | Sigma-Aldrich | F8798 | |
| Biotin | Sigma-Aldrich | B4639 | |
| Cobalamine | Sigma-Aldrich | C3607 | |
| Pyridoxal HCl | Sigma-Aldrich | P9130 | |
| Pyridoxine | Sigma-Aldrich | P5669 | |
| EDTA | Sigma-Aldrich | E6758 | |
| Iron sulfate · 7H2O | Sigma-Aldrich | F8263 | |
| Zinc sulfate · 7H2O | Sigma-Aldrich | Z0251 | |
| Manganese chloride · 4H2O | Sigma-Aldrich | M8054 | |
| Boric acid | Sigma-Aldrich | B6768 | |
| Cobalt chloride · 6H2O | Sigma-Aldrich | C8661 | |
| Copper chloride · 2H2O | Sigma-Aldrich | 459097 | |
| Nickel chloride · 6H2O | Sigma-Aldrich | 203866 | |
| Sodium molybdate · 2H2O | Sigma-Aldrich | 331058 | |
| Trypticase (Pancreatic digest of casein) | Thermo Fisher | B11921 | |
| Potassium phosphate monobasic anhydrous | Thermo Fisher | P284 | |
| Sodium carbonate · H2O | Thermo Fisher | S636 | |
| Agar | Thermo Fisher | 50841063 | |
| Magnesium sulfate · 6H2O | Thermo Fisher | 7791-18-6 | |
| Calcium chloride · 2H2O | Thermo Fisher | BP510 | |
| Cysteine HCl | Thermo Fisher | 19464780 | |
| Potassium phosphate dibasic anhydrous | Thermo Fisher | P290 | |
| Sodium chloride | Thermo Fisher | BP358 | |
Referanslar
- Stahl, E., Ashworth, M. R. F. Thin-layer chromatography. , Springer. (1969).
- Marston, A. Thin-layer chromatography with biological detection in phytochemistry. J. Chromatogr. A. 1218 (19), 2676-2683 Forthcoming.
- Homans, A. L., Fuchs, A. Direct bioautography on thin-layer chromatograms as a method for detecting fungitoxic substances. J. Chromatogr. 51, 327-329 Forthcoming.
- Lund, B. M., Lyon, G. D. Detection of inhibitors of Erwinia carotovora and E. herbicola on thin-layer chromatograms. J. Chromatogr. 110, 193-196 (1975).
- Betina, V. Bioautography in paper and thin-layer chromatography and its scope in the antibiotic field. J. Chromatogr. A. 78, 41-51 (1973).
- Weltzien, H. C. Ein biologischer Test für fungizide Substanzen auf dem Papierchromatogramm. Naturwissenschaften. 45, 288-289 (1958).
- Khurram, M., Khan, A. M., Hameed, A., Abbas, N., Quayum, A., Inayat, H. Antibacterial activities of Dodonaea viscosa using contact bioautography technique. Molecules. 14 (3), 1332-1341 (2009).
- Khurram, M., et al. Evaluation of anticandidal potential of Quercus baloot Griff. using contact bioautography technique. Afr. J. Pharm. Pharmacol. 5 (12), 1538-1542 (2012).
- Robinson, T. The Organic Constituents of Higher Plants. , Burgess Publishing Co. (1963).
- Kagan, I. A., Flythe, M. D. Factors affecting the separation and bioactivity of red clover (Trifolium pratense) extracts assayed against Clostridium sticklandii, a ruminal hyper ammonia-producing bacterium. Nat. Prod. Commun. 7 (12), 1605-1608 (2012).
- Mattila, P., Kumpulainen, J. Determination of free and total phenolic acids in plant-derived foods by HPLC with diode-array detection. J. Agric. Food Chem. 50 (13), 3660-3667 (2002).
- Hamburger, M. O., Cordell, G. A. A direct bioautographic TLC assay for compounds possessing antibacterial activity. J. Nat. Prod. 50 (1), 19-22 (1987).
- Flythe, M., Kagan, I. Antimicrobial effect of red clover (Trifolium pratense) phenolic extract on the ruminal hyper ammonia-producing bacterium, Clostridium sticklandii. Curr. Microbiol. 61, 125-131 Forthcoming.
- Rahalison, L., Hamburger, M., Hostettmann, K., Monod, M., Frenk, E. A bioautographic agar overlay method for the detection of antifungal compounds from higher plants. Phytochem. Anal. 2 (5), 199-203 (1991).
- Chomnawang, M. T., Trinapakul, C., Gritsanapan, W. In vitro antigonococcal activity of Coscinium fenestratum stem extract. J. Ethnopharmacol. 122, 445-449 (2009).
- Stahl, E., Kaldewey, H. Spurenanalyse physiologisch aktiver, einfacher Indolderivate. Hoppe-Seyler’s Z. Physiol. Chem. 323, 182-191 Forthcoming.
- Kagan, I. A., Hammerschmidt, R. Arabidopsis ecotype variability in camalexin production and reaction to infection by Alternaria brassicicola. J. Chem. Ecol. 28 (11), 2121-2140 (2002).
- Kline, R. M., Golab, T. A simple technique in developing thin-layer bioautographs. J. Chromatogr. 18, 409-411 (1965).
- Wedge, D. E., Nagle, D. G. A new 2D-TLC bioautography method for the discovery of novel antifungal agents to control plant pathogens. J. Nat. Prod. 63 (8), 1050-1054 (2000).
- Beck, A. B., Knox, J. R. The acylated isoflavone glycosides from subterranean clover and red clover. Aust. J. Chem. 24 (7), 1509-1518 (1971).
- Kahn, R. A., Bak, S., Svendsen, I., Halkier, B. A., Møller, B. L. Isolation and reconstitution of cytochrome P450ox and in vitro reconstitution of the entire biosynthetic pathway of the cyanogenic glucoside dhurrin from sorghum. Plant Physiol. 115 (4), (1997).
- Peterson, C. A., Edgington, L. V. Quantitative estimation of the fungicide benomyl using a bioautograph technique. J. Agr. Food Chem. 17 (4), 898-899 (1969).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır